Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 5, стр. 650-656
Роль активных форм кислорода в инфаркт-лимитирующем эффекте раннего гипоксического прекондиционирования
А. С. Семенцов 1, 2, *, Л. Н. Маслов 1, Н. В. Нарыжная 1, Ю. В. Бушов 2, Ю. Б. Лишманов 1
1 Научно-исследовательский институт кардиологии, Томский национальный исследовательский медицинский центр РАН
Томск, Россия
2 Национальный исследовательский Томский государственный университет
Томск, Россия
* E-mail: hamkot@sibmail.com
Поступила в редакцию 14.06.2018
После доработки 14.03.2019
Принята к публикации 14.03.2019
Аннотация
Исследование выполнено на крысах-самцах линии Вистар, у которых воспроизводили коронароокклюзию (45 мин) и реперфузию (2 ч). Гипоксическое прекондиционирование (ГП) моделировали с помощью 6 сеансов гипоксии и реоксигенации общей продолжительностью 2 ч. Установили, что ГП оказывает инфаркт-лимитирующий эффект. Защитный эффект ГП не проявлялся после применения “ловушки” гидроксильных радикалов 2-меркаптопропионилглицина (2-МПГ). Защитный эффект 2-МПГ не проявлялся, если его применяли после ГП. “Ловушка” супероксидных радикалов темпол и антиоксидант тролокс сами по себе не влияли на инфаркт-лимитирующий эффект ГП. Результаты работы свидетельствуют, что активные формы кислорода играют важную роль в реализации инфаркт-лимитирующего эффекта гипоксического прекондиционирования. Полученные данные косвенно указывают на то, что что гидроксильные радикалы могут играть ведущую роль в гипоксическом прекондиционировании.
В 70-е–80-е годы прошлого столетия, благодаря работам отечественных биохимиков и физиологов, сложилось мнение об исключительно негативной, патогенетической роли свободных радикалов, активных форм кислорода (АФК), продуктов перекисного окисления липидов [1–3]. Проводились успешные клинические испытания антиоксидантов в качестве препаратов, повышающих устойчивость сердца к ишемическим и реперфузионным повреждениям [4, 5]. Однако постепенно отношение к АФК стало меняться. В настоящее время принято считать, что АФК в малых концентрациях обеспечивают внутриклеточную и межклеточную сигнализацию, а в высоких концентрациях оказывают цитотоксический эффект, вызывая, в частности, гибель болезнетворных микроорганизмов и апоптоз злокачественных клеток [6]. Установлено, что АФК играют сигнальную роль в реализации инфаркт-лимитирующего эффекта адаптивного феномена ишемического прекондиционирования [7]. Суть этого феномена сводится к повышению устойчивости сердца к действию длительной ишемии и реперфузии после нескольких сеансов кратковременной ишемии (5 мин) и реперфузии (5 мин) [8]. Установлено, что АФК активируют ряд киназ и фосфатаз [9]. Известно, что защитить сердце от негативного влияния ишемии можно не только посредством ишемического прекондиционирования, но и с помощью адаптации к гипоксии, в частности, с помощью раннего гипоксического прекондиционирования (ГП) [10–12]. Ранним ГП называют повышение толерантности органов к действию длительной гипоксии–реоксигенации сразу же после нескольких сеансов кратковременной гипоксии–реоксигенации [10, 11]. На наш взгляд, изучение молекулярных механизмов ГП может помочь разработать медикаментозные подходы к повышению устойчивости сердца к ишемии–реперфузии.
Цель работы: оценить роль активных форм кислорода в инфаркт-лимитирующем эффекте раннего гипоксического прекондиционирования.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на 159 самцах крыс линии Вистар массой 280–320 г. Все болезненные процедуры проводили на наркотизированных животных в соответствии с Приказом МЗ СССР № 742 от 13.11.84 г. “Об утверждении правил проведения работ с использованием экспериментальных животных” и № 48 от 23.01.85 г. “О контроле за проведением работ с использованием экспериментальных животных”.
Моделирование ГП проводили с помощью 6 последовательных циклов гипоксии–реоксигенации. Во время сеанса нормобарической гипоксии животное помещали на 10 мин в герметичный сосуд емкостью 3.3 л, внутри которого формировали воздушную среду с пониженным содержанием кислорода (8% О2, 0.9% СО2 и 91.1% N2). После гипоксии следовал 10-минутный сеанс реоксигенации атмосферным воздухом. Контроль газового состава среды осуществляли с помощью газоанализатора Stat Profile M (“Nova Biomedical Corporation”, Waltham, США). Общая продолжительность ГП составляла 2 ч.
Наркотизацию крыс осуществляли внутрибрюшинным введением α-хлоралозы в дозе 100 мг/кг. Искусственную вентиляцию легких проводили с помощью аппарата SAR-830 Series (“CWE Inc.”, США). Через 40 мин после ГП выполняли локальную 45-минутную коронароокклюзию, которую моделировали путем наложения лигатуры на переднюю нисходящую ветвь левой коронарной артерии, после чего, ослабив лигатуру, проводили 2-часовую реперфузию миокарда [13].
Определение размера инфаркта миокарда определяли по методу, предложенному J. Neckar и соавт. [14]. После окончания ишемии–реперфузии сердце иссекали, канюлировали аорту и последовательно промывали 20 мл раствора 0.9%-ного NaCl и 2 мл 5%-ного раствора перманганата калия, разграничивая зону нормальной перфузии миокарда и область риска (ОР). Поперечные срезы миокарда левого желудочка толщиной 1 мм изготавливали, используя слайсер HSRA001-1 (“Zivic Instrument”, Pittsburgh, США). Срезы инкубировали в 1%-ном растворе 2,3,5-трифенилтетразолия хлорида (30 мин, 37°С), который придает интенсивную розово-красную окраску жизнеспособным тканям и клеткам; клетки в зоне инфаркта (ЗИ) остаются неокрашенными. После инкубации срезы помещали в 10%-ный раствор формалина на 1 сут, затем сканировали с обеих сторон, получая изображение в формате JPEG (2400 dpi). Инфаркт-лимитирующий эффект оценивали по изменению соотношения ЗИ/ОР. Определение размера ОР и ЗИ осуществляли компьютеризированным планиметрическим методом, используя оригинальное программное обеспечение.
Животным экспериментальных групп вводили тиоловый антиоксидант N-(2-меркаптопропионил)глицин (2-МПГ, “Sigma-Aldrich”, St Louis, США) в дозе 20 мг/кг [15, 16], либо водорастворимый аналог α-токоферола тролокс в дозе 2.5 мг/кг (“Sigma-Aldrich”, St Louis, США) [17], либо “ловушку” супероксидных (${\text{O}}_{2}^{\centerdot }$) радикалов темпол в дозе 30 мг/кг (“Tocris Bioscience”, Bristol, Великобритания) [18]. Антиоксидант 2-МПГ вводили внутривенно за 15 мин до начала ГП, либо после адаптации – за 10 мин до ишемии. Внутривенную инъекцию тролокса и темпола осуществляли за 15 мин до ГП. Препарат 2-МПГ растворяли в 0.9%-ном растворе NaCl; тролокс – в калий-фосфатном буфере, темпол – в 20%-ном гидроксипропил-β-циклодекстрине (“Tocris Bioscience”, Bristol, Великобритания). Крысам контрольных групп внутривенно вводили либо 0.9%-ный раствор NaCl, либо калий-фосфатный буфер, либо 20%-ный раствор гидроксипропил-β-циклодекстрина из расчета 1 мл/кг.
Статистический анализ полученных результатов проводили, используя прикладную программу Statistica 6.0 (“StatSoft”, США). Результаты исследования представлены в виде среднего арифметического (М) ± стандартная ошибка среднего (SEM). Для оценки значимости межгрупповых различий использовали U-критерий Манна–Уитни. Статистически значимыми считали различия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Моделирование 45-минутной ишемии с последующей 2-х часовой реперфузией у крыс контрольной группы приводило к формированию ЗИ величиной 58.6 ± 1.4% от размера ОР. У адаптированных животных показатель ЗИ/ОР снижался до величины 40.8 ± 1.2%, однако введение “ловушки” гидроксильных радикалов 2-МПГ (20 мг/кг) за 15 мин до ГП полностью устраняло защитное действие адаптации (рис. 1). Применение 2-МПГ после ГП за 10 мин до начала коронароокклюзии не влияло на формирование инфаркт-лимитирующего эффекта ГП (рис. 1).
Рис. 1.
Влияние антиоксиданта 2-МПГ на формирование кардиопротекторного эффекта раннего ГП. ГП – раннее гипоксическое прекондиционирование; ЗИ – зона инфаркта; ОР – область риска; 2-МПГ – N-(2-меркаптопропионил)глицин в дозе 20 мг/кг за 10 мин до коронароокклюзии, либо за 15 мин до адаптации, либо после адаптации за 10 мин до ишемии; *p < 0.05 – уровень значимости отличий относительно контрольной группы.

Внутривенное введение водорастворимого аналога α-токоферола тролокса (2.5 мг/кг) или “ловушки” супероксидных радикалов темпола (30 мг/кг) за 15 мин до адаптации не предотвращало формирование защитного эффекта ГП (рис. 2).
Рис. 2.
Влияние антиоксидантов тролокс (А) и темпол (Б) на инфаркт-лимитирующий эффект ГП. Тролокс (2.5 мг/кг) и темпол (30 мг/кг) вводили внутривенно неадаптированным животным – за 10 мин до коронароокклюзии, адаптированным – за 15 мин до ГП; ГП – гипоксическое прекондиционирование; ЗИ – зона инфаркта; ОР – область риска; * p < 0.05 – уровень значимости различий относительно значений соответствующих контрольных групп.
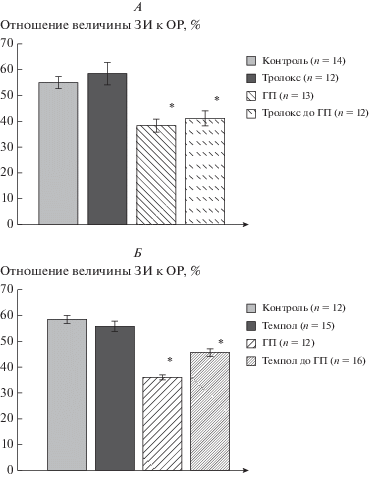
Следует отметить, что использованные в нашем исследовании препараты-антиоксиданты в указанных дозировках не обладали собственным инфаркт-лимитирующим эффектом (рис. 1 и 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты наших исследований свидетельствуют, что 2-МПГ не влиял на размер инфаркта у неадаптированных крыс, что согласуется с данными других исследователей [16, 19, 20]. В то же время введение 2-МПГ перед ГП устраняло инфаркт-лимитирующий эффект срочной адаптации к гипоксии. Однако 2-МПГ не влиял на толерантность сердца к ишемии и реперфузии, если его вводили крысам после ГП. Известно, что 2-МПГ является “ловушкой” гидроксильных радикалов [15]. Следовательно, есть основание утверждать, что гидроксильный радикал является триггером, но не медиатором кардиопротекторного действия ГП. Водорастворимый аналог α-токоферола – тролокс не влиял на размер инфаркта у неадаптированных особей и не устранял кардиопротекторный эффект ГП. Темпол также не влиял на размер инфаркта у неадаптированных крыс и не влиял на инфаркт-лимитирующий эффект ГП. Известно, что темпол является ловушкой ${\text{O}}_{2}^{\centerdot }$ [18], поэтому отсутствие его влияния на соотношение ЗИ/ОР говорит о том, что ${\text{O}}_{2}^{\centerdot }$ не играет существенной роли в обеспечении толерантности сердца к действию коронароокклюзии (45 мин) и реперфузии (2 ч) у крыс.
Представленные данные, казалось бы, противоречат распространенной точке зрения о том, что антиоксиданты обладают кардиопротекторными свойствами. Действительно, в некоторых работах показано, что 2-МПГ и темпол могут оказывать инфаркт-лимитирующий эффект [21, 22]. Исследование S.E. Mitsos и соавт. [22] было выполнено на собаках с коронароокклюзией, возможно, что ${\text{O}}{{{\text{H}}}^{\centerdot }}$ играют большую роль в ишемическом повреждении сердца у собак, чем у крыс, поэтому 2-МПГ у собак оказывает инфаркт-лимитирующий эффект. В 1999 г. M.C. McDonald и соавт. [21] смогли обнаружить инфаркт-лимитирующий эффект темпола у крыс. Однако указанные авторы применяли темпол в дозе 100 мг/кг, что в 3 раза превышает дозу, использованную нами (30 мг/кг), и дозу, вводимую другими авторами [23]. Следовательно, есть основания предполагать, что снижение индекса ЗИ/ОР после применения темпола не является следствием его антиоксидантного действия, а осуществляется по механизму, не связанному с АФК. Мы предполагаем, что ${\text{O}}{{{\text{H}}}^{\centerdot }}$ образуются в реакции Фентона при участии негеминого железа и выполняют триггерную функцию в реализации кардиопротекторного эффекта ГП:
ЗАКЛЮЧЕНИЕ
Результаты работы свидетельствуют о том, что активные формы кислорода играют важную роль в реализации инфаркт-лимитирующего эффекта гипоксического прекондиционирования. Эти данные косвенно указывают на то, что ведущую роль в гипоксическом прекондиционировании играют гидроксильные радикалы.
Список литературы
Биленко М.В. Ишемические и реперфузионные повреждения органов. М. Медицина. 1989. [Bilenko M.V. Ishemicheskie i reperfuzionnye povrezhdenija organov [Ischemic and reperfusion organ damage]. Moscow. Medicina. 1989].
Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М. Наука. 1972. [Vladimirov Ju.A., Archakov A.I. Perekisnoe okislenie lipidov v biologicheskih membranah [Lipid peroxidation in biological membranes]. Moscow. Nauka. 1972].
Меерсон Ф.З. Патогенез и предупреждение стрессорных и ишемических повреждений сердца. М. Медицина. 1984. [Meerson F.Z. Patogenez i preduprezhdenie stressornyh i ishemicheskih povrezhdenij serdca [Pathogenesis and prevention of stress and ischemic heart damage]. Moscow. Medicina. 1984].
Ласукова Т.В., Ускина Е.В., Афанасьев С.А., Пономаренко И.В., Нарыжная Н.В., Чернявский А.М., Лишманов Ю.Б. Влияние эмоксипина и гистохрома на процесс перекисного окисления липидов и активность МВ-креатинфосфокиназы сыворотки крови больных ишемической болезнью сердца в динамике операции аорто-коронарного шунтирования. Экспер. и клин. фармакол. 60(5): 51–53. 1997. [Lasukova T.V., Uskina E.V., Afanas’ev S.A., Ponomarenko I.V., Naryzhnaja N.V., Chernjavskij A.M., Lishmanov Ju.B. Effects of emoxipine and histochrome on lipid peroxidation and activity of serum MB-creatine phosphokinase in patients with ischemic heart disease during aortocoronary shunting. Eksp. Klin. Farmakol. 60(5): 51–53. 1997. (In Russ.)].
Чернявский А.М., Маслов Л.Н., Пономаренко И.В., Вечерский Ю.Ю., Лишманов Ю.Б., Карпов Р.С. Кардиопроекторный эффект эмоксипина при хирургической реконструкции коронарных артерий. Кардиология. 36(8): 35–38. 1996. [Chernjavskij A.M., Maslov L.N., Ponomarenko I.V., Vecherskij Ju.Ju., Lishmanov Ju.B., Karpov R.S. Cardioprotective effect of emoxipin in the surgical reconstruction of the coronary arteries. Kardiologiya. 36(8): 35–38. 1996. (In Russ.)].
Меньщикова Е.Б., Ланкин В.З., Зенков Н.К., Бондарь И.А., Круговых Н.Ф., Труфакин В.А. Окислительный стресс. Прооксиданты и антиоксиданты. М. Фирма “Слово”. 2006. [Menshhikova E.B., Lankin V.Z., Zenkov N.K., Bondar I.A., Krugovyh N.F., Trufakin V.A. Okislitelnyj stress. Prooksidanty i antioksidanty [Oxidative stress. Prooxidants and Antioxidants]. Moscow. Firma “Slovo”. 2006].
Маслов Л.Н., Нарыжная Н.В., Подоксенов Ю.К., Прокудина Е.С., Горбунов А.С., Жанг И., Пей Ж.-М. Активные формы кислорода – триггеры и медиаторы повышения устойчивости сердца к действию ишемии–реперфузии. Рос. физиол. журн. им. И.М. Сеченова 101(1): 3–24. 2015. [Maslov L.N., Naryzhnaja N.V., Podoksenov Ju.K., Prokudina E.S., Gorbunov A.S., Zhang I., Pej Zh.-M. Reactive oxygen species – triggers and mediators of increasing the resistance of the heart to ischemia–reperfusion. Russ. J. Physiol. 101(1): 3–24. 2015. (In Russ.)].
Murry C.E., Jennings R.B., Reimer K.A. Preconditioning with ischemia: A delay of lethal cell injury in ischemic myocardium. Circulation. 74(5): 1124–1136. 1986.
Маслов Л.Н., Нарыжная Н.В., Подоксенов Ю.К., Семенцов А.С., Горбунов А.С., Жанг И., Пей Ж.-М. Сигнальный механизм кардиопротекторного эффекта активных форм кислорода. Рос. физиол. журн. им. И.М. Сеченова. 101(4): 377–385. 2015. [Maslov L.N., Naryzhnaja N.V., Podoksenov Ju.K., Sementsov A.S., Gorbunov A.S., Zhang I., Pej Zh.-M. Signaling mechanism of the cardioprotective effect of reactive oxygen species. Russ. J. Physiol. 101(4): 377–385. 2015. (In Russ.)].
Маслов Л.Н., Лишманов Ю.Б., Емельянова Т.В., Прут Д.А., Колар Ф., Портниченко А.Г., Подоксёнов Ю.К., Халиулин И.Г., Ванг Х., Пей Ж.-М. Гипоксическое прекондиционирование как новый подход к профилактике ишемических и реперфузионных повреждений головного мозга и сердца. Ангиол. сосуд. хирургия. 17(3): 27–36. 2011. [Maslov L.N., Lishmanov Yu.B., Emelianova T.V., Prut D.A., Kolar F., Portnichenko A.G., Podoksenov Y.K., Khaliulin I.G., Wang H., Pei J.-M. Hypoxic preconditioning as novel approach to prophylaxis of ischemic and reperfusion damage of brain and heart. Angiol. Vasc. Surg. 17(3): 36. 2011. (In Russ.)].
Маслов Л.Н., Лишманов Ю.Б., Колар Ф., Портниченко А.Г., Подоксёнов Ю.К., Халиулин И.Г., Ванг Х., Пей Ж.-М. Гипоксическое прекондиционирование – феномен, обеспечивающий повышение толерантности кардиомиоцитов к гипоксии–реоксигенации. Рос. физиол. журн. им. И.М. Сеченова. 96(12): 1170–1189. 2010. [Maslov L.N., Lishmanov Ju.B., Kolar F., Portnichenko A.G., Podoksjonov Ju.K., Haliulin I.G., Vang H., Pej Zh.-M. Hypoxic preconditioning – a phenomenon that increases the tolerance of cardiomyocytes to hypoxia–reoxygenation. Russ. J. Physiol. 96(12): 1170–1189. 2010. (In Russ.)].
Маслов Л.Н., Лишманов Ю.Б., Крылатов А.В., Семенцов А.С., Портниченко А.Г., Подоксёнов Ю.К., Халиулин И.Г. Сравнительный анализ кардиопротекторной и антиаритмической эффективности раннего и позднего гипоксического прекондиционирования. Бюлл. экспер. биол. и мед. 156(12): 705–708. 2013. [Maslov L.N., Lishmanov Yu.B., Krylatov A.V., Sementsov A.S., Portnichenko A.G., Podoksenov Yu.K., Khaliulin I.G. Comparative analysis of early and delayed cardioprotective and antiarrhythmic efficacy of hypoxic preconditioning. Bull. Exp. Biol. Med. 156(6): 746-749. 2014. (In Russ.)].
Schultz J.E., Hsu A.K., Gross G.J. Ischemic preconditioning and morphine-induced cardioprotection involve the delta (d)-opioid receptor in the intact rat heart. Mol. Cell. Cardiol. 29(8): 2187–2195. 1997.
Neckar J., Papousek F., Novakova O., Ost’adal B., Kolar F. Cardioprotective effects of chronic hypoxia and ischaemic preconditioning are not additive. Basic Res. Cardiol. 97: 161–167. 2002.
Bolli R., Jeroudi M.O., Patel B.S., Aruoma O.I., Halliwell B., Lai E.K., McCay P.B. Marked reduction of free radical generation and contractile dysfunction by antioxidant therapy begun at the time of reperfusion. Evidence that myocardial “stunning” is a manifestation of reperfusion injury. Circ. Res. 65(3): 607–622. 1989.
Tanaka M., Fujiwara H., Yamasaki K., Sasayama S. Superoxide dismutase and N-2-mercaptopropionyl glycine attenuate infarct size limitation effect of ischaemic preconditioning in the rabbit. Cardiovasc. Res. 28(7): 980–986. 1994.
Eum H., Lee S. Effects of Trolox on the activity and gene expression of cytochrome P450 in hepatic ischemia/reperfusion. Br. J. Pharmacol. 142(1): 35–42. 2004.
Just A., Whitten C.L., Arendshorst W.J. Reactive oxygen species participate in acute renal vasoconstrictor responses induced by ETA and ETB receptors. Am. J. Physiol. Renal. Physiol. 294(4): F719–F728. 2008.
Baines C.P., Goto M., Downey J.M. Oxygen radicals released during ischemic preconditioning contribute to cardioprotection in the rabbit myocardium. J. Mol. Cell. Cardiol. 29(1): 207–216. 1997.
Vinten-Johansen J., Chiantella V., Johnston W.E., Jolly B.T., Kendricks W.D., Hester T.O., Cordell A.R. Adjuvant N-(2-mercaptopropionyl)-glycine in blood cardioplegia does not improve myocardial protection in ischemically damaged hearts. J. Thorac. Cardiovasc. Surg. 100(1): 65–76. 1990.
McDonald M.C., Zacharowski K., Bowes J., Cuzzocrea S., Thiemermann C. Tempol reduces infarct size in rodent models of regional myocardial ischemia and reperfusion. Free Radic. Biol. Med. 27(5–6): 493–503. 1999.
Mitsos S.E., Fantone J.C., Gallagher K.P., Walden K.M., Simpson P.J., Abrams G.D., Schork M.A., Lucchesi B.R. Canine myocardial reperfusion injury: protection by a free radical scavenger, N-2-mercaptopropionyl glycine. J. Cardiovasc. Pharmacol. 8(5): 978–988. 1986.
Kimura S., Zhang G.X., Nishiyama A., Shokoji T., Yao L., Fan Y.Y., Rahman M., Suzuki T., Maeta H., Abe Y. Role of NAD(P)H oxidase- and mitochondria-derived reactive oxygen species in cardioprotection of ischemic reperfusion injury by angiotensin II. Hypertension. 45(5): 860–866. 2005.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


