Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 5, стр. 619-633
Влияние L-карнитина на иммунологические, интегральные и биохимические показатели мышей, получающих рацион с избытком жира и фруктозы
Н. В. Трусов 1, К. В. Мжельская 1, В. А. Шипелин 1, А. А. Шумакова 1, А. Н. Тимонин 1, Н. А. Ригер 1, С. А. Апрятин 1, И. В. Гмошинский 1, *, Д. Б. Никитюк 1
1 Федеральный исследовательский центр питания, биотехнологии и безопасности пищи;
“ФИЦ питания и биотехнологии”
Москва, Россия
* E-mail: gmosh@ion.ru
Поступила в редакцию 21.02.2019
После доработки 18.03.2019
Принята к публикации 18.03.2019
Аннотация
В экспериментах на мышах инбредной линии DBA/2J и тетрагибридах DBCB изучено влияние потребления L-карнитина (L-Кар) в дозе 300 мг/кг массы тела на физиологические, интегральные биохимические, морфологические и иммунологические показатели в условиях 65-суточного потребления высокожирового рациона с заменой питьевой воды на 20%-ный водный раствор фруктозы (ВУВЖР). Уровень поисковой активности и тревожности животных изучали в тесте “Приподнятый крестообразный лабиринт” (ПКЛ), мышечный тонус определяли по удельной силе хватки передних лап. По окончании эксперимента определяли массу внутренних органов, белой и бурой жировой ткани, изучали морфологию печени методом светооптической микроскопии, определяли концентрации глюкозы, холестерина общего и в составе ЛПВП, триглицеридов, активности ферментов − АЛТ, АСТ, креатинфосфокиназы (КФК), липазы, уровни инсулина, лептина, грелина, IL-3, 5, 10, 12р(70), RANTES методом мультплексного анализа. Показано, что в отличие от мышей линии DBA/2J мыши DBCB отвечали на добавку L-Кар увеличением удельного энергопотребления рациона. У этих животных потребление L-Кар способствовало снижению признаков жировой дистрофии печени, более выраженной (по сравнению c DBA/2J) нормализацией уровней печеночных трансаминаз и КФК, приводило к снижению уровня лептина и соотношения лептин/грелин. В тесте ПКЛ показано, что потребление L-Кар потенцировало эффект возрастания подвижности у мышей DBA/2J и эффект возрастания тревожности у мышей DBCB. Потребление L-Кар повышало уровни IL-3, IL-12p(70) и снижало концентрацию инсулина у мышей обоих генотипов. Полученные данные свидетельствуют о позитивном эффекте L-Кар в отношении ряда показателей липидного обмена и гепатопротекторном действии у мышей тетрагибридов, чувствительных к ВУВЖР и указывают на перспективность использования L-Кар и его комбинаций с другими биологически активными веществами пищи в качестве средств диетической коррекции ожирения и связанных с ним алиментарно-зависимых заболеваний.
ВВЕДЕНИЕ
Применение биологически активных веществ в составе специализированных пищевых продуктов — это перспективный подход в диетотерапии ожирения, метаболического синдрома и сахарного диабета 2-го типа, являющийся альтернативой либо дополнением к использованию редуцированных по калорийности диет [1, 2]. В качестве компонентов специализированных продуктов рассматриваются, в том числе, некоторые витамины и витаминоподобные вещества, в частности L-карнитин (L-Кар), (3R)3-гидрокси-4-триметиламмонио-бутаноат [3]. Его основной функцией в организме является связывание с остатками жирных кислот, чем обеспечивается их беспрепятственный перенос через мембрану в митохондрии [4]. Механистические представления о L-Кар как “сжигателе жира” послужили основанием для многочисленных рекомендаций по его использованию в составе специализированных продуктов и биологически активных добавок к пище в программах по снижению массы тела [5] и в питании спортсменов [6]. Однако, несмотря на высокую популярность данной продукции среди диетологов, тренеров и спортсменов, эффективность L-Кар, принимаемого перорально, в спортивном питании считается не доказанной [3, 6, 7]. Возможно, что причиной этого является отсутствие выраженного эффекта L-Кар на показатели липидного обмена у здоровых лиц с нормальной массой тела, а также неоднозначность его действия у больных ожирением и метаболическим синдромом в зависимости от их генотипа. В экспериментах in vivo на лабораторных животных L-Кар, несмотря на свою высокую биодоступность, не повышал физическую работоспособность [8], а также, возможно, оказывал отрицательное действие на сердечную мышцу на модели ишемии–реперфузии [9].
Возможные механизмы воздействия L-Кар на организм могут реализоваться как системно, за счет регуляции в периферийных органах и тканях (печень, скелетные мышцы, жировая ткань и др.) активности генов липидного и углеводно-энергетического обмена, входящих в группу PPAR-α зависимых генов, в частности, карнитинацилтрансферазы типа I [10], так и центрально, вследствие влияния на отделы головного мозга, отвечающие за нейрорегуляцию обменных процессов при участии дофаминергической и серотонинергической подсистем. Отражением этого могут быть вызываемые L-Кар изменения в пищевом поведении, поисковой активности и тревожности животных, оцениваемые в тестах поведенческих реакций. При анализе центральных эффектов L-Кар важно учитывать, что он относится к числу веществ, ограниченно проходящих через гематоэнцефалический барьер [11].
Целью настоящей работы явилось изучение влияния L-Кар на лабораторных мышах (Mus domesticus) инбредной линии DBA/2J и гибрида 2-го поколения (тетрагибрида) DBCB, различающихся по степени резистентности к развитию ожирения в условиях потребления экспериментального гиперкалорийного рациона, с помощью оценки поведенческих реакций, интегральных, морфологических, биохимических и иммунологических показателей.
МЕТОДЫ ИССЛЕДОВАНИЯ
В работе использовали самцов мышей (возраст 8–10 нед.) инбредной линии DBA/2J, полученных из питомника “Столбовая”, и сложного гибрида 2-го поколения DBCB, выведенного путем скрещивания 4-х различных инбредных линий мышей (DBA/2J, BALB/c, CBA/lac и С57Black/6J), поступивших из вышеуказанного питомника. Методика выведения гибридных мышей была ранее представлена в [12]. Работу с животными выполняли в соответствии правилами надлежащей лабораторной практики (Приказ Министерства здравоохранения Российской Федерации № 199 н от 01.04.2016 г.). Дизайн эксперимента был одобрен Комитетом по этике ФГБУН “ФИЦ питания и биотехнологии” (протокол № 4 от 20.04.2017 г.).
Было сформировано по 3 группы мышей, как линейных, так и тетрагибридов, численностью по 8 особей, не различающихся по исходной массе тела в пределах каждого генотипа (p > 0.05; ANOVA). Животные 1-х (контрольных) групп обоих генотипов получали сбалансированный полусинтетический рацион по AIN93М [13], содержащий 10% жира по массе, и очищенную обратным осмосом питьевую воду; животные 2-х групп – высокоуглеводный, высокожировой рацион с заменой части крахмала на жир (смесь 1 : 1 рафинированного кукурузного масла и свиного лярда до общего содержания жира, равного 30% по массе сухих веществ рациона и с заменой питьевой воды на 20% водный раствор фруктозы – высокожировой, высокоуглеводный рацион − ВУВЖР); животные 3-х групп – такой же рацион с добавлением L-Кар (производства фирмы WIRUD, Германия, 98%-ной чистоты по данным ВЭЖХ) в расчетной дозе 300 мг/кг массы тела. Соотношение по энергетической ценности белка, жира и углеводов составляло 20.6 : 11.4 : 68.0 для контрольного рациона и 13.1 : 43.9 : 42.9 в среднем, с учетом потребленной фруктозы, для ВУВЖР. Применяемая доза соответствовала приблизительно 20-кратной аггравации против верхнего допустимого уровня потребления L-Кар человеком11, сделанной с учетом большей интенсивности процессов метаболизма у мелких млекопитающих. Животных содержали по 4 особи в клетке при температуре 21 ± 1°С и режиме освещения 12/12 ч. Общая продолжительность кормления рационами составила 65 сут. На протяжении эксперимента ежедневно определяли количество съеденного корма и выпитой жидкости, для расчета на основании этих данных общей потребляемой энергетической ценности, наблюдали за внешним видом, активностью, состоянием шерстяного покрова, особенностями поведения.
Тестирование поведенческих реакций в установке “приподнятый крестообразный лабиринт” (ПКЛ) проводили на 8-е и 59-е сутки эксперимента, мышечную силу сжатия (определяемую по силе хватки передних лап) на 3-и и 58-е сутки по методикам, описанным ранее [12]. В обоих случаях использовали аппаратуру фирмы “Panlab Harvard Apparatus” (Испания).
Выведение животных из эксперимента осуществляли на 66-е сутки путем обескровливания из нижней полой вены под эфирной анестезией. Кровь собирали в мерные пробирки с 0.3 см3 1%-ного раствора гепарина, индивидуально фиксируя разведение каждой пробы. Отбор органов осуществляли стерильными хирургическими инструментами из нержавеющей стали. Массу органов и тканей (печень, селезенка, сердце, тимус, межлопаточный бурый и забрюшинный белый жир) определяли на лабораторных весах с точностью ±0.01 г. Выделяли пробы печени, которые фиксировали в течение не менее 3 сут в 3.7%-ном растворе формальдегида в 0.1 М натрий-фосфатном буфере рН 7.00 ± 0.05, дегидратировали в спиртах восходящей концентрации, пропитывали ксилолом и заливали гомогенизированной парафиновой средой “Histomix”. Парафиновые срезы толщиной 3–4 мкм изготавливали на микротоме “Microm HM355s” (“Leica”, Германия), окрашивали гематоксилином и эозином по стандартной методике и исследовали на микроскопе “AxioImager Zl” (“Zeiss”, Германия) с цифровой фотокамерой при увеличении ×200. Содержание в плазме крови глюкозы, триглицеридов, холестерина общего и в составе ЛПВП, активности аспарагиновой (АСТ) и аланиновой (АЛТ) аминотрансфераз, креатинфосфокиназы (КФК) и общую липолитическую активность определяли на биохимическом анализаторе “Konelab 20i” (Thermo Scientific) по стандартным методикам. Для определения уровня цитокинов IL-3, IL-10, IL-12p70 и RANTES и пептидных гормонов − грелина, инсулина и лептина в плазме мышей использовали базовый набор Bio Bio-Plex Pro™ Reagent Kit V, дополняемый реагентами: Bio-Plex Pro™ Mouse Cytokine IL-3 Set, Bio-Plex Pro™ Mouse Cytokine IL-10 Set, Bio-Plex Pro™ Mouse Cytokine IL-12p70 Set, Bio-Plex Pro™ Mouse Cytokine RANTES Set, Bio-Plex Pro Mouse Diabetes Ghrelin Set, Bio-Plex Pro Mouse Diabetes Insulin Set и Bio-Plex Pro Mouse Diabetes Leptin Set – все производства фирмы “Bio-Rad Laboratories, Inc.” (США). Исследования проводили на мультиплексном анализаторе Luminex 200 (Luminex Corporation, США) по технологии xMAP с использованием программного обеспечения Luminex xPONENT Version 3.1.
Статистическую обработку данных проводили с использованием трехфакторного дисперсионного анализа ANOVA по факторам потребляемого рациона (стандартный рацион/ВУВЖР), генотипа животных и введения L-Кар в состав рациона; t-теста Стьюдента для попарно связанных величин; непараметрического критерия Вилкоксона–Манна–Уитни с использованием программного пакета SPSS 20.0. Различия считали достоверными при вероятности принятия нуль-гипотезы p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
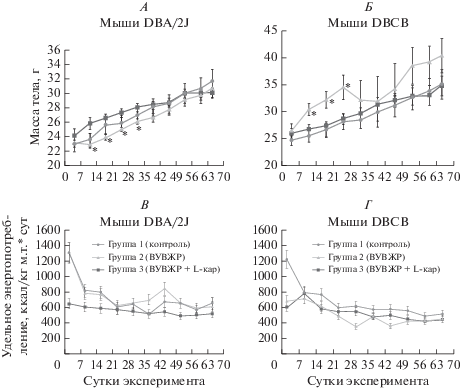
В ходе кормления экспериментальными рационами в группе мышей DBCB, получавших ВУВЖР, наблюдалась гибель животных (4 из 8) при явлениях острой циркуляторной дисфункции. Мыши остальных опытных групп были активными, имели нормальный внешний вид; летальность и заболеваемость не отмечалась. Средняя масса тела мышей DBA/2J, потреблявших ВУВЖР, была достоверно ниже, чем у контрольных животных до 30-х суток эксперимента; у мышей DBCB наблюдалось обратное соотношение (рис. 1А, Б). В дальнейшем масса тела мышей в группах различалась недостоверно для каждого генотипа. Анализ удельного энергопотребления животных (рис. 1В, Г) показал, что у мышей DBA/2J потреблению ВУВЖР соответствует достоверно повышенное удельное потребление энергии (рис. 1Д), тогда как L-Кар, по-видимому, не влияет на этот показатель. В отличие от этого, удельное энергопотребление мышей DBCB, получавших ВУВЖР, практически не отличалось от величины контрольной группы, а добавка L-Кар приводила к достоверному (рис. 1Д) возрастанию удельного энергопотребления на протяжении практически всего времени кормления.
Рис. 1.
Масса тела (А, Б), удельное энергопотребление (В, Г) мышей в ходе эксперимента и результаты статистической обработки данных удельного энергопотребления ( M ± m); t-тест Стьюдента для попарно связанных величин (Д). Данные для мышей DBA/2J (А, В), DBCB (Б, Г). * – различие с контрольной группой достоверно, t-тест Стьюдента.
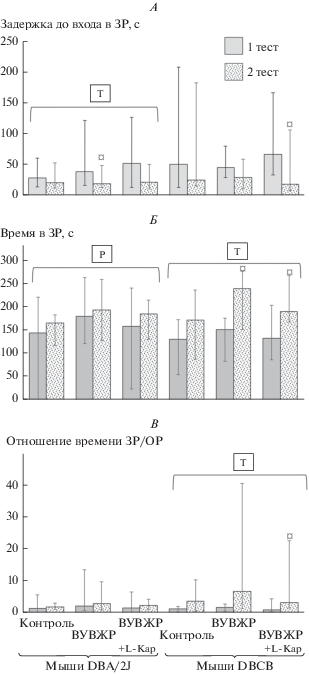
Исследование показателей подвижности и поисковой активности в тесте ПКЛ показало, что у мышей DBA/2J средняя скорость перемещения в открытых рукавах (ОР) лабиринта (рис. 2А) достоверно возрастает при 2-м тесте по сравнению с первым, тогда как у мышей DBCB этого не наблюдалось. Напротив, подвижность этих мышей по показателю пути, пройденного в ОР (рис. 2Б), при 2-м тесте снижалась. Максимальная скорость перемещения в ОР возрастала при 2-м тесте только у мышей DBA/2J, получавших L-Кар (рис. 2В). Тревожность мышей, которая считалась тем большей, чем меньшим был показатель задержки перед первым в закрытый рукав (ЗР) лабиринта (рис. 3А), возрастала при 2-м тесте у всех групп мышей DBA/2J. У мышей DBCB это было отмечено только в группе, получавшей L-Кар, при парном сравнении в пределах одной группы. Вместе с тем, по показателю времени, проведенного в ЗР (рис. 3Б), мыши DBCB демонстрировали при 2-ом тесте повышение тревожности, причем в наибольшей степени это было характерно для животных, получавших ВУВЖР и ВУВЖР с L-Кар. Отношение времен, проведенных в ОР и ЗР (рис. 3В), существенно не различалось в группах мышей DBA/2J при 1-м и 2-м тесте, а мыши DBCB становились по этому показателю достоверно более тревожными при повторном тестировании, причем L-Кар, возможно, потенцировал этот эффект. Таким образом, есть основания предполагать, что потребление L‑Кар потенцирует эффект возрастания подвижности у мышей DBA/2J и эффект возрастания тревожности у мышей DBCB.
Рис. 2.
Показатели подвижности/поисковой активности (медиана; интервалы изменения) мышей, потреблявших контрольный рацион, ВУВЖР и ВУВЖР с добавкой L-Кар, в тесте ПКЛ: А) средняя скорость в ОР; Б) путь, пройденный в ОР; В) максимальная скорость в ОР. Показатели – медиана, интервалы изменения в соответствующих единицах. ¤ − различие при 1 и 2 тесте достоверно, р < 0.05, критерий Вилкоксона для попарно связанных значений. Горизонтальная скобка – распределение неоднородно (p < 0.05, ANOVA) по фактору “тест” (Т), “карнитин × тест” (L-Кар × T) для охватываемого диапазона выборок. Число животных в группах − см. табл. 1.

Рис. 3.
Показатели тревожности (медиана; интервалы изменения) мышей, потреблявших контрольный рацион, ВУВЖР и ВУВЖР с добавкой L-Кар, в тесте ПКЛ: А) задержка до первого входа в ЗР; Б) время в ЗР; В) отношение времени в ЗР к ОР. Показатели – медиана, интервалы изменения в соответствующих единицах. ¤ – различие при 1 и 2 тесте достоверно, р < 0.05, критерий Вилкоксона для попарно связанных значений. Горизонтальная скобка − распределение неоднородно (p < 0.05, ANOVA) по фактору “тест” (Т), “рацион” (Р) для охватываемого диапазона выборок. Число животных в группах − см. табл. 1.
Определение уровня мышечного тонуса мышей в тесте силы хватки передних лап показало, что L-Кар не оказывал достоверного влияния на этот показатель у линейных животных и тетрагибрида (ANOVA, p > 0.05 по фактору “карнитин” как у DBA/2J, так и у DBCB мышей, данные не представлены).
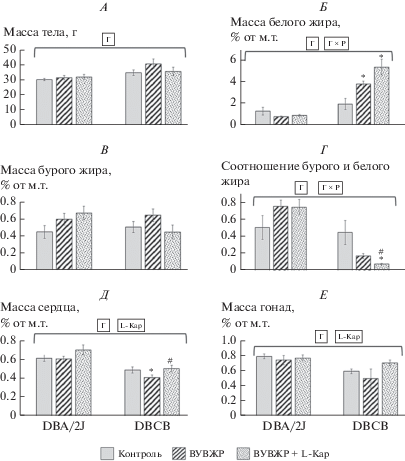
Как следует из результатов оценки интегральных показателей при выведении из эксперимента, L-Кар не оказывал достоверного влияния на общую массу тела как у линейных мышей, так и тетрагибридов (рис. 4А); массу белой (рис. 4Б) и бурой жировой ткани (рис. 4В) у мышей DBA/2J. При этом у мышей DBCB, получавших L‑Кар, относительная доля бурого жира в оцененных жировых запасах была минимальной (рис. 4Г). Применявшаяся методика, состоявшая во взвешивании выделенных из организма забрюшинной белой и межлопаточной бурой жировой ткани, по-видимому, приводила к занижению общих запасов белого жира у животных, так как не учитывала количество подкожной жировой клетчатки и жира, диффузно распределенного в скелетных мышцах и печени. Поэтому, степень снижения под действием L-Кар количества бурой жировой ткани у мышей тетрагибридов, в действительности, по-видимому, даже превосходит сделанную оценку. Следует отметить, что L-Кар вызывал подтверждаемое результатами факторного анализа возрастание относительной массы сердца и гонад, причем у мышей DBCB, получавших ВУВЖР с добавкой L-Кар, эти показатели возвращались практически к значениям, отмечавшимся в контрольной группе.
Рис. 4.
Интегральные показатели (M ± m) мышей, потреблявших контрольный рацион, ВУВЖР и ВУ-ВЖР с добавкой L-Кар, при выведении из эксперимента на 66-е сутки: А) масса тела, г; Б) масса забрюшинного белого жира, В) масса межлопаточного бурого жира; Г) соотношение массы бурого и белого жира; Д) масса сердца; Е) масса гонад. * – различие с контрольной группой достоверно; # – различие с группой ВУВЖР достоверно, р < 0.05, U-критерий Манна–Уитни. Горизонтальная скобка – распределение неоднородно (p < 0.05, ANOVA) по фактору “генотип” (Г), и “генотип*рацион” (Л × Р), “карнитин” (L-Кар) для охватываемого диапазона выборок. Число животных в группах − см. табл. 1.
Изучение биохимических показателей плазмы крови мышей (табл. 1) показало, что на уровень глюкозы и триглицеридов в плазме крови значимым образом влияет генотип животных, но не потребление L-Кар. Независимо от состава потребляемого рациона, мыши линии DBCB характеризуются повышенным уровнем глюкозы плазмы крови в сравнении с DBA/2J (ANOVA, p < 0.05 по фактору “генотип”). Вместе с тем, по данным факторного анализа было выявлено достоверное влияние L-Кар на уровень холестерина и показатели ферментативной активности, причем у мышей DBCB L-Кар вызывал наиболее заметную нормализацию величин активности ACT, АЛТ и КФК, повышенных вследствие потребления ВУВЖР, а у мышей DBA/2J указанная тенденция также проявлялась, хотя и в меньшей степени. Можно предположить, что снижение активности указанных ферментов указывает на снижение под действием L-Кар токсического действия избытка жира и фруктозы рациона на клетки печени (АСТ, АЛТ) и мышц (КФК), что также согласуется с отсутствием летальности у мышей DBCB, получавших ВУВЖР с L-Кар (тогда, как у мышей тетрагибридов, получавших только ВУВЖР, летальность составила 50%).
Таблица 1.
Биохимические показатели плазмы крови мышей, получавших экспериментальные рационы, M ± m*
| Группа №№ | 1 | 2 | 3 | 1 | 2 | 3 | Фактор** |
|---|---|---|---|---|---|---|---|
| линия | DBA/2J | DBCB | |||||
| рацион | Контроль | ВУВЖР | ВУВЖР+ L-Кар |
Контроль | ВУВЖР | ВУВЖР+ L-Кар |
|
| число мышей | 8 | 7 | 8 | 7 | 4 | 8 | |
| Глюкоза, ммоль/л | 12.8 ± 0.72.3 | 16.2 ± 0.91.3 | 20.0 ± 1.21.2 | 20.5 ± 1.8 | 22.1 ± 2.5 | 22.6 ± 0.9 | Генотип |
| Триглиц-ы, ммоль/л | 1.86 ± 0.21 | 2.38 ± 0.47 | 2.27 ± 0.19 | 1.67 ± 0.136 | 1.58 ± 0.27 | 1.24 ± 0.134 | Генотип |
| Холестерин, ммоль/л | 3.05 ± 0.203 | 3.55 ± 0.14 | 3.94 ± 0.211 | 4.45 ± 0.43 | 5.02 ± 0.70 | 5.01 ± 0.21 | L-Кар |
| Холестерин ЛПВП, ммоль/л | 1.99 ± 0.13 | 2.30 ± 0.12 | 2.51 ± 0.15 | 2.78 ± 0.29 | 3.21 ± 0.35 | 3.15 ± 0.12 | Генотип |
| АЛТ, Ед/мл | 22.0 ± 3.8 | 27.5 ± 11.1 | 14.9 ± 3.6 | 19.6 ± 4.9 | 62.8 ± 20.5 | 25.7 ± 5.7 | Рацион L-Кар |
| АСТ, Ед/мл | 220 ± 43 | 201 ± 39 | 176 ± 35 | 180 ± 35 | 454 ± 253 | 172 ± 13 | L-Кар |
| КФК, кЕд/мл | 5.7 ± 1.7 | 5.9 ± 1.6 | 3.9 ± 1.0 | 5.1 ± 0.7 | 10.7 ± 3.7 | 4.9 ± 0.9 | L-Кар |
| Липаза, Ед/мл | 129 ± 13 | 110 ± 4 | 128 ± 9 | 119 ± 15 | 111 ± 7 | 147 ± 18 | L-Кар |
Светооптическое морфологическое исследование показало, что у мышей DBA/2J, получавших контрольный рацион, отмечалась нормальная структура ткани печени, а потребление ими ВУВЖР приводило к относительно небольшому и диффузному накоплению жира в гепатоцитах без изменения общей архитектуры ткани (ядра оставались в центрах клеток). L-Кар не оказывал видимого влияния на эту картину (данные не представлены). В отличие от этого у мышей DBCB (рис. 5) при потреблении ВУВЖР наблюдалась массивная баллонная дистрофия гепатоцитов с образованием крупных округлых вакуолей, лишенных видимой клеточной структуры. Добавка L-Кар к ВУВЖР приводила к уменьшению размера и числа жировых вакуолей и их концентрированию в периваскулярной области.
Рис. 5.
Репрезентативные микрофотографии срезов тканей печени мышей DBCB: А) контрольный сбалансированный рацион; Б) ВУВЖР; В) ВУВЖР с добавкой L-карнитина. Окраска гематоксилин-эозином, увеличение ×200.

Как следует из данных, представленных на рис. 6А, при потреблении L-Кар отмечалась относительная нормализация уровня инсулина, повышенного вследствие потребления ВУВЖР у мышей обоих генотипов, причем у DBA/2J этот эффект, по-видимому, был более заметным. У мышей DBCB добавка L-Кар к рациону приводила к повышению уровня грелина (рис. 6Б), снижению – лептина (рис. 6В) и соотношения лептин/грелин (рис. 6Г), который рассматривается в качестве маркеров липогенеза [14]. У мышей DBA/2J подобные эффекты L-Кар не наблюдались. Потребление L-Кар сопровождалось достоверным повышением уровней IL-3 (рис. 6Д) и IL-12р(70) (рис. 6Е) у животных обоих генотипов, но не оказывало достоверного влияния на уровни IL-5 и IL-10 (данные не представлены). L-Кар также не влиял на уровень RANTES, который достоверно повышался вследствие приема ВУВЖР (ANOVA, p < 0.05 по фактору “рацион”), более заметно у мышей DBA/2J.
Рис. 6.
Уровни адипокинов и цитокинов (медиана; интервалы изменения) в плазме крови мышей при выведении из эксперимента на 66-е сутки: А) инсулин; Б) грелин; В) лептин; Г) отношение лептин/грелин; Д) IL-3; Е) IL-12р(70); Ж) RANTES. Ось абсцисс − группы животных (генотип, рацион, добавка); ось ординат − концентрация, пг/мл (А, Б, В, Д, Е, Ж), безразмерное соотношение (Г). * – различие с контрольной группой достоверно; # – различие с группой ВУВЖР достоверно, р < 0.05, U-критерий Манна–Уитни. Горизонтальная скобка – распределение неоднородно (p < 0.05, ANOVA) по фактору “генотип” (Г), “рацион” (Р), “карнитин” (L-Кар), “генотип*рацион” (Л × Р), “генотип × карнитин” (Л × × L-Кар) для охватываемого диапазона выборок. Число животных в группах − см. табл. 1.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные характеризуют влияние L-Кар у линейных мышей и тетрагибридов, изначально различающихся по своей реакции на потребление ВУВЖР.
У мышей линии DBA/2J при этом отмечается повышение удельного энергопотребления и увеличение отношения массы бурого к белому жиру при отсутствии существенных изменений общей массы тела и количества забрюшинной белой жировой ткани. В совокупности это может указывать на усиление у этих животных под действием ВУВЖР процессов термогенеза в бурой жировой ткани. В отличие от этого мыши тетрагибриды DBCB, обладающие большим аллельным разнообразием, в том числе по генам липидного и углеводно-энергетического обмена, характеризуются повышенным уровнем глюкозы уже при потреблении сбалансированного рациона, а на кормление ВУВЖР отвечают возрастанием массы белой жировой ткани и снижением отношения межлопаточного бурого жира к белому жиру, развитием выраженной жировой дистрофии ткани печени с ростом активности трансаминаз и КФК в плазме крови при неизменном удельном энергопотреблении. В отличие от DBA/2J у мышей DBCB добавка L-Кар способствует снижению удельного энергопотребления рациона. При анализе поведенческих реакций было показано, что L-Кар, по-видимому, потенцировал возрастание подвижности у мышей DBA/2J, но при этом не влиял на снижение подвижности у мышей DBCB. С другой стороны, L-Кар потенцировал возрастание тревожности у мышей DBCB, но не влиял в этом отношении на мышей DBA/2J. Полученные данные свидетельствуют о наличии у L-Кар выраженных нейротропных свойств, что согласуется с данными литературы [11], и различной направленности их проявлений у мышей вышеуказанной линии и тетрагибрида. Влияния L-Кар на показатель мышечной силы сжатия, тесно связанный с физической работоспособностью индивида [15], в проведенных экспериментах не было выявлено у мышей обоих генотипов, что совпадает с данными работ [8, 16], выполненных на других биологических моделях. Следует отметить явный гепатопротекторный эффект L-Кар, выразившийся в снижении активности трансаминаз АЛТ и АСТ, а также КФК в плазме крови, а у мышей DBCB, в дополнение к этому, и в снижении выраженности жировой дистрофии печени и нормализации массы сердца. На наличие у L-Кар гепатопротекторного и кардиопротекторного действия указывают данные работ [17–19].
Влияние L-Кар на биохимические и иммунологические показатели у мышей DBA/2J и DBCB также различается. Так, только у последних выявлено нормализующее действие L-Кар в отношении повышенного уровня триглицеридов, лептина и соотношения лептин/грелин. Стимулирующее влияние L-Кар на выработку грелина было также выявлено только у мышей тетрагибридов. Напротив, снижение уровня инсулина, повышенного вследствие потребления ВУВЖР, было более заметным у мышей DBA/2J. Указанные различия, предположительно, могут быть связаны с изначально повышенным у мышей тетрагибридов уровнем воспалительных процессов в жировой ткани, о чем свидетельствуют данные определения RANTES в плазме крови. Общим для мышей обоих генотипов было стимулирующее действие L-карнитина на продукцию IL-3, и IL-12(p70), что указывает на наличие иммуностимулирующего действия. Отсутствие влияния L-Кар на продукцию IL-10 совпадает с данными [20]. Таким образом, у мышей DBCB, генетически более склонных к развитию ожирения и жировой дистрофии печени, потребление L-Кар привело к выраженным позитивным изменениям показателей липидного обмена, что согласуется с результатами ряда исследований [21–23].
Различия в эффективности L-Кар в коррекции показателей, характеризующих развитие ожирения, у линейных мышей и тетрагибридов, могут предположительно быть связаны с особенностями обмена и клеточного транспорта этого соединения. Как известно, L-Кар синтезируется в организме из триметиллизина, входящего в состав метилированных белков, в частности, гистонов, однако возможности его синтеза часто неадекватны потребностям организма, особенно в условиях, требующих усиления β-окисления жирных кислот (при повышенных энерготратах, стрессе и т.д.) [4]. Значительная часть L-Кар поступает в организм с пищей, в составе продуктов животного происхождения. Биодоступность L-Кар в желудочно-кишечном тракте может достигать 90% [24]. Перенос L-Кар через биологические мембраны опосредуется рядом близкородственных транспортных белков, из которых наиболее важным считается OCTN2 (SLC22A5). Этот переносчик экспрессирован в плазматической мембране энтероцитов слизистой оболочки тонкой кишки, а также клеток печени, скелетных мышц и других тканей [25]. Он же, по данным [26], отвечает за перенос L-Кар в головной мозг через гемато-энцефалический барьер. Согласно [27] экспрессия гена белка OCTN2 у мышей, свиней, коров и человека непосредственно регулируется системой рецептора, связанного с пероксисомным пролифератором PPARα, то есть должна быть чувствительна к изменениям в липидном обмене. Однако непосредственные данные о влиянии жира на экспрессию OCTN2 немногочисленны. Так, в работе [28] показано, что экспрессия белка OCTN2 понижена у крыс Zucker с ожирением по сравнению с их нормальными генетическими аналогами. Для выяснения роли OCTN2 в характере реакции организма на прием L-Кар необходимы дополнительные исследования на транскриптомном и протеомном уровне.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о положительном эффекте L-Кар в отношении ряда биохимических и иммунологических показателей и гепатопротекторном действии у чувствительных к ВУВЖР мышей. Это указывает на перспективность использования L-Кар и его комбинаций с другими биологически активными веществами в качестве средств диетической коррекции ожирения и связанных с ним алиментарно-зависимых заболеваний, а также указывает на важность выбора адекватной биологической модели для оценки такой эффективности. Однако, для обоснования схем использования L-Кар в лечебно-профилактическом питании необходимы дальнейшие исследования.
Список литературы
Позняковский В.М., Суханов Б.П. Биологически активные добавки в современной нутрициологии. Техника и технология пищевых производств. 2(13). 2009. [Электронный ресурс: http://fptt.ru/stories/archive/13/13.pdf]. [Poznjakovsky V.M., Sukhanov B.P. Biologically active additives in a modern food. Food Processing: Techniques and Technology. 2(13). 2009. (In Russ.)].
Тутельян В.А., Киселева Т.Л., Кочеткова А.А., Смирнова Е.А., Киселева М.А., Саркисян В.А. Перспективные источники фитонутриентов для специализированных пищевых продуктов с модифицированным углеводным профилем: опыт традиционной медицины. Вопр. питания. 84(4): 46–60. 2016 [Tutelyan V.A., Kiseleva T.L., Kochetkova А.А., Smirnova Е.А., Kiseleva M.A., Sarkisyan V.A. Promising source of micronutrients for specialized foods with modified carbohydrate profile: traditional medicine experience. Vopr. Pitan. (Problems of nutrition). 84(4): 46–60. 2016. (In Russ.)].
Раджабкадиев Р.М., Коростелева М.М., Евстратова В.С., Никитюк Д.Б., Ханферьян Р.А. L-карнитин: свойства и перспективы применения в спортивной практике. Вопр. питания. 84(3): 4–12. 2015. [Radzhabkadiev R.M., Korostelyova M.M., Evstratova V.S., Nikityuk D.B., Khanferyan R.A. L-carnitine: properties and perspectives for use in sports practice. Vopr. Pitan. (Problems of nutrition). 84(3): 4–12. 2015. (In Russ.)].
Longo N., Frigeni M., Pasquali M. L-Carnitine transport and fatty acid oxidation. Biochim. Biophys. Acta Mol. Cell Res. 1863(10): 2422–2435. 2016.
Pooyandjoo M., Nouhi M., Shab-Bidar S., Djafarian K., Olyaeemanesh A. The effect of (L-) carnitine on weight loss in adults: A systematic review and meta-analysis of randomized controlled trials. Obes Rev. 17(10): 970–976. 2016.
Brass E.P. L-Carnitine and sports medicine: Use or abuse? Ann. N.Y. Acad. Sci. 1033(1): 67–78. 2004.
Oliveira C., Sousa M. The effects of L-carnitine supplementation in athletic performance. Science & Sports. 2018. https://doi.org/10.1016/j.scispo.2018.09.005
Morand R., Bouitbir J., Felser A., Hench J., Handschin C., Frank S., Krähenbühl S. Effect of carnitine, acetyl-, and propionylcarnitine supplementation on the body carnitine pool, skeletal muscle composition, and physical performance in mice. Eur. J. Nutr. 53(6): 1313–1325. 2014.
Díaz R., Lorita J., Soley M., Ramírez I. L-Carnitine worsens both injury and recovery of contractile function after transient ischemia in perfused rat heart. J. Physiol. Biochem. 64(1): 1–8. 2008.
Li T.T., Tan T.B., Hou H.Q., Zhao X.Y. Changes in peroxisome proliferator-activated receptor alpha target gene expression in peripheral blood mononuclear cells associated with non-alcoholic fatty liver disease. Lipids Health Dis. 17(1): 256. 2018.
Beaudet A.L. Brain carnitine deficiency causes nonsyndromic autism with an extreme male bias: A hypothesis. Bioessays. 39(8): 12. 2017.
Апрятин С.А., Шипелин В.А., Сидорова Ю.С., Петров Н.А., Гмошинский И.В., Никитюк Д.Б. Межвидовые различия поведенческих реакций и нейромоторики лабораторных грызунов, получающих рационы с легкоусвояемыми углеводами. Бюлл. эксперим. биол. мед. 165(1): 9–14. 2018. [Apryatin S.A., Shipelin V.A., Sidorova Yu.S., Petrov N.A., Gmoshinskii I.V., Nikityuk D.B. Interspecific Differences in Behavioral Responses and Neuromotorics between Laboratory Rodents Receiving Rations with Easily Digested l-Carbohydrates. Bull. Exp. Biol. Med. 165(1): 9–14. 2018. (In Russ.)].
Reeves P.C. AIN-93 purified diets for the study of trace elements metabolism in rodents. In: Trace elements in laboratory rodents. Ed. Watson R.R. ISBN 0-8493-9611-5.CRC Press. 2000.
Williams R.L., Wood L.G., Collins C.E., Morgan P.J., Callister R. Energy homeostasis and appetite regulating hormones as predictors of weight loss in men and women. Appetite. 101: 1–7. 2016.
Fujiwara M., Iwata M., Inoue T., Aizawa Y., Yoshito N., Hayashi K., Suzuki S. Decreased grip strength, muscle pain, and atrophy occur in rats following long-term exposure to excessive repetitive motion. FEBS Open Bio. 7(11): 1737–1749. 2017.
Kaup D., Keller J., Most E., Geyer J., Eder K., Ringseis R. The carnitine status does not affect the contractile and metabolic phenotype of skeletal muscle in pigs. Nutr. Metab. (London). 15: 2. 2018.
Malaguarnera M., Pistone G., Astuto M., Vecchio I., Raffaele R., Lo G.E., Rampello L. Effects of L-acetylcarnitine on cirrhotic patients with hepatic coma: Randomized double-blind, placebo-controlled trial. Dig. Dis. Sci. 51(12): 2242–2247. 2006.
Fujisawa K., Takami T., Matsuzaki A., Matsumoto T., Yamamoto N., Terai S., Sakaida I. Evaluation of the effects of L-carnitine on medaka (Oryzias latipes) fatty liver. Sci. Rep. 7(1): 2749. 2017.
Panchal S.K., Poudyal H., Ward L.C., Waanders J., Brown L. Modulation of tissue fatty acids by L-carnitine attenuates metabolic syndrome in diet-induced obese rats. Food Funct. 6(8): 2496–2506. 2015.
Rafraf M., Karimi M., Jafari A. Effect of L-carnitine supplementation in comparison with moderate aerobic training on serum inflammatory parameters in healthy obese women. J. Sports Med. Phys. Fitness. 55(11): 1363–1370. 2015.
Jang A., Kim D., Sung K.S., Jung S., Kim H.J., Jo C. The effect of dietary α-lipoic acid, betaine, L-carnitine, and swimming on the obesity of mice induced by a high-fat diet. Food Funct. 5(8): 1966–1974. 2014.
Wu T., Guo A., Shu Q., Qi Y., Kong Y., Sun Z., Sun S., Fu Z. L-l-Carnitine intake prevents irregular feeding-induced obesity and lipid metabolism disorder. Gene. 554(2): 148–154. 2015.
Xie X., Guo A., Wu T., Hu Q., Huang L., Yao C., Zhao B., Zhang W., Chi B., Lu P., Zhao Z., Fu Z. Preventive effect of L-carnitine on the disorder of lipid metabolism and circadian clock of mice subjected to chronic jet-lag. Physiol. Res. 66(5): 801–810. 2017.
Ringseis R., Keller J., Eder K. Basic mechanisms of the regulation of L-carnitine status in monogastrics and efficacy of L-carnitine as a feed additive in pigs and poultry. J. Anim. Physiol. Anim Nutr. (Berlin). 102(6): 1686–1719. 2018.
Kou L., Sun R., Ganapathy V., Yao Q., Chen R. Recent advances in drug delivery via the organic cation/carnitine transporter 2 (OCTN2/SLC22A5). Expert Opin. Ther. Targets. 22(8): 715–726. 2018.
Okura T., Kato S., Deguchi Y. Functional expression of organic cation/carnitine transporter 2 (OCTN2/SLC22A5) in human brain capillary endothelial cell line hCMEC/D3, a human blood-brain barrier model. Drug Metab. Pharmacokinet. 29(1): 69–74. 2014.
Luo H., Zhang Y., Guo H., Zhang L., Li X., Ringseis R., Wen G., Hui D., Liang A., Eder K., He D. Transcriptional regulation of the human, porcine and bovine OCTN2 gene by PPARα via a conserved PPRE located in intron 1. BMC Genet. 15:90. 2014.
Couturier A., Ringseis R., Most E., Eder K. Pharmacological doses of niacin stimulate the expression of genes involved in carnitine uptake and biosynthesis and improve the carnitine status of obese Zucker rats. BMC Pharmacol. Toxicol. 15: 37. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


