Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 5, стр. 657-664
Функциональная активность гликопротеина-P в гематоэнцефалическом барьере на фоне ишемии–реперфузии головного мозга
И. В. Черных 1, *, А. В. Щулькин 1, Е. Н. Якушева 1, А. С. Есенина 1, М. М. Градинарь 1, П. Ю. Мыльников 1, М. В. Гацанога 1
1 Рязанский государственный медицинский университет им. академика И.П. Павлова
Рязань, Россия
* E-mail: ivchernykh88@mail.ru
Поступила в редакцию 28.01.2019
После доработки 18.03.2019
Принята к публикации 31.03.2019
Аннотация
На 70 крысах-самцах линии Вистар изучена активность белка-транспортера гликопротеина-Р (Pgp) и его относительное количество в гематоэнцефалическом барьере (ГЭБ) коры лобной доли больших полушарий головного мозга при окклюзии–реперфузии средней мозговой артерии. Окклюзию выполняли эндоваскулярно на протяжении 30 мин. Активность Pgp в ГЭБ оценивали косвенно по концентрации его маркерного субстрата – фексофенадина в коре больших полушарий головного мозга крыс после его внутривенного введения в дозе 10 мг/кг через 24 ч после реперфузии. Образцы ткани коры больших полушарий головного мозга и плазмы крови забирали через 5, 10, 15, 30, 45 и 60 мин после введения фексофенадина. Концентрацию фексофенадина в тканях определяли методом высокоэффективной жидкостной хроматографии. Относительное количество транспортера оценивали методом иммуногистохимии. Установлено, что окклюзия–реперфузия средней мозговой артерии приводила к увеличению проницаемости ГЭБ для фексофенадина, о чем свидетельствует повышение площади под кривой “концентрация фексофенадина в коре головного мозга–время” и отношения площади под кривой “концентрация фексофенадина в коре головного мозга–время” к площади под кривой “концентрация фексофенадина в плазме крови–время” в 3.2 и 2.5 раза соответственно по сравнению с показателями ложнооперированных животных. Иммуногистохимическая оценка относительного количества Pgp в ГЭБ после окклюзии–реперфузии средней мозговой артерии показала, что количество транспортера возрастает в 1.9 раза по сравнению с крысами, которые подвергались “ложной” операции. Таким образом, несмотря на повышение количества Pgp в ГЭБ на фоне окклюзии–реперфузии средней мозговой артерии, его проницаемость для фексофенадина возрастает, что, вероятно связано с нарушением структуры барьера на фоне дефицита кислорода.
Гликопротеин-P (Pgp, АВСВ1-белок) – эффлюксный мембранный белковый транспортер, осуществляющий выброс различных по химической структуре эндогенных и экзогенных веществ из клеток во внеклеточное пространство [1]. Локализуясь в гематоэнцефалическом барьере (ГЭБ), он препятствует проникновению его субстратов в головной мозг. Многие вещества с установленной нейропротективной активностью in vitro – флавоноиды [2], ривастигмин [3], берберин [4] – не применяются в качестве таковых в связи с тем, что в терапевтической дозе не достигают достаточной концентрации в головном мозге за счет их эффлюкса посредством Pgp, а при повышении дозы оказывают выраженные системные побочные эффекты.
Кроме того, широкий спектр препаратов и факторов способен изменять активность Pgp, а соответственно и проницаемость ГЭБ [5, 6].
Например, повышение экспрессии и активности белка-транспортера при остром нарушении мозгового кровообращения может быть одним из факторов, обуславливающих низкую активность нейропротекторов-субстратов Pgp при данной патологии.
Целью настоящего исследования явилась оценка функциональной активности и относительного количества Pgp в ГЭБ на фоне окклюзии–реперфузии средней мозговой артерии (СМА).
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на 70 половозрелых крысах-самцах линии Вистар массой 220–260 г в соответствии с правилами лабораторной практики (Приказ Министерства здравоохранения РФ от 1 апреля 2016 г. № 199н “Об утверждении Правил надлежащей лабораторной практики”).
Животные были разделены на 2 серии: в первой (n = 60) оценивали функциональную активность Pgp в ГЭБ на фоне ишемии–реперфузии СМА, во второй (n = 10) – относительное количество белка-транспортера в ГЭБ.
Первая серия, в свою очередь, была разделена на 2 группы. Первая – контроль, представлена животными, которым выполняли “ложную” операцию – вскрытие кожи и мягких тканей шеи без окклюзии СМА с последующим ушиванием раны. Вторая группа включала животных, подвергнутых окклюзии СМА в течение 30 мин с последующей реперфузией. Через 24 ч после манипуляций у животных обеих групп оценивали функциональную активность Pgp в ГЭБ.
Вторая серия животных также делилась на 2 группы: на первой (n = 5) анализировалось относительное количество Pgp в ГЭБ на фоне “ложной” операции, на второй (n = 5) – на фоне окклюзии–реперфузии СМА.
Окклюзию–реперфузию СМА моделировали под золетиловым наркозом: внутрибрюшинное введение золетила (“Virbac”, Франция) в дозе 30 мг/кг [7]) путем 30-минутной эндоваскулярной окклюзии сосуда полипропиленовой нитью диаметром 0.150–0.199 мм совместно с перманентной перевязкой общей и наружной сонных артерий с последующей реканализацией [8].
Оценку проницаемости ГЭБ проводили по анализу фармакокинетики маркерного субстрата Pgp фексофенадина – гистаминолитика 3-го поколения, который незначительно проникает в головной мозг из-за активного эффлюкса транспортером. Повышение содержания фексофенадина в головном мозге происходит при увеличении проницаемости ГЭБ, что косвенно свидетельствует об угнетении функциональной активности Pgp, т.к. фексофенадин не метаболизируется в организме, а его проникновение в мозг контролируется преимущественно данным белком-транспортером [9].
Через 24 ч после ложной операции (первая группа) или после реканализации СМА (вторая группа) животным внутривенно вводили фексофенадин в дозе 10 мг/кг с последующим забором крови в объеме 4 мл из брюшной аорты и ткани коры больших полушарий головного мозга через 5, 10, 15, 30, 45 и 60 мин (на каждую временную точку приходилось по 5 крыс) для определения содержания маркерного субстрата Pgp.
Количественное определение фексофенадина в плазме крови и гомогенате головного мозга крыс производилось методом высокоэффективной жидкостной хроматографии с колонкой Phenomenex Synergi 4u Polar-RP 80A (250 × 4.6) с зернением 4 мкм и термостатированием при 45°С на хроматографической системе “Stayer” (“Аквилон”, Россия) с УФ-спектрофотометрическим детектированием при длине волны 220 нм. Состав подвижной фазы: ацетонитрил (128 мл), вода деионизированная (267.4 мл), триэтиламин (7.0 мл), кислота уксусная ледяная (6.3 мл), pH 6.15. Осаждение белка при пробоподготовке проводилось с применением ацетонитрила.
Суммарное количество фексофенадина, поступившее в системный кровоток, оценивали по площади под кривой “концентрация фексофенадина в плазме–время” (AUC0-t(плазма)), а суммарное количество фексофенадина в коре больших полушарий – по площади под кривой “концентрация фексофенадина в коре головного мозга–время” (AUC0-t(мозг)), которые рассчитывали методом трапеции [10]. Для оценки проницаемости ГЭБ и функциональной активности Pgp в нем был определен показатель AUC0-t(мозг)/AUC0-t(плазма) – отношение площади под кривой “концентрация фексофенадина в коре головного мозга–время” к площади под кривой “концентрация фексофенадина в плазме–время” [11].
Животных второй серии выводили из исследования под эфирным наркозом через 24 ч после реперфузии СМА (первая группа) или “ложной” операции (вторая группа), извлекали лобную долю коры головного мозга, и часть ее фиксировали в 10%-ном растворе нейтрального формалина. Гистологический материал обезвоживали в растворах этилового спирта возрастающей концентрации, просветляли ксилолом и помещали в парафин. Перед реакцией иммунного окрашивания производили демаскировку антигенов тканей посредством нагревания на водяной бане в 10 мМ цитратном буфере (рН 6.0), блокировали эндогенную пероксидазу 3%-ным раствором перекиси водорода. Затем инкубировали срезы с первичными антителами к Pgp (ABCBl antibody-middle region, Aviva Systems Biology, США) в разведении 1 : 100. Для иммунного окрашивания использовали полимерную систему детекции с пероксидазной меткой (“DAKO”, Дания) (вторичные антитела к чужеродному белку крыс). Ядра клеток окрашивали гематоксилином.
Микропрепарат фотографировали с помощью цифровой камеры “ЛОМО ТС-500” (Россия) при увеличении в 400 раз. В каждом гистологическом препарате оценивали 10 репрезентативных участков (10 фотографий). В дальнейшем изображения подвергали анализу с применением медицинской программы для анализа и обработки цифровых изображений ImageJ (США). Далее определяли относительную площадь мембран, экспрессирующих Pgp, которая рассчитывалась как площадь мембран, экспрессирующих Pgp (pix2), деленная на общую площадь поля зрения (pix2) [https://imagej.nih.gov].
Статистическая обработка результатов проводилась с использованием пакета MS Excel и Statistica 7.0. Характер распределения данных определяли по критерию Шапиро–Уилка. В случае нормального распределения статистическую значимость различий оценивали с помощью теста ANOVA, попарные сравнения выполняли с помощью критерия Ньюмена–Кейсла. При распределении данных, отличном от нормального, различия между сериями оценивали с помощью критерия Крускала–Уоллиса. При уровне значимости менее 0.05 проводили парное сравнение параметров с помощью критерия Манна–Уитни с поправкой Бонферонни. В таблицах данные представлены в виде среднего арифметического ± стандартное отклонение среднего (нормальное распределение данных) или медианы, нижнего и верхнего квартилей (распределение данных, отличное от нормального).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
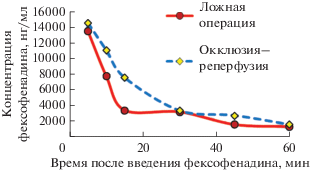
При изучении фармакокинетики фексофенадина после его внутривенного введения у ложнооперированных животных были получены следующие результаты. Концентрация фексофенадина в плазме крови крыс через 5 мин после его внутривенного введения в дозе 10 мг/кг массы (контроль) составила 13.5 мкг/мл, затем постепенно снижалась и достигала значения 1.3 мкг/мл к 60-й минуте исследования. Окклюзия–реперфузия СМА статистически значимо не влияла на содержание фексофенадина в плазме крови: его концентрация в исследуемые временные точки, так же, как и площадь под фармакокинетической кривой концентрация–время (AUC0-t(плазма)) достоверно не отличались от показателей контрольных животных (рис. 1).
Рис. 1.
Динамика концентраций фексофенадина в плазме крови крыс после его однократного внутривенного введения в дозе 10 мг/кг массы тела.
Динамика концентраций фексофенадина в гомогенате коры больших полушарий головного мозга крыс в сериях контроля и окклюзии–реперфузии СМА представлена в табл. 1.
Таблица 1.
Динамика концентраций фексофенадина в гомогенате коры больших полушарий головного мозга крыс в сериях “ложной” операции и окклюзии–реперфузии СМА
| Группы эксперимента | Сроки эксперимента | |||||
|---|---|---|---|---|---|---|
| 5 мин | 10 мин | 15 мин | 30 мин | 45 мин | 60 мин | |
| “Ложная” операция | 322.77 (251.20; 406.41) |
442.12 (421.63; 472.86) |
789.91 (702.81; 790.21) |
364.06 (330.61; 395.10) |
150.99 (147.82; 172.23) |
58.01 (35.86; 68.56) |
| Окклюзия– реперфузия СМА |
978.85 (874.38; 1244.70)* |
678.98 (627.75; 1292.04)* |
1083.21 (934.02; 1236.41) |
1037.25 (1010.37; 1171.99)* |
1005.98 (864.58; 1204.76)* |
735.87 (567.97; 1056.33)* |
Установлено, что у ложнооперированных животных концентрация фексофенадина в коре больших полушарий головного мозга постепенно повышалась после его внутривенного введения, достигая своего максимума (759.35 нг/г) через 15 мин и постепенно снижалась к 60-й мин эксперимента.
Моделирование патологии приводило к повышению содержания фексофенадина в коре ишемизированного полушария головного мозга крыс через 5 мин после его внутривенного введения в 5 раз (p < 0.05), через 10 мин – в 2 раза (p < 0.05), через 30 мин – в 3 раза (p < 0.05), через 45 мин – в 6.2 раза (p < 0.05) и через 60 мин – в 17.8 раз (p < 0.05) по сравнению с показателями контроля. Площадь под кривой “концентрация фексофенадина в коре головного мозга–время” (AUC0-t(мозг)), отражающая общее содержание маркерного субстрата в коре, в ишемизированном полушарии превышала аналогичный показатель контрольных животных в 3.2 раза (p < 0.05) (табл. 2).
Таблица 2.
Усредненные значения площадей под фармакокинетическими кривыми фексофенадина в гомогенате головного мозга крыс и плазме, а также соотношение указанных параметров в сериях “ложной” операции и окклюзии–реперфузии СМА
| Серия эксперимента |
Параметр | ||
|---|---|---|---|
| AUC0-t(мозг), нг/(г мин) | AUC0-t(плазма), нг/(мл ч) | AUC0-t(мозг)/ AUC0-t(плазма) | |
| “Ложная” операция | 19 921.42 ± 1637.03 | 222 683.55 ± 23 247.77 | 0.0901 ± 0.0108 |
| Окклюзия– реперфузия СМА |
63 622.49 ± 16 039.13* | 307 234.11 ± 105 486.80 | 0.2271 ± 0.1029* |
Отношение AUC0-t(мозг)/AUC0-t(плазма), характеризующее проницаемость ГЭБ и активность Pgp в нем, в ишемизированном полушарии у крыс, подвергнутых окклюзии–реперфузии СМА, превышало данный показатель ложнооперированных животных в 2.5 раза (p < 0.05) (табл. 2).
Иммуногистохимическая оценка относительного количества Pgp в ГЭБ после окклюзии–реперфузии СМА показала, что относительное количество транспортера возрастало 1.86 раза по сравнению с крысами (p < 0.05), которые подвергались “ложной” операции (табл. 3; рис. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В ходе данной работы исследовалось функционирование Pgp в ГЭБ на фоне окклюзии–реперфузии СМА. Активность белка-транспортера анализировали по проникновению его маркерного субстрата – фексофенадина в головной мозг. Особенностью фармакокинетики фексофенадина является то, что он не метаболизируется микросомальными ферментами печени, а его энтеральная абсорбция и проникновение в головной мозг через ГЭБ контролируется преимущественно Pgp [9]. Поэтому при внутривенном введении (когда исключено влияние абсорбции на фармакокинетику препарата) концентрация фексофенадина в головном мозге может характеризовать активность Pgp в ГЭБ.
В ходе настоящего исследования установлено, что моделирование окклюзии–реперфузии СМА не влияло на системную фармакокинетику фексофенадина: его концентрации в плазме крови в разные временные точки так же, как и AUC0-t-плазма, отражающая общее количество препарата, попавшее в системный кровоток, статистически значимо не отличались у контрольных и ишемизированных животных.
При этом на фоне окклюзии–реперфузии СМА наблюдалось возрастание AUC0-t(мозг), отражающее общее содержание маркерного субстрата в коре, и отношения AUC0-t(мозг)/AUC0-t(плазма), характеризующего проницаемость ГЭБ и активность Pgp в нем, в коре лобной доли ишемизированного полушария по сравнению с ложнооперированными крысами, что говорит о локальном снижении активности Pgp в ГЭБ на фоне моделируемой патологии.
Аналогичные результаты получены K. Yano с соавт. на крысах со спонтанной гипертензией при одновременной окклюзии дистальной СМА и ипсилатеральной общей сонной артерии с использованием силнидепина (антигипертензивного и нейропротекторного средства) в качестве маркерного субстрата. Показано повышение концентрации препарата в клетках пораженного полушария по сравнению с нормальной тканью, что, по мнению авторов, свидетельствует об ингибировании активности Pgp [12].
В нашем исследовании также выявлено, что ишемия-реперфузия приводила к увеличению относительного количества Pgp в ГЭБ, что согласуется с данными литературы. Так, в экспериментах, выполненных на культурах эндотелиальных клеток ГЭБ, установлено, что гипоксическая гипоксия и развитие окислительного стресса усиливают экспрессию белка-транспортера, причем важную роль в регуляции данного процесса играют транскрипционные факторы HIF1, Sp1, Nrf2 [13]. При локальной ишемии головного мозга показано повышение экспрессии Pgp в эндотелии капилляров [14]. Перманентная окклюзия СМА у крыс-самцов в течение 4 ч приводила к стимуляции экспрессии Pgp в ГЭБ и нейронах головного мозга, что было выявлено методом Вестерн-блоттинга [15].
Вероятно, при ишемии и ишемии–реперфузии СМА повышение относительного количества Pgp – это защитно-приспособительный механизм, однако развивающийся на фоне патологии окислительный стресс, активация протеолитических ферментов и энергодефицит повреждают ГЭБ с ростом его проницаемости. При этом Pgp не способен адекватно выполнять свою транспортную функцию, даже несмотря на повышение его синтеза. Кроме того, в литературе описаны случаи несоответствия экспрессии и эффлюксной активности данного белка-транспортера [16].
Таким образом, 30-минутная окклюзия СМА с последующей реперфузией в течение 24 ч вызывает повышение относительного количества Pgp в ГЭБ, однако его проницаемость для маркерного субстрата данного белка-транспортера возрастает, что, вероятно, связано с нарушением структуры барьера на фоне моделируемой патологии.
Список литературы
Гацанога М.В., Черных И.В., Щулькин А.В., Якушева Е.Н., Попова Н.М. Можно ли оценивать принадлежность лекарственных веществ к субстратам гликопротеина-P на самках кроликов породы Шиншилла. Наука молодых (Eruditio Juvenium). 4(4): 5–10. 2016. [Gatsanoga M.V., Chernykh I.V., Shchulkin A.V., Yakusheva E.N., Popova N.M. The method of assessment of drugs belonging to the substrates of P-glycoprotein on female rabbits. Nauka molodykh (Eruditio Juvenium). 3: 5–10. 2016. (In Russ.)].
Youdim K.A., Qaiser M.Z., Begley D.J., Rice-Evans C.A., Abbott N.J. Flavonoid permeability across an in situ model of the blood-brain barrier. Free Radic. Biol. Med. 36(5): 592–604. 2004.
Mohamed L.A., Keller J.N., Kaddoumi A. Role of P-glycoprotein in mediating rivastigmine effect on amyloid-β brain load and related pathology in Alzheimer’s disease mouse model. Biochim. Biophys. Acta. 1862(4): 778–787. 2016.
Kumar A., Ekavali M., Mishra J., Chopra K., Dhull D.K. Possible role of P-glycoprotein in the neuroprotective mechanism of berberine in intracerebroventricular streptozotocin-induced cognitive dysfunction. Psychopharmacology (Berlin). 233(1): 137–152. 2016.
Черных И.В., Щулькин А.В., Якушева Е.Н., Гацанога М.В., Попова Н.М. Анализ принадлежности препарата ноопепт к субстратам и модуляторам функциональной активности ABCB1-белка в эксперименте in vivo. Рос. медико-биол. вестн. им. акад. И.П. Павлова. 25(1): 30–41. 2017. [Chernykh I.V., Shchulkin A.V., Yakusheva E.N., Gatsanoga M.V., Popova N.M. Analysis of attribution of Noopept to substrates and modulators of functional activity of ABCB1-protein in in vivo experiment. Rossiyskiy mediko-biologicheskiy vestnik imeni akademika I.P. Pavlova. 25(1): 30–41. 2017. (In Russ.)].
Щулькин А.В., Якушева Е.Н., Попова Н.М. Роль гликопротеина-P в рациональной фармакотерапии в кардиологии. Рациональная фармакотерапия в кардиологии. 9(6): 701–707. 2013. [Shchulkin A.V., Yakusheva E.N., Popova N.M. The role of P-glycoprotein in rational pharmacotherapy in cardiology. Ratsional’naya farmakoterapiya v kardiologii. 9(6): 701–707. 2013. (In Russ.)].
Ивашев М.Н., Арльт А.В., Савенко И.А., Сергиенко А.В., Зацепина Е.Е., Лысенко Т.А., Куянцева А.М., Саркисян К.Х. Особенности кардиогемодинамики при применении золетила у лабораторных животных. Научные ведомости БелГУ. Серия: Медицина. Фармация. 123(4–1): 168–171. 2012. [Ivashev M.N., Arl’t A.V., Savenko I.A., Sergiyenko A.V., Zatsepina E.E., Lysenko T.A., Kuyantseva A.M., Sarkisyan K.H. Features of cardiohaemodynamics after usage of zoletil at laboratory animals. Nauchnyye vedomosti BelGU. Seriya: Meditsina. 123(4–1): 168–171. 2012. (In Russ.)].
Liu W.J., Jiang H.F., Rehman F.U., Zhang J.W., Chang Y., Jing L., Zhang J.Z. Lycium barbarum polysaccharides decrease hyperglycemia-aggravated ischemic brain injury through maintaining mitochondrial fission and fusion balance. Int. J. Biol. Sci. 13(7): 901–910. 2017.
Ohura K., Nakada Y., Kotani S., Imai T. Design of fexofenadine prodrugs based on tissue-specific esterase activity and their dissimilar recognition by P-glycoprotein. J. Pharm. Sci. 104(9): 3076–3083. 2015.
Каркищенко Н.Н., Хоронько В.В., Сергеева С.А., Каркищенко В.Н. Фармакокинетика. Ростов-на-Дону. Феникс. 2001. [Karkishchenko N.N., Khoronko V.V., Sergeeva S.A., Karkishchenko N.N. Farmakokinetika. [Pharmacokinetics]. Rostov-na-Donu. Feniks. 2001.
Kerns E.H., Di L. Drug-like properties: Concepts, structure design and methods: from ADME to toxicity optimizati. Acad. Press. 2016.
Yano K., Takimoto S., Motegi T., Tomono T., Hagiwara M., Idota Y., Moromot K., Takahara A., Ogihara T. Role of P-glycoprotein in regulating cilnidipine distribution to intact and ischemic brain. Drug Metab. Pharmacokinet. 29(3): 254–258. 2014.
Ji B.S., Cen J., He L., Liu M., Liu Y.Q., Liu L. Modulation of P-glycoprotein in rat brain microvessel endothelial cells under oxygen glucose deprivation. J. Pharm. Pharmacol. 65(10): 1508–1517. 2013.
Spudich A., Kilic E., Xing H., Kilic U., Rentsch K.M., Wunderli-Allenspach H., Bassetti C.L., Hermann D.M. Inhibition of multidrug resistance transporter-1 facilitates neuroprotective therapies after focal cerebral ischemia. Nat. Neurosci. 9(4): 487–488. 2006.
Cen J., Liu L., Li M.S., He L., Wang L.J., Liu Y.Q., Liu M., Ji B.S. Alteration in P-glycoprotein at the blood–brain barrier in the early period of MCAO in rats. J. Pharm. Pharmacol. 65: 665–672. 2013.
Dickens D., Owen A., Alfirevic A., Pirmohamed M. ABCB1 single nucleotide polymorphisms (1236C > T, 2677G > T, and 3435C > T) do not affect transport activity of human P-glycoprotein. Pharmacogenet. Genomics. 23(6): 314–323. 2013.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова