Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 7, стр. 812-831
Методика оценки вклада различных типов ионотропных рецепторов в постсинаптический ответ в ходе эпилептоподобных разрядов in vitro
Д. В. Амахин 1, Е. Б. Соболева 1, А. В. Зайцев 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: aleksey_zaitsev@mail.ru
Поступила в редакцию 24.04.2019
После доработки 08.05.2019
Принята к публикации 10.05.2019
Аннотация
Эпилептоподобная активность в переживающем срезе головного мозга – результат сложной интеграции возбуждающих и тормозных синаптических сигналов. Временной паттерн активации различных синаптических проводимостей в ходе интериктальных разрядов позволяет описать закономерности работы нейронной сети при эпилептоподобных состояниях и проанализировать влияние различных фармакологических агентов на нее. Существующие методы оценки синаптических проводимостей, как правило, исходят из предположения линейности вольт-амперных характеристик (ВАХ) ответов нейрона и позволяют оценить вклад в постсинаптический ответ двух типов проводимостей – возбуждающей и тормозной без выделения вклада специфических типов синаптических рецепторов. В данной работе описаны теоретические основы методики оценки постсинаптических проводимостей сразу трех типов ионотропных рецепторов (AMPA-, NMDA- и ГАМКа-типа), активирующихся в ходе интериктальных разрядов в энторинальной коре. Предлагаемый алгоритм использует различия формы ВАХ этих рецепторов для оценки их вкладов в постсинаптический ответ нейрона и предполагает применение метода патч-кламп в конфигурации “целая клетка” в режиме фиксации потенциала. Применение методики продемонстрировано на примере нескольких моделей эпилептоподобной активности. Было проведено сравнение временного течения синаптических проводимостей в ходе интериктальных разрядов, генерируемых при полном сохранении ГАМКа-рецептор-опосредованной проводимости и при ее частичной блокаде с помощью антибиотика цефепима или бикукуллина. Показано, что несмотря на то, что цефепим является антагонистом ГАМКа-рецепторов, их суммарная проводимость на поздних этапах интериктального разряда значительно повышается по сравнению с моделью, в которой данный тип рецепторов не блокировался, или в которой использовался другой конкурентный антагонист – бикукуллин. Таким образом, предлагаемая методика позволяет выявлять тонкие различия временного течения трех типов синаптических проводимостей и позволяет продемонстрировать различия проэпилептических эффектов блокаторов ГАМКа-рецепторов.
При эпилептической активности в нейронной сети синхронно активируются глутаматергические и ГАМК-ергические нейроны. При этом каждый отдельный нейрон получает различные синаптические входные сигналы и отвечает на эти входные сигналы определенным паттерном генерации потенциалов действия (ПД) [1, 2]. В ходе электрофизиологических экспериментов имеется возможность единовременно отслеживать только небольшое количество параметров активности нейронов. Так, регистрация полевого внеклеточного потенциала позволяет регистрировать усредненную по популяции нейронов спайковую активность или постсинаптический ответ [3, 4]. Регистрация мембранного потенциала с помощью острого микроэлектрода [5], либо патч-кламп регистрация в конфигурации “целая клетка” в режиме фиксации тока [1, 6, 7] или в конфигурации “на клетке” в режиме фиксации напряжения [8] позволяют регистрировать спайковую активность одного задействованного в генерации эпилептических разрядов нейрона. Патч-кламп регистрация в режиме фиксации напряжения позволяет регистрировать синаптический входной сигнал, получаемый нейроном [1, 7, 9]. При этом сигналы различной модальности требуют различных условий для своей регистрации. Таким образом, чтобы полностью описать нейронную активность требуется одновременная реализация нескольких методических подходов, не всегда совместимых в рамках одного эксперимента. В связи с этим возникает задача разработки методик, позволяющих одновременно рассматривать несколько аспектов активности сети.
В исследованиях на переживающих срезах головного мозга задача оценить вклад возбуждающих и тормозных синаптических входов в ходе стереотипных событий в нервной сети возникает довольно часто. В исследованиях эпилепсии in vitro такая оценка необходима при анализе механизмов интериктальных и иктальных разрядов [10]. Во время этих разрядов реализуется довольно сложный паттерн активности ГАМК- и глутаматергических нейронов. Вклады ионотропных рецептов ГАМК и глутамата в постсинаптический ток в ходе эпилептического разряда в первом приближении отражают активность соответственно тормозных интернейронов и пирамидных нейронов. Величины соответствующих вкладов также отражают степень синхронизации этих популяций в ходе разряда. Таким образом, подробное описание временной динамики синаптических проводимостей разных типов в ходе этих разрядов позволяет делать выводы о механизмах их возникновения и режимах работы нейронной сети в ходе патологической активности [11]. При этом применение фармакологической блокады ионотропных рецепторов с целью изолировать интересующий компонент ответа не представляется возможным (либо ограничено только теми антагонистами, которые могут действовать изнутри клетки в ходе регистрации методом патч-кламп [8]), поскольку фармакологическое воздействие может видоизменить или остановить эпилептоподобную активность in vitro [2]. В связи с этим наибольший практический интерес представляют численные методы оценки синаптических проводимостей, использующие непосредственно измеряемые в ходе электрофизиологических экспериментов характеристики нейрона (мембранный потенциал или ток) [10, 12–16].
Применявшиеся ранее методы оценки синаптических проводимостей в ходе эпилептиформных разрядов используют различия потенциалов реверсии ионных токов через глутаматные и ГАМКа-рецепторы [10, 12]. Основной принцип метода заключается в вычислении искомых проводимостей, исходя из экспериментально определенных значений потенциала реверсии синаптического ионного тока и общей проводимости мембраны. Данный подход исходит из предположения линейности ВАХ мембраны в ходе синаптического ответа и позволяют оценить всего два компонента – возбуждающий и тормозный. Ранее нами было продемонстрировано, что предположение линейности ВАХ мембраны может приводить к значительным ошибкам определения проводимостей в ряде экспериментальных ситуаций [1, 15]. Наиболее значимым источником ошибки является проводимость NMDA-рецепторов, имеющая выраженную зависимость от мембранного потенциала. В данной статье приводится описание и теоретическое обоснование методики, которая может быть применена для одновременной оценки проводимости сразу трех типов постсинаптических ионотропных рецепторов (AMPA, NMDA и ГАМКа типов), активируемых в ходе спонтанных интериктальных разрядов. Основным принципом предлагаемого анализа является разделение компонент постсинаптического ответа, используя различие ВАХ ионных каналов, задействованных в нем. Возможности методики проиллюстрированы на трех моделях эпилептоподобной активности in vitro, в каждой из которых в энторинальной коре возникают стереотипные залпы синхронизованной активности нейронов. Стереотипность регистрируемых событий делает возможным их накопление при разных условиях регистрации, например, позволяет осуществить запись синаптической активности в ходе этих разрядов при фиксации мембранного потенциала на нескольких значениях. Предлагаемый подход позволяет формализовать оценку проводимости трех основных типов постсинаптических ионотропных рецепторов в ходе интериктального разряда в рамках одного эксперимента методом патч-кламп. При этом для его реализации не требуется использование фармакологических препаратов (антагонистов ионотропных рецепторов), способных нарушить процесс генерации эпилептиформной активности. Применение описываемого подхода позволяет сравнить свойства интериктальных разрядов в различных моделях эпилептической активности и выявить особенности влияния на них цефалоспоринового антибиотика цефепима.
МЕТОДЫ ИССЛЕДОВАНИЯ
Изготовление переживающих срезов энторинальной коры головного мозга крысы
Исследование проводилось на нейронах глубоких слоев энторинальной коры головного мозга крыс линии Вистар (возраст – 21 день). Все экспериментальные процедуры проводились в соответствии с директивой Совета Европы 86/609/EEC и регламентом использования лабораторных животных ИЭФБ РАН, принятым и утвержденным комиссией по биоэтике.
Методика изготовления переживающих срезов была описана ранее [1]. Крыс убивали декапитацией. Головной мозг быстро извлекался и помещался в искусственную спинномозговую жидкость (ИСЖ), аэрируемую газовой смесью 95% О2 + 5% СО2. ИСЖ использовалась на всех стадиях приготовления срезов и имела следующий состав (в мМ): NaCl 126, KCl 2.5, NaH2PO4 1.25, MgSO4 1, CaCl2 2, NaHCO3 24 и декстроза 13.
С помощью вибротома Microm HM650V (Thermo Fisher Scientific, США) изготавливались горизонтальные срезы головного мозга крысы толщиной 350 мкм, содержащие энторинальную кору и гиппокамп. Далее срезы оставлялись при комнатной температуре в емкости с аэрируемой ИСЖ на 1.5 ч для адаптации.
Патч-кламп регистрация
Изготовленные срезы перемещались в перфузируемую камеру, нейроны глубоких слоев медиальной энторинальной коры визуализировались с помощью микроскопа (Zeiss Axoscop 2, Германия), оснащенного объективом с водной иммерсией (×40), оптическим блоком для дифференциального контраста и цифровой камерой (Grasshopper 3 GS3-U3-23S6M-C, FLIR Integrated Imaging Solutions Inc., США).
Регистрация синаптических токов во время эпилептоподобных разрядов проводилась с нейрона в конфигурации “целая клетка” в режиме фиксации напряжения с помощью патч-кламп усилителя (Модель 2400, AM-Systems, США), аналого-цифрового преобразователя NI USB-6343 (National Instruments, США) и программного обеспечения WinWCP 5 (SIPBS, Великобритания). Данные фильтровались на 10 кГц и записывались с той же частотой дискретизации. Регистрация велась при температуре 30°С и скорости перфузии камеры со срезом равной 5–7 мл/мин.
Патч-пипетки были изготовлены на пуллере Sutter P-1000 (Sutter Instrument, США) из трубочек боросиликатного стекла с наружным диаметром 1.5 мм и внутренним диаметром 0.86 мм. Пипетки заполнялись раствором состава (в мМ): цезий-метансульфонат (CsMeSO4) 127, NaCl 10, EGTA 5, HEPES 10, QX314 6, АТФ-Mg 4, ГТФ 0.3 и имели сопротивление 3–3.5 МОм. Согласно описанной ранее методике [17] был измерен потенциал на границе раздела пипеточного и внеклеточного растворов (liquid junction potential, LJP), который составил –7 мВ, он был учтен при обработке данных. За исключением периодов регистрации эпилептоподобной активности большую часть времени потенциал на мембране фиксировали на –27 мВ.
Величину последовательного сопротивления (Rseries) отслеживали в ходе эксперимента, и в выборку включали нейроны, у которых величина последовательного сопротивления не превышала 20 МОм и не изменялась в течение записи более, чем на 30% от начального значения.
1) 4-аминопиридиновая модель (Модель 1)
В этой модели для вызова эпилептоподобной активности в срезе энторинальной коры использовался внеклеточный раствор следующего состава (в мМ): NaCl 120, KCl 8.5, NaH2PO4 1.25, MgSO4 0.25, CaCl2 2, NaHCO3 24, глюкоза 13 (проэпилептический раствор). В целях ускорения развития эпилептоподобного состояния в срезе энторинальной коры в раствор добавлялся 4-аминопиридин (4-АП, 0.05 мМ). Основные особенности эпилептоподобной активности в этой модели проиллюстрированы на рис. 1. Подробное описание режимов работы нейронной сети энторинальной коры в ходе эпилептоподобных состояний для 4-аминопиридиновой модели приводилось нами ранее [1, 18–20].
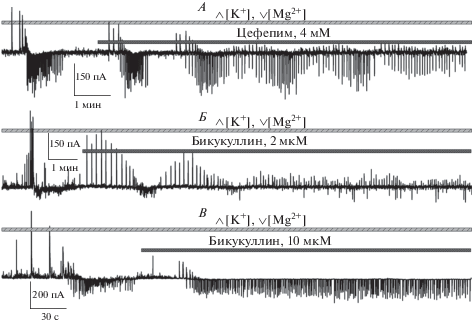
Рис. 1.
Характерный пример записи синаптической активности в энторинальной, вызванной перфузией среза раствором с повышенной концентрацией ионов калия (8.5 мМ), сниженной концентрацией ионов магния (0.25 мМ) и добавлением хемоконвульсанта 4-аминопиридина (50 мкМ). Записи сделаны от пирамидных нейронов методом патч-кламп в конфигурации “целая клетка” в режиме фиксации потенциала на –27 мВ. Регистрация осуществлялась с применением пипеточного раствора с низкой концентрацией ионов хлора, поэтому в подобной конфигурации положительные относительно базовой линии события опосредованы активацией ГАМКа-рецепторов, а отрицательные – активацией глутаматных рецепторов. А – продолжительная запись, демонстрирующая циклическую смену режимов синхронизованной активности в сети. В начале записи наблюдается режим, при котором преимущественно наблюдаются ГАМК-опосредованные интериктальные разряды (участок, отмеченный серым прямоугольником под записью, продемонстрирован более подробно на рис Б). Периодически этот режим сменяется иктальными разрядами (характерный пример, отмеченный серым прямоугольником над записью, продемонстрирован более подробно на рис В). Б – пример записи ГАМК-опосредованных разрядов (интериктальные разряды первого типа). В – пример записи иктального разряда. Серым прямоугольником отмечен участок, продемонстрированный более подробно на рис Г. Г – последовательность стереотипных паттернов активности, составляющих поздние стадии иктального разряда. Д – наблюдаемый в примерно 22% случаях применения данной модели режим активности, при котором иктальный разряд не останавливается, а составляющие его разряды, подобные приведенным на рис Г (интериктальные разряды второго типа), генерируются с постоянной частотой.

2) Цефипимовая модель (Модель 2)
В этой модели (рис. 2А) использовался проэпилептический раствор аналогичного состава без 4-АП, но с добавлением антагониста ГАМКа-рецепторов цефепима (4 мМ) – цефалоспоринового антибиотика, являющегося слабым конкурентным антагонистом ГАМКа-рецепторов [21–24]. Используемая концентрация цефепима приводит к 70–80%-ному блоку вызванного экстраклеточной стимуляцией тормозного постсинаптического тока (вТПСТ) [24].
Рис. 2.
Регистрация синаптической активности, провоцируемой частичной (А, Б) или полной (В) фармакологической блокадой ГАМКа-рецепторов в условиях перфузии среза проэпилептическим раствором с повышенной концентрацией ионов калия и сниженной концентрацией ионов магния. Регистрация в режиме фиксации напряжения при –27 мВ. В случае полной блокады наблюдается исчезновение всех положительных (относительно базовой линии) токов, опосредованных активацией ГАМКа-рецепторов. В случае частичной блокады ГАМКа-рецепторов положительные токи остаются. Для достижения частичной блокады используются цефепим (4 мМ, А) и бикукуллин (2 мкМ, Б) соответственно. Для достижения полной блокады ГАМКа-рецепторов используется бикукуллин в концентрации 10 мкМ (В).
3) Бикукуллиновая модель (Модель 3)
В этой модели (рис. 2Б) в проэпилептический раствор указанного состава добавляли другой конкурентный антагонист ГАМКа-рецепторов – бикукуллин (2 мкМ). Применение данной концентрации бикукуллина приводит к такому же по величине блоку вТПСТ, что и 4 мМ цефепима.
Реактивы
Если не указано иначе, все реактивы, использованные в работе, были произведены компанией Sigma-Aldrich, США.
Анализ данных и статистика
Анализ данных и оценка синаптических проводимостей производились в среде Wolfram Mathematica 10 (Wolfram Research, США). Статистический анализ был выполнен с использованием SigmaPlot 14 (Systat Software Inc, США). Нормальность распределения выборочных данных оценивалась по критерию Колмогорова–Смирнова. Поскольку полученные экспериментальные данные имели нормальное распределение, для анализа результатов применялись t-критерий Стьюдента или однофакторный дисперсионный анализ. Все значения приведены как среднее арифметическое ± стандартная ошибка среднего. Графические изображения были воспроизведены при помощи программы SigmaPlot 14.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Синаптическая активность в применяемых моделях острого судорожного состояния
Режимы эпилептоподобной активности в модели 1 подробно охарактеризованы и смоделированы математически в наших предыдущих работах [1, 18–20]. В подавляющем большинстве случаев первые залпы синхронизованной активности нейронов в этой модели регистрировались уже спустя несколько минут от начала перфузии среза проэпилептическим раствором с добавлением 4-АП. Для последующей оценки синаптических проводимостей использовались записи, в которых интериктальные разряды второго типа (ИИР2, рис. 1Г) генерировались с постоянной частотой (22% срезов, рис. 1Д).
В случае перфузии среза проэпилептическим раствором без добавления 4-АП эпилептоподобная активность в срезе развивалась значительно медленнее: первые иктальные разряды, аналогичные рис. 1А и В, возникали в течение получаса от начала перфузии среза, а режима, аналогичного рис. 1Г, не наблюдалось. Полная или частичная фармакологическая блокада ГАМКа-рецепторов приводила к исчезновению иктальных разрядов и установлению режима стабильной генерации интериктальных разрядов (рис. 2) [8, 25]. В модели 2 частичная блокада ГАМКа-рецепторов производилась с помощью цефепима – цефалоспоринового антибиотика четвертого поколения, известного свой способностью провоцировать эпилептические судороги у пациентов [26, 27]. Ранее нами была охарактеризована способность данного антибиотика блокировать ГАМКа-рецептор-опосредованную синаптическую передачу в энторинальной коре и было показано, что в данной концентрации этот антибиотик блокирует примерно 75% вызванного экстраклеточной стимуляцией тормозного тока (вТПСТ) [24]. В модели 3 частичная блокада ГАМКа-рецепторов осуществлялась с помощью их классического конкурентного антагониста – бикукуллина. Применение обоих блокаторов приводит к примерно аналогичному эффекту на эпилептиформную активность в энторинальной коре (рис. 2А, Б): в срезе с постоянной частотой начинают генерироваться интериктальные разряды, в которых присутствуют как ГАМК-, так и глутамат-опосредованные компоненты. В обоих случаях иктальные разряды исчезали.
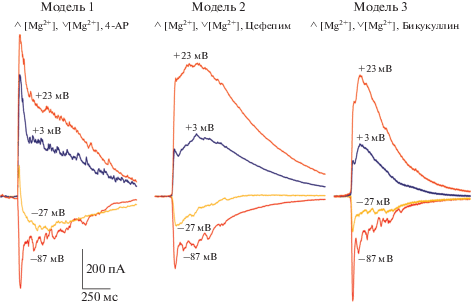
Для всех трех применяемых моделей на рис. 3 приведены примеры совокупностей усредненных синаптических токов, зарегистрированных при разных значениях мембранного потенциала.
Рис. 3.
Усредненные совокупности синаптических токов, регистрируемые в ходе интериктальных разрядов в трех моделях острого судорожного состояния in vitro. Каждый пробег из приведенных совокупностей является результатом усреднения записей от 10, 7 и 8 нейронов для моделей судорожного состояния 1, 2 и 3 соответственно. Для каждой клетки, вошедшей в анализ, производилось усреднение синаптических токов, накопленных за 30 с регистрации при заданном значении мембранного потенциала.
Общий принцип оценки синаптических проводимостей
Основным принципом предлагаемого анализа является разделение компонент постсинаптического ответа, используя различия ВАХ ионных каналов, задействованных в нем. Поэтому для оценки вклада рецепторов каждого типа необходимо знать их ВАХ. В условиях данного эксперимента постсинаптические токи нейрона энторинальной коры практически полностью опосредованы активацией трех типов ионотропных рецепторов: AMPA, NMDA и ГАМКа [1]. ВАХ этих рецепторов в соответствующих экспериментальных условиях были получены нами ранее [1, 8] и приведены на рис. 4. Если рассмотреть гипотетический пример ответа нейрона, в ходе которого активируются все три типа рецепторов (ВАХ каждой из компонент приведены на рис. 4А), то результирующую ВАХ такого ответа можно получить путем сложения ординат ВАХ каждой из компонент (рис. 4Б), так как рецепторы разных типов на мембране можно рассматривать как параллельно подключенные элементы цепи.
Рис. 4.
А – ВАХ трех основных типов постсинаптических ионотропных рецепторов, активирующихся в нейронах энторинальной коры в ходе интериктальных разрядов. Б – гипотетический пример ВАХ постсинаптического ответа, в ходе которого одновременно активируются все три указанных типа рецепторов, причем ВАХ каждого из компонент ответа соответствует ВАХ на А (ВАХ получена в результате сложения ординат трех зависимостей от мембранного потенциала, приведенных на А).

Поскольку ВАХ различных ионотропных рецепторов сильно отличаются друг от друга, то при разных значениях мембранного потенциала на нейроне вклад трех типов рецепторов также будет различаться. Вследствие магниевого блока NMDA-рецепторов и наружного выпрямления ВАХ ГАМКа-рецепторов при отрицательных значениях мембранного потенциала наиболее значим будет вклад AMPA-рецепторов. В области нулевых значений потенциала (в области потенциала реверсии токов через ионотропные глутаматные рецепторы) наиболее весом будет вклад ГАМКа-рецепторов, а при положительных значениях потенциала на мембране результирующий ток будет опосредован всеми тремя типами рецепторов. Описываемый в данной работе подход позволяет однозначно оценить вклад рецепторов разных типов при любом мембранном потенциале, эту величину можно назвать синаптической проводимостью. Таким образом, на основе этих данных можно оценить относительную активность возбуждающих и тормозных популяций нейронов в ходе любой изучаемой сетевой активности.
Неоднозначность понятия синаптической проводимости в случае нелинейных ВАХ
Активация постсинаптических ионных каналов приводит к увеличению проводимости мембраны. Регистрация синаптических ответов в режиме фиксации напряжения позволяет записывать ионный ток, идущий через эту дополнительную проводимость. В электротехнических терминах активацию постсинаптических рецепторов можно описать как включение дополнительного элемента в цепь параллельно сопротивлению мембраны. При этом ВАХ этого элемента может быть нелинейной, как в случае активации NMDA-рецепторов. В теории электрических цепей для описания нелинейных элементов применяются два понятия: статическая и дифференциальная проводимость [28]. Под статической проводимостью понимают отношение тока через нелинейный элемент к напряжению на нем, тогда как дифференциальной проводимостью называется величина производной силы тока по напряжению и представляющая собой наклон ВАХ элемента при заданном значении напряжении. Если первая величина всегда положительная, то вторая может быть как положительной, так и отрицательной. Подобная терминология применима и для описания свойств некоторых ионных каналов [15]. Рассмотрим для примера ВАХ NMDA-рецепторов (рис. 3А). Из-за магниевого блока NMDA-рецепторов их ВАХ имеет сильно нелинейную зависимость от мембранного потенциала [29]. На участке графика от –100 до примерно –30 мВ его наклон (динамическая проводимость ионных каналов) отрицательны. Статическая проводимость NMDA-рецепторов всегда положительна и описывается сигмоидальным уравнением. В области положительных значений ВАХ становится практически линейной; в этой области динамическая и статическая проводимость положительны и практически совпадают.
Таким образом, для сопоставления двух различных по своей амплитуде ответов постсинаптических NMDA-рецепторов необходимо договориться о том, что такое 1 нС их проводимости: при каком мембранном потенциале и каким образом эта проводимость будет измеряться. Аналогичная неоднозначность возникает и при количественном описании меры активации других ионных каналов с нелинейными ВАХ. Например, в случае если внутриклеточная концентрация хлорид-ионов меньше, чем их наружная концентрация, то ВАХ синаптических ответов ГАМКа-рецепторов хорошо описывается уравнением Гольдмана–Ходжкина–Катца [30, 31].
В целях разрешения возникающей неоднозначности при оценке синаптических проводимостей с помощью предлагаемого алгоритма были введены референсные ВАХ. Синаптическая проводимость соответствующего типа рецепторов считалась равной 1 нС, если их ВАХ совпадала с референсной. Совокупность референсных ВАХ, использованная для анализа синаптических проводимостей в ходе интериктальных разрядов, приведена на рис. 4.
ВАХ NMDA-рецепторов
Референсная ВАХ NMDA-рецепторов описывается следующим уравнением [29]:
(1)
${{f}_{{{\text{NMDA}}}}}\left( U \right) = \frac{1}{{1 + {\text{exp}}\left( {\frac{{{{V}_{{12}}} - U}}{k}} \right)}}\left( {U - {{V}_{{{\text{NMDA}}}}}} \right),$ВАХ ГАМКа-рецепторов
Поскольку в используемом внутриклеточном растворе концентрация хлорид-ионов гораздо меньше, чем во внеклеточном растворе, а основным анионом является метансульфонат, слабо проходящий через ГАМКа-рецепторы, потенциал реверсии ионного тока через эти рецепторы отрицателен. Референсная ВАХ ГАМКа-рецепторов задается уравнением Гольдмана–Ходжкина–Катца [32–34]:
(2)
${{f}_{{{\text{GABA}}}}}\left( U \right) = \frac{{{{F}^{2}}}}{{RT}}PS\,U\frac{{\left[ {{{C}_{{{\text{out}}}}}} \right]\left( {{\text{exp}}\left( {\frac{F}{{RT}}\left( {U - {{V}_{{{\text{GABA}}}}}} \right)} \right) - 1} \right)}}{{\exp \left( {\frac{{ - FU}}{{RT}}} \right) - 1}},$ВАХ AMPA-рецепторов
ВАХ AMPA-рецепторов в условиях эксперимента практически линейна. В связи с этим их референсная ВАХ имеет единичный наклон при любом мембранном потенциале и задается уравнением
где ${{V}_{{{\text{AMPA}}}}}$ = 3.5 мВ (потенциал реверсии ионного тока через AMPA-рецепторы для условий эксперимента).Поскольку гипотетическая ВАХ на рис. 4Б получена как сумма ВАХ на рис. 4А, ее уравнение можно записать как
(4)
${{I}_{{{\text{total}}}}}\left( U \right) = 1 \times {{f}_{{{\text{GABA}}}}}\left( U \right) + 1 \times {{f}_{{{\text{NMDA}}}}}\left( U \right) + 1 \times {{f}_{{{\text{AMPA}}}}}\left( U \right),$Поэтому можно сказать, что в момент времени, когда ВАХ была зарегистрирована, синаптические проводимости AMPA-, NMDA- и ГАМКа-рецепторов были равны 1 нС, поскольку коэффициенты при соответствующих слагаемых равны единице. Несмотря на то, что данные значения статической или дифференциальной проводимостей достигаются только при определенных условиях регистрации (причем разных для NMDA- и ГАМКа-рецепторов), подобный формализм однозначно характеризует полученную ВАХ и позволяет определить ионный ток через соответствующий тип рецепторов при любом мембранном потенциале.
В ходе работы нейронной сети соотношение активных глутаматергических и ГАМКергических нейронов непрерывно меняется, что приводит к изменению вкладов трех типов ионотропных рецепторов в постсинаптический ответ регистрируемого нейрона. ВАХ мембраны нейрона, рассчитанные в разные моменты времени ответа, будут различаться, что отразится на коэффициентах при слагаемых в уравнении 4. Поэтому в общем виде ВАХ синаптического ответа нейрона описывается следующим уравнением:
(5)
$\begin{gathered} {{I}_{{{\text{total}}}}}\left( {U;{{g}_{{{\text{AMPA}}}}},{{g}_{{{\text{GABA}}}}},{{g}_{{{\text{NMDA}}}}}} \right) = \\ = {{g}_{{{\text{GABA}}}}}{{f}_{{{\text{GABA}}}}}\left( U \right) + {{g}_{{{\text{NMDA}}}}}{{f}_{{{\text{NMDA}}}}}\left( U \right) + {{g}_{{{\text{AMPA}}}}}{{f}_{{{\text{AMPA}}}}}\left( U \right), \\ \end{gathered} $Эксперимент методом патч-кламп позволяет зарегистрировать ВАХ мембраны в виде дискретного набора значений силы тока при заданных значениях мембранного потенциала. В ходе реализации предлагаемого алгоритма экспериментальные ВАХ аппроксимируются уравнением 5, представляющего собой сумму нелинейных слагаемых, что позволяет получить оценку сразу для трех компонент ответа, а не только для двух – возбуждающей и тормозной, как это производилось раньше. В связи с увеличившемся числом определяемых в ходе аппроксимации параметров требования к качеству собираемых экспериментальных данных и их предварительной обработке также существенно возросли. Далее, на примере интериктальных разрядов в моделях эпилептической активности, будут описаны необходимые процедуры для успешной реализации алгоритма.
Сбор экспериментальных данных
Во всех трех моделях эпилептической активности в срезе производилось накопление записей интериктальных разрядов при 15-ти уровнях фиксируемого потенциала (от –97 до +43 мВ с шагом 10 мВ). На каждом уровне регистрация осуществлялась в течение 30 с, что позволило накопить 5–10 разрядов. Пример записей приведен на рис. 5А. Накопленные на каждом уровне потенциала разряды усреднялись (рис. 5Б), после чего из полученной усредненной совокупности формировался набор ВАХ, как проиллюстрировано на рис. 5Б, В. ВАХ формировались через 1 мс, для чего производилось снижение частоты дискретизации записей ионного тока методом скользящего среднего. Полученная совокупность ВАХ использовалась для последующей процедуры компенсации последовательного сопротивления и оценки синаптических проводимостей.
Рис. 5.
Этапы реализации метода оценки синаптических проводимостей в ходе интериктальных разрядов. А – примеры записей интериктальных разрядов, сделанные при четырех разных значениях фиксируемого потенциала в течение 25 с. В данном примере использовалась модель эпилептической активности № 2. Б – усредненные разряды из записи на А. Вертикальные пунктирные линии обозначают моменты времени, в которые считывались ВАХ синаптического ответа, приведенные на В. В – ВАХ синаптических ответов, построенных по записям из А и Б. Сила тока считывалась с записей при 15-и уровнях фиксируемого потенциала в моменты времени, отмеченные пунктирной линией на Б. Г – эквивалентная схема нейрона, образовавшего плотный контакт с микропипеткой в ходе регистрации методом патч-кламп в конфигурации “целая клетка”. На схеме обозначены (снизу-вверх): нелинейный элемент, проводимость Gm которого зависит от величины потенциала на мембране Vm; источник напряжения, создающий собственный мембранный потенциал Vm; последовательное сопротивление Rseries, возникающее в месте контакта клетки и микропипетки. Д – гипотетический пример, иллюстрирующий алгоритм компенсации последовательного сопротивления в цепи мембрана-пипетка. Е – оценки проводимостей AMPA-, NMDA- и ГАМКа-рецепторов, активирующихся в ходе интериктальных разрядов. Оценки сделаны по примерам на рис. А–В.

Компенсация последовательного сопротивления в цепи мембрана–микропипетка
Особенностью метода патч-кламп является то, что один и тот же микроэлектрод используется и для измерения мембранного потенциала, и для подачи тока в целях его фиксации [35]. Поэтому при регистрации необходимо учитывать наличие в цепи сопротивления, подключенного последовательно к мембране регистрируемого нейрона (Rseries, рис. 5Г). Оно обусловлено малым диаметром отверстия, которым соединены внутренние объемы микропипетки и клетки. Поданный в клетку ток создает падение напряжения на последовательном сопротивлении, в результате чего фиксируемый на мембране потенциал отличается от командного потенциала, задаваемого экспериментатором. Цепь компенсации, которая имеется у большинства современных патч-кламп усилителей, позволяет частично нивелировать это расхождение за счет изменения величины поданного тока. Это позволяет добиться лучшего соответствия мембранного и командного потенциалов. В то же время в результате применения данного подхода увеличивается шум, и могут возникать осцилляции тока. Альтернативным подходом является его компенсация после записи, предложенная нами ранее [8]. Для этого необходимо произвести преобразование ВАХ, зарегистрированной в ходе эксперимента, используя метод расчета ВАХ цепи [28], содержащий последовательно соединенные линейный и нелинейный элемент. Поскольку в общем случае ВАХ мембраны не линейна, на рис. 5Г ей соответствует нелинейный элемент. В ходе этого преобразования величина командного потенциала корректировалась на величину падения напряжения, создаваемого регистрируемым током на последовательном сопротивлении. Величина коррекции рассчитывается по формуле
На рис. 5Д приведен пример осуществления данного преобразования: для получения преобразованной ВАХ абсцисса каждой ВАХ, полученной в ходе эксперимента, смещалась на величину, вычисленную по уравнению 6.
Примеры оценки синаптических проводимостей в трех моделях эпилептиформной активности in vitro
Оценка синаптических проводимостей осуществлялась путем аппроксимации каждой ВАХ с помощью уравнения 5, в ходе которой коэффициенты ${{g}_{{{\text{AMPA}}}}},$ ${{g}_{{{\text{GABA}}}}},$ ${{g}_{{{\text{NMDA}}}}}$ соответствующие проводимостям AMPA-, ГАМКа- и NMDA-рецепторов, подбирались методом наименьших квадратов. Коэффициенты могли варьировать только в положительном диапазоне. В результате были оценены AMPA, NMDA и ГАМКа синаптические проводимости в ходе интериктальных разрядов в трех моделях острого судорожного состояния in vitro. Полученные зависимости от времени приведены на рис. 6. Проводимости через глутаматергические рецепторы в трех моделях эпилептической активности не различались (пиковые величины AMPA-опосредованной проводимости составляли 4.1 ± 1.6 нС (n = 7), 4.1 ± 0.8 нС (n = 6) и 6.1 ± 1.0 нС (n = 8) соответственно в 1–3-ей моделях; однофакторный дисперсионный анализ, p = 0.39; максимальные величины NMDA-опосредованной проводимости составляли 10.5 ± 2.0 нС (n = 7), 11.3 ± 2.1 нС (n = 6) и 8.6 ± 1.2 нС (n = 8) соответственно; однофакторный дисперсионный анализ, p = 0.54).
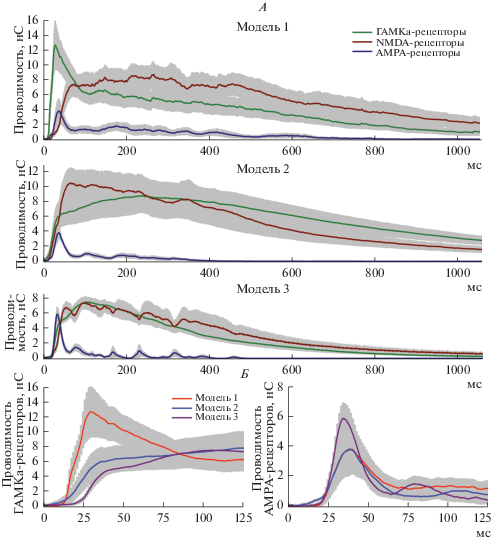
Рис. 6.
Оценки трех типов синаптических проводимостей в ходе интериктальных разрядов в трех моделях эпилептической активности. A – крупный масштаб. Б – первые 125 мс от начала разряда. Левая панель: проводимости ГАМКа-рецепторов в трех моделях. Правая панель: проводимости AMPA-рецепторов от начала разряда.
Ключевым отличием 2-й и 3-й моделей от первой является использование антагонистов ГАМКа-рецепторов. Продемонстрировано, что временное течение ГАМК-опосредованных синаптических проводимостей в ходе интериктальных разрядов имеет различия в трех моделях эпилептических судорог.
В 1-й модели, в которой ГАМКа-рецепторы не блокировались, именно проводимость этих рецепторов доминировала в начале разряда (на 24-й мс от начала разряда проводимости ГАМКа-, NMDA- и AMPA-рецепторов составляли 8.9 ± 1.9 нС, 0.6 ± 0.3 нС, 0.7 ± 0.5 нС (n = 7); различия достоверны по однофакторному дисперсионному анализу с повторными измерениями, p < 0.001; множественные сравнения по критерию Даннета с проводимостью ГАМКа-рецепторов: p < 0.001 для NMDA-рецепторов, p < 0.001 для AMPA-рецепторов). Проводимости рецепторов глутамата активировались с небольшой задержкой после активации тормозной проводимости. Экспериментальные и модельные исследования, проведенные ранее, свидетельствуют о значительной роли ГАМК-ергических интернейронов в инициации эпилептиформной активности [6, 18, 19, 36–38], что дополнительно подтверждается полученными оценками.
Во 2-й и 3-й моделях, в которой ГАМКа-рецепторы частично ингибировались цефепимом или бикукуллином, проводимость этих рецепторов была снижена в начале ответа (рис. 6Б): на 24-й мс от начала разряда амплитуда ГАМК-опосредованной компоненты была 8.9 ± 1.9 нС (n = 7), 3.3 ± 1.5 нС (n = 6), 0.9 ± 0.2 нС (n = 8) в моделях 1, 2 и 3, соответственно (различия статистически достоверны согласно однофакторному дисперсионному анализу, p < 0.01; множественные сравнения по критерию Даннета с проводимостью в модели 1: p < 0.05 и p < 0.001 для моделей 2 и 3 соответственно). Также в моделях с частичной блокадой ГАМКа-рецепторов исчезла видимая задержка между активацией тормозной и возбуждающих проводимостей, наблюдаемая в модели 1. Таким образом, можно заключить, что в моделях эпилептической активности с частичной блокадой ГАМКа-рецепторов всплеск активности интернейронов больше не является триггером, запускающим интериктальный разряд. Возбуждение популяций глутаматергических и ГАМКергических интернейронов происходит одновременно.
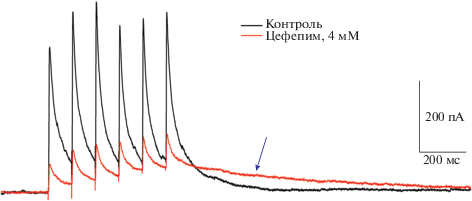
Ранее нами была продемонстрирована способность цефепима приводить к замедлению кинетики вызванного экстраклеточной стимуляцией постсинаптического ГАМКа-рецептор-опосредованного тока [24]. Наиболее наглядно этот эффект виден во время ответа на множественную стимуляцию (рис. 7). На приведенном примере через 800 мс от начала стимуляции амплитуда ответа в присутствии цефепима больше, чем без него. Чтобы выяснить, проявляется ли данный эффект в ходе интериктальных разрядов, была проанализирована величина ГАМК-опосредованной проводимости через 800 мс от его начала. Оказалось, что несмотря на то, что цефепим – антагонист ГАМКа-рецепторов, проводимость этих рецепторов доминирует на поздних этапах разряда в модели 2 и по своей величине превосходит их проводимость в отсутствие блокатора (рис. 6А, амплитуда ГАМК-опосредованной компоненты на 800-ой мс от начала ответа составляла 1.8 ± 0.5 нС (n = 7) и 4.5 ± 1.0 нС (n = 6), в моделях 1 и 2 соответственно, различия достоверны по критерию Стьюдента, p < 0.05). Бикукуллин, применяемый в модели 3, не вызывал подобного эффекта, а наоборот, снижал ГАМК-проводимость на всем протяжении разряда (амплитуда ГАМК-компонента в модели 3 на 800 мс от начала разряда составляла 0.7 ± 0.1 нС (n = 8), что достоверно меньше, чем аналогичное значение в модели 1, p < 0.05, критерий Стьюдента). Таким образом, аналогично тому, как это происходит в ходе вызванного экстраклеточной стимуляцией ответа, цефепим приводит к увеличению амплитуды поздних фаз ГАМК-опосредованного тока в ходе интериктального разряда. На данный момент молекулярные механизмы этого эффекта не ясны и требуют дальнейшего изучения.
Рис. 7.
Пример эффекта цефепима (4 мМ) на ГАМК-опосредованный ионный ток, вызванный пачечной экстраклеточной стимуляцией. Регистрация в ИСЖ в условиях блокады AMPA- и NMDA-рецепторов (10 мкМ DNQX, 20 мкМ MK801). Цефепим замедляет кинетику ответа [24], это приводит к тому, что на поздних стадиях ответа, ионный ток в присутствии цефепима превышает таковой в контроле (отмечено синей стрелкой).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В отличие от предыдущих исследований, в которых оценивались только возбуждающая и тормозная синаптические проводимости [10], предлагаемый метод оценки синаптических проводимостей в ходе интериктальных разрядов позволяет дифференциально оценить вклад трех типов постсинаптических рецепторов. Результатом оценки являются абсолютные единицы проводимости, что дает возможность непосредственно сравнить величину интересующего компонента ответа в разных моделях эпилептической активности. Точность метода позволяет судить о динамике активации популяций ГАМКергических и глутаматергических нейронов и выявлять особенности действия фармакологических модуляторов ионотропных рецепторов.
Ограничения, преимущества и недостатки метода
Поскольку для реализации метода необходимы множественные повторные измерения, применение метода ограничено анализом стереотипных регулярно повторяющихся ответов, таких как интериктальные эпилептоподобные разряды [1] или ответы, вызванные экстраклеточной стимуляцией [8]. Для анализа менее регулярной активности требуется разработка новых методов оценки синаптических проводимостей, позволяющих оценить несколько компонент ответа за однократное измерение [39], основывающиеся на применении динамического патч-клампа.
Применение метода основывается на ряде предположений, которые справедливы лишь в первом приближении, и нарушение которых может быть потенциальным источником ошибок. Во-первых, метод предполагает линейную суммацию проводимостей различных рецепторов, что может быть не верно в случае взаимовлияния одних постсинаптических рецепторов на другие [40].
Также следует иметь в виду, что для оценки синаптических проводимостей используются заранее зарегистрированные ВАХ постсинаптических рецепторов, участвующих в ответе. Предполагается, что эти ВАХ одинаковы для всех нейронов, включенных в анализ, и не изменяют свою форму по ходу ответа. Последнее предположение может выполняться не всегда, поскольку высокоамплитудные ионные токи, идущие через мембрану, способны изменять концентрацию соответствующих ионов внутри клетки даже во время регистрации методом патч-кламп в конфигурации “целая клетка”. Как теоретические, так и экспериментальные работы показывают, что эффективность обмена ионами между пипеточным раствором и цитоплазмой клетки может быть недостаточной [41–46], при больших токах это может приводить к кратковременным отклонениям концентраций ионов от равновесных. Наиболее характерно подобное поведение для хлорид-ионов, что может приводить к смещению ВАХ ГАМКа-рецепторов в сторону больших значений мембранного потенциала в случае положительных токов и в сторону меньших значений в случае отрицательных токов [45]. Отсутствие возможности корректного учета этого фактора при реализации предлагаемого метода потенциально может приводить к переоценке ГАМКа-рецептор-опосредованной проводимости.
Другим фактором, способным привести к искажению получаемых оценок, является последовательное сопротивление в цепи “мембрана–микропипетка”. Чем большая проводимость мембраны активируется в ходе синаптического ответа, тем более существенным будет падение напряжения на этом паразитном сопротивлении и тем сильнее будет расхождение реального мембранного потенциала от задаваемого экспериментатором. Поскольку в общем случае ВАХ мембраны является нелинейной, это расхождение будет разным при разных значениях командного потенциала и в зависимости от соотношения типов рецепторов на мембране. Предлагаемый алгоритм компенсации последовательного сопротивления частично позволяет нейтрализовать этот фактор. Но в то же время, он исходит из предположения, что сопротивление мембраны в покое гораздо выше, чем ее сопротивление в ходе интериктального разряда. В значительной мере этому способствует использование пипеточного раствора, содержащего ионы цезия вместо ионов калия [47]. В случае недостаточно высокого сопротивления мембраны в покое, вычитание базовой линии при каждом уровне фиксируемого потенциала с последующим применением алгоритма коррекции ВАХ синаптического ответа будет приводить к недостаточно эффективной компенсации последовательного сопротивления.
Эффект частичной блокады ГАМКа-рецепторов на интериктальные разряды в моделях эпилептической активности in vitro
Анализ интериктальных разрядов в трех моделях эпилептической активности показывает, что частичная блокада ГАМКа-рецепторов сказывается на динамике синаптических проводимостей. В обеих моделях, где применялись блокаторы ГАМКа-рецепторов, не наблюдалось режима эпилептоподобной активности с иктальными разрядами. Учитывая данные о ключевой роли активации ГАМКа-рецепторов в создании кратковременных повышений внеклеточной концентрации ионов калия, приводящих к инициации иктального разряда в энторинальной коре [48, 49], это наблюдение указывает на то, что остаточной проводимости ГАМКа-рецепторов недостаточно для задействования этого механизма. В модели 1 без блокады ГАМКа-рецепторов их проводимость активировалась на несколько миллисекунд раньше, чем проводимость рецепторов глутамата. Но в результате применения антагонистов ГАМКа-рецепторов их проводимость активировалась одновременно с проводимостью глутаматных рецепторов, и на ранних этапах развития разряда была достоверно меньше, чем проводимость ГАМКа-рецепторов в модели 1, где блокаторы не применялись. Это указывает на утерю интернейронами инициирующей роли в генерации интериктальных разрядов.
Характерной особенностью цефепима, помимо непосредственной блокады вызванного экстраклеточной стимуляцией ГАМК-опосредованного синаптического тока, является способность к замедлению его кинетики спада [24]. Произведенные оценки синаптических проводимостей показали, что данная особенность в полной мере проявляется и в ходе интериктальных разрядов: на поздних стадиях разряда ГАМК-опосредованная проводимость была выше в присутствии цефепима, чем без него или чем в присутствии другого блокатора – бикукуллина. Известно, что в ходе эпилептической активности вследствие накопления внутриклеточных хлорид-ионов ГАМК может оказывать возбуждающее действие на нейроны. Кроме того, проведенное нами ранее моделирование эпилептоподобной активности в энторинальной коре показывает, что генерация рассматриваемого типа интериктальных разрядов происходит в условиях повышенной внутриклеточной концентрации ионов хлора [19]. В связи с большим числом сообщений о проэпилептическом действии цефепима [26, 27] данная особенность этого антибиотика может быть дополнительным проэпилептическим фактором в условиях ослабленного градиента ионов хлора и играть важную роль в развитии судорог вследствие приема этого вещества.
Список литературы
Amakhin D.V., Ergina J.L., Chizhov A.V., Zaitsev A.V. Synaptic Conductances during Interictal Discharges in Pyramidal Neurons of Rat Entorhinal Cortex. Front. Cell. Neurosci. 10: 233. 2016. https://doi.org/10.3389/fncel.2016.00233
Avoli M., D’Antuono M., Louvel J., Köhling R., Biagini G., Pumain R., D’Arcangelo G., Tancredi V. Network and pharmacological mechanisms leading to epileptiform synchronization in the limbic system in vitro. Prog. Neurobiol. 68: 167–201. 2002.
Gonzalez-Sulser A., Wang J., Queenan B.N., Avoli M., Vicini S., Dzakpasu R. Hippocampal neuron firing and local field potentials in the in vitro 4-aminopyridine epilepsy model. J. Neurophysiol. 108: 2568–2580. 2012.
Shiri Z., Lévesque M., Etter G., Manseau F., Williams S., Avoli M. Optogenetic Low-Frequency Stimulation of Specific Neuronal Populations Abates Ictogenesis. J. Neurosci. 37: 2999–3008. 2017.
Lopantsev V., Avoli M. Participation of GABAA-Mediated Inhibition in Ictallike Discharges in the Rat Entorhinal Cortex. J. Neurophysiol. 79: 352–360. 1998.
Shiri Z., Manseau F., Lévesque M., Williams S., Avoli M. Activation of specific neuronal networks leads to different seizure onset types. Ann. Neurol. 79: 354–365. 2016.
Trevelyan A.J., Schevon C.A. How inhibition influences seizure propagation. Neuropharmacology. 69: 45–54. 2013.
Amakhin D.V., Soboleva E.B., Ergina J.L., Malkin S.L., Chizhov A.V., Zaitsev A.V. Seizure-Induced Potentiation of AMPA Receptor-Mediated Synaptic Transmission in the Entorhinal Cortex. Front. Cell. Neurosci. 12: 486. 2018. https://doi.org/10.3389/fncel.2017.00264
Trevelyan A.J., Sussillo D., Yuste R. Feedforward Inhibition Contributes to the Control of Epileptiform Propagation Speed. J. Neurosci. 27: 3383–3387. 2007.
Ziburkus J., Cressman J.R., Schiff S.J. Seizures as imbalanced up states: excitatory and inhibitory conductances during seizure-like events. J. Neurophysiol. 109: 1296–1306. 2013.
Ziburkus J., Cressman J.R., Barreto E., Schiff S.J. Interneuron and pyramidal cell interplay during in vitro seizure-like events. J. Neurophysiol. 95: 3948–3954. 2006.
Borg-Graham L., Monier C., Frkgnac Y. Voltage-clamp measurement of visually-evoked conductances with whole-cell patch recordings in primary visual cortex. J. Physiol. 90: 185–188. 1996.
Monier C., Fournier J., Frégnac Y. In vitro and in vivo measures of evoked excitatory and inhibitory conductance dynamics in sensory cortices. J. Neurosci. Methods. 169: 323–365. 2008.
Lankarany M., Heiss J.E., Lampl I., Toyoizumi T. Simultaneous Bayesian Estimation of Excitatory and Inhibitory Synaptic Conductances by Exploiting Multiple Recorded Trials. Front. Comput. Neurosci. 10: 110. 2016. https://doi.org/10.3389/fncom.2016.00110
Chizhov A.V., Amakhin D.V. Method of experimental synaptic conductance estimation: Limitations of the basic approach and extension to voltage-dependent conductances. Neurocomputing. 275: 2414–2425. 2018.
Li S., Liu N., Yao L., Zhang X., Zhou D., Cai D. Determination of effective synaptic conductances using somatic voltage clamp. PLoS Comput. Biol. 15(3): e1006871. 2019. https://doi.org/10.1371/journal.pcbi.1006871
Neher E. Correction for Liquid Junction Potentials in Patch Clamp Experiments. Methods Enzymol. 207: 123–131. 1992.
Chizhov A.V., Amakhin D.V., Zaitsev A.V. Computational model of interictal discharges triggered by interneurons. PLoS One. 12(10): e0185752. 2017. https://doi.org/10.1371/journal.pone.0185752
Chizhov A.V., Amakhin D.V., Zaitsev A.V. Mathematical model of Na-K-Cl homeostasis in ictal and interictal discharges. PLoS One. 14(3): e0213904. 2019. https://doi.org/10.1371/journal.pone.0213904
Chizhov A.V., Amakhin D.V., Zaitsev A.V. Spatial propagation of interictal discharges along the cortex. Biochem. Biophys. Res. Commun. 508: 1245–1251. 2019.
Sugimoto M., Uchida I., Mashimo T., Yamazaki S., Hatano K., Ikeda F. et al. Evidence for the involvement of GABA(A) receptor blockade in convulsions induced by cephalosporins. Neuropharmacology. 45: 304–14. 2003.
Fujimoto M., Munakata M., Akaike N. Dual mechanisms of GABAA response inhibition by beta-lactam antibiotics in the pyramidal neurones of the rat cerebral cortex. Br. J. Pharmacol. 116: 3014–3020. 1995.
Sugimoto M., Fukami S., Kayakiri H., Yamazaki S., Matsuoka N., Uchida I., Mashimo T. The beta-lactam antibiotics, penicillin-G and cefoselis have different mechanisms and sites of action at GABA(A) receptors. Br. J. Pharmacol. 135: 427–432. 2002.
Amakhin D.V., Soboleva E.B., Zaitsev A.V. Cephalosporin antibiotics are weak blockers of GABAa receptor-mediated synaptic transmission in rat brain slices. Biochem. Biophys. Res. Commun. 499: 868–874. 2018.
Chizhov A.V., Amakhin D.V., Zaitsev A.V., Magazanik L.G. AMPAR-mediated Interictal Discharges in Neurons of Entorhinal Cortex: Experiment and Model. Dokl. Biol. Sci. 479: 1–4. 2018.
Payne L.E., Gagnon D.J., Riker R.R., Seder D.B., Glisic E.K., Morris J.G., Fraser G.L. Cefepime-induced neurotoxicity: a systematic review. Crit. Care. BioMed Central. 21: 276. 2017.
Appa A.A., Jain R., Rakita R.M., Hakimian S., Pottinger P.S. Characterizing Cefepime Neurotoxicity: A Systematic Review. Open forum Infect. Dis. Oxford University Press. 4. 2017.
Атабеков Г.И., Купалян С.Д., Тимофеев А.Б., Хухриков С.С. Теоретические основы электротехники. Нелинейные электрические цепи. Электромагнитное поле. СПб. Лань. 2010. [Atabekov G.I., Kupalyan S.D., Timofeev A.B., Huhrikov S.S. Teoreticheskiye osnovy elektrotehniki. Nelineyniye elekticheskiye tsepi. Elektromagnitnoye pole [Theoretical foundations of electrical engineering. Nonlinear electrical circuits. Electromagnetic field]. St. Petersburg. Lan’. 2010].
Jahr C.E., Stevens C.F. Voltage dependence of NMDA-activated macroscopic conductances predicted by single-channel kinetics. J. Neurosci. 10: 3178–3182. 1990.
Goldman D.E. Potential, Impedance, and Rectification in Membranes. J. Gen. Physiol. 27: 37–60. 1943.
Hodgkin A.L., Katz B. The effect of sodium ions on the electrical activity of giant axon of the squid. J. Physiol. 108: 37–77. 1949.
Barker J.L., Harrison N.L. Outward rectification of inhibitory postsynaptic currents in cultured rat hippocampal neurones. J. Physiol. 403: 41–55. 1988.
Jedlicka P., Deller T., Gutkin B.S., Backus K.H. Activity-dependent intracellular chloride accumulation and diffusion controls GABA(A) receptor-mediated synaptic transmission. Hippocampus. 21: 885–898. 2011.
Staley K.J., Proctor W.R. Modulation of mammalian dendritic GABAa receptor function by the kinetics of Cl- and HCO3-transport. J. Physiol. 519: 693–712. 1999.
Sakmann B., Neher E. Single-Channel Recording. Boston, MA. Springer. 1995.
de Curtis M., Librizzi L., Uva L., Gnatkovsky V. GABAa receptor-mediated networks during focal seizure onset and progression in vitro. Neurobiol. Dis. 125: 190–197. 2019.
Librizzi L., Losi G., Marcon I., Sessolo M., Scalmani P., Carmignoto G., de Curtis M. Interneuronal Network Activity at the Onset of Seizure-Like Events in Entorhinal Cortex Slices. J. Neurosci. 37: 10398–10407. 2017.
Shiri Z., Manseau F., Levesque M., Williams S., Avoli M. Interneuron Activity Leads to Initiation of Low-Voltage Fast-Onset Seizures. Ann. Neurol. 77: 541–546. 2015.
Chizhov A.V., Malinina E., Druzin M., Graham L.J., Johansson S. Firing clamp: a novel method for single-trial estimation of excitatory and inhibitory synaptic neuronal conductances. Front. Cell. Neurosci. 8: 86. 2014. https://doi.org/10.3389/fncel.2014.00086
Bai D., Muller R.U., Roder J.C. Non-ionotropic cross-talk between AMPA and NMDA receptors in rodent hippocampal neurones. J. Physiol. 543: 23–33. 2002.
Mathias R.T., Cohen I.S., Oliva C. Limitations of the whole cell patch clamp technique in the control of intracellular concentrations. Biophys. J. 58: 759–770. 1990.
Oliva C., Cohen I.S., Mathias R.T. Calculation of time constants for intracellular diffusion in whole cell patch clamp configuration. Biophys. J. 54: 791–799. 1988.
Push M., Neher E. Rates of diffusional exchange between small cells and a measuring patch pipette. Pflugers Arch. 411: 204–211. 1988.
Karlsson U., Druzin M., Johansson S. Cl(–) concentration changes and desensitization of GABA(A) and glycine receptors. J. Gen. Physiol. 138: 609–626. 2011.
Yelhekar T.D., Druzin M., Karlsson U., Blomqvist E., Johansson S. How to Properly Measure a Current-Voltage Relation? – Interpolation vs. Ramp Methods Applied to Studies of GABAA Receptors. Front. Cell. Neurosci. 10: 10. 2016. https://doi.org/10.3389/fncel.2016.00010
Семенов В.А., Амахин Д.В., Веселкин Н.П. Вклад нестационарности внутриклеточной концентрации ионов калия в кинетику потенциал-зависимых калиевых токов. Биологические мембраны. 36(3): 207–217. 2019. [Semenov V.A., Amakhin D.V., Veselkin N.P. The Contribution of Changes of Intracelluar Potassium Ion Concentration to the Kinetics of Voltage-Dependent Potassium Current. Biologicheskie membrany. 36(3): 207–217. 2019. (In Russ.)]
Clay J.R. Comparison of the effects of internal TEA+ and Cs+ on potassium current in squid giant axons. Biophys. J. 48: 885–892. 1985.
Avoli M., Barbarosie M., Lücke A., Nagao T., Lopantsev V., Köhling R. Synchronous GABA-mediated potentials and epileptiform discharges in the rat limbic system in vitro. J. Neurosci. 16: 3912–3924. 1996.
Avoli M., Louvel J., Kurcewicz I., Pumain R., Barbarosie M. Extracellular free potassium and calcium during synchronous activity induced by 4-aminopyridine in the juvenile rat hippocampus. J. Physiol. 493: 707–717. 1996.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


