Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 7, стр. 832-852
Оценка индивидуальной устойчивости человека к острой гипоксии по интегральным характеристикам структурной функции многоканальной ЭЭГ
В. П. Рожков 1, *, М. И. Трифонов 1, Э. А. Бурых 1, С. И. Сороко 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: vlrozhkov@mail.ru
Поступила в редакцию 05.04.2019
После доработки 16.05.2019
Принята к публикации 17.05.2019
Аннотация
Оценивали влияние острой гипоксии на электрическую активность головного мозга у 32 мужчин 19–45 лет. Состояние гипоксии моделировали, используя для дыхания газовые смеси с 8% содержанием кислорода в азоте. С помощью структурной функции многоканально́й ЭЭГ вычисляли интегральные параметры (ИП), характеризующие меру временной и пространственной (корреляционной) связности колебаний биопотенциалов. Описаны особенности изменений ИП и обобщенного спектра ЭЭГ у лиц с различной степенью устойчивости к гипоксии. У лиц с высокой устойчивостью к гипоксии в динамике временно́го ИП выделены ряд фаз компенсаторной реакции, отражающих изменения функционального состояния ЦНС при общей тенденции к снижению уровня физиологической лабильности. В случае низкой устойчивости к гипоксии уже после 3–7-ми мин дыхания обедненной кислородом смесью отмечался резкий сдвиг величин временно́го ИП, характеризующий увеличение временно́й связности и инерционности в ЭЭГ, снижение функциональной лабильности ЦНС. Показана возможность использования нормированных пространственного и временно́го интегральных параметров ЭЭГ для оценки критического уровня гипоксии.
Одной из наиболее трудных и не разработанных проблем в нейрофизиологии является поиск маркеров количественной оценки функциональных резервов мозга и признаков наступления дестабилизации регулирующих функций центральной нервной системы в экстремальных условиях внешней среды. В связи с развитием авиакосмической и подводной техники, спортивной и специфической деятельностью человека в горной местности (альпинизм, высокогорные пограничные заставы и егерские подразделения), при природных и техногенных катастрофах, у человека возникают гипоксические состояния. Эти состояния могут характеризоваться частичной или полной дезинтеграцией системной деятельности мозга с развитием психических расстройств, неадекватности поведенческих реакций, нарушением деятельности и возникновением критических состояний.
Опасность состояния острой гипоксии у пилотов во время полета, у специалистов при управлении сложной техникой при работе на высоте или погружении на большие глубины связана с тем, что развитие нарушений системной деятельности мозга вначале субъективно не ощущается. Первоначально может развиваться возбуждение, легкая эйфория, повышение работоспособности [1, 2]. Однако уже через несколько минут может наступить полная дезорганизация деятельности и потеря сознания. Показано, что при парциальном давлении кислорода, соответствующем высотам 1500–2000 м над уровнем моря, происходит нарушение сумеречного зрения, а начиная с уровня высот более 2500 м возникают расстройства психомоторной и когнитивной сферы (снижение показателей внимания, восприятия, оперативной и кратковременной памяти, эффективности зрительного поиска, принятия решения, времени сенсомоторной реакции) [1, 3]. При крайне низком содержании кислорода помимо сведений о динамике развития острой гипоксии особое значение имеют данные об интервале времени, на протяжении которого у человека сохраняется способность к осуществлению деятельности (“резервное время”, “время активного сознания”) [1].
Практический опыт и экспериментальные исследования показывают, что время возникновения и тяжесть проявления симптомов гипоксии сугубо индивидуальна даже при одинаковых условиях среды [4–6]. Указанные обстоятельства выдвигают на первый план необходимость изучения особенностей механизмов срочной компенсации и адаптации человека к гипоксии в зависимости от индивидуальных свойств механизмов саморегуляции функций [5–7], их пластичности и устойчивости, объема функциональных резервов [7, 8]. Важнейшее прикладное значение приобретают исследования, связанные с разработкой критериев непрерывного контроля и прогнозирования динамики функционального состояния индивидуума, позволяющих оперативно реагировать на возможность возникновения аварийных ситуаций по вине “человеческого фактора”.
Наличие и степень гипоксии обычно определяют по уровню парциального давления кислорода во вдыхаемом воздухе, характеру изменений биоэлектрической активности мозга, снижению насыщения артериальной крови кислородом, динамике частоты сердечных сокращений и ряда других физиологических параметров [4]. Считается, что из всего списка физиологических показателей именно ЭЭГ как маркер функционального состояния мозга может обеспечить выявление ранних признаков когнитивных расстройств, обусловленных нарастающей гипоксемией. По данным исследования ЭЭГ в динамике воздействия острой гипоксии различают от 4 [9] до 6 [1] стадий (степеней гипоксии). Эти стадии описаны на основе качественной (визуальной) оценки ЭЭГ. Количественная, параметрическая, оценка стадии (степени) гипоксии затруднена, поскольку формализованное описание паттерна многоканальной ЭЭГ, как правило, требует одновременного анализа сотен числовых показателей, многие из которых функционально или статистически взаимосвязаны, и имеют большую индивидуальную вариабельность. Более того, среди исследователей нет единого мнения в том, использование какого из методов анализа ЭЭГ предпочтительнее для этой цели – спектрального [10–12], периодограммного [5], кросскорреляционного [13, 14], когерентного [7] или нелинейного динамического [12].
Отсутствие общепринятого подхода к анализу подобного типа сигналов обусловлено, в частности, тем, что ЭЭГ сигнал нестационарен, и имеет место сильная функциональная связность, как между каналами, так и взаимная скоррелированность ряда соседних отсчетов амплитуд в рамках одного канала. Корректный анализ ЭЭГ в обычной практике требует выделения квазистационарных участков. В последнее время наблюдается изменение в понимании и трактовке функциональной связности (functional connectivity) физиологических процессов. Речь идет прежде всего о результатах функциональной магнитно-резонансной томографии, согласно которым следует различать статическую и динамическую функциональные связности различных областей головного мозга в состоянии покоя [15]. Это означает, что наряду со случайной происходят и неслучайные перестройки функциональной связности. С этой точки зрения целесообразно разложить общую вариативность ЭЭГ (случайную и неслучайную) на пространственную и временну́ю составляющую.
Естественно полагать, что функциональное состояние мозга является интегральной характеристикой, для оценки которого предпочтительно использовать интегральные параметры ЭЭГ, отражающие обобщенные характеристики биоэлектрической активности мозга по всей совокупности отведений. Мы полагаем, что эту проблему можно решить с помощью вычисления структурной функции (СФ) многоканальной ЭЭГ. Структурная функция служит основной характеристикой случайных процессов со стационарными приращениями [17] и может рассматриваться как более общий метод корреляционной обработки случайных процессов, включающих помимо стационарных эргодических также определенный класс нестационарных процессов [18]. Структурная функция, являясь основой для оценки интегральных показателей, характеризующих многоканальные процессы, позволяет количественно оценивать масштабы их временно́й и пространственной связности [19] и описывать общие, системные реакции мозга без подробного описания локальных изменений.
Оценки параметров СФ в отдельных отведениях использовали в исследованиях различных состояний мозга человека в норме и патологии [20, 21]. Примеры использования мультивариативных СФ, рассчитанных по 8-ми и 16-ти канальной ЭЭГ, были представлены в наших предыдущих работах [22, 23]. В работе [23] показаны эффекты влияния возмущений геомагнитной и солнечной активности в условиях высоких широт на параметры (интегральные временно́й и пространственный) и амплитудно-частотный спектр мультивариативных СФ. При этом интегральный временно́й параметр может характеризовать изменения физиологической лабильности ЦНС (по А.А. Ухтомскому [24]), а интегральный пространственный – обобщенный уровень пространственной синхронизации биопотенциалов мозга (по М.Н. Ливанову [25]). То есть, использование СФ ЭЭГ позволяет оценивать интегральную реакцию мозга как единой системы на воздействие физических факторов окружающей среды на человека.
В свою очередь, применение обобщенных (интегральных) показателей облегчает решение сложной проблемы межиндивидуальной вариабельности физиологических реакций и процессов когнитивной деятельности. Поиск методов оценки индивидуальных или индивидуально-типологических особенностей функционирования нейрофизиологических механизмов является одним из ведущих трендов современных исследований динамических перестроек электрической активности мозга при когнитивной деятельности, нервно-психических расстройствах [26, 27], а также при воздействии факторов внешней среды [2, 5]. Именно высокая межиндивидуальная вариабельность не только реакции ЦНС, но и оцениваемых параметров в исходном состоянии (покое) является существенным ограничителем использования данных ЭЭГ анализа при разработке, в частности, интерфейсов “мозг–компьютер” [28] и других практических приложений [29], а также препятствует применению стандартных математических методов оценки “усредненного” показателя или методов статистического сравнения при выявлении наличия или отсутствия межиндивидуального сходства [30].
Целью данной работы являлось изучение индивидуальной динамики и вариативности интегральных параметров многоканальной ЭЭГ, характеризующих пространственную и временну́ю связность колебаний биопотенциалов мозга у лиц с различной устойчивостью к состоянию острой гипоксии, и выявление ЭЭГ-маркеров развития сумеречного (предколлаптоидного) состояния.
МЕТОДИКА
Исследования выполнены на 32 здоровых мужчинах-добровольцах в возрасте от 19 до 45 лет. Лица, испытывавшие недомогание, психологический дискомфорт, имевшие накануне интенсивные физические нагрузки, употреблявшие алкоголь, психотропные или нейротропные препараты, к исследованию не допускались. Испытуемые располагались в удобном кресле с подлокотниками, с кислородной маской на лице на протяжении всего исследования. Они должны были находиться в состоянии спокойного бодрствования с закрытыми глазами, контролируя движения тела, конечностей, глаз и напряжение мышц лица. Исследования проводились с соблюдением требований Хельсинкской Декларации. Протокол исследований утвержден Комиссией по этике Ученого совета ИЭФБ РАН. Все испытуемые были информированы о целях и характере исследования, ознакомлены с протоколом исследования и дали добровольное письменное согласие.
Гипоксическое воздействие осуществлялось с помощью гипоксических газовых смесей (ГГС) с 8% содержанием кислорода в азоте. Время дыхания ГГС, о котором испытуемым сообщали заранее, составляло 15 мин для 8 человек, 25 мин для 9 человек и 40 мин для 15 человек.
Проводилось комплексное электрофизиологическое исследование с использованием компьютерной энцефалографии (электроэнцефалограф ЭЭГА-21/26 “Энцефалан-131-03”, фирмы “Медиком МТД”, Россия), компьютерной реоэнцефалографии (реоанализатор-монитор РиД-115, фирмы “Диамант”, Россия), непрерывной регистрацией кислородной сатурации гемоглобина и динамики частоты сердечных сокращений (пульсоксиметр “Nonin 8500”, США), регистрации артериального давления, мониторинга тканевого (транскутанного) напряжения кислорода и углекислого газа (транскутанный монитор TCM-3, фирмы “Radiometer”, Дания), газового анализа вдыхаемого и выдыхаемого воздуха (компьютерный on-line-газоанализатор КАД-БШ (разработка ИЭФБ РАН, Россия) с датчиком кислорода КЕ-25 фирмы “Figaro” (Япония), и датчиком объема воздушного потока РК 80150 серии AWM700 фирмы “Honeywell”, США). Вся указанная аппаратура объединена в единый аппаратно-программный сопряженный комплекс, что позволяло регистрировать все физиологические параметры одновременно и проводить совокупный анализ данных.
ЭЭГ регистрировали в 21 отведении по международной системе “10–20” в полосе 0.5–70 Гц с частотой дискретизации 250 Гц. Использовали монополярное отведение с объединенными ушными референтными электродами. Представленные в статье результаты относятся к 16-ти отведениям: Fp1, Fp2, F7, F3, F4, F8, T3, C3, C4, T4, T5, P3, P4, T6, O1, O2. Анализировали ЭЭГ в исходном состоянии (“фон”, 15 мин), при экспозиции гипоксии (“гипоксия”, 15 мин, 25 мин или 40–50 мин), в восстановительный период (“восстановление”, 15 мин). Участки записей, содержащие артефакты, исключали из обработки.
В основу математического анализа ЭЭГ был положен расчет структурной функции c оценкой ее параметров. Важной особенностью оценки структурной функции является ее независимость от оценки среднего значения ЭЭГ процесса, а также то, что на нее не влияют большие по протяженности флуктуации этого процесса. Все это свидетельствует в пользу того, что она может быть использована при анализе и нестационарных случайных процессов к каковым, несомненно, относится и ЭЭГ процесс. При этом, если исследуемый случайный процесс является стационарным, то его структурная функция ограничена и с течением времени выходит на установившееся значение. В случае нестационарного случайного процесса его структурная функция с течением времени неограниченно возрастает. На основании проведенных исследований нами было получено, что при выбранной нами 4 с эпохе анализа ЭЭГ, СФ1 для любой записи с течением времени либо выходила на установившийся уровень (асимптоту), либо осциллировала относительно этого уровня. При увеличении эпохи анализа до 1 мин подобное поведение СФ1 проявлялось еще ярче. Данный факт косвенно свидетельствует о том, что использованные нами ЭЭГ можно рассматривать с некоторым приближением как случайные процессы со стационарными приращениями.
Согласно предложенному нами ранее методу анализа ЭЭГ данных [19, 23], каждая запись ЭЭГ, представленная в виде векторного временно́го ряда X(t) последовательных значений амплитуд в 16-ти отведениях, предварительно центрировалась путем вычитания соответствующего среднего в каждом отведении и нормировалась на величину определителя выборочной ковариационной матрицы в степени 1/32. В результате получали новый векторный временно́й ряд Y(t), который является безразмерным и характеризуется одинаковой выборочной обобщенной дисперсией для всех испытуемых. Данный векторный временно́й ряд Y(t) анализировали на основе временно́й мультивариативной структурной функции 1-го порядка (СФ1), определяемой как среднее приращение амплитуды вектора Y(t) в 16-мерном (по числу отведений ЭЭГ) пространстве на интервалах, кратных интервалу дискретизации ЭЭГ (4 мс)
В данной работе в качестве параметров, характеризующих СФ1, будем использовать величину радиуса корреляции Rsf и значение ее горизонтальной асимптоты Asf. Из-за отсутствия универсального определения величины радиуса корреляции будем понимать под Rsf интервал времени, на котором абсцисса СФ1 впервые достигает уровня 0.7Asf, т.е. когда величина автокорреляционной связи между значениями интегрального ЭЭГ процесса, уменьшается приблизительно в 3.3 раза. Данное определение не является единственным, однако, в соответствие с [31] вполне допустимо. Отметим, что параметр Rsf служит для оценки масштаба интегральной временно́й корреляции многоканальной ЭЭГ, тогда как значение Asf характеризует уровень пространственной взаимосвязи ЭЭГ между всеми отведениями, поскольку его величина связана с определителем выборочной корреляционной матрицы ЭЭГ [19].
Кроме того, рассчитывали величины Ps = AN /Asf, где AN – значение горизонтальной асимптоты СФ1 для гипотетической случайной (“шумовой”) ЭЭГ, 0 ≤ Ps ≤ 1, а также величину Pt = СФ1(Δt)/Asf, 0 ≤ Pt ≤ 1. “Шумовая” ЭЭГ генерировалась в среде MATLAB с использованием функции randn и характеризовалась отсутствием корреляционных связей между значениями амплитуд как внутри каждого отведения, так и между различными отведениями. Оценка величины Asf производилась на основе многократного расчета СФ1 для гипотетической ЭЭГ, полученной из реальной ЭЭГ путем случайного перемешивания порядка следования в ней значений амплитуд одновременно по всем отведениям. Всякий раз такое перемешивание производилось в среде MATLAB с использованием функций randperm и приводило к разрушению корреляционных связей между значениями амплитуд внутри каждого отведения, но сохраняло неизменной выборочную корреляционную матрицу. Важно подчеркнуть, что временна́я упорядоченность относится здесь к минимальному временно́му масштабу Δt. Крайние значения (0 и 1) параметров Ps и Pt соответствуют полностью детерминированной и “случайной” пространственной и, соответственно, временно́й организации ЭЭГ в целом.
Оценки Rsf, Asf, Ps, Pt были получены как для одноминутных (20–50 с после удаления артефрактов), так и 4-секундных эпох анализа ЭЭГ. Расчет СФ1, определение параметров Rsf, Asf, Ps, Pt, а также спектральный анализ СФ1 проводился в среде MATLAB, причем для оценки спектральной плотности мощности (спектра) СФ1 использовалась стандартная функция fft, выполняющая прямое дискретное преобразование Фурье на интервале 8.192 с (2048 отсчетов) за пределами радиуса корреляции. Отметим, что спектр СФ1 характеризует спектр ЭЭГ, однако, не соотносится с ним напрямую. Как известно, спектр ЭЭГ представляет спектр ЭЭГ процесса в отдельном отведении, тогда как спектр СФ1 характеризует спектр ЭЭГ в интегральном (обобщенном) смысле. В случае стационарных случайных сигналов известны интегральные соотношения, связывающие спектр одномерного временно́го процесса со спектром соответствующей ему структурной функции 2-ого порядка [18].
Статистическая обработка данных производилась при помощи пакета программ Statistica-10 и включала построение распределений, расчет индивидуальных средних значений и дисперсии показателей, а также оценку влияния фактора “гипоксия” на ИП у каждого испытуемого в рамках дисперсионного анализа (ANOVA).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
По результатам исследования среди испытуемых были выделены лица с низкой устойчивостью к гипоксии – 9 человек, 7 из которых не выдержали запланированное время дыхания ГГС (у 4-х из них развилась коллаптоидная реакция), а у 2-х после 15 мин дыхания ГГС отмечено ухудшение самочувствия, заторможенность и слабость. Испытуемые, у которых в течение 15 мин дыхания ГГС предельное снижение уровня насыщенности артериальной крови кислородом составило не более 57–58% и ЧСС не превышала 110 уд./мин (по [2]), были отнесены к категории лиц с высокой устойчивостью к гипоксии (12 человек). Остальные 11 человек были отнесены к категории испытуемых со средней устойчивостью к гипоксии.
На рис. 1 показаны изменения амплитудно-частотного спектра СФ1 ЭЭГ, а также двух интегральных параметров многоканальной ЭЭГ у испытуемого с высокой устойчивостью к гипоксии. При дыхании гипоксической смесью сатурация О2 крови снижается сначала резко в течение 6–7 мин, затем более медленно, плавно достигая минимума к моменту окончания экспозиции гипоксии. В представленном на рисунке случае при длительной экспозиции гипоксии (53 мин) в динамике обоих – пространственного и временно́го параметров ЭЭГ – можно видеть не менее 4-х фаз. Величина интегрального временно́го параметра, в качестве которого здесь представлена оценка радиуса корреляции Rsf, в течение первых 3-х мин гипоксии колеблется в пределах, чуть превышающий колебания исходного фонового уровня. От 4-й до 9-й мин следует фаза резкого повышения величины Rsf, свидетельствующая о снижении уровня физиологической лабильности ЦНС. Далее величина Rsf постепенно снижается, стабилизируясь на 18–22 мин на уровне, близком к оптимальному (уровень фона). Следующая фаза, которая заканчивается примерно к 40–42 минутам экспозиции гипоксии, характеризуется высокоамплитудными колебаниями величины Rsf с длительностью 4–5 минут, причем, даже локальные минимумы Rsf уже располагаются на уровне выше фонового (физиологическая лабильность снижена). С 43-й минуты период и амплитуда колебаний Rsf уменьшается, что указывает на появление тенденции к стабилизации функционального состояния мозга, которое остается неустойчивым на фоне сниженной физиологической лабильности ЦНС. При отмене гипоксического воздействия наблюдается 1–2 минутное снижение Rsf до исходного уровня и даже ниже. В дальнейшем Rsf стабилизируется на уровне выше фонового, что характеризует сниженный уровень физиологической лабильности и функционального состояния мозга.
Рис. 1.
Динамика обобщенного амплитудно-частотного спектра (А), интегральной временно́й (Rsf) и пространственной (Аsf) характеристик (Б) многоканальной ЭЭГ при острой гипоксии у испытуемого с высокой гипоксической устойчивостью (В-ев).
По оси абсцисс – время, мин. По оси ординат – на (А): частота, Гц; на (Б) – параметры Rsf (1), Asf (2), Hb(O2) (3) в процентах по отношению к начальному уровню фона (100%). По левой оси ординат –параметры 1 и 2, по правой оси ординат – параметр 3. Гипоксическое воздействие отмечено жирной линией под осью абсцисс.
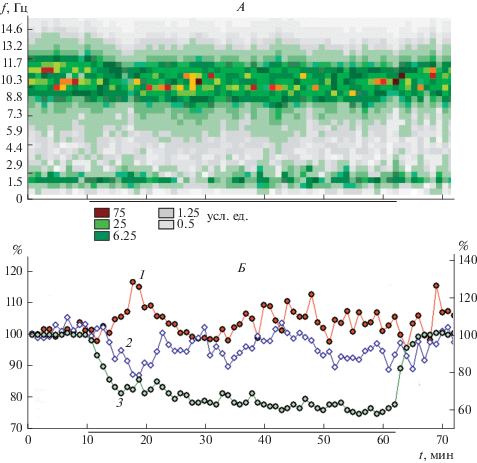
Спектрограмма СФ1 (рис. 1А) у данного испытуемого представлена относительно широким набором частот в альфа-2 и альфа-3 диапазонах. В первые минуты гипоксии амплитуда частот альфа-диапазона снижается. Также к более низким частотам сдвигаются границы всего альфа-диапазона (амплитуда “перетекает” от альфа-3 к альфа-2 диапазону). В целом такое “тотальное” снижение частоты колебаний альфа-диапазона частот видно на всем протяжении гипоксического воздействия. Определенное соответствие изменений спектральных характеристик СФ1 ЭЭГ и временно́го ИП прослеживается в совпадении повышения амплитуды волн дельта-диапазона частот с локальными максимумами Rsf. В описываемом случае изменения пространственного ИП (Аsf) также демонстрируют фазный характер с чередованием периодов снижения величины Аsf (уменьшение доли пространственно-синхронной составляющей ЭЭГ) и возвращения значения Аsf к исходному уровню.
Выраженность и продолжительность различных фаз реакции на продолжительное действие гипоксии, как и длительность фазы восстановления после отмены воздействия, были сугубо индивидуальными и различалось не только у лиц с различной устойчивостью к воздействию гипоксии, но и у лиц одной группы, в частности, отнесенным к испытуемым, устойчивым к гипоксии.
У испытуемого с более низкой (“средней”) резистентностью к гипоксии на первой минуте (рис. 2) видно снижение величины Rsf. На картограмме динамики спектра СФ1 этот период времени представлен “пустыми” клеточками, что отражает уменьшение амплитуды колебаний во всем диапазоне частот, при этом на нативной ЭЭГ наблюдается десинхронизация активности – реакция активации, сопровождающаяся повышением уровня физиологической лабильности (уменьшением Rsf).
Рис. 2.
Динамика обобщенного амплитудно-частотного спектра (А), интегрального временно́го (Rsf) и пространственного (Asf ) параметров (Б) многоканальной ЭЭГ при нарастании гипоксии у испытуемого со средней степенью устойчивости к гипоксии (В-ов).
Обозначения как на рис. 1.
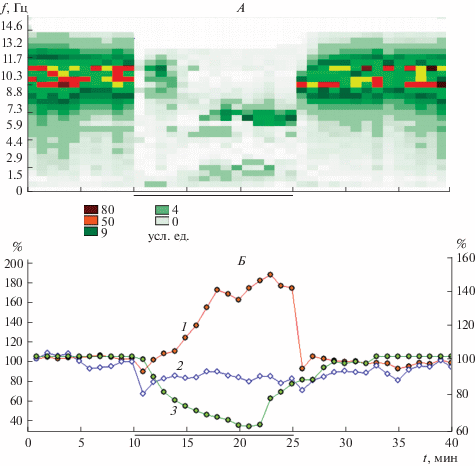
По мере углубления гипоксического состояния, величина Rsf неуклонно увеличивается с тенденцией к стабилизации на 3–4-й, 7–10-й и 13–15-ой минутах. На спектрограмме (рис. 2А) видно небольшое снижение амплитуды колебаний в широком диапазоне на 2–4-й минутах гипоксической нагрузки, переход к низкоамплитудной дизритмической активности на 4–6-й минутах воздействия. На 4–11-ой минутах наблюдается тенденция к формированию относительно регулярных колебаний в тета- и дельта-диапазонах частот ЭЭГ и с 12-й до 15-й минуты происходит стабилизация колебаний с акцентом на “верхнем” тета-диапазоне частот.
При переходе к дыханию атмосферным воздухом наблюдается относительное быстрое “восстановление” исходного спектра СФ1 и стабилизация величины Rsf на уровне близком к исходному после начального кратковременного снижения величины Rsf (повышение уровня физиологической лабильности на фоне реакции активации на ЭЭГ). Величина Аsf снижается на 1-й минуте гипоксии и 1-й минуте восстановительного периода, что характеризует уменьшение доли детерминированной составляющей пространственной организации ЭЭГ – уменьшение уровня пространственной синхронизации биопотенциалов (характерного, в частности, для реакции активации ЭЭГ). На протяжении гипоксического воздействия величина Аsf колеблется на уровне ниже исходного фона. В восстановительный период Аsf возрастает, но не достигает исходного уровня даже в течение 15 мин.
На рис. 3 представлены данные испытуемого с низкой устойчивостью к гипоксии. При гипоксии кислородная сатурация гемоглобина падает сначала резко, потом более медленно, при прекращении нагрузки быстро восстанавливается до исходного уровня. Величина Rsf на 1-й минуте гипоксии снижается, что, как и в примере, приведенном на рис. 2, можно трактовать как повышение уровня физиологической лабильности на фоне реакции активации. В течение 3-х последующих минут гипоксии величина Rsf держится на уровне, близком к исходному. Далее следуют увеличивающиеся в размахе колебания величины Rsf с локальными минимумами близкими к исходному уровню. Наконец, с 10–11-й минуты гипоксии идет быстрое возрастание величины Rsf (трактуемое как резкое снижение уровня физиологической лабильности и, соответственно, функционального состояния испытуемого), которое сменяется еще более быстрым снижением величины Rsf после прекращения нагрузки. В последействии гипоксии величина Rsf находится на несколько более низком, чем в исходном состоянии, уровне.
Рис. 3.
Динамика обобщенного амплитудно-частотного спектра (А), интегрального временно́го (Rsf ) и пространственного (Asf ) параметров (Б) многоканальной ЭЭГ при нарастании гипоксии у испытуемого с низкой устойчивостью к гипоксии (С-ев).
Обозначения как на рис. 1.
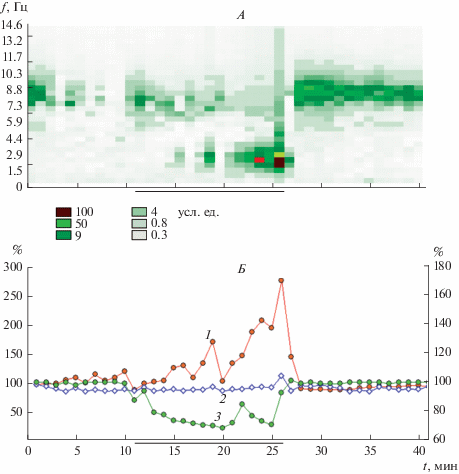
В картине амплитудно-частотного спектра СФ1 моментам резкого увеличения параметра Rsf соответствует также резкий рост медленноволновой активности, обеспечивающий ее доминирование в спектре ЭЭГ. Отмечается постепенное замедление (уменьшение частоты колебаний в альфа-диапазоне частот) в первые минуты экспозиции гипоксии и сохранение определенной доли активности высокочастотного диапазона в спектре при доминировании низкочастотного диапазона волн в ЭЭГ (что, возможно, отражает известную степень сохранности контроля за внешней средой).
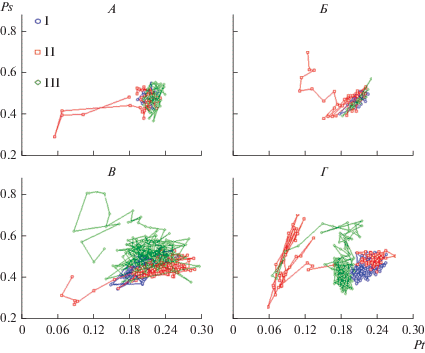
На рис. 4 представлены индивидуальные совместные распределения нормированных (в интервале [0, 1]) оценок Pt и Ps, полученных для последовательных 4-секундных эпох анализа ЭЭГ, которые также характеризуют масштабы интегральной временно́й и пространственной корреляции многоканальной ЭЭГ.
Рис. 4.
Динамика сочетанных изменений пространственного (Ps) и временно́го (Pt) интегрального параметра ЭЭГ у испытуемых с высокой (А, Б), средней (В) и низкой (Г) степенью устойчивости к гипоксии до (I), во время (II) и после (III) гипоксической нагрузки. По оси абсцисс – значение параметра Pt в отн. ед., по оси ординат – значение параметра Ps в отн. ед. Одинаковые значки на разных графиках соответствуют одному из трех состояний.
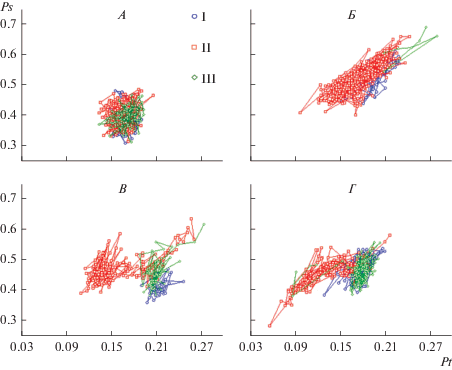
Двое испытуемых с высокой устойчивостью к гипоксии различаются характером статистической взаимосвязи между параметрами Pt и Ps. В случае (А) связь между изменениями величин параметров отсутствует. В случае (Б) обнаруживается тенденция к увеличению параметра Ps с ростом Pt и, соответственно, уменьшению параметра Ps со снижением Pt. Общим для обоих испытуемых является то, что в исходном состоянии, при гипоксии и в последействии облака точек, каждая из которых соответствует отдельной четырехсекундной эпохе анализа, практически полностью перекрываются. То есть, обоим испытуемым удается поддерживать близкий к исходному, оптимальному в бодрствовании, уровень функционального состояния (как по параметру, характеризующему меру временно́й связности колебаний потенциалов – физиологической лабильности, так и по параметру, отражающему уровень пространственной связности – пространственной синхронизации ЭЭГ).
У испытуемого со средней степенью устойчивости к гипоксии (В) при дыхании обедненной кислородом газовой смесью отмечается смещение на графике облака точек-символов влево – уменьшение величины Pt. Компактное облако соответствующих символов при гипоксии свидетельствует о формировании устойчивого функционального состояния, характеризующегося сниженным уровнем физиологической лабильности, – состояния, в котором испытуемый выдержал гипоксическую нагрузку.
Пример динамики интегральных ЭЭГ параметров у лица с условно низкой устойчивостью к гипоксии (тем не менее выдержавшим 15-минутную нагрузку) представлен на рис. 4Г. Облако символов, соответствующих эпохам анализа ЭЭГ при гипоксии, растянуто по горизонтали. В составе этого облака можно видеть 2 кластера, один из которых лежит в области низких значений интегрального временно́го параметра (ниже 0.12–0.13). Отмечен даже единичный “выброс” величины параметра до крайне низкого значения 0.056. Стоит отметить, что в отличие от испытуемых с низкой устойчивостью к гипоксии и не выдержавших нагрузку, уменьшение величины Pt у данного испытуемого носит сравнительно постепенный, а не резкий характер. Наблюдается формирование по меньшей мере двух относительно устойчивый состояний (компактных групп точек). То есть, ЦНС путем саморегуляции функционального состояния удается приспосабливаться к условиям гипоксии ценой снижения уровня физиологической лабильности. В данном случае мы наблюдаем формирование не одного, а возможно, двух устойчивых состояний, переход между которым может быть скачкообразным (что может косвенно свидетельствовать о различиях структурно-функционального обеспечения данных состояний).
На рис. 5 представлен пример одновременных изменений показателей дыхания, системного и мозгового кровообращения и биоэлектрической активности мозга при развитии обморочной реакции у испытуемого с низкой устойчивостью к гипоксии.
Рис. 5.
Динамика показателей дыхания (А), системного и мозгового кровообращения (Б) и биоэлектрической активности мозга (В) при развитии обморочной реакции у испытуемого с низкой устойчивостью к гипоксии.
V O2 – потребление кислорода; EB (Exhaled Breath) О2 – % О2 на выдохе; VE – минутный объем дыхания; Sa О2 – кислородная сатурация гемоглобина; REG – реографический индекс, отведения РЭГ: FM – фронто-мастоидальное, ОМ – окципито-мастоидальные, s – левая сторона, d – правая сторона; HR – частота сердечных сокращений; Pt – временно́й ИП; Ps – пространственный ИП.
Для всех показателей по оси ординат – величина показателя в процентах по отношению к уровню фона (100%). Правая ось ординат на (Б) для параметра HR.
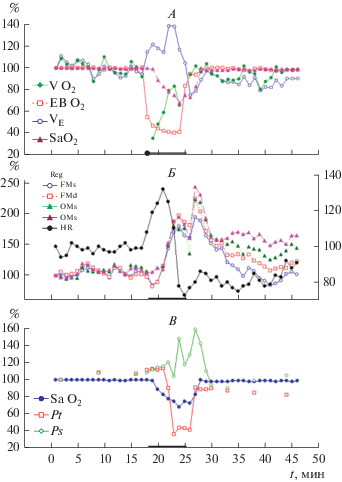
В первые 1.5–2 мин гипоксии кислородная сатурация гемоглобина (далее сатурация) держится на уровне фона за счет возрастания минутного объема дыхания (МОД) и резкого снижения потребления кислорода (ПК). Далее видно плавное падение сатурации, которое не может компенсироваться увеличением МОД, усугубляясь ростом потребления кислорода. По достижению определенного уровня МОД падает, что может вызывать падение ПК, сатурация при этом достигает наименьших значений. Снижение обеспечения тканей кислородом организм пытается компенсировать за счет увеличения притока крови, о чем свидетельствует рост ЧСС. Однако на 4–5-й минуте происходит срыв развития данной компенсаторной реакции (резкое падение ЧСС). На фоне сниженного МОД, усугубляющейся брадикардии, сниженного уровня ПК возникает обморочная реакция.
До 4–5-й минуты гипоксии показатели пульсового кровенаполнения мозга (реографический индекс, РЭГ) держатся на уровне исходного состояния, несмотря на резкий рост ЧСС, что объясняется механизмами ауторегуляции мозгового кровотока. При этом минимально изменяются (возрастают) величины как временно́го, так и пространственного ИП ЭЭГ.
При развитии нарушений системного кровообращения потребности мозга в кислороде отчасти обеспечиваются за счет роста пульсового кровенаполнения мозга, что отражает увеличение мозгового кровотока. Одновременно (а по интегральному временно́му параметру ЭЭГ с определенным опережением) происходят существенные перестройки в ЭЭГ, которые характеризуются резким снижением величины Pt, (ростом “инерционности” системы, снижением уровня физиологической лабильности) и подъемом величины интегрального пространственного параметра Ps (повышением уровня пространственной синхронизации ЭЭГ). В момент вынужденного прекращения испытания пульсовое кровенаполнение относительно снизилось с последующим достижением абсолютного максимума на 2–3 минутах восстановительного периода. Последнее может свидетельствовать о формировании кислородного “долга”. Примечательно, что в изменениях интегрального пространственного параметра ЭЭГ обнаруживаются 2 пика, которые совпадают по времени с локальными максимумами пульсового кровенаполнения. Характерен также в последействии гипоксии длительный период снижения величины интегрального временно́го параметра ЭЭГ (сниженного уровня функциональной лабильности) на фоне повышенного уровня пульсового кровенаполнения мозга. Такой же длительный период последействия обнаруживается в динамике ЧСС (брадикардия), в снижении МОД и уровня потребления кислорода. Обращает внимание, что в период последействия гипоксии пульсовое кровенаполнение в вертебробазилярном бассейне оказывается повышенным в большей мере, чем в каротидном бассейне.
У испытуемых, данные которых представлены на рис. 6, на 5–9-й минутах дыхания гипоксической газовой смесью (8% О2) произошла коллаптоидная (обморочная) реакция. Исходное состояние до нагрузки характеризуется компактным облаком точек. Во время экспозиции гипоксии точки определенное время также располагаются компактно. Непосредственно перед обморочной реакцией (А, Б, В) наблюдается резкое уменьшение величины интегрального временно́го параметра (сдвиг 5–6-ти точек, соответствующих последовательным эпохам анализа, влево), характеризующий увеличение временно́й связности в ЭЭГ, увеличение инерционности системы, снижение функциональной лабильности ЦНС. Границей, переход которой в сторону уменьшения интегрального временно́го параметра влечет развитие обморочной реакции, во всех 4-х представленных случаях, является Pt = 0.12–0.13. В трех случаях переход этой границы означает, что через 20–24 с вероятно развитие обморочного состояния. То есть, параметр Pt может выступать в роли не только маркера, но и предиктора развития этого состояния, что обеспечивает определенный запас времени для принятия превентивных мер. В случае (Г) испытуемый относительно долго пребывал в предобморочном состоянии, однако так и не смог перейти на адекватный уровень функциональной регуляции.
Рис. 6.
Сочетанные изменения пространственного (Ps) и временно́го (Pt) интегрального параметра ЭЭГ у 4-х лиц (А–Г) с низкой устойчивостью к гипоксии до (I), во время (II) и после (III) гипоксической нагрузки.
По оси абсцисс – значение параметра Pt в отн. ед., по оси ординат – значение параметра Ps в отн. ед. Одинаковые значки на разных графиках соответствуют одному из трех состояний.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты исследований показали, что изменения ЭЭГ при углублении гипоксии коррелируют с нарастанием нарушений системной деятельности мозга, ведущим к расстройствам когнитивных функций и дестабилизации регулирующих функций ЦНС. При разработке подходов к поиску ранних ЭЭГ-маркеров начинающихся нарушений мы исходили из того, что воздействие гипоксии прежде всего сказывается не на отдельных структурах и даже центральных регуляторных системах, а на деятельности мозга как целого, вызывая перестройки в его работе, которые характеризуются изменениями функционального состояния ЦНС, и этот показатель по сути также является интегральным. Следовательно, искомые оценки ЭЭГ, во-первых, должны быть интегральными, учитывающие и пространственную, и временну́ю составляющую многоканальной ЭЭГ, во-вторых, быть приближенными по смыслу к фундаментальным физиологическим характеристикам, по которым оценивают функциональное состояние мозга.
В качестве наиболее общих параметров оценки функционального состояния в классической физиологии рассматриваются характеристики динамики основных нервных процессов. И.П. Павлов связывал функциональное состояние с уровнем возбудимости и тонусом коры больших полушарий [32]. В работах А.А. Ухтомского [24] показано, что динамика функционального состояния отражается в изменении не только возбудимости головного мозга, но и уровня его реактивности и физиологической лабильности ЦНС при определяющем значении показателей физиологической лабильности как меры функциональной подвижности нервных процессов.
Мы полагаем, что параметр Rsf структурной функции, характеризующий масштабы внутренней (временно́й) связности ЭЭГ процессов, представляет собой оценку одного из фундаментальных свойств нервной системы – физиологической лабильности. Мерой лабильности Н.Е. Введенский (1901) считал “наибольшую частоту раздражения ткани, воспроизводимую ею без преобразования ритма” [33]. Такое определение вполне допускает оценку параметра лабильности как временно́го интервала, периода между последовательными состояниями возбуждения. Это свойство связано со “свойством подвижности нервных процессов”. Сущность подвижности, как считал И.П. Павлов [32], состоит в быстроте перехода от одного действия в другое, от одного нервного процесса (возбуждение, торможение) в другой. Уровень лабильности тем выше, чем быстрее “данный физиологический субстрат успевает переходить от состояния покоя к состоянию возбуждения и обратно … к состоянию физиологического покоя с готовностью к новой реакции” [24]. При этом “интервал возбуждения (продолжительность состояния возбуждения) характеризует степень инерционности субстрата” [24]. Величина радиуса (интервала) корреляции автокорреляционной функции характеризует отрезок времени, в течение которого корреляционная связь исчезает или затухает. Величина параметра Rsf – время достижения асимптоты СФ1 – также может характеризовать, как долго система удерживает след памяти о своем предыдущем состоянии. Иными словами, позволяет оценивать, насколько система инерционна. Мы полагаем, что имеется содержательная связь между этими оценками инерционности в смысле классической физиологии и электроэнцефалографии. То есть, чем больше интервал корреляции автокорреляционной функции или СФ1 ЭЭГ, тем больше инерционность системы и тем ниже уровень функциональной (физиологической) лабильности. И, соответственно, чем меньше (до достижения предполагаемого оптимума реакции, поскольку предельно низкие значения интервала корреляции могут характеризовать дезинтеграцию системы) интервал корреляции, тем меньше инерционность системы и тем выше уровень физиологической лабильности.
Полученные нами результаты, прежде всего, демонстрируют генеральную тенденцию к снижению уровня физиологической лабильности ЦНС, функциональной подвижности нервных процессов при пребывании в условиях острой гипоксии. Подобное снижение функциональной подвижности, повышение инерционности нервных процессов, по-видимому, и служит основой замедления (в последствии и нарушения) процессов восприятия, когнитивных функций и целенаправленной деятельности.
Параметр Rsf характеризует временно́й масштаб организации биоэлектрической активности мозга на микроинтервалах времени, в диапазоне десятков мс, сопоставимом с длительностью процесса восприятия и элементарных моторных актов. Из числа немногочисленных подходов к оценке масштабов временно́й связности ЭЭГ в сопоставимом диапазоне можно отметить данные анализа временны́х рядов карт топического распределения потенциалов, составленных из значений амплитуд ЭЭГ, одновременно зарегистрированных в различных отведениях [34, 35]. Топография таких карт остается стабильной в течение приблизительно 100 мс, а затем очень быстро настраивается в новую топографию, в которой она снова остается стабильной. Д. Леманн обозначил эти периоды стабильных конфигураций карты как функциональные микросостояния мозга [34]. Длительность временно́го интервала ЭЭГ, в течение которого, по данным нашего исследования временно́го ИП многоканальной ЭЭГ система удерживает след памяти о своем предыдущем состоянии (величина Rsf/0.7), составляет у разных лиц в исходном состоянии спокойного бодрствования, в среднем 22–30 мс (при гипоксии в отдельных случаях достигая уровня 60 мс и более). Можно заметить, что длительность “функционального микросостояния” (80–120 мс) соответствует периоду, а интервал корреляции (Rsf) – четверти периода волны альфа-ритма. Примечательно, что по оценкам критической частоты слияния световых мельканий (КЧСМ), которая также используется для характеристики функционального состояния ЦНС, частота слияния мельканий в норме составляет приблизительно 40–45 Гц [36], что соответствует интервалу между стимулами 22–25 мс. Аналогия между КСЧМ и Rsf поддерживается еще и тем обстоятельством, оба показателя обнаруживают однонаправленную динамику при снижении функционального состояния – увеличение Rsf при гипоксии и возрастание величины интервала слияния вспышек света (уменьшение КЧСМ) при утомлении.
Полученные нами данные показали, что величина пространственного ИП (Asf) менялась по мере углубления гипоксии, демонстрируя фазность и высокую индивидуальную вариабельность изменений, а также общую тенденцию к снижению уровня статистической пространственной взаимосвязи ЭЭГ между всеми отведениями (увеличение доли стохастической составляющей в ЭЭГ). Эти данные соответствуют выявленным ранее фазным изменениям пространственной синхронизации ЭЭГ при гипоксии, которые могли проявляться у большинства лиц в форме начального усиления процессов дистантной синхронизации корковых потенциалов с последующим ее снижением [14]. Оценка воздействия гипоксии на биоэлектрическую активность мозга в большинстве исследований выполнена с использованием метода количественной ЭЭГ (qEEG) с численными значениями спектральных характеристик активности в различных отведениях. В зависимости от количества отведений число анализируемых параметров может измеряться десятками и сотнями, что представляется избыточным. На этапе определения значимых предикторов проходит “отсев” взаимно связанных и незначимых параметров. Такое снижение размерности осуществляется различными методами, и даже применение одного метода не гарантирует совпадение результатов при анализе данных в разных выборках лиц, пребывающих в одинаковых экспериментальных условиях.
Так, противоречивые результаты дает поиск корковых зон, где при гипоксии обнаруживаются наибольшие изменения спектральных параметров ЭЭГ, зон, наиболее “чувствительных” к гипоксемии. По данным разных исследователей, к числу таких зон можно отнести затылочные [37], заднетеменные, затылочные, а также височные зоны правого полушария [11], лобные и центральные [12], лобные области левого полушария (данные электромагнитной томографии низкого разрешения – sLORETA) [38]. Разнонаправленную, подчас топически избирательную динамику обнаруживают в изменениях спектральной мощности различных диапазонов частот ЭЭГ: увеличение активности тета-дельта-диапазона в теменных, височных и центральных зонах наряду с генерализованным снижением альфа-активности (гипоксическая гипоксия) [39], уменьшение активности альфа-диапазона в задних областях и увеличение активности тета-диапазона в передних областях коры (гипобарическая гипоксия) [10].
На структурной функции многоканальной ЭЭГ можно видеть достаточно регулярную составляющую, которая проявляется в виде соответствующих осцилляций относительно ее асимптоты. Наличие такой регулярной составляющей характеризует всю совокупность колебаний биопотенциалов в различных отведениях ЭЭГ. Пространственно-временна́я согласованность колебаний поддерживается определенное время, что обнаруживается в постепенном затухании колебаний. Частота, максимальная амплитуда колебаний, а также время их затухания индивидуальны для различных испытуемых. В целом, частота этих осцилляций СФ1 для человека в состоянии спокойного бодрствования соответствует частоте альфа-ритма ЭЭГ в затылочных отведениях, хотя еще предстоит найти аналитический вид преобразования, связывающего частотные характеристики совокупности локальных ЭЭГ процессов и СФ1 многоканальной ЭЭГ.
Что показывает сопоставление данных спектрального анализа СФ1 (для СФ первого порядка – амплитудно-частотного спектра) с изменениями спектров нативной ЭЭГ в динамике острой гипоксии? Анализ ЭЭГ, снятых у испытуемых в барокамере при моделировании высоты от 5000 до 9000 метров над уровнем моря, позволил [1] выделить ряд фаз изменений биоэлектрической активности мозга. Появление первых двух фаз – активации бета-ритма (1 фаза) и синхронизации альфа-ритмa (2 фаза), широко варьирует в ЭЭГ у разных лиц. В нашем исследовании на начальной фазе гипоксии на СФ1 чаще наблюдалось снижение амплитуды колебаний во всех диапазонах частот, что более соответствовало реакции активации на ЭЭГ. Во время этих изменений ЭЭГ у многих лиц обнаруживалось некоторое сокращение времени выполнения тестов, улучшение настроения, умеренная эйфория [1, 2]. Изменения анализируемого нами параметра Rsf также свидетельствовали об улучшении функционального состояния и повышении уровня физиологической лабильности ЦНС в этот период. Третья фаза – снижение частоты альфа-ритма, появление и усиление тета-активности (по [1]), слабо представлена в виде снижения частоты колебаний альфа-диапазона частот на спектре СФ1 (см. рис. 1) у испытуемых с высоким уровнем устойчивости к гипоксии, и отчетливо видна на рис. 2 у лиц со средней устойчивостью к гипоксии. В эту фазу возрастает время выполнения различных тестов, ухудшается внимание, появляются ошибки, наблюдаются изменения почерка, нередко возникает заторможенность и сонливость [1, 9]. Изменения параметра Rsf, характеризующие снижение уровня физиологической лабильности и функционального состояния ЦНС, соответствуют приведенным данным поведенческих оценок. Четвертая фаза – сравнительного преобладания по амплитуде нерегулярной тета-активности в большинстве случаев в нашем исследовании не была явно представлена на спектре СФ1, хотя, например, на рис. 2 доминирующие колебания потенциалов позиционировались на границе нижнего альфа- и верхнего тета-диапазонов частот ЭЭГ. Прогрессирующие снижение уровня физиологической лабильности по параметру Rsf также соответствовало динамике ухудшения показателей выполнения психологических тестов и расстройствам координации.
Фаза доминирования дельта-ритмов высокой амплитуды представлена на рис. 3 у испытуемого со сравнительно низкой устойчивостью к гипоксии. На фоне этой фазы, когда могут возникать выраженные нарушения ЦНС с потерей не только работоспособности, но и сознания, по параметру Rsf видно резкое падение уровня физиологической лабильности ЦНС.
Таким образом, динамика спектральных характеристик, обобщенных в СФ1 многоканальной ЭЭГ, соответствует изменениям реальной ЭЭГ при гипоксии, и в качестве интегральных характеристик делают описание индивидуальных реакций на гипоксию более наглядным.
По динамике, скорости изменения параметра Rsf (Pt), характеризующего уровень физиологической лабильности ЦНС в ходе воздействия гипоксии, можно определить не только общую устойчивость к гипоксии, но и вероятные индивидуальные пороги нарушения процессов восприятия и когнитивной деятельности. В настоящей работе мы предлагаем использовать нормированные интегральные параметры многоканальной ЭЭГ, характеризующие ее пространственную (Ps) и временну́ю (Pt) упорядоченность. Крайние значения этих параметров соответствуют полностью детерминированной (0) и “случайной” (1) пространственной и временно́й организации ЭЭГ в целом. Использование предложенных параметров структурной функции многоканальной ЭЭГ позволяет рассмотреть интегральный ЭЭГ-образ в пространстве двух переменных, одна из которых характеризует пространственную (корреляционную) структуру связей между отведениями, а другая – обобщенную временну́ю организацию ЭЭГ-сигнала. Важной особенностью представления ЭЭГ с помощью нормированных интегральных параметров Ps и Pt является то, что с их помощью можно провести классификацию испытуемых по степени их устойчивости к воздействию экстремальных условий среды, в частности, к гипоксии. Ранее, в работе [30] на основе оценки совместного распределения данных интегральных параметров было показано, что для каждого испытуемого они изменяются в определенной области с четко выраженной индивидуальной конфигурацией, отражающей тип вариабельности ЭЭГ (пространственный, временно́й или смешанный), причем характеристики этих типов могли быть связаны с успешностью выполнения когнитивных заданий. Рис. 4 в наглядной форме демонстрирует особенности “поведения” образа ЭЭГ в пространстве двух интегральных переменных у лиц с различной степенью устойчивости к гипоксии. Так, у высоко устойчивых к гипоксии лиц облако точек минимально изменяет свое положение. У менее устойчивых лиц в условиях гипоксемии образуется обособленный кластер точек, что отражает формирование нового функционального состояния, которое характеризуются минимальным по отношению к исходному состоянию изменением величины пространственного параметра и отчетливым смещением величин временно́го параметра. Направление этого смещения можно трактовать, с одной стороны, как возрастание детерминированной временно́й составляющей сигнала, внутренней (временно́й) связности сигнала, с другой – повышение инерционности, ригидности системы, а, следовательно, уменьшение показателя физиологической лабильности и снижение функционального состояния ЦНС. Наконец, у лиц с низкой устойчивостью к гипоксии в ходе ее воздействия отмечается значительное вытягивание облака точек в сторону наименьших значений, как по временно́му, так и по пространственному параметру, отражая повышение внутренней детерминированности, инерционности, ригидности системы (по временно́му показателю – существенное снижение физиологической лабильности и функционального состояния ЦНС). В целом, если допустить аналогию с механизмами регуляции сердечного ритма, ригидность системы может свидетельствовать о переходе ее на нижний, автономный уровень регуляции, что в клинической кардиологии рассматривается в качестве тревожного знака.
Еще больший интерес представляет наблюдение за траекториями смещения оценок двух интегральных показателей при развитии коллаптоидной реакции. При дыхании гипоксической смесью смещение характеристических точек за пределы исходного облака происходит быстро и без тенденции к агрегации, что говорило бы о формировании квазиустойчивого функционального состояния. По полученным нами данным, минимальный интервал от начала смещения точки до момента развития коллаптоидной реакции включает 6–7 точек и при эпохе анализа 4 с составляет от 24 до 28 с, что позволяет заблаговременно, пусть и только за несколько секунд до события, дать сигнал тревоги. Безусловно, практическая реализация системы контроля на базе предлагаемых показателей потребует дальнейших исследований.
Исследования, направленные на поиск объективных электрофизиологических критериев количественной оценки индивидуальной устойчивости и предикторов развития состояний, угрожающих жизни или срывом деятельности человека в экстремальных условиях внешней среды, имеют не только фундаментальное, но и важнейшее прикладное значение. Нейрофизиологической базой такого поиска могут служить объективные показатели функционального состояния мозга как центральной системы регуляции функций в организме, отвечающей за компенсаторные и адаптационные процессы и сохранение гомеостаза. При этом на первом месте должны стоять показатели оценки интегративных функций. В нашем исследовании оценкой функционального состояния служили ИП биоэлектрической активности мозга, рассчитываемые на основе структурной функции многоканальной ЭЭГ и характеризующие меру временно́й и пространственной (корреляционной) связности колебаний биопотенциалов. Динамика ИП ЭЭГ позволяет дать оценку изменениям функционального состояния мозга в целом, обеспечивает наблюдение (мониторинг) за снижением уровня физиологической лабильности ЦНС в условиях гипоксемии, при этом достижение определенных численных значений ИП может быть маркером дезинтеграции системной деятельности мозга с нарушением когнитивных функций и работоспособности.
Список литературы
Малкин В.Б., Гиппенрейтер Е.Б. Острая и хроническая гипоксия. Проблемы космической биологии. Москва. Наука. Т. 35. 1977. [Malkin V.B., Gippenreiter E.B. Ostraia i khronicheskaia gipoksiia. Problemy kosmicheskoi biologii [Acute and chronic hypoxia. Prob. Kosm. Biol. 35:]. Moscow. Nauka. 1977].
Новиков В.С., Сороко С.И. Физиологические основы жизнедеятельности человека в экстремальных условиях. СПб. Политехника-принт. 2017. [Novikov V.S., Soroko S.I. Fiziologicheskie osnovy zhiznedeiatelnosti cheloveka v ekstremalnykh usloviiakh. [Physiological basis of human life in extreme conditions]. St. Petersburg. Politehnika-print. 2017].
McMorris T., Hale B.J., Barwood M., Costelloa J., Corbett J. Effect of acute hypoxia on cognition: A systematic review and meta-regression analysis. Neurosci. Biobehav. Rev. 74(Pt A): 225–232. 2017.
Virués-Ortega J., Buela-Casal G., Garrido E., Alcázar B. Neuropsychological functioning associated with high-altitude exposure. Neuropsychol. Rev. 14(4): 197–224. 2004.
Сороко С.И., Бурых Э.А., Бекшаев C.C., Рожков В.П., Бойко Е.Р. Индивидуальные особенности системных реакций организма человека на острую гипоксию. Рос. физиол. журн. им. И.М. Сеченова. 98(11): 1396–1415. 2012. [Soroko S.I., Burykh E.A., Bekshaev C.C., Rozhkov V.P., Boiko E.R. Individual systemic reactions of human organism under acute hypoxia. Ross. Fiziol. Zh. Im. I.M. Sechenova. 98(11): 1396–1415. 2012. (In Russ.)]
Divert V.E., Krivoschekov S.G., Vodyanitsky S.N. Individual-typological assessment of cardiorespiratory responses to hypoxia and hypercapnia in young healthy men. Hum. Physiol. 41(2): 166–174. 2015.
Кривощеков С.Г., Леутин В.П., Диверт В.Э. Системные механизмы адаптации и компенсации. Бюллетень СО РАМН. Новосибирск. 2(112): 148–153. 2004. [Krivoshchekov S.G., Leutin V.P., Divert V.E. System mechanisms of adaptation and compensation. Biulleten SO RAMN. 2(112): 148–153. 2004. (In Russ.)]
Сороко С.И., Бекшаев С.С., Сидоров Ю.А. Основные типы механизмов саморегуляции мозга. Л. Наука. 1990. [Soroko S.I., Bekshaev S.S., Sidorov Iu.A. Osnovnye tipy mekhanizmov samoreguliatcii mozga. [The main types of brain self-regulation mechanisms]. Leningrad. Nauka. 1990. (In Russ.)].
Gastaut H., Bostem F., Fernandez-Guardiola A., Naquet R., Gibson W. Hypoxic activation of the EEG by nitrogen inhalation. In: Cerebral Anoxia and the Electroencephalogram. Eds. Gastaut H, Meyer J.S. Springfield. IL. Charles C Thomas. 343–54. 1961.
Ozaki H., Watanabe S., Suzuki H. Topographic EEG changes due to hypobaric hypoxia at simulated high altitude. Electroencephalogr. Clin. Neurophysiol. 94(5): 349–356. 1995.
Zhao J.P., Zhang R., Yu Q., Zhang J.X. Characteristics of EEG activity during high altitude hypoxia and lowland reoxygenation. Brain Res. 1648 (Pt A): 243–249. 2016.
Papadelis C., Kourtidou-Papadeli C., Bamidis P.D., Maglaveras N., Pappas K. The effect of hypobaric hypoxia on multichannel EEG signal complexity. Clin. Neurophysiol. 118(1): 31–52. 2007.
Ginsburg D.A., Pasternak E.B., Gurvitch A.M. Correlation analysis of delta activity generated in cerebral hypoxia. Electroencephalogr. Clin. Neurophysiol. 42(4): 445–455. 1990.
Рожков В.П., Сороко С.И., Трифонов М.И., Бекшаев С.С., Бурых Э.А., Сергеева Е.Г. Корково-подкорковые взаимодействия и регуляция функционального состояния мозга при острой гипоксии у человека. Рос. физиол. журн. им. И.М. Сеченова. 94(5): 481–501. 2008. [Rozhkov V.P., Soroko S.I., Trifonov M.I., Bekshaev S.S., Burykh E.A., Sergeeva E.G. Cortical-subcortical interactions and the brain functional state regulation under acute hypoxia in man. Ross. Fiziol. Zh. Im. I. M. Sechenova. 94(5): 481–501. 2008. (In Russ.)]]
Hindriks R., Adhikari M.H., Murayama Y., Ganzetti M., Mantini D., Logothetis N.K., Deco G. Can sliding-window correlations reveal dynamic functional connectivity in resting-state fMRI? Neuroimage. 127: 242–256. 2016.
Каплан А.Я., Бьен Дж.Г., Тимашев С.Ф., Встовский Г.В., Пак Б.У. Функциональная изменчивость автокорреляционной структуры ЭЭГ. Журн. высш. нерв. деят. 56(3): 389–392. 2006. [Kaplan A.Ia., Ben Dzh. G., Timashev S.F., Vstovskii G.V., Pak B.U. Functional variability of the autocorrelation structure of the EEG. Zh. Vyssh. Nerv. Deiat. Im. I. P. Pavlova. 56(3): 389–392. 2006. (In Russ.)].
Колмогоров А.Н. Локальная структура турбулентности в несжимаемой вязкой жидкости при очень больших числах Рейнольдса. Докл. АН СССР. 30(4): 299–303. 1941. [Kolmogorov A.N. The local structure of turbulence in incompressible viscousn fluid for very large Reynolds numbers. Dokl. Acad. Nauk SSSR. 30(4): 299–303. 1941. (In Russ.)]
Прохоров С.А., Графкин В.В. Структурно-спектральный анализ случайных процессов. Самара. СНЦ РАН. 2010. [Prokhorov S.A., Grafkin V.V. Strukturno-spektralnyi analiz sluchainykh protcessov [Structural-spectral analysis of random processes]. Samara. SNTC RAN. 2010. (In Russ.)].
Trifonov M. The structure function as new integral measure of spatial and temporal properties of multi-channel EEG. Brain informatics. 3(4): 211–220. 2016.
Conte E., Khrennikov A., Federici A., Zbilut J.P. Fractal fluctuations and quantum-like chaos in the brain by analysis of variability of brain waves: A new method based on a fractal variance function and random matrix theory: A link with El Naschie fractal Cantorian space–time and V. Weiss and H. Weiss golden ratio in brain. Chaos Soliton Fract. 41(5): 2790–2800. 2009.
Timashev S.F., Panischev O.Yu., Polyakov Y.S., Demin S.A., Kaplan A.Ya. Analysis of cross-correlations in electroencephalogram signals as an approach to proactive diagnosis of schizophrenia. Physica A Stat. Mech. Appl. 391(4): 1179–1194. 2012.
Trifonov M., Rozhkov V. Age-related changes in probability density function of pairwise Euclidean distances between multichannel human EEG signals. J. Biosci. Med. 2(4): 19–23. 2014.
Rozhkov V.P., Trifonov M.I., Bekshaev S.S., Belisheva N.K., Pryanichnikov S.V., Soroko S.I. Assessment of the Effects of Geomagnetic and Solar Activity on Bioelectrical Processes in the Human Brain Using a Structural Function. Neurosci. Behav. Physiol. 48(3): 317–326. 2018.
Ухтомский А.А. Собрание сочинений. Т. II. Парабиоз, физиологическая лабильность, усвоение ритма. Л. Изд-во Ленинградского государственного университета. 1951. [Ukhtomskij A.A. Sobranie sochinenii. T. II. Parabioz, fiziologicheskaia labilnost, usvoenie ritma. [Collection works. 2: Parabiosis, physiological lability, assimilation of a rhythm] Leningrad. Publishing house LSU. 1951. (In Russ.)].
Ливанов М.Н. Пространственная организация процессов головного мозга. М.: Наука, 1972. [Livanov M.N. Prostranstvennaia organizatciia protcessov golovnogo mozga [Spatial organization of cerebral processes]. Moscow. Nauka. 1972. (In Russ.)].
Thiagarajan T. Interpreting electrical signals from the brain. Acta Physica Polonica B. 49(12): 2095–2125. 2018.
Seghier M.L., Price C.J. Interpreting and Utilising Intersubject Variability in Brain Function. Trends Cogn. Sci. 22(6): 517–530. 2018.
Wei C.-S., Lin Y.-P., Wang Y.-T., Lin C.-T., Jung T.-P. A subject-transfer framework for obviating inter- and intra-subject variability in EEG-based drowsiness detection. Neuroimage. 174: 407–419. 2018.
Roy Y., Banville H., Albuquerque I., Gramfort A., Falk T.H., Faubert J. Deep learning-based electroencephalography analysis: a systematic review. arXiv:1901.05498v2 [cs.LG] 20 Jan 2019. https://arxiv.org/pdf/1901.05498.pdf
Trifonov M.I., Panasevich E.A. Prediction of Successful Personal Cognitive Performance Based on Integrated Characteristics of Multichannel EEG. Human Physiology. 44(2): 208–215. 2018.
Васильев К.К., Глушков В.А., Дормидонтов А.В., Нестеренко А.Г. Теория электрической связи. Ульяновск. УлГТУ. 2008. [Vasil’ev K.K., Glushkov V.A., Dormidontov A.V., Nesterenko A.G. Teoriya elektricheskoj svyazi [Theory of electrical communication]. Ul’yanovsk. UlGTU. 2008. (In Russ.)].
Павлов И.П. Полн. cобр. соч. М. Изд-во АН СССР. 1951–1952. Т. 3. Кн. 2. С. 268. [Pavlov I.P. Poln. sobr. soch. [Full composition of writings]. 3(2): 268. Moscow. Publishing House of the USSR Academy of Sciences. 1951–1952. (In Russ.)].
Введенский Н.Е. (1901) Избр. произв. Ч. 2. Возбуждение, торможение и наркоз. М. Изд-во АН СССР. 1951. [Vvedenskij N.E. Izbr. proizv. Vozbuzhdenie, tormozhenie i narkoz. [ Selected works. Pt. 2. Excitation, inhibition and narkosis.]. Moskow. Publishing House of the USSR Academy of Sciences. 1951. (In Russ.)].
Lehmann D., Ozaki H., Pal I. EEG alpha map series: brain micro-states by space-oriented adaptive segmentation. Electroencephalogr. Clin. Neurophysiol. 67(3): 271–288. 1987.
Khanna A., Pascual-Leone A., Michel C.M., Farzan F. Microstates in Resting-State EEG: Current Status and Future Directions. Neurosci. Biobehav. Rev. 49: 105–113. 2015.
Леонова А.Б. Психодиагностика функциональных состояний человека. М. Издательство Московского университета. 1984. [Leonova A.B. Psikhodiagnostika funktcionalnykh sostoianii cheloveka [Psychodiagnostics of human functional states]. Moscow. Moscow University Press. 1984. (In Russ.)].
Schellart N.A., Reits D. Transient and maintained changes of the spontaneous occipital EEG during acute systemic hypoxia. Aviat. Space Environ. Med. 72(5): 462–470. 2001.
Schneider S., Strüder H.K. Monitoring effects of acute hypoxia on brain cortical activity by using electromagnetic tomography. Behav. Brain Res. 197(2): 476–480. 2009.
Saletu B., Grunberger J., Andere P., Linzmayer L., Konig P. On the cerebro-protective effects of caroverine, a calcium-channel blocker and antiglutamatergic drug: double-blind, placebo-controlled, EEG mapping and psychometric studies under hypoxia. Br. J. Clin. Pharmacol. 41(2): 89–99. 1996.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


