Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 7, стр. 861-878
Влияние микроинъекций агониста и антагониста рецепторов серотонина (5-НТ 2А/С) в миндалину крыс на тревожное поведение и условнорефлекторный страх
И. В. Павлова 1, *, Н. Д. Брошевицкая 1, М. П. Рысакова 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: pavlovfml@mail.ru
Поступила в редакцию 10.01.2019
После доработки 28.03.2019
Принята к публикации 19.04.2019
Аннотация
Изучали роль 5-НТ 2А/С рецепторов миндалины при выработке, тестировании и угашении условнорефлекторного страха, а также при тревожном поведении животных. Микроинъекция антагониста (кетансерина, 0.5 мкг/0.5 мкл) рецепторов в базолатеральное ядро миндалины уменьшала проявление условнорефлекторного страха в виде замирания и препятствовала повторному обучению, но не влияла на тревожное поведение крыс. Введение агониста (DOI, 1 мкг/0.5мкл) приводило к увеличению двигательной активности, паникоподобному поведению и снижению тревожности, уменьшению проявления страха в виде замирания. Воздействие как агониста, так и антагониста 5-НТ 2А/С рецепторов было способно ускорить угашение страха у крыс с длительным замиранием, который с трудом поддается угашению. Полученные результаты свидетельствуют о том, что 5-НТ 2А/C рецепторы миндалины играют существенную роль в возникновении и сохранении условнорефлекторного страха, проявляющегося в виде замирания.
В аверсивных ситуациях, при потенциальной и реальной угрозе у животных выявляются индивидуально-групповые особенности поведения. В тестах на тревожность выделяют низко- и высокотревожных особей, основываясь на способности животных выходить в потенциально опасные отсеки лабиринтов и камер. При выработке классического оборонительного рефлекса (fear conditioning) выделяют группы с разной длительностью замирания – низко- или высокореактивные животные [1, 2], мало- и многозамирающие крысы [3]. Изучение нейромедиаторных механизмов, обеспечивающих разное проявление и скорость угашения условнорефлекторного страха, является актуальной задачей для понимания закономерностей возникновения и регуляции эмоциональных состояний. Особый интерес вызывает поиск препаратов, способных повлиять на поведение высокотревожных особей, а также скорость угашения и проявление страха у животных с высоким уровнем замирания, поскольку такие животные могут служить моделью невротических расстройств у человека, возникающих при нарушениях в угашении страха (например, тревожных и посттравматических стрессовых расстройств).
Согласно данным литературы базолатеральное ядро миндалины является ключевой структурой в нейронных сетях, обеспечивающих как возникновение, так и угашение условнорефлекторного страха и тревожного состояния [4]. Миндалина находится под модулирующим влиянием моноаминергических систем, в частности, серотонинергической системы. Серотонинергические проекции следуют к миндалине от дорзального ядра шва среднего мозга [5]. Согласно представлениям F.G. Graeff активация восходящих дорзальных серотонинергических путей от ядра шва, иннервирующих миндалину и фронтальную кору, приводит к облегчению выработки условнорефлекторного страха и усилению тревожности, в то время как активация перивентрикулярного пути к дорзальному серому околоводопроводному веществу вызывает торможение врожденных реакций в виде бегства, борьбы, панических проявлений [6, 7]. Известно, что концентрация серотонина (5-НТ) увеличивается в миндалине при стрессе, при выработке и проявлении условнорефлекторного страха [8–10]. В миндалине обнаружено несколько подтипов рецепторов к 5-НТ, при этом роль 5-НТ 1А и 5-НТ 2А/C рецепторов в регуляции страха и тревожноcти может отличаться [11]. Ранее нами было показано участие 5-НТ 1А рецепторов миндалины крыс при выработке и угашении условнорефлекторного страха [12] и тревожности [13]. Особый интерес вызывают 5-НТ 2А/C рецепторы, которые широко представлены в базолатеральном ядре миндалины (BLA). С помощью иммуногистохимической техники была показана локализация 5-НТ 2А рецепторов на пирамидных проекционных нейронах, а также на парвальбумин- и соматостатинсодержащих интернейронах [14]. При системном введении агонисты 5-НТ 2А рецепторов улучшают выработку мигательного рефлекса [15], облегчают консолидацию и угашение памяти о страхе и консолидацию объектной памяти [16], улучшают память о социальном поражении (conditioned defeat) [17]. Введение антагонистов, наоборот, уменьшает признаки социального поражения [17], а также условнорефлекторный страх на обстановку [18] и замедляет угашение страха [16]. Системное введение агонистов 5-НТ 2С рецепторов приводило к анксиогенному эффекту на поведение в приподнятом крестообразном лабиринте и открытом поле [19]. Поскольку в данных работах применялось системное введение агонистов и антагонистов, оставалось не ясным, какие структуры опосредуют наблюдаемые эффекты, поскольку 5-НТ 2А/C рецепторы широко представлены не только в миндалине, но и в гиппокампе, гипоталамусе и коре мозга [11]. Работы с локальным введением агонистов или антагонистов 5-НТ 2А/C рецепторов непосредственно в миндалину малочисленны и касаются в основном тревожного поведения. Имеются сведения о влиянии введения в базолатеральную миндалину лигандов 5-НТ 2 рецепторов на поведение животных в открытом поле [20], в Т-образном лабиринте [21], а также в таких моделях как условнорефлекторная аверсия на место [22], условнорефлекторное поражение при социальных конфликтах [23]. Следует признать, что роль 5-НТ 2А/C рецепторов миндалины при условнорефлекторном страхе и его угашении изучена недостаточно. Данные литературы не дают ответа на вопрос о связи между степенью активности данных рецепторов в миндалине и проявлением индивидуально-групповых особенностей оборонительного поведения, в частности, с разным уровнем замирания у животных.
Целью данной работы было изучить роль 5-НТ 2А/2С рецепторов миндалины в тревожном поведении и при условных оборонительных рефлексах у крыс с различными индивидуально-групповыми особенностями поведения. В задачи нашей работы входило исследование влияния локального введения в базолатеральную миндалину агониста и антагониста 5-НТ 2А/C рецепторов на тревожное поведение животных, а также на проявление, угашение и повторную выработку условнорефлекторного страха у мало- и многозамирающих крыс.
Известно, что 5-HT2А и 5-HT2С рецепторы сходны по структуре, фармакологии и сигнальным путям, а активация как 5-HT2А, так и 5-HT2С рецепторов в отличие, например, от 5HT 1A рецепторов приводит к деполяризации клеток [24]. В связи с этим во многих работах используют неспецифические 5-HT 2A/2C лиганды. Однако есть данные, что помимо стабильных гомодимеров 5-HT2C и 5-НТ2А данные подтипы рецепторов могут образовывать гетеродимеры [25], в этом случае лиганды оказывают влияние преимущественно на 5-HT2C рецепторы. В настоящее время гетеродимеры данных рецепторов исследованы в искусственно созданных условиях, а именно на культурах клеток (не нейронов), в миндалине они на сегодняшний день не обнаружены, хотя и отмечаются потенциально возможные для них локусы [24]. Исходя из этого, в работе применялись неспецифический агонист DOI и антагонист кетансерин.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объект исследования. Опыты проводили в условиях хронического эксперимента на 45 крысах-самцах Вистар массой 270–350 г, полученных из филиала “Столбовая” ФГБУН НЦБМТ ФМБА России. Животные содержались в виварии при обычном 12-часовом световом режиме со свободным доступом к воде и стандартному корму в клетках по 5–6 крыс. В экспериментах соблюдали принципы гуманности, изложенные в директивах Европейского Сообщества (2010/63/ЕU), и положения ИВНД и НФ РАН о работе с экспериментальными животными.
Тестирование крыс на тревожность и паникоподобное поведение. В работе изучали поведение крыс в трех тестах на тревожность: в “открытом поле” (ОП), в “приподнятом крестообразном лабиринте” (ПКЛ), в “темно-светлой камере” (ТСК). Первый раз животных тестировали до операции в самом начале экспериментов после 4–5-дневного хендлинга, второй раз – через 3 недели на фоне введения препаратов в миндалину. Использовали общепринятые размеры и конфигурации лабиринта и камер, которые были подробно описаны ранее [2, 5]. Время наблюдения в каждом тесте составляло 5 мин. Для фиксирования траектории движения крыс и элементов поведения использовали программу Etho Vision, а также видеорегистрацию. Анализировали показатели, отражающие тревожность/смелость крыс (число и длительность выходов в центр ОП, в открытые рукава ПКЛ, в светлый отсек ТСК), двигательную активность крыс (пройденную дистанцию, скорость движения, время движения, число переходов между рукавами в ПКЛ или отсеками в ТСК), исследовательское поведение (стойки, выглядывания), поведение по оценке риска (свешивания в ПКЛ, вытягивания), элементы замещающего поведения (число и длительность груминга), а также ряд показателей, отражающих вегетативные реакции (число дефекаций и уринаций). В работе использовали три теста на тревожность, поскольку, как было ранее показано, поведение крыс линии Вистар не коррелирует между собой в разных тестах, что связано, по-видимому, с возникновением разных видов тревожности [3].
Для оценки тревожности и паникоподобного поведения в работе также использовался Т-образный приподнятый лабиринт (ТПЛ), в котором животных тестировали один день на фоне введения препаратов в миндалину. В трех пробах замеряли латентность выхода в открытый рукав из закрытого, в конец которого помещалась крыса экспериментатором в начале опыта (тест на тревожность). В трех пробах также определяли латентность входа в закрытый рукав при посадке крысы на конец открытого рукава (тест на паникоподобное поведение). За день до эксперимента животных помещали в открытый рукав на 20 мин, согласно рекомендациям [6].
Выработка, тестирование и угашение классического условного оборонительного рефлекса (УОР). Для выработки классического Павловского условного оборонительного рефлекса использовали камеру Startle and Fear Combined System производства PanLab Harvard apparatus (Испания, 2000). При обучении после 120 с интервала исследования камеры животным давали 5 сочетаний звука (30 с, 80 дБ, 2000 Гц) и электрокожного раздражения (2 с, 0.8 мА, задержка 28 с от начала действия звука) с 20-секундными межсигнальными интервалами. Затем через 24 ч после обучения проводили тестирование условнорефлекторного страха (Тест 1), при этом предъявляли только звук (120 с, 80 дБ, 2000 Гц). На основании данных Теста 1 крысы были поделены на группы много- и малозамирающих животных, для этого использовали медианный тест. К группе малозамирающих животных были отнесены крысы, замирающие 20–70% времени, а к группе многозамирающих – более 70% времени. Через 24 ч проводили Тест 2, за 10 мин перед началом которого в миндалину вводили препараты. Далее в двух опытах с предварительным введением препаратов в миндалину проводили угашение условнорефлекторного страха, при этом давали 10 изолированных звуковых стимулов (30 с, 80 дБ, 2000 Гц) без электрокожных раздражений. После каждого опыта с угашением тестировали сохранность рефлекса (Тесты 3 и 4). На последнем этапе проводили повторное обучение на фоне введения препаратов в миндалину, что позволяло оценить их влияние на выработку условнорефлекторного страха. Перед и после повторного обучения следовали Тесты 5 и 6. Более подробно методика была описана ранее [26].
Поведение крыс анализировали в интервалы времени до, во время и после действия звука. Замирание (периоды неподвижности, когда можно было наблюдать только дыхательные движения животного) определяли с помощью амплитудного и временного порогов. Обработка проводилась с помощью стандартной программы, прилагающейся к установке фирмы Panlab.
Выработка условного рефлекса пассивного избегания (УРПИ) проходила в темно-светлой камере (аппаратно-программный комплекс Шелтер, ООО “Нейроботикс”, 2017). Через 30 с после помещения крысы в светлый отсек, открывалась дверца между светлым и темным отсеком, и в течение 180 с у крысы была возможность переходить из одного отсека в другой. После двух контрольных опытов, в которых замеряли латентность ухода из светлого отсека в темный, вырабатывали УРПИ путем подачи тока на пол темного отсека (3 с, 0.8 мА) после захода в него крысы. За 10 мин до опыта с обучением в миндалину вводили препараты. В последующих 5 опытах, проводимых каждый день, смотрели сохранность и угашение рефлекса. Определяли латентность ухода в темный отсек и время пребывания в нем, число заглядываний, стоек, актов груминга, число дефекаций и уринаций. Выделяли заглядывания с постановкой лап на пол темного отсека и заглядывания с засовыванием только головы в аверсивный отсек.
Хирургическая операция. За 10 дней до начала опытов с локальной инъекцией веществ крысам стереотаксически вживляли стальные направляющие (диаметром 0.6 мм) с находящимися внутри канюлями (диаметром 0.3 мм). Кончики канюль располагались в правом и левом базолатеральном ядре миндалины по координатам АР = –2.8, L = 4.8, Н = 8.5 [27] и выступали из направляющих на 0.7–1.0 мм. Направляющие закреплялись на кости с помощью стоматологической пластмассы карбодент. На время пребывания животных в виварии канюли заменяли на мандрены такой же длины и диаметра как канюли. Во время операции для наркоза использовали хлоралгидрат (400 мг/кг, внутрибрюшинно). В конце операции крысам вводили антибиотик амоксициллин (0.2 мл, внутримышечно) и раствор глюкозы (2 мл, подкожно, в холку).
Введение препаратов. Вещества, растворенные в физиологическом растворе, вводили с помощью шприца Гамильтона и электронного инжектора Stoelting со скоростью 0.25 мкл/мин одновременно в правую и левую миндалину. После окончания введения канюля извлекалась из направляющей через 60 с. Вводили агонист 5-НТ 2А/С рецепторов DOI гидрохлорид (1 мкг/0.5 мкл, Sigma), антагонист кетансерин (0.5 мкг/0.5 мкл, Sigma), физиологический раствор (0.5 мкл, контроль). Дозировку препаратов подбирали, исходя из описанного в литературе эффективного диапазона [22, 28–30]. Крыс делили на три подгруппы: одной на протяжении всех опытов вводили агонист (14 крыс), другой антагонист (12 крыс), третьей физиологический раствор (19 крыс). Интервалы времени между опытами с введением препаратов были не менее двух суток.
Морфологический контроль. После окончания опытов крыс умерщвляли путем внутрибрюшинного введения двойной дозы наркоза. Череп извлекали и помещали в 10%-ный раствор формалина на 3–5 суток. Срезы изготавливали на замораживающем микротоме. По результатам морфологического контроля оказалось, что из 90 канюль, вживленных 45 крысам, у 64 кончики располагались в различных отделах базолатерального комплекса миндалины (BLA, BLP, BLV), у 10 – в центральных ядрах (СеС, СеМ), у 9 – в латеральных ядрах (LaVL, LaVM), у 7 – на границе СеС и BLA [27]. Результаты, представленные в статье, были получены на крысах с расположением обеих канюль в базолатеральных ядрах справа и слева, а также на животных с одной канюлей в центральном или латеральном ядре, а другой в базолатеральном ядре.
Статистическая обработка результатов. Для обработки результатов использовали стандартную программу STATISTICA 8.0. С применением basic statistics строили распределение крыс по различным показателям. Распределение параметров, проанализированных в статье, было проверено на нормальность по критерию Kolmogorov–Smirnov (Basic Statistics, раздел Descriptive Statistics). Процент времени замирания, анализируемый при классическом оборонительном рефлексе, удовлетворял данному критерию, в этом случае при сопоставлении групп крыс использовали дисперсионный анализ ANOVA, раздел для повторных измерений (repeated measures ANOVA) и многофакторный анализ (factorial ANOVA). При применении ANOVA c повторными измерениями (R > 2) использовали тест Mauchly’s test of Sphericity. При отсутствии сферичности применяли Pillai’s test из раздела Multivariate tests. При post-hoc анализе использовали критерий Newman-Keuls. Различия считали статистически значимыми при p < 0.05, отмечали наличие тенденции при 0.05 ≤ р ≤ 0.1. При отсутствии нормальности распределения поведенческих параметров использовали Kruskal-Wallis ANOVA, а также Mann–Whitney U test. При сравнении процентных соотношений использовали 2 × 2 Table (Nonparametric Statistics), применяли критерий χ2.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
1. Влияние введения агониста и антагониста 5-НТ 2А/С рецепторов в миндалину на тревожное и паникоподобное поведение крыс. Из всех проанализированных тестов на тревожность наибольшие изменения в поведении крыс под влиянием вводимых препаратов наблюдали в ТСК и ТПЛ. В ОП не было обнаружено изменений ни в одном из проанализированных параметров поведения крыс после введения кетансерина или DOI. При анализе сопоставляли данные при первом (без препаратов) и втором тестировании (на фоне введения препаратов) с помощью Mann–Whitney U test. В ТСК при втором тестировании после введения DOI по сравнению с первым опытом происходило увеличение времени выхода в светлый отсек камеры (U = 30, p = 0.004), длины пройденной дистанции (U = 31, p = 0.006) и числа стоек (U = 16, p = 0.043, рис. 1А–В). В контрольной группе после введения физиологического раствора данные параметры не менялись при втором тестировании (рис. 1А–В). Полученные данные можно рассматривать как свидетельство снижения уровня тревожности, увеличения двигательной и исследовательской активности крыс в ТСК под влиянием DOI. Все прочие показатели поведения крыс в ТСК не менялись после введения DOI. В ПКЛ под влиянием введения DOI в миндалину не происходило изменений времени и числа выходов в открытые рукава лабиринта, а также длины пройденной дистанции. Однако число переходов через центр при втором тестировании снижалось на фоне физиологического раствора (U = 14, p = = 0.021), чего не происходило на фоне DOI (рис. 1Г). Число переходов через центр после введения DOI было статистически значимо больше, чем после введения физиологического раствора (Multiple Comparisons, p = 0.016; Kruskal–Wallis ANOVA, H(2, N = 45) = 7.930, p =0.019, рис. 1Г), что свидетельствовало об увеличении двигательной активности. Введение кетансерина не вызывало изменений ни в одном из проанализированных параметров поведения крыс в ТСК и ПКЛ. После введения DOI отмечалось также увеличение агрессивноподобного поведения крыс по отношению к экспериментатору, стремление убежать и даже спрыгнуть с экспериментального стола, на котором проводилось вставление канюль в направляющие на голове крысы.
Рис. 1.
Влияние введения кетансерина (Кет), DOI и физиологического раствора (Ф) в миндалину крыс на поведение в тестах ТСК (А, Б, В), ПКЛ (Г) и ТПЛ (Д, Е). По оси абсцисс на А–Г – 1 – первая посадка без препаратов, 2 – вторая посадка после введения препаратов, на Д–Е – вводимые препараты. Т – время, Т лат. – латентность, ОР – открытые рукава, ЗР – закрытые рукава, СО – светлый отсек. ↓↑ – снижение/увеличение на второй посадке по сравнению с первой (р < 0.05, Mann–Whitney U test). * – значимые отличия при введении агониста/антагониста по сравнению с введением физиологического раствора (p < 0.05) (Kruskal-Wallis ANOVA). n – число крыс в группе. Данные представлены в виде среднее ± ± ошибка среднего.
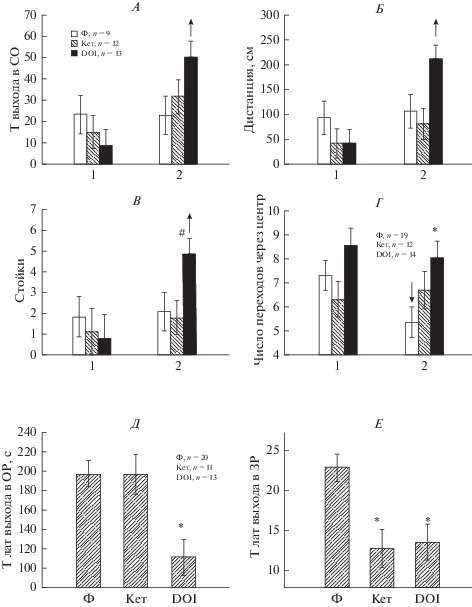
В ТПЛ (рис. 1Д) на фоне введения DOI латентность выходов в открытые рукава была ниже, чем на фоне физиологического раствора (Multiple Comparisons, p = = 0.012; Kruskal–Wallis ANOVA, H(2, N = 132) = 10.56, p = 0.005), что указывало на снижение тревожности. На фоне DOI (Multiple Comparisons, p = 0.019), и кетансерина (p = 0.009) латентность входа в закрытый рукав из открытого была ниже, чем на фоне физиологического раствора (Kruskal–Wallis ANOVA, H(2, N = 116) = 11.36, p = 0.003, рис. 1Е), что можно рассматривать как проявление паникоподобного состояния.
Таким образом, судя по результатам тестирования в ТСК, ПКЛ и ТПЛ, микроинъекция DOI в миндалину вызывала увеличение двигательной активности, снижение тревожности, увеличение паникоподобного поведения крыс. Кетансерин оказывал меньшее влияние на поведение крыс в тестах на тревожность, приводя к сокращению латентности ухода в закрытый рукав ТПЛ.
2. Влияние введения агониста и антагониста 5-НТ 2А/С рецепторов в миндалину на проявление условнорефлекторного страха. Сопоставление суммарных данных по времени замирания крыс в Тесте 1 и 2 (рис. 2А, Б) с помощью Repeated measures ANOVA выявило влияние факторов “препарат” (F2,117 = 5.25, p = 0.007), “группа крыс” (F1,117 = 45.31, p < 0.001), “№ теста” (F1,117 = 71.23, p < 0.001), взаимодействие всех трех факторов проявлялось на уровне тенденции (F2,117 = 3.04, p = 0.052). Подробный анализ по различным интервалам времени в опыте показал, что в Тесте 1 через 24 ч после обучения между подгруппами крыс, которым в дальнейшем вводили разные препараты, не было обнаружено различий в проценте времени замирания (фактор “препарат” F2,105 = 0.96, p = 0.388, Factorial ANOVA, рис. 2А, В). Через 24 ч в Тесте 2 (рис. 2Г) после введения препаратов различия возникали, фактор “препарат” оказывал существенное влияние (F2,105 = 10.09, p < 0.001), было также обнаружено взаимодействие факторов “препарат”/“группа крыс” (F2,105 = 4.67, p = = 0.011). Введение как кетансерина, так и DOI перед Тестом 2 по сравнению с физиологическим раствором вызывало снижение времени замирания в ответ на звук, причем это происходило только у малозамирающих крыс (рис. 2Г). Поведение многозамирающих крыс практически не менялось под влиянием препаратов. Таким образом, введение кетансерина и DOI в миндалину уменьшало проявление условнорефлекторного страха в виде замирания, причем препараты оказывали влияние только на малозамирающих крыс.
Рис. 2.
Влияние введения кетансерина (Кет), DOI и физиологического раствора (Ф) в миндалину крыс на проявление условнорефлекторного страха. А – схема экспериментов, Б – сопоставление Теста 1 и 2 с помощью Repeated measures ANOVA, В – Тест 1, Г – Тест 2 после введения препаратов. По оси абсцисс на Б – номер Теста, на В и Г – интервалы времени в опыте, До – до, Звук – во время, После – после действия звука. По оси ординат – процент времени замирания крыс. МАЗ – группа мало замирающих крыс, МНЗ – группа много замирающих крыс. ↓↑ – уменьшение/увеличение по сравнению с Тестом 1 (post hoc анализ). * – статистически значимые отличия в подгруппах с введением кетансерина или ДОИ по сравнению с введением физиологического раствора (p < 0.05, Factorial ANOVA, post hoc анализ, критерий Newman-Keuls), # – тенденция (0.05 ≤ p < 0.1). n – число крыс в группах МАЗ/МНЗ.
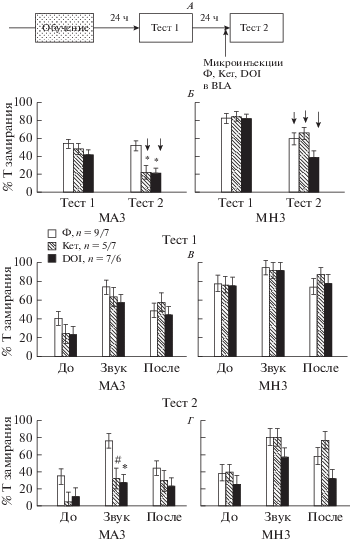
3. Влияние введения агониста и антагониста 5-НТ 2А/С рецепторов в миндалину на угашение условнорефлекторного страха. Сопоставление суммарных данных по времени замирания крыс в Тесте 1, 3 и 4 (рис. 3А, Б) с помощью Repeated measures ANOVA выявило влияние факторов “препарат” (F2,110 = 16.3, p < 0.001), “группа крыс” (F1,110 = 44.0, p < 0.001), “№ теста” (F2,220 = 201, p < 0.001), а также взаимодействие всех трех факторов (F4,220 = 5.4, p < 0.001). Подробный анализ по различным интервалам времени в опыте показал, что введение препаратов перед сеансами угашения оказывало влияние на замирание в последующих Тесте 3 (фактор “препарат” F2,99 = 21.43, p < 0.001) и Тесте 4 (фактор “препарат” F2,99 = 17.35, p = 0.006), причем в Тесте 4 было обнаружено взаимодействие факторов “препарат”/“группа крыс” (F2,98 = 4.41, p = 0.015, Factorial ANOVA). В Тесте 3 (рис. 3А, В) в группе малозамирающих крыс после введения кетансерина и DOI по сравнению с введением физиологического раствора наблюдался меньший процент времени замирания в ответ на звук (post hoc анализ). В группе многозамирающих слабое уменьшение времени замирания в Тесте 3 происходило только после введения DOI. В Тесте 4 (рис. 3А, Г) в группе многозамирающих значительное уменьшение времени замирания наблюдалось после введения DOI, слабое уменьшение (на уровне тенденции) происходило после введения кетансерина, в группе малозамирающих после введения препаратов не возникало различий с контролем, поскольку крысы этой группы хорошо угашали условнорефлекторный страх без каких-либо дополнительных воздействий. Таким образом, введение кетансерина и DOI в миндалину перед сеансами угашения приводило к ускорению угашения условнорефлекторного страха, причем это происходило не только в группе малозамирающих, но и у многозамирающих крыс, рефлекс которых с трудом поддается угашению.
Рис. 3.
Влияние введения кетансерина (Кет), DOI и физиологического раствора (Ф) в миндалину крыс на угашение условнорефлекторного страха. А – схема экспериментов, Б – сопоставление Теста 1, 3 и 4 с помощью Repeated measures ANOVA, В – Тест 3, Г – Тест 4. По оси абсцисс на Б – номер Теста, на В и Г – интервалы времени в опыте, До – до, Звук – во время, После – после действия звука. По оси ординат – процент времени замирания крыс. МАЗ – группа мало замирающих крыс, МНЗ – группа много замирающих крыс. Остальные обозначения как на рис. 2.

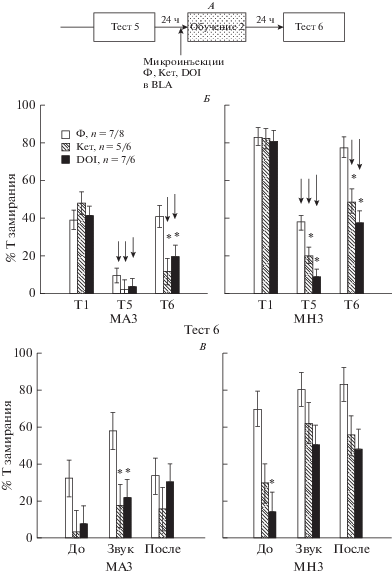
4. Влияние введения агониста и антагониста 5-НТ 2А/С рецепторов в миндалину на повторное обучение. Сопоставление суммарных данных по времени замирания крыс в Тесте 1, 5 и 6 показало (рис. 4А, Б), что существенное влияние на повторную выработку рефлекса оказывали фактор “препарат” (Repeated measures ANOVA, F2,111 = 10.8, p < 0.001), “группа крыс” (F1,111 = 86.3, p < 0.001), а также “номер теста” (F2,222 = 162.4, p < 0.001), взаимодействия трех факторов не наблюдалось (F4,222 = 1.1, p = 0.359). Введение кетансерина или DOI перед повторным обучением приводило к тому, что в Тесте 6 время замирания уменьшалось по сравнению с Тестом 1 (рис. 4А, Б) и оказывалось ниже, чем после введения физиологического раствора. В контрольной группе процент времени замирания в Тесте 6 не отличался от Теста 1 (Repeated measures ANOVA, Post hoc анализ, рис. 4А, Б). Подробный анализ времени замирания по интервалам времени в Тесте 6 показал (рис. 4В), что в группе малозамирающих животных на фоне препаратов в основном уменьшается время замирания в ответ на звук, в группе многозамирающих – преимущественно до действия звукового стимула (Factorial ANOVA, post hoc анализ). Таким образом, введение кетансерина и DOI в миндалину перед повторным обучением нарушало выработку условнорефлекторного страха.
Рис. 4.
Влияние введения кетансерина (Кет), DOI и физиологического раствора (Ф) в миндалину крыс на повторную выработку оборонительного рефлекса. А – схема экспериментов, Б – сопоставление процента времени замирания в Тестах 1, 5 и 6 (Repeated measures ANOVA), ↓ – снижение времени замирания по сравнению с Тестом 1, * – значимые отличия в подгруппах с введением кетансерина или DOI по сравнению с подгруппой с физиологическим раствором в этом же тесте. В – Тест 6 (Factorial ANOVA). По оси абсцисс на Б – номер теста, Т1 – Тест 1, Т5 – Тест 5, Т6 – Тест 6, на В – интервалы времени в опыте, До – до, Звук – во время, После – после действия звука. По оси ординат – процент времени замирания. МАЗ – группа мало замирающих крыс, МНЗ – группа много замирающих крыс. Остальные обозначения как на рис. 2.
5. Влияние введения агониста и антагониста 5-НТ 2А/С рецепторов в миндалину на выработку и угашение рефлекса пассивного избегания. Фактор “препарат” оказывал слабое воздействие на латентность входа в темный отсек камеры (F2,175 = 2.50, p = 0.085, Factorial ANOVA), наибольшие отличия были получены только при сопоставлении крыс с введением физиологического раствора и DOI (р = 0.059). На следующий день после обучения число крыс, заходящих в темный отсек (рис. 5А, В), не отличалось после введения физиологического раствора (25%), кетансерина (33%) и DOI (33%), также не было отмечено различий и в латентности входов (рис. 5Б). Однако в первом опыте процент крыс, не входящих и не заглядывающих в темный отсек, т.е. с высоким качеством пассивного избегания, был выше у контрольных животных, чем у крыс после введения кетансерина (χ2 = 4.1, р = 0.043) и DOI (χ2 = 4.1, р = 0.043, рис. 5Г). Эти данные свидетельствовали о слабом влиянии препаратов на выработку УРПИ. В четвертом и пятом опытах при угашении УРПИ крысы, которым при выработке вводили DOI, начинали в два раза чаще (67 и 80% соответственно) заходить в темный отсек, чем животные с введением физиологического раствора (25 и 42% соответственно, рис. 5А, В). Из-за небольшого количества животных различия в процентных соотношениях проявлялись на уровне тенденции (χ2 = 2.95, р = 0.086). Крысы, которым при выработке вводили кетансерин, занимали промежуточное положение по скорости угашения между животными с физиологическим раствором и DOI (рис. 5А–В). В четвертом опыте при угашении УРПИ крысы с введением физиологического раствора чаще не заходили и не заглядывали в темный отсек, чем животные с введением агониста (χ2 = 4.1, р = = 0.043) или антагониста (χ2 = 4.1, р = 0.043, рис. 5Г). Таким образом, введение DOI перед выработкой УРПИ способствовало все же более быстрому угашению рефлекса и уменьшало длительность его сохранения.
Рис. 5.
Влияние введения кетансерина (Кет), DOI и физиологического раствора (Ф) в миндалину крыс на выработку и угашение УРПИ. А – схема экспериментов. Б – латентность входа в темный отсек камеры. В – число крыс (в процентах), заходящих в темный отсек. Г – число крыс (в процентах) не заходящих и не заглядывающих в темный отсек. По оси абсцисс – номер опыта, –2–1 – контрольные опыты до обучения, 0 – день выработки УРПИ, 1–5 опыты после обучения. # – тенденция ( 0.05 ≤ p < 0.1), * – значимые отличия (р < 0.05) – Nonparametric Statistics, 2 × 2 Table.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Введение агониста 5-НТ 2А/С рецепторов DOI в BLA приводило к специфическому эффекту в тестах на тревожность: увеличению двигательной активности, увеличению времени нахождения в аверсивном отсеке ТСК, снижению латентности выходов в открытые рукава ТПЛ, т.е. оказывало анксиолитическое и двигательно-активирующее действие. Вместе с тем снижалась латентность входа в закрытый рукав из открытого в ТПЛ, т.е. увеличивалось паникоподобное поведение. Отмечалось увеличение агрессивноподобного поведения по отношению к экспериментатору. Введение антагониста кетансерина в наших опытах практически не оказывало влияния на поведение крыс в тестах на тревожность. Согласно данным литературы введение других агонистов 5-НТ 2А/С рецепторов (mCPP, IL-639, MK212) в миндалину дает анксиогенный эффект [20, 21], но может оказывать анксиолитическое действие при введении в гиппокамп или при системном введении [29]. Показано, что системное введение DOI мышам, нокаутным по гену белка TLX, вызывало увеличение частоты и длительности атак в тесте резидент-интрудер, т.е. приводило к увеличению агрессивности, введение кетансерина имело обратный эффект [31]. Есть данные, что другой антагонист 5-HT рецепторов (ритансерин) сам по себе, так же как кетансерин в наших опытах, не оказывал влияния на поведение животных в ПКЛ при введении в миндалину [19], но мог блокировать действие агониста. Сложный эффект от введения DOI в наших опытах может быть связан с тем, что 5-НТ 2А/С рецепторы располагаются как на основных проекционных, так и ГАМК-ергических интернейронах миндалины [14, 24], т.е. агонист способен активировать функционально разные группы клеток. В исследованиях с применением patch-clamp методики in vitro показано увеличение гиперполяризации мембраны пирамидных нейронов BLA после инъекции агониста α-m5HT [32]. Такая гиперполяризация основных клеток миндалины может приводить к анксиолитическому эффекту в поведении животных. В литературе появление паникоподобного поведения связывают с активностью серого околоводопроводного вещества [6]. Появление паникоподобного поведения после инъекции DOI в миндалину можно объяснить ее тесными связями с серым околоводопроводным веществом, активация которого могла вызывать такую реакцию. Ранее отмечалось антипаническое действие при введении в миндалину агониста 5-НТ 1А рецепторов [13, 33].
Влияние инъекций антагониста кетансерина было обнаружено при выработке и угашении условнорефлекторного страха. Введение кетансерина приводило к уменьшению проявления страха в виде замирания, ускоряло его угашение и препятствовало повторной выработке. Важно отметить, что введение кетансерина было способно ускорить угашение у многозамирающих крыс, у которых рефлекс отличается прочностью и с трудом поддается угашению. В литературе имеются сведения, подтверждающие наши результаты, но полученные на других поведенческих моделях. Локальное введение в миндалину антагониста 5-НТ 2А рецепторов (MDL) предотвращает возникновение оборонительного и подчиненного поведения после социального поражения у хомяков, т.е. также препятствует выработке условнорефлекторного страха [23]. Другой антагонист (SB242084) 5-HT 2C рецепторов препятствовал выработке тормозного избегания в Т-образном лабиринте [21]. Микроинъекции кетансерина в BLA приводили к уменьшению условнорефлекторной аверсии на место, т.е. уменьшали проявление приобретенного страха [22]. Основой такого уменьшения в проявлении и приобретении страха под влиянием кетансерина может быть снижение активации пирамидных клеток BLA, которые возбуждались за счет 2А/C рецепторов. Показано, что при системном введении кетансерина происходило уменьшение количества с-Fos иммунореактивных клеток (числа активирующихся нейронов) в BLA и в медиальной префронтальной коре в аверсивной ситуации [34]. Можно предположить, что в случае введения антагониста кетансерина, по-видимому, мы имели дело со снижением уровня страха, которое проявлялось в уменьшении уровня замирания и затруднении при повторном обучении.
Введение DOI в миндалину в нашей работе оказывало формально сходное с кетансерином действие на поведение крыс в условнорефлекторной ситуации. Инъекция DOI приводила к уменьшению проявления условнорефлекторного страха в виде замирания, ускоряла его угашение и препятствовала выработке рефлекса. Инъекция DOI в миндалину способствовала возникновению менее прочного навыка при выработке УРПИ, что проявлялось в более быстром его угашении. В литературе имеются факты как противоречащие, так и подтверждающие наши данные. С одной стороны, известно, что локальная инъекция агониста 5-НТ 2А рецепторов (TCB) в BLA облегчала приобретение условнорефлекторного поражения у сирийских хомяков [23], а введение агониста МК-212 способствовало выработке тормозного избегания [21], т.е. в этих работах агонисты улучшали выработку оборонительных рефлексов. При системном введении агонистов также были получены данные о том, что активность 5-НТ 2А рецепторов способствует консолидации памяти о страхе [16]. С другой стороны, при локальной инъекции агониста 5-НТ2 рецепторов (α-m5HT) в миндалину описано уменьшение длительности тонической иммобильности у морских свинок, возникающей при резком надавливании на их тело, т.е. пассивно-оборонительной реакции на сильное воздействие [35], что совпадает с нашими данными об уменьшении проявления страха в виде замирания. Наши результаты об ускорении угашения условнорефлекторного страха при локальной микроиъекции агониста в миндалину совпадают с данными литературы, полученными при системном введении другого агониста TCB-2 [16].
Для объяснения полученных нами данных при введении агониста 5-НТ 2А/С рецепторов можно привлечь сведения, имеющиеся в литературе [36], согласно которым замирание возникает при удаленной угрозе животному и отражает умеренный страх. При близкой угрозе для жизни животное предпочитает либо быстрое убегание, либо агрессию и нападение. Возможно, что при используемых нами дозах агониста при увеличении страха крысы переходили на другой “уровень защиты”, а именно к активным двигательным реакциям. Подтверждают это предположение наши данные об увеличении паникоподобного и агрессивноподобного поведения, двигательной активности крыс после введения DOI. Кроме того, известно, что при введении агониста DOI в BLA чаще возникают импульсивные ответы в тесте дифференцировки по месту (5-choice serial reaction time task), т.е. уменьшается торможение двигательных реакций [28]. Показано, что при введении агониста 5-НТ 2 рецепторов (mCPP) в миндалину увеличивалась экспрессия mРНК генов белка с-Fos в лимбических структурах и медиальной префронтальной коре, т.е. происходила активация большого числа структур мозга [20].
В нашей работе была обнаружена различная чувствительность у крыс с разным проявлением страха к вводимым препаратам. В Тесте 2 только у группы малозамирающих уменьшалось проявление страха в виде замирания после введения кетансерина и DOI. Ранее также наблюдали уменьшение проявления условнорефлекторного страха в виде замирания только у группы малозамирающих при введении в миндалину лигандов D1 и D2 рецепторов, 5-НТ 1А рецепторов и бета-адренорецепторов [12, 26, 37]. Возможно, для уменьшения замирания у многозамирающих крыс требуется воздействие сразу на несколько типов рецепторов, а монотерапия оказывается неэффективной. Ранее при изучении поведения крыс с другими индивидуальными особенностями (с разным уровнем импульсивности) также была показана разная чувствительность к системному введению агониста (DOI) и антагониста (кетансерина) 5-НТ 2А/С рецепторов у “импульсивных” и “самоконтрольных” крыс [38]. В целом эти данные свидетельствуют о том, что уровень серотонинергической передачи через 5-НТ 2А/С рецепторы в эмоциогенных структурах мозга тесно связан с возникновением различных индивидуально-групповых особенностей поведения.
ВЫВОДЫ
1. Введение агониста 5-НТ 2А/С рецепторов DOI (1 мкг/0.5 мкл) в базолатеральную миндалину увеличивало двигательную активность, оказывало анксиолитическое действие, приводило к паникоподобному поведению крыс, судя по анализу поведения животных в “темно-светлой камере”, “приподнятом крестообразном лабиринте” и “Т-образном приподнятом лабиринте”. Введение антагониста 5-НТ 2А/С рецепторов кетансерина (0.5 мкг/0.5 мкл) не оказывало существенного влияния на тревожное поведение крыс.
2. Введение антагониста кетансерина и агониста DOI 5-НТ 2А/С рецепторов в базолатеральную миндалину перед напоминанием приводило к уменьшению проявления условнорефлекторного страха в виде замирания только у крыс с низким уровнем замирания.
3. Введение антагониста кетансерина и агониста DOI 5-НТ 2А/С рецепторов в базолатеральную миндалину перед сеансами угашения ускоряло угашение условнорефлекторного страха у крыс как с низким, так и высоким уровнем замирания.
4. Введение антагониста кетансерина и агониста DOI 5-НТ 2А/С рецепторов в базолатеральную миндалину перед повторным обучением препятствовало выработке условнорефлекторного страха в виде замирания.
5. Предполагается, что введение кетансерина способствовало снижению уровня страха, в то время как введение DOI, наоборот, его увеличивало и приводило к переходу животного на другой “уровень защиты”, проявляющийся в увеличении активных двигательных реакций на угрожающий стимул.
Список литературы
Bush D.E., Sotres-Bayon F., LeDoux J.E. Individual differences in fear: isolating fear reactivity and fear recovery phenotypes. J. Trauma Stress. 20(4): 413–422. 2007.
Lehner M., Taracha E., Maciejak P., Szyndler J., Skorzewska A., Turzynska D., Sobolewska A., Wislowska-Stanek A., Hamed A., Bidzinski A., Plaznik A. Colocalisation of c-Fos and glucocorticoid receptor as well as of 5-HT(1A) and glucocorticoid receptor immunoreactivity-expressing cells in the brain structures of low and high anxiety rats. Behav. Brain Res. 200(1): 150–159. 2009.
Павлова И.В., Рысакова М.П. Проявление тревожности крыс Вистар при выработке условнорефлекторного страха. Журн. высш. нерв. деят. 65(6): 719–735. 2015. [Pavlova I.V., Rysakova M.P. The manifestation of the anxiety during fear conditioning in Wistar rats. Zh. Vyssh. Nerv. Deiat. Im. I. P. Pavlova. 65(6): 720–34. 2015. (In Russ.)].
Le Doux J.E. The amygdale. Curr. Biol. 17(20): 868–874. 2007.
Vertes R.P.A. PHA-L analysis of ascending projections of the dorsal raphe nucleus in the rat. J. Comp. Neurol. 3123(4): 643–668. 1991.
Graeff F.G., Silveira M.C., Nogueira R.L., Audi E.A., Oliveira R.M. Role of the amygdala and periaqueductal gray in anxiety and panic. Behav. Brain Res. 58 (1–2): 123–131. 1993.
Zangrossi H.J., Viana M.B., Zanoveli J., Bueno C., Nogueira R.L., Graeff F.G. Serotonergic regulation of inhibitory avoidance and one-way escape in the rat elevated T-maze. Neurosci. Biobehav. Rev. 25(7–8): 637–645. 2001.
Kawahara H., Yoshida M., Yokoo H., Nishi M., Tanaka M. Psychological stress increases serotonin release in the rat amygdale and prefrontal cortex assessed by in vivo microdialysis. Neurosci. Lett. 162(1–2): 81–84. 1993.
Yokoyama M., Suzuki T., Sato T., Maruta S., Watanabe S., Miyaoka H. Amygdalic levels of dopamine and serotonin rise upon exposure to conditioned fear stress without elevation of glutamate. Neurosci. Lett. 379(1): 37–41. 2005.
Mo B., Feng N., Renner K., Forster G. Restraint stress increases serotonin release in the central nucleus of the amygdale via activation of corticotrophin-releasing factors receptors. Brain Res. Bul. 76(5): 493–498. 2008.
Bauer E.P. Serotonin in fear conditioning processes. Behav. Brain Res. 277: 68–77. 2015.
Павлова И.В., Рысакова М.П. Влияние введения лигандов рецепторов серотонина 5‑НТ1А в миндалину на поведение крыс с разным проявлением условнорефлекторного страха. Журн.высш.нерв.деят. 66(6): 710–724. 2016. [Pavlova I.V., Rysakova M.P. The influence of the serotonin receptors 5-HT1A ligands infusion in the amygdale on behavior of rats with different manifestation of conditioned fear. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 66(6): 710–724. 2016. (In Russ.)].
Rysakova M.P., Pavlova I.V., Broshevitskaya N.D. Intra-amygdala injection of 5-HT1A receptor ligands produces differential effects on the behavior of high- and low-anxiety Wistar rats. Res. Neurosci. 6(1): 11–20. 2017. https://doi.org/10.5923/j.neuroscience.20170601.03
McDonald A.J., Mascagni F. Neuronal localization of 5-HT type 2A receptor immunoreactivity in the rat basolateral amygdale. Neuroscience. 146(1): 306–320. 2007.
Harvey J.A. Role of the serotonin 5-HT (2A) receptor in learning. Learn. Mem. 10(5): 355–362. 2003.
Zhang G., Asgeirsdottir H.N., Cohen S.J., Munchow A.H., Barrera M.P., Stackman R.W.J. Stimulation of serotonin 2A receptors facilitates consolidation and extinction of fear memory in C57BL/6J mice. Neuropharmacology. 64: 403–413. 2013.
Harvey M.L., Swallows C.L., Cooper M.A. A double dissociation in the effects of 5-HT2A and 5-HT2C receptors on the acquisition and expression of conditioned defeat in Syrian hamsters. Behav. Neurosci. 126(4): 530–537. 2012.
Harada K., Yamaji T., Matsuoka N. Activation of the serotonin 5-HT 2C receptor is involved in the enhanced anxiety in rats after single-prolonged stress. Pharmacol. Biochem.Behav. 89: 11–16. 2008.
de Mello Cruz A.P., Pinheiro G., Alves S.H., Ferreira G., Mendes M., Faria L., Macedo C.E., Motta V., Landeira-Fernandez J. Behavioral effects of systemically administered MK-212 are prevented by ritanserin microinfusion into the basolateral amygdale of rats exposed to the elevated plus-maze. Psychopharmacology. 182(3): 345–354. 2005.
Campbell B.M., Merchant K.M. Serotonin 2C receptors within the basolateral amygdale induce acute fear-like responses in an open-field environment. Brain Res. 993(1–2): 1–9. 2003.
Vicente M.A., Zangrossi H. Involvement of 5-HT2C and 5-HT1A receptors of the basolateral nucleus of the amygdale in the anxiolytic effect of chronic antidepressant treatment. Neuropharmacology. 79: 127–135. 2014.
Macedo C.E., Martinez R.C., Albrechet-Souza L., Molina V.A., Brandao M.L. 5-HT2- and D1-mechanisms of the basolateral nucleus of the amygdale enhance conditioned fear and impair unconditioned fear. Behav. Brain Res. 177(1): 100–108. 2007.
Clinard C.T., Bader L.R., Sullivan M.A., Cooper M.A. Activation of 5-HT2A receptors in the basolateral amygdale promotes defeat-induced anxiety and the acquisition of conditioned defeat in Syrian hamsters. Neuropharmacology. 90: 102–112. 2015.
Bombardi C. Neuronal localization of the 5-HT2 receptor family in the amygdaloid complex. Front Pharmacol. 5(68): 1–10. 2014.
Moutkine I., Quentin E., Guiard B.P., Maroteaux L., Doly S. Heterodimers of serotonin receptor subtypes 2 are driven by 5-HT2C protomers. J. Biol. Chem. 292 (15): 6352–6368. 2017.
Павлова И.В., Рысакова М.П., Сергеева М.И. Влияние блокады D1 и D2 рецепторов в базолатеральной миндалине на поведение крыс с высоким и низким уровнем тревожности и страха. Журн. высш. нерв. деят. 65(4): 471–485. 2015. [Pavlova I.V., Rysakova M.P., Sergeeva M.I. Influence of D1, D2 receptor blockade in basolateral amygdala on behavior of rats with high or low levels of anxiety and fear. Zh. Vyssh. Nerv. Deiat. Im. I. P. Pavlova. 65(4): 471–485. 2015. (In Russ.)].
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Acad. Press. 1998.
Hadamitzky M., Koch M. Effects of acute intra-cerebral administration of the 5-HT (2A/C) receptor ligands DOI and ketanserin on impulse control in rats. Behav. Brain Res. 204(1): 88–92. 2009.
Masse F., Petit-Demouliere B., Dubois I., Hascoet M., Bourin M. Anxiolytic-like effects of DOI microinjections into the hippocampus (but not the amygdale nor the PAG) in the mice four plates test. Behav. Brain. Res. 188(2): 291–297. 2008.
Monassi C.R., Menescal-De-Oliveira L. Serotonin 5-HT2 and 5-HT1A receptors in the periaqueductal gray matter differentially modulate tonic immobility in guinea pig. Brain Res. 1009 (1-2): 169–180. 2004.
Juárez P., Valdovinos M.G., May M.E., Lloyd B.P., Couppis M.H., Kennedy C.H. Serotonin 2A/C receptors mediate the aggressive phenotype of TLX gene knockout mice. Behav. Brain Res. 256: 354–361. 2013.
McCool B.A., Christian D.T., Fetzer J.A., Chappell A.M. Lateral/basolateral amygdale serotonin type-2 receptors modulate operant self-administration of a sweetened ethanol solution via inhibition of principal neuron activity. Front. Integr. Neurosci. 8:5. 2014. https://doi.org/10.3389/fnint.2014.00005eCollection
Strauss C.V.A., Vicente M.A., Zangrossi H.J. Activation of 5-HT1A receptors in the rat basolateral amygdale induces both anxiolytic and antipanic-like effects. Behav. Brain Res. 246: 103–110. 2013.
Hervig M.E., Jensen N.C.H., Rasmussen N.B., Rydbirk R., Olesen M.V.,Hay-Schmidt A., Pakkenberg B., Aznar S. Involvement of serotonin 2A receptor activation in modulating medial prefrontal cortex and amygdale neuronal activation during novelty-exposure. Behav. Brain Res. 326: 1–12. 2017.
Leite-Panissi C.R., Ferrarese A.A., Terzian A.L., Menescal-de-Oliveira L. Serotoninergic activation of the basolateral amygdala and modulation of tonic immobility in guinea pig. Brain Res. Bull. 69(4): 356–364. 2006.
Blanchard D.C., Blanchard R.J. Ethoexperimental approaches to the biology of emotion. Annu. Rev. Psychol. 39: 43–68. 1988.
Павлова И.В., Рысакова М.П. Роль бета1,2-адренорецепторов миндалины в поведении крыс с разным уровнем замирания при условнорефлекторном страхе. Журн. высш. нерв. деят. 68(1): 1–14. 2018. [Pavlova I.V., Rysakova M.P. Role of amygdale beta1,2 – adrenoreceptors in the behavior of rats with different freezing level during fear condition. Zh. Vyssh. Nerv. Deiat. Im. I. P. Pavlova. 68(1): 1–14. 2018. (In Russ.)].
Зайченко М.И., Мержанова Г.Х., Ванециан Г.Л. Влияние агониста и антагониста 5HТ2 рецепторов на поведение крыс, различающихся по выбору ценности подкрепления. Журн. высш. нерв. деят. 63(2): 246–255. 2013. [Zaĭchenko M.I., Merzhanova G.Kh., Venetsian G.L. Effect of agonists and antagonists of 5-HT2 receptors on rats with different choice of reinforcement value. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 63(2): 246–55. 2013. (In Russ.)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


