Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 7, стр. 853-860
Влияние острой инъекции этанола на мезолимбическую систему дофамина свободноподвижных крыс
М. А. Михайлова 1, *, Р. Р. Гайнетдинов 1
1 Институт трансляционной биомедицины,
Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: maria.m.vita@gmail.com
Поступила в редакцию 04.04.2019
После доработки 10.05.2019
Принята к публикации 10.05.2019
Аннотация
Алкоголь является третьим по значимости фактором риска болезней в России и во всем мире. По данным ВОЗ в результате злоупотребления алкоголя ежегодно в мире умирает 2.5 млн человек, что сопоставимо с населением крупного города, из них 600–700 тысяч приходится на Россию. Несмотря на развитие науки и медицины, механизмы развития алкогольной зависимости до конца не ясны. Понимание этих механизмов поможет создать новые подходы к лечению алкогольной зависимости. На сегодняшний день известно, что мезолимбическая система дофамина играет ключевую роль в формировании аддиктивных расстройств, в частности, алкогольной зависимости. Быстрая сканирующая циклическая вольтаметрия (FSCV) является широко распространенным методом исследования дофамина. Преимуществом данного метода является высокое временное и пространственное разрешение, что делает FSCV мощным методом для обнаружения изменений в концентрации моноаминовых нейромедиаторов in vivo. Используя FSCV на свободноподвижных животных, мы продемонстрировали, что электрическая стимуляция вентральной области покрышки (VTA) приводит к детектируемому выбросу дофамина в прилежащем ядре (NAcc). Мы показали, что острая инъекция этанола (0.5 г/кг) приводит к значительному снижению высвобождения дофамина в NAcc, вызванного электростимуляцией VTA на свободнодвижущихся крысах. Применение селективного антагониста дофаминовых ауторецепторов D2, раклоприда, значительно увеличивало измеряемый сигнал, это указывало на то, что полученнный сигнал, измеренный в NAcc, являлся именно дофаминергическим, но не норадренергическим.
Алкоголь является третьим по значимости фактором риска болезней в России и во всем мире. По данным ВОЗ в результате злоупотребления алкоголя ежегодно в мире умирает 2.5 млн человек, что сопоставимо с населением крупного города, из них 600–700 тысяч приходится на Россию. На сегодняшний день, несмотря на развитие науки и медицины, механизмы развития алкогольной зависимости до конца не ясны, наше понимание точных нейронных механизмов, ответственных за возникновение и развитие алкогольной зависимости, по-прежнему является неполным [1]. Успех разработки эффективных методов лечения алкоголизма и наркомании зависит от знания биологических механизмов, лежащих в основе формирования зависимостей. В настоящее время известно, что этанол влияет на мозг путем модуляции многочисленных нейромедиаторных систем, включая, но не ограничиваясь, ГАМК [2, 3], глутамат [4], серотонин [5], норадреналин [6], вазопрессин [7], аденозин [8] и дофамин (DA) [9–11]. На сегодняшний день известно, что мезолимбическая система дофамина играет ключевую роль в формировании аддиктивных расстройств, в частности, алкогольной зависимости [9, 10, 12–14]. Следует подчеркнуть, что эффекты этанола на высвобождение дофамина (DA) интенсивно исследовались в течение последних двух десятилетий, и эти результаты и их интерпретации в некоторой степени противоречивы. Электрофизиологические данные свидетельствуют о том, что воздействие этанола стимулирует передачу DA. M.S. Brodie с соавт. сообщили о вызванном этанолом дозозависимом увеличении клеточной активности дофаминовых нейронов вентральной области покрышки (VTA) in vitro [15]. Данные микродиализа предполагают двухфазный дофаминергический ответ на этанол с увеличением содержания внеклеточного дофамина в прилежащем ядре (NAcc) после введения этанола от низких до умеренных доз [16] и без эффекта [17] или с уменьшением [18] внеклеточного уровня дофамина при воздействии этанола в более высоких дозах. Однако микродиализ лучше всего подходит для выявления изменений тонической активности DA, которые происходят в течение нескольких минут. Быстрая сканирующая циклическая вольтаметрия (FSCV) является широко распространенным методом исследования DA. Преимуществом данного метода является высокое временное (100 мс) и пространственное разрешение. Данные, полученные с помощью вольтаметрических экспериментов, показывают, что острое введение этанола уменьшает терминальное высвобождение DA, вызванное электростимуляцией VTA на анестезированных животных или препаратах in vitro [19–23]. Однако ввиду трудоемкости изготовления электродов для свободноподвижных животных данная методика чаще всего используется на анестезированных животных, что может повлиять на конечный результат. Таким образом, целью настоящей работы являлось исследование острого эффекта этанола на фазическое высвобождения дофамина в области прилежащего ядра на свободноподвижных животных c помощью метода FSCV.
МЕТОДЫ ИССЛЕДОВАНИЯ
Изготовление электродов
Датчик для детекции и измерения концентрации дофамина представляет собой микроэлектрод, изготовленный из углеродного волокна, помещенного в капилляр из диоксида кремния (Polymicro Technologies, США), соединенный с коннектором (Multicomp by Newark element14, США) [24, 25]. Углеродное волокно диаметром 7 мкм (Goodfellow, Oakdale, PA, США) вставляли в капилляр длиной 8 мм (Polymicro Technologies, США) при погружении в изопропанол, таким образом, чтобы волокно выступало с двух сторон. Один конец микродатчика затем герметизировали двухкомпонентной эпоксидной смолой Devcon (IWT Performance Polymers, FL, США) и давали высохнуть сутки. На другом конце капилляра был закреплен коннектор в контакте с углеродным волокном, обработанным серебряной эпоксидной смолой (8331; MG Chemicals, BC, Канада). После отверждения в течение ночи место соединения коннектора и капилляра было изолированно слоем из двухкомпонентной эпоксидной смолы Devcon (IWT Performance Polymers, FL, США). После дополнительных двенадцати часов высыхания изготовление хронического микросенсора было завершено путем обрезки экспонированного углеродного волокна до желаемой длины (120 мкм). Перед экспериментом регистрирующие электроды из углеродного волокна были откалиброваны in vitro с использованием раствора с известной концентрацией DA (1 мкМ). Полученный калибровочный коэффициент был использован для нормализации записей сигналов DA in vivo.
Биполярный стимулирующий электрод (Plastics One, VA) подрезался до необходимой длины 8.8 мм. Референсный электрод, изготовленный из изолированной серебряной проволоки, соединенной с коннектором, очищался от пленки и помещался на сутки в раствор 1N HCL.
Операция
Все исследования на животных проводились в соответствии с принципами Базельской декларации и рекомендациями Этического комитета в области исследований на животных Санкт-Петербургского государственного университета.
Самцов крыс линии Спрег–Доули массой от 300 г до 350 г анестезировали изофлюраном, брили и помещали в стереотаксическую установку. Скальп обрабатывали 10%-ным раствором йода и разрезали, чтобы обнажить череп. Три отверстия были просверлены и очищены от твердой мозговой оболочки: для микроэлектрода в области NAcc (AP + 1.3 мм, ML + 1.3 мм от брегмы), для хлорированного референсного электрода Ag/AgCl в контралатеральной области, для биполярного стимулирующего электрода (Plastics One, VA) в области VTA (AP – 5.2 мм, ML + 1 мм от брегмы). Несколько дополнительных отверстий были просверлены для анкерных винтов. После закрепления анкерных винтов, электроды опускались на соответствующую глубину: 7.4 мм для микроэлектрода, 8.8 мм для стимулирующего электрода и 3 мм для референсного электрода относительно кости черепа. Для закрепления использовался стоматологический цемент (Lang Dental, США). Для заживления раны животное оставлялось на 3–4 нед.
Экспериментальная сессия
Животное помещалось в специальную камеру, расположенную в клетке Фарадея (90 × 100 см), и подключалось к вольтаметрической установке. Дофамин вызывался электрической стимуляцией VTA и измерялся в NAcc с использованием FSCV. Вольтаметрические записи проводились на микроэлектроде из углеродного волокна каждые 100 мс с применением треугольной формы волны (от –0.4 В до +1.3 В vs. Ag/AgCl, 400 В/с). Дофамин был идентифицирован с помощью циклической вольтамперограммы, характеризующейся определенными пиками окисления и восстановления при +0.6 и –0.2 В соответственно (vs. Ag/AgCl референсного электрода). После установления стабильных сигналов c разницей не более 10% стимуляция (60 импульсов, 60 Гц, 300 мкA, 4 мс/фаза, monophasic) применялась каждые 10 мин в течение 30 мин до и через 1 ч после введения этанола (0.5 г/кг, внутрибрюшинно).
Фармакологическая верификация дофамина
Для фармакологической верификации DA крыс через неделю после экспериментальной сессии анестезировали уретаном (1.5 г/кг, внутрибрюшинно) и закрепляли в стереотаксическую установку. Высвобождение дофамина вызывалось электрической стимуляцией VTA с теми же параметрами, что и для экспериментальной сессии и измерялось в NAcc с использованием FSCV. Физиологический раствор или раклоприд (2 мг/кг, внутрибрюшинно) вводили после того, как был установлен стабильный ответ DA на электростимуляцию (не менее 3-х измерений с отклонением не более 10%), и записи проводились каждые 10 мин в течение 1 ч.
Анализ данных
Graph Pad Prism (GraphPad Software версия 6.07, CA, США) использовался для статистического анализа данных и создания графиков. Данные, полученные в вольтаметрических экспериментах, были проанализированы с помощью двухфакторного дисперсионного анализа (ANOVA). При обнаружении значимых взаимодействий или основных эффектов групповые различия были проверены с использованием post hoc анализа Бонферрони. Данные представлены как среднее значение ±SEM, критерий значимости был установлен на уровне р < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
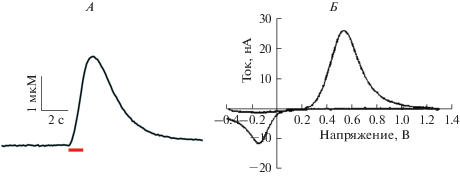
На первом этапе нами было показано, что электрическая стимуляция (1 с, 60 Гц) области VTA свободноподвижных крыс вызывала вольтаметрический сигнал в области NAcc (рис. 1А), характеризующийся определенными пиками окисления и восстановления при +0.6 и –0.2 В соответственно (vs. Ag/AgCl референсного электрода), которые соответствовали DA (рис. 1Б).
Рис. 1.
Повышение концентрации дофамина (DA) в прилежащем ядре (NAcc), вызванное электрической стимуляцией вентральной области покрышки (VTA) длительностью 1 с, 60 Гц и измеренное с помощью быстрой сканирующей циклической вольтаметрии (FSCV). Репрезентативный график показывает изменения концентрации DA с течением времени. Красная линия обозначает продолжительность стимуляции (А). Циклическая вольтамограмма показывает ток, измеренный на полном диапазоне приложенных потенциалов, на пике высвобождения DA (Б).
Так же мы подтвердили, что максимальный ответ DA на электрический стимул может быть достаточно стабильным, если между стимуляциями был сохранен 10-минутный интервал. Как и ожидалось, после введения физиологического раствора никаких изменений в высвобождении DA обнаружено не было (рис. 2).
Рис. 2.
Влияние этанола на электрически индуцированное высвобождение дофамина (DA) в прилежащем ядре (NAcc), измеренное на свободноподвижных крысах.
Острое введение этанола (0.5 г/кг) приводило к значимому снижению высвобождения DA, в то время как изменений в оттоке DA, измеренных после введения физиологического раствора, обнаружено не было. Электростимуляция вентральной области покрышки (VTA) на свободноподвижных крысах проводилась каждые 10 мин до тех пор, пока не был установлен стабильный DA сигнал (не менее 3-х записей с отклонением не более 10%). Сразу после последней базовой записи была сделана внутрибрюшинная инъекция либо физиологического раствора, либо 0.5 г/кг этанола. Ответ DA регистрировался в течение 1 часа после инъекции. Значения представлены в виде среднего ± SEM. Черная стрелка указывает на инъекцию. Количество крыс в каждой группе n = 8, ***р < 0.001; *р < 0.05.

Таким образом, стабильность вызванного сигнала DA позволила нам достоверно оценить изменения динамики DA под действием этанола. В нашем исследовании мы показали, что острая инъекция этанола (0.5 г/кг, внутрибрюшинно) на свободноподвижных крысах приводит к значимому снижению вызванного электростимуляцией DA, измеренного FSCV в NAcc (рис. 2). С помощью двухфакторного дисперсионного анализа был рассчитан основной эффект препарата (F(1,14) = 26.98; p = 0.0001) и значимое взаимодействие (F(8,11) = 4.22; p = 0.0002). Эти данные согласуются с предыдущими экспериментами, проведенными на анестезированных животных. Для фармакологической верификации DA был использован антагонист D2 рецептора, раклоприд, который способен модулировать высвобождение дофамина посредством блокады ауторецепторов (рис. 3). Двухфакторный дисперсионный анализ показал как основное влияние времени (F(8,64) = 51.94; р < 0.0001), препарата (F(1,8) = 395.7; р < 0.0001), так и значимое взаимодействие (F(8,64) = = 55.53; р < 0.0001). Статистический анализ выявил, что уровень DA у животных, получающих раклоприд (р < 0.0001), значительно отличается от группы с введением физиологического раствора. Таким образом, наблюдаемый эффект подтверждает, что вещество, обнаруженное во время электрической активации VTA, представляет собой именно DA, а не норадреналин.
Рис. 3.
Фармакологическая верификация высвобождения дофамина (DA) в прилежащем ядре (NAcc). Электростимуляция вентральной области покрышки (VTA) на анестезированных крысах проводилась каждые 10 мин до тех пор, пока не был установлен стабильный DA сигнал (не менее 3-х записей с отклонением не более 10%). Сразу после последней базовой записи была сделана внутрибрюшинная инъекция физиологического раствора или раклоприда (2 мг/кг). DA ответ был зарегистрирован в течение 1 ч после инъекции. Данные представлены в виде среднего ± SEM. n = 5 крыс для каждой группы. ****р < 0.0001.

На сегодняшний день хорошо известно, что этанол обладает двухфазным действием. Электрофизиологические данные свидетельствуют о том, что острое введение этанола стимулирует передачу DA. Но используя этот метод, мы не можем видеть, что происходит в терминальных окончаниях нервных клеток. Данные, полученные с использованием микродиализа, свидетельствуют о двухфазном дофаминергическом ответе на этанол, с увеличением внеклеточного содержания DA в NAcc после введения этанола от низких до умеренных доз [16] и без эффекта [17] или уменьшении внеклеточной концентрации DA в более высоких дозах [18]. Но микродиализ предоставляет информацию об изменениях внеклеточного уровня DA, которые регулируются множеством механизмов, включая высвобождение, поглощение, синтез и метаболизм [26]. Результаты вольтаметрических экспериментов показали, что этанол вызывает дозозависимое снижение концентрации DA, вызванного электрической стимуляцией [19, 26–28]. Используя FSCV in vitro, было показано, что низкие и умеренные концентрации этанола (20, 45 и 100 мМ) не влияли на вызванное высвобождение DA, в то время как высокие концентрации (150 и 200 мМ) значительно снижали высвобождение DA в NAcc крыс [19] и мышей [28]. Дозозависимый двухфазный эффект влияния этанола на систему DA, по-видимому, вызван различной чувствительностью области клеточных тел и пресинаптических терминальных окончаний к этанолу. Общеизвестно, что существуют несколько компонентов, которые влияют на внеклеточную концентрацию DA. Фаза роста взаимно контролируется высвобождением и поглощением DA, а фаза падения – только поглощением. Следовательно, максимальная концентрация DA может быть уменьшена за счет снижения высвобождения или увеличения поглощения. Снижение электрически вызванного DA под действием этанола не было связано с увеличением скорости поглощения DA или уменьшением биосинтеза, а скорее было связано с прямым подавлением высвобождения [19, 20, 26, 27]. Также было показано, что острое введение этанола не влияет на дофаминовый транспортер (DAT), через который могло бы осуществляться воздействие этанола на систему DA [29]. Следовательно, снижение амплитуды сигнала DA может быть связано с обратной связью с ауторецептором D2, вызванной повышением частоты запуска клеток и повышенными концентрациями DA в синаптической щели NAcc.
Список литературы
McGinnis J.M., Foege W.H. Mortality and morbidity attributable to use of addictive substances in the United States. Proc. Assoc. Am. Physicians. 111: 109–118. 1999.
Koob G.F. A role for GABA mechanisms in the motivational effects of alcohol. Biochem. Pharmacol. 68: 1515–1525. 2004.
Siggins G.R., Roberto M., Nie Z. The tipsy terminal: presynaptic effects of ethanol. Pharmacol. Ther. 107: 80–98. 2005.
Woodward J.J. Ethanol and NMDA receptor signaling. Crit. Rev. Neurobiol. 14: 69–89. 2000.
Grant K.A. The role of 5-HT3 receptors in drug dependence. Drug Alcohol. Depend. 38: 155–171. 1995.
Weinshenker D., Rust N.C., Miller N.S., Palmiter R.D. Ethanol – associated behaviors ofmice lacking norepinephrine. J. Neurosci. 20: 3157–3164. 2000.
Edwards S., Guerrero M., Ghoneim O.M., Roberts E., Koob G.F. Evidence that vasopressin V1b receptors mediate the transition to excessive drinking in ethanol-dependent rats. Addict. Biol. 17: 76–85. 2012.
Nam H.W., Bruner R.C., Choi D.S. Adenosine signaling in striatal circuits and alcohol use disorders. Mol. Cells. 36, 195–202. 2013.
Weiss F., Porrino L.J. Behavioral neurobiology of alcohol addiction: recent advances and challenges. J. Neurosci. 22: 3332–3337. 2002.
Gonzales R.A., Job M.O., Doyon W.M. The role of mesolimbic dopamine in the development and maintenance of ethanol reinforcement. Pharmacol. Ther. 103: 121–146. 2004.
Koob G.F. Addiction is a reward deficit and stress surfeit disorder. Front. Psychiatry. 4: 72. 2013.
Berke J.D., Hyman S.E. Addiction, dopamine, and the molecular mechanisms of memory. Neuron. 25: 515–532. 2000.
Grace A.A. The tonic/phasic model of dopamine system regulation and its implications for understanding alcohol and psychostimulant craving. Addiction. 95 (Suppl. 2): S119–S128. 2000.
Stuber G.D., Britt J.P., Bonci A. Optogenetic modulation of neural circuits that underlie reward seeking. Biol. Psychiatry. 71: 1061–1067. 2012.
Brodie M.S., Pesold C., Appel S.B. Ethanol directly excites dopaminergic ventral tegmental area reward neurons. Alcohol. Clin. Exp. Res. 23: 1848–1852. 1999.
Yoshimoto K., McBride W.J., Lumeng L., Li T.K. Alcohol stimulates the release of dopamine and serotonin in the nucleus accumbens. Alcohol. 9: 17–22.1991.
Blanchard B.A., Steindorf S., Wang S., Glick S.D. Sex differences in ethanolinduced dopamine release in nucleus accumbens and in ethanol consumption in rats. Alcohol. Clin. Exp. Res. 17: 968–973. 1993.
Imperato A., Di Chiara G. Preferential stimulation of dopamine release in the nucleus accumbens of freely moving rats by ethanol. J. Pharmacol. Exp. Ther. 239: 219–228. 1986.
Budygin E.A., Phillips P.E., Wightman R.M., Jones S.R. Terminal effects of ethanol on dopamine dynamics in rat nucleus accumbens: an in vitro voltammetric study. Synapse. 42(2): 77–79. 2001.
Jones S.R., Mathews T.A., Budygin E.A. Effect of moderate ethanol dose on dopamine uptake in rat nucleus accumbens in vivo. Synapse. 60: 251–255. 2006.
Schilaty N.D., Hedges D.M., Jang E.Y., Folsom R.J., Yorgason J.T., McIntosh J.M., Steffensen S.C. Acute Ethanol Inhibits Dopamine Release in the Nucleus Accumbens via a6 Nicotinic Acetylcholine Receptors. J. Pharmacol. Exp. Therap. 349: 559–567. 2014.
Shnitko T.A., Kennerly L.C., Spear L.P., Robinson D.L. Ethanol reduces evoked dopamine release and slows clearance in the rat medial prefrontal cortex. Alcohol. Clin. Exp. Res. 38: 2969–2977. 2014.
Shnitko T.A., Spear L.P., Robinson D.L. Adolescent binge-like alcohol alters sensitivity to acute alcohol effects on dopamine release in the nucleus accumbens of adult rats. Psychopharmacology (Berl). 233: 361–371. 2016.
Swiergiel A.H., Palamarchouk V.S., Dunn A.J. A new design of carbon fiber microelectrode for in vivo voltammetry using fused silica. J. Neurosci Methods. 73(1): 29–33. 1997.
Gerhardt G.A., Ksir C., Pivik C., Dickinson S.D., Sabeti J., Zahniser N.R. Methodology for coupling local application of dopamine and other chemicals with rapid in vivo electrochemical recordings in freely-moving rats. J. Neurosci. Methods. 87(1): 67–76. 1999.
Budygin E.A., Phillips P.E., Robinson D.L., Kennedy A.P., Gainetdinov R.R., Wightman R.M. Effect of acute ethanol on striatal dopamine neurotransmission in ambulatory rats. Pharmacol. Exp. Ther. 297(1): 27–34. 2001.
Budygin E.A., John C.E., Mateo Y., Daunais J.B., Friedman D.P., Grant K.A., Jones S.R. Chronic ethanol exposure alters presynaptic dopamine function in the striatum of monkeys: a preliminary study. Synapse. 1: 50(3): 266–268. 2003.
Budygin E.A., Mathews T.A., Lapa G.B., Jones S.R. Local effects of acute ethanol on dopamine neurotransmission in the ventral striatum in C57BL/6 mice. Eur. J. Pharmacol. 31: 523(1–3): 40–5. 2005.
Mathews T.A., John C.E., Lapa G.B., Budygin E.A., Jones S.R. No role of the dopamine transporter in acute ethanol effects on striatal dopamine dynamics. Synapse. 15: 60(4): 288–294. 2006.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


