Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 8, стр. 1013-1020
Влияние центральных β-адренергических рецепторов на высвобождение кортикостерона во время стресса у мышей
Э. А. Андяржанова 1, 2, *, С. Т. Вотьяк 3
1 НИИ фармакологии им. В.В. Закусова
Москва, Россия
2 University Hospital Bonn, Clinic of Psychiatry and Psychotherapy
Bonn, Германия
3 Max Planck Institute of Psychiatry and Psychotherapy
Munich, Германия
* E-mail: Elmira.Anderzhanova@ukbonn.de
Поступила в редакцию 24.05.2019
После доработки 12.06.2019
Принята к публикации 12.06.2019
Аннотация
Активность β-адренергических рецепторов может быть ключевым фактором взаимодействия сигналинга кортикостерона и норадреналина при стрессе, а также определять терапевтическую эффективность пропранолола при лечении постравматического стрессового заболевания. Остается неясным, связана ли фармакологическая активность пропранолола с изменениями в секреции кортикостерона и какую роль в этом играют периферические и центральные β-адренергические рецепторы. С помощью метода внутримозгового микродиализа была проведена оценка влияния ингибиторов β-адренергических рецепторов пропранолола и соталола на стимулированную стрессом секрецию кортикостерона у мышей линии С57Bl/6N. Полученные данные показали, что системное применение пропранолола в дозе 10 мг/кг, но не соталола, неколько уменьшало, но не предотвращало усиление секреции кортикостерона при стрессе, смоделированном в тесте “приподнятая платформа”, что свидетельствует о влиянии центральных β-адренергических рецепторов на высвобождение кортикостерона во время стресса у мышей.
Психоэмоциональный стресс выступает важнейшей причиной развития психопатологии у людей. У животных хронический стресс приводит к формированию депрессивно-подобного поведения и тревожности. Однократный стресс высокой интенсивности вызывает поведенческие нарушения подобные симптомам постравматического стрессового расстройства (ПТСР) [1, 2].
Наибольшее внимание в патогенезе ассоциированных со стрессом психопатологических состояний уделяется взаимодействию сигнала, опосредуемого гормонами гипоталамо-гипофизарно-адреналовой (ГГА) системы (прежде всего, кортикостероном) и моноаминами (норадреналином, дофамином и серотонином) [3, 4]. Обсуждается, в частности, значимость реактивности ГГА системы и норадренергической нейропередачи во время стресса в определении выраженности последствий стресса. Так, в модели ПТСР у мышей базальная и стимулированная секреция кортикостерона отрицательно коррелировала с величиной стартл-рефлекса измеренном через месяц после стресса [5]. В нашем предыдущем исследовании было показано, что величина высвобождения норадреналина во время стресса, вызываемого электрошоком конечностей, нелинейно коррелировала с выраженностью замирания и величиной стартл-рефлекса, определенных через 1 месяц латентного периода [6].
Блокатор β-адренергических рецепторов пропранолол был предложен в качестве средства терапии ПТСР [7]. При применении пропранолола во время латентного периода наблюдают усиление экстинкции (гашения) памяти о травмирующем эпизоде [8]. Как предполагается, терапевтический эффект пропранолола зависит от его связывания с центральными β-адренергическими рецепторами [9–11]. Однако остается неясным, связан ли этот эффект с изменениями в активности ГГА системы [12] и имеет ли преимущества использование пропранолола в качестве терапевтического средства острой фазы ПТСР [13].
Целью данного исследования была оценка влияния неселективного ингибитора β-адренергических рецепторов пропранолола на секрецию кортикостерона у мышей во время психологического стресса, смоделированном в тесте “приподнятая платформа”, в сравнении с действием ингибитора β-адренергических рецепторов соталола, не проникающего через гематоэнцефалический барьер (ГЭБ).
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Использовали мышей линии С57Bl/6N возраста 10–12 недель из питомника Martinsried (Германия). Животных содержали в стандартных условиях вивария при естественной суточной смене освещения день/ночь и свободном доступе к воде и пище. Содержание животных соответствовало правилам надлежащей лабораторной практики, утвержденной European Community Council Directive 2010/63/EEC. При проведении экспериментов были приняты меры, исключающие излишние физические страдания или повреждение животных.
Схема эксперимента. Для того чтобы провести оценку динамических изменений в секреции кортикостерона использовали метод мозгового микродиализа [14]. Кортикостерон проникает через ГЭБ, поэтому измеряемое в мозге содержание гормона полностью отражает изменения в его содержании в плазме крови [14]. При этом определение измерений в гиппокампе оправдано тем, что гиппокамп является структурой, вовлеченной в патогенез ассоциированных со стрессом психопатологий.
За 7 дней до эксперимента животным имплантировали канюлю микродиализной пробы. За день до эксперимента проводили инсталляцию микродиализной пробы. В первый день экспермента оценивали базальную секрецию кортикостерона, для чего собирали микродилизаты (20-минутные фракции) при базальных условиях, когда животное находилось в домашней клетке. За 20 мин до помещения мыши на приподнятую платформу вводили исследуемые вещества. Пропранолола гидрохлорид, 10 мг/кг (Cat.N. 0835, Tocris, Германия), соталола гидрохлорид, 10 мг/кг (Cat.N. 0952, Tocris, Германия) или физраствор вводили внутрибрюшинно (в.б.) в объеме 10 мл/кг. Животных подвергали стрессу в течение 20 мин, после чего их возвращали в домашнюю клетку и продолжали сбор микродилизатов. Микродилизаты замораживали и хранили при –80°С до момента анализа. На второй день эксперимента все шаги указанного протокола повторяли. После завершения микродиализа животных декапитировали, мозг извлекали и замораживали, фактическую локализацию микродиализных проб удостоверяли в серии криосекций.
Тест “приподнятая платформа”. Аппаратная установка представляла собой круглую платформу из нескользского непрозрачного пластика диаметром 10 см, помещенную на вертикальном шесте на расстоянии 60 см от уровня пола и 20 см от стенок аппаратной камеры [15]. Тест проводили при освещении 250 люкс. Для стрессирования мышь аккуратно помещали в центр платформе и оставляли на 20 мин. В течение первых 10 мин пребывания на платформе животное демонстрировало выраженную реакцию замирания (отсутствие любых движений за исключением тех, которые были связаны с дыхательной экскурсией грудной клетки), что на оценочном уровне удостоверяло эффективность стрессирования.
Внутримозговой микродиализ. Стереотаксическую имплантацию проводили при общей анестезии изофлураном 1–2% v/v в воздухе (Abbot, Индия) и аналгезии с помощью Metacam® (0.5 мг/кг, в.б., Boehringer Ingelheim, Германия) и Novalgin® (200 мг/кг, подкожно, Sanofi-Aventis, Германия). Локальную анестезию проводили 0.5%-ным раствором лидокаина (Xylocaine®, AstraZeneca Int.). Животных фиксировали в стереотаксической рамке (TSE Systems Inc., Германия). Постоянную температуру тела (37°C) поддерживали при помощи термостатируемого коврика (Harvard Apparatus, США). Микродиализные канюли (MAB4.15.IC, Microbiotech Se, Швеция) имплантировали в правый гиппокамп в соответствии с координатами: –3.0 AP, ML +3.0 ML, DV –1.8 DV [16]. Имплант фиксировали стальными микрошурупами с помощью быстрополимеризующегося зубного цемента (Vivadent, Германия). По окончании операции мышь перемещали в микродиализную клетку размерами (16 × 16 × 32 см3) сделанную из прозрачного плексигласа. Воду и корм предоставляли ad libitum. В течение 3 дней после операции при признаках болевого синдром (т.е., низком уровне груминга, агрессивном поведеним, общей заторможенности и снижении потребления воды и корма) мышам подкожно водили Metacam® в дозе 0.5 мг/кг.
За день до эксперимента животных подвергали кратковременной (1–2 мин) анестезии изофлураном (3–4% v/v в воздухе), микродиализную пробу (MAB4.15.3, 15 кДа, 3 мм, Microbiotech Se, Швеция), перфузируемую стерильной искусственной цереброспинальной жидкостью с помощью шприцевого насоса (Harvard Apparatus, США), инсталлировали в канюлю. Перфузионная линия состояла из калиброванных пластиковых (FEP) трубочек и вертлюга для жидкостей с низким внутренним объемом TCS2-23 (Eicom, Япония). Фиксирование животного осуществлялось с помощью стальной проволоки, что, в сочетании с вертлюгом, давало возможность свободного перемещения животного по микродиализной клетке и переноса его на приподнятую платформу. До момента начала эксперимента и между двумя экспериментальными днями скорость перфузии составляла 0.3 мкл/мин; рабочая скорость перфузии составляла 1.5 мкл/мин.
Радиоиммунологическое определение кортикостерона. Определение содержания кортикостерона проводили с использованием набора реагентов MPBiomedicals, США, согласно протоколу производителя. Декларируемый предел детекции составлял 7 нг/мл. Определение концентраций проводили путем сравнения с калибровочной кривой.
Статистическая обработка результатов. Обработку полученных данных проводили в программе “Graph Pad Prizm 7” GraphPad Software, La Jolla California, США, www.graphpad.com). Проверка результатов на нормальность распределения осуществляли по критерию Шапиро–Уилка и Колмогорова–Смирнова. Различия между дисперсиями среднего устанавливали методом двухфакторного дисперсионного анализа (время × препарат или время × день) с последующим post-hoc анализом (тест Туки). Данные представлены в виде средних значений с указанием стандартной ошибки среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
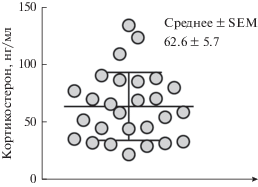
Базальные уровни свободного кортикостерона, измеренные в гиппокампе мышей линии С57Bl/6N, составляли 62.6 ± 5.7 нг/мл (рис. 1). Минимум составил 20.9 нг/мл, максимум – 132.8 нг/мл, медиана – 57.7 нг/мл. Проверка на нормальность подтвердила соответствие распределения значений кривой Гаусса (тест Шапиро–Уилка: W = 0.94, p = 0.15, тест Колмогорова–Смирнова: дистанция = 0.10, p > 0.1).
Рис. 1.
Распределение значений концентраций свободного кортикостерона, измеренных в гиппокампе мышей линии С57Bl/6N. SEM – стандартная ошибка среднего.
Стресс, вызываемый помещением мыши на приподнятую платформу, сопровождался транзиторным увеличением секреции кортикостерона, что наблюдалось в оба экспериментальных дня. Содержание свободного кортикостерона в микродиализатах гиппокампа мышей, которым вводили физраствор, по сравнению с базальными значениями было статистически значимо больше (p < 0.001) в течение 20-минутного стресса и следующих за ним 40 мин (микродиализные фракции 5, 6 и 7). Максимальное изменение в 4–4.5 раз по сравнению с базальными уровнями достигалось через 20 мин после окончания стресса (фракция 6) (рис. 2).
Рис. 2.
Изменения в уровнях свободного кортикостерона в гиппокампе мышей линии C57Bl/6N при стрессе, смоделированном в тесте “приподнятая платформа” (ПП) в условиях системного введения β-адреноблокаторов. Стрелки – момент в.б. введения препаратов или физраствора. Вертикальные столбцы – временные промежутки, в течение которых мышь находилась на ПП. Горизонтальная линия соответствует среднему базальному содержанию кортикостерона в микродиализатах. * – p < 0.05, *** – p < 0.001 при сравнении “пропранолол” vs “физраствор”.
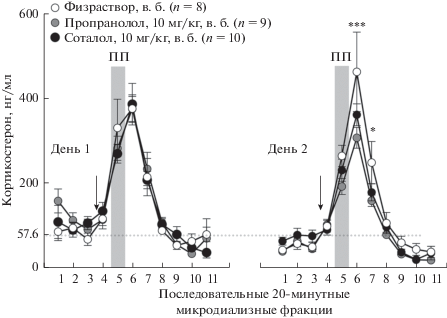
В первый день наблюдения не было обнаружено влияния пропранолола или соталола, по сравнению с эффектом физраствора, на вызванное стрессом повышение уровней кортикостерона (рис. 2, левая панель). Двухфакторый дисперсионный анализ указал только на значимость эффекта времени в отношении измеряемых уровней гормона (время: F(10,240) = 47.27, p < 0.001; препарат: F(2,240) = 0.15, p = 0.86, взаимодействие факторов: F(20,240) = 0.56, p = 0.94). Анализ множественных сравнений не выявил значимых различий.
При анализе данных, полученных во второй день наблюдения, было найдено статистически значимое влияние пропранолола на вызванное стрессом повышение уровней кортикостерона по сравнению с эффектом физраствора (рис. 2, правая панель). Двухфакторный дисперсионный анализ указал на значимость эффекта времени и взаимодействия факторов времени и препарата (время: F(10,210) = 98.35, p < 0.001; препарат: F(2,21) = 2.22, p = 0.13; взаимодействие факторов: F(20,210) = 1.89, p = 0.02). Результаты post-hoc множественных сравнений показали, что соталол не оказывал влияния, а введение пропранолола сопровождалось статистически значимым, по сравнению с измеренным у мышей, получавших физраствор, уменьшением содержания кортикостерона через 20 и 40 мин после окончания стресса (p < 0.001, p = 0.02). Поскольку эта разница могла быть следствием повышения уровня секреции кортикостерона на второй день у мышей, получавших физраствор, было проведено сравнение между динамикой высвобождения кортикострона в ответ на стресс в первый и во второй день эксперимента у животных контрольной группы. Результаты двухфакторного дисперсионного анализа (время × день) показали, что между измеренными уровнями кортикостерона при сравнении между соответствующими по времени микродиализными фракциями не было статистически значимых отличий (время: F(10,130) = 37.1, p < 0.001; день: F(1,13) = 0.18, p = 0.68; взаимодействие факторов: F(1,13) = 1.16, p = 0.33). Следовательно, наблюдаемые различия между группами мышей, получавших физраствор и пропранолол, с большим основанием можно отнести к действию пропранолола.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В отличие от пропранолола, который легко проникает в мозг, антагонист β-адренорецепторов соталол характеризуется незначительной проницаемостью ГЭБ. Наши данные, удостоверяющие эффект пропранолола, но не соталола, в отношении стимулированной секреции кортикостерона, указывают на то, что β-адренорецепторы, экспрессирующиеся в мозге, оказывают влияние на уровень активности ГГА при стрессе. Можно предположить, что центральные β-адренорецепторы вовлечены в осуществление негативной обратной связи. Известно, что взаимодействие глюкокортикоидных рецепторов и β-адренорецепторов на уровне миндалевидного тела функционально значимо и опосредует консолидацию памяти о стрессе [17, 18]. Поскольку экспрессирующие кортикотропин нейроны миндалевидного тела посылают свои проекции в содержащие ГАМК-ергические нейроны паравентрикулярного ядра гипоталамуса, при ингибировании β-адренорецепторов возможно уменьшение активности ГГА системы.
В нашем эксперименте эффект пропранолола был обнаружен во время повторного стрессирования. Ранее мы показали, что при повторении стресса высвобождение норадреналина в префронтальной коре мышей уменьшается [6]. Вызываемые стрессом нейропластические изменения в норадренергической системе, например, в уровнях экспрессии рецепторов, могут определять не только изменение локальной регуляциии высвобождения нейромедиатора, но и большую чувствительность к пропранололу за счет увеличения числа рецепторов, с которыми провзаимодействовал пропранолол.
Функциональная значимость изменения активности центральных β-адренорецепторов продемонстрирована в экспериментах с введением пропранолола в гиппокамп сразу после стресса, вызываемого электрошоком конечностей. Локальный эффект пропранолола заключался в уменьшении консолидации памяти о травмирующем событии [19].
Обнаруженный нами эффект пропранолола в отношении секреции кортикостерона был проявлен во время небольшого временного промежутка. Поскольку для моноаминов характерно существование “окна” внеклеточных концентраций, в пределах которого происходит оптимальное исполнение зависимых от высвобождения нейромедиатора функций [20, 21], неэффективность пропранолола может иметь отношение к использованной дозе – 10 мг/кг [6]. Однако можно также предполагать, что терапевтическое действие пропранолола не зависит от его влияния на активность ГГА системы и опосредуется, например, изменениями в когнитивных функциях [22].
Таким образом, полученные нами данные удостверяют влияние центральных β‑адренергических рецепторов на секрецию кортикостерона во время стресса. Этот эффект может быть опосредован вовлечением β-адренергических рецепторов в осуществление негативной обратной связи при регуляции активности ГГА системы.
Список литературы
Hunter R.G., McEwen B.S. Stress and anxiety across the lifespan: Structural plasticity and epigenetic regulation. Epigenomics. 5(2): 177–194. 2013.
Saveanu R.V., Nemeroff C.B. Etiology of depression: Genetic and environmental factors. Psychiatr. Clin. North Am. 35(1): 51–71. 2012.
Binder E.B., Holsboer F. Low cortisol and risk and resilience to stress-related psychiatric disorders. Biol. Psychiatry. 71(4): 282–283. 2012.
Haase J., Brown E. Integrating the monoamine, neurotrophin and cytokine hypotheses of depression-a central role for the serotonin transporter? Pharmacol. Ther. 147: 1–11. 2015.
Danan D., Matar M.A., Kaplan Z., Zohar J., Cohen H. Blunted basal corticosterone pulsatility predicts post-exposure susceptibility to PTSD phenotype in rats. Psychoneuroendocrinology. 87: 35–42. 2018.
Kao C.Y., Stalla G., Stalla J., Wotjak C.T., Anderzhanova E. Norepinephrine and corticosterone in the medial prefrontal cortex and hippocampus predict PTSD-like symptoms in mice. Eur. J. Neurosci. 41(9): 1139–1148. 2015.
Brunet A., Saumier D., Liu A., Streiner D.L., Tremblay J., Pitman R.K. Reduction of PTSD Symptoms With Pre-Reactivation Propranolol Therapy: A Randomized Controlled Trial. Am. J. Psychiatry. 175(5): 427–433. 2018.
Giustino T.F., Fitzgerald P.J., Maren S. Revisiting propranolol and PTSD: Memory erasure or extinction enhancement? Neurobiol. Learn. Mem. 130: 26–33. 2016.
Морозов И.С., Бобков И.Г., Неробкова Л.Н. Роль периферических адренореактивных структур в реализации расстройств моторных компонентов оперантной деятельности крыс в условиях эмоционального стресса. Бюл. эксперим. биол. мед. 95(5): 39–41. 1983. [Morozov I.S., Bobkov Iu.G., Nerobkova LN. Role of peripheral adrenoreactive structures in the etiology of disorders of the motor components of rat operant behavior during emotional stress. Bull. Eksp. Biol. Med. 95(5): 39–41. 1983 (In Russ.)].
Dietl H. Regulation of the release of neuronally localized corticosterone in rat forebrain areas by catecholamines. Neurosci. Lett. 77(1): 76–80. 1987.
Roozendaal B., Okuda S., Van der Zee E.A., McGaugh J.L. Glucocorticoid enhancement of memory requires arousal-induced noradrenergic activation in the basolateral amygdala. Proc. Natl. Acad. Sci. USA. 103(17): 6741–6746. 2006.
Selvage D. Roles of the locus coeruleus and adrenergic receptors in brain-mediated hypothalamic-pituitary-adrenal axis responses to intracerebroventricular alcohol. Alcohol. Clin. Exp. Res. 36(6): 1084–1090. 2012.
Nugent N.R., Christopher N.C., Crow J.P., Browne L., Ostrowski S., Delahanty D.L. The efficacy of early propranolol administration at reducing PTSD symptoms in pediatric injury patients: A pilot study. J. Trauma. Stress. 23 (2): 282–287. 2010.
Qian X., Droste S.K., Gutièrrez-Mecinas M., Collins., Kersanté F., Reul J.M., Linthorst A.C. A rapid release of corticosteroid-binding globulin from the liver restrains the glucocorticoid hormone response to acute stress. Endocrinology. 152(10): 3738–3748. 2011.
Miyata S, Shimoi T, Hirano S, Yamada N, Hata Y, Yoshikawa N, Ohsawa M, Kamei J. Effects of serotonergic anxiolytics on the freezing behavior in the elevated open-platform test in mice. J. Pharmacol. Sci. 105(3): 272–278. 2007.
Paxinos G., Franklin K.B.J. Paxinos and Franklin’s the mouse brain in stereotaxic coordinates. Fourth edition. Amsterdam, Boston, Heidelberg. Elsevier, Acad. Press. 2013.
Liu X.H., Zhu R.T., Hao B., Shi Y.W., Wang X.G., Xue L., Zhao H. Norepinephrine Induces PTSD-Like Memory Impairments via Regulation of the β-Adrenoceptor-cAMP/PKA and CaMK II/PKC Systems in the Basolateral Amygdala. Front. Behav. Neurosci. 13: 43. 2019.
Roozendaal B., Quirarte G.L., McGaugh J.L. Glucocorticoids interact with the basolateral amygdala beta-adrenoceptor-cAMP/cAMP/PKA system in influencing memory consolidation. Eur. J. Neurosci. 15(3): 553–560. 2002.
Zhu R.T., Liu X.H., Shi Y.W., Wang X.G., Xue L., Zhao H. Propranolol can induce PTSD-like memory impairments in rats. Brain Behav. 8(2): e00905. 2018.
Aston-Jones G., Cohen J.D. An integrative theory of locus coeruleus-norepinephrine function: adaptive gain and optimal performance. Annu. Rev. Neurosci. 28: 403–450. 2005.
Cools R., D’Esposito M. Inverted-U-shaped dopamine actions on human working memory and cognitive control. Biol. Psychiatry. 69(12): e113-125. 2011.
Mahabir M., Ashbaugh A.R., Saumier D., Tremblay J. Propranolol’s impact on cognitive performance in post-traumatic stress disorder. J. Affect. Disord. 192: 98–103. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


