Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 8, стр. 1002-1012
ЭЭГ активность мозга, предшествующая спонтанному восстановлению психомоторной деятельности после эпизодов микросна
Е. А. Черемушкин 1, *, Н. Е. Петренко 1, М. С. Генджалиева 2, И. А. Яковенко 1, Д. Г. Малахов 3, В. Б. Дорохов 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
3 НИЦ “Курчатовский институт”
Москва, Россия
* E-mail: ivnd@mail.ru
Поступила в редакцию 28.05.2019
После доработки 18.06.2019
Принята к публикации 18.06.2019
Аннотация
В опытах с дневным сном по данным, полученным у 23 испытуемых, изучали изменения спектральных характеристик ЭЭГ в период, предшествующий моменту пробуждения, который регистрировался по восстановлению выполнения психомоторного теста. В течение одного короткого эксперимента с его помощью можно исследовать несколько последовательных эпизодов: исчезновения сознательной когнитивной деятельности при засыпании и кратковременных эпизодов микросна и ее возобновления при самопроизвольном пробуждении. Изучение характеристик ЭЭГ перед пробуждением важно для оценки переходных процессов цикла сон–бодрствование, определяющих степень восстановления психомоторной деятельности после пробуждении и уровень сознания. Показано, что альфа-активации, наблюдаемой при пробуждении, часто предшествует появление К-комплексов разной степени выраженности, на которые накладываются низкочастотные альфа-колебания, они могут рассматриваться как медленные сигма-веретена. Этот паттерн, вероятнее всего, отражает действие универсального таламо-кортикального активирующего механизма, одинакового как для ночного, так и для дневного сна, независимо от того, следует ли за ним период кратковременной активации с последующим сном, или далее начинается осуществление когнитивной деятельности.
Нейрофизиологические исследования переходных состояний цикла сон–бодрствование дают важную информацию о мозговых механизмах, поддерживающих этот цикл, и расширяют наши представления о деятельности мозга в целом. Для исследования нейрональных коррелятов сознания эффективной моделью является сравнение состояний сна и бодрствования, сознание исчезает при засыпании и восстанавливается при пробуждении [1–4]. При этом необходимо упомянуть, что в отношении тождественности и различия понятий “сознание” (consciousness) и “бодрствование” (awareness) не существует однозначного мнения, и вопрос этот является предметом дискуссии [5]. Отметим, что идея связать паттерны ЭЭГ в цикле сон–бодрствование с уровнем сознания появилась еще в середине 50-ых годов прошлого века [6].
Переход от бодрствования ко сну (состояние дремоты) сопровождается характерными физиологическими изменениями в биоэлектрической активности мозга, электроокулограмме (ЭОГ), электромиограмме (ЭМГ), сердечном ритме и описан достаточно подробно [7]. При этом исследованиям пробуждения уделено существенно меньше внимания. В 70 годах были описаны кратковременные явления, нарушающие непрерывность сна [8, 9]. В ЭЭГ они соответствуют резким и коротким сдвигам в сторону колебаний высокой частоты, которые указывают на кратковременное вторжение бодрствования в сон или, по крайней мере, повышение уровня бдительности. По мнению некоторых авторов, такие пробуждения являются составной частью самой структуры сна [10, 11]. Дальнейшие исследования также преимущественно касались кратковременных периодов активации на разных стадиях сна [12–14].
Изучение спонтанных пробуждений и пробуждений, вызванных внешней стимуляцией, в опытах с ночным сном у больных эпилепсией показали, что частотные характеристики ЭЭГ во время пробуждения отличаются как от состояния бодрствования, так и от сна [15]. В процессе пробуждения электрическая активность таламуса носит стереотипный характер и ее спектральный состав соответствует промежуточному состоянию между бодрствованием и сном. Изменения частотных характеристик ЭЭГ во время пробуждений неоднородны и связаны с такими факторами как стадия сна, зона коры и тип пробуждения (самопроизвольный или вызванный внешней стимуляцией) [15].
Для исследования нейрофизиологических механизмов спонтанного пробуждения был разработан непрерывно-дискретный психомоторный тест [16] с устным счетом последовательностей от 1 до 10, сопровождающимся нажатием на кнопку. Монотонный характер теста вызывает быстрое снижение уровня бодрствования с множественными кратковременными эпизодами засыпания/пробуждения в течение одного часа эксперимента. Наличие нажатий на кнопку является поведенческим показателем возобновления функционирования когнитивных процессов, заторможенных во время сна, что позволяет с большой точностью (около 1 с) анализировать динамику физиологических и психологических процессов, сопровождающих переход от бодрствования ко сну. Момент пробуждения от микроэпизодов сна и возобновления когнитивных действий устного счета и нажатий на кнопку фактически является моментом возникновения сознания. Как полагают авторы, этот тест может быть перспективной моделью и для исследования механизмов сознания в широком общебиологическом плане и для клиники – в качестве модели выхода из бессознательных состояний, таких как кома, вегетативное состояние и др.
В работе [16], было показано наличие двух активационных ЭЭГ паттернов, предшествующих моменту пробуждения и возобновлению нажатий. После микроэпизодов сна из его 1 стадии пробуждению предшествовало появление альфа-веретен, а после микроэпизодов глубокого сна (2 и 3 стадии) перед возобновлением нажатий часто возникал активационный паттерн, состоящий из К-комплекса с наложенными на него альфа-веретенами и включением более высокочастотных составляющих ЭЭГ. Дальнейшие исследования с использованием фМРТ мозга [17] показали, что в момент пробуждения и возобновления нажатий происходит активация в областях правого таламуса, левого клина, мозжечковых зон и стволовых структур.
В упомянутых работах [16, 17] активационные паттерны ЭЭГ, предшествующие пробуждению, оценивались визуально. Задачей этого исследования было изучение изменения спектральных характеристик ЭЭГ в период, предшествующий моменту пробуждения, которые можно считать нейрональными коррелятами активации последовательных уровней сознания, необходимых для выполнения психомоторного теста
МЕТОДЫ ИССЛЕДОВАНИЯ
Испытуемые. Обследовали 23 человека (16 женщин и 7 мужчин, возраст от 19 до 22 лет, все студенты, правши). Они были ознакомлены с процедурой исследования и дали согласие на участие в нем. Исследование соответствовало этическим нормам Хельсинской декларации Всемирной медицинской ассоциации “Этические принципы проведения научных медицинских исследований с участием человека” с поправками 2000 г. и “Правилами клинической практики в Российской Федерации”, утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266. Для оценки параметров ночного сна, предшествующего обследованию, испытуемые заполняли дневник сна [18]; для оценки дневной сонливости использовали опросник KSS (Каролинскую шкалу сонливости).
Процедура исследования. Время эксперимента: с 13.00 до 16.00. Продолжительность – от 55 мин до 1 ч. Обследуемые находились в затемненном, звукоизолирующим и проветриваемом помещении с кушеткой. В помещении поддерживалась постоянная комфортная температура.
Использовали непрерывно-дискретный психомоторный тест разработанный В.Б. Дороховым [16]. Обследуемые считали “про себя” от 1 до 10, одновременно при каждом отсчете они должны были нажимать на кнопку большим пальцем правой руки, зафиксированную на указательном пальце той же руки. Далее они продолжали считать “про себя” от 1 до 10, но уже без нажатий. Чередование счета с нажатиями и без нажатий продолжалось до тех пор, пока обследуемые не засыпали или до конца опыта. В случае засыпания и последующего спонтанного пробуждения они должны были немедленно возобновить выполнения психомоторного теста. В инструкции особо подчеркивалось, что при просыпании надо сначала выполнять счет с нажатием на кнопку и только потом без нажатия.
ЭЭГ с поверхности головы регистрировали от 17 электродов, расположенных в соответствии со схемой 10–20% (F3, F4, F7, F8, Fz, C3, C4, Cz, T3, T4, P3, P4, Pz, T5, T6, O1, O2). Отведение ЭЭГ было монополярным, референтный электрод – объединенный ушной. Также регистрировали электроокулограмму (ЭОГ), миограмму (ЭМГ) и механограмму нажатия на кнопку. Для регистрации нажатий использовали пневматическую кнопку, чувствительную к силе нажатий, которая ранее была разработана для фМРТ-исследования [17]. Одновременно с регистрацией механограммы нажатия на кнопку, регистрировали электромиограмму (ЭМГ) короткой мышцы, отводящей большой палец кисти правой руки (musculus abductor pollicis brevis). Регистрацию всех показателей проводили с помощью системы Neocortex-Pro (“Neurobotics”, Россия). Частота дискретизации – 250 Гц. Полоса пропускания частот: 0.5–70 Гц. ЭЭГ регистрировали с помощью специального шлема с хлорсеребряными электродами, с сопротивлением, не превышающим 5 КОм. Перед выполнением психомоторного теста в течение 5 мин записывали ЭЭГ испытуемого в состоянии спокойного бодрствования при закрытых глазах.
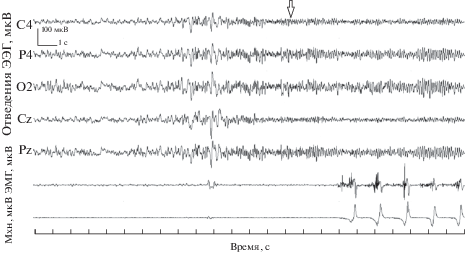
Анализ данных. Анализировали 20-секундные отрезки ЭЭГ в трех состояниях: 1 – спокойного бодрствования, 2 – засыпания, 3 – перед пробуждением. При выборе эпохи анализа мы руководствовались следующим. В статье [15] было показано, что для оценки состояния перед пробуждением достаточно 15 с записи ЭЭГ. Мы увеличили эпоху анализа до 20 с, чтобы сопоставить ЭЭГ на участке микросна перед пробуждением с периодом начала засыпания. Критерием его начала служило прекращение нажатий на кнопку в сочетании с отсутствием миограммы и альфа-активности в ЭЭГ. От этого момента мы выделяли отрезок ЭЭГ, по длине соответствующий циклу психомоторного теста (счет “про себя” от 1 до 10 с нажатиями и последующий счет без нажатий). Данный отрезок в среднем был длиной 20 с. За начало самопроизвольного пробуждения принимали момент возникновения альфа-ритма в большинстве отведений ЭЭГ с последующим возобновлением психомоторного теста. Этот критерий ЭЭГ активации во сне используется в большом количестве работ [9, 15]. Отметим, что появление выраженного альфа-ритма предшествовало началу нажатий на кнопку, причем данный промежуток варьировался от 1 до 8 с, в среднем составляя 3–4 с (рис. 1). Эти критерии соответствуют критериям Американской ассоциации по нарушениям сна (ASDA), согласно которым пробуждения определяются как резкие сдвиги частоты ЭЭГ, возникающие после не менее 10 с стабильного сна и продолжительностью 3–15 с [19]. Всего для анализа выделили 65 отрезков ЭЭГ, при этом время сна (микросон) перед пробуждением варьировалось от 1.5 до 14 мин.
Рис. 1.
Пример появления альфа-ритма после пробуждения и перед возобновлением выполнения психомоторного теста. Сверху вниз: отведения ЭЭГ, ЭМГ и механограмма (Мхн). Вертикальными линиями отмечены 1-секундные интервалы времени. Стрелка – предполагаемое начало активации.
Для оценки мощностных характеристик ЭЭГ в разные периоды цикла сон–бодрствование (спокойное бодрствование, засыпание, микросон, период перед пробуждением) для соответствующих отрезков записи проводили непрерывное вейвлет-преобразование на основе “материнского” комплексного Morlet-вейвлета (Matlab 78.01, параметры для скриптов брали из [20]). Карты распределения значений модуля коэффициента вейвлет-преобразования (КВП) строили в полосе 0.5–40 Гц с шагом 0.5 Гц и разрешением по времени 0.01 с. В частотных диапазонах дельта – (0.5–3.5 Гц), альфа-1 (8–10.5 Гц) и альфа-2 (11–14.5 Гц) ритмов проводили усреднение КВП по частотам и далее – по времени, в 1-секундных интервалах. При оценке динамики ЭЭГ перед пробуждением для каждого выделенного диапазона определяли изменения КВП на односекундных интервалах времени по отношению к его значению на первой (начальной) секунде исследуемого 20-секундного отрезка (R = 100% (A – Af)/Af; A – средние значения модуля КВП по каждому диапазону на том или ином 1-секундном отрезке до пробуждения, Af – те же значения на начальном отрезке, R – величина изменений). Таким образом, вычисленный параметр показывает, на какую долю по отношению к мощности на первой секунде исследуемого интервала (в %) изменялась мощность того или иного ритма ЭЭГ в последующие 1-секундные интервалы времени.
Для оценки изменений в ЭЭГ на разных этапах выполнения теста использовали дисперсионный анализ (ANOVA, метод повторных измерений). В качестве факторов, влияющих на ЭЭГ, брались факторы “состояние” (3 уровня: фон, засыпание, пробуждение) и “время” (20 уровней: 20 односекундных интервалов). Анализ проводили отдельно для каждого из исследуемых частотных диапазонов. Для оценки статистической значимости изменений мощности ЭЭГ перед пробуждением использовали дисперсионный анализ только с фактором “время” (20 уровней) и парный критерий Стьюдента. Все статистические вычисления проводили с помощью пакета программ SPSS 13.0.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
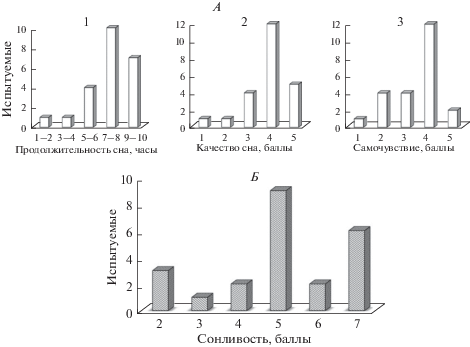
У большинства испытуемых перед обследованием была нормальная продолжительность сна (рис. 2А, 1) и его хорошее качество (4–5 баллов), свое состояние после сна они также оценивали как хорошее (4–5 баллов) (рис. 2А, 2–3). При этом уровень дневной сонливости испытуемые оценивали в основном как средний (5 баллов) или отмечали у себя признаки дневной сонливости (6–7 баллов) (рис. 2Б).
Рис. 2.
Гистограммы распределения характеристик ночного сна накануне обследования и дневной сонливости испытуемых. А – ночной сон, Б – сонливость (по горизонтали – баллы); 1, 2, 3 – продолжительность (часы), качество ночного сна (баллы) и самочувствие (баллы) соответственно. По вертикали – количество испытуемых.
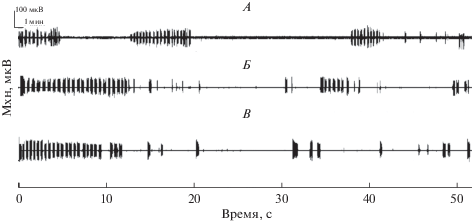
У обследуемых обнаружили существенное разнообразие в длительности периодов выполнения психомоторного теста при засыпании и периодов спонтанных пробуждений. Некоторые не засыпали вовсе: они выполняли тест в течение всего опыта (3 человека – ЭЭГ этих испытуемых на данном этапе из дальнейшего анализа исключили). Время засыпания изменялось от 7 до 45 мин (M = 20.8 ± 2.8). Количество спонтанных пробуждений варьировало от 1 до 8 (M = 3.5 ± 0.6). На рис. 3 приведены примеры распределения периодов засыпания–пробуждения в течение опыта для трех испытуемых.
Рис. 3.
Примеры выполнения психомоторного теста испытуемыми. В сжатом виде изображен канал записи механограммы (Мхн). По вертикали: А, Б, В – разные испытуемые; по горизонтали: время выполнения теста (мин).
Для всех исследуемых ритмов выявили значимые изменения параметров ЭЭГ, связанные с переходами фон–засыпание–пробуждение, отражающееся в изолированном влиянии фактора “состояние” (F(2,18) = 14.5, p < 0.001, F(2,18) = 25.0, p < 0.001 и F(2,18) = 29.0, p < 0.001 для дельта-, альфа-1- и альфа-2-ритмов соответственно). Данный результат для дельта-ритма получен за счет постепенного роста мощности его колебаний от фона к пробуждению (219.1 ± 13.6, 235.2 ± 20.2 и 393.7 ± 35.8 – средние значения в фоне, засыпании и пробуждении соответственно, приведены ошибки средних); для альфа-1- и альфа-2-ритмов за счет снижения при засыпании и роста при пробуждении (288.2 ± 28.3, 172.9 ± 8.3, 225.4 ± 9.3 и 207.6 ± 20.6, 110.0 ± 5.6, 148.1 ± 7.1 – для альфа-1- и альфа-2-ритмов соответственно). Для всех исследуемых ритмов наблюдали достоверные изменения в динамике ЭЭГ перед пробуждением (F(4,49) = 2.9, p < 0.03, F(6,119) = 3.2, p < 0.01 и F(6,114) = 3.2, p < 0.01 – для альфа-1- и альфа-2-ритмов соответственно). Все результаты получали с использованием поправки Гринхауза–Гессера.
Более подробный анализ временной динамики изменений мощностных параметров ЭЭГ за 20 с перед пробуждением показал, что этот процесс протекает в достаточной мере локально. На первых 7 с отмечали стабильное состояние биоэлектрической активности коры больших полушарий, статистически не отличаемое от 1 секунды исследуемого отрезка ЭЭГ. В диапазоне дельта-активности наиболее ранние различия наблюдали, начиная с 9–10 с, когда происходит значимый (на 24–27% по отношению к 1 с; t = –3.7, p < 0.01; t = –2.4, p < 0.03) рост мощности. Далее различия выявили в интервале 11–14 с (44–48% рост; t = –2.5, p < 0.02; t = –4.2, p < 0.01; t = –4.3, p < 0.001; t = –3.0, p < 0.01). С 17-й по 19-ю секунду относительный рост мощности приближается к 70–80%, а на 20-й секунде отмечали падение мощности до 54% (t = –3.7, p < 0.001; t = –5.2, p < 0.001; t = –4.0, p < 0.001; t = –2.6, p < 0.02).
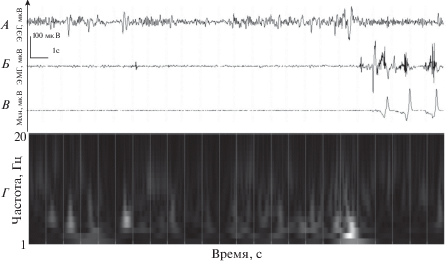
В диапазоне 8–10.5 Гц наиболее ранний рост относительной мощности (альфа-1) наблюдали на 14-й секунде, он достигал 25% (t = –3.1, p < 0.01). Далее происходило ее небольшое падение, а на 17-й–20-й секунде, т.е. непосредственно перед пробуждением, рост с 20 до 36% от начального уровня (t = –2.4, p < 0.02; t = –4.0, p < 0.001; t = –3.5, p < 0.01; t = –3.1, p < 0.01). В альфа2-диапазоне (11–14,5 Гц) значимое нарастание мощности (с 17 до 41%) наблюдали только с 17-й по 20-ю секунду исследуемого отрезка записи ЭЭГ, т.е. опять же непосредственно перед пробуждением (t = –2.1, p < 0.04; t = –4.7, p < 0.001; t = –4.5, p < 0.002; t = –3.2, p < 0.01). Пример изменений в колебаниях биоэлектрических потенциалов и их мощностных показателях перед пробуждением приведены на рис. 4А и 4Б.
Рис. 4.
Изменения в ЭЭГ, ЭОГ и механограмме перед пробуждением и после возобновления выполнения психомоторного теста. А, Б, В, Г – ЭЭГ, ЭОГ, механограмма (Мхн) и карта-схема КВП соответственно. Вертикальные линии – секунды. Значения КВП на карте-схеме нормированы по максимальной величине КВП, по вертикали – Гц.
При анализе регионарных различий выявили преобладание генерализованного характера упомянутых изменений мощностных характеристик исследуемых ритмов ЭЭГ (рис. 5). На 15-й–16-й секундах статистически значимых изменений не получили, поэтому на рис. 5 карты-схемы для этих односекундных интервалов не приводятся.
Рис. 5.
Карты-схемы статистически значимых изменений в мощностных характеристиках биоэлектрических колебаний разных частотных диапазонов перед пробуждением. По вертикали: А, Б, В – дельта-, медленные альфа-, быстрые альфа-колебания соответственно; по горизонтали: секундные интервалы исследуемого отрезка ЭЭГ (20 с); белые, светло-серые, темно-серые и черные круги – отсутствие значимости, р < 0.05, р < 0.01 и р < 0.001 соответственно. Значимости приведены по отношению к спектральным характеристикам ЭЭГ на первой секунде исследуемого отрезка записи. На карте-схеме в левом верхнем рисунка показаны названия отведений, для которых проводился статистический анализ.
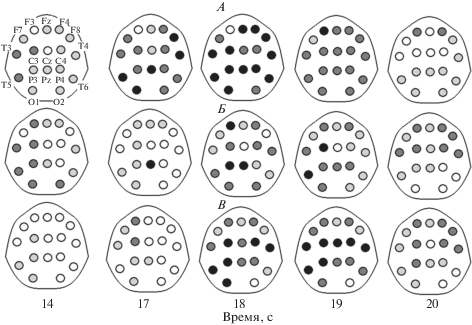
В дельта-ритме на 11-й и 14-й с значимые (р < 0.05) различия выявили для всех корковых зон, за исключением левой лобной области. В период с 17-й по 19-ю с различия значимы во всех регистрируемых областях коры. На 20-й секунде эти различия наблюдали билатерально в каудальных областях, а так же в правой префронтальной коре. Для низкочастотного альфа-ритма на 14-й секунде значимые различия выявили билатерально в дорзолатералной префронтальной коре и передневисочных областях, левой центральной зоне и во всех каудальных областях, за исключением левой теменной области. На 17-й секунде достоверный рост мощности наблюдали в дорзолатеральной префронтальной коре обоих полушарий, левой центральной области и правой затылочной, теменной и нижневисочной области. В интервале 18–20 секунд изменения затрагивают уже большинство корковых зон. В высокочастотном альфа-ритме на 17-й секунде различия преобладали в левом полушарии (в областях отведений С3, F3, F7, P3, T3, O1), а также в O2. В последующие 2 секунды они охватывали все корковые зоны, а на 20-й секунде отсутствовали только в левой затылочной и нижневисочной зонах. Отметим, что рост мощности колебаний корковых потенциалов в альфа-диапазоне показан по отношению к периоду их практически полного отсутствия и носит, пусть и достоверный, но относительно небольшой характер по сравнению c последующим периодом окончательного пробуждения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование характеристик мощности колебаний корковых потенциалов, предшествующих пробуждению, показало их отличие как от состояния бодрствования при закрытых глазах, так и от начала засыпания. Снижение мощности высокочастотных составляющих ЭЭГ, в том числе альфа-ритма, и рост низкочастотной ее компоненты при засыпании является стандартным явлением [6, 16]. Парадоксальная, на первый взгляд, реакция роста мощности дельта-ритма при пробуждении совпадает с данными, описанными [15]. В их исследовании процессов пробуждения из второй стадии ночного сна на больных эпилепсией также выявлено увеличение мощностных характеристик как медленноволновой, так и более быстрой активности. Изменения в дельта-ритме связывается авторами с предполагаемой временно́й динамикой процессов деактивации–активации, которые или возвращали пациентов в сон в конце этого возбуждения, или вели к пробуждению. В нашем случае рост мощности дельта-активности предшествовал пробуждению испытуемых.
Анализ динамики изменений мощностных характеристик ЭЭГ на протяжении 20 с, предшествующих пробуждению, показал временну́ю неоднородность этого процесса. На первых 7 с биоэлектрическая активность коры больших полушарий статистически не отличалась от 1-й секунды анализируемого отрезка записи. Существенные изменения во всех исследуемых диапазонах наблюдаются на 14-й, а также с 17 по 20 секунду перед пробуждением.
При визуальном анализе в эти временные интервалы на ЭЭГ выявляются электроэнцефалографические феномены, названные К-комплексами, которые по своим частотным характеристикам совпадают с дельта-активностью [21]. В современной литературе отмечается неоднозначная функциональная роль К-комплекса: с одной стороны, он интерпретируется как один из активационных паттернов, с другой – участвует и в обеспечении стабильности сна [22–24].
Можно предположить, что упомянутая двойственная роль К-комплекса связана с его функциональной неоднородностью как электрофизиологического феномена. Эта гипотеза нашла свое подтверждение в исследовании [25], выявившем три разных типа K-комплексов, различающихся по форме и наличию ритмической активности, сопровождающей К-комплекс.
Часто К-комплексу предшествуют или сопровождают его т. н. сигма-веретена, представляющие собой короткие вспышки активности в диапазоне 11–16 Гц [16, 22, 26, 27]. Описано два типа сигма-веретен: медленные (9–12 Гц) и быстрые (12–16 Гц) – с различной локализацией и функциональной ролью [28]. Медленные сигма-веретена специфически реагируют на сенсорную стимуляцию во время сна и могут быть связаны с информационными процессами, а быстрые отражают таламо-кортикальную связь и напрямую связаны с реорганизацией памяти во время сна [29]. Наличие сигма-веретена также наблюдались в составе активационных паттернов [16], появление которых может приводить к пробуждению.
По данным фМРТ сигма-веретенам соответствовало усиление BOLD сигнала в таламусе и задней поясной извилине, а также в правом предклинье, базальном ядре, парацентральной коре и височной доле. Появление K-комплексов соответствовало усилению сигнала в таламусе, верхних височных долях, парацентральной извилине, и медиальных областях затылочной, теменной и лобной долей [22, 23]. В некоторых из этих отделов мозга, а именно – в областях правого таламуса, левого клина, мозжечковых зон и стволовых структур мозга наблюдались изменения мозгового кровотока по показателям фМРТ в процессе пробуждения [17].
Таким образом, значительное участие подкорковых структур, а именно таламуса и ствола мозга, в генерации как K-комплексов так и сигма-веретен, может объяснять генерализованный характер изменений мощностных характеристик как дельта-, так и альфа-диапазонов перед пробуждением. Можно предположить, что именно объединение K-комплексов и медленных сигма-веретен в единый комплекс является активирующем паттерном [24, 25], необходимым для выхода системы из “спящего” в “активный” режим – для пробуждения, активации сознания и обеспечения последующей когнитивной деятельности. Этот паттерн скорее всего отражает действие универсального таламо-кортикального активирующего механизма, одинакового как для ночного, так и для дневного сна, независимо от того, следует ли за ним период кратковременной активации с последующим сном, или далее начинается когнитивная деятельность.
ЗАКЛЮЧЕНИЕ
Использование психомоторного теста в часовых экспериментах с дневным сном позволило наблюдать в течение одного опыта от 1 до 8 эпизодов засыпания и пробуждения. Исследование спектральных характеристик ЭЭГ перед пробуждением, которое определялось по восстановлению выполнения психомоторного теста после микросна, обнаружило рост мощностных характеристик в дельта- и альфа-диапазоне. Данный факт мы связываем с частым предшествованием пробуждению К-комплексов разной степени выраженности, на которые накладываются низкочастотные альфа-колебания, последние могут рассматриваться как медленные сигма-веретена. Этот паттерн биоэлектрической активности, по всей вероятности, отражает действие универсального таламо-кортикального активирующего механизма, который можно считать нейрональными коррелятом активации последовательных уровней сознания, необходимых для выполнения психомоторного теста.
Список литературы
Gemignani A., Menicucci D., Laurino M., Piarulli A., Mastorci F., Sebastiani L., Allegrini P. Linking Sleep Slow Oscillations with consciousness theories: New vistas on Slow Wave Sleep unconsciousness. Arch. Ital. Biol. 153(1–2):135–143. 2015.
Koch C., Massimini M., Boly M., Tononi G. Neural correlates of consciousness: Progress and problems. Nat. Rev. Neurosci. 17(5): 307–321. 2016.
Windt J.M., Nielsen T., Thompson E. Does Consciousness Disappear in Dreamless Sleep? Trends. Cogn. Sci. 20(12):871-882. 2016.
Tagliazucchi E., van Someren Eus J.W. The large-scale functional connectivity correlates of consciousness and arousal during the healthy and pathological human sleep cycle. Neuroimage 160(15):55–72. 2017.
Overgaard M., Rote J., Mouridsen K., Ramsoy T.Z. Is conscious perception gradual or dichotomous? A comparison of report methodologies during a visual task. Conscious. Cogn. 15:700–708. 2006.
Simon Ch.W., Emnions W.H. EEG, Consciousness, and Sleep. Science. 124:1056–1069. 1956.
Jackson M.L., Kennedy G.A., Clarke C., Gullo M., Swann P., Downey L. A., Hayley A.C., Pierce R.J., Howard M.E. The utility of automated measures of ocular metrics for detecting driver drowsiness during extended wakefulness. Accident Analysis and Prevention. 87:127–133. 2016.
Schieber J.P., Muzet A., Ferriere P.J. Phases of spontaneous transitory activation during normal sleep in humans. Arch. Sci. Physiol. 25:443–465. 1971.
Halasz P., Kundra O., Rajna P., Pal I., Vargha M. Micro-arousals during nocturnal sleep. Acta Physiol. Acad. Sci. Hung. 54:1–12. 1979.
Mathur R., Douglas N.J. Frequency of EEG arousals from nocturnal sleep in normal subjects. Sleep. 18:330–333. 1995.
Boselli M., Parrino L., Smerieri A., Terzan M.G. Effect of age on EEG arousals in normal sleep. Sleep. 21. 351–357. 1998.
De Gennaro L., Ferrara M., Bertini M. EEG arousals in normal sleep: Variations induced by total and selective slow-wave sleep deprivation. Sleep. 24:673–679. 2001.
Magnnin M., Bastuji H., Garcia-Larrea L., Mauguiere F. Human thalamic medial pulvinar nucleus is not activated during paradoxical sleep. Cereb. Cortex. 14: 858–862. 2004.
Nobili L., Ferrara M., Moromi F., De Gennaro L., Russo G.L., Campus C., Cardinale F., De Carli F. Dissociated wake-like and sleep-like electrocortical activity during sleep. Neuroimage. 58: 612–619. 2011.
Peter-Derex L., Magnina M., Bastuji H. Heterogeneity of arousals in human sleep: A stereo-electroencephalographic study. Neuroimage. 123: 229–244. 2015.
Дорохов В.Б. Альфа-веретена и К-комплекс – фазические активационные паттерны при спонтанном восстановлении нарушений психомоторной деятельности на разных стадиях дремоты. Журн. высш. нервн. деят. им. И.П. Павлова 53(4): 502–511. 2003. [Dorokhov V.B. Alpha bursts and K-complex: phasic activation pattern during spontaneous recovery of correct psychomotor performance at different stages of drowsiness. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 53(4): 502–511. 2003. (In Russ.)].
Dorokhov V.B., Malakhov D.G., Orlov V.A., Ushakov V. Experimental Model of Study of Consciousness at the Awakening: FMRI, EEG and Behavioral Methods: Proceedings of the Ninth Annual Meeting of the BICA Society. In book: Biologically Inspired Cognitive Architectures. 82–87. 2018.
Morin C.M. Insomnia, psychological assessment and management. New York. Guilford Press. 1993.
American sleep disorders association report. EEG arousals: scoring rules and examples: a preliminary report from the Sleep Disorders Atlas Task Force of the American Sleep Disorders Association. Sleep. 15:173–184. 1992.
Tallon-Baudry C., Bertrand O., Peronnet F., Pernier J. Indused gamma band activity during the delay of a visual short term memory task in humans. J. Neurosci. 18:4244–4255. 1998.
Amzica F., Steriade M. The K–complex: It’s slow (<1–Hz) rhythmicity and relation to delta waves. Neurology. 49(4):952e9. 1997.
Caporro M., Haneef Z., Yeh H. J., Lenartowicz A., Buttinelli C., Parvizi J., Stern J.M. Functional MRI of sleep spindles and K-complexes. Clin. Neurophysiol. 123: 303–309. 2012.
Jahnke K., von Wegner F., Morzelewski A., Borisov S., Maischein M., Steinmetz H., Laufs H. To wake or not to wake? The two-sided nature of the human K-complex. Neuroimage. 59:1631–1638. 2012.
Halász P., Terzano M., Parrino L., Bodizs R. The nature of arousal in sleep. J. Sleep. Res. 13: 1–23. 2004.
Kokkinos V., Koupparis A.M., Kostopoulos G.K. An intra-K complex oscillation with independent and labile frequency and topography in NREM sleep. Front. Hum. Neurosci. 7(163):1–16. 2013.
Fisher R.S., Cordova S. EEG for beginners. In: Krauss G.L., Fisher R.S., editors. The Johns Hopkins atlas of digital EEG. Baltimore. The Johns Hopkins Univer. Press. 2006.
Chang B.S., Schomer D.L., Niedermeyer E. Normal EEG and sleep: adults and elderly. In: Schomer D.L., Lopes da Silva F.H., eds. Niedermeyer’s electroencephalography. 6th ed. Philadelphia. Lippincott Williams & Wilkins. 2011.
Mölle M., Bergmann T.O., Marshall L., Born J. Fast and slow spindles during the sleep slow oscillation: disparate coalescence and engagement in memory processing. Sleep. 34: 1411–1421. 2011.
Perl O., Arzi A., Sela L. Secundo L., Holtzman Y., Samnon P., Oksenberg A., Sobel N., Hairston I.S. Odors enhance slow–wave activity in non-rapid eye movement sleep. J. Neurophysiol. 115:2294–2302. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


