Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 8, стр. 1031-1040
Активность кальция в главных клетках собирательных трубок почки крысы и клетках линии HEK293 в гипертонической среде
Л. Е. Каткова 1, *, Г. С. Батурина 1, 2, Е. И. Соленов 1, 2, 3
1 Институт цитологии и генетики СО РАН
г. Новосибирск, Россия
2 Новосибирский государственный университет
г. Новосибирск, Россия
3 Новосибирский государственный технический университет
г. Новосибирск, Россия
* E-mail: ile@bionet.nsc.ru
Поступила в редакцию 14.05.2019
После доработки 11.06.2019
Принята к публикации 13.06.2019
Аннотация
В работе исследовали влияние гипертонического шока на динамику клеточного объема и внутриклеточную концентрацию ионов кальция в главных клетках собирательных трубок наружного мозгового вещества почки крысы (OMCD) и в линии клеток эмбриональной почки человека HEK293. Главные клетки OMCD в гипертонической среде, которая создавалась добавлением 280 мМ маннита в PBS, снижали объем на 50%, клетки линии HEK293 снижали объем на 20% от исходного уровня. При этом наблюдали кратковременное повышение концентрации внутриклеточного кальция ([Ca2+]in) с последующим ее снижением. Применяемый в настоящем исследовании флуоресцентный метод позволяет определять временные характеристики, которые измеряли с разрешением 10–2 с, что дает возможность анализировать кинетики процессов регуляции внутриклеточного кальция в этих клетках. Исследование влияния гипертонической среды на внутриклеточную концентрацию кальция выявило значительную разницу динамики этого параметра в главных клетках собирательных трубок наружного мозгового вещества почки крысы и клетках линии HEK293. В настоящем исследовании впервые измерены временные характеристики реакции [Ca2+]in в ответ на гипертонический шок в клетках OMCD почки крысы. Показана низкая водная проницаемость клеток культуры HEK293. Результаты настоящего исследования указывают на существование эффективного механизма снижения концентрации внутриклеточного кальция в главных клетках OMCD почки.
Эпителиальные клетки, участвующие в транспорте воды и осмотически активных веществ, должны обладать механизмом для защиты от изменений осмотического давления внутриклеточной среды, вызываемых транспортируемыми веществами. Эффективность таких механизмов связана как с интенсивностью процессов переноса, в которых клетки участвуют, так и c вариабельностью осмотического давления внешней среды [1]. Гипертонический шок вызывает выход из клетки воды и снижение объема клетки. Восстановление клеточного объема после гипертонического шока (регуляторное повышение объема, RVI) происходит в результате поступления в клетку осмотически активных веществ из окружающей среды и синтеза внутри клетки органических осмолитов. Реакция RVI имеет двухфазный характер. Быстрая фаза связана с поступлением осмолитов через транспортеры плазматической мембраны из окружающей среды, более медленная и длительная фаза связана с синтезом органических осмолитов клеткой. Синтетические процессы в клетке регулируются осмотически активируемыми генами, важным регуляторным фактором для которых является транскрипционный фактор TonEBP [2–5].
Результаты современных исследований механизма клеточной осмопротекции не позволяют составить представление о структуре сигнальных и транспортных процессов, определяющих жизнеспособность клетки в гипертонических условиях, поскольку получены для разных типов клеток [6, 7]. Это связано с тем, что в основном клетки, на которых проводятся исследования, существуют в изотонических условиях и не имеют развитого механизма адаптации к гипертонической среде. Развитым защитным механизмом, позволяющим клеткам постоянно функционировать в среде с высоким осмотическим давлением, обладают только клетки почечных канальцев, находящиеся в области осмотического градиента. Развитый механизм адаптации к гипертонической среде главных клеток собирательных трубок почки делает эти клетки наиболее перспективным объектом исследования фундаментальных основ клеточной осмопротекции.
Воздействие гипертонической среды приводит к повышению концентрации внутриклеточных веществ, в том числе тех, которые выполняют сигнальные функции. Такое неспецифическое повышение активности сигнальных молекул может быть опасным. Клетки, подвергающиеся гипертоническим шокам, должны иметь защитные механизмы для снижения неспецифической сигнальной активности. Ионы кальция участвуют в регуляции множества процессов в клетке, и при гипертоническом воздействии можно ожидать неспецифическое повышение их концентрации в клетке и соответственно активацию множества кальций зависимых процессов.
Целью настоящей работы было исследование влияния гипертонической среды на активность ионов кальция в главных клетках эпителия собирательных трубок почки, способных к высокой интенсивности транспорта воды и ионов. Для сравнения исследовали влияние гипертонического шока на клетки линии эмбриональной почки (HEK293), которые широко используются для изучения участия кальция в регуляторных внутриклеточных процессах, однако механизмы транспорта у которых должны быть менее развиты по сравнению с высокодифференцированными главными клетками эпителия собирательных трубок наружного мозгового вещества почки (OMCD).
МЕТОДЫ ИССЛЕДОВАНИЯ
В экспериментах использовали культуры клеток человека линий HEK293. Для получения переживающей культуры главных клеток собирательных трубок наружного мозгового вещества почек крысы использовали 60-дневных крыс линии Вистар обоих полов, выращенных на базе Центра генетических ресурсов лабораторных животных ИЦиГ СО РАН (RFMEFI61914X0005 и RFMEFI61914X0010). Работа проведена с соблюдением “Правил работ с использованием экспериментальных животных” (приложение к приказу Мин. здрав. № 755 от 12.08.1977) и международных принципов Хельсинкской декларации о гуманном отношении к животным EU (86/609/EEC). Для стандартизации состояния животных при антидиурезе их лишали воды за 24 ч до эксперимента.
Растворы. Растворы, использованные в работе, приготовлены на основе PBS (мМ: 137 NaCl, 4.7 Na2HPO4, 2.7 KCl, 1.5 KH2PO4, 0.5 MgCl2, 1 CaCl2, 5 глюкоза; 300 мОсм/кг H2O; pH 7.4). Гипертонический раствор PBS (580 мОсм/кг H2O) получали добавлением маннита (280 мМ).
Клетки и микроскопия. Культуру клеток эмбриональной почки человека получали из клеточной коллекции ИЦиГ СО РАН. Клетки содержались в среде RPMI с 10%-ным содержанием эмбриональной сыворотки при 37°С в атмосфере с 5%-ным содержанием CO2.
Для приготовления суспензии собирательных трубок использовали низкокальциевый PBS (мМ: 137 NaCl, 4.7 Na2HPO4, 2.7 KCl, 1.5 KH2PO4, 0.5 MgCl2, 0.05 CaCl2). Фрагменты OMCD получали согласно протоколу [8], помещали в проточную камеру микроскопа, интенсивность флуоресценции клеток записывали с помощью ФЭУ-71 оснащенного диафрагмой, позволяющей регистрировать флуоресценцию из области фрагмента собирательной трубки, содержащей главные клетки. Из значений флуоресценции клеток вычитали интенсивность флуоресценции области сравнения – участка, свободного от клеток. Конструкция проточной камеры и методика записи флуоресценции были описаны в предыдущих работах [9, 10].
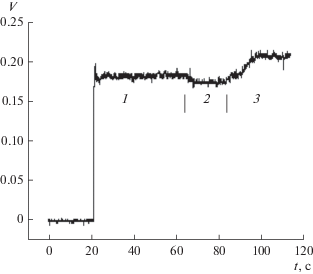
Камеру с фрагментами OMCD помещали на стол микроскопа (Axiovert 40, Zeiss, Германия, объектив ×40/0.50, набор фильтров № 09). Для загрузки внутриклеточным флуоресцентным индикатором кальция клетки и фрагменты собирательных трубок инкубировали в присутствии красителя Fluo-4 (8 мкM, 30 мин, 37°C; Fluo-4, Molprobes, США). Калибровку производили в присутствии 0.1 Ед/мкл нистатина (Sigma, США) (рис. 1).
Рис. 1.
Калибровочная кривая. 1 – интактные клетки в среде PBS (1.0 мМ Ca2+), 2 – клетки в бескальциевой среде, 3 – клетки в среде PBS (1.0 мМ Ca2+) в присутствии 0.1 U/мкл нистатина. Оси: абсцисс – время, с, ординат – флуоресценция, V.
Изменения клеточного объема определяли в отдельном эксперименте с помощью метода, основанного на эффекте гашения флуоресцентного красителя кальцеина [10, 11]. Скорость изменения объема клеток и скорость снижения концентрации внутриклеточного кальция [Ca2+]in оценивали по коэффициенту линейной регрессии начального участка соответствующего графика зависимости относительной флуоресценции от времени. Расчет коэффициента линейной регрессии проводили, используя линейную аппроксимацию начального участка кривой методом наименьших квадратов. Кривые зависимостей относительной флуоресценции от времени построены по средним значениям точек из указанного в подписях к рисункам количества экспериментов.
Статистическую достоверность отличий оценивали с помощью t-критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Согласно полученным результатам, главные клетки OMCD в гипертонической среде снижали объем на 50%, клетки линии HEK293 снижали объем на 20% от исходного уровн (рис. 2).
Рис. 2.
Снижение относительного объема* в гипертонической среде (580 мОсм/кг H2O). А – главные клетки собирательных трубок наружного мозгового вещества почки (n = 12); Б – клетки HEK293 (n = 8). Стрелки – момент смены среды. Оси: абсцисс – время, с; ординат – относительный объем клетки, V/V0. * – интерпретация относительной флуоресценции Calcein. (F/F0 ≈ V/V0, см. раздел “Методы исследования”).
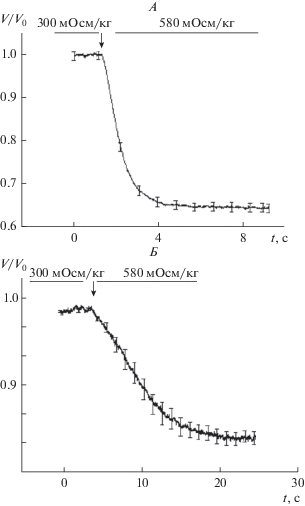
Наблюдаемая разница, по-видимому, объясняется главным образом различиями водной проницаемости этих клеток. Низкая водная проницаемость клеток линии HEK293 позволяет эффективно регулировать клеточный объем при гипертоническом воздействии.
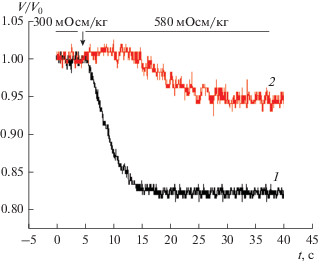
Гипертоническая среда вызывала кратковременное повышение концентрации внутриклеточного кальция с последующим ее снижением в клетках OMCD (рис. 3) и в клетках HEK293 (рис. 4).
Рис. 3.
Влияние гипертонической среды на относительный объем и внутриклеточную концентрацию кальция главных клеток собирательных трубок наружного мозгового вещества почки (типичный профиль). Стрелка – смена среды. Оси: абсцисс – время, с, ординат: – относительный объем клетки (V/V0); 2 – концентрация внутриклеточного кальция, усл. ед. (AU).
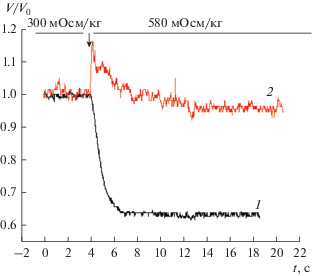
Рис. 4.
Влияние гипертонической среды на относительный объем и внутриклеточную концентрацию кальция клеток HEK293 (типичный профиль). Оси: абсцисс – время, с; ординат: относительный объем клетки, V/V0; 2 – концентрация внутриклеточного кальция, усл. ед., AU.
Применяемый в настоящем исследовании флуоресцентный метод позволяет определять временные характеристики с разрешением 10–2 с, что обеспечивает достаточную точностью для изучения временных характеристик процессов регуляции внутриклеточного кальция. Динамика снижения [Ca2+]in в гипертонической среде значительно различается в главных клетках OMCD почки крысы и в клетках линии HEK293 (табл. 1, рис. 5).
Таблица 1.
Влияние гипертонической среды на показатели изменения объема и внутриклеточной концентрации кальция исследованных клеток
| Клетки | Коэффициент регрессии
относительного клеточного
объема Kr (V/V0), M ± sem, (с)–1 |
Коэффициент регрессии
относительной флуоресценции Fluo-4 Kr (F/F0), M ± sem, (с)–1 |
n |
|---|---|---|---|
| Главные клетки OMCD почки крысы | –0.280 ± 2.8E-3 | –0.030 ± 4.4E-4 | 12 |
| HEK293 | –0.010 ± 3.8E-5 | –0.006 ± 6.0E-5 | 8 |
Рис. 5.
Типичная кривая снижения концентрации внутриклеточного кальция в гипертонической среде (580 мОсм/кг H2O) в: 1 – главных клетках собирательных трубок наружного мозгового вещества почки, 2 – клетках HEK293. Оси: абсцисс – время,с, ординат: концентрация внутриклеточного кальция, усл. ед., AU.
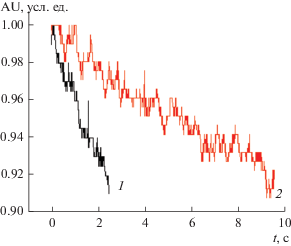
Скорость снижения концентрации внутриклеточного кальция дает представление об активности механизма, регулирующего уровень [Ca2+]in в изучаемых клетках в условиях гипертонического шока. Из анализа зависимости относительной флуоресценции внутриклеточного кальций-специфического красителя Fluo-4 от времени видно, что в гипертонической среде в клетках устанавливался более низкий стационарный уровень [Ca2+]in по сравнению с его уровнем в нормальных условиях. Количественная оценка амплитуд как возрастания, так и снижения концентрации внутриклеточного кальция в настоящей работе не производилась, поскольку используемый флуоресцентный метод не обладает достаточной разрешающей способностью, как это можно видеть из профиля калибровочной кривой, полученной для главных клеток собирательных трубок наружного мозгового вещества почки крысы (рис. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В основе осмопротекторного механизма клетки в гипертонической среде лежит реакция регуляторного повышения объема (RVI). В настоящий момент описание транспорта и метаболизма осмолитов в процессе RVI возможно на качественном уровне [12].
В гипертонической среде из клетки выходит вода, повышается ионная сила в цитоплазме, активируются осмочувствительные каналы и нарушается функция систем вторичных посредников. Кальций как вторичный посредник и сигнальный агент участвует в регуляции множества процессов и функций клетки [13–15]. В главных клетках собирательных трубок почки крысы показана роль кальция в реализации сигнала осморегулирующей функции вазопрессина [16–20]. Известно, что повышение [Ca2+]in, связанное с проведением гормонального сигнала, осуществляется за счет выхода кальция из внутриклеточного депо и входа из окружающей среды. Повышение [Ca2+]in в результате осмотического снижения объема клетки может вызывать множественные нарушения в процессах и работе сигнальных путей, что может представлять опасность для жизненно важных функций клетки. Косвенным подтверждением такого предположения можно считать способность гипертонической среды вызывать апоптоз клеток [21–24]. В этой связи важным механизмом для защиты клетки от гипертонических шоков должен выступать механизм нормализации концентрации внутриклеточного кальция.
Современные знания о системах внутриклеточных сигналов, активируемых гипертоническим шоком, дают ограниченные представления об их функционировании и их роли в процессах RVI. Специфического осморецептора в клетке не обнаружено и, по-видимому, его не существует. Сигнал для RVI множественный, суммируется из реакций осмочувствительных каналов, цитоскелета и активации внутриклеточных систем вторичных посредников [25]. Таким образом, вопрос о механизме осмопротекции клеток является нерешенной фундаментальной проблемой, связанной с адаптацией клетки к гипертонической среде.
В настоящем исследовании мы впервые измерили временные характеристики реакции системы [Ca2+]in на его повышение в результате гипертонического шока в клетках OMCD почки крысы. Одним из ключевых результатов исследования является демонстрация высокой скорости нормализации уровня [Ca2+]in в процессе адаптации к гипертонической среде главных клеток OMCD почки.
Клетки HEK293 происходят из эмбриональной почки человека, однако исследования многих авторов не демонстрируют в них явной тканеспецифической экспрессии генов, в этих клетках обнаруживается экспрессия маркеров нескольких тканей (маркеров эмбриональных стволовых клеток, маркеров эндодермы, мезодермы и эктодермы, а также маркеров почечных клеток-предшественников, маркеров клубочков, маркеров проксимальных канальцев, маркеров петли Генле и дистальных канальцев) [26]. На основе анализа транскриптом клеток HEK293 Y.-C. Lin и соавт. предположили, что клетки HEK293 произошли от эмбриональной структуры предшественника надпочечников (мозгового вещества надпочечников), которая тесно связана с почкой во время развития, и нервного гребня эктодермального происхождения [27]. Согласно нашим результатам, водная проницаемость клеток культуры HEK293 ниже, чем у клеток OMCD, что, по-видимому, в значительной мере защищает эти клетки от резкого возрастания активности внутриклеточного кальция в гипертонической среде. Таким образом, наши исследования подтверждают, что клеточная линия HEK293 не может использоваться в качестве модели почечных клеток.
Результаты настоящего исследования указывают на существование эффективного механизма снижения концентрации внутриклеточного кальция в главных клетках OMCD почки. Изучение функционирования механизма, регулирующего уровень [Ca2+]in в клетке, является фундаментальной проблемой. Ее решение необходимо, в том числе, для создания методов предотвращения осложнений, вызываемых медицинскими процедурами, связанными с гипертоническими воздействиями на организма, такими как перитонеальный диализ или осмотерапия отеков.
Список литературы
Delpire E., Gagnon K.B. Water Homeostasis and Cell Volume Maintenance and Regulation. Curr. Top Membr. 81: 3–52. 2018.
Jeon U.S., Kim J.A., Sheen M.R., Kwon H.M. How tonicity regulates genes: Story of TonEBP transcriptional activator. Acta. Physiol. (Oxf). 187(1–2): 241–247. 2006.
Hasler U., Jeon U.S., Kim J.A., Mordasini D., Kwon H.M., Féraille E., Martin P.Y. Tonicity-responsive enhancer binding protein is an essential regulator of aquaporin-2 expression in renal collecting duct principal cells. J. Am. Soc. Nephrol. 17(6): 1521–1531. 2006.
Bartolo R.C., Donald J.A. The effect of water deprivation on the tonicity responsive enhancer binding protein (TonEBP) and TonEBP-regulated genes in the kidney of the Spinifex hopping mouse, Notomysalexis. J. Exp. Biol. 211(Pt 6): 852–859. 2008.
Chua O.W., Wong K.K., Ko B.C., Chung S.K., Chow B.K., Lee L.T. Role of nuclear factor of activated T-cells 5 in regulating hypertonic-mediated secretin receptor expression in kidney collecting duct cells. Biochim. Biophys. Acta. 1859(7): 922–932. 2016.
Lindinger M.I., Leung M., Trajcevski K.E., Hawke T.J. Volume regulation in mammalian skeletal muscle: the role of sodium-potassium-chloride cotransporters during exposure to hypertonic solutions. J. Physiol. 589(Pt 11): 2887–2899. 2011.
Antico S., Lionetto M.G., Giordano M.E., Caricato R., Schettino T. Cell volume regulation and apoptotic volume decrease in rat distal colon superficial enterocytes. Cell Physiol. Biochem. 32(6): 1551–1565. 2013.
Соленов Е.И., Батурина Г.С., Иванова Л.Н. Влияние вазопрессина на водную проницаемость клеток эпителия собирательных трубок почки в постнатальном онтогенезе крыс. Рос. физиол. журн. им. И. М. Сеченова. 87 (7): 965–972. 2001. [Solenov E.I., Baturina G.S., Ivanova L.N. Effect of vasopressin on water permeability of epithelial cells in the kidney collecting duct during postnatal ontogenesis in rats. Ross. Fiziol. Zh. Im. I M Sechenova. 87(7): 965–972. 2001. (In Russ.)].
Иляcкин А.В., Батуpина Г.C., Медведев Д.А., Еpшов А.П., Cоленов Е.И. Исследование реакции главных клеток собирательных трубок почки на гипотонический шок. Эксперимент и математическое моделирование. Биофизика. 56(3): 550–560. 2011. [Iliaskin A.V., Baturina G.S., Medvedev D.A., Ershov A.P., Solenov E.I. A mathematical model of the response of principal cells of collecting ducts to hypotonic shock. Biofizika. 56(3): 550–560. 2011. (In Russ.)].
Zarogiannis S.G., Ilyaskin A.V., Baturina G.S., Katkova L.E., Medvedev D.A., Karpov D.I., E-rshov A.P., Solenov E.I. Regulatory volume decrease of rat kidney principal cells after successive hypo-osmotic shocks. Math. Biosci. 244(2): 176–187. 2013.
Solenov E., Watanabe H., Manley G.T., Verkman A.S. Sevenfold-reduced osmotic water permeability in primary astrocyte cultures from AQP-4 deficient mice, measured by a fluorescence quenching method. Am. J. Physiol. Cell Physiol. 286: 426–432. 2004.
Hoffmann E.K., Schettino T., Marshall W.S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp. Biochem. Physiol. A Mol. Integr. Physiol. 148(1): 29–43. 2007.
Sirko P., Gale J.E., Ashmore J.F. Intercellular Ca2+ signalling in the adult mouse cochlea. J. Physiol. 597(1): 303–317. 2019.
Nesbitt W.S., Giuliano S., Kulkarni S., Dopheide S.M., Harper I.S., Jackson S.P. Intercellular calcium communication regulates platelet aggregation and thrombus growth. J. Cell Biol. 160(7): 1151–1161. 2003.
Verkhratsky A., Rodríguez J.J., Parpura V. Calcium signalling in astroglia. Mol. Cell Endocrinol. 353(1–2): 45–56. 2012.
Balasubramanian L., Sham J.S., Yip K.P. Calcium signaling in vasopressin-induced aquaporin-2 trafficking. Pflugers Arch. 456(4): 747–754. 2008.
Соленов Е.И., Каткова Л.Е., Нестеров В.В., Иванова Л.Н. Роль Cа2+ и аквапорина 2 в регуляции водной проницаемости базолатеральной мембраны собирательной трубки почки крысы. Рос. физиол. журн. им. И.М. Сеченова. 92(11): 1358–1364. 2006. [Solenov E.I., Katkova L.E., Nesterov V.V., Ivanova L.N. Role of Ca2+ and aquaporin-2 in regulation of basolateral water permeability of collecting ducts in the rat kidney. Ross. Fiziol. Zh. Im. I.M. Sechenova. 92(11): 1358–1364. 2006. (In Russ.)].
Ходус Г.Р., Соленов Е.И., Нестеров В.В., Каткова Л.Е., Иванова Л.Н. Роль кальций-зависимых процессов в регуляции вазопрессином водной проницаемости клеток собирательных трубок почки мыши. Рос. физиол. журн. им. И.М. Сеченова.92(5): 626–632. 2006. [Khodus G.R., Solenov E.I., Nesterov V.V., Katkova L.E., Ivanova L.N. Calcium dependent mechanisms in vasopressin regulation of osmotic water permeability in the mouse kidney collecting duct cells. Ross. Fiziol. Zh. Im. I. M. Sechenova. 92(5): 626–632. 2006. (In Russ.)].
Каткова Л.Е., Соленов Е.И., Иванова Л.Н. Роль протеинкиназы С в становлении механизма антидиуретического действия вазопрессина в почке крысы в постнатальном онтогенезе. Онтогенез. 40(6): 442–448. 2009. [Katkova L.E., Solenov E.I., Ivanova L.N. The role of protein kinase C in the establishment of the mechanism of vasopressin antidiuretic action in the rat kidney during mammalian postnatal development. Ontogenez. 40(6): 442–448. 2009. (In Russ.)].
Liwang J.K., Ruiz J.A., LaRocque L.M., Rianto F., Ma F., Wang Y. Role of PKC and AMPK in hypertonicity-stimulated water reabsorption in rat inner medullary collecting ducts. Am. J. Physiol. Renal Physiol. 316(2): F253–F262. 2019.
Koos B., Christmann J., Plettenberg S., Käding D., Becker J., Keteku M., Klein C., Imtiaz S., Janning P., Bastiaens PIH, Wehner F. Hypertonicity-induced cation channels in HepG2 cells: Architecture and role in proliferation vs. apoptosis. J. Physiol. 596(7): 1227–1241. 2018.
Lang F., Shumilina E., Ritter M., Gulbins E., Vereninov A., Huber S.M. Ion channels and cell volume in regulation of cell proliferation and apoptotic cell death. Contrib. Nephrol. 152: 142–160. 2006.
Lang F., Ritter M., Gamper N., Huber S., Fillon S., Tanneur V., Lepple-Wienhues A., Szabo I., Gulbins E. Cell volume in the regulation of cell proliferation and apoptotic cell death. Cell Physiol. Biochem. 10(5–6): 417–428. 2000.
Hoffmann E.K., Lambert I.H., Pedersen S.F. Physiology of cell volume regulation invertebrates. Physiol. Rev 89: 193–277. 2009.
Toft-Bertelsen T.L., Larsen B.R., MacAulay N. Sensing and regulation of cell volume – we know so much and yet understand so little: TRPV4 as a sensor of volume changes but possibly without a volume-regulatory role? Channels (Austin). 12(1): 100–108. 2018.
Stepanenko A.A., Dmitrenko V.V. HEK293 in cell biology and cancer research: Phenotype, karyotype, tumorigenicity, and stress-induced genome-phenotype evolution. Gene. 569(2): 182–190. 2015.
Lin Y.-C., Boone M., Meuris L., Lemmens I., Van Roy N., Soete A., Reumers J., Moisse M., Plaisance S., Drmanac R., Chen J., Speleman F., Lambrechts D., Van de Peer Y., Tavernier J., Callewaert N. Genome dynamics of the F. human embryonic kidney 293 lineage in response to cell biology manipulations. Nat. Commun. 5: 4767. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


