Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 8, стр. 1041-1053
Параметры биоэлектрического импеданса легких у самок крыс линии Вистар при экспериментальной легочной гипертензии
Н. Л. Коломеец 1, *, О. В. Суслонова 1, С. Л. Смирнова 1, А. С. Гуляева 1, И. М. Рощевская 2, 3
1 Федеральный исследовательский центр “Коми научный центр Уральского отделения РАН”
Сыктывкар, Россия
2 Сыктывкарский государственный университет им. Питирима Сорокина
Сыктывкар, Россия
3 Научно-исследовательский институт фармакологии им. В.В. Закусова
Москва, Россия
* E-mail: nat.kolomeyets@gmail.com
Поступила в редакцию 08.05.2019
После доработки 13.06.2019
Принята к публикации 17.06.2019
Аннотация
Цель работы – выявить изменения биоэлектрического импеданса легких и тела у самок крыс линии Вистар при индуцированной монокроталином легочной гипертензии. Многочастотные биоимпедансные исследования у крыс проведены до и спустя месяц после введения препарата (доза 100 мг/кг). Гистологические срезы легкого толщиной 5–7 мкм окрашивали гематоксилином и эозином. У крыс при монокроталиновом поражении гистологически показано ремоделирование легочных сосудов, подтверждающее развитие легочной гипертензии, наличие эмфизематозных изменений и воспалительного процесса. Выявленное у крыс с монокроталиновой моделью легочной гипертензии по сравнению с крысами контрольной группы значимое увеличение активного сопротивления, амплитуды биоэлектрического импеданса легких при низких частотах тока может свидетельствовать об эмфизематозных изменениях, а при более высоких частотах – о воспалительном процессе и сужении просвета кровеносных сосудов в легких. Значимое уменьшение значений фазового угла биоимпеданса легких и реактивного сопротивления биоэлектрического импеданса тела при низкой частоте у крыс опытной группы могут указывать на повреждения клеточных мембран.
Легочная артериальная гипертензия приводит к гипертрофии правого желудочка и в дальнейшем к развитию тяжелой сердечной недостаточности [1]. Наиболее распространенной экспериментальной моделью, позволяющей изучать легочную артериальную гипертензию, является введение животным монокроталина, вызывающего токсическое повреждение периферических сосудов легких и других органов: почек, печени и сердца [2].
При монокроталиновом поражении у животных возможно развитие токсичного альвеолярного повреждения, отека, фиброза легких, нарушение газообмена в легких [3–5]. Патологические изменения легочной ткани при воздействии монокроталина соответствуют модели острого легочного повреждения [3].
Структурные изменения в тканях, выявляемые при гистологическом анализе, отражаются в динамике электропроводящих свойств образцов органов [6]. Измеряемый биоэлектрический импеданс живой ткани – комплексная величина, зависящая от частоты прикладываемого электрического тока. Активное сопротивление зависит от содержания и электролитного состава жидкости, уровня кровоснабжения ткани. Емкостная составляющая импеданса обусловлена наличием клеточных и внутриклеточных мембран [7]. Фазовый угол биоэлектрического импеданса позволяет оценить фиброз ткани (например, миокарда) [8]. Выявлено изменение сопротивления легкого при алкогольной интоксикации [6].
Для диагностики гипертрофии или дилатации левого желудочка сердца у больных с хронической сердечной недостаточностью было предложено использовать отношение компонентов биоэлектрического импеданса грудной клетки при высокой частоте (200 кГц) синусоидального тока [9]. При гипертонии наблюдали изменения уровня внутриклеточной жидкости и общей воды организма, оцениваемые методом биоимпедансной спектроскопии [10].
Неинвазивное измерение биоэлектрического импеданса легких с поверхности тела имеет ограничения в диагнозе состояния ткани. С применением математических моделей биоимпедансной диагностики показан малый вклад легких в значение биоэлектрического импеданса, измеренного на поверхности тела, зависящий от расположения электродов, частоты тока [11–13].
Прямое измерение электрического сопротивления ткани легких при развитии патологических процессов дыхательной и сердечно-сосудистой систем может позволить проводить оценку структурных и функциональных изменений легких.
Для моделирования кардиоэлектрического поля на поверхности тела необходимо учитывать изменения электрического сопротивления органов, окружающих сердце, при различных заболеваниях сердечно-сосудистой и дыхательной систем.
Недостаточно рассмотрен вопрос о реактивном сопротивлении биологических тканей и изменениях электрического сопротивления в зависимости от частоты зондирующего переменного электрического тока [9]. Параметры биоимпедансной спектроскопии легких при легочной гипертензии не изучены.
Цель работы – изучение биоэлектрического импеданса легких и тела у самок крыс с индуцированной монокроталином легочной гипертензией.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проведены на самках крыс линии Вистар (13 особей) массой тела 215.0 ± 13.8 г, в возрасте 3 месяцев, полученных из питомника лабораторных животных “Пущино” (г. Пущино, Россия). Животных содержали в условиях свободного доступа к водопроводной питьевой воде и корму в помещении с естественно-искусственным освещением. Крысы находились в вентилируемых клетках группами по 2–3 особи при температуре 20–22°C на подстилке из древесных стружек.
Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями комиссии по биоэтике Выльгортской научно-экспериментальной биологической станции – филиала Федерального исследовательского центра “Коми научный центр Уральского отделения Российской академии наук”.
Первую группу (опытную) составили 8 животных, которым моделировали легочную гипертензию путем подкожного введения однократной дозы монокроталина (100 мг/кг массы тела животных; Sigma-Aldrich, Германия). Крысам в группе контроля (n = 5) вводили сопоставимую дозу физиологического раствора (0.9%‑ный раствор NaCl).
Многочастотный биоэлектрический импеданс тела и легких регистрировали при помощи анализатора физических свойств материалов и веществ 126094W (Solartron Analytical, Великобритания). Полученные измерения отражали усредненную во времени (в течение 4 с) характеристику электрического сопротивления.
Измерения биоэлектрического импеданса тела крыс тетраполярным методом выполняли до и спустя месяц после введения препарата или физиологического раствора. Игольчатые электроды из нержавеющей стали размещали согласно рекомендациям [14], предложенным для оценки состава тела у крысы.
Для седации, подавления болевой чувствительности при измерении биоэлектрического импеданса тела, выхода животного из наркоза использовали золетил (2.5 мг/100 г массы тела внутримышечно). Спустя месяц после введения препарата, при проведении острого эксперимента со вскрытием грудной клетки, для глубокой наркотизации животного использовали уретан (1.2 г/кг массы тела внутрибрюшинно). У крыс перед вскрытием грудной клетки проводили трахеотомию и переводили животных на искусственное дыхание с использованием аппарата SAR-830/AP (CWE Inc., США). Частота дыхания была 60 дыханий в мин, дыхательный объем подбирали индивидуально (примерно 3 мл/100 г).
Измерение электрического импеданса легкого проводили на поверхности правого легкого. Использовали датчик с медными электродами (диаметр 0.1 мм, длина контакта ~1 мм), расстояние между измеряющими электродами 1.5 мм, токовыми – 4.5 мм. Вычисляли постоянную ячейки c ≈ 73 м–1 на основе измерений датчиком электрического сопротивления RNaCl физиологического раствора (NaCl, 0.9%-ный раствор) при температуре 24.9°С с использованием формулы c = RNaCl/ρNaCl, где ρNaCl = 0.713 Ом м.
У крыс измеряли длину тела без хвоста (L) в сантиметрах. Индекс массы тела вычисляли как отношение массы тела (г) к квадрату длины тела L (см2). Массу тела крыс определяли с помощью лабораторных электронных весов Acom JW-1 (Корея, точность 0.05 г). Массу сердца измеряли на аналитических весах (OHAUS Europe AR 0640, Швейцария, точность 0.5 мг).
После окончания эксперимента у четырех животных из опытной группы и двух из контрольной группы вырезали левое легкое. Гистологические срезы получали на микротоме-криостате СМ 1510S (Leica, Германия). Замороженные образцы ткани (–23°С) нарезали толщиной 5–7 мкм, окрашивали гематоксилином и эозином по стандартной методике [15]. Гистологические срезы фотографировали цифровой камерой-окуляром (DCM500, Бельгия).
Обработка экспериментальных данных электрического импеданса проведена с помощью оригинального программного обеспечения [16], реализованного средствами Delphi и функционирующего в среде Windows XP. Используя алгоритм аппроксимации данных (годографа) дугой окружности, предложенного в работе [17], вычисляли параметры модели Коула: сопротивление при нулевой (R0), характеристической (Rc), бесконечной (R∞) частоте, внутриклеточное сопротивление (Ri = R0R∞/(R0 – R∞)), характеристическую частоту, коэффициент α, показатели R∞/R0, R0 – R∞.
Внеклеточное сопротивление тканей равно сопротивлению при нулевой частоте (Rе = R0). При характеристической частоте переменный ток преодолевает омическое сопротивление клеточной мембраны, в измеряемое сопротивление вносит свой вклад и внеклеточная, и внутриклеточная жидкость [18].
У крыс опытной и контрольной групп сравнивали значения компонентов биоэлектрического импеданса (активного и реактивного сопротивления, амплитуды и фазового угла) легкого и тела при 10–200 кГц, параметры модели Коула.
При предположении, что тело является однородным цилиндром, определяли оценки суммарного объема воды (d2/Rc) и объема внеклеточной жидкости (d2/R0) в теле крыс согласно рекомендациям [18], где d – расстояние между измеряющими электродами.
Статистическая обработка проведена с помощью пакета программ Statistica 10.0. Для проверки нормальности распределения количественных признаков использовали критерий Шапиро–Уилка. Равенство дисперсий распределений признаков в группах проверяли по критерию Левена. Нормально распределенные количественные признаки представлены как среднее арифметическое ± стандартное отклонение. При распределении, не соответствующем нормальному, величины описаны при помощи медианы Ме и межквартильного размаха (Q1–Q3). Сравнения двух групп из совокупностей с нормальным распределением проводили с помощью t-критерия Стьюдента, отличающихся от нормального распределения – по критерию Манна–Уитни. Уровень значимости различий принимали равным 0.05. Для множественных сравнений использовали однофакторный дисперсионный анализ, ранговый анализ вариаций по Краскелу–Уоллису с последующей процедурой апостериорного сравнения средних (по критериям Шеффе, Тьюки или Манна–Уитни с применением поправки Бонферрони при оценке значения ρ). Анализ выборок при повторных измерениях проводили с помощью дисперсионного анализа повторных измерений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Массы тела и сердца значимо не различались у крыс опытной и контрольной групп. Относительная масса сердца у крыс в опытной группе была значимо меньше этого показателя у крыс в контрольной группе (от 3.6 ± 0.2 г/кг до 3.2 ± 0.2 г/кг, t = 4.27, df = 11, ρ = 0.001).
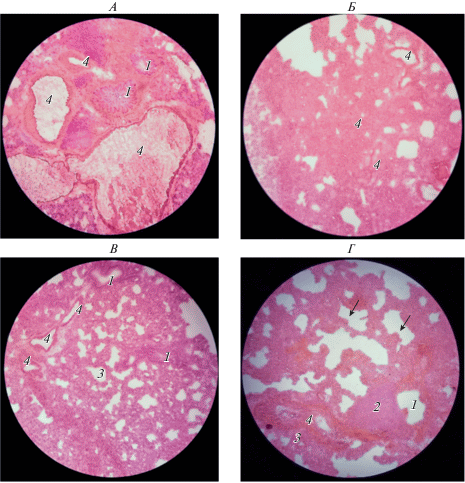
При гистологическом исследовании левого легкого у крыс в опытной группе выявлены изменения легочной паренхимы с формированием лимфоидных фолликулов, экссудата с лимфоцитами в просвете альвеол, ведущего к обтурации, увеличением интенсивности ангиогенеза, а также появлением участков с эмфизематозно расширенными альвеолами (рис. 1Б, 1Г).
Рис. 1.
Гистологическая картина периферических отделов легкого (с 250-кратным увеличением). Слева (рис. А, В) указаны гистологические срезы легкого в норме, справа (рис. Б, Г) – при вызванных монокроталином структурных повреждениях. 1 – бронхиола, 2 – лимфоидный фолликул, 3 – просвет альвеол, 4 –сосуды. Справа цифрой 4 показаны сосуды с утолщением стенок (сильно утолщенные стенки мелких артериол). На рис. Г стрелками показано эмфизематозно трансформированные альвеолы.
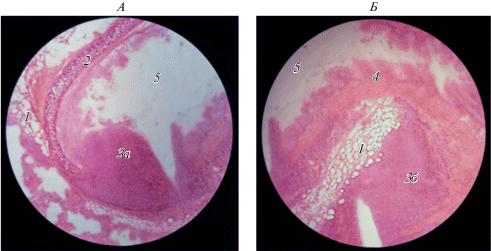
Выявлена деформация бронхов, сопровождающаяся изменением слизистой оболочки (преобразование однослойного многорядного реснитчатого эпителия в многослойный). Наблюдалось разрастание лимфоидной ткани как внутрь бронха, так и снаружи, приводящее к сдавливанию и к сужению его просвета. В области бронхов отмечено разрастание жировой ткани (рис. 2).
Рис. 2.
Гистологическая картина лимфоидной инфильтрации стенок бронха у самок крыс в опытной группе (с 400-кратным увеличением). 1 – жировая ткань, 2 – пластина бронхиального хряща, 3а – разрастание лимфоидной ткани внутрь бронха, 3б – разрастание лимфоидной ткани вокруг бронха, 4 – респираторный эпителий бронхов, 5 – просвет бронха.
В легких у крыс с монокроталиновой моделью легочной гипертензии наблюдали утолщение стенок кровеносных сосудов (рис. 1). Чем меньше диаметр сосуда, тем больше он был подвержен изменениям за счет отека. В мелких артериолах наблюдали сильное сужение просвета, практически полное его закрытие (рис. 1). Крупные ветви легочных артерий в большинстве образцов не были изменены. Значимых структурных изменений со стороны сосудов микроциркуляторного русла не выявлено.
При исследовании биоэлектрического импеданса легочной ткани у крыс в опытной группе выявлено значимое увеличение активного сопротивления (рис. 3) и амплитуды (рис. 4) по сравнению с крысами контрольной группы при частотах тока 10, 70 и 120 кГц (табл. 1). Электрическое сопротивление при нулевой и характеристической частотах, разность электрических сопротивлений при нулевой и бесконечной частотах, вычисленные по измерениям электрического биоимпеданса легких, значимо увеличились у крыс опытной группы по сравнению с крысами контрольной группы (табл. 2).
Рис. 3.
Активное сопротивление биоэлектрического импеданса легочной ткани у самок крыс опытной (темные столбики) и контрольной (светлые столбики) групп. * отмечено значимое различие у крыс с экспериментальной легочной гипертензией по сравнению с контрольной группой.
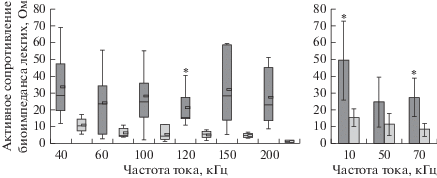
Рис. 4.
Амплитуда биоэлектрического импеданса легочной ткани у крыс опытной (темные столбики) и контрольной (светлые столбики) групп. * отмечено значимое различие у крыс с экспериментальной легочной гипертензией по сравнению с контрольной группой.
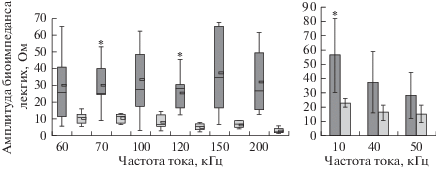
Таблица 1.
Компоненты биоэлектрического импеданса легкого у самок крыс в опытной (ОГ) и контрольной (КГ) группах
| Наименование показателя | Частота тока, кГц | Значение показателя | Значение статистического теста и достигнутого уровня статистической значимости | |
|---|---|---|---|---|
| ОГ | КГ | |||
| Активное сопротивление биоэлектрического импеданса легочной ткани | 10 | 48.9 ± 23.7 Ом | 15.1 ± 5.3 Ом | F1,12 = 5.7, ρ = 0.033 Критерий Шеффе: ρ = 0.034 |
| 70 | 27.0 ± 11.6 Ом | 7.9 ± 3.9 Ом | F1,13 = 15.0, ρ = 0.002 Критерий Шеффе: ρ = 0.002 Критерий Тьюки: ρ = 0.004 |
|
| 120 | 15.4 (14.7–27.5) Ом | 5.2 (4.2–7.0) Ом | H = 9.0, ст. св.1, ρ = 0.003 U = 0, Z = 2.9, ρ = 0.003 (6 сравнений) |
|
| Фазовый угол биоэлектрического импеданса легочной ткани | 10 | –24.4 ± 8.1° | –39.6 ± 17.2° | F1,12 = 7.8, ρ = 0.016 Критерий Шеффе: ρ = 0.016 Критерий Тьюки: ρ = 0.046 |
| 40 | –30.2 ± 9.0° | –47.6 ± 12.0° | F1,12 = 5.3, ρ = 0.039 Критерий Шеффе: ρ = 0.039 |
|
| Амплитуда биоэлектрического импеданса легочной ткани | 10 | 56.3 ± 25.6 Ом | 22.3 ± 3.0 Ом | F1,12 = 5.0, ρ = 0.045 Критерий Шеффе: ρ = 0.045 |
| 70 | 23.2 (22.7–36.8) Ом | 10.8 (6.8–12.1) Ом | H = 7.3, ст. св.1, ρ = 0.007 U = 4, Z = 2.9, ρ = 0.003 (6 сравнений) |
|
| 120 | 26.5 (15.5–28.4) Ом | 6.0 (5.1–6.5) Ом | H = 9.0, ст. св.1, ρ = 0.003 U = 0, Z = 2.7, ρ = 0.008 (6 сравнений) |
|
Таблица 2.
Параметры модели Коула, вычисленные по измерениям биоимпеданса легкого у крыс линии Вистар в опытной (ОГ) и контрольной (КГ) группах
| Компоненты модели Коула | Значение показателя, Ом | Значение критерия Манна–Уитни и достигнутого уровня статистической значимости | |
|---|---|---|---|
| ОГ | КГ | ||
| R0, Rе | 77.7 (38.6–119.2) | 30.4 (13.8–35.8) | U = 8, Z = 2.5, ρ = 0.014 |
| Rс | 51.5 (25.8–69.7) | 16.5 (8.4–19.6) | U = 7, Z = 2.6, ρ = 0.010 |
| R0–R∞ | 57.6 (25.5–107.1) | 27.6 (10.8–32.7) | U = 10, Z = 2.3, ρ = 0.024 |
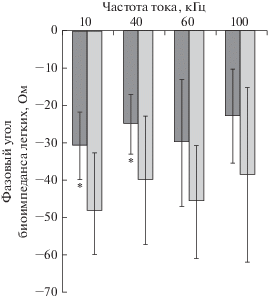
Значимо уменьшилось абсолютное значение фазового угла (рис. 5) биоэлектрического импеданса легочной ткани у крыс опытной группы по сравнению с крысами контрольной группы при частотах тока 10 и 40 кГц (табл. 1).
Рис. 5.
Фазовый угол биоэлектрического импеданса легочной ткани у крыс опытной (темные столбики) и контрольной (светлые столбики) групп. * отмечено значимое различие у крыс с экспериментальной легочной гипертензией по сравнению с контрольной группой.
У крыс в группе с монокроталиновым поражением отмечено значимое влияние препарата на изменение реактивного сопротивления биоэлектрического импеданса тела с нормировкой на длину тела L при 30 кГц (F1,11 = 15.71, ρ = 0.002). У крыс в монокроталиновой группе по сравнению с крысами контрольной группы спустя месяц после введения препарата наблюдали значимо меньшее абсолютное значение реактивного сопротивления биоимпеданса тела с нормировкой на длину тела (критерий Тьюки, ρ = 0.048; критерий Дункана, ρ = 0.027). За время опыта показатель уменьшился у крыс в опытной группе с 1.94 ± 0.27 Ом/см до 1.74 ± 0.21 Ом/см, и значимо увеличился у крыс в контрольной группе с 1.65 ± 0.10 Ом/см до 1.88 ± 0.21 Ом/см (критерий Дункана, ρ = 0.044). Активное сопротивление биоэлектрического импеданса тела с нормировкой на длину тела L в конце эксперимента, в среднем, было ниже у крыс линии Вистар в монокроталиновой группе по сравнению с животными контрольной группы.
Не было выявлено значимого влияния препарата на изменения оцениваемых нами объема внеклеточной жидкости, суммарного объема воды в теле крыс и их отношения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Ранее было показано, что у крыс при введении больших доз монокроталина (60–100 мг/кг) происходит острое повреждение легких, повреждаются не только легочные артерии, но наблюдается и альвеолярный отек, гиперплазия клеток межальвеолярных перегородок в легких, окклюзия легочных вен, заметный околососудистый отек, значимое утолщение альвеолярной перегородки [3].
При интоксикации монокроталином (доза 60 мг/кг, спустя три недели) у самок крыс была выявлена значимо большая концентрация протеинов в легких по сравнению с крысами из контрольной группы, пролиферация гранулированных пневмоцитов, бронхиолярного эпителия, отек легких [19].
Гистологическое исследование в нашей модели показало структурные изменения в легких (ремоделирование легочных сосудов), подтверждающие повышение легочного артериального давления и развитие легочной гипертензии. При отеке легких выпотевание отечной жидкости сопровождалось выхождением ее в альвеолы и бронхиолы, что обычно приводит к снижению дыхательного объема легких и сильному нарушению газообмена. Выявлены эмфизематозные изменения в легких.
Значимое увеличение сопротивления легочной ткани при частотах тока 10, 70 и 120 кГц у крыс опытной группы связано с воспалительным процессом и структурными изменениями в легких.
При эмфиземе легких патологически расширяется альвеолярное воздушное пространство, и электрическое сопротивление легочной ткани увеличивается [20].
У больных бронхиальной астмой увеличивается модульное значение импеданса на частотах 5, 10 и 20 кГц, соответствующее увеличению длины и сужению диаметра дыхательных путей [9, 21]. При большем объеме воздуха в легких амплитуда биоимпеданса легочной ткани человека, в среднем, выше при низких частотах (в том числе, сопротивление при нулевой частоте) [22].
Методом математического моделирования было показано, что при сужении просвета кровеносного сосуда (при стенозе) поверхностный биоимпеданс ткани увеличивается больше при низкой (50 кГц в сравнении с 100 МГц и 1 ГГц) частоте тока [23].
Повышение импеданса тканей при начинающемся воспалительном процессе в ране можно объяснить изменением мембранных структур клеток при их повреждении [24]. В очаге атеросклеротического повреждения (с фиброзным утолщением) амплитуда биоэлектрического импеданса ткани при 100 кГц тока была значимо выше при наличии обильной неоваскуляризации, воспалительных клеток и протеолитических ферментов [25].
Значимое уменьшение абсолютного значения фазового угла биоэлектрического импеданса легочной ткани (при 10 и 40 кГц тока) у крыс в опытной группе отражает воспалительные повреждения легких при токсическом воздействии монокроталина.
При повреждении клеточных мембран абсолютное значение фазового угла биоэлектрического импеданса тканей у человека уменьшается [26].
У крыс в группе с монокроталиновым поражением в используемой нами модели выявлено значимое уменьшение абсолютного значения реактивного сопротивления биоэлектрического импеданса тела по сравнению с крысами в контрольной группе. Реактивное сопротивление биоимпеданса тела обусловлено структурной целостностью клеточных мембран, образующих ткани, уменьшение значения реактивного сопротивления биоэлектрического импеданса тела может указывать на множественные повреждения клеточных мембран [27, 28].
У пациентов с застойной сердечной недостаточностью была показана отрицательная корреляционная связь между биоэлектрическим импедансом тела (с нормировкой на длину тела) и давлением заклинивания легочных капилляров, измеряемым методом эхокардиографии и характеризующим внутрисосудистое гидростатическое давление [29].
Отношение объемов внутриклеточной жидкости и общей воды организма, оцениваемое методом биоимпедансной спектроскопии, имеет значимую связь с легочным артериальным давлением и достоверно отличается у пациентов на последней стадии легочной гипертензии (с почечной недостаточностью, проходящих процедуру перитонеального диализа) по сравнению со здоровыми [30].
В нашем исследовании не отмечено значимого влияния препарата на изменения оценок объемов жидкости.
У самцов крыс показано более агрессивное течение легочной гипертензии, вызванной монокроталином, объясняемое более низкой антиоксидантной защитой, чем у самок [31]. Выявлен защитный эффект эстрадиола относительно развития легочной гипертензии у самок крыс [32, 33] по сравнению с самцами. При исследовании связей “активное напряжение–деформация”, “пассивное напряжение–деформация”, зависимости “сила–скорость” в препаратах из папиллярных мышц правого желудочка сердца самцов и самок крыс при монокроталиновом поражении показано различие механизмов адаптации к нагрузке у животных разного пола, возможно обусловленное более высоким адаптационным потенциалом систем регуляции сократимости миокарда у самок крыс по сравнению с самцами [34]. При введении эстрадиола 17β самцам крыс при монокроталиновой модели легочной гипертензии (при дозе 60 мг/кг) выявлено уменьшение медиальной гипертрофии небольших легочных артерий, гипертрофии правого желудочка сердца, числа альвеолярных макрофагов с накоплением липидов в альвеолярном пространстве, объема отечной жидкости в легких, большая плотность артерий с внешним диаметром менее 100 мкм [35].
Ранее нами было выявлено уменьшение электрического сопротивления легких у самцов крыс при монокроталиновой модели легочной гипертензии при 150 кГц [28]. При артериальной гипертензии разного генеза у самцов крыс электрическое сопротивление легких тоже снизилось [36, 37], что может свидетельствовать о накоплении внеклеточной жидкости в организме.
Поведение сопротивления легочной ткани в экспериментальной модели легочной артериальной гипертензии у самок крыс отличалось от полученных нами результатов у самцов. У самок крыс с легочной гипертензией, вызванной однократным введением монокроталина показано увеличение сопротивления легочной ткани по сравнению с крысами контрольной группы, значимое при нулевой частоте тока и при 10, 70 и 120 кГц.
Выявленное нами с использованием метода биоимпедансной спектроскопии значимое увеличение активного сопротивления и амплитуды биоэлектрического импеданса легочной ткани при низкой частоте тока может указывать на подтвержденные гистологически эмфизематозные изменения в легких; а изменение компонентов биоимпеданса при более высокой частоте может свидетельствовать о воспалительных повреждениях легочной ткани при монокроталиновом поражении, сужении просвета кровеносных сосудов в легких.
Экспериментальная легочная монокроталиновая артериальная гипертензия у самцов [28] и самок крыс линии Вистар вызвала схожие изменения биоэлектрического импеданса тела: тенденцию к снижению активного сопротивления биоэлектрического импеданса тела при всех частотах тока, указывающую на увеличение объема внеклеточной жидкости.
Значимое уменьшение значений фазового угла биоимпеданса легких и реактивного сопротивления биоэлектрического импеданса тела при низкой частоте у крыс опытной группы может указывать на вызванные монокроталином множественные повреждения клеточных мембран.
Список литературы
Boggard H.J., Abe K., Vonk N.A., Voelkel N.F. The right ventricle under pressure: Cellular and molecular mechanisms of right-heart failure in pulmonary hypertension. Chest. 135 (3): 794–804. 2009.
Stenmark K.R., Meyrick B., Galie N., Mooi W.J., McMurtry I.F. Animal models of pulmonary arterial hypertension: The hope for etiological discovery and pharmacological cure. Am. J. Physiol. Lung Cell Mol. Physiol. 297(6): L1013–1032. 2009.
Gomez-Arroyo J.G., Farkas L., Alhussaini A.A., Farkas D., Kraskauskas D., Voelkel N.F., Bogaard H.J. The monocrotaline model of pulmonary hypertension in perspective. Am. J. Physiol. Lung Cell Mol. Physiol. 302(4): L363–369. 2012.
Ogata T., Shibagaki T., Kamma H., Yokose T., Iizima T. Alveolar damage: Epithelial damage and endothelial damage. J. Toxicol. Pathol. 2(2): 223–240. 1989.
Kido M., Hirose T., Tanaka K., Kurozumi T., Shoyama Y. Increased alveolar-capillary membrane permeability by monocrotaline. Japn. J. Med. 20 (3): 170–179. 1981.
Торнуев Ю.В., Колдышева Е.В., Лапий Г.А., Балахнин С.М., Бушманова Г.М., Преображенская В.К. Электроимпедансометрия в гистологической технологии. Фундаментальные исследования. (6): 1164–1167. 2013. [Tornuev Yu.V., Koldysheva E.V., Lapii G.A., Balakhnin S.M., Bushmanova G.M., Preobrazhenskaya V.K. Electroimpedansometry in histological technology. Fundamen. Res. (6): 1164–1167. 2013. (In Russ.)].
Bioimpedance and Bioelectricity Basics / Edit. S.Grimnes, O.G.Martinsen; Third Edition. Amsterdam, Boston, Heidelberg, London, New York, Oxford, Paris, San Diego, San Francisco, Singapore, Sydney, Tokyo. Elsevier. Acad. Press. 2015.
Amorós-Figueras G., Jorge E., García-Sánchez T., Bragós R., Rosell-Ferrer J., Cinca J. Recognition of Fibrotic Infarct Density by the Pattern of Local Systolic-Diastolic Myocardial Electrical Impedance. Front Physiol. 31(7): 389. 2016. https://doi.org/10.3389/fphys.2016.00389
Мишланов В.Ю., Владимирский В.Е., Сыромятникова Л.И., Савкин В.В., Зуев А.Л., Судаков А.И., Шакиров Н.В., Езов С.Г. Новые патофизиологические механизмы актуальных респираторных и сердечно-сосудистых заболеваний и перспективы разработки методов диагностики на основе измерения электрического импеданса органов грудной клетки. Вестн. Пермск. Научн. центра УрО РАН. (2): 87–100. 2014. [Mishlanov V.Ju., Vladimirskiy V.E., Syromyatnikova L.I., Savkin V.V., Zuev A.L., Sudakov A.I., Shakirov N.V., Ezov S.G. Novel pathophysiological mechanisms of current respiratory and cardiovascular diseases and prospects of developing diagnostic methods based on thoracic electrical impedance measurement. Perm. Scient. Center J. (2): 87–100. 2014. (In Russ.)].
Cianci R., Citro F., Migneco A., Baldoni F., Minisci M.C., Di Daniele N., De Lorenzo A. Body fluid compartments in hypertension. Eur. Rev. Med. Pharmacol. Sci. 10: 75–78. 2006.
Yang F., Patterson R.P. The contribution of the lungs to thoracic impedance measurements: A simulation study based on a high resolution finite difference model. Physiol. Meas. 28(7): S153–161. 2007.
Василевский Ю.В., Данилов А.А., Николаев Д.В., Руднев С.Г., Саламатова В.Ю., Смирнов А.В. Конечно-элементный анализ задач биоимпедансной диагностики. Журн. вычисл. матем. и матем. физ. 52(4): 733–745. 2012. [Vasilevskij YU.V., Danilov A.A., Nikolaev D.V., Rudnev S.G., Salamatova V.YU., Smirnov A.V. Konechno-elementnyj analiz zadach bioimpedansnoj diagnostiki. Z. Hurn. vychisl. matem. i matem. fiz. 52(4): 733–745. 2012. (In Russ.)].
Cuba-Gyllensten I., Gastelurrutia P., Bonomi A.G., Riistama J., Bayes-Genis A., Aarts R.M. A method to adapt thoracic impedance based on chest geometry and composition to assess congestion in heart failure patients. Med. Eng. Phys. 38: 538–546. 2016. https://doi.org/10.1016/j.medengphy.2016.03.002
Hu L., Maslanik T., Zerebeckyj M., Plato C.F. Evaluation of bioimpedance spectroscopy for the measurement of body fluid compartment volumes in rats. J. Pharmacol. Toxicol. Methods. 65: 75–82. 2012.
Саркисов Д.С., Перов Ю.Л. Микроскопическая техника: Руководство для врачей и лаборантов. М. Медицина. 1996. [Sarkisov D.S., Perov Yu.L. Microscopical Equipment. Management. M. Medicine. 1996. (In Russ.)].
А.с. № 2015612667 РФ. Анализ биоэлектрического импеданса сегментов, органов и тканей тела животных и человека: свидетельство об официальной регистрации программы для ЭВМ [Текст] / Н.Л. Коломеец; заявитель и правообладатель ФГБУН Коми НЦ УрО РАН. № 2014663579; заявл. 12.2014; зарегистр. 24.02.2015. 1 с. [Kolomeyets N.L. Bioelectrical impedance analysis of body segments, organs and tissues in humans and animal. Certificate of registration of computer program № 2015612667. 2014. (In Russ.)].
Kun S., Ristic B., Peura R.A., Dunn R.M. Real-time extraction of tissue impedance model parameters for electrical impedance spectrometer. Med. Biol. Eng. Comput. 37(4): 428–432. 1999.
Cornish B.H., Thomas B.J., Ward L.C. Improved prediction of extracellular and total body water using impedance loci generated by multiple frequency bioelectrical impedance analysis. Phys. Med. Biol. 38(3): 337–346. 1993. https://doi.org/10.1088/0031-9155/38/3/001
Keane P.M., Kay J.M., Suyama K.L., Gauthier D., Andrew K. Lung angiotensin converting enzyme activity in rats with pulmonary hypertension. Thorax. 37(3): 198–204. 1982.
Nopp P., Rapp E., Pfutzner H., Nakesch H., Ruhsam C. Dielectric properties of lung tissue as a function of air content. Phys. Med. Biol. 1993. 38: 699–716. 1993.
Мишланов В.Ю. Исследование функции внешнего дыхания путем измерения электрического импеданса легких и дыхательных путей на различных частотах зондирующего переменного тока. Вест. соврем. клин. мед. 4(4): 24–28. 2011. [Mishlanov V.Yu. Lung and airways electrical impedance measurement on different probing current frequences or lung functional testing study. Bull. Curr. Clin. Med. 4(4): 24–28. 2011. (In Russ.)].
Sanchez B., Vandersteen G., Martin I., Castillo D., Torrego A., Riu P.J., Schoukens J., Bragos R. In vivo electrical bioimpedance characterization of human lung tissue during the bronchoscopy procedure. A feasibility study. Med. Eng. Phys. 35(7): 949–957. 2013. https://doi.org/10.1016/j.medengphy.2012.09.004
Shash Y.H., Eldosoky M.A.A., Elwakad M.T. The effect of vascular diseases on bioimpedance measurements: Mathematical modeling. Biomed. Res. Therapy. 5 (6): 2414–2431. 2018. https://doi.org/10.15419/bmrat.v5i6.453
Торнуев Ю.В., Хачатрян Р.Г., Хачатрян А.П., Махнев В.П., Осенний А.С. Электрический импеданс биологических тканей. М. Изд-во ВЗПИ. 1990. [Tornuev Yu.V., Hachatryan R.G., Hachatryan А.P., Mahnev V.P., Osenniy А.S. Electricheskiy impedans biologicheskih tkaney [Electrical impedance of biological tissues]. Мoscow: Izd-vо VZPI. 1990].
Streitner I., Goldhofer M., Cho S., Kinscherf R., Thielecke H., Borggrefe M., Suselbeck T., Streitner F. Cellular Imaging of Human Atherosclerotic Lesions by Intravascular Electric Impedance Spectroscopy. PLOS ONE. 7(4): e35405. 2012.
Garlini L.M., Alves F.D., Ceretta L.B., Perry I.S., Souza G.C., Clausell N.O. Phase angle and mortality: A systematic review. Eur. J. Clin. Nutr. 2018. https://doi.org/10.1038/s41430-018-0159-1
Nescolarde L., Yanguas J., Lukaski H., Alomar X., Rosell-Ferrer J., Rodas G. Effects of muscle injury severity on localized bioimpedance measurements. Physiol. Meas. 36(1): 27–42. 2015.
Коломеец Н.Л., Суслонова О.В., Смирнова С.Л., Рощевская И.М. Биоэлектрический импеданс тела крыс при монокроталиновой модели легочной гипертензии. Биомедицина. 15(1): 95–101. 2019. [Kolomeyets N.L., Suslonova O.V. Smirnova S.L., Roshchevskaya I.M. Bioelectrical impedance of the body in rats with monocrotaline-induced pulmonary hypertension. Biomedicine. 15(1): 95–101. 2019. (In Russ.)].
Parrinello G., Paterna S., Pasquale P.D., Torres D., Mezzero M., Cardillo M., Fasullo S., Rocca G.L., Licata G. Changes in Estimating Echocardiography Pulmonary Capillary Wedge Pressure After Hypersaline Plus Furosemide Versus Furosemide Alone in Decompensated Heart Failure. J. Card. Failure. 17(4): 331–339. 2011.
Unal A., Sipahioglu M., Oguz F., Kaya M., Kucuk H., Tokgoz B., Buyukoglan H., Oymak O., Utas C. Pulmonary hypertension in peritoneal dialysis patients: Prevalence and risk factors. Perit. Dial. Int. 29(2): 191–198. 2009.
Bal E., Ilgin S., Atli O., Ergun B., Sirmagul B. The effects of gender difference on monocrotaline-induced pulmonary hypertension in rats. Hum. Exp. Toxicol. 32(7): 766–774. 2013.
Tofovic P.S., Zhang X., Petrusevska G. Progesterone inhibits vascular remodeling and attenuates monocrotaline-induced pulmonary hypertension in estrogen-deficient rats. Prilozi. 30(1): 25–44. 2009.
Nadadur R.D., Umar S., Wong G., Eghbali M., Iorga A., Matori H., Partow-Navid R., Eghbali M. Reverse right ventricular structural and extracellular matrix remodeling by estrogen in severe pulmonary hypertension. J. Appl. Physiol. 113(1): 149–158. 2012.
Балакин А.А., Кузнецов Д.А., Лисин Р.В., Мухлынина Е.А., Проценко Ю.Л. Гендерные особенности адаптации к нагрузкам механизмов регуляции сократимости миокарда. Вест. Уральской мед. акад. науки. (2): 39–43. 2013. [Balakin Alexandr A., Kuznetsov D.A., Lisin R.V., Mukhlynina E.A., Protsenko Y.L. Gender-specific adaptation of regulatory mechanisms of myocardial contractility to external load. The Vestnik uralskoi med. аkad. nauki. (2): 39–43. 2013. (In Russ.)].
Farhat M.Y., Chen M.F, Bhatti T., Iqbal A., Cathapermal S., Ramwell P.W. Protection by oestradiol against the development of cardiovascular changes associated with monocrotaline pulmonary hypertension in rats. Br. J. Pharmacol. 110 (2): 719–723. 1993.
Коломеец Н.Л., Рощевская И.М. Электрическое сопротивление легких и межреберных мышц у крыс с артериальной гипертензией. Практическая медицина. (2): 50–55. 2017. [Kolomeyets N.L., Roshchevskaya I.M. The electrical resistance of the lungs and intercostal muscles in rats with arterial hypertension. Practical medicine. (2): 50-55. 2017. (In Russ.)].
Коломеец Н.Л., Смирнова С.Л., Рощевская И.М. Электрическое сопротивление легких, межреберных мышц и почки гипертензивных крыс линии НИСАГ. Биофизика. 61(3): 590–597. 2016. [Kolomeyets N.L., Smirnova S.L., Roshchevskaya I.M. The electrical resistance of the lungs, intercostal muscles, and kidneys in hypertensive ISIAH rats. Biophysics. 61(3): 498–504. 2016. (In Russ.)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


