Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 8, стр. 1054-1064
Ионорегулирующая функция почек и эффект глюкагоноподобного пептида-1 у крыс на высокосолевой диете
Е. В. Балботкина 1, А. Е. Боголепова 1, Т. А. Каравашкина 1, А. В. Кутина 1, *
1 Институт эволюционной физиологии и биохимии
им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: kutina_anna@mail.ru
Поступила в редакцию 10.07.2019
После доработки 11.07.2019
Принята к публикации 11.07.2019
Аннотация
Глюкагоноподобный пептид-1 (ГПП-1) – основной инкретиновый гормон, оказывающий инсулинотропное действие после приема пищи, а также физиологически значимый натрийуретический фактор, вносящий вклад в регуляцию баланса натрия и воды. Цель работы – оценить влияние ГПП-1 и его миметика на ионорегулирующую функцию почек у крыс, длительно содержащихся на диете с высокой концентрацией NaCl, а также при экспериментальной гиперволемии и гипернатриемии. У крыс линии Вистар, в течение месяца получавших корм с высоким содержанием NaCl (4%), по сравнению с животными на стандартной диете (0.4% NaCl) не изменилось артериальное давление и уровень предсердного натрийуретического пептида в крови, повысилась экскреция почками ионов натрия, кальция и хлоридов, снизилась концентрация альдостерона в крови. После введения ГПП-1 и его миметика, эксенатида, усилилась экскреция ионов натрия и хлоридов почками; величина натрийуреза была равной у крыс с различным уровнем потребления NaCl с пищей, что указывает на независимость натрийуретического действия ГПП-1 от избытка NaCl в организме при длительном высоком потреблении соли. По сравнению со стандартной диетой, на высокосолевом корме более низкий уровень альдостерона в крови у крыс обусловил меньшую потерю калия с мочой при действии ГПП-1 и эксенатида. Аналогичные изменения экскреции натрия и калия почками наблюдались при действии миметика ГПП-1 у крыс с гиперволемией, вызванной внутрибрюшинным введением изотонического раствора NaCl. При гипернатриемии после введения гипертонического раствора NaCl у крыс наблюдалась суммация эффектов эксенатида и нагрузочной пробы на выведение натрия. Таким образом, ГПП-1 является эффективным натрийуретическим фактором как в стандартных условиях водно-солевого баланса, так и при остром и хроническом избытке NaCl в организме.
Глюкагоноподобный пептид-1 (ГПП-1) является основным инкретиновым гормоном, который оказывает инсулинотропное действие после приема пищи [1], т.е. стимулирует выброс инсулина бета-клетками поджелудочной железы при постпрандиальном повышении уровня глюкозы в крови [2]. Его миметики (синтетические пептиды с пролонгированным действием, устойчивые к расщеплению ферментом дипептидилпептидазой-4) все шире внедряются в клиническую практику для лечения пациентов с сахарным диабетом 2 типа [3, 4]. Экспериментально обосновано, что, помимо участия в гомеостазе глюкозы, ГПП-1 является физиологически значимым диуретическим и натрийуретическим фактором [5, 6], вносящим вклад в регуляцию баланса натрия и воды посредством модуляции активности Na/H-обменника в проксимальных канальцах в почке [7]. Показано, что секреция ГПП-1 повышается как в ответ на прием пищи и поступление отдельных нутриентов [8, 9], так и на питье воды и различных солевых растворов [10, 11]. ГПП-1 и его миметики, действуя через свой специфический рецептор в клетках проксимального сегмента нефрона [12, 13], снижают реабсорбцию натрия и осмотически связанной с ним воды, увеличивают приток жидкости в дистальные отделы нефрона. При гипергидратации это способствует усилению экскреции воды, при гиперосмии и гипернатриемии – ускорению выведения натрия и повышению реабсорбции осмотически свободной воды в почках. Данные эффекты ГПП-1 были выявлены в экспериментах на животных с применением нагрузочных проб, вызывающих быстрые сдвиги водно-солевого равновесия [6, 14], а также при обследовании человека [15]. Для клинической практики большее значение имеют хронические изменения солевого баланса, в том числе задержка натрия и жидкости, связанные с различными заболеваниями сердечнососудистой системы и хронически высоким потреблением NaCl с пищей; актуален поиск средств, эффективно удаляющих избыток натрия и жидкости из организма при этих состояниях. Показано, что как высокое, так и низкое потребление соли с пищей в течение длительного времени могут существенно изменить экспрессию, функциональную активность различных натриевых транспортеров и каналов, их распределение на мембранах канальцевых клеток [16, 17], а также реакцию почек на диуретики и физиологически активные вещества [16, 18]. Представляло интерес оценить влияние ГПП-1 и его миметика на ионорегулирующую функцию почек у крыс, длительно содержащихся на диете с высокой концентрацией NaCl, а также при экспериментальной гиперволемии и гипернатриемии.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены на крысах линии Вистар в возрасте 3–5 мес. из экспериментально-биологической клиники ИЭФБ РАН в соответствии с принципами Базельской декларации и рекомендациями комиссии по биоэтике ИЭФБ РАН. Животные получали воду ad libitum, стандартный гранулированный корм для грызунов (Лабораторкорм, Россия) с нормальным содержанием NaCl или высокосолевой корм, полученный путем опрыскивания стандартного корма 20%-ным раствором NaCl (20 мл на 100 г корма) с дальнейшим высушиванием. Эксперименты проводили утром, накануне у животных в 17.00 забирали корм при сохранении свободного доступа к воде. Во всех сериях экспериментов у крыс собирали пробы мочи при спонтанных мочеиспусканиях в течение 4 ч после воздействий, для чего животных помещали в специальные индивидуальные клетки. После проведения эксперимента крыс возвращали в виварий, повторно их использовали в исследовании не ранее, чем через 1 нед. Число животных в каждой экспериментальной группе составило 10.
I серия экспериментов включала животных, которые получали стандартный или высокосолевой корм (n = 20 в каждой группе). Животных регулярно взвешивали и оценивали количество выпитой ими воды. Ионорегулирующую функцию почек у них оценивали через 2 недели после начала потребления корма с разным содержанием NaCl: в контроле и при действии ГПП-1 (Bachem, США) и эксенатида (Баета®, Eli Lilly, США). Эксенатид вводили в дозах 0.015 и 0.15 нмоль на 100 г массы тела (м.т.) внутримышечно. ГПП-1 инъецировали внутрибрюшинно в дозе 0.15 нмоль на 100 г м.т., за 30 мин до инъекции вводили ингибитор дипептидилпептидазы-4, вилдаглиптин (Matrix Scientific, Колумбия; 0.1 мг на 100 г м.т., внутрибрюшинно). В конце месяца наблюдений у крыс определяли уровень артериального давления и забирали пробы крови.
Во II серии экспериментов эффект эксенатида оценивали на фоне блокады рецепторов минералокортикоидов у животных, содержавшихся на стандартной диете (n = 20). Спиронолактон (Sigma-Aldrich, Китай) растворяли в растительном масле и вводили per os в дозе 2.5 мг в 0.2 мл на 100 г м.т. за 30 мин до инъекции эксенатида. Соответствующей группе контроля давали 0.2 мл растительного масла на 100 г м.т.
В III серии экспериментов у животных, содержавшихся на стандартной диете, вызывали острый избыток NaCl в организме (770 мкмоль Na на 100 г м.т.) с помощью нагрузочных проб (внутрибрюшинное введение 0.9%- или 2.5%-ного растворов NaCl); на этом фоне инъецировали эксенатид в дозе 0.015 нмоль на 100 г м.т. В отдельных экспериментах у контрольных животных и крыс через 15 мин после нагрузочных проб забирали кровь.
Измерение уровня артериального давления у бодрствующих крыс производили неинвазивным методом на двухканальной установке Coda (Kent Scientific Co, США). Животные, помещенные в фиксаторы, располагались на подогревающей платформе, обеспечивающей поддержание температуры тела в диапазоне 32–36°С, необходимом для корректности измерений. Регистрация зависимости объем–давление выполнялась с использованием окклюзионной и снабженной датчиком хвостовых манжет, соединенных с установкой.
Пробы крови забирали из общей сонной артерии под золетиловым наркозом (золетил, Вирбак, Франция, 5 мг в 0.1 мл на 100 г м.т. внутримышечно), после этого животных декапитировали. Для получения сыворотки кровь центрифугировали при 8000 об./мин и комнатной температуре в течение 15 мин. Кровь для определения концентрации предсердного натрийуретического пептида и альдостерона забирали в охлажденные пробирки с K3EDTA и немедленно центрифугировали при 2000 оборотах и 4°C в течение 15 мин, пробы плазмы крови хранили при –20°C до проведения анализа.
Минеральный состав корма определяли после его озоления азотной кислотой. Для этого порции растолченных кормов высушивали в термостате при 108°C в течение 20 ч до стабильного веса; в кварцевой пробирке к 50 мг пробы корма добавляли 0.5 мл 70%-ной азотной кислоты и выдерживали в суховоздушной бане при 90°C 1.5 ч до полного растворения, периодически взбалтывая. Затем перемешивали с 4.5 мл дистиллированной воды и центрифугировали 10 мин при 3000 об./мин, надосадочную жидкость отбирали. В полученных пробах определяли концентрацию катионов.
Осмоляльность мочи и сыворотки крови измеряли на микроосмометре 3300 Advanced Instruments (США). Концентрацию ионов натрия и калия в моче и пробах озоленного корма определяли на пламенном фотометре Sherwood-420 (Великобритания), магния и кальция – на атомно-абсорбционном спектрофотометре Shimadzu AA-6200 (Япония). Концентрацию креатинина и хлоридов в моче и сыворотке, а также концентрацию натрия и калия в сыворотке крови измеряли на биохимическом анализаторе Erba XL-200 с ионоселективным блоком (Чехия). Предсердный натрийуретический пептид и альдостерон определяли в плазме крови иммуноферментным методом с помощью наборов proANP(1–98) ELISA kit (Biomedica, Германия) и Aldosterone ELISA kit (Enzo Life Sciences, Швейцария), измерение оптической плотности и расчет концентрации проводили на микропланшетном ридере ELx808 (Bio-Tek Instruments, США).
Показатели функций почек рассчитывали по стандартным формулам [19] и нормировали на 100 г м.т. Данные представлены в виде среднего значения (M) ± ошибки среднего (m). Для сравнения групп использовали одно- или двухфакторный дисперсионный анализ с последующим применением теста Холма–Шидака. Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Содержание NaCl в высокосолевом корме превышало его количество в стандартном корме для грызунов в 10 раз, в расчете на влажный корм оно составило 4.1 ± 0.3% и 0.43 ± 0.01% соответственно. Калия, магния и кальция в кормах было 0.81 ± 0.01%, 0.27 ± 0.01% и 0.92 ± 0.04% соответственно. Крысы на высокосолевой диете потребляли больше воды (табл. 1) и выводили с мочой больше ионов натрия, кальция и хлоридов (табл. 2) по сравнению с животными, получавшими стандартный корм. Выведение ионов калия и магния у крыс при потреблении корма с разным содержанием NaCl не отличалось (табл. 2). Осмоляльность крови, концентрация ионов натрия и хлоридов у животных на высокосолевой диете были немного ниже, чем у крыс на стандартном рационе (табл. 1), а прибавка в массе тела выше (табл. 1), что свидетельствует о гемодилюции и задержке жидкости в организме при избытке NaCl. При этом уровни артериального давления у крыс двух экспериментальных групп значимо не различались (табл. 1).
Таблица 1.
Концентрация ионов в сыворотке крови, уровень артериального давления, потребление воды и концентрация гормонов в крови у крыс, получавших в течение месяца корм с различным содержанием NaCl (M ± m)
| Параметр | Стандартный корм 0.4% NaCl |
Высокосолевой корм 4% NaCl |
|---|---|---|
| Среднее артериальное давление, мм рт.ст. | 102 ± 4 | 105 ± 4 |
| Питье воды, мл/сут/крыса | 26.4 ± 1.4 | 37.1 ± 3.0** |
| Прирост массы тела, г/мес | 24 ± 1 | 29 ± 2* |
| Осмоляльность сыворотки, мОсмоль/кг H2O | 300 ± 1 | 296 ± 1** |
| Натрий сыворотки, ммоль/л | 143.8 ± 0.2 | 142.8 ± 0.3* |
| Калий сыворотки, ммоль/л | 4.5 ± 0.1 | 4.4 ± 0.1 |
| Хлориды сыворотки, ммоль/л | 107 ± 1 | 106 ± 1* |
| Магний сыворотки, ммоль/л | 0.81 ± 0.02 | 0.81 ± 0.03 |
| Кальций сыворотки, ммоль/л | 2.7 ± 0.1 | 2.7 ± 0.1 |
| Альдостерон плазмы, нг/л | 0.87 ± 0.03 | 0.69 ± 0.05** |
| Атриопептид плазмы, мкг/л | 3.0 ± 0.7 | 4.2 ± 0.8 |
Таблица 2.
Экскреция ионов почками за 1 ч у крыс, получавших корм с различным содержанием натрия, в контроле и при действии ГПП-1 и его миметика (M ± m)
| Группа и содержание NaCl в корме |
Na, мкмоль/ч |
Cl, мкмоль/ч |
К, мкмоль/ч |
Mg, мкмоль/ч |
Ca, мкмоль/ч |
|---|---|---|---|---|---|
| Контроль | |||||
| 0.4% | 6 ± 1 | 15 ± 2 | 8 ± 1 | 2.2 ± 0.2 | 0.05 ± 0.01 |
| 4% | 21 ± 3& | 33 ± 4& | 8 ± 1 | 2.6 ± 0.2 | 0.24 ± 0.04& |
| ГПП-1 + вилдаглиптин | |||||
| 0.4% | 132 ± 19** | 74 ± 12* | 23 ± 3* | 2.6 ± 0.3 | 0.74 ± 0.11** |
| 4% | 151 ± 23** | 96 ± 16* | 12 ± 2& | 3.2 ± 0.3 | 1.26 ± 0.18** |
| Эксенатид 0.015 нмоль | |||||
| 0.4% | 64 ± 16* | 43 ± 10 | 12 ± 2 | 2.9 ± 0.5 | 0.67 ± 0.20* |
| 4% | 63 ± 8* | 44 ± 5 | 5 ±1 & | 2.6 ± 0.3 | 0.77 ± 0.20 |
| Эксенатид 0.15 нмоль | |||||
| 0.4% | 228 ± 16*** | 141 ± 11*** | 20 ± 1*** | 6.7 ± 0.7** | 2.21 ± 0.23*** |
| 4% | 201 ± 20*** | 120 ± 12*** | 10 ± 2& | 5.7 ± 0.4*** | 2.60 ± 0.28*** |
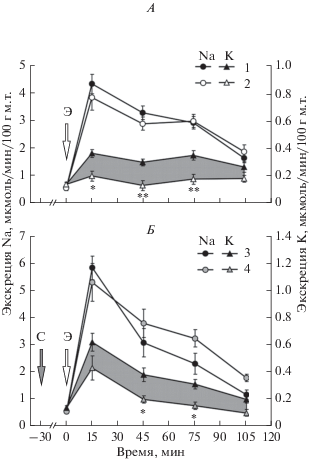
Выведение ионов натрия, хлоридов, магния и кальция почками при действии ГПП-1 и эксенатида усилилось в равной степени у крыс, получавших рацион с высоким и со стандартным содержанием NaCl (табл. 2). Выведение ионов калия у крыс на высокосолевой диете при действии ГПП-1 и его миметика было достоверно ниже, чем у крыс, получавших корм с нормальным содержанием NaCl, и не отличалось от группы контроля (табл. 2, рис. 1А). Это может объясняться тем, что при хроническом чрезмерном потреблении NaCl снижается секреция минералокортикоидов надпочечниками, это подтверждается выявленной более низкой концентрацией альдостерона в крови у крыс, в течение месяца получавших корм, содержащий 4% NaCl (табл. 1). Калийсберегающий эффект проявлялся и при введении эксенатида на фоне блокады рецепторов минералокортикоидов. После предварительного введения спиронолактона экскреция калия при действии эксенатида была ниже, чем в аналогичной группе без введения спиронолактона (рис. 1Б).
Рис. 1.
Влияние эксенатида в дозе 0.15 нмоль на 100 г м.т. на экскрецию почками ионов натрия и калия у крыс, получавших корм с различным содержанием NaCl, или на фоне блокады рецепторов альдостерона. А: 1 – стандартный корм, 2 – высокосолевой корм, Б: 3 – без спиронолактона, стандартный корм, 4 – с предварительным введением спиронолактона, стандартный корм. Серая стрелка – введение спиронолактона (С), белая стрелка – инъекция эксенатида (Э). * p < 0.05, ** p < 0.01 по сравнению с группой крыс, получавших стандартный корм, или с группой без введения спиронолактона.
Данные, полученные при действии ГПП-1 и его миметика у крыс, потребляющих корм с различным содержанием соли, были сопоставлены с их эффектами у крыс с острым избытком NaCl в организме, вызванным внутрибрюшинной инъекцией растворов NaCl. Выбор нагрузочных проб был обусловлен тем, что внутрибрюшинное введение, в отличие от перорального, не стимулирует секрецию кишкой ГПП-1 [10] и позволяет достаточно быстро ввести ненаркотизированному животному большой объем жидкости. Кратковременное увеличение объема жидкостей внутренней среды внутрибрюшинной инъекцией изотонического раствора NaCl не привело к изменениям параметров сыворотки крови (табл. 3); экскреция натрия возросла в небольшой степени и была сопоставима с таковой при длительном потреблении крысами корма с высоким содержанием NaCl. Внутрибрюшинная нагрузка гипертоническим раствором NaCl кроме гиперволемии вызвала гипернатриемию, гиперхлоремию и гиперосмию (табл. 3); экскреция натрия увеличилась более чем в 20 раз и сопровождалась повышением выведения ионов калия и магния (табл. 3).
Таблица 3.
Осмоляльность, концентрация ионов в сыворотке крови и экскреция различных ионов почками за 1 ч у крыс в контроле и при нагрузочных пробах с введением NaCl (M ± m)
| Параметр | Контроль | Нагрузка 0.9%-ным раствором NaCl | Нагрузка 2.5%-ным раствором NaCl |
|---|---|---|---|
| Осмоляльность сыворотки, мОсмоль/кг H2O |
299 ± 1 | 300 ± 1 | 314 ± 1# |
| Натрий сыворотки, ммоль/л | 143 ± 1 | 144 ± 1 | 152 ± 1# |
| Калий сыворотки, ммоль/л | 4.6 ± 0.1 | 4.4 ± 0.1 | 4.3 ± 0.1 |
| Хлориды сыворотки, ммоль/л | 101 ± 1 | 103 ± 1 | 112 ± 1# |
| Магний сыворотки, ммоль/л | 0.79 ± 0.03 | 0.76 ± 0.03 | 0.74 ± 0.02 |
| Кальций сыворотки, ммоль/л | 2.5 ± 0.1 | 2.5 ± 0.1 | 2.7 ± 0.1 |
| Экскреция натрия, мкмоль/ч | 6 ± 1 | 30 ± 4# | 142 ± 14# |
| Экскреция калия, мкмоль/ч | 8 ± 1 | 12 ± 2 | 52 ± 3# |
| Экскреция магния, мкмоль/ч | 2.2 ± 0.2 | 2.7 ± 0.4 | 5.4 ± 0.5# |
| Экскреция кальция, мкмоль/ч | 0.05 ± 0.01 | 0.15 ± 0.06 | 0.35 ± 0.08 |
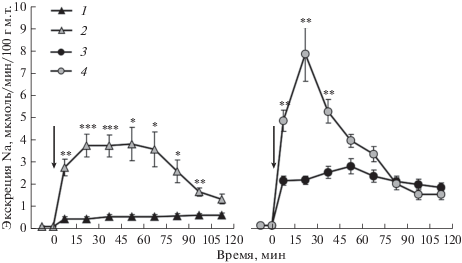
Выведение ионов натрия под действием миметика ГПП-1, эксенатида, у крыс с нормальным водно-солевым балансом и после нагрузки изотоническим раствором NaCl увеличилось в равной степени (рис. 2А). Значимо более высокий натрийурез наблюдался при действии эксенатида на фоне нагрузки гипертоническим раствором NaCl (рис. 2А и 3). При этом обращает на себя внимание, что величина прироста экскреции натрия от соответствующего контрольного уровня одинакова во всех трех экспериментальных группах (рис. 2А). Иная картина наблюдалась в отношении экскреции калия. Эксенатид в стандартных условиях стимулировал умеренный калийурез (рис. 2Б), на фоне нагрузки изотоническим раствором NaCl миметик ГПП-1 вызвал статистически значимый, но меньший по величине прирост экскреции калия (рис. 2Б). Внутрибрюшинное введение гипертонического раствора NaCl само по себе вызвало усиление экскреции калия почками. Инъекция на этом фоне эксенатида не изменила величину экскреции калия с мочой (рис. 2Б).
Рис. 2.
Влияние эксенатида в дозе 0.015 нмоль на 100 г м.т. на экскрецию ионов натрия (А) и калия (Б) у крыс при обычном водно-солевом режиме и после нагрузочных проб с введением NaCl. 1 – стандартные условия, 2 – нагрузка 0.9%-ным раствором NaCl, 3 – нагрузка 2.5%-ным раствором NaCl. * p < 0.05, ** p < 0.01, *** p < 0.001 при сравнении с группами без введения эксенатида; $ p < 0.05, $$ p < 0.01, $$$p < 0.001 при сравнении с аналогичной группой в стандартных условиях.
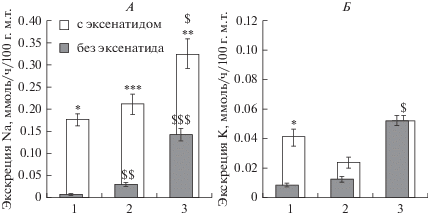
Рис. 3.
Влияние эксенатида в дозе 0.015 нмоль на 100 г м.т. на экскрецию натрия у крыс после нагрузочных проб с NaCl. Стрелка – момент введения препаратов: 1 – нагрузка 0.9% -ным раствором NaCl, 2 – то же + эксенатид, 3 – нагрузка 2.5%-ным раствором NaCl, 4 – то же + эксенатид. * p < 0.05, ** p < 0.01, *** p < 0.001 при сравнении с группой без введения эксенатида.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Регуляция баланса натрия в организме подчинена многокомпонентному контролю, в нем участвуют гормоны надпочечников, предсердий, нейрогипофиза, желудочно-кишечного тракта и др. [20–22]. Ключевым эффекторным звеном при этом являются процессы транспорта ионов в почечных канальцах. Изменение потребления солей натрия влияет как на уровень секреции различных гормонов, быстро регулирующих интенсивность реабсорбции ионов в зависимости от сдвигов параметров внутренней среды, так и на активность транспортных систем в нефроне, что оказывает долгосрочный эффект на функции почек. Так, показано, что при гиперволемии увеличивается уровень предсердного натрийуретического пептида [23], снижается активность ренин-ангиотензиновой системы [24], при гиперосмии и гипернатриемии растет секреция вазопрессина [25, 26] и окситоцина [26, 27], может изменяться локальная продукция биологически активных веществ (простагландины, оксид азота) [28, 29]. Сравнительно недавно было охарактеризовано еще одно звено в системе регуляции водно-солевого гомеостаза – инкретин ГПП-1. Вызываемое им угнетение реабсорбции натрия и жидкости в проксимальном отделе нефрона повышает значимость селективной реабсорбции ионов и воды в дистальных отделах и собирательных трубках при участии других гормонов и физиологически активных веществ [14]. Долгосрочные сдвиги баланса натрия вызывают не только изменение уровня гормонов, но и экспрессии и/или функциональной активности различных каналов и транспортеров в почечных канальцах. Показано, что при резком ограничении потребления соли повышается экспрессия Na/Cl-котранспортеров в дистальном извитом канальце и α-субъединиц эпителиальных натриевых каналов в собирательных трубках и связующем отделе [16]. При длительном избыточном поступлении натрия в организм изменяется распределение и функциональная активность практически всех транспортных систем для натрия, резко снижается эффективность действия тиазидных диуретиков [18].
Полученные в нашей работе данные указывают на то, что при избытке NaCl в организме ГПП-1 и его миметики сохраняют свое натрийуретическое действие. При длительном потреблении NaCl с пищей и однократном введении большого объема изотонического раствора NaCl натрийурез при действии ГПП-1 и эксенатида значимо не отличается от эффекта у крыс со стандартным водно-солевым режимом. Вероятно, при изотонической гиперволемии, вызванной как хроническим избытком NaCl, так и внутрибрюшинной нагрузочной пробой, преимущественно изменяется продукция альдостерона, изменяется реабсорбция натрия в конечных отделах нефрона и собирательных трубках, что вызывает небольшой по сравнению с эффектом ГПП-1 и его миметика рост выведения натрия с мочой. При введении эксенатида одновременно с гипертонической нагрузкой NaCl величина натрийуреза складывается из эффектов миметика ГПП-1 и самой нагрузки (увеличение количества профильтровавшегося натрия на фоне гипернатриемии, секреция и действие различных натрийуретических факторов, основным из которых предположительно является вазопрессин [6, 25]). Благодаря этому мы видим существенный рост экскреции ионов натрия и ускорение выведения избытка NaCl из организма.
Ранее было показано, что, хотя эксенатид и вызывает рост экскреции не только натрия, но и калия, и даже может способствовать коррекции гиперкалиемии [30], натрийуретическое действие миметика ГПП-1 намного превышает калийуретическое [31]. Результаты данной работы показывают, что натрийурез, вызванный ГПП-1, в зависимости от физиологических условий может быть как калийсберегающим, так и сопровождающимся ростом экскреции калия. По-видимому, эксенатид и ГПП-1, вызывая увеличение притока натрия в дистальные отделы нефрона, могут создавать условия для секреции калия. Величина же экскреции калия в значительной степени зависит от действующих параллельно с ГПП-1 регуляторных факторов (альдостерон, вазопрессин и др.) и может как сохраняться на контрольном уровне, так и возрастать в несколько раз. На фоне хронического положительного баланса натрия в организме наиболее значимо изменяется уровень минералокортикоидов [16, 32], то же самое происходит при введении животным изотонического раствора NaCl. Таким образом, при изотонической гиперволемии, развивающейся у крыс в обоих случаях, низкий уровень альдостерона обусловливает калийсберегающий натрийуретический эффект ГПП-1 и его миметика. При гипернатриемии усиление экскреции натрия сопровождается калийурезом, его величина в этих условия не зависит от действия ГПП-1.
Таким образом, ГПП-1 является эффективным натрийуретическим фактором как в стандартных условиях водно-солевого баланса, так и при остром и хроническом избытке NaCl в организме.
Список литературы
Rowlands J., Heng J., Newsholme P., Carlessi R. Pleiotropic effects of GLP-1 and analogs on cell signaling, metabolism, and function. Front. Endocrinol. (Lausanne). 9: 672. 2018.
Gastaldelli A., Gaggini M., DeFronzo R. Glucose kinetics: an update and novel insights into its regulation by glucagon and GLP-1. Curr. Opin. Clin. Nutr. Metab. Care. 20(4): 300–309. 2017.
Аметов А. С., Абаева Ф. Т. Современные возможности интенсификации сахароснижающей терапии у пациентов с сахарным диабетом 2-го типа. Проблемы эндокринологии. 58(6): 49–52. 2012. [Ametov A.S., Abaeva F.T. Modern possibilities for the intensification of hypoglycemic therapy in the patients presenting with type 2 diabetes mellitus. Probl. Endokrinol. 58(6): 49–52. 2012. (In Russ.)].
Галстян Г.Р., Каратаева Е.А., Юдович Е.А. Эволюция агонистов рецепторов глюкагоноподобного пептида-1 в терапии сахарного диабета 2 типа. Сахарный диабет. 20(4): 286–298. 2017. [Galstyan G.R., Karataeva E.A., Yudovich E.A. Evolution of glucagon-like peptide-1 receptor agonists for the treatment of type 2 diabetes. Diabetes Mellitus. 20(4): 286–298. 2017. (In Russ.)].
Skov J. Effects of GLP-1 in the kidney. Rev. Endocr. Metab. Disord. 15(3): 197–207. 2014.
Kutina A.V., Golosova D.V., Marina A.S., Shakhmatova E.I., Natochin Y.V. Role of vasopressin in the regulation of renal sodium excretion: interaction with glucagon-like peptide-1. J. Neuroendocrinol. 28(4): 1–8. 2016.
Farah L.X., Valentini V., Pessoa T.D., Malnic G., McDonough A.A., Girardi A.C. The physiological role of glucagon-like peptide-1 in the regulation of renal function. Am. J. Physiol. Renal Physiol. 310(2): F123–F127. 2016.
Karhunen L.J., Juvonen K.R., Huotari A., Purhonen A.K., Herzig K.H. Effect of protein, fat, carbohydrate and fibre on gastrointestinal peptide release in humans. Regul. Pept. 149: 70–78. 2008.
Ahren B., Carr R.D., Deacon C.F. Incretin hormone secretion over the day. Vitam. Horm. 84: 203–220. 2010.
Natochin Yu.V., Kutina A.V., Marina A.S., Shakhmatova E.I. Stimulus for glucagon-like peptide 1 secretion in rats. Dokl. Biol. Sci. 479: 57–59. 2018.
Marina A.S., Kutina A.V., Shakhmatova E.I., Balbotkina E.V., Natochin Y.V. Stimulation of glucagon-like peptide-1 secretion by water loading in human. Dokl. Biol. Sci. 459: 323–325. 2014.
Carraro-Lacroix L.R., Malnic G., Girardi A.C. Regulation of Na+/H+exchanger NHE3 by glucagon-like peptide 1 receptor agonist exendin-4 in renal proximal tubule cells. Am. J. Physiol. Renal Physiol. 297: F1647–F1655. 2009.
Thomson S.C., Kashkouli A., Singh P. Glucagon-like peptide-1 receptor stimulation increases GFR and suppresses proximal reabsorption in the rat. Am. J. Physiol. Renal Physiol. 304: F137–F144. 2013.
Natochin Y.V., Marina A.S., Kutina A.V., Balbotkina E.V., Karavashkina T.A. The mechanism of glucagon-like peptide-1 participation in the osmotic homeostasis. Dokl. Biol. Sci. 469(1): 156–158. 2016.
Шахматова Е.И., Пименова Е.В., Шуцкая Ж.В. Влияние баеты на осморегулирующую функцию почек у человека при сахарном диабете. Эксп. клинич. фармакол. 77(3): 24–27. 2014. [Shakhmatova E.I., Pimenova E.V., Shchutskaia Zh.V. Effect of byetta on renal osmoregulatory function in patients with diabetes mellitus. Eksp. Klin. Farmakol. 77(3): 24–27. 2014. (In Russ.)].
Knepper M.A., Kim G.H., Masilamani S. Renal tubule sodium transporter abundance profiling in rat kidney: response to aldosterone and variations in NaCl intake. Ann. N. Y. Acad. Sci. 986: 562–569. 2003.
Yang L.E., Sandberg M.B., Can A.D., Pihakaski-Maunsbach K., McDonough A.A. Effects of dietary salt on renal Na+ transporter subcellular distribution, abundance, and phosphorylation status. Am. J. Physiol. Renal Physiol. 295(4): F1003–F1016. 2008.
Walsh K.R., Kuwabara J.T., Shim J.W., Wainford R.D. Norepinephrine-evoked salt-sensitive hypertension requires impaired renal sodium chloride cotransporter activity in Sprague-Dawley rats. Am. J. Physiol. Regul. Integr. Comp. Physiol. 310(2): R115–R124. 2016.
Наточин Ю.В. Почка. Справочник врача. СПб. СПБГУ. 1997. [Natochin Y.V. Pochka. Spravochnik vracha. [Kidney. Doctor’s handbook]. St-Petersburg. SPbU. 1997].
Ventura R.R., Gomes D.A., Reis W.L., Elias L.L., Castro M., Valenca M.M., Carnio E.C., Rettori V., McCann S.M., Antunes-Rodrigues J. Nitrergic modulation of vasopressin, oxytocin and atrial natriuretic peptide secretion in response to sodium intake and hypertonic blood volume expansion. Braz. J. Med. Biol. Res. 35(9): 1101–1109. 2002.
Логвиненко Н.С. Альдостерон: молекулярный механизм действия. Рос. физиол. журн. им. И.М. Сеченова. 93(7): 746–761. 2007. [Logvinenko N.S. Aldosterone: the mechanisms of molecular action. Russ. J. Physiol. 93(7): 746–761. 2007. (In Russ.)].
Mecawi Ade S., Ruginsk S.G., Elias L.L., Varanda W.A., Antunes-Rodrigues J. Neuroendocrine regulation of hydromineral homeostasis. Compr. Physiol. 5(3): 1465–1516. 2015.
Amadieu-Farmakis M., Giry J., Barlet J.P. Increase in plasma concentrations of atrial natriuretic peptide during infusion of hypertonic saline in conscious newborn calves. J. Endocrinol. 119(1): 23–29. 1988.
Andersen L.J., Jensen T.U., Bestle M.H., Bie P. Isotonic and hypertonic sodium loading in supine humans. Acta Physiol. Scand. 166(1): 23–30. 1999.
Lichardus B., Foldes O., Styk J., Zemankova A., Kovacs L. On the role of digoxin-like substances, ANP, and AVP in natriuresis induced by hypertonic saline infusion in dogs. J. Cardiovasc. Pharmacol. 22 (Suppl. 2): S82–S83. 1993.
Stricker E.M., Callahan J.B., Huang W., Sved A.F. Early osmoregulatory stimulation of neurohypophyseal hormone secretion and thirst after gastric NaCl loads. Am. J. Physiol. Regul. Integr. Compr. Physiol. 282(6): R1710–R1717. 2002.
Huang W., Lee S.L., Sjoquist M. Natriuretic role of endogenous oxytocin in male rats infused with hypertonic NaCl. Am. J. Physiol. 268(3 Pt. 2): R634–R640. 1995.
Wangensteen R., Rodriguez-Gomez I., Moreno J.M., Chamorro V., Osuna A., Vargas F. Role of neuronal nitric oxide synthase in response to hypertonic saline loading in rats. Acta Physiol. Scand. 182(4): 389–395. 2004.
Дубинина А.Д., Иванова Л.Н. Влияние блокады синтеза простагландинов на натрийуретическую функцию почек крыс со стресс-индуцируемой гипертензией (линия НИСАГ). Рос. физиол. журн. им. И.М. Сеченова. 104(12): 1442–1455. 2018. [Dubinina A.D., Ivanova L.N. Effects of blockade of prostaglandin production on renal natriuretic function in rats with stress-induced hypertension (ISIAH). Russ. J. Physiol. 104(12): 1442–1455. 2018. (In Russ.)].
Marina A.S., Kutina A.V., Natochin Y.V. Exenatide enhances kaliuresis under conditions of hyperkalemia. Bull. Exp. Biol. Med. 152(2): 177–179. 2011.
Кутина А.В., Марина А.С., Наточин Ю.В. Натрийуретическое свойство эксенатида: высокая эффективность и локализация действия. Эксп. клинич. фармакол. 75: 22–25. 2012. [Kutina A.V., Marina A.S., Natochin Iu.V. Natriuretic effect of exenatide: high efficacy and site of action. Eksp. Klin. Farmakol. 75(2): 22–25. 2012. (In Russ.)].
Wang W., Shen J., Cui Y., Jiang J., Chen S., Peng J., Wu Q. Impaired sodium excretion and salt-sensitive hypertension in corin-deficient mice. Kidney Int. 82(1): 26–33. 2012.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


