Российский физиологический журнал им. И.М. Сеченова, 2019, T. 105, № 9, стр. 1122-1132
Влияние эндоканнабиноида анандамида на эффективность норадренергической нейропередачи в миндалевидном теле при остром стрессе у мышей
Э. А. Андяржанова 1, 2, *, В. С. Кудрин 1, С. Т. Вотьяк 3
1 НИИ фармакологии им. В.В. Закусова
Москва, Россия
2 Clinic of Psychiatry and Psychotherapy, University Hospital Bonn
Bonn, Germany
3 Max Planck Institute of Psychiatry
Munich, Germany
* E-mail: Elmira.Anderzhanova@ukbonn.de
Поступила в редакцию 02.06.2019
После доработки 03.07.2019
Принята к публикации 03.07.2019
Аннотация
Влияние эндоканнабиноидной нейропередачи на секрецию кортикостерона надпочечниками и высвобождение норадреналина в миндалевидном теле во время острого стресса, смоделированного в тесте “приподнятая платформа”, изучали с помощью метода внутримозгового микродиализа у мышей линии С57Bl/6N с использованием антагониста CB1 рецепторов римонабанта и ингибитора обратного захвата анандамида AM-404. Увеличение секреции кортикостерона при действии римонабанта (3 мг/кг, перорально) подтверждает роль CB1 рецепторов в контроле активности гипоталамо-гипофизарно-адреналовой (ГГА) системы и удостоверяет их влияние на амплитуду, но не длительность секреции гормона. Стресс сопровождается транзиторным увеличением высвобождения норадреналина в миндалевидном теле. АМ-404 (3 мг/кг, внутрибрюшинно) подавляет, но не ингибирует полностью вызванное стрессом высвобождение норадреналина, уменьшая его до контрольных уровней. Результаты свидетельствуют о том, что эндоканнабиноид анандамид участвует в регуляции пресинаптического высвобождения норадреналина в миндалевидном теле в условиях психологического стресса.
Комплексный ответ организма на стресс включает изменение процессов памяти. В качестве адаптивной реакции стресс может способствовать лучшему запоминанию специфической информации о факторе стресса и контексте стрессовой ситуации. Это позволяет вовремя распознать угрозу в будущем и, таким образом, избежать или уменьшить ее. Стресс также влияет на запоминание информации, которая не имеет непосредственной связи с детерминантой стресса, но ассоциирована с ним по времени [1]. Конечное влияние стресса на запоминание различно (усиление, ослабление памяти или отсутствие эффекта) и зависит от суммы условий. К ним относятся уровень активации гипоталамо-гипофизарно-адреналовой (ГГА) системы, модальность стрессора, характер запоминаемой информации, психофизиологическое состояние биологического объекта. Эффект этих и других факторов свидетельствует о принципиальной возможности влияния на количественные и качественные характеристики запоминания.
Исследование механизмов, которые участвуют в реализации взаимодействия сигналинга кортикостерона и норадренергической нейропередачи, является важной компонентой изучения психофизиологии стресса. Это определяется необходимостью в получении терапевтических средств, которые бы не столько подавляли память о стрессоре, сколько устраняли обусловленный им негативный эмоциональный ответ на контекст стрессирующей ситуации. При поиске мишеней новых лекарственных средств системе эндогенных каннабиноидов уделяется особое внимание [2, 3]. Фармакологические модуляторы эндоканнабиноидной нейропередачи рассматриваются как кандидаты в новый класс противотревожных препаратов [4, 5].
Эндоканнабиноиды обеспечивают модуляцию нейрональной активности по типу негативной обратной связи, функционирующей только по факту активации глутаматергической или ГАМК-ергической синаптической передачи. Активация постсинаптических глутаматных и ГАМК-рецепторов – пусковой фактор синтеза и высвобождения эндоканнабиноидов. После ретроградного пассажа в синаптическом пространстве эндоканнабиноиды ингибируют высвобождение глутамата и ГАМК, внося существенный вклад в синаптическую регуляцию [2].
Поскольку высвобождение эндоканнабиноидов вторично по отношению к активации глутаматергической и ГАМК-ергической нейропередачи, то при применении веществ с эндоканнабиноидной активностью возможно адресное, соответствующее паттерну активации нейрональной сети при стрессе, изменение уровней норадренергической нейропередачи [6].
Активность миндалевидного тела в период непосредственно после психотравмы (20–30 мин) является критичным для формирования эмоциональной памяти [7]. В этот процесс вовлекаются как системные, так и локальные механизмы. Во-первых, активность центрального региона миндалевидного тела опосредует влияние на активность ГГА оси, ингибируя ГАМК-ергические нейроны в окружении паравентрикулярного ядра гипоталамуса, таким образом, усиливая активность последнего [8]. Нейроны миндалевидного тела участвуют в продукции кортикотропина и влияют на активность норадренергической системы мозга [9, 10].
Для формирования эмоциональной памяти о стрессе, в острой фазе психотравмы существенным является взаимодействие сигналинга норадреналина и кортикостерона (не относящегося к его геномным эффектам) на уровне базолатерального региона миндалевидного тела [11]. Исследователями под руководством Dr. B. Roozendaal было высказано предположение, что опосредуемое кортикостероном во время острого стресса увеличение высвобождения норадреналина в миндалевидном теле, которое происходит с вовлечением высвобождения ГАМК, регулируемого эндоканнабиноидами (анандамидом и 2-арахидолинглицеролом), усиливает эмоциональную память о стрессе [12]. Блокирование этого механизм предполагается ведущим в терапевтическом действии антагониста β-адренергических рецепторов пропранолола при терапии острой фазы посттравматического стрессового расстройства [13], поскольку известно, что пропранолол при его системном и локальном (в миндалевидное тело) введении оказывает влияние на консолидацию травматической памяти [14, 15].
Целью настоящего исследования была проверка гипотезы о существовании влияния эндоканнабиноидов на высвобождение норадреналина при стрессе [12, 16]. Для этого методом внутримозгового микродиализа была проведена оценка эффектов психологического стресса, смоделированного в тесте “приподнятая платформа” и фармакологических модуляторов эндоканнабиноидной нейропередачи на уровень секреции кортикостерона и на высвобождение норадреналина в миндалевидном теле.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Использовали мышей линии С57Bl/6N возраста 10–12 недель из питомника Martinsried, Германия. Животных содержали в стандартных условиях вивария при естественной суточной смене освещения день/ночь и свободном доступе к воде и пище. Содержание животных соответствовало правилам надлежащей лабораторной практики утвержденной European Community Council Directive 2010/63/EEC. При проведении экспериментов были приняты меры, исключающие излишние физические страдания или повреждение животных.
Общая схема экспериментов. За 8 дней до микродиализной фазы животным имплантировали канюлю микродиализного зонда. За день до микродиализной фазы проводили инсталляцию микродиализного зонда. В течение каждого экспериментального дня оценивали базальные и стимулированные уровни кортикостерона или норадреналина. Для того чтобы провести оценку динамических изменений в секреции кортикостерона использовали метод мозгового микродиализа [17, 18]. Измеряемое в мозге содержание гормона полностью отражает изменения в содержании свободной формы в плазме крови, поскольку кортикостерон проникает через гематоэнцефалический барьер (ГЭБ) [17]. При этом определение измерений в гиппокампе оправдано тем, что гиппокамп является структурой, вовлеченной в патогенез ассоциированных со стрессом психопатологий. Длительность сбора микродиализных фракций составляла 20 мин. Для моделирования стресса животных помещали однократно на приподнятую платформу на 20 мин. Оценивали эффекты веществ с эндоканнабиноидной активностью: (1) селективного обратимого антагониста эндоканнабиноидных рецепторов первого типа CB1 римонабанта (Cat. N. 0923, Tocris, Германия), и (2) эндоканнабиноидомиметика AM-404 (Cat. N. 0952, Tocris, Германия), сочетающего свойства селективного ингибитора транспорта анандамида и агониста валлиноидных рецепторов, при сравнении с растворителем (4.25% полиэтиленгликоля 400, 4.25% ТВИН80, 15% диметилсульфоксида, 76.5% физиологического раствора). Растворы вводили в объеме 10 мл/кг.
Эксперимент 1. Оценку содержания свободной формы кортикостерона проводили в гиппокампе. В первый день эксперимента оценивали эффекты вводимого перорально (п.о.) римонабанта (3 мг/кг) или растворителя. На второй день эксперимента мышам повторно п.о. вводили римонабант или растворитель и через 2 ч подвергали стрессу, смоделированному в тесте “приподнятая платформа”.
Эксперимент 2. Оценку высвобождения норадреналина проводили в миндалевидном теле. Мышей подвергали стрессированию в тесте “приподнятая платформа”. Животные экспериментальной группы за 20 мин до стрессирования получали внутрибрюшинно (в.б.) AM-404 (3 мг/кг); животные контрольной группы получали растворитель. Вещество АМ-404 проявляет анксиолитический эффект в эксперименте [19, 20]. Основным молекулярным механизмом его действия является угнетение обратного захвата эндоканнабиноида анандамида. Поэтому АМ-404 способствует аккумуляции в межклеточном пространстве и повышению вероятности связывания de novo синтезированного и высвобождающегося анандамида с CB1 рецепторами.
Тест “приподнятая платформа”. Аппаратная установка была сделана из нескользкого непрозрачного пластика, платформа диаметром 10 см была помещена на высоте 60 см от уровня пола [21]. Во время процедуры мышь помещали в центр платформы и оставляли на 20 мин при освещении 250 люкс. В течение первых 10 мин не наблюдали никаких движений за исключением тех, которые были связаны с дыхательной экскурсией грудной клетки, что на оценочном уровне удостоверяло эффективность стрессированя.
Внутримозговой микродиализ. Стереотаксическую имплантацию с помощью стереотаксической рамки (TSE Systems Inc., Германия) проводили при анестезии и анальгезии изофлураном (1–2% v/v в воздухе, (Abbot, Индия), Metacam® (0.5 мг/кг, в.б., Boehringer Ingelheim, Германия) и Novalgin® (200 мг/кг, подкожно, Sanofi-Aventis, Германия), лидокаином (0.5%-ный раствор, подкожно, Xylocaine®, AstraZeneca Int.).
Постоянную температуру тела (37°C) поддерживали при помощи термостатируемого коврика (Harvard Apparatus, США). Микродиализные канюли (MAB4.15.IC, Microbiotech Se, Швеция) имплантировали в правый гиппокамп (−3.00 AP, +3.00 ML, −1.80 DV) или в правое миндалевидное тело (−1.50 AP, +3.20 ML, −4.00 DV) [22]. Имплант фиксировали стальными микрошурупами с помощью быстрополимеризующегося зубного цемента (Vivadent, Германия). По окончании операции мышь перемещали в микродиализную клетку размерами (16 × 16 × 32 см) сделанную из прозрачного плексигласа. Воду и корм предоставляли ad libitum. В течение 3 дней при признаках болевого синдрома (низком уровне груминга, агрессивном поведении, общей заторможенности и низком уровне потребления воды и корма) мышам подкожно водили Metacam® в дозе 0.5 мг/кг.
За день до эксперимента животных подвергали кратковременной (1–2 мин) анестезии изофлураном (3–4% v/v в воздухе), микродиализный зонд (MAB4.15.3, 15 кДа, 3 мм, в случае микродиализа гиппокампа и MAB4.15.1, 15 кДа, 1 мм, в случае микродиализа миндалевидного тела, Microbiotech Se, Швеция), перфузируемый стерильной искусственной цереброспинальной жидкостью с помощью шприцевого насоса (Harvard Apparatus, США), инсталлировали в канюлю. Перфузионная линия состояла из пластиковых (FEP) трубочек и вертлюга для жидкостей с низким внутренним объемом TCS2-23 (Eicom, Япония). Фиксирование животного осуществлялось с помощью стальной проволоки, что, в сочетании с вертлюгом, давало возможность свободного перемещения животного в микродиализной клетке и переноса его на приподнятую платформу. До начала эксперимента и между двумя экспериментальными днями скорость перфузии составляла 0.3 мкл/мин, рабочая скорость перфузии составляла 1.5 мкл/мин. Миродиализаты замораживали и хранили при –80°С до момента анализа. После завершения микродиализа животных декапитировали, мозги замораживали и проверяли фактическую локализацию микродиализных зондов в серии криосекций.
Высокоэффективная жидкостная хроматография. Для определения содержания норадреналина в микродилизатах использовали автоматизированную хроматографическую систему с электрохимической детекцией (UltiMate3000 CoulochemIII, ThermoFischer, США). Разделение моноаминов проводили на аналитической колонке (C18, 150 × 3 мм, 3 мкм, YMC Triart, YMC Europe GmbH, Германия) при скорости цитратно-фосфатной мобильной фазы 0.4 мл/мин (0.1 моль/л цитратно-фосфатный буфер, 1.85 ммоль/л 1-октансульфоновая кислота, 0.1 ммоль/л ЭДТА-Na2 и 5% ацетонитрил (v/v), pH = 4.0). Потенциалы рабочих электродов были устновлены на −150 и +220 мВ; потенциал электрода предокисляющей ячейки был установлен на +350 мВ. Количественная оценка была проведена путем сравнения площадей хроматографических пиков, соответствующих моноаминам внутреннего стандарта. Предел детекции для норадреналина составлял 0.032 нмоль/л [18].
Радиоиммунологическое определение кортикостерона. Определение содержания кортикостерона в диализатах проводили с использованием набора реагентов M-PBiomedicals (США) согласно протоколу производителя. Декларируемый предел детекции составлял 7 нг/мл. Определение концентраций проводили путем сравнения с калибровочной кривой.
Статистическая обработка результатов. Обработку полученных данных проводили в программе “Graph Pad Prizm 7” GraphPad Software, La Jolla California США, www.graphpad.com). Проверку результатов на нормальность распределения осуществляли по критерию Шапиро–Уилка и Колмогорова–Смирнова. Различия между дисперсиями среднего устанавливали методом двухфакторного дисперсионного анализа (время × препарат, время × день) с последующим post-hoc анализом (тест Туки). Данные представлены в виде средних значений (абсолютных концентраций кортикостерона и относительных изменений концентрации норадреналина в микродиализатах) с указанием стандартной ошибки среднего.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Эксперимент 1. Влияние римонабанта на вызванную стрессом секрецию кортикостерона. Базальные уровни свободного кортикостерона измеренные в гиппокампе мышей линии С57Bl/6N в первый день эксперимента составляли 76.1 ± 7.9 нг/мл микродиализата. Минимум составил 6.4 нг/мл, максимум – 200.9 нг/мл, медиана – 70.5 нг/мл. Проверка на нормальность подтвердила соответствие распределения значений кривой Гаусса (тест Шапиро–Уилка: W = 0.94, p = 0.06, тест Колмогорова–Смирнова: дистанция = 0.12, p > 0.10).
В первый день эксперимента оценивали эффект римонабанта (3 мг/кг) на секрецию кортикостерона. В обеих группах мышей пероральное введение препаратов сопровождалось немедленным увеличением секреции кортикостерона (рис. 1). В контрольной группе мышей, получавших растворитель, концентрация кортикостерона в микродилизатах была повышенной в течение 60 мин после введения растворителя (фракции 4–6), достигая величины 219.4 ± 17.4 нг/мг. Через 120 мин после введения (фракция 9) измеряемые концентрации возвращались к базальным значениям (рис. 1). Римонабант усиливал секрецию кортикостерона, сопровождавшую пероральное введение. Пиковая концентрация кортикостерона в этой группе составила 316.2 ± 18.9 нг/мг. Особенно выраженными были различия между концентрациями измеряемыми через 40, 60 и 80 мин после введения препаратов (фракции 5–7). Однако римонабант не влиял на темпоральный характер секреции гормона, и через 120 мин после его введения уровень кортикостерона возвращался к базальным значениям (рис. 1). Двухфакторный дисперсионный анализ удостоверил различия между эффектами римонабанта и растворителя, указав на статистически значимые эффекты времени (F(13,156) = 55.83, p < 0.001) и взаимодействия факторов времени и введенного вещества (F(13,156) = 3.78, p < 0.001). Эффект вещества был незначимым (F(1,12) = 3.2, p = 0.10).
Рис. 1.
Изменения уровней свободного кортикостерона, измеренных в гиппокампе мышей линии C57Bl/6N, при действии римонабанта (3 мг/кг, п.о.). Стрелка обозначает момент введения вещества или контрольного растворителя. * р < 0.05 (при сравнении римонабант vs. растворитель).
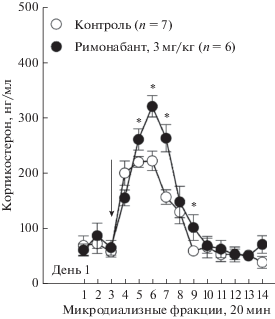
На второй день эксперимента динамика изменений в уровне секреции кортикостерона после повторного введения римонабанта или растворителя (фракции 1–9) была аналогична той, которую наблюдали в первый день (рис. 2). У мышей, получавших физраствор, секреция кортикостерона повышалась; его пиковая концентрация в микродилизатах, измеренная через 40 мин после стресса (фракция 5), достигала величины 249.1 ± 25.9 нг/мг. У мышей экспериментальной группы, получавших римонабант, секреция кортикостерона была более выраженной по сравнению с контролем. Пиковая концентрация, измеренная через 60 мин после введения препарата (фракция 6), достигала величины 329.0 ± 41.8 нг/мг. По истечении 2 ч после введения препаратов уровни секреции кортикостерона в обеих группах приближались к базальным, что определялось завершением фазы активации ГГА системы при стрессе.
Рис. 2.
Изменения уровней свободного кортикостерона, измеренных в гиппокампе мышей линии C57Bl/6N в условиях психологического стресса, смоделированного в тесте “приподнятая платформа” (ПП), при введении римонабанта (3 мг/кг, п.о.) Стрелка на рисунке обозначает момент введения вещества или контрольного растворителя. Вертикальная полоса обозначает временной промежуток, в течение которого мышь находилась на ПП. * p < 0.05 (при сравнении римонабант vs. растворитель).
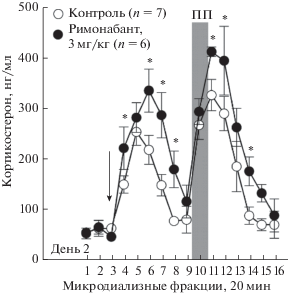
Помещение мышей на приподнятую платформу на 20 мин сопровождалось повторной волной секреции кортикостерона у мышей обеих групп. Пиковые концентрации, наблюдаемые через 40 мин после начала стресса (фракция 11) достигали значений 320.3 ± 30.4 нг/мг у мышей, получавших растворитель, и 404.5 ± 9.25 нг/мг у мышей, получавших римонабант, и были соответственно выше тех, которые наблюдали во время предыдущей стимулированной пероральным введением волны секреции (рис. 2). Двухфакторный дисперсионный анализ удостоверил различия между эффектами римонабанта и растворителя, указав на статистически значимые эффекты времени (F(15,165) = 31.81, p < 0.001) и введенного вещества (F(1,11) = 0.96, p = 0.01). Взаимодействие этих факторов (F(15,165) = 1.54, p = 0.09) было незначимым.
Эксперимент 2. Влияние АМ-404 на высвобождение норадреналина в миндалевидном теле в условиях стресса. Базальные уровни норадреналина, измеренные в миндалевидном теле мозга мышей, не различались между контрольной и экспериментальной группами (тест Стьюдента: t(67) = 0.09, p = 0.93). Среднее значение составило 0.157 ± 0.01 нмоль/л.
Внутрибрюшинаая инъекция растворителя статистически значимо увеличивала высвобождение норадреналина (фракция 7, 182 ± 22.5% по сравнению со средним базальным значением, p < 0.05) (рис. 3). Стресс, смоделированный в тесте “приподнятая платформа”, сопровождался еще большим увеличением высвобождения норадреналина в миндалевидном теле. Максимальное относительное увеличение внеклеточного содержания норадреналина, измеренного в 8-ой фракции, составило 265.8 ± 31.2% (статистически значимое отличие по сравнению со средним базальным значением, p < 0.001).
Рис. 3.
Изменения уровней норадреналина, измеренных в миндалевидном теле мышей линии C57Bl/6N, в условиях психологического стресса, смоделированного в тесте “приподнятая платформа” (ПП), при введении АМ-404 (3 мг/кг, в.б.). Стрелка на рисунке обозначает момент введения вещества или растворителя. Вертикальная полоса обозначает временной промежуток, в течение которого мышь находилась на ПП. *p < 0.05, ****p < 0.0001 (при сравнении АМ-404 vs. растворитель).
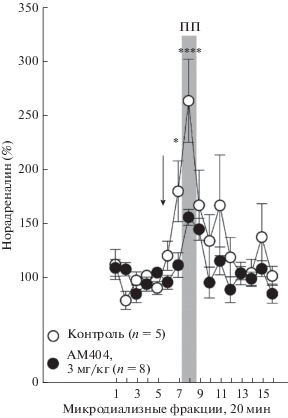
АМ-404, введенный в.б. в дозе 3 мг/кг за 20 мин до стресса, предотвращал, но не ингибировал ассоциированное со стрессом высвобождение норадреналина в миндалевидном теле (рис. 3). Двухфакторный дисперсионный анализ эффектов АМ-404 и растворителя показал, что все главные факторы эксперимента (время и вещество) оказывали статистически значимое влияние на относительное содержание норадреналина в межклеточном пространстве миндалевидного тела: время: F(15,165) = 11.88, p < 0.001; вещество: F(1,11) = 6.78, p = 0.03; взаимодействие: F(15,165) = 3.28, p < 0.001. Анализ post-hoc удостоверил значимые отличия при сравнении значений, определенных для фракций 7 (p < 0.05) и фракций 8 (p < 0.001).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные свидетельствуют о значимости эндоканнабиноидной нейропередачи в регуляции высвобождения норадреналина в миндалевидном теле и подтверждают роль CB1 рецепторов в контроле над активностью ГГА системы во время психологического стресса у мышей.
Как известно, римонабант в дозах 2–10 мг/кг изменяет эмоциональное поведение, например, провоцирует депрессивное поведение и вызывает пассивную стратегию реагирования на стресс у мышей линии C57Bl/6N. При этом римонабант потенцирует секрецию кортикостерона вне зависимости от модальности стресса, вызывая увеличение его содержания в плазме как в тесте вынужденного плавания по Парсолту, так и при стрессе, сопровождающем внутрибрюшинную инъекцию [23, 24]. Результаты нашего исследования расширяют представление о динамике секреции кортикостерона и удостоверяют влияние римонабанта на амплитуду пикового высвобождения гормона (рис. 1 и 2). Таким образом, наши данные подтверждают вовлечение CB1 рецепторов (и эндоканнабиноидов) в контроль ГГА системы во время стресса.
Полученные результаты также указывают на то, что п.о. введение – стимулятор ГГА системы. Можно сделать вывод, что сочетание иммобилизации животного, необходимой при этом способе системного введения фармакологически активных препаратов, и дискомфорта интубации, обладает потенциально стрессогенным действием. Однако контекст проводимой манипуляции (например наличие предварительной габитуации, отсутствие специфического стрессора, пол животного) или краткосрочность такой процедуры могут быть предпосылками, определяющими, тем не менее, отсутствие значимых последствий на молекулярном и поведенческом уровне [25, 26].
Наши данные удостоверяют модель стресса приподнятой платформы как способа активации ГГА системы и дают основание для изучения влияния эндоканнабиноидомиметика непрямого действия AM-404 на высвобождение норадреналина в условиях усиления секреции кортикостерона на этой модели.
Норадренергическая нейропередача в миндалевидном теле является ключевым компонентом регуляции экспрессии эмоционального ответа при острой и хронической тревожности [27, 28]. Взаимодействие кортикостерона, эндоканнабиноидов и ГАМК, имеющее своей мишенью регуляцию пресинаптического высвобождения норадреналина в миндалевидном теле, рассматривается как ключевой механизм формирования долгосрочной эмоциональной памяти [16]. Особая роль в модулировании активности нейронов, посылающих проекции из миндалевидного тела в структуры переднего мозга, паравентрикулярное ядро и моноаминергические нейроны среднего и заднего мозга, отводится β-адренергическим рецепторам [29].
Наши данные свидетельствуют о том, что терапевтическое действие вещества с эндоканнабиноидной активностью AM-404 [19] может определяться уменьшением высвобождения норадреналина в миндалевидном теле в условиях активации ГГА системы (рис. 3). Наблюдаемое в нашем эксперименте предотвращение вызванного стрессом повышения внеклеточного содержания норадреналина в миндалевидном теле при действии AM-404 может влиять на активность структур переднего мозга, определяющих нисходящий контроль эмоций. Так, в экспериментах на крысах недавно было продемонстрировано, что локальная инсталляция антагониста β-адренергических рецепторов пропранолола в базолатеральую область миндалевидного тела блокировала изменения в биоэлектрической активности и нейрональной пластичности в коре, вызванные системным введением кортикостерона [30]. Помимо влияния на когнитивные функции, активность коры, промодулированная сигналом нейронов миндалевидного тела, может изменять биоэлектрическую активность нейронов паравентрикулярного ядра гипоталамуса, секретирующих кортикотропин [8]. Уменьшение активности ГГА системы при стимуляции CB1 рецепторов, располагающихся в других регионах мозга [3], может дополнять и одновременно облегчать реализацию активности AM-404 в миндалевидном теле при стрессе.
Надо отметить, что с помощью использованного микродиализного подхода дифференцированная оценка уровней нейромедиаторов в центральном и базолатеральном регионах миндалевидного тела мышей невозможна, поэтому полученные данные отражают изменения в уровне высвобождения норадреналина в обоих регионах.
Обращает на себя внимание то, что инъекционный стресс оказывается достаточным, чтобы вызывать значимое изменение в высвобождении норадреналина в миндалевидном теле (рис. 3). Это наблюдение подтверждает наши недавние результаты, свидетельствующие об активации моноаминергической нейропередачи в мозге при введении физраствора крысам [31, (неопубликованные данные) и указывает на потенциальную, но не обязательную, стрессогенность внутрибрюшинных инъекций.
Суммируя, полученные результаты подтверждают гипотезу о вовлечении эндоканнабиноидов в регуляцию норадренергической нейропередачи во время активации ГГА системы и соответствующего увеличения секреции кортикостерона и указывают на то, что анандамид может играть значимую роль в реализации этого физиологического эффекта.
Список литературы
Joëls M., Fernandez G., Roozendaal B. Stress and emotional memory: A matter of timing. Trends Cogn. Sci. 15(6): 280–288. 2011.
Hill M.N., Patel S., Campolongo P., Tasker J.G., Wotjak C.T., Bains J.S. Functional interactions between stress and the endocannabinoid system: From synaptic signaling to behavioral output. J. Neurosci. Off. J. Soc. Neurosci. 30(45): 14980–14986. 2010.
Patel S., Roelke C.T., Rademacher D.J., Cullinan W.E., Hillard C.J. Endocannabinoid signaling negatively modulates stress-induced activation of the hypothalamic-pituitary-adrenal axis. Endocrinology. 145(12): 5431–5438. 2004.
Patel S., Hill M.N., Cheer J.F., Wotjak C.T., Holmes A. The endocannabinoid system as a target for novel anxiolytic drugs. Neurosci. Biobehav. Rev. 76(Pt A): 56–66. 2017.
Riebe C.J., Pamplona F.A., Kamprath K., Wotjak C.T. Fear relief-toward a new conceptual frame work and what endocannabinoids gotta do with it. Neuroscience. 204: 159–185. 2012.
Patel S., Hillard C.J. Pharmacological evaluation of cannabinoid receptor ligands in a mouse model of anxiety: Further evidence for an anxiolytic role for endogenous cannabinoid signaling. J. Pharmacol. Exp. Ther. 318(1): 304–11. 2006.
Kochli D.E., Thompson E.C., Fricke E.A., Postle A.F., Quinn J.J. The amygdala is critical for trace, delay, and contextual fear conditioning. Learn. Mem. Cold Spring Harb. 22(2): 92–100. 2015.
Herman J.P., Tasker J.G., Ziegler D.R., Cullinan W.E. Local circuit regulation of paraventricular nucleus stress integration: Glutamate-GABA connections. Pharmacol. Biochem. Behav. 71(3): 457–468. 2002.
Makino S., Shibasaki T., Yamauchi N., Nishioka T., Mimoto T., Wakabayashi I., Gold P.W., Hashimoto K. Psychological stress increased corticotropin-releasing hormone mRNA and content in the central nucleus of the amygdala but not in the hypothalamic paraventricular nucleus in the rat. Brain Res. 850(1–2): 136–143. 1999.
Paretkar T., Dimitrov E. The central amygdala corticotropin-releasing hormone (CRH) neurons modulation of anxiety-like behavior and hippocampus-dependent memory in mice. Neuroscience. 390: 187–197. 2018.
Roozendaal B., Quirarte G.L., McGaugh J.L. Glucocorticoids interact with the basolateral amygdala beta-adrenoceptor–cAMP/cAMP/PKA system in influencing memory consolidation. Eur. J. Neurosci. 15(3): 553–560. 2002.
Roozendaal B., Okuda S., Van der Zee E.A., McGaugh J.L. Glucocorticoid enhancement of memory requires arousal-induced noradrenergic activation in the basolateral amygdala. Proc. Natl. Acad. Sci. USA. 103(17): 6741–6746. 2006.
Nugent N.R., Christopher N.C., Crow J.P., Browne L., Ostrowski. S, Delahanty D.L. The efficacy of early propranolol administration at reducing PTSD symptoms in pediatric injury patients: A pilot study. J. Trauma Stress. 23(2): 282–287. 2010.
LaLumiere R.T., Pizano E., McGaugh J.L. Intra-basolateral amygdala infusions of AP-5 impair or enhance retention of inhibitory avoidance depending on training conditions. Neurobiol. Learn. Mem. 81(1): 60–66. 2004.
Roozendaal B., de Quervain D.J., Schelling G., McGaugh J.L. A systemically administered beta-adrenoceptor antagonist blocks corticosterone-induced impairment of contextual memory retrieval in rats. Neurobiol. Learn. Mem. 81(2): 150–154. 2004.
Atsak P., Hauer D., Campolongo P., Schelling G., Fornari R.V., Roozendaal B. Endocannabinoid signaling within the basolateral amygdala integrates multiple stress hormone effects on memory consolidation. Neuropsychopharmacol. Off. Publ. Am. Coll. Neuropsychopharmacol. 40(6): 1485–1494. 2015.
Qian X., Droste S.K., Gutièrrez-Mecinas M., Collins A., Kersanté F., Reul J.M., Linthorst A.C. A rapid release of corticosteroid-binding globulin from the liver restrains the glucocorticoid hormone response to acute stress. Endocrinology. 152(10): 3738–3748. 2011.
Kao C.Y., Stalla G., Stalla J., Wotjak C.T., Anderzhanova E. Norepinephrine and corticosterone in the medial prefrontal cortex and hippocampus predict PTSD-like symptoms in mice. Eur. J. Neurosci. 41(9): 1139–1148. 2015.
Bitencourt R.M., Pamplona F.A., Takahashi R.N. Facilitation of contextual fear memory extinction and anti-anxiogenic effects of AM-404 and cannabidiol in conditioned rats. Eur. Neuropsychopharmacol. J. Eur. Coll. Neuropsychopharmacol. 18(12): 849–859. 2008.
Patel S., Cravatt B.F., Hillard C.J. Synergistic interactions between cannabinoids and environmental stress in the activation of the central amygdala. Neuropsychopharmacol. Off. Publ. Am. Coll. Neuropsychopharmacol. 30(3): 497–507. 2005.
Miyata S., Shimoi T., Hirano S., Yamada N., Hata Y., Yoshikawa N., Ohsawa M., Kamei J. Effects of serotonergic anxiolytics on the freezing behavior in the elevated open-platform test in mice. J. Pharmacol. Sci. 105(3): 272–278. 2007.
Paxinos G., Franklin K.B.J. Paxinos and Franklin’s the mouse brain in stereotaxic coordinates. Amsterdam Boston Heidelberg. Elsevier. Acad. Press. Fourth edition. 2013.
Steiner M.A., Marsicano G., Nestler E.J., Holsboer F., Lutz B., Wotjak C.T. Antidepressant-like behavioral effects of impaired cannabinoid receptor type 1 signaling coincide with exaggerated corticosterone secretion in mice. Psychoneuroendocrinology. 33(1): 54–67. 2008.
Steiner M.A., Wanisch K., Monory K., Marsicano G., Borroni E., Bächli H., Holsboer F., Lutz B., Wotjak C.T. Impaired cannabinoid receptor type 1 signaling interferes with stress-coping behavior in mice. Pharmacogenomics J. 8(3): 196–208. 2008.
Bohacek J., Manuella F., Roszkowski M., Mansuy I.M. Hippocampal gene expression induced by cold swim stress depends on sex and handling. Psychoneuroendocrinology. 52: 1–12. 2015.
Golub Y., Mauch C.P., Dahlhoff M., Wotjak C.T. Consequences of extinction training on associative and non-associative fear in a mouse model of Posttraumatic Stress Disorder (PTSD). Behav. Brain Res. 205(2): 544–549. 2009.
Aubry A.V., Serrano P.A., Burghardt N.S. Molecular Mechanisms of Stress-Induced Increases in Fear Memory Consolidation within the Amygdala. Front. Behav. Neurosci. 10: 191. 2016.
Ronzoni G., Del Arco A., Mora F., Segovia G. Enhanced noradrenergic activity in the amygdala contributes to hyperarousal in an animal model of PTSD. Psychoneuroendocrinology. 70: 1–9. 2016.
McGaugh J.L. The amygdala modulates the consolidation of memories of emotionally arousing experiences. Annu. Rev. Neurosci. 27: 1-28. 2004.
Barsegyan A., Mirone G., Ronzoni G., Guo C., Song Q., van Kuppeveld D., Schut E.H.S., Atsak P., Teurlings S., McGaugh J.L., Schubert D., Roozendaal B. Glucocorticoid enhancement of recognition memory via basolateral amygdala-driven facilitation of prelimbic cortex interactions. Proc. Natl. Acad. Sci. USA. 116 (14): 7077–7082. 2019.
Наплёкова П.Л. Исследование нейрохимических сдвигов в структурах мозга крыс Вистар при моделировании острого стресса, вызванного инъекцией физиологического раствора. Вестник Рос. гос. мед. универ. 1: 278–279. 2012. [Naplekova P.L. The study of neurochemical changes in brain structures of Wistar rats in the modeling of acute stress caused by injection of saline. Bull. Russ. State. Med. Univer. 1: 278–279. 2012. (In Russ.)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


