Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 1, стр. 97-109
Влияние С-пептида проинсулина и инсулина на гонадную и тиреоидную системы у самцов крыс с мягкой формой сахарного диабета 1-го типа
К. В. Деркач 1, В. М. Бондарева 1, А. О. Шпаков 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург,, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 29.10.2019
После доработки 31.10.2019
Принята к публикации 01.11.2019
Аннотация
Сахарный диабет 1-го типа (СД1) характеризуется дефицитом как инсулина, так и С-пептида, являющегося модулятором активности инсулиновых сигнальных путей. Заместительная терапия С-пептидом при СД1 улучшает метаболические показатели, восстанавливает функции нервной и выделительной систем. Предполагают, что через центральные механизмы эта терапия может восстанавливать функции эндокринной системы, нарушенные при СД1. Для компенсации дефицита С-пептида в ЦНС может быть применен интраназальный способ его введения. Цель работы состояла в изучении влияния лечения (9 дней) самцов крыс Вистар с моделью мягкого СД1, вызванного низкой дозой стрептозотоцина (35 мг/кг), с помощью интраназально вводимых С-пептида (36 мкг/крысу/день) и инсулина (20 мкг/крысу/день), совместно или раздельно, на гормональные показатели тиреоидной и гонадной систем, а также на активность аденилатциклазы (АЦ) в мембранах, выделенных из щитовидной железы и семенников. Фермент АЦ вовлечен в регуляцию синтеза тиреоидных гормонов в тироцитах и тестостерона в клетках Лейдига. В крови оценивали уровни тиреотропного (ТТГ) и лютеинизирующего гормонов (ЛГ), тиреоидных гормонов, тестостерона, инсулина и лептина. Лечение крыс совместно С-пептидом и инсулином ослабляло гипергликемию, несмотря на сохранение гипоинсулинемии, восстанавливало сниженные уровни трийодтиронина, тестостерона и лептина, нормализовало уровень ТТГ, повышенный в условиях СД1, но не влияло на уровень ЛГ, который при СД1 также не менялся. Одним из механизмов нормализации функций тиреоидной и гонадной систем при лечении инсулином и С-пептидом было восстановление стимулирующего эффекта ТТГ на активность АЦ в мембранах щитовидной железы и соответствующего эффекта хорионического гонадотропина человека в тестикулярных мембранах. Монотерапия инсулином была менее эффективной, в то время как монотерапия С-пептидом частично восстанавливала андрогенный статус только на третий день после начала лечения. Таким образом, нами показано потенцирующее влияние С-пептида на вызываемое инсулином восстановление функций тиреоидной и гонадной систем у крыс с мягким СД1, в основе чего, как мы полагаем, лежит усиление инсулинового сигналинга в гипоталамусе в присутствии С-пептида.
C-пептид проинсулина, продукт биосинтеза инсулина, образуется при сайт-специфичном гидролизе проинсулина в β-клетках поджелудочной железы. Соответствующая С-пептиду аминокислотная последовательность обеспечивает такое взаимное расположение A- и B-цепей в проинсулине, которое позволяет образовать между ними “правильные” дисульфидные связи и, тем самым, способствует синтезу биологически активных форм инсулина [1–3]. В дальнейшем, взаимодействие N-концевого участка С-пептида с инсулином в секреторных гранулах β-клеток способствует сохранению запасенного в них инсулина в биологически активной форме [3]. В настоящее время имеются свидетельства того, что уже после секреции в кровоток взаимодействие между С-пептидом и инсулином не прекращается. Оно необходимо как для обеспечения стабильности структуры молекулы инсулина, так и для реализации его регуляторных эффектов на ткани-мишени. Взаимодействие С‑пептида с инсулином приводит к диссоциации олигомерных инсулиновых комплексов и препятствует агрегации образующихся в результате этого мономерных форм гормона, что является одним из механизмов регуляции активности инсулина [3–5]. Полагают, что С-пептид функционирует как шаперон и коактиватор инсулина.
В условиях инсулин-дефицитных состояний, в первую очередь при сахарном диабете 1-го типа (СД1), снижается не только уровень инсулина, но и С-пептида. Заместительная терапия инсулином не может компенсировать дефицит эндогенного С-пептида, что приводит к нарушению равновесия между инсулином и С-пептидом в крови и тканях-мишенях. В результате меняется фармакокинетика инсулина, снижается его способность регулировать инсулин-зависимые сигнальные системы. Нами ранее было показано, что совместное применение инсулина и С-пептида более эффективно восстанавливает метаболические и гормональные показатели при СД1 в сравнении с монотерапией инсулином [6, 7]. Следует отметить, что С-пептид и сам наделен сигнальными функциями. Связываясь со специфичными к нему рецепторами, в том числе с рецептором GPR146, С-пептид активирует NO-зависимые и 3-фосфоинозитидные сигнальные пути и каскад митогенактивируемых протеинкиназ [8, 9]. Одной из его мишеней являются гипоталамические нейроны, регулируя активность которых С-пептид самостоятельно или совместно с инсулином влияет на энергетический обмен и физиологические процессы на периферии.
В условиях СД1 в значительной степени нарушаются функции гонадной и тиреоидной систем, что приводит к изменению продукции половых стероидных гормонов в семенниках и яичниках и продукции тиреоидных гормонов тироцитами щитовидной железы [10–14]. Причиной этого может быть не только дефицит инсулина, но и С-пептида, который продуцируется β-клетками в соотношении 1 : 1 с инсулином. На основании этого можно предположить, что при СД1 лечение С-пептидом, в том числе совместно с инсулином, может положительно влиять на функции гонадной и тиреоидной систем. В пользу этого свидетельствуют данные о восстанавливающем эффекте С-пептида на метаболические показатели и функции нервной и выделительной систем при лечении им животных с экспериментальным СД1 и пациентов с СД1 и диабетической нефропатией [15–21]. Следует, однако, отметить, что в экспериментальных условиях эффективность С-пептида изучается на моделях тяжелого или среднетяжелого СД1, вызванного высокими дозами стрептозотоцина, или генетически обусловленного СД1, для которого характерен острый дефицит инсулина и С-пептида. Эти модели отличаются от СД1 человека, поскольку дефицит инсулина у диабетических пациентов в значительной степени компенсируется инсулиновой терапией. Более приближенными к СД1 человека, в том числе по дисфункциям эндокринной системы, являются модели мягкого СД1, вызванного сравнительно низкими дозами стрептозотоцина [14].
Целью исследования было изучение восстанавливающего эффекта интраназально вводимых С-пептида и инсулина на функции тиреоидной и гонадной систем у самцов крыс с мягким СД1. При таком способе введения С-пептид и инсулин поступают в структуры мозга, минуя гематоэнцефалический барьер, что позволяет компенсировать их дефицит в ЦНС, возникающий в условиях СД1, и восстановить регуляторное влияние С-пептида и инсулина на гипоталамические нейроны, вовлеченные в функционирование гипоталамо-гипофизарно-гонадной и гипоталамо-гипофизарно-тиреоидной осей. В ходе исследования изучали влияние совместного интраназального введения С-пептида и инсулина, в сравнении с их раздельным введением, на уровни тиреотропного (ТТГ) и лютеинизирующего гормонов (ЛГ), тиреоидных гормонов и тестостерона в крови, а также на активность аденилатциклазной сигнальной системы в щитовидной железе и семенниках крыс с мягким СД1. Выбор в качестве объекта исследования аденилатциклазной системы обусловлен тем, что в тироцитах она вовлечена в ТТГ-индуцированную стимуляцию продукции тироксина, предшественника эффекторного гормона тиреоидной оси трийодтиронина, а в клетках Лейдига она отвечает за стимулированный гонадотропинами синтез тестостерона [11, 22].
МЕТОДЫ ИССЛЕДОВАНИЯ
Для экспериментов использовали самцов крыс Вистар. В начале эксперимента, перед индукцией СД1, возраст животных составил 2.5 месяца. Крыс содержали в стандартных условиях со свободным доступом к корму и воде. Эксперименты выполняли в соответствии с требованиями Комитета по биоэтике ИЭФБ РАН (15.02.2018 г.) и правилами и положениями European Communities Council Directive 1986 (86/609/EEC) и “Guide for the Care and Use of Laboratory Animals”.
Для индукции мягкой формы СД1 крыс однократно обрабатывали стрептозотоцином (Sigma, США) в низкой дозе 35 мг/кг (в/б). Контрольным животным (К, n = 6) вводили растворитель стрептозотоцина – 0.1 М натрий-цитратный буфер (pH 4.5). Через неделю для формирования диабетической группы отбирали животных с уровнем постпрандиальной глюкозы в крови выше 11 мМ. Концентрацию глюкозы определяли с помощью тест-полосок One Touch Ultra (США) и глюкометра Life Scan Johnson & Johnson (Дания) через 2 ч после еды в образцах крови, полученной из хвостовой вены. Через 10 недель после индукции СД1 крыс рандомизировали на 4 группы: без лечения (Д, n = 6), с лечением интраназально вводимыми инсулином (ИИ) в суточной дозе 20 мкг/крысу (ДИ, n = 6) или С-пептидом в суточной дозе 36 мкг/крысу (ДС, n = 6), с лечением совместно ИИ и С-пептидом в тех же дозах (ДИС, n = 6). Лечение продолжали в течение 9 дней, препараты вводили дважды в день. По окончании эксперимента, через 2 ч после введения препаратов, крыс декапитировали под наркозом, забирали у них образцы крови, ткани щитовдной железы и семенников для дальнейших исследований.
В крови оценивали уровни глюкозы, гликированного гемоглобина (HbA1c), инсулина, лептина, ЛГ, ТТГ, тестостерона, тиреоидных гормонов – свободного и общего тироксина (fT4, tT4) и свободного и общего трийодтиронина (fT3, tT3). Уровень HbA1c определяли с помощью набора Multi Test HbA1c System (Polymer Technology Systems, Inc., США), уровни инсулина, ТТГ, лептина и ЛГ – с помощью наборов Rat Insulin ELISA kit (Mercodia AB, Швеция), Rat TSH ELISA (Cusabio Biotech. Co., Ltd., Wuhan, Китай), ELISA kit for Leptin и ELISA kit for LH (Cloud-Clone Corp., США), уровень тестостерона – с помощью набора Тестостерон-ИФА (Алко-р-Био, Россия), уровни тиреоидных гормонов – с помощью наборов фирмы Иммунотех (Россия).
Активность аденилатциклазы (АЦ), каталитического компонента аденилатциклазной сигнальной системы, оценивали во фракциях плазматических мембран, выделенных из щитовидной железы и семенников крыс. Выделение мембран из щитовидной железы осуществляли по методу [23], с нашими модификациями [24], для чего образцы ткани промывали в 40 мМ Tris-HCl-буфере (pH 7.4), содержащем 5 мМ MgCl2 (буфер А), измельчали, гомогенизировали в 10 объемах буфера А, содержащего ингибиторы протеаз (4°C). Полученный гомогенат центрифугировали (500 g, 15 мин), осадок отбрасывали, супернатант снова центрифугировали (10 000 g, 30 мин). Фракции тестикулярных мембран выделяли, как описано ранее [25], для чего при 4°C ткани семенников измельчали, гомогенизировали в буфере А, гомогенат центрифугировали (1500 g, 10 мин), осадок отбрасывали, супернатант снова центрифугировали (20 000 g, 30 мин). Полученные мембраны ресуспендировали в 50 мМ Tris-HCl-буфере (pH 7.4) и использовали для определения активности АЦ. Для этого мембраны (50–80 мкг белка) инкубировали в реакционной смеси, содержащей 50 мМ Tris-HCl (pH 7.5), 5 мМ MgCl2, 0.1 мМ цАМФ, 1 мМ АТФ, 37 КБк [α-32P]АТФ, 20 мМ креатинфосфата, 0.2 мг/мл креатинфосфокиназы, в течение 12 мин при 37°С. Активность АЦ оценивали по количеству цАМФ, получающегося в ходе ферментативной реакции, и выражали в пмоль цАМФ/мин/мг белка. Базальную активность АЦ измеряли в отсутствие воздействий. Для определения активности АЦ использовали [α-32P]АТФ (150 ГБк/ммоль) (Всерегиональное объединение “Изотоп”, Россия), для оценки ее регуляторных свойств использовали ТТГ из гипофиза быка Sigma-Aldrich (США) и хорионический гонадотропин человека (ХГЧ) (Московский эндокринологический завод, Россия).
Статистическую обработку данных проводили с помощью программного обеспечения GraphPad Prism 7 (GraphPad Software, США). Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента, для сравнения трех и более групп – дисперсионный анализ с поправкой Бонферрони. Статистически значимыми считали отличия при p < 0.05. Данные представлены как M ± SD.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У крыс с мягкой формой СД1 были снижены масса тела и уровни инсулина и лептина и повышены уровни постпрандиальной глюкозы и HbA1c, что указывает на развитие у них умеренной гипергликемии (табл. 1). При лечении в течение 9 дней интраназально вводимым С-пептидом отмечали тенденцию к нормализации уровня лептина, хотя различия с группой Д не были статистически значимыми, в то время как уровни глюкозы, HbA1c и инсулина в группе ДС менялись слабо. Совместное лечение ИИ и С-пептидом достоверно снижало уровни глюкозы и HbA1c и повышало уровень лептина, в то время как в группе ДИ отмечали тенденцию к восстановлению этих показателей, но различия с группой Д не были статистически значимыми (табл. 1). Поскольку ослабление гипергликемии в группах ДИС и ДИ не сопровождалось повышением уровня инсулина, то причиной этого является либо повышение чувствительности тканей к инсулину, либо уменьшение продукции глюкозы гепатоцитами.
Таблица 1.
Масса тела, уровни глюкозы, гликированного гемоглобина, инсулина, лептина, ТТГ, ЛГ и тиреоидных гормонов у крыс с мягким сахарным диабетом 1-го типа и влияние на них лечения С-пептидом и инсулином совместно и по раздельности Table 1. The body weight and the levels of glucose, glycated hemoglobin, insulin, leptin, TSH, LH and thyroid hormones in rats with mild type 1 diabetes mellitus and the effect of the treatment with C-peptide and insulin in the conditions of their separate and joint administration.
| К C |
Д D |
ДС DC |
ДИ DI |
ДИС DIC |
|
|---|---|---|---|---|---|
| Масса, г Weight, g |
329 ± 13 | 278 ± 18* | 277 ± 33* | 297 ± 25* | 294 ± 24* |
| Глюкоза, мМ Glucose, mM |
4.6 ± 0.4 | 12.6 ± 2.8* | 12.1 ± 2.6* | 9.5 ± 1.3* | 8.8 ± 1.7*# |
| HbA1c, % HbA1c, % |
4.1 ± 0.2 | 7.9 ± 0.8* | 7.7 ± 1.2* | 6.6 ± 1.0* | 5.8 ± 1.2*# |
| Инсулин, нг/мл Insulin, ng/ml |
0.78 ± 0.20 | 0.31 ± 0.08* | 0.33 ± 0.19* | 0.30 ± 0.12* | 0.32 ± 0.11* |
| Лептин, нг/мл Leptin, ng/ml |
3.13 ± 0.73 | 2.07 ± 0.49* | 2.43 ± 0.57 | 2.17 ± 0.70 | 2.98 ± 0.60# |
| ТТГ, мкМЕ/мл TSH, μIU/ml |
0.66 ± 0.28 | 1.15 ± 0.27* | 1.04 ± 0.31 | 0.76 ± 0.14# | 0.78 ± 0.16# |
| fT4, пМ fT4, pM |
33.3 ± 2.7 | 29.6 ± 2.7 | 33.1 ± 3.2 | 33.3 ± 4.7 | 33.5 ± 3.7 |
| tT4, нМ tT4, nM |
108.8 ± 12.3 | 99.7 ± 11.1 | 102.3 ± 7.2 | 105.3 ± 16.6 | 110.2 ± 15.4 |
| fT3, пМ fT3, pM |
7.5 ± 1.2 | 5.9 ± 0.6* | 6.3 ± 0.6 | 7.1 ± 0.5# | 8.1 ± 0.6#@ |
| tT3, нМ tT3, nM |
3.3 ± 0.5 | 2.0 ± 0.4* | 2.5 ± 0.3* | 2.9 ± 0.3# | 3.6 ± 0.5#@ |
| ЛГ, а LH, a |
1.70 ± 0.21 | 1.78 ± 0.16 | 2.05 ± 0.26 | 1.69 ± 0.15 | 1.99 ± 0.25 |
| ЛГ, б LH, b |
1.59 ± 0.25 | 1.74 ± 0.16 | 1.75 ± 0.22 | 1.68 ± 0.23 | 1.61 ± 0.20 |
К – контроль; Д – диабет; ДС – диабет с лечением С-пептидом (и/н, 36 мкг/крысу); ДИ – диабет с лечением инсулином (и/н, 20 мкг/крысу); ДИС – диабет с лечением совместно С-пептидом и инсулином. Измерение уровня ЛГ проводили на третий день лечения (а) и в конце эксперимента (б). * – различия с контролем статистически значимы при p < 0.05; # – различия с группой Д статистически значимы при p < 0.05; @ – различия между группами ДИ и ДИС статистически значимы при p < 0.05. В каждой группе n = 6, M ± SD. C – control; D – diabetes; DC – diabetes with C-peptide treatment (i.n., 36 μg/rat); DI – diabetes with insulin treatment (i.n., 20 μg/rat); DIC – diabetes with co-administered C-peptide and insulin. The LH levels were measured on the third day of treatment (a) and at the end of the experiment (b). * – the differences with control are statistically significant at p < 0.05; # – the differences with the group D are statistically significant at p < 0.05; @ – the differences between the DI and DIC groups are statistically significant at p < 0.05. In each group: n = 6, M ± SD.
На следующем этапе изучали гормональный статус тиреоидной и гонадной осей, для чего в крови животных оценивали уровни ТТГ и ЛГ, а также тиреоидных гормонов и тестостерона. В условиях мягкого СД1 уровень ТТГ повышался (+74%, p < 0.05 в сравнении с контролем), в то время как концентрация fT3 и tT3 снижалась (–21 и –39%, p < 0.05) (табл. 1). Концентрация тироксина в группе Д в сравнении с контрольными животными существенно не менялась. Лечение С-пептидом слабо влияло на гормональные показатели тиреоидной оси, в то время как лечение ИИ и совместно С-пептидом и ИИ нормализовало уровень ТТГ и повышало уровни fT3 и tT3 до их значений в контроле. Совместное лечение ИИ и С-пептидом было более эффективным, на что указывает достоверное повышение уровней трийодтиронина в группе ДИС в сравнении с группой ДИ (табл.1). Эти данные свидетельствуют о способности ИИ и его комбинации с С-пептидом эффективно восстанавливать тиреоидный статус у крыс с мягкой формой СД1.
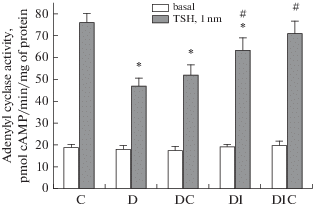
Одной из причин ослабления функций тиреоидной оси может быть снижение чувствительности тироцитов к ТТГ. Для проверки этого изучали стимулирующее влияние ТТГ на активность АЦ в мембранах, выделенных из щитовидной железы диабетических крыс. В группе Д базальная активность АЦ существенно не менялась, в то время как стимулирующий АЦ эффект ТТГ (10–9 М) был снижен (рис. 1). В группах ДИ и ДИС отмечали частичное восстановление эффекта ТТГ, в большей степени в группе ДИС (рис. 1). Таким образом, лечение диабетических крыс ИИ и совместно ИИ и С-пептидом восстанавливает чувствительность АЦ тироцитов к ТТГ.
Рис. 1.
Базальная и стимулированная ТТГ активность аденилатциклазы в мембранах щитовидной железы диабетических крыс и влияние на нее лечения С-пептидом и инсулином. К – контроль; Д – диабет; ДС – диабет с лечением С-пептидом (и/н, 36 мкг/крысу); ДИ – диабет с лечением инсулином (и/н, 20 мкг/крысу); ДИС – диабет с лечением С-пептидом и инсулином. * – различия с контролем статистически значимы при p < 0.05; # – различия с группой Д статистически значимы при p < 0.05. В каждой группе n = 6, M ± SD. Fig. 1. The basal and TSH-stimulated activities of adenylyl cyclase in the thyroidal membranes of diabetic rats and the effect of treatment with C-peptide and insulin on them. C – control; D – diabetes; DC – diabetes with C-peptide treatment (i.n., 36 μg/rat); DI – diabetes with insulin treatment (i.n., 20 μg/rat); DIC – diabetes with the treatment with C-peptide and insulin. * – the differences with control are statistically significant at p < 0.05; # – the differences with the group D are statistically significant at p < 0.05. In each group n = 6, M ± SD.
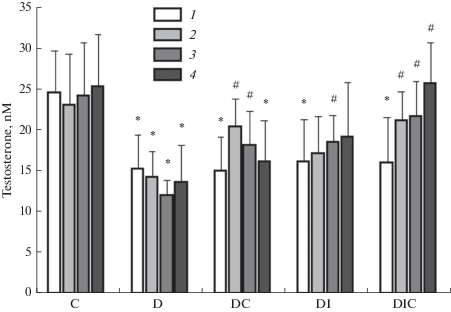
Уровень ЛГ в крови диабетических крыс не отличался от такового в контроле, несмотря на то, что уровень тестостерона в группе Д был достоверно снижен на протяжении всего эксперимента (табл. 1, рис. 2). Через 3 дня после начала лечения в группах ДС и ДИС отмечали тенденцию к повышению уровня ЛГ и достоверное повышение уровня тестостерона в крови (табл. 1, рис. 2). Однако через 9 дней ни в одной из групп уровень ЛГ не отличался от контрольных значений, в то время как уровень тестостерона в группе ДИС был достоверно выше, чем в группе Д (рис. 2). Эти данные указывают на повышение чувствительности клеток Лейдига к гонадотропинам при длительном лечении совместно ИИ и С-пептидом, что было подтверждено в экспериментах in vitro.
Рис. 2.
Уровни тестостерона в крови крыс с мягким сахарным диабетом 1-го типа и влияние на них лечения С-пептидом и инсулином. К – контроль; Д – диабет; ДС – диабет с лечением С-пептидом (и/н, 36 мкг/крысу); ДИ – диабет с лечением инсулином (и/н, 20 мкг/крысу); ДИС – диабет с лечением С-пептидом и инсулином. 1 – до начала лечения; 2, 3 и 4 – через 3, 6 и 9 дней после начала лечения соответственно. * – различия с контролем статистически значимы при p < 0.05; # – различия с группой Д статистически значимы при p < 0.05. В каждой группе n = 6, M ± SD. Fig. 2. The plasma testosterone levels in rats with mild type 1 diabetes mellitus and the effect of treatment with C-peptide and insulin on them. C – control; D – diabetes; DC – diabetes with C-peptide treatment (i.n., 36 μg/rat); DI – diabetes with insulin treatment (i.n., 20 μg/rat); DIC – diabetes with the treatment with C-peptide and insulin. 1 – before treatment; 2, 3 and 4 – on the third, sixth and ninth days after the start of treatment, respectively. * – the differences with control are statistically significant at p < 0.05; # – the differences with the group D are statistically significant at p < 0.05. In each group n = 6, M ± SD.
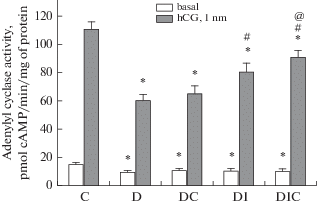
В тестикулярных мембранах крыс группы Д снижались как базальная, так и стимулированная ХГЧ (10–9 М) активность АЦ, причем эффект ХГЧ, оцениваемый по приросту над базальным уровнем активности, составил 53% от такового в контроле (рис. 3). В тестикулярных мембранах диабетических крыс, которых в течение 9 дней лечили ИИ или совместно ИИ и С-пептидом, стимулирующий эффект ХГЧ на активность АЦ частично восстанавливался, в наибольшей степени в группе ДИС. В группе ДС этот эффект менялся слабо (рис. 3). Эти данные свидетельствуют о том, что повышение продукции тестостерона в группах ДИ и ДИС в значительной степени обусловлено восстановлением чувствительности тестикулярной аденилатциклазной системы диабетических крыс к гонадотропинам.
Рис. 3.
Базальная и стимулированная ХГЧ активность аденилатциклазы в тестикулярных мембранах диабетических крыс и влияние на нее лечения С-пептидом и инсулином. К – контроль; Д – диабет; ДС – диабет с лечением С-пептидом (и/н, 36 мкг/крысу); ДИ – диабет с лечением инсулином (и/н, 20 мкг/крысу); ДИС – диабет с лечением С-пептидом и инсулином. * – различия с контролем статистически значимы при p < 0.05; # – различия с группой Д статистически значимы при p < 0.05; @ – различия между группами ДИ и ДИС статистически значимы при p < 0.05. В каждой группе n = 6, M ± SD. Fig. 3. The basal and hCG-stimulated activities of adenylyl cyclase in the testicular membranes of diabetic rats and the effect of treatment with C-peptide and insulin on them. C – control; D – diabetes; DC – diabetes with C-peptide treatment (i.n., 36 μg/rat); DI – diabetes with insulin treatment (i.n., 20 μg/rat); DIC – diabetes with the treatment with C-peptide and insulin. * – the differences with control are statistically significant at p < 0.05; # – the differences with the group D are statistically significant at p < 0.05; @ – the differences between the DI and DIC groups are statistically significant at p < 0.05. In each group n = 6, M ± SD.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Имеются многочисленные свидетельства того, что лечение С-пептидом животных с сильно выраженным СД1, для которого характерны острый дефицит инсулина и С-пептида, улучшает гликемический контроль, положительно влияет на нарушенные в условиях диабетической патологии функции нервной и выделительной систем [15–21]. Введение С-пептида снижает экспрессию молекул клеточной адгезии, препятствует повреждению лейкоцитами сосудистой стенки, ослабляет продукцию провоспалительных цитокинов, восстанавливает систему антиоксидантной защиты и нормализует уровень активных форм кислорода в тканях-мишенях. Лечение C-пептидом пациентов с СД1 приводит к смягчению проявлений диабетической полинейропатии и нефропатии, что обусловлено восстанавливающим эффектом С-пептида на функции сосудов и окислительно-восстановительный статус организма, а также сохранением в его присутствии активности и массы панкреатических β-клеток, продуцирующих инсулин [19, 21, 26, 27]. Нами ранее было установлено, что интраназальное введение С-пептида и его С-концевых фрагментов крысам с тяжелыми и среднетяжелыми формами СД1 улучшает их гормональные и метаболические показатели [6, 28]. Однако лечение С-пептидом крыс, имеющих относительный дефицит инсулина, было малоэффективным [7].
В настоящем исследовании нами также не было выявлено значимого влияния лечения С-пептидом на массу тела, уровни глюкозы, гликированного гемоглобина, инсулина, ТТГ и тиреоидных гормонов у крыс с мягкой формой СД1. Это свидетельствует о том, что в условиях относительного дефицита С-пептида его фармакологические эффекты выражены слабо. Нельзя исключить и того факта, что отсутствие восстанавливающего эффекта С-пептида на метаболические и гормональные показатели может быть обусловлено развитием к нему резистентности гипоталамических нейронов в ходе продолжительного лечения. Так, через 3 дня после начала лечения С-пептидом была выявлена тенденция к повышению уровня ЛГ и обусловленное этим повышение уровня тестостерона, в то время как через 9 дней эти эффекты исчезали.
Ранее при инсулин-дефицитных состояниях отмечали усиление эффекта ИИ при его совместном введении с эквимолярными или превышающими их количествами С-пептида, хотя потенцирующий эффект С-пептида варьировал в зависимости от исследуемой модели диабета и выраженности метаболических нарушений [6, 7]. В настоящем исследовании было показано, что в группе диабетических крыс, которых лечили совместно ИИ и С-пептидом, более эффективно, чем при монотерапии ИИ, ослаблялась гипергликемия, на что указывает снижение уровней постпрандиальной глюкозы и HbA1c. Наряду с этим в группе ДИС улучшался гормональный статус, о чем свидетельствует снижение уровня ТТГ до контрольных значений, а также повышение уровней лептина, трийодтиронина и тестостерона, сниженных в группе Д.
Потенцирование восстанавливающего эффекта ИИ в присутствии С-пептида может быть обусловлено несколькими причинами. Во-первых, эффективность взаимодействия инсулина с инсулиновым рецептором, а, следовательно, и активация гипоталамических инсулиновых сигнальных путей повышается при облегченной диссоциации олигомерного комплекса инсулина в присутствии С-пептида [4, 5]. Во-вторых, поскольку мишенями инсулина и С-пептида являются 3-фосфоинозитидный путь и его основной эффекторный компонент – фермент Akt-киназа, то при совместном воздействии можно ожидать усиления активации этого пути инсулином [29]. В-третьих, С-пептид стимулирует процесс аутофосфорилирования инсулинового рецептора и инсулин-зависимую активацию инсулин-рецепторного субстрата-1 и других белков инсулинового сигналинга, включая Akt-киназу и митоген-активируемые протеинкиназы [30–32]. Нами ранее было показано, что интраназальное введение диабетическим крысам С-пептида и инсулина вызывает более выраженное, в сравнении с одним ИИ, повышение фосфорилирования Akt-киназы по остаткам Thr308 и Ser473 в гипоталамусе, что указывает на усиление активации 3-фосфоинозитидного пути при совместном воздействии на него С-пептида и инсулина [33].
Инсулин способен влиять на секрецию гипоталамическими нейронами рилизинг-факторов ТТГ и ЛГ – тиролиберина и гонадолиберина. Эффекты инсулина на тиреоидную и гонадную системы могут осуществляться как непосредственно, путем активации инсулиновых рецепторов, расположенных на поверхности гипоталамических нейронов, экспрессирующих тиролиберин и гонадолиберин, так и опосредованно, через модуляцию активности гипоталамических сигнальных путей, зависимых от кисспептина, меланокортиновых пептидов, нейропептида Y [14, 34–37]. Одним из механизмов действия ИИ является потенцирование стимулирующего эффекта лептина, положительного регулятора функций тиреоидной и гонадной осей, на гипоталамические нейроны [37–39]. Полученные нами данные подтверждают, что гипоталамические нейроны являются основной мишенью интраназально вводимого инсулина и его смеси с С-пептидом. Их активация влияет на активность нижележащих компонентов тиреоидной и гонадной осей, вызывая восстановление уровней тиреоидных гормонов и тестостерона в крови крыс с мягким СД1. Важно отметить, что эти эффекты, по крайней мере частично, обусловлены повышением чувствительности тироцитов к ТТГ и клеток Лейдига к гонадотропинам, на что указывает восстановление стимулирующих эффектов ТТГ и ХГЧ на активность АЦ во фракциях плазматических мембран, выделенных из щитовидных желез и семенников крыс в группах ДИ и ДИС.
Нами обнаружено, что через 3 дня после начала лечения в группах ДС и ДИС, но не в группе ДИ, уровень тестостерона повышался, что сопровождалось небольшим увеличением уровня ЛГ в крови. Можно предположить, что С-пептид способен при непродолжительном воздействии стимулировать активность гонадной оси, усиливая синтез и секрецию гонадотропинов с ЛГ-активностью, но в дальнейшем его эффект затухает. Это может быть обусловлено развитием резистентности гипоталамических нейронов к С-пептиду, как это постулируется для эндотелиальных клеток в условиях длительной С-пептидемии [18]. В связи с этим можно предположить, что эффекты С-пептида, в том числе при совместном введении с ИИ, на функции эндокринной системы при СД1 могут зависеть не только от тяжести СД1, но и от продолжительности лечения.
Нами установлено, что у крыс с мягким СД1 уровень тироксина в крови существенно не меняется, несмотря на повышение уровня ТТГ, что является следствием снижения чувствительности щитовидной железы к ТТГ и указывает на развитие гипотиреоза с повышенным уровнем ТТГ, типичным для пациентов с СД1 [11]. В то же время снижаются уровни трийодтиронина, что вносит вклад в повышение продукции ТТГ гипофизом из-за ослабления системы обратных отрицательных связей в тиреоидной оси. Одной из причин этого может быть снижение активности D2-дейодиназ – ферментов, осуществляющих конверсию тироксина в трийодтиронин. Восстановление уровня трийодтиронина при лечении крыс ИИ и С-пептидом может быть обусловлено не только нормализацией функций тиреоидной оси, но и восстановлением активности D2-дейодиназ как в гипоталамусе, так и в гипофизе и других периферических тканях. Это может влиять на систему обратных отрицательных связей в тиреоидной оси и на метаболический статус организма в целом. В настоящее время данные о регуляции инсулином D2-дейодиназ в гипоталамусе и гипофизе отсутствуют. В то же время известно, что лептин, сигнальные пути которого в гипоталамусе пересекаются с таковыми инсулина, модулирует активность D2-дейодиназ в ЦНС и на периферии [40]. Так, введение лептина гипотиреоидным крысам повышает активность D2-дейодиназ в гипоталамусе в полтора раза, что приводит к усилению системы обратных связей в тиреоидной оси и нормализует продукцию ТТГ тиреотрофами гипофиза [41, 42]. Нами было показано восстановление уровня лептина в группе ДИС, что ассоциировалось с нормализацией продукции тиреоидных гормонов и ТТГ в этой группе.
Таким образом, при продолжительном лечении крыс с мягким СД1 с помощью смеси интраназально вводимых С-пептида и инсулина восстанавливается продукция трийодтиронина и тестостерона, сниженная в условиях СД1, и это ассоциировано с улучшением метаболических показателей и нормализацией уровня ТТГ. Одним из механизмов этого является повышение чувствительности аденилатциклазной системы, ответственной за синтез тиреоидных гормонов в тироцитах и за продукцию тестостерона в клетках Лейдига, к ТТГ и ХГЧ соответственно. Потенцирование восстанавливающего эффекта ИИ при его совместном применении с С-пептидом на функции тиреоидной и гонадной осей, с учетом отсутствия значимого эффекта монотерапии С-пептидом, свидетельствует о том, что в основе этого, скорее всего, лежит повышение эффективности взаимодействия инсулина с его рецептором, вызванное облегчением диссоциации олигомерных комплексов инсулина в присутствии С-пептида, и(или) усилением пострецепторных этапов передачи инсулинового сигнала, общих для инсулина и С-пептида.
Список литературы
Chen L.M., Yang X.W., Tang J.G. Acidic residues on the N-terminus of proinsulin C-Peptide are important for the folding of insulin precursor. J. Biochem. 131(6): 855–859. 2002.
Min C.Y., Qiao Z.S., Feng Y.M. Unfolding of human proinsulin. Intermediates and possible role of its C-peptide in folding/unfolding. Eur. J. Biochem. 271: 1737–1747. 2004.
Nerelius C., Alvelius G., Jörnvall H. N-terminal segment of proinsulin C-peptide active in insulin interaction/desaggregation. Biochem. Biophys. Res. Commun. 403: 462–467. 2010.
Shafqat J., Melles E., Sigmundsson K., Johansson B.L., Ekberg K., Alvelius G., Henriksson M., Johansson J., Wahren J., Jörnvall H. Proinsulin C-peptide elicits disaggregation of insulin resulting in enhanced physiological insulin effects. Cell Mol. Life Sci. 63: 1805–1811. 2006.
Jornvall H., Lindahl E., Astorga-Wells J., Lind J., Holmlund A., Melles E., Alvelius G., Nerelius C., Mäler L., Johansson J. Oligomerization and insulin interactions of proinsulin C-peptide: Threefold relationships to properties of insulin. Biochem. Biophys. Res. Commun. 391: 1561–1566. 2010.
Derkach K.V., Shpakova E.A., Bondareva V.M., Shpakov A.O. The effect of intranasal administration of proinsulin C-peptide and its C-terminal fragment on metabolic parameters in rats with streptozotocin diabetes. J. Evol. Biochem. Physiol. 54(3): 242–245. 2018.
Derkach K.V., Bondareva V.M., Perminova A.A., Shpakov A.O. C-peptide and insulin during combined intranasal administration improve the metabolic parameters and activity of the adenylate cyclase system in the hypothalamus, myocardium, and epididymal fat of rats with type 2 diabetes. Cell Tissue Biol. 13(3): 228–236. 2019.
Yosten G.L., Kolar G.R., Redlinger L.J., Samson W.K. Evidence for an interaction between proinsulin C-peptide and GPR146. J. Endocrinol. 218: B1–B8. 2013.
Brunskill N.J. C-peptide and diabetic kidney disease. J. Intern. Med. 281(1): 41–51. 2017.
Шпаков А.О. Функциональное состояние гипоталамо-гипофизарно-гонадной системы при сахарном диабете. Проблемы эндокринологии. 56(5): 23–29. 2010. [ Shpakov A.O. Functional state of hypothalamic-pituitary-gonadal axis in diabetes mellitus. Problemy endocrinologii. 56(5): 23–29. 2010. (In Russ)].
Шпаков А.О. Тиреоидная система в норме и при сахарном диабете 1-го и 2-го типов. СПб. Изд-во Политехнического университета. 2016. [Shpakov A.O. Tireoidnaya sistema v norme i pri saharnom diabete 1-go i 2-go tipov [Thyroid system in norm and in types 1 and 2 diabetes mellitus. St-Petersburg. Polytechnic University Publisher. 2016.]
Duntas L.H., Orgiazzi J., Brabant G. The interface between thyroid and diabetes mellitus. Clin. Endocrinol. (Oxf.). 75(1): 1–9. 2011.
Jangir R.N., Jain G.C. Diabetes mellitus induced impairment of male reproductive functions: a review. Curr. Diabetes Rev. 10(3): 147–157. 2014.
Derkach K.V., Bogush I.V., Berstein L.M., Shpakov A.O. The influence of intranasal insulin on hypothalamic-pituitary-thyroid axis in normal and diabetic rats. Horm. Metab. Res. 47(12): 916–924. 2015.
Sima A.A., Zhang W., Sugimoto K., Henry D., Li Z., Wahren J., Grunberger G. C-peptide prevents and improves chronic Type I diabetic polyneuropathy in the BB/Wor rat. Diabetologia. 44: 889–897. 2001.
Sima A.A., Zhang W., Muzik O., Kreipke C.W., Rafols J.A., Hoffman W.H. Sequential abnormalities in type 1 diabetic encephalopathy and the effects of C-peptide. Rev. Diabet. Stud. 6: 211–222. 2009.
Samnegard B., Jacobson S., Jaremko G., Johansson B., Ekberg K., Isaksson B., Eriksson L., Wahren J., Sjöquist M. C-peptide prevents glomerular hypertrophy and mesangial matrix expansion in diabetic rats. Nephrol. Dial. Transplant. 20(3): 532–538. 2005.
Vasic D., Walcher D. Proinflammatory Effects of C-Peptide in Different Tissues. Int. J. Inflam. 2012: 932725. 2012.
Wahren J., Kallas A., Sima A.A. The clinical potential of C-peptide replacement in type 1 diabetes. Diabetes. 61: 761–772. 2012.
Wahren J., Larsson C. C-peptide: new findings and therapeutic possibilities. Diabetes Res. Clin. Pract. 107. 309–319. 2015.
Luppi P., Drain P. C-peptide antioxidant adaptive pathways in β cells and diabetes. J. Intern. Med. 281 (1): 7–24. 2017.
Шпаков А.О. Регуляция и молекулярные механизмы функционирования гипоталамо-гипофизарно-гонадной оси. СПб. Изд-во Политехнического университета. 2017. [Regulyaciya i molekulyarnye mekhanizmy funkcionirovaniya gipotalamo-gipofizarno-gonadnoj osi [Regulation and molecular mechanisms of functioning of hypothalamic-pituitary-gonadal axis. St-Petersburg. Polytechnic University Publisher. 2017].
Heyma P., Harrison L.C. Precipitation of the thyrotropin receptor and identification of thyroid autoantigens using Graves’ disease immunoglobulins. J. Clin. Invest. 74: 1090–1097. 1984.
Shpakov A.O., Shpakova E.A., Tarasenko I.I., Derkach K.V. Peptide 612–627 of thyrotropin receptor and its modified analogs as regulators of adenylyl cyclase in rat thyroid gland. Cell Tissue Biol. 8(6): 488–498. 2014.
Derkach K.V., Bondareva V.M., Moiseyuk I.V., Shpakov A.O. The effect of 2-month bromocriptine treatment on the activity of the adenylate cyclase signaling system in the myocardium and testes of rats with type 2 diabetes. Cell Tissue Biol. 9(5): 395–405. 2015.
Ekberg K., Brismar T., Johansson B.L., Lindström P., Juntti-Berggren L., Norrby A., Berne C., Arnqvist H.J., Bolinder J., Wahren J. C-peptide replacement therapy and sensory nerve function in type 1 diabetic neuropathy. Diabetes Care. 30(1): 71–76. 2007.
Luppi P., Cifarelli V., Wahren J. C-peptide and long-term complications of diabetes. Pediatr. Diabetes. 12: 276–292. 2011.
Derkach K.V., Bondareva V.M., Shpakov A.O. Coadministration of intranasally delivered insulin and proinsulin C-peptide to rats with the types 1 and 2 diabetes mellitus restores their metabolic parameters. Adv. Gerontol. 8(2): 139–146. 2018.
Al-Rasheed N.M., Chana R.S., Baines R.J., Willars G.B., Brunskill N.J. Ligand-independent activation of peroxisome proliferator-activated receptor-γ by insulin and C-peptide in kidney proximal tubular cells: dependent on phosphatidylinositol 3-kinase activity. J. Biol. Chem. 279(48): 49747–49754. 2004.
Li Z.G., Qiang X., Sima A.A., Grunberger G. C-peptide attenuates protein tyrosine phosphatase activity and enhances glycogen synthesis in L6 myoblasts. Biochem. Biophys. Res. Commun. 280: 615–619. 2001.
Li Z.G., Zhang W., Sima A.A. C-peptide enhances insulin-mediated cell growth and protection against high glucose-induced apoptosis in SH-SY5Y cells. Diabetes Metab. Res. Rev. 19: 375–385. 2003.
Grunberger G., Sima A.A. The C-peptide signaling. Exp. Diabetes Res. 5: 25–36. 2004.
Derkach K.V., Perminova A.A., Buzanakov D.M., Shpakov A.O. Intranasal administration of proinsulin C-peptide enhances the stimulating effect of insulin on insulin system activity in the hypothalamus of diabetic rats. Bull. Exp. Biol. Med. 167(3): 351–355. 2019.
Fekete C., Singru P.S., Sanchez E., Sarkar S., Christoffolete M.A., Riberio R.S., Rand W.M., Emerson C.H., Bianco A.C., Lechan R.M. Differential effects of central leptin, insulin, or glucose administration during fasting on the hypothalamic-pituitary-thyroid axis and feeding-related neurons in the arcuate nucleus. Endocrinology. 147: 520–529. 2006.
Sliwowska J.H., Fergani C., Gawałek M., Skowronska B., Fichna P., Lehman M.N. Insulin: its role in the central control of reproduction. Physiol. Behav. 133: 197–206. 2014.
DiVall S.A., Herrera D., Sklar B., Wu S., Wondisford F., Radovick S., Wolfe A. Insulin receptor signaling in the GnRH neuron plays a role in the abnormal GnRH pulsatility of obese female mice. PLoS One. 10(3): e0119995. 2015.
Hill J.W., Elias C.F. Neuroanatomical framework of the metabolic control of reproduction. Physiol. Rev. 98(4): 2349–2380. 2018.
Nillni E.A. Regulation of the hypothalamic thyrotropin releasing hormone (TRH) neuron by neuronal and peripheral inputs. Front. Neuroendocrinol. 31: 134–156. 2010.
Shpakov A.O., Ryzhov Ju.R., Bakhtyukov A.A., Derkach K.V. The regulation of the male hypothalamic-pituitary-gonadal axis and testosterone production by adipokines (Chapter 2). In: Advances in Testosterone Action (Ed. by M. Estrada). Intech Open Access Publisher, Rijeka, Croatia. 25–57. 2018. ISBN 978-953-51-6241-4.
Mullur R., Liu Y.Y., Brent G.A. Thyroid hormone regulation of metabolism. Physiol. Rev. 94(2): 355–382. 2014.
Cabanelas A., Lisboa P.C., Moura E.G., Pazos-Moura C.C. Leptin acute modulation of the 5'‑deiodinase activities in hypothalamus, pituitary and brown adipose tissue of fed rats. Horm. Meta-b. Res. 38(8): 481–485. 2006.
Cabanelas A., Lisboa P.C., Moura E.G., Pazos-Moura C.C. Acute effects of leptin on 5'-deiodinases are modulated by thyroid state of fed rats. Horm. Metab. Res. 39(11): 818–822. 2007.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


