Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 1, стр. 110-120
Влияние активации ванилоидных рецепторов эводиамином на содержание кальцитонин-ген-родственного пептида в крови крыс в норме и при гипертензии, вызванной потреблением фруктозы
З. С. Толочко 1, *, В. К. Спиридонов 1
1 Институт физиологии и фундаментальной медицины
Новосибирск, Россия
* E-mail: toloch@physiol.ru
Поступила в редакцию 20.06.2019
После доработки 03.09.2019
Принята к публикации 17.09.2019
Аннотация
Кальцитонин-ген-родственный пептид (CGRP) – один из наиболее мощных вазодилататоров, в опосредовании вазоактивного действия которого принимает участие оксид азота (NO). Цель исследования заключалась в оценке содержания CGRP и NO в крови крыс в норме и при гипертензии, вызванной потреблением фруктозы, без воздействия на ванилоидные рецепторы 1 (TRPV1) и после введения их агониста эводиамина. Крысы (самцы, Вистар) в течение 10 нед. употребляли в качестве питья либо 12.5%-ный раствор фруктозы, либо водопроводную воду (контроль). Эводиамин, агонист TRPV1, вводили через 8 нед. после начала потребления фруктозы (10 мг/кг, в/б, через день, 2 нед.). Систолическое артериальное давление (АД) измеряли неинвазивным методом. Содержание глюкозы (натощак) и через 1 ч после нагрузки глюкозой (2 г/кг, в/б) измеряли глюкометром в крови, взятой из надреза на хвостовой вене. В сыворотке крови определяли концентрации CGRP, метаболитов NO (NOx), триглицеридов (ТГ) и продуктов перекисного окисления липидов (ПОЛ). Потребление фруктозы вызывало развитие гипертензии, нарушение толерантности к глюкозе, повышение содержания в крови продуктов ПОЛ, ТГ и снижение содержания CGRP. Введение эводиамина крысам, потреблявшим фруктозу, восстанавливало содержание CGRP в крови до контрольных значений, снижало АД, содержание ПОЛ, ТГ и улучшало толерантность к глюкозе. Уровень NOx во всех группах не отличался от контроля. Авторы полагают, что CGRP участвует в развитии гипертензии, вызванной потреблением фруктозы, и в опосредовании гипотензивного эффекта эводиамина.
Эводиамин (алколоид, экстрат растения Evodia fructus)–агонист ванилоидных рецепторов 1 (transient receptor potential vanilloid 1, TRPV1) [1], локализованных на C-немиелизированных и Aδ-миелизированных волокнах сенсорных нервов, открытых и изученных с использованием селективного агониста TRPV1 капсаицина и вследствие избирательной чувствительности к нему, получивших название “капсаицин-чувствительные нервы” [2, 3]. Проекции сенсорных нервов, экспрессирующих TRPV1, представлены в центральной нервной системе, в коже, внутренних органах, сосудистой системе [2–5].
Кальцитонин-ген-родственный пептид (сalcitonin-gene-related peptide, CGRP), нейропептид, синтезируемый в клеточных телах сенсорных нейронов, экспрессирующих TRPV1, является мощным вазодилататором, релаксирующее действие которого в сосудах опосредовано его взаимодействием с рецепторами к CGRP и осуществляется как эндотелий-независимым путем, так и c участием NO эндотелия сосудов [4, 6–8]. Вазоактивное действие CGRP послужило основанием для изучения его роли в развитии и лечении гипертензии.
Несмотря на большое количество исследований, посвященных этой теме, результаты которых рассмотрены и проанализированы в ряде обзорных статей [4–9], вопрос о механизмах участия CGRP в этих процессах остается открытым. Тем не менее, на основании данных о снижении артериального давления (АД) у гипертензивных животных при экзогенном введении CGRP [10] и о повышении АД при дефиците этого нейропептида, как генетически обусловленного (CGRP knockout mice) [11], так и вызванного неонатальным введением капсаицина [5], складывается представление, что на величину АД при гипертензии влияет уровень CGRP.
Исследователи, изучавшие содержание CGRP в крови гипертензивных и инсулин-резистентных крыс с генетически обусловленным ожирением (Zucker rats), обнаружили у них превышение концентрации CGRP в крови более чем в 3 раза по сравнению с таковой у “худых” животных этой же линии [12]. Эти нарушения устранялись десентизацией сенсорных нервов капсаицином, что послужило основанием для утверждения авторами, что повышение активности сенсорных нервов и связанное с этим увеличение содержания CGRP в крови, предшествуют развитию инсулин-резистентности и гипертонии у тучных крыс. Однако в модели гипертензии, связанной с инсулин-резистентностью, вызванной фруктозой, но развивающейся без ожирения, обнаружено уменьшение плотности CGRP-содержащих нервных терминалей в брыжейке и снижение синтеза этого нейропептида в дорзальных ганглиях, что, по мнению авторов, отражает снижение активности сенсорных нервов и является одной из причин развития данной патологии у этих животных [9, 13]. В пользу этой версии свидетельствуют и наши данные о снижении АД у крыс с гипертензией, вызванной потреблением фруктозы, после введения гипертензивным животным малых доз капсаицина, вызывающих активацию TRPV1 [14].
Изучение механизма развития гипертензии, обусловленной инсулин-резистентностью, одного из наиболее широко распространенного заболевания и роли в этом процессе вазоактивных нейропептидов сенсорных нервов, в частности CGRP, с учетом противоречивости данных литературы, представляется актуальной проблемой. Развитие артериальной гипертензии, вызванной фруктозной диетой, реализуется через многие механизмы, включающие и снижение продукции вазодилататоров, в том числе и NO [15], принимающим участие в опосредовании вазорелаксирующего действия CGRP [4, 6–8]. Поэтому представляется важным для понимания роли CGRP в развитии гипертензии, связанной с инсулин-резистентностью, оценить содержание CGRP в крови совместно с NO.
Цель исследования – оценить содержание CGRP и NO в крови крыс в норме и при гипертензии, вызванной потреблением фруктозы, без воздействия на ванилоидные рецепторы 1 (TRPV1) и после введения их агониста эводиамина.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили на крысах-самцах Вистар с исходной массой тела 150–160 г (возраст 2–2.5 мес.). Животные получали стандартный корм (ПроКорм, ЗАО БиоПро), содержались на 12-часовом цикле день/ночь и в качестве питья в течение 10 нед. потребляли либо водопроводную воду (стандартный питьевой режим), либо 12.5%-ный раствор фруктозы. Все манипуляции с животными проводились с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества, и одобрены комитетом по биомедицинской этике НИИФФМ (протокол № 6 от 16 июня 2016 г.), Новосибирск, Россия.
Протокол исследований. Еженедельно на бодрствующих крысах измеряли неинвазивном методом систолическое артериальное давление (АД) с помощью системы “Coda” (Kent Scientific, США) и регистрировали их массу. Содержание глюкозы в крови из надреза на хвостовой вене определяли натощак ( после ночного голодания ) и при проведении глюкозо-толерантного теста (через 1 ч после нагрузки глюкозой, 2 г/кг, внутрибрюшинно ) глюкометром One Touch Ultra (Life Scan, Швейцария). Через 8 нед. после начала эксперимента каждая из 2-х групп была разделена на 3 подгруппы: группа со стандартным питьевым режимом (контроль, контроль1, контроль2) и группа с потреблением фруктозы (фруктоза, фруктоза1, фруктоза2). Группы “контроль” и “фруктоза” в последующие 2 недели дополнительным воздействиям не подвергались. Остальным группам (“контроль2”, “контроль1”) и (“фруктоза2”, “фруктоза1”) вводили в течение 2-х недель либо эводиамин (TCI, Chemical, Китай, 10 мг/кг, через день, внутрибрюшинно,) либо в аналогичном объеме его растворитель, состоящий из диметилсульфоксида (ДМСО), (10%), Твин-80 (10%) и физиологического раствора (80%).
Крыс под легким эфирным наркозом забивали через 10 недель после начала потребления фруктозы. В сыворотке крови определяли содержание CGRP иммуноферментным методом с использованием набора “CEA 876 Ra” (Cloud Clon Corp, США) c регистрацией на ридере TriStar LB 941 (Berthold Technologies, Германия) и на спектрофотометре Shimadzu (UV-2501PC) измеряли содержание суммы метаболитов NO: нитрит/нитратов (NOx) [16], триглицеридов (ТГ) набором “Триглицериды-Ново” (Вектор Бест, Россия). Уровень перекисного окисления липидов (ПОЛ) оценивали по содержанию продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-РП) [17].
Результаты обрабатывали статистически с использованием t-критерия Стьюдента. Данные представлены в виде средней величины и ошибки средней (M ± SEM). Количество животных в каждой экспериментальной группе составляло 9–10 крыс.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Данные по массе тела представлены в табл. 1. Достоверных различий по этому показателю между всеми экспериментальными группами через 8 и 10 нед. после начала эксперимента не обнаружено. Полученные данные показывают, что потребление фруктозы не вызывает развития ожирения у животных.
Таблица 1.
Содержание глюкозы в крови (натощак) и масса тела у крыс различных экспериментальных групп через 8 и 10 недель после начала эксперимента
| Экспериментальные группы | Концентрация глюкозы (ммоль/л) | Масса тела, г | ||
|---|---|---|---|---|
| 8 недель | 10 недель | 8 недель | 10 недель | |
| Контроль – интактные крысы | 4.4 ± 0.2 | 4.5 ± 0.4 | 341.7 ± 12.4 | 380.3 ± 15.5 |
| Контроль1 + растворитель (через 8 недель после начала опыта ) | 4.3 ± 0.2 | 4.6± 0.1 | 345.4 ± 16.1 | 387.8 ± 14.6 |
| Контроль2 + эводиамин (через 8 недель после начала опыта) | 4.2 ± 0.3 | 4.0 ± 0.4 | 342.8 ± 13.2 | 380.2 ± 14.1 |
| Фруктоза – 12.5% р-р фруктозы | 4.4 ± 0.2 | 4.6 ± 0.2 | 358.4 ± 13.9 | 405.1 ± 16.3 |
| Фруктоза1 + растворитель (через 8 недель после начала потребления фруктозы) | 4.5 ± 0.3 | 4.6 ± 0.1 | 360.2 ± 11.8 | 403.6 ± 11.2 |
| Фруктоза2 + эводиамин (через 8 недель после начала потребления фруктозы) | 4.3 ± 0.1 | 4.1 ± 0.3 | 360.9 ± 14.1 | 399.4 ± 13.7 |
1. Влияние длительного потребления фруктозы на АД и исследуемые показатели в крови
Результаты исследования показали, что достоверное повышение АД (на 16–17%) наблюдается через 8 нед. после начала потребления фруктозы и в последующие 2 нед. эксперимента отмечается его дальнейший рост (рис. 1), что свидетельствует об устойчивом росте АД и развитии артериальной гипертензии. Потребление фруктозы не вызывало изменения концентрации глюкозы в крови натощак (табл. 1), но приводило к увеличению ее содержания после нагрузки ( рис. 2). Кроме этого, у крыс, потреблявших фруктозу, обнаружено повышение содержания ТГ и продуктов ПОЛ (табл. 2).
Рис. 1.
Влияние эводиамина на систолическое АД у крыс в норме и при потреблении фруктозы. Группы: К – контроль – интактные крысы со стандартным питьевым режимом; К1 + Раств. и К2 + Эв. – через 8 нед. после начала эксперимента интактным группам К1 (контроль1) и К2 (контроль2) вводили либо растворитель (Раств.), либо эводиамин (Эв.) соответственно; Ф – фруктоза – 12.5% р-р фруктозы в течение 10 нед.; Ф1 + Раств. и Ф2 + Эв. – через 8 недель после начала потребления фруктозы группам Ф1 (фруктоза1) и Ф2(фруктоза2) вводили либо растворитель, либо эводиамин соответственно; эводиамин и растворитель – 10 мг/кг, в/б, через день, 2 недели; 8 н., 10 н. – 8 и 10 нед. после начала эксперимента; *, #, ^ – p < 0.05 относительно: * – контрольных групп, # – группы Ф/8н., ^– группы Ф/10н. Данные представлены в виде: M ± SEM.
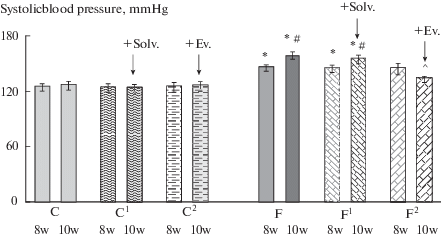
Рис. 2.
Влияние эводиамина на содержание глюкозы в крови крыс через 1 ч после нагрузки глюкозой (2г/кг, в/б ) в норме и при потреблении фруктозы. Группы: К – контроль – интактные крысы со стандартным питьевым режимом; К1 + Раств. и К2 + Эв. – через 8 нед. после начала эксперимента интактным группам К1 (контроль1) и К2 (контроль2) вводили либо растворитель (Раств.), либо эводиамин (Эв.), соответственно; Ф – фруктоза – 12.5%-ный р-р фруктозы в течение 10 нед.; Ф1 + Раств. и Ф2 + Эв. –через 8 нед. после начала потребления фруктозы группам Ф1 (фруктоза1) и Ф2(фруктоза2) вводили либо растворитель, либо эводиамин соответственно; эводиамин и растворитель – 10 мг/кг, в/б, через день, 2 нед.; 8 н., 10 н. – 8 и 10 нед. после начала эксперимента; *, #, ^ – p < 0,05 относительно: * – контрольных групп, # – группы Ф/8н., ^ – группы Ф/10н. Данные представлены в виде: M ± SEM
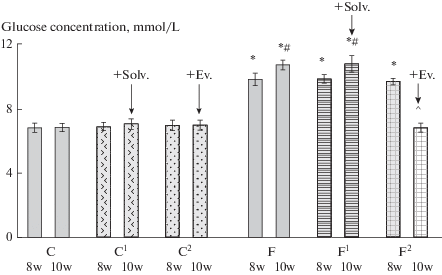
Таблица 2.
Влияние эводиамина на содержание в крови крыс триглицеридов и ТБК-РП в норме и через 10 недель после потребления фруктозы
| Экспериментальные группы | Концентрация
триглицеридов ммоль/л |
Концентрация
ТБК-РП мкмоль/л |
|---|---|---|
| Контроль – интактные крысы | 0.701 ± 0.060 | 7.9 ± 0.4 |
| Контроль1 + растворитель (через 8 недель после начала эксперимента) | 0.710 ± 0.082 | 7.8 ± 0.5 |
| Контроль2 + эводиамин (через 8 недель после начала эксперимента) | 0.698 ± 0.061 | 7.4 ± 0.2 |
| Фруктоза – ( 12.5%-ный р-р, 10 недель ) | 1.2 ± 0.1* | 10.6 ± 0.6* |
| Фруктоза1 + растворитель (через 8 недель после начала эксперимента) | 1.3 ± 0.2* | 10.8 ± 0.5* |
| Фруктоза2 + эводиамин (через 8 недель после начала эксперимента) | 0.685 ± 0.062^ | 6.8 ± 0.2^ |
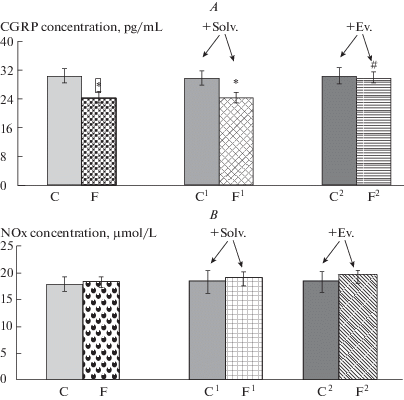
Содержание CGRP в крови у крыс, потреблявших фруктозу, в отличие от других показателей, было снижено на 20% относительно контрольных животных (рис. 3А). При этом содержание NOx в крови у этой группы не отличалось от контроля (рис. 3Б).
Рис. 3.
Влияние эводиамина на содержание CGRP (А) и NOx (Б) в крови крыс в норме и через 10 недель после начала потребления фруктозы. Группы: К (контроль) – интактные крысы со стандартным питьевым режимом; К1 + Раст. и К2 + Эв. – через 8 нед. после начала опыта интактным группам К1 (контроль1) и К2 (контроль2) вводили либо растворитель (Раств.), либо эводиамин (Эв.) соответственно; Ф – (фруктоза ) – 12.5%-ный р-р фруктозы в течение 10 нед.; Ф1 + Раст. и Ф2 + Эв. – через 8 нед. после начала потребления фруктозы группам Ф1 (фруктоза1) и Ф2 (фруктоза2) вводили либо растворитель, либо эводиамин соответственно; эводиамин и растворитель – 10 мг/кг, в/б, через день, 2 нед.; * – p < 0.05 относительно контрольных групп: # – p < 0.05 относительно группы фруктоза/без эводиамина. Данные представлены в виде: M ± SEM.
2. Влияние эводиамина на исследуемые показатели у крыс в норме и при потреблении фруктозы
Введение эводиамина или его растворителя животным со стандартным питьевым режимом показало, что величина АД, содержание в крови глюкозы (натощак и после нагрузки глюкозой) ТГ и ПОЛ и CGRP и NOx не отличались от соответствующих показателей контрольных животных (рис. 1, 2), (табл. 1, 2), (рис. 3А, Б).
Иные результаты получены через 2 недели после введения эводиамина животным, потреблявшим фруктозу. Величина АД у этих животных снижалась на 20.8% по сравнению с группой, употреблявшей фруктозу в течение 10 недель, но не получавшей эводиамин, и достигала контрольных значений (рис. 1). Концентрации в крови глюкозы (через 1 ч после нагрузки) ТГ и продуктов ПОЛ у этой группы не отличались от показателей контрольных животных (рис. 2, табл. 2).
Содержание CGRP в крови у группы, потреблявшей фруктозу и получавшей эводиамин, было выше более чем 18.14% по сравнению с животными, употреблявшими только фруктозу (рис. 3А). Концентрация CGRP после введения эводиамина не отличалась от таковой контрольных животных (рис. 3А). Уровень NOx в крови после введения эводиамина, животным, получавшим фруктозу, не отличался от группы, употреблявшей только фруктозу (рис. 3Б).
При введении животным с фруктозной диетой ДМСО все исследуемые показатели через 2 нед. последующего потребления фруктозы имели те же значения, что в и группе, получавшей фруктозу в течение 10 недель, но без воздействия эводиамином (рис. 1, 2, 3), (табл. 1, 2). Это значит, что все изменения, полученные нами после введения эводиамина, связаны с его действием и не обусловлены влиянием его растворителя.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты наших исследований показали, что развитие артериальной гипертензии у крыс, потреблявших фруктозу, сопровождается снижением содержания CGRP в крови. Считают, что основным источником нейронального происхождения этого нейропептида в крови являются периваскулярные сенсорные нервы, экспрессирующие TRPV1 [5, 7], выделяющие CGRP не только из центральных, но и периферических нервных окончаний (локальная эффекторная функция этих сенсорных нервов) и проекции которых широко представлены в сосудистом русле [2, 3, 5, 7, 8]. Наличие в крови CGRP нейронального происхождения дает основания предполагать, что CGRP, помимо локального действия в местах выделения из периферических нервных терминалей, может оказывать системное влияние, одним из возможным запускающим механизмом которого может быть связывание с рецепторами CGRP, которые расположены во всех тканях и органах и представляют собой комплекс CRLR/RAMP1(calcitonin receptor-like receptor/receptor activity-modifying protein1), обладающих высоким сродством к CGRP [4, 7, 8].
Тот факт, что активация TRPV1 вызывает восстановление сниженного содержания CGRP в крови до нормальных значений, указывает на то, что снижение этого нейропептида в крови связано с уменьшением активности TRPV1-сенсорных нервов. В пользу того, что процесс развития гипертензии при потреблении фруктозы сопровождается снижением активности сенсорных нервов, свидетельствуют и данные литературы о снижении синтеза CGRP в дорзальных ганглиях и уменьшении плотности CGRP-содержащих волокон в артериях брыжейки крыс, потреблявших фруктозу в течение 10 недель [9, 13]. Подтверждением того, что TRPV1 опосредуют повышение концентрации CGRP в крови, являются данные об устранении этого эффекта антагонистом данных рецепторов капсазепином [18].
Высказывается точка зрения, что одна из функций CGRP, реализуемая путем увеличения его синтеза и повышенного выделения из терминалей, заключается в препятствии развитию различных патологий, в том числе гипертензии и диабету [5, 7]. Это нашло подтверждение и в наших результатах, полученных после введения агониста TRPV1 эводиамина, животным потреблявшим фруктозу в течение 8 нед. У этих животных после активации TRPV1 эводиамином не только не происходило последующего роста АД ( в отличие от крыс, не получавших этот препарат), но его величина, а также содержание в крови CGRP не отличались от соответствующих данных, полученных от контрольных животных. Таким образом, активация TRPV1 у крыс с повышенным АД препятствует последующему росту АД, одним из возможных опосредующих механизмов которого является нормализация уровня CGRP.
Введение эводиамина, помимо снижения АД, оказывало подобный эффект на содержание ТГ, продуктов ПОЛ и глюкозы через один час после нагрузки, что можно рассматривать как улучшение толерантности к глюкозе. Данные литературы свидетельствуют о широкой биологической активности эводиамина: антиноцептивной, антивоспалительной, противораковой, антиатерогенной [19]. Эводиамин снижает ожирение и улучшает инсулин-резистентность, повышает толерантность к глюкозе у тучных мышей [20]. Эти эффекты реализуются как через TRV1-пути, так и другие механизмы, которые включают экспрессию мРНК гидролазы триглицеридов жировой ткани и ингибирования фосфорилирования серина в IRS1(insulin receptor substrate 1), индикатора инсулин-резистентности [19, 21].
В отличие от крыс, потреблявших фруктозу, введение эводиамина контрольным животным не сопровождалось изменением уровня CGRP в крови и не оказывало влияния на АД и другие регистрируемые нами метаболические показатели в крови, что свидетельствует об устойчивости механизмов физиологической регуляции этих функций у нормальных животных к агонистам TRPV1. Данные литературы также свидетельствуют о том, что введение CGRP или капсаицина в стимулирующих дозах нормотензивным животным не изменяют величину АД [7]. Сопоставление этих данных с результатами, полученными у крыс, потреблявших фруктозу, указывает на важную роль функционального статуса, сенсорных нервов, содержащих CGRP, у животных с нарушенной регуляцией, в частности, с артериальной гипертензией, как для развития патологического процесса, так и для препятствия его развитию.
Вопрос о конкретных механизмах, реализующих участие CGRP в развитии гипертензии, остается открытым. Как указывалось ранее, одним из важных опосредующих факторов вазодилататорного действия CGRP является эндотелиальный NO [4, 6–8]. Высказывается точка зрения, что главной и конечной причиной развития гипертензии при длительном потреблении фруктозы, является дисфункция эндотелия, снижение вазорелаксации сосудов, вызванное снижением синтеза и активности эндотелиальной синтазы NO (e-NOS), уменьшением содержания NO и снижением биодоступности NO [15]. Однако данные литературы, полученные при изучении уровня NOx в крови у крыс с гипертензией, вызванной фруктозой, неодназначны. Показано, что этот процесс может сопровождаться как снижением содержания NOx в крови [22], так и увеличеним их уровня [23]. Кроме этого, имеются данные о том, что гипертензия, вызванная фруктозой, не влияет на содержание NOx в крови [24].
Данные наших исследований показали, что развитие артериальной гипертензии и другие метаболические нарушения, вызванные потреблением фруктозы, не изменяют содержание NOx в крови. Активация TRPV1 как у контрольных животных, так и крыс, потреблявших фруктозу, также не оказывала влияние на содержание этих метаболитов. Возможно, что совместное участие NO и CGRP в опосредовании гипотензивного эффекта связано с локальными изменениями активностей TRPV1, eNOS и содержанием NO в стенке сосудов, что находит подтверждение в данных, полученных на культуре эндотелиальных клеток, в которых в ответ на активацию TRPV1 обнаружено повышение активности eNOS и увеличение продукции NO [25].
Высказывается точка зрения о том, что развитие артериальной гипертензии и инсулин-резистентности у крыс с фруктозной диетой, обусловлено нарушением баланса между симпатическими и CGRP-содержащими нервами [9, 13]. В качестве доказательства авторы приводят данные о повышении плотности симпатических нервных окончаний и снижении CGRP-иннервации в сосудах брыжейки у крыс с длительной фруктозной диетой.
Данные литературы свидетельствуют о реципрокном взаимодействии между CGRP-содержащими- и симпатическими нервами [4, 26, 27]. Так показано, что снижение выделения CGRP из нервных терминалей, может осуществляться при активации симпатическими медиаторами α2-адренорецепторов, локализованных на этих сенсорных нервных окончаниях [27]. Для объяснения снижения уровня CGRP у крыс, потреблявших фруктозу, эти данные могут представлять интерес, поскольку повышенная активность симпатической нервной системы рассматривается некоторыми исследователями в качестве причины развития гипертензии при потреблении фруктозы [15, 20]. С другой стороны, имеются данные о том, что экзогенная аппликация CGRP на артериолы тормозит выделения медиаторов из симпатических нервных окончаний [26]. Можно предположить, основываясь на приведенном выше реципрокном механизме регуляции функций этими нервами, что одной из причин снижения АД у гипертензивных крыс после введения эводиамина является снижение активности симпатических нервов, вызванное активацией TRPV1.
Таким образом, наши исследования показали, что снижение содержания CGRP в крови является одной из составляющей механизма развития артериальной гипертензии у крыс с длительным потреблением фруктозы. При активации TRPV1 эводиамином у животных с повышенным АД наблюдается восстановление уровня CGRP до нормальных значений и снижение АД. Эводиамин оказывает терапевтическое действие и на другие метаболические нарушения, выявленные у крыс с артериальной гипертензией: улучшает толерантность к глюкозе, снижает повышенное содержание ТГ и окислительный стресс. Однако вопрос опосредуются эти терапевтические эффекты эводиамина через TRPV1-пути или другие механизмы, требует дальнейших исследований.
Список литературы
Ivanova B., Spiteller M. Evodiamine and rutaecarpine alkaloids as highly selective transient receptor potential vanilloid 1 agonists. Int. J. Biol. Macromol. 65: 314–324. 2014.
Holzer P. Peptidergic sensory neurons in the control of vascular functions: mechanisms and significance in the cutaneous and splanchnic vascular beds. Rev. Physiol. Biochem. Pharmacol. 121(1): 49–146. 1992.
Holzer P. Forty years in capsaicin research for sensory pharmacology and physiology. Neuropeptides. 38(6): 377–384. 2004.
Brain S.D., Grant A.D. Vascular actions of calcitonin gene-related peptide and adrenomedullin. Physiol. Rev. 84(3): 903–934. 2004.
Deng P.Y., Li Y.J. Calcitonin gene-related peptide and hypertension. Peptides. 26: 1676–1685. 2005.
Kee Z., Kodji X., Brain S.D. The Role of Calcitonin Gene Related Peptide (CGRP) in Neurogenic Vasodilation and its Cardioprotective Effects. Front. Physiol. 9: 1–12. 2018.
Russell F.A., King R., Smillie S.J., Kodji X., Brain S.D.. Calcitonin gene-related peptide: Physiology and pathophysiology. Physiol. Rev. 94(4): 1099–1142. 2014.
Smillie S.J., Brain S.D. Calcitonin gene-related peptide (CGRP) and its role in hypertension. Neuropeptides. 45: 93–104. 2011.
Takatori S., Zamami Y., Mio M., Kurosaki Y., Kawasaki H. Chronic hyperinsulinemia enhances adrenergic vasoconstriction and decreases calcitonin gene-related peptide-containing nerve-mediated vasodilation in pithed rats. Hypertens. Res. 29(5): 361–368. 2006.
Fujioka S., Sasakawa O., Kishimoto H., Tsumura K., Morii H. The antihypertensive effect of calcitonin gene-related peptide in rats with norepinephrine- and angiotensin II-induced hypertension. J. Hypertens. 9(2): 175–179. 1991.
Mai T.H., Wu J., Diedrich A., Garland E. M., Robertson D. Calcitonin gene related peptide (CGRP) in autonomic cardiovascular regulation and vascular structure. J. Am. Soc. Hypertens. 8(5): 286–296. 2014.
Gram D.X., Hansen A.J., Wilken M., Elm T., Svendsen O., Carr R.D., Ahrén B., Brand C.L. Plasma calcitonin gene-related peptide is increased prior to obesity, and sensory nerve desensitization by capsaicin improves oral glucose tolerance in obese Zucker rats. Eur. J. Endocrinol. 153(6): 963–969. 2005.
Zamami Y., Takatori S., Hobara N., Yabumae N., Tangsucharit P., Jin X., Hashikawa N., Kitamura Y., Sasaki K., Kawasaki H. Hyperinsulinemia induces hypertension associated with neurogenic vascular dysfunction resulting from abnormal perivascular innervations in rat mesenteric resistance arteries. Hypertens. Res. 34(11): 1190–1196. 2011.
Толочко З.С., Спиридонов В.К. Влияние капсаицина на окислительную модификацию белков плазмы и артериальное давление у крыс, потреблявших фруктозу. Эксперим. клин. фармакол. 75(3): 3–6. 2012. [Tolochko Z.S., Spiridonov V.K. Effects of capsaicin on oxidative modification of blood plasma proteins and arterial blood pressure in fructose-fed rats. Eksp. Klin. Farmakol. 75(3): 3–6. 2012 (In Russ.)].
Tran L.T., Yuen V.G., McNeill J.H. The fructose-fed rat: A review on the mechanisms of fructose-induced insulin resistance and hypertension. Mol. Cell. Biochem. 332: 145–159. 2009.
Navarro-Gonzálvez J.A., García-Benayas C., Arenas J. Semiautomated measurement of nitrate in biological fluids. Clin. Chem. 44(3): 679–681. 1998.
Levine R.L., Garland D., Oliver C.N., Amici A., Climent I., Lenz A.G., Ahn B.W., Shaltiel S., Stadtman E.R. Determination of carbonyl content in oxidatively modified proteins. Methods Enzymol. 186: 464–478. 1990.
Rang W.Q., Du Y.H., Hu C.P., Ye F., Xu K.P., Peng J., Deng H.W., Li Y.J. Protective effects of evodiamine on myocardial ischemia-reperfusion injury in rats. Planta Med. 70(12): 1140–1143. 2004.
Yu H., Jin H., Gong W., Wang Z., Liang H. Pharmacological actions of multi-target-directed evodiamine. Molecules. 18(2): 1826–1843. 2013.
Verma S., Bhanot S., McNeill J.H. Sympathectomy prevents fructose-induced hyperinsulinemia and hypertension. Eur. J. Pharmacol. 373: 1–4. 1999.
Wang T., Kusudo T., Takeuchi T., Yamashita Y., Kontani Y., Okamatsu Y., Saito M., Mori N., Yamashita H. Evodiamine inhibits insulin-stimulated mTOR-S6K activation and IRS1 serine phosphorylation in adipocytes and improves glucose tolerance in obese/diabetic mice. PloS One. 8(12): e83264. 2013.
Mellouk Z., Sener A., Ait Yahia D., Malaisse W.J. The metabolic syndrome of fructose-fed rats: effects of long-chain polyunsaturated ω3 and ω6 fatty acids. VII. Oxidative stress. Mol. Med. Rep. 6(6): 1409–1412. 2012.
Kantar Ş., Türközkan N., Bircan F.S., Paşaoğlu Ö.T. Beneficial effects of melatonin on serum nitric oxide, homocysteine, and ADMA levels in fructose-fed rats. Pharm. Biol. 53(7): 1035–1041. 2015.
Lee D.H., Lee J.U., Kang D.G., Paek Y.W., Chung D.J., Chung M.Y. Increased vascular endothelin-1 gene expression with unaltered nitric oxide synthase levels in fructose-induced hypertensive rats. Metabolism. 50(1): 74–78. 2001.
Ching L.C, Kou Y.R., Shyue S.K., Su K.H., Wei J., Cheng L.C., Yu Y.B., Pan C.C., Lee T.S. Molecular mechanisms of activation of endothelial nitric oxide synthase mediated by transient receptor potential vanilloid type 1. Cardiovasc. Res. 91(3): 492–501. 2011.
Coffa P.F., Kotecha N. Modulation of sympathetic nerve activity by perivascular sensory nerves in the arterioles of the guinea-pig small intestine. J. Auton. Nerv. Syst. 77(2–3): 125–132. 1999.
Deng P.Y., Yu J., Ye F., Li D., Luo D., Cai W.J., Zhang J.W., Luo X.G., Deng H. W., Li Y.J. Interactions of sympathetic nerves with capsaicin-sensitive sensory nerves: neurogenic mechanisms for phenol-induced hypertension in the rat. Hypertension. 23(3): 603–609. 2005.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


