Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 1, стр. 78-83
Влияние коллагеназы на активность гиалуронидазы 1-го типа в почечном сосочке и сыворотке крови белых крыс
1 Владикавказский научный центр РАН
Владикавказ, Россия
2 Северо-Осетинский государственный университет им. К.Л. Хетагурова
Владикавказ, Россия
* E-mail: stanislavdzgoev@yandex.ru
Поступила в редакцию 02.10.2019
После доработки 24.10.2019
Принята к публикации 24.10.2019
Аннотация
Исследовано влияние разных концентраций коллагеназы на активность изоформ гиалуронидазы 1-го типа (ГИАЛ1) папиллярной зоны почек и сыворотки крови белых крыс. В почечных сосочках коллагеназа вызывала ингибирование изоформ ГИАЛ1 с молекулярной массой 63 и 73 кДа, степень ингибирования которых росла по мере увеличения концентрации фермента, а затем снижалась. В сыворотке коллагеназа не оказывала никакого влияния на изоформы ГИАЛ1 с молекулярной массой 73 и 132 кДа.
Основными органическими компонентами, формирующими пространственную структуру соединительной ткани млекопитающих, являются коллагеновые белки и гиалуроновая кислота [1, 2]. Эти биополимеры формируют каркас, к которому прикрепляются другие компоненты межклеточного матрикса и который удерживает влагу во всех органах и тканях. Предполагается, что степень полимеризации гиалуроновой кислоты межклеточного матрикса может быть одним из регуляторных факторов, влияющих на целый ряд биологических и патологических процессов. В почках млекопитающих, главном органе по поддержанию водного баланса, содержание гиалуроновой кислоты в медуллярной зоне в несколько раз превышает ее содержание в корковой зоне и прямо пропорционально степени гидратации организма, что указывает на непосредственное участие обмена гиалуроновой кислоты в регуляции процесса реабсорбции воды из собирательных трубок нефронов, происходящего в папиллярной зоне почек [3]. В высокополимеризованном состоянии гиалуроновая кислота, связывая большое количество ионов и воды, создает высокое сопротивление межклеточного матрикса осмотическому току воды из собирательных трубок в кровеносные сосуды. При дегидратации организма, наоборот, степень полимеризации этого биополимера уменьшается, что, в свою очередь, облегчает реабсорбцию воды в почках. Что касается коллагенов, как главных белковых компонентов любой соединительной ткани, очевидно, что их обмен также может влиять на процессы реабсорбции воды в почках. Таким образом, коллагеназы и гиалуронидазы, ферменты, разрушающие и деполимеризующие коллагены и гиалуроновую кислоту, могут быть вовлечены в реализацию физиологических эффектов гормонов, регулирующих водно-электролитный баланс организма млекопитающих за счет облегчения осмотического тока воды через соединительную ткань. Впервые А.Г. Гинецинский обнаружил, что антидиуретический эффект вазопрессина сопровождается увеличением гиалуронидазной активности в моче, а в дальнейшем было продемонстрировано, что данный эффект характерен для почечного сосочка и сыворотки крови [4–7]. В нашем недавнем исследовании изоформ гиалуронидазы 1-го типа в интерстиции почечного сосочка белых крыс добавление коллагеназы вызывало подавление гиалуронидазной активности [8]. Данный эффект оказался неожиданным, поскольку, исходя из существующих представлений, скорее всего, следовало ожидать рост гиалуронидазной активности под действием коллагеназы. Чтобы выяснить причину данного несоответствия цель настоящей работы заключалась в исследовании влияния коллагеназы на активность изоформ гиалуронидазы 1-го типа интерстиция почечного сосочка и сыворотки белых крыс.
МЕТОДЫ ИССЛЕДОВАНИЯ
В экспериментах использовали самцов крыс линии Вистар массой 250–350 г, которые содержались на стандартной диете в условиях вивария. Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями биоэтического комитета Северо-Осетинского государственного университета. В одном эксперименте использовали одну-две крысы, которых декапитировали, собирали кровь, извлекали почки и выделяли почечные сосочки. Кровь центрифугировали 5 мин при 500 g, отбирали сыворотку и использовали в экспериментах. Ферментативные экстракты межклеточного матрикса ГИАЛ1 получали по методу, описанному нами ранее с некоторыми модификациями [8]. Почечные сосочки измельчали до кусочков объемом 1–3 мм3. Измельченные кусочки почечных сосочков, находящиеся в охлажденном физиологическом растворе объемом 2 мл, помещали в устройство, состоящее из двух шприцов объемом 5 мл, соединенных друг с другом через иглу с внутренним диаметром 0.5 мм, и дезинтегрировали, прогоняя буфер с кусочками ткани из одного шприца в другой. Затем суспензию фильтровали через капроновый фильтр с диаметром пор 0.2 мм и центрифугировали 5 мин при 100 g и 4°С. Осадок отбрасывали, а супернатант еще раз центрифугировали 10 мин при 10 000 g и 4°С. Осадок отбрасывали, а надосадочную жидкость считали ферментативным экстрактом ГИАЛ1.
К ферментативным экстрактам ГИАЛ1 (45 мкл) добавляли по 5 мкл растворенной в физиологическом растворе коллагеназы (Sigma, Германия) разных концентраций и инкубировали в течение 60 мин при 37°С.
Гиалуронидазную активность белков определяли методом зимографии с импрегнированной в гель гиалуроновой кислотой [9] с некоторыми модификациями [8]. Образцы смешивали с равным объемом буфера, содержащего 4%-ный додецилсульфат натрия без редуцирующего агента, и оставляли при комнатной температуре на один час. Разделение белков проводили за счет диск-электрофореза в системе Лэммли, но без редуцирующего агента [10]. После электрофореза гель отмывался 2.5%-ным раствором Тритона Х-100 в течение 80 мин при комнатной температуре и инкубировался в 0.1 М натрий-ацетатном буфере (рН 3.5) в течение 18 ч при температуре 37°С. Затем гель инкубировался в 20 мМ Трис-HCl буфере, содержащем 0.1 мг/мл проназу Е (Merck, Германия) при рН 8.0 в течение 2 ч при температуре 37°С. Для визуализации зон с гидролизованной гиалуроновой кислотой гель окрашивался 0.5%-ным раствором алцианового синего (Panreac, Испания). После обесцвечивания проводилось повторное окрашивание геля 0.1%-ным раствором кумасси бриллиантовый синий R-250 (Serva, Германия) c последующим обесцвечиванием. Количественные оценки гиалуронидазной активности полос и определение молекулярной массы делали, сканируя окрашенный гель на денситометре GS-900 с программным обеспечением Image Lab (Bio-Rad, США).
Количественное определение белка осуществляли по методу М. Bradford [11]. Статистическую обработку данных проводили методом парных сравнений с использованием t-критерия Стьюдента. Результаты представлены в виде М ± SEM.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлено влияние различных концентраций коллагеназы на белки ферментативных экстрактов почечных сосочков с молекулярной массой 63 и 73 кДа, обладающие активностью гиалуронидазы 1-го типа. Как видно из рис. 1, даже очень низкие концентрации коллагеназы в инкубационной среде вызывали значительное подавление гиалуронидазной активности обеих изоформ ГИАЛ1.
Рис. 1.
Зимограмма ферментативных экстрактов ГИАЛ1 межклеточного матрикса почечного сосочка в присутствии разных концентраций коллагеназы. Перед проведением зимографии ферментативные экстракты инкубировали с коллагеназой при 37°С в течение 60 мин. Справа обозначены молекулярные массы белков, обладающих гиалуронидазной активностью. Внизу обозначены концентрации коллагеназы, мг/мл. Fig. 1. Zymogram of enzymatic extracts of HYAL1 intercellular matrix of the renal papilla in the presence of different concentrations of collagenase. Enzymatic extracts were incubated with collagenase at 37°C for 60 min before zymography. The molecular mass of proteins with hyaluronidase activity are indicated at right. The collagenase concentration is indicated below, mg/ml.

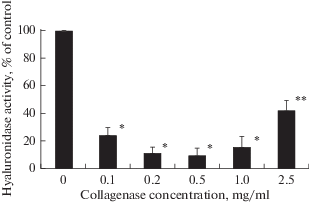
Данный эффект был дозозависимым и усиливался вплоть до концентрации коллагеназы в инкубационной среде 0.5 мг/мл. Однако дальнейшее увеличение концентрации коллагеназы вызывало снижение ингибирующего влияния коллагеназы и рост гиалуронидазной активности обеих изоформ ГИАЛ1. Особенно это было характерно для изоформы ГИАЛ1 с молекулярной массой 73 кДа (рис. 2). Возможно, это связано с тем, что 73 кДа-белок является основной изоформой ГИАЛ1 межклеточного матрикса почечного сосочка, в то время как 63 кДа-белок является внутриклеточным белком, характерным для клеток собирательных трубок [8].
Рис. 2.
Влияние коллагеназы на гиалуронидазную активность 73 кДа-белка. Относительная оптическая плотность полосы белка в отсутствие коллагеназы принималась за 100% и считалась контролем. Результаты являются средними значениями 9 отдельных экспериментов. Звездочкой обозначены достоверные отличия при p < 0.01 по сравнению с контролем. Двумя звездочками обозначены достоверные отличия при p < 0.01 по сравнению с контролем и меньшими концентрациями коллагеназы. Fig. 2. The effect of collagenase on the hyaluronidase activity of the 73 kDa protein. The relative band intensity in the absence of collagenase was used as control, and all values were normalized to it. The results are averages of 9 separate experiments. Significant differences from values for the control are indicated by asterisk at p < 0.01. Significant differences from values for the control and lower concentrations of collagenase are indicated by two asterisks at p < 0.01.
Полученные результаты продемонстрировали, что в интерстиции почечного сосочка внеклеточная коллагеназа может подавлять активность ГИАЛ1, причем степень ингибирования снижается при высоких концентрациях фермента. Мы не нашли в литературе каких-либо сведений относительно влияния этих гидролитических ферментов друг на друга, не говоря уже о механизме этого влияния. Следует отметить, что коллагеназа, по-видимому, непосредственно не действует на изоформы ГИАЛ1, гидролизуя пептидные связи в молекуле изоферментов. В противном случае увеличение концентрации коллагеназы не приводило бы к устранению ингибирующего влияния низких концентраций фермента и росту гиалуронидазной активности тех же самых белковых зон. По-видимому, в ходе расщепления коллагеновых белков интерстиция почечного сосочка под действием коллагеназ могут образовываться какие-то низкомолекулярные продукты гидролиза, оказывающие ингибирующее влияние на активность изоформ ГИАЛ1. При увеличении концентрации коллагеназы эти продукты теряют способность ингибировать изоформы ГИАЛ1, возможно, в виду дальнейшей деградации.
Исследование изоформ ГИАЛ1 в различных тканях белых крыс показало, что в почечном сосочке активность 73 кДа-белка была гораздо выше по сравнению с другими тканями и уступала лишь сыворотке крови, где активность была максимальна [12]. В этой связи представляло интерес выяснить, как будут влиять различные концентрации коллагеназы на активность данной изоформы ГИАЛ1 в сыворотке крови.
Как видно из рис. 3, в отличие от ферментативных экстрактов почечных сосочков разные концентрации коллагеназы не оказывали никакого влияния на сывороточный 73 кДа-белок, а также на изоформу ГИАЛ1 с молекулярной массой 132 кДа, характерную для сыворотки крови крыс [13]. Данный факт подтверждает наше предположение о том, что коллагеназа не гидролизует белки, обладающие активностью ГИАЛ1, но способна опосредованно влиять на гиалуронидазную активность через распад коллагенов соединительной ткани. Отсутствие этих коллагенов в крови, скорее всего, и есть та причина, по которой коллагеназа не влияла на активность 73 кДа-белка в сыворотке крови.
Рис. 3.
Зимограмма ГИАЛ1 сыворотки крови белых крыс в присутствии разных концентраций коллагеназы. Перед проведением зимографии сыворотку разбавляли в 8 раз и инкубировали с коллагеназой при 37°С в течение 60 мин. Справа обозначены молекулярные массы белков, обладающих гиалуронидазной активностью. Внизу обозначены концентрации коллагеназы, мг/мл. Fig. 3. Zymogram of serum HYAL1 from white rats in the presence of different concentrations of collagenase. Serum was diluted for 8 times and incubated with collagenase at 37°C for 60 minutes before zymography. The molecular mass of proteins with hyaluronidase activity are indicated at right. The collagenase concentration is indicated below, mg/ml.
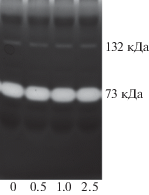
Таким образом, в данном исследовании показано, что коллагеназа, не оказывая непосредственного гидролитического влияния на изоформы ГИАЛ1, тем не менее, способна вызывать дозозависимое ингибирование гиалуронидазной активности в папиллярной зоне почек крыс, степень которого при низких концентрациях сначала растет по мере увеличения концентрации коллагеназы, а затем начинает снижаться. Снижение ингибирующего влияния коллагеназы при высоких концентрациях фермента может отражать тот факт, что по мере усиления деградации коллагенов межклеточного матрикса происходит и увеличение скорости деградации гиалуроновой кислоты, что в целом обеспечивает увеличение проницаемости интерстиция почечного сосочка для воды.
Список литературы
Di Lullo G.A., Sweeney S.M., Körkkö J., Ala-Kokko L., San Antonio J.D. Mapping the Ligand-binding Sites and Disease-associated Mutations on the Most Abundant Protein in the Human, Type I Collagen.|J. Biol. Chem. 277(6): 4223–4231. 2002.
Erickson M., Stern R. Chain gangs: new aspects of hyaluronan metabolism. Biochem. Res. Int. 2012: 893947. 2012.
Hansell P., Göransson V., Odlind C., Gerdin B., Hällgren R. Hyaluronan content in the kidney in different states of body hydration. Kidney Int. 58: 2061–2068. 2000.
Ginetzinsky A.G. Role of hyaluronidase in the reabsorption of water in renal tubules (The mechanism of action of antidiuretic hormone). Nature. 182: 1218–1219. 1958.
Ivanova L.N., Babina A.V., Baturina G.S., Katkova L.E. The effect of vasopressin on the expression of genes of key enzymes of the interstitial hyaluronan turnover and concentration ability in WAG rat kidneys. Russ J. Genetics: Appl Res. 7(3): 249–257. 2017.
Дзгоев С.Г., Иванова Л.Н. Гиалуронидазная активность плазмы крови крыс Вистар: влияние дегидратации и вазопрессина. Рос физиол журн им. И.М.Сеченова. 98(6): 777–781. 2012. [Dzgoev S.G. Hyaluronidase activity of Wistar rat blood plasma: effect of dehydration and vasopressin. Russ. J. Physiol. 98(6): 777–781. 2012. (In Russ)].
Dzgoev S.G. Selective vasopressin V2-agonist desmopressin stimulates blood hyaluronidase activity. Bull Exp. Biol. Med. 159(4): 424–426. 2015.
Дзгоев С.Г. Активность гиалуронидазы 1-го типа в клетках собирательных трубок и интерстиция папиллярной зоны почек крыс. Рос. физиол. журн. им. И.М. Сеченова. 105(3): 295–302. 2019. [Dzgoev S.G. Hyaluronidase activity of the 1-st type in the cells of the collecting ducts and interstitium of the papillary zone of rat kidney. Russ. J. Physiol. 105(3): 295–302. 2019. (In Russ)].
Miura R.O., Yamagata S., Miura Y., Harada T., Yamagata T. Analysis of glycosaminoglycan-degrading enzymes by substrate gel electrophoresis (zymography). Anal. Biochem. 225: 333–340. 1995.
Laemmli U.K. Cleavage of Structural Proteins During the Assembly of the Head of Bacteriophage T4. Nature. 277: 680–685. 1970.
Bradford M.M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248–254. 1976.
Дзгоев С.Г. Сравнительная характеристика изоформ гиалуронидазы 1-го типа в соматических тканях и сыворотке белых крыс. Рос. физиол. журн. им. И.М. Сеченова. 102(8): 963–967. 2016. [Dzgoev S.G. Comparative characterization of hyaluronidase isoforms of the 1-st type in somatic tissues and serum of white rats. Russ. J. Physiol. 102(8): 963–967. 2016. (In Russ)].
Ikegami-Kawai M., Okuda R., Nemoto T., Inada N., Takahashi T. Enhanced activity ofserum and urinary hyaluronidases in streptozotocin-induced diabetic Wistar and GK rats. Glycobiology. 14(1): 65–72. 2004.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


