Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 1, стр. 66-77
Поведенческие и гормонально-метаболические характеристики самок крыс, селекционированных по длительности пассивно-оборонительной реакции
Т. А. Алехина 1, *, Н. А. Пальчикова 2, 3, Д. В. Клочков 1
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
2 Федеральный исследовательский центр фундаментальной и трансляционной медицины
Новосибирск, Россия
3 Новосибирский государственный университет экономики и управления
Новосибирск, Россия
* E-mail: alek@bionet.nsc.ru
Поступила в редакцию 08.04.2019
После доработки 20.09.2019
Принята к публикации 22.10.2019
Аннотация
Работа выполнена на самках крыс линии ГК (Генетическая Кататония), селекционированных по длительности пассивно-оборонительной реакции на слабый стимул. Поскольку ранее исследования проводились в основном на крысах-самцах, то целью настоящей работы стало описание поведенческих, гормонально-метаболических параметров и уровня фертильности у самок линии ГК и выделение особенностей эффектов синхронизации эстрального цикла у этих животных. Определяли стадию эстрального цикла при помощи анализа влагалищных мазков. Регистрировали в ходовом колесе число оборотов колеса, актов раскачивания, общую двигательную активность (сумму пробежек, поворотов, умываний, стоек, нахождений на центральном стержне внутри колеса), а также уровень возбудимости по реакции на звуковой раздражитель. Измеряли уровни прогестерона, эстрадиола, холестерина и триглицеридов в плазме крови. В результате исследования подтвержден пассивный тип реагирования и повышенный уровень возбудимости у самок крыс линии ГК. Установлены более низкая рождаемость и более низкая масса тела у крыс-кататоников по сравнению с крысами Вистар. Определен более высокий уровень прогестерона в проэструсе у самок линии ГК. Показана сниженная концентрация триглицеридов у самок-кататоников на том же уровне, что и у самцов. Установлен повышенный уровень прогестерона в общей группе Вистар и ГК на стадии синхронизированного эстрального цикла по сравнению с несинхронизированной фазой. Полученные результаты продемонстрировали, что селекция на длительность пассивно-оборонительного реакции у самок крыс линии ГК ассоциирована с усиленными реакциями умеренного стрессирования, изменением гормонального и метаболического профиля и сниженной фертильностью этих животных.
Фенотипирование признаков является первым и необходимым этапом для выяснения механизмов патогенеза на животных моделях. Фенотипические характеристики включают не только поведенческие признаки, но и маркеры гормональных и метаболических процессов. Сформировавшиеся наследственные свойства в ходе селекции, например, такие как половые особенности функционирования также относятся к фенотипическим характеристикам. Фенотипирование на крысах линии ГК (от Генетическая Кататония), селекционированных по длительности пассивно-оборонительной реакции (застывание в неудобной позе) (рис. 1), проводилось в основном на самцах. Проявившиеся у них в результате селекции такого рода особенности поведения, как нарушение латентного торможения и снижение престимульного ингибирования [1, 2], являются специфическими для моделирования шизофреноподобных патологий у грызунов [3–5]. Накоплены данные по коморбидным признакам у крыс линии ГК как модели депрессивного расстройства [6].
В последних 30 поколениях направленной селекции крысы линии ГК демонстрируют два кататонических полюса реагирования на тестовые стимулы: негативный (застывание, пассивность), и позитивный (высокая возбудимость и неврозоподобные реакции) [7]. По негативному полюсу вектор изменения поведения и уровня стероидных гормонов у крыс линии ГК [8] сходен с таковыми у мышей линии ASC (antidepressant sensitive catalepsy), селекционированных на проявление щипковой каталепсии [9, 10]. Признаки позитивного полюса, проявляющиеся у особей линии ГК [7], продемонстрированы на линиях крыс НАВ (high anxiety behavior) [11], у крыс FSL с депрессивноподобными наклонностями [5] и на линиях с низким порогом возбудимости НП1, НП2 [12, 13].
К настоящему времени показано, что существует взаимосвязь между уровнем общей возбудимости и специфической половой активацией [14–17]. У самок крыс линии ГК часто возникает состояние синхронизации фаз эструса при групповом содержании этих животных [18]. Синхронизация функций является объективным критерием состояния функциональных систем различного уровня в организме [19]. Большинство фенотипических исследований проводилось на самцах линии ГК, не учитывалось влияния на фенотипические проявления состояния фаз эстрального цикла у самок этой линии. Однако известно, что существуют ассоциации между стадиями эстральной цикличности и поведенческими и гормональными характеристиками у самок лабораторных грызунов [15–17]. Показано также, что нарушения функционирования в половой системе на моделях с пассивным типом поведения может привести к снижению уровня рождаемости потомства [20].
Целью настоящей работы было охарактеризовать самок крыс линии ГК по поведенческим, гормонально-метаболическим параметрам и по уровню фертильности, а также выявить особенности механизмов синхронизации эстрального цикла у этих животных.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили на самках крыс линий ГК (n = 24) и Вистар (n = 27), содержащихся группами по 5–7 особей в виварии Института цитологии и генетики СО РАН при свободном доступе к воде и корму. Кроме того, были взяты данные по рождаемости у 40 пометов крыс линий Вистар и ГК, и в дальнейшем приведены показатели массы тела этих животных. Условия содержания и протоколы работы с животными утверждены Комиссией по биоэтике Института цитологии и генетики СО РАН, все процедуры проводили в соответствии с рекомендациями Европейского парламента и Совета Европейского Союза (директива 2010/63/EU от 22 сентября 2010 г.).
Тест колесо. На I стадии исследовали крыс в тесте колесо без взятия мазков (см. схему опыта). Используемое устройство в форме ходового колеса было заказано в мастерских ИЦиГ СО РАН. Диаметр колеса – 35 см, ширина “дорожки” – 10 см, боковые стенки сделаны из оргстекла. Животное помещали внутрь устройства, где крыса двигалась по дорожке, состоящей из стальных стержней. Регистрировали в течение 5 мин следующие показатели: полное число оборотов, акты раскачивания и уровень общей двигательной активности (пробежка внутри колеса, повороты, умывание, стойки, нахождение на центральном стержне, акты раскачивания). Через 4 мин тестирования подавался звуковой сигнал (90 дБ, 60 Гц, 2 с), фиксировали реакцию по балльной системе: 0 – нет никакой реакции, 1 – застывание, 2 – двигательные побежки. Отмечали количество болюсов за 5 мин.
Схема опыта:
На II стадии исследовали фазы эстральной цикличности при групповом содержании животных путем анализа влагалищных мазков у самок-крыс ГК и Вистар, начиная с двухмесячного возраста [22].
На III стадии после взятия мазков анализировали содержание гормонов и метаболитов в плазме крови на разных стадиях синхронизированного и несинхронизированного эстрального цикла в группах крыс Вистар и ГК.
Определение содержания гормонов и метаболитов. Крыс декапитировали при помощи гильотины в день определения фазы эструса. Периферическую кровь собирали в пробирку, содержащую в качестве антикоагулянта ЭДТА. Кровь центрифугировали 20 мин при 3000 об/мин и 4°С, плазму хранили при –40°С.
Уровни эстрадиола (нмоль/л) и прогестерона (нмоль/л) измеряли иммуноферментным методом с использование наборов “ЭСТРАДИОЛ-ИФА” и “ПРОГЕСТЕРОН-ИФА” (“ХЕМА”, Москва) по прилагаемым инструкциям. Диапазон определения концентраций: 0–20 нмоль/л для эстрадиола и 0–300 нмоль/л для прогестерона; чувствительность – 0.025 и 0.25 нмоль/л соответственно. Измерение проводили на микропланшетном иммуноферментном анализаторе “ImmunoChem 2100”. Содержание триглицеридов (ммоль/л) и холестерина (ммоль/л) в плазме крови определяли ферментативным колориметрическим методом с использованием наборов “FLUTEST CHOL” и “FLUTEST TG” (Biocon, Германия) по прилагаемым инструкциям. Диапазон определения концентраций: 0.08–20.7 ммоль/л для холестерина и 0.11–22.6 ммоль/л для триглицеридов; аналитическая чувствительность – 0.08 и 0.004 моль/л соответственно. Измерения проводили на спектрофотометре СФ-2000. Оборудование ЦКП “Современные оптические системы” ФИЦ ФТМ.
Статистическую обработку проводили с использованием пакета программ “Stastistica 10.0”. Для каждого параметра вычислялось среднее арифметическое (M) и ошибка среднего (±m). Различия считались достоверными на уровне значимости p < 0.05 и выше. При сравнении фенотипических признаков использовали однофакторный дисперсионный анализ, в качестве апостериорного критерия применяли LSD-тест.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Тест колесо. К двигательным реакциям отнесли показатель “число раскачиваний” (табл. 1). Крыса цепляется за прутья дорожки и мышечными усилиями заставляет раскачиваться колесо. Значение этого показателя у крыс Вистар в несколько раз больше, чем у ГК. Другой параметр – общая активность, включает число всех двигательных реакций за 5 мин тестирования: акты раскачивания, пробежки внутри колеса, повороты, умывание, стойки, залезание на центральный стержень. По величине этого показателя крысы Вистар также опережают крыс ГК. Таким образом, самки Вистар более активны по сравнению с самками ГК (табл. 1).
Таблица 1.
Показатели поведенческих реакций в тесте Колесо у крыс Вистар и ГК Table 1. Rates of behavioral reactions in the test Wheel in Wistar and GC rats
| Вистар (27) Wistar (27) | ГК (24) GC (24) |
Вероятность различий Probability of the differences | |
|---|---|---|---|
| Раскачивание (n) Rocking (n) |
16.5 ± 5.4 | 2.7 ± 2.7 | p < 0.001 |
| Общая активность Overall activity (n) |
31.3 ± 4.7 | 17.0 ± 3.2 | p < 0.05 |
| Реакция на звонок (баллы) Reaction on bell (scores) |
1.1 ± 0.2 | 2.2 ± 0.2 | p < 0.05 |
| Дефекация (число болюсов) Defecation (number of boluses) |
0.7 ± 0.2 | 2.0 ± 0.6 | p < 0.05 |
Самки линии ГК показали повышенную реакцию на звонок (маркер стрессовой реактивности), более высокий уровень дефекации (маркер эмоциональности) (табл. 1) и более низкую массу тела (табл. 2). По этим параметрам вырисовывается картина невротизированного животного. Кроме того, самки ГК по количеству детенышей в помете (маркер фертильности) уступают место крысам Вистар, что сочетается с состоянием животных, находящихся в состоянии умеренного стресса (табл. 2).
Таблица 2.
Масса тела и рождаемость у крыс Вистар и ГК Table 2. Body weight and fertility in Wistar and GC rats
| Вистар (20 пометов) Wistar (20 litters) |
ГК (20 пометов) GC (20 litters) |
Вероятность различий Probability of the differences | |
|---|---|---|---|
| Масса тела в 3-месячном возрасте (г) Body weight at 3 months of age (g) |
264.5 ± 4.0 | 204.0 ± 3.3 | p < 0.001 |
| Рождаемость в помете (n) Fertility (n) |
10.4 ± 0.6 | 7.6 ± 0.5 | p < 0.001 |
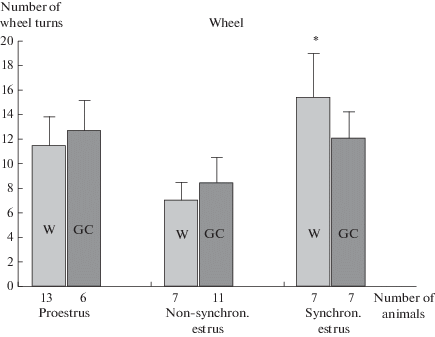
Установлено, что по числу полных оборотов колеса синхронизированные по эструсу самки линии Вистар превосходят более чем в 2 раза несинхронизированных самок этой же линии. У крыс ГК отмечена тенденция к повышению этого показателя на 31% (рис. 2).
Рис. 2.
Число оборотов колеса на разных стадиях эстрального цикла. * – p < 0.05 различия в LSD post hoc тесте между синхронизированным и несинхронизированным эструсом в группах Вистар. Fig. 2. Number of the wheel turns at different stages of the estrous cycle. * – p < 0.05 differences in the LSD post hoc test between synchronized and non-synchronized estrus in Wistar groups.
Концентрация основного липида в плазме крови – холестерина – общего предшественника стероидных гормонов, в частности, таких как прогестерон и эстрадиол, не различалась у крыс обеих линий (рис. 3).
Рис. 3.
Уровни триглицеридов и холестерина на разных стадиях эстрального цикла. ** – p < 0.01 различия в LSD post hoc тесте между Вистар и ГК. Fig. 3. Triglycerides and cholesterol levels at different stages of the estrous cycle. ** – p < 0.01 differences in the LSD post hoc test between Wistar and GC.
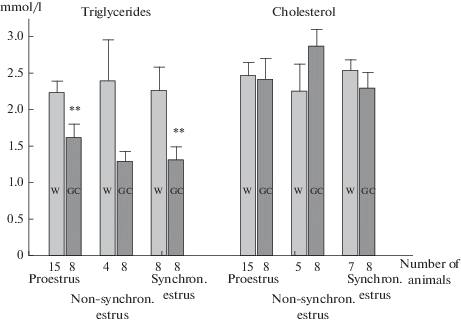
Однако по содержанию другого липида – уровню триглицеридов в плазме крови обнаружены различия у самок двух линий (рис. 3): у крыс линии ГК величина этого показателя в 2 раза ниже, чем у крыс Вистар во всех исследуемых фазах – проэструс, синхронизированный и несинхронизированный эструс.
Не обнаружено межлинейных различий в концентрации эстрадиола в плазме крови – гормона, регулирующего эстральный цикл (рис. 4). Однако выявлены различия по содержанию прогестерона в плазме крови в фазе проэструс у самок крыс линий Вистар и ГК (рис. 4). Уровень этого гормона у особей ГК выше более чем в 3 раза по сравнению с исходной линией.
Рис. 4.
Уровни эстрадиола и прогестерона на разных стадиях эстрального цикла. * – p < 0.05 различия в LSD post hoc тесте между группами Вистар и ГК. F1,29 = 6.2; p < 0.02 между общими группами Вистар и ГК, различающимися по степени синхронизации. Fig. 4. Estradiol and progesterone levels at different stages of the estrous cycle. * – (p < 0.05) differences in the LSD post hoc test between the Wistar and GK groups. F1,29 = 6.2; p < 0.02 between the general Wistar and GC groups, differences in the degree of synchronization.
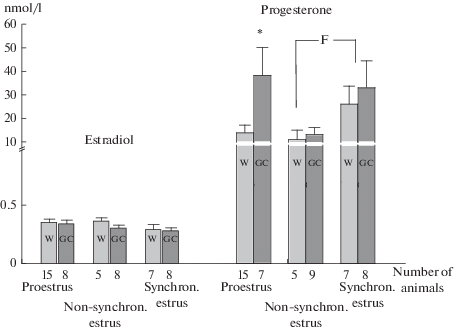
Дисперсионный анализ выявил влияние фактора синхронизации в линиях Вистар и ГК: F1,29 = 6.2; p < 0.02. Этот факт демонстрирует повышение уровня прогестерона на стадии синхронизации эструса в группах обеих линий по сравнению с несинхронизированной фазой.
Таким образом, в настоящей работе описаны фенотипические характеристики у самок линий Вистар и ГК, которые различают и объединяют их по ряду параметров. У крыс ГК снижена двигательная активность и повышена реакция на звуковой раздражитель в ходовом колесе. У крыс Вистар выявлено большее число оборотов колеса на стадии синхронизированного эструса по сравнению с несинхронизированной фазой. По уровню холестерина и эстрадиола в плазме крови не было обнаружено межлинейных различий. Однако по содержанию триглицеридов обнаружено значительное снижение этого липида у самок линии ГК. При сравнении уровней прогестерона в фазе проэструса показан повышенный уровень этого гормона у самок-кататоников в отличие от самок Вистар. Выявлена сниженная фертильность у крыс линии ГК. В общей группе самок Вистар и ГК содержание прогестерона на стадии синхронизированного эструса было достоверно выше, чем на стадии несинхронизированного эструса.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поведенческие реакции в ходовом колесе содержат элементы защитного поведения, реактивности, агрессивности по отношению к человеку и тревожноподобные признаки [21] и в сумме свидетельствуют о пассивном типе поведения у самок-кататоников линии ГК.
Известно, что крысы-самцы ГК с пассивным поведением отличались от крыс исходной линии Вистар и высоковозбудимых крыс линии ГК промежуточной позицией по ряду фенотипических параметров. Пассивные особи заняли среднее положение по времени застывания в светло-темной камере, по уровню моноаминов в мозге и по содержанию норадреналина в надпочечниках [22]. Приведенные факты указывают на нейрогормональную основу пассивного поведения, что согласуется с работой Д.А. Жукова и соавт. [23], в которой у крыс с пассивной стратегией приспособления был установлен средний, а не низший социальный ранг. Тип наследования у самцов и самок линии ГК, проанализированный путем менделевского скрещивания, оказался доминантным с неполной пенетрантностью по признаку пассивно-оборонительных реакций [24]. Такое же доминантное (или не полностью доминантное) наследование было установлено у 300 собак разных пород с пассивной формой реагирования [25]. Доминирование пассивных признаков подтверждает их адаптивное значение.
Помимо сниженной двигательной активности в ходовом колесе у самок линии ГК на всех исследуемых стадиях полового цикла выявлен более низкий уровень триглицеридов в плазме крови, как это было ранее установлено у самцов той же линии [26]. Последний факт указывает на более низкий энергетический потенциал у особей обоих полов, от которого может зависеть и более низкая двигательная активность, и более низкая масса тела у крыс-кататоников. Сведения об участии в метаболизме триглицеридов при формировании энергетического баланса, как у животных, так и у человека опубликованы в обзорах [27, 28].
Ранее нами было выдвинуто предположение о единстве генетического ядра застывающих и высоковозбудимых крыс линии ГК [29]. У животных-самцов в неврозоподобном состоянии показано повышение уровня кортикостерона, сниженное содержание норадреналина в надпочечниках и более высокая масса надпочечников [26], как и у линейных крыс с повышенным уровнем тревожности [11]. У самок ГК при взятии у них мазков мы неоднократно наблюдали высокую прыгучесть. Такое поведение в англоязычной литературе называют “jumping and/or impulsive”, т.е. прыгающие и/или импульсивные животные [30, 31]. По полученным в этой работе результатам был продемонстрирован повышенный уровень возбудимости на звуковой раздражитель у самок ГК в ходовом колесе. Вышеописанные признаки указывают на более высокую восприимчивость к действию умеренного стресса (взятие мазков, пересаживание в другую клетку, перенос в незнакомую установку) [20, 23, 32].
В то же время повышение активности гипоталамо-гипофизарно-надпочечниковой системы у самок кататонической линии может спровоцировать подъем уровня прогестерона. В литературе мы находим факты об однотипном изменении синтеза кортикостерона и прогестерона в состоянии стресса, вызванном предъявлением запаха меха кота, различающимся у крыс с активной и пассивной стратегией поведения [33]. Особи с пассивной стратегией значительно сильнее реагировали на стрессор поднятием уровня кортикостерона и прогестерона в плазме крови. Эти данные указывают на то, что несмотря на застывание около пугающего стимула – кошачьей шерсти, состояние стресса длилось гораздо дольше, что говорит о более продолжительной защитной реакции у животных с пассивным типом поведения. Повышение уровней двух вышеуказанных гормонов при стрессе подтверждено и на людях. Высказано предположение, что нарушение функционирования в прогестероновой системе может привести к крайне пассивному состоянию у человека – симптомам депрессии [34].
В группе самок ГК, в которую отбирались крысы по пассивной реакции застывания, проявились различия в содержании прогестерона в проэструсе. Уровень этого гормона оказался в 3 раза выше, чем у самок Вистар. Важно отметить, что ранее было выявлено у самок линии ГК снижение большинства типов фолликул на стадии проэструса – подготовительной фазы к имплантации яйцеклетки, свидетельствующее о нарушении протекания у них фолликулогенеза [35]. Можно, по-видимому, рассматривать повышение содержания прогестерона как компенсаторную реакцию на этой стадии.
Аналогичные данные о повышенном уровне прогестерона в крови были получены у самок крыс с пассивной формой приспособления – в линии KLA [33]. Авторы расценили полученные результаты на самках KLA, сочетающиеся с низкой фертильностью у этих животных как фактор снижения вероятности наступления беременности в результате хронического умеренного стресса [20, 32]. По-видимому, одной из причин снижения фертильности у самок крыс линии ГК стала повышенная восприимчивость к действию умеренного стресса, нарушение протекания фолликулогенеза у самок [35] и низкое число и сниженная подвижность сперматозоидов у самцов [36].
В последнее время стали накапливаться данные о влиянии прогестерона и его предшественника аллопрегнанолона, связанных с тормозным ГАМК-рецепторным комплексом, на состояние пассивности и депрессии у людей и животных [37–39]. При этом на большом количестве работ документировано, что основной функцией этого гормона является подготовка к имплантации яйцеклетки в слизистую оболочку матки [40]. Такую двойную роль прогестерона можно ассоциировать с пассивным типом поведения у самок-крыс линии ГК, как это было показано на крысах линии KLA [25, 42].
В последнее время в литературе опубликованы немногочисленные данные о существовании или несуществовании синхронизации эстральной цикличности у грызунов [18, 41, 42]. Наши результаты подтверждают существование эффектов синхронизации фаз эструса у самок крыс вида Rattus norvegicus. Этот эффект проявляется в группах особей, находящихся в непосредственной близости друг от друга, что позволяет максимально сократить длительность периода размножения для подготовки генитального эпителия и приводит к повышению уровня общего центрального возбуждения. Феномен синхронизации в общей группе Вистар и ГК проявился в повышении значений уровня прогестерона на стадии синхронизированного эструса по сравнению с несинхронизированными фазами, что указывает на общий признак, характерный для крыс вида Rattus norvegicus.
Таким образом, в настоящей работе описаны фенотипические характеристики у самок крыс линии ГК, прошедшие длительный период отбора на пассивный тип реагирования. Такой тип ответа сочетается с двукратным падением уровня триглицеридов в плазме крови и с более низкой массой тела этих животных. Помимо этого, продемонстрированы повышенная восприимчивость к умеренному стрессу и повышенный уровень прогестерона, который вместе с другими наследственными факторами приводит к снижению рождаемости у животных кататонической линии.
Список литературы
Alekhina T.A., Ryazanova M.A., Ukolova T.N., Sakharov D.G., Chugui V.F., Prokudina O.I. Neurohormonal changes during formation of latent inhibition in rats predisposed to catalepsy. Neurochem J. 2(3): 183–187. 2008.
Рязанова М.А., Прокудина О.И., Плеканчук В.С., Алехина Т.А. Экспрессия генов системы катехоламинов в среднем мозге и реакция престимульного торможения у крыс с генетической кататонией. Вавиловский журн генетики и селекции. 21(7): 798–803. 2017. [Ryazanova M.A., Prokudina O.I., Plekanchuk V.S., Alekhina T.A. Expression of catecholamine system genes in the midbrain and prepulse inhibition reaction in rats with genetic catatonia. Vavilovskii Zhurn Genetiki i Selektsii. 21(7): 798–803. https://doi.org/10/18699/VJ17.296. 2017. (In Russ.)].
Lipina T.V., Rasquinha R., Roder J. Parametric and pharmacological modulations of latent inhibition in mouse inbred strains. Pharmacol. Biochem. Behaviour. 100(2): 244–252. 2011.
Kloet E.R., Jolls M., Holsboer F. Stress and the brain: from adaptation to disease. Neuroscience. 6: 463–475. 2005.
Wegener G., Mathe A.A., Neumann I.D. Selectively bred rodents as models of depression and anxiety. Curr. Topics Behav. Neurosci. 2012. 139–187. https://doi.org/10.1007/7854_2011_192
Kulikov A.V., Kolpakov V.G., Popova N.K. The genetic cataleptic (GC) rat strain as a model of depressive disorders. In: Animal models in biological psychiatry. Ed. A.V. Kalueff. Nova Science Publ. 59–73. 2006.
Рязанова М.А., Игонина Т.Н., Алехина Т.А., Прокудина О.И. Увеличение доли “нервных” животных в ходе селекции на кататонию: участие в кататонических реакциях центральных адренорецепторов. Генетика. 48(11): 1141–1147. 2012. [Ryazanova M.A., Igonina T.N., Alekhina T.A., Prokudina O.I. The increase in the proportion of nervous animals bred for catatonia: the participation of central adrenoreceptors in catatonic reactions. Genetika. 48(11): 1141–1147. 2012. (In Russ)].
Шульга В.А., Барыкина Н.Н., Алехина Т.А., Колпаков В.Г. Некоторые физиологические характеристики генетической предрасположенности к каталепсии у крыс в зависимости от стадии селекции. Рос. физиол. журн. им. И.М. Сеченова. 82(10–11): 77–83. 1996. [Shulga V.A., Barykina N.N., Alekhina T.A., Kolpakov V.G. Some physiological characteristics of genetic predisposition of rats to catalepsy. Russ. J. Physiol. 82(10–11): 77–83. 1996. (In Russ)].
Базовкина Д.В., Куликов А.В., Кондаурова Е.М., Попова Н.К. Селекция на предрасположенность к каталепсии усиливает депрессивноподобное поведение у мышей. Генетика. 41(9): 1–6. 2005. [Bazovkina D.V., Kulikova A.V., Kondaurova E.M., Popova N.K. Selection for the predisposition to catalepsy enhances depressive-like traits in mice. Genetika. 41(9): 1–6. 2005. (In Russ)].
Tikhonova M.A., Kulikov A.V., Bazovkina D.V., Kulikova E.A., Tsybko A.S., Bazhenova E.Yu., Naumenko V.S., Akulov A.E., Moshkin M.P., Popova N.K. Hereditary catalepsy in mice is associated with the brain dysmorphology and altered stress response. Behav. Brain Res. 243: 53–60. 2013.https://doi.org/10.1016/j.bbr.2012.12.057
Salome N., Vitart O., Lesage J., Landgraf R., Vieau D., Laborie C. Altered hypothalamo-pituitary-adrenal and sympatho-adrenomedullary activities in rats bred for anxiety: central and peripheral correlates. Psychoneuroendocrinology. 31: 724–735. DOI: 2006.02.002https://doi.org/10.1016/j.psyneuen
Ордян Н.Э., Вайдо А.И., Ракицкая В.В., Ширяева Н.В., Проймина Ф.И., Лопатина Н.Г., Шаляпина В.Г. Функционирование гипофизарно-адренокортикальной системы у крыс, селекционированных по порогу чувствительности к электрическому току. Бюл. экспер. биол. мед. 125(4): 443–445. 1998. [Ordian N.E., Vaydo A.I., Rakitskaia V.V., Shiriaeva N.V., Proimina F.I., Lopatina N.G., Shalyapina V.G. Functioning of the hypophyseal-adrenocortical system in rats selected for the sensitivity threshold to the electric current. Bull. Eksper. Biol. Med. 125(4): 443–5. 1998. (In Russ)].
Vaydo A.I., Shiryaeva N.V., Lopatina N.G. Divergent responses to long-term stressors in rat lines selected for different functional states of the nervous system. Behavior Genetics. 23(5): 499–503. 1993.
Schober J., Weil Z., Pfaff D. How generalized CNS arousal strengthens sexual arousal (and vice versa). Hormones Behav. 59: 689–695.https://doi.org/10.1016/j.yhbeh.2010.10.005
Сашков В.А., Сельверова Н.Б., Моренков Э.Д., Ермакова И.В., Бурая Т.И. Взаимосвязь уровня нейроактивных стероидов в мозге, поведения и тревожности у созревающих и половозрелых самок крыс в течение эстрального цикла. Нейрохимия. 26(1): 42–50. 2009. [Sashkov V.A., Sel’verova N.B., Morenkov E.D., Ermakova I.V. Neuroactive steroids in the brain and age and sex specificity of behavior and anxiety: an experimental study. Neurochemistry. 26(1): 42–50. 2009. (In Russ)].
Devidze N., Lee A.W., Zhou J., Pfaff D.W. CNS arousal mechanisms bearing on sex and other biologically regulated behaviors. Physiol. Behav. 88: 283–293. 2006. https://doi.org/10.1016/j.physbeh.2006.05.030
Oyola M.G., Handa R.G. Hypothalamic-pituitary-adrenal and hypothalamic-pituitary-gonadal axes: sex differences in regulation of stress responsivity. Stress. 20(5): 476–494.https://doi.org/10.1080/10253890.2017.1369523
Клочков Д.В., Алехина Т.А. Селекция на усиление кататонической реактивности крыс, половая функция и синхронизация эстральной цикличности. Вавиловский журн генетики и селекции. 16(4/2): 1025–1031. 2012. [Klochkov D.V., Alekhina T.A. Selection for catatonia: effect on the sexual function and estrous cycle synchronization. Vavilovskii Zhurn. Genetiki i Selektsii. 16(4/2): 1025–1031. 2012. (In Russ)].
Судаков К.В. Временная синхронизация функций – объективный критерий функциональных систем различного уровня организации. Журн. высш. нерв. деят. им. И.П. Павлова. 36(4): 638–646. 1986. [Sudakov K.V. Temporal synchronization of functions–objective criterion for functional systems with different levels of organization. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 36(4): 638–646. 1986. (In Russ)].
Виноградова Е.П., Чаадаева Е.В., Жуков Д.А. Нарушение репродуктивной функции у крыс, генетически селектированных по способности к активному избеганию. Журн. высш. нерв. деят. им. И.П. Павлова. 44(6): 1134–1136. 1994. [Vinogradova E.P., Chaadaeva E.V., Zhukov D.A. Disordered reproductive function in rats genetically selected for their capacity for active avoidance. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 44(6): 1134–1136. 1994. (In Russ)].
Novak C.M., Burghardt P.R., Levine J.A. The use of a running wheel to measure activity in rodents: relationship to energy balance, general activity and reward. Neurosci. Biobehav. Rev. 36(3): 1001–1014. https://doi.org/10.1016/j.neuboirev.2011.12.012
Алехина Т.А., Барыкина Н.Н., Петренко О.И., Чугуй В.Ф., Колпаков В.Г. О “патоморфозе” каталептической реакции у крыс. Журн. эволюц. биохим. физиол. 41(6): 536–540. 2005. [Alekhina T.A., Barykina N.N., Petrenko O.I., Chugui V.F., Kolpakov V.G. Pathomorphosis of cataleptic reactions in rats. Zh. Evol. Biokhim. Fiziol. 41(6): 534–538. 2005. (In Russ)].
Жуков Д.А., Вековищева О.Ю., Виноградова Е.П. Крысы с пассивной стратегией приспособления обладают средним, а не низшим рангом. Журн. высш. нерв. деят. им. И.П. Павлова. 52(2): 175–182. 2002. [Zhukov D.A., Vekovishcheva O.Iu., Vinogradova E.P. Rats with passive coping strategy have average, but not low social range. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 52(2): 175–82. 2002. (In Russ)].
Колпаков В.Г., Барыкина Н.Н., Чугуй В.Ф., Алехина Т.А. Взаимоотношение между некоторыми формами каталепсии у крыс. Попытка генетического анализа. Генетика. 35(6) : 807–810. 1999. [Kolpakov V.G., Barykina N.N., Chugui V.F., Alekhina T.A. Relationship between certain forms of catalepsy in rats. An attempt at genetic analysis. Genetika. 35(6): 807–810. 1999. (In Russ)].
Крушинский Л.В. Наследование пассивно-оборонительного поведения (трусости) в связи с типами нервной системы у собак. В кн.: Эволюционно-генетические аспекты поведения. М. Наука. 72–95. 1991. [Krushinskii L.V. Inheritance of passive-defensive behavior (cowardice) in connection with the types of the nervous system in dogs. In: Evolutionary genetic aspects of behavior. Moscow. Nauka. 72–95. 1991. (In Russ)].
Алехина Т.А., Пальчикова Н.А., Игонина Т.Н., Кузнецова Н.В. Сравнительный анализ реакций на введение имипрамина крысам кататонической линии ГК и Вистар. Рос физиол журн им. И.М. Сеченова. 101(3): 249–257. 2015. [Alekhina T.A., Palchikova N.A., Igonina T.N., Kuznetsova N.V. Comparative analysis of imipramine intake reactions in catatonic and Wistar rats. Russ. J. Physiol. 101(3): 249–257. 2015. (In Russ)].
Leibowitz S.F. Regulation and effects of hypothalamic galanin: relation to dietary fat, alcohol ingestion, circulating lipids and energy homeostasis. Neuropeptides. 39(3): 327–332. 2005.
Muller M.J., Enderle J., Bosy-Westphal A. Changes in energy expenditure with weight gain and weight loss in humans. Curr. Obes. Rep. 5: 413–423. https://doi.org/10.1007/s13679-016-0237-4
Чугуй В.Ф., Колпаков В.Г., Барыкина Н.Н. Каталепсия и “нервность” у крыс. Результаты повторной селекции. Генетика. 43(2): 276–279. 2007. [Chugui V.F., Kolpakov V.G., Barykina N.N. Catalepsy and “nervousness” in rats: results of replicated selection. Genetika. 43(2): 276–279. 2007. (In Russ)].
Himmler B.T., Stryjek R.S., Modlinska K., Derksen S.M., Pisula W., Pellis S.M. How domestication modulates play behavior: a comparative analysis between wild rats and a laboratory strain of Rattus norvegicus. J. Comp. Psychol. 127(4): 453–464. 2013 https://doi.org/10.1037/a0032187
Moreno M., Cardona C., Gomez M.J., Sanchez-Santed F., Tobena A., Fernandez-Terual A., Campa L., Sunol C., Escarabajal D., Torres C., Flores P. Impulsivity characterization in the Roman High- and Low-avoidance rat strains: behavioral and neurochemical differences. Neuropsychopharmacology. 35: 1198–1208. 2010.
Виноградова Е.П., Арутюнян Н.А., Жуков Д.А. Тревожность и прогестерон в плазме крови в разные стадии эстрального цикла у крыс с противоположными стратегиями поведения. Рос. физиол. журн. им. И.М. Сеченова. 104(5): 565–572. 2018. [Vinogradova E.P., Arutunan N.A., Zhukov D.A. Anxiety and plasma progesterone in different stages of the estrous cycle in rats with opposite coping style. Russ. J. Physol. 104(5): 565–572. 2018. (In Russ)].
Bowen M.T., Hari Dass S.A., Blooth J., Suraev A., Vyas A., McGregor I.S. Active coping towards predatory stress is associated with lower corticosterone and progesterone plasma levels and decreased methylation in the medial amygdala vasopressin system. Hormones Behav. 66: 561–566. 2014.
Wirth M.M. Beyond the HPA axis: progesterone-derived neuroactive steroids in human stress and emotion. Front. Endocrinol. 2. https://doi.org/10.3389/fendo.2011.00019
Клочков Д.В., Алехина Т.А., Барыкина Н.Н. Моноамины и функция яичников крыс, селекционированных на усиление кататонической реактивности. Журн. эволюц. биохим. физиол. 45(3): 329–333. 2009. [Klochkov D.V., Alekhina T.A. Monoamines and function of ovaries of rats selected for catatonia. Zhurn. Evol. Biokhim. Phiziol. 45(3): 329–333. 2009. (In Russ)].
Клещев М.А., Алехина Т.А., Осадчук Л.В. Сперматогенная функция семенников у крыс с наследственной предрасположенностью к проявлению кататонических реакций. Вавиловcкий журн генетики и селекции. 22(4): 400–405. 2018. [Kleshchev M.A., Alekhina T.A., Osadchuk L.V. The spermatogenic function testes in rats predisposed to the manifestation of catatonic reactions. Vavilovskii Zhurn. Genetiki i Selektsii. 22(4): 400–405. https://doi.org/10.18699/VJ18.000. 2018. (In Russ)].
Backstrom T., Bixo M., Johansson M., Nyberg S., Ossewaarde L., Ragagnin G., Savic I., Stromberg J., Timby E., van Broekhoven F., van Wingen G. Allopregnanolone and mood disorders. Prog. Neurobiol. 113: 88–94. 2014.
Melcangi R.C., Panzika G.C. Allopregnanolone: state of the art. Prog. Neurobiol. 113: 1–5. 2014.
Wei W., Zhang N., Peng Z., Houser C.R., Mody I. Perisynaptic localization of delta subunit-containing GABA(A) receptors and their activation by GABA spillover in the mouse dentate gyrus. J. Neurosci. 23: 10650–10661. 2003.
Holesh J.E., Lord M. Physiology, Ovulation. StatPearls [Internet]. Treasure Island (FL): StatPearls publishing; 2018.
Schank J.C. Do Norway rats (Rattus Norvegicus) synchronize their estrus cycles? Physiol. Behav. 72: 129–139. 2001.
Иванов Ю.Н., Клочков Д.В., Поздняков М.А. Исследование синхронизации полового цикла у самок серой крысы (Rattus Norvegicus) при совместном содержании. Вавиловский журн генетики и селекции. 15(1): 35–44. 2011. [Ivanov Yu.N., Kolchkov D.V., Pozdnyakov M.A. Estrous cycle synchronization in rats (Rattus Norvegicus) females kept together. Vavilovskii Zhurn. Genetiki i Selektsii. 15(1): 35–44. 2011. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова