Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 1, стр. 17-30
Влияние блокады вегетативных ганглиев, М-холино- и β-адренорецепторов миокарда на вариабельность сердечного ритма крыс
Е. В. Курьянова 1, *, А. В. Трясучев 1, В. О. Ступин 1, Ю. Д. Жукова 1, Н. А. Горст 1
1 Астраханский государственный университет
Астрахань, Россия
* E-mail: fyzevk@rambler.ru
Поступила в редакцию 15.05.2019
После доработки 17.09.2019
Принята к публикации 08.10.2019
Аннотация
Анализ вариабельности сердечного ритма (ВСР) у крыс выявил, что блокада вегетативных узлов (гексаметоний, 7 мг/кг) повышает ЧСС на 12–16%, снижает мощность очень низкочастотных волн на 85% (p < 0.001), низкочастотных – на 60% (p < 0.05), высокочастотных – на 40% (р < 0.05). Блокада М-холинорецепторов (атропин, 1 мг/кг) повышает ЧСС на 30% (p < 0.001) и снижает мощность всех волн ВСР ритма на 96–98% (p < 0.001). Блокада β-адренорецепторов (анаприлин, 2 мг/кг) снижает ЧСС на 25% (p < 0.001) и мощность очень низкочастотных волн на 70% (р < 0.05). На фоне блокады вегетативных ганглиев введение атропина снижает мощность волн сердечного ритма в меньшей мере, а введение анаприлина мало изменяет ЧСС, но потенцирует рост мощности высокочастотных волн. Таким образом, регуляторные влияния через М-холинорецепторы кардиомиоцитов отвечают за формирование мощности всех волн вариабельности сердечного ритма. Взаимодействие холинергических механизмов с сигналами, поступающими через вегетативные узлы и β-адренорецепторы, определяет мощность низкочастотных волн. Активность вегетативных узлов влияет на характер и выраженность изменений сердечного ритма при воздействии на холино- и адренорецепторы миокарда.
Методы анализа вариабельности сердечного ритма (ВСР) весьма широко используются для оценки вегетативного баланса организма в медико-биологических и клинических исследованиях [1–7], что требует высокой точности и объективности физиологической интерпретации показателей ВСР. Традиционно мощность высокочастотных или дыхательных волн (HF-волн) рассматривается в качестве показателя активности парасимпатических влияний, а мощность низкочастотных или вазомоторных волн (LF-волн) – как критерий активности симпатических влияний на сердце [1–5, 8]. Однако блокада М-холинорецепторов атропином снижает мощность не только HF-волн, но и других волн спектра ВСР [4, 6, 8–12]. В свою очередь мощность LF-волн после введения блокаторов β-адренорецепторов изменяется неоднозначно, может как повышаться, так и снижаться [6, 12–14]. То есть, по данным литературы, исключительно парасимпатическая природа HF-волн и симпатическая природа LF-волн до сих пор не нашли четкого подтверждения. Поэтому вопрос о роли холинергических и адренергических механизмов в формировании волн спектра ВСР требует продолжения исследований для уточнения известных трактовок параметров ВСР, поскольку от этого зависит адекватность заключений, имеющих значение для прогнозирования состояния организма, выбора тактики лечения и т.п. В этой связи важно выяснить причины неоднозначного изменения мощности волн ВСР в фармакологических пробах (анаприлиновой, атропиновой и др.). Следует отметить, что при изучении физиологической природы волн ВСР внимание ученых сконцентрировано в основном на адрено- и холинорецепторах кардиомиоцитов [3, 4, 6, 8, 10, 12, 13, 15], роль вегетативных ганглиев рассматривается редко [9, 16]. Между тем вегетативные ганглии являются мощными периферическими нервными центрами, интегрирующими и передающими к сердцу сигналы от отделов ЦНС и различных рефлексогенных зон. Через вегетативные узлы замыкаются местные рефлекторные дуги, благодаря чему они оказывают самостоятельное регуляторное влияние на периферические органы [17–19]. Поэтому для уточнения представлений о вегетативных нервных механизмах вариабельности кардиоинтервалов необходимо моделирование воздействий не только на периферические холино- и адренорецепторы, но на вегетативные ганглии. Возможно, это позволит лучше понять причины неоднозначных эффектов традиционных фармакологических проб в отношении ВСР и раскрыть роль взаимодействия ганглионарного и эффекторного уровней в формировании ВСР. В этой связи цель настоящей работы – исследовать роль ганглионарного и эффекторного уровней вегетативной регуляции функций в формировании волн ВСР с применением однократного и комбинированного введения блокаторов N- и М-холинорецепторов, β-адренорецепторов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования выполнены на 70 половозрелых крысах-самцах 4–5-месячного возраста из вивария при лаборатории экспериментальной физиологии Астраханского государственного университета. До и в период эксперимента животные содержались в контролируемых условиях окружающей среды (температура воздуха 24–26°С, относительная влажность 35–40%, освещение в помещениях – искусственное, с фиксированным режимом 12 ч день и 12 ч ночь), в пластиковых клетках с мелкой древесной стружкой на стандартном рационе – комбикорм гранулированный полнорационный для лабораторных животных (экструдированный) ПК-120 ГОСТ 50258-92 производства ООО “Лабораторкорм”. Животные потребляли корм и воду ad libitum.
Все эксперименты выполнялись в соответствии с Национальным стандартом РФ ГОСТ Р-53434-2009 “Принципы надлежащей лабораторной практики”, Приказом Минздрава РФ от 01.04.2016 г. № 199н “Об утверждении правил надлежащей лабораторной практики” и Европейской конвенции Directive 2010/63/EU of 22 September 2010. Эксперименты проведены в осенне-зимний период.
ЭКГ регистрировали у бодрствующих нефиксированных крыс на аппаратно-программном комплексе “Варикард” (Рамена, Россия) с частотой дискретизации сигнала 1200 Гц. Отведение ЭКГ осуществляли с помощью миниатюрных электродов-зажимов при местном обезболивании лидокаином, как описано ранее [9, 11]. До введения препаратов у всех животных записывали ЭКГ и рассчитывали исходные показатели ВСР в состоянии спокойного бодрствования.
На первом этапе исследований для проведения фармакологических проб экспериментальные животные были разделены на три группы, которым однократно вводили 1) блокатор N-холинорецепторов гексаметоний в дозе, достаточной для блокады передачи сигнала в вегетативных узлах (7 мг / кг, Sigma, n = 12), [9, 15, 16]; 2) неселективный блокатор М-холинорецепторов атропин (1 мг/кг, ГНЦЛС, Украина, n = 12) [6, 10, 12]; 3) неселективный блокатор β-адренорецепторов анаприлин (2 мг/кг, ИФА, Россия, n = 12) [6, 8, 12, 14]. Контролем служили животные (n = 16), получавшие однократную инъекцию физиологического раствора (0.1 мл/100 г).
На втором этапе исследований использовали комбинированные пробы, когда динамику показателей ВСР у животных экспериментальных групп (по 6 особей) анализировали при последовательном введении: 1) гексаметония (7 мг/кг) и М-холиноблокатора атропина (1 мг/кг) [2], 2) гексаметония (7 мг/кг) и β-адреноблокатора анаприлина (2 мг/кг). Для выявления особенностей эффектов атропина и анаприлина на фоне блокады вегетативных ганглиев контрольные животные (6 особей) также получали гексаметоний (7 мг/кг), а затем – инъекцию физиологического раствора (0.1 мл/100 г). Временной интервал между инъекциями гексаметония и блокатора М-холинорецепторов (или β-адренорецепторов) составлял 10–15 мин. Все препараты вводили внутрибрюшинно.
Регистрацию ЭКГ и анализ ВСР выполняли в течение первых 5–10 мин после введения препаратов, когда, согласно [20], развиваются их периферические эффекты.
Измерение R–R-интервалов и обработку данных осуществляли в компьютерной программе ИСКИМ6 (Рамена, Россия). Для анализа из каждой записи брали непрерывные и стационарные ряды из 350 R–R-интервалов. Определяли ЧСС (уд./мин), индекс напряжения (отн. ед.) [1, 9, 11] с учетом ширины класса гистограммы 7.8 мс: ИН = (AMo/2 × ΔХ × Mo) × (50/7.8) × 1000. Спектральный анализ ВСР проводили в диапазонах высокой частоты, high frequency – HF(0.9–3.5 Гц), низкой частоты, low frequency – LF (0.32–0.9 Гц), очень низкой частоты, very low frequency – VLF (0.15–0.32 Гц) [9, 11]. Рассчитывали абсолютную (мс2) и относительную (%) мощность волн в каждом диапазоне, индекс централизации (IC) (отн. ед.) [1]: IC = (LF + VLF)/HF.
Результаты исследования обработаны статистически в программе Statisticа 10.0 с использованием возможностей описательной статистики, параметрического критерия Стьюдента и непараметрического критерия Манна–Уитни. Из описательной статистики приведены средние значения и их ошибки (M ± m). Достоверность изменений показателей ВСР в результате экспериментальных воздействий по сравнению с исходным состоянием оценивали по критерию U Манна–Уитни. Достоверность различий между контрольной и экспериментальными группами определяли по критерию t Стьюдента. Различия между средними считали достоверными при р < 0.05. Выявленные различия подтверждены результатами дисперсионного анализа (ANOVA, Statisticа 10.0). При представлении результатов в графическом виде учтены стандартные отклонения средних и квартили.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В исходном состоянии у самцов крыс ЧСС колебалась в пределах 300–360 уд./мин, ИН – 12–30 отн. ед., мощность волн спектра ВСР соответствовала ранее опубликованным данным (5–20 мс2) [9, 11]. У большинства крыс HF-волны составляли 30–50%, а волны LF и VLF в совокупности 50–70% от общей мощности спектра, поэтому индекс централизации был выше 1 отн. ед. (табл. 1).
Таблица 1.
Изменения параметров ВСР крыс после однократного введения блокаторов N-холинорецепторов, М-холинорецепторов и β-адренорецепторов, M ± m Table 1. Changes of Heart Rate Variability Parameters of Rats After a Single Injection of N- and М-Acetylcholine Receptor и β-Adrenergic Receptors Blockers, M ± m
| Показатели Parameters |
Группы Groups |
Исходное
состояние The initial state |
После введения препарата After the introduction of drug |
|---|---|---|---|
| ЧСС, уд./мин Heart rate frequency, beats/min |
Контроль Control (n = 16) |
321.1 ± 6.7 | 310.6 ± 5.9 |
| Гексаметоний Hexametonium (n = 12) |
309.2 ± 6.4 | 346.9 ± 9.7**, ## | |
| Атропин Atropine (n = 12) |
330.1 ± 10.7 | 426.8 ± 16.4***, ### | |
| Анаприлин Anapriline (n = 12) |
337.3 ± 14.8 | 264.8 ± 11.0**, ### | |
| Индекс напряжения,
отн.ед. Stress Index, rel. units |
Контроль Control (n = 16) |
29.1 ± 2.9 | 29.0 ± 4.9 |
| Гексаметоний Hexametonium (n = 12) |
26.9 ± 4.1 | 76.8 ± 11.2***, ### | |
| Атропин Atropine (n = 12) |
23.1 ± 3.8 | 256.5 ± 41.9***, ### | |
| Анаприлин Anapriline (n = 12) |
22.6 ± 3.7 | 39.0 ± 6.4* | |
| HF-волны, мс2 HF-waves, ms2 |
Контроль Control (n = 16) |
6.5 ± 0.9 | 8.4 ± 1.3 |
| Гексаметоний Hexametonium (n = 12) |
7.6 ± 2.7 | 4.7 ± 1.9 | |
| Атропин Atropine (n = 12) |
8.5 ± 1.9 | 0.5 ± 0.1***, ### | |
| Анаприлин Anapriline (n = 12) |
6.8 ± 1.1 | 5.1 ± 1.9* | |
| LF-волны, мс2 LF-waves, ms 2 |
Контроль Control (n = 16) |
3.8 ± 0.7 | 4.3 ± 0.9 |
| Гексаметоний Hexametonium (n = 12) |
2.4 ± 0.4 | 0.8 ± 0.3**, ## | |
| Атропин Atropine (n = 12) |
7.3 ± 1.2 | 0.1 ± 0.03***, ## | |
| Анаприлин Anapriline (n = 12) |
7.4 ± 1.1 | 4.3 ± 1.1* | |
| VLF- волны, мс2 VLF-waves, ms2 |
Контроль Control (n = 16) |
4.4 ± 0.9 | 4.8 ± 1.2 |
| Гексаметоний Hexametonium (n = 12) |
4.2 ± 0.7 | 0.7 ± 0.1***, ## | |
| Атропин Atropine (n = 12) |
6.8 ± 1.4 | 0.2 ± 0.1***, ### | |
| Анаприлин Anapriline (n = 12) |
8.3 ± 1.3 | 2.4 ± 0.9*** | |
| %HF | Контроль Control (n = 16) |
48.0 ± 4.4 | 54.1 ± 3.3 |
| Гексаметоний Hexametonium (n = 12) |
48.3 ± 5.9 | 66.9 ± 4.2*, # | |
| Атропин Atropine (n = 12) |
38.1 ± 5.7 | 65.2 ± 4.2**, # | |
| Анаприлин Anapriline (n = 12) |
32.1 ± 3.9 | 44.2 ± 4.9 | |
| %LF | Контроль Control (n = 16) |
24.4 ± 2.7 | 21.5 ± 1.7 |
| Гексаметоний Hexametonium (n = 12) |
18.6 ± 2.2 | 14.8 ± 1.7# | |
| Атропин Atropine (n = 12) |
33.9 ± 5.4 | 14.4 ± 1.2***, ## | |
| Анаприлин Anapriline (n = 12) |
31.9 ± 2.1 | 36.5 ± 3.7### | |
| %VLF | Контроль Control (n = 16) |
27.7 ± 3.4 | 25.2 ± 3.0 |
| Гексаметоний Hexametonium (n = 12) |
33.3 ± 4.4 | 18.3 ± 3.8* | |
| Атропин Atropine (n = 12) |
34.2 ± 5.9 | 20.4 ± 3.9 | |
| Анаприлин Anapriline (n = 12) |
36.1 ± 3.1 | 19.1 ± 2.8*** | |
| Индекс централизации,
отн. ед. Centralization Index, rel. units |
Контроль Control (n = 16) |
1.4 ± 0.2 | 1.0 ± 0.1 |
| Гексаметоний Hexametonium (n = 12) |
1.4 ± 0.3 | 0.6 ± 0.1* | |
| Атропин Atropine (n = 12) |
2.5 ± 0.6 | 0.6 ± 0.1** | |
| Анаприлин Anapriline (n = 12) |
2.7 ± 0.5 | 2.0 ± 0.7 |
Примечание. Достоверность различий по сравнению с исходным состоянием в каждой группе рассчитана по U-критерию Манна–Уитни: * (p < 0.05), **(p < 0.01), ***(p < 0.001); достоверность различий по сравнению с контрольной группой рассчитана по t-критерию Стьюдента: #( p < 0.05), ## (p < 0.01), ### (p < 0.001). Достоверность влияния гексаметония, атропина, анаприлина на ВСР подтверждена дисперсионным анализом (ANOVA, Statistica.10). The significant differences in comparison with an initial condition in each group were calculated by Mann–Whitney U-test: *(p < 0.05), **(p < 0.01), ***(p < 0.001); the significant differences in comparison with an control group were calculated by Student’s t test: #(p < 0.05), ##(p < 0.01), ###(p < 0.001). Reliability of influence of Hexametonium, Atropine, Anapriline on HRV were confirmed by analysis of variance (ANOVA, Statistica.10).
После однократного введения гексаметония в течение 10 мин ЧСС повысилась на 12% (p < 0.01). Одновременно индекс напряжения увеличился почти в 2.8 раза (p < 0.001) и стал значительно выше, чем у контрольных животных (p < 0.001) (табл. 1). Быстрое нарастание напряженности ритма сердца у крыс определялось весьма значительным ослаблением LF- и VLF-волн (на 66%, p < 0.01 и 83%, p < 0.001 соответственно), а также некоторым снижением мощности HF-волн (на 38%). В результате изменилось соотношение спектральных компонент: доля VLF сократилась до 15% (p < 0.05), а доля HF выросла до 67% (p < 0.05). Индекс централизации снизился на 57% (p < 0.05), что обычно расценивается как признак ослабления централизации управления ритмом сердца [1]. То есть, блокада вегетативных узлов вызвала падение мощности волн низкочастотной части спектра, особенно VLF, а также, хотя и в меньшей мере, отразилась на мощности волн HF-диапазона (дыхательных волнах), что в совокупности обусловило значительный рост напряженности ритма сердца. Приведенные данные вполне согласуются с ранее опубликованными [9], и дают основание говорить, что сигналы, поступающие к сердцу через вегетативные узлы, влияют на формирование преимущественно LF-и VLF-колебаний длительности кардиоинтервалов.
После введения атропина в течение первых 2–3 мин ЧСС у животных выросла почти на треть от исходной (p < 0.001) и превысила в покое 400 уд./мин, индекс напряжения увеличился в 11 раз (p < 0.001) (табл. 1). Кардиоинтервалограмма практически выровнялась, поскольку вариабельность кардиоинтервалов снизилась во всех спектральных диапазонах: LF – на 98% (p < 0.001), VLF – на 97% (p < 0.001), HF – на 96.5% (р < 0.001). Мощности всех волн на фоне атропина не превышали 0.1–0.5 мс2, причем наименьшие величины регистрировались в низкочастотной области спектра, несколько большей была мощность HF-волн (табл. 1). Соответственно в структуре спектра ВСР доля HF-волн достигла 65% (p < 0.05) от суммарной мощности, вклад медленных волн сократился до 14–20%, индекс централизации стал ниже исходного на 76% (p < 0.01). То есть, эффекты атропина сходны по характеру изменений ВСР с эффектами гексаметония, но выражены значительно сильнее, распространяются на весь спектральный диапазон, включая не только HF, но LF и VLF-волны.
Введение блокатора β-адренорецепторов анаприлина в течение 5–7 мин привело, как и ожидалось, к урежению ЧСС (на 21.5%, p < 0.01) (табл. 1). Вариабельность кардиоинтервалов изменилась в сторону снижения, ослабление мощности HF- и LF-волн произошло на 37–38% (p < 0.05), в VLF-диапазоне мощность колебаний снизилась более резко (на 68%, p < 0.001). В связи с этим доля VLF-волн в спектре сократилась до 20% (p < 0.001), а вклад HF-волн несколько увеличился. Снижение индекса централизации после введения анаприлина было статистически незначимыми. Очевидно, в сравнении с блокаторами N- и М-холинорецепторов, блокатор β-адренорецепторов вызвал наименее выраженные изменения ВСР. Несмотря на урежение ЧСС, мощность волн спектра ВСР при введении анаприлина также снизилась, особенно в VLF-диапазоне.
Таким образом, при разнонаправленном воздействии на ЧСС блокаторы N- и М-холинорецепторов и блокатор β-адренорецепторов вызвали снижение вариабельности кардиоинтервалов, особенно сильно в низкочастотных диапазонах (VLF, LF). HF-волны при блокаде вегетативных узлов и β-адренорецепторов снизилась в меньшей степени – всего на 30–40%, и только при блокаде М-холинорецепторов – на 96%. По выраженности эффектов в отношении мощности волн ВСР блокаторы можно расположить в порядке: атропин $ \gg $ гексаметоний > анаприлин. Обнаруженные изменения свидетельствуют, что регуляторные влияния через М-холинорецепторы, β-адренорецепторы и вегетативные узлы в той или иной мере вовлечены в формирование волн всех частотных диапазонов спектра ВСР.
На втором этапе работы анализировалась динамика параметров ВСР при последовательном введении гексаметония и блокаторов М-холинорецепторов, β-адренорецепторов (рис. 1, 2). Как и в первой серии, введение гексаметония привело к росту ЧСС на 7–16% (p < 0.01) и ИН в 2–3.5 раза (p < 0.01). При этом мощность волн спектра снизилась в диапазоне VLF – на 82–88% и LF – на 53–83% (p < 0.05 – p < 0.01), в меньшей мере в диапазоне HF – на 50–60% от исходной. В результате у всех животных на фоне гексаметония доля HF в спектре выросла до 65–70%, а вклад LF и VLF сократился до 12–16% и 14–20% соответственно. Индекс централизации стал ниже 1 отн. ед. (р < 0.1 – р < 0.05) из-за особенно сильного снижения мощности низкочастотных волн.
Рис. 1.
Динамика ЧСС, индекса напряжения и индекса централизации при последовательном введении гексаметония и блокаторов М-холинорецепторов (атропина), β-адренорецепторов (анаприлина). Из программы Statistica 10.0. На графиках в каждой группе первая точка – исходное состояние (n = 6), вторая точка – после введения гексаметония (n = 6), третья точка – после введения атропина (анаприлина) в эксперименте или физиологического раствора в контроле (n = 6). Достоверность различий по сравнению с исходным состоянием в каждой группе рассчитана по U-критерию Манна–Уитни: * (p < 0.05), ** (p < 0.01), *** (p < 0.001); достоверность различий по сравнению с состоянием после введения гексаметония в каждой группе рассчитана по U-критерию Манна–Уитни: + (p < 0.05), ++ (p < 0.01), +++ (p < 0.001); достоверность различий по сравнению с контрольной группой рассчитана по t-критерию Стьюдента: #(p < 0.05), ## (p < 0.01), ### (p < 0.001). Достоверность влияния гексаметония, атропина, анаприлина на ВСР подтверждена дисперсионным анализом (ANOVA, Statistica.10). Fig. 1. Dynamics of heart rate frequency (HRF), stress index and centralization index with the sequential administration of hexamethonium and blockers of M-cholinergic receptors (atropine), β-adrenergic receptors (anapriline). From the program Statistica 10.0. On the graphs in each group, the first point is the initial state (n = 6), the second point after the introduction of hexamethonium (n = 6), the third point after the introduction of atropine (anapriline) in the experiment or physiological saline in the control (n = 6). The significant differences compared with the initial state in each group was calculated using the Mann–Whitney U-test: * (p < 0.05), ** (p < 0.01), *** (p < 0.001); the significant differences compared with the state after the introduction of hexamethonium in each group was calculated according to the Mann–Whitney U-test: + (p < 0.05), ++ (p < 0.01), +++ (p < 0.001); the significant differences compared with the control group was calculated using the Student t-test: # (p < 0.05), ## (p < 0.01), ### (p < 0.001). The significant effects of hexamethonium, atropine, anapriline on HRV was confirmed by analysis of variance (ANOVA, Statistica.10).
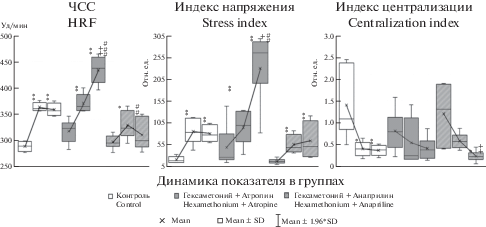
Рис. 2.
Динамика мощности волн HF, LF и VLF при последовательном введении гексаметония и блокаторов М-холинорецепторов (атропина), β-адренорецепторов (анаприлина). Из программы Statistica 10.0. На графиках в каждой группе первая точка – исходное состояние (n = 6), вторая точка – после введения гексаметония (n = 6), третья точка – после введения атропина (анаприлина) в эксперименте или физиологического раствора в контроле (n = 6). Достоверность различий по сравнению с исходным состоянием в каждой группе рассчитана по U-критерию Манна–Уитни: * (p < 0.05), ** (p < 0.01), *** (p < 0.001); достоверность различий по сравнению с состоянием после введения гексаметония в каждой группе рассчитана по U-критерию Манна–Уитни: + (p < 0.05), ++ (p < 0.01), +++ (p < 0.001); достоверность различий по сравнению с контрольной группой рассчитана по t-критерию Стьюдента: # (p < 0.05), ## (p < 0.01), ### (p < 0.001). Достоверность влияния гексаметония, атропина, анаприлина на ВСР подтверждена дисперсионным анализом (ANOVA, Statistica 10). Fig. 2. Dynamics the power of the HF, LF и VLF-waves with the sequential administration of hexamethonium and blockers of M-cholinergic receptors (atropine), β-adrenergic receptors (anapriline). From the program Statistica 10.0. On the graphs in each group, the first point is the initial state (n = 6), the second point after the introduction of hexamethonium (n = 6), the third point after the introduction of atropine (anapriline) in the experiment or physiological saline in the control (n = 6). The significant differences compared with the initial state in each group was calculated using the Mann–Whitney U-test: * (p < 0.05), ** (p < 0.01), *** (p < 0.001); the significant differences compared with the state after the introduction of hexamethonium in each group was calculated according to the Mann–Whitney U-test: + (p < 0.05), ++ (p < 0.01), +++ (p < 0.001); the significant differences compared with the control group was calculated using the Student t-test: # (p < 0,05), ## (p < 0,01), ### (p < 0.001). The significant effects of hexamethonium, atropine, anapriline on HRV was confirmed by analysis of variance (ANOVA, Statistica10).
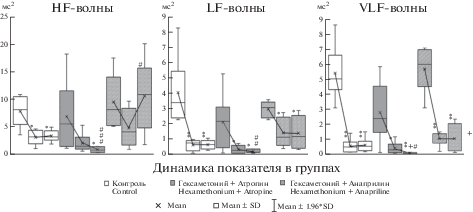
На фоне блокады вегетативных узлов введение атропина привело в течение первых 2–5 мин к дальнейшему росту ЧСС (еще на 16.8%, р < 0.01), в результате она достигла 420–450 уд./мин, то есть суммарный прирост ЧСС составил 36% от исходной (p < 0.01). Индекс напряжения после введения атропина увеличился еще в 2.3 раза (p < 0.05) и превысил 200 отн.ед. в покое. Мощность волн ВСР продолжила снижение, хотя на фоне блокады вегетативных узлов в LF и VLF-диапазонах она уже составляла не более 0.5 мс2. Введение атропина ослабило мощность HF-и LF- волн еще на 50% (р < 0.01), VLF – на 75% (р < 0.05) от тех величин, которые были зарегистрированы на фоне гексаметония (рис. 1, 2). В итоге последовательной блокады N- и М-холинорецепторов мощность HF-волн снизилась на 86% (p < 0.05) и находилась в пределах 1 мс2, мощности LF- и VLF-волн сократились на 90% (p < 0.05) и 96% (p < 0.01) соответственно, а их абсолютные величины составили всего 0.1–0.2 мс2. В этой связи доминирование HF-волн в спектре сохранилось и даже усилилось, а индекс централизации стал еще ниже (на 50%). Приведенные данные вполне согласуются с ранее полученными [9], что подтверждает характер эффектов, оказываемых блокаторами N- и М-холинорецепторов на ЧСС и мощность HF-, а также LF- и VLF-волн. Вместе с тем нужно отметить, что изменения ВСР после введения атропина на фоне блокады вегетативных узлов проявились не столь резко, остаточная мощность волн спектра ВСР была несколько выше, чем после введения только атропина.
Введение анаприлина на фоне блокады вегетативных узлов, вопреки ожиданиям, не привело к существенному урежению ЧСС, хотя по сравнению с контрольной серией ЧСС была ниже (p < 0.01) (рис. 1, 2). Кроме того, ни в одном из диапазонов спектра ВСР дальнейшего снижения мощности колебаний не произошло, но в диапазоне HF наблюдалось усиление вариабельности (почти на 120%), поэтому мощность HF-волн оказалась выше, чем в контрольной серии, почти втрое (p < 0.05) (рис. 1, 2). По причине некоторого усиления HF-волн их доминирование в спектре ВСР стало еще значительнее (более 75%, p < 0.05), а величины индекса централизации – ниже. Эти результаты свидетельствуют об изменении эффектов анаприлина на фоне блокады N-холинергической передачи в вегетативных ганглиях не только в отношении мощности волн ВСР, но даже ЧСС.
Таким образом, предварительная блокада вегетативных узлов гексаметонием несколько модифицировала эффекты блокады М-холинорецепторов и, довольно существенно, эффекты блокады β-адренорецепторов в отношении ЧСС и мощности волн ВСР. Полученные данные позволяют говорить, что функциональная активность вегетативных узлов модулирует реализацию регуляторных влияний через периферические М-холино- и, особенно β-адренорецепторы, то есть имеет место взаимодействие ганглионарного и эффекторного уровней вегетативных нервных влияний при формировании длительности кардиоинтервалов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выполненное исследование подтвердило, что введение гексаметония в дозе, достаточной для блокады N-холинорецепторов вегетативных узлов [9, 16, 20], потенцирует рост ЧСС и существенное ослабление вариабельности R–R-интервалов во всех диапазонах спектра ВСР, особенно VLF и LF (на 83 и 67% соответственно). Эффекты гексаметония выявляются достаточно стабильно, согласуются с результатами предыдущей работы [9]. Известно, что блокада N-холинергической передачи ограничивает передачу сигналов и в симпатических, и в парасимпатических вегетативных узлах, которые являются периферическими нервными центрами, интегрирующими сигналы от рецепторов внутренних органов, других рецептивных полей, а также от гемодинамического и других центров и отделов мозга [17–19]. Поэтому снижение мощности волн ВСР можно рассматривать как проявление общего ослабления регуляторных влияний, которые обычно поступают к сердцу и другим органам через вегетативные ганглии.
Особо следует отметить, что сигналы, поступающие к сердцу через вегетативные узлы, в наибольшей мере влияют на формирование VLF- и LF-колебаний спектра ВСР. Это в целом согласуется с представлениями Р.М. Баевского и соавт. о природе ВСР [1], с фактами о роли симпатического механизма в образовании низкочастотных и очень низкочастотных волн ВСР, приведенными в статье Ю.Р. Шейх-Заде и соавт. [21] и представлениями об особенностях симпатических регуляторных влияний, поскольку, значительная часть вегетативных узлов являются симпатическими [17–19]. Вместе с тем, ослабление HF-волн почти на 40% позволяет говорить, что N-холинергическая передача также участвует в формировании дыхательных колебаний R–R-интервалов. Учитывая предыдущие исследований [9], полагаем, что в норме примерно половина мощности дыхательных волн ВСР определяется сигналами, поступающими через вегетативные узлы, также существенный вклад вносят внутрисердечные нервные и миогенные механизмы. Подтверждением этому является стойкая умеренная тахикардия, возникающая после введения гексаметония. Учитывая результаты предыдущих работ [17, 19, 21], она, по-видимому, является реакцией на снижение артериального давления и поддерживается за счет функционирования внутрисердечных рефлекторных дуг и миогенных механизмов в условиях блокады потока сигналов с пре- на постганглионарные нейроны, с учетом [17, 19, 21].
Изменения сердечного ритма после введения М-холиноблокатора оказались весьма резкими и более значительными, чем после N-холиноблокатора. Прирост ЧСС составил почти треть от исходной, мощность волн HF снизилась на 96%, LF и VLF – на 98–97%. Сходные данные по изменению мощности волн спектра ВСР после введения атропина приводятся и в других работах [4, 6, 8, 10–12, 15]. Преобладание эффектов атропина над эффектами гексаметония, имеет ряд причин: 1) М-холинорецепторы передают на клетки миокарда потоки сигналов, идущие не только со стороны ЦНС и рефлексогенных зон через вегетативные ганглии, но и от элементов внутрисердечной нервной системы; 2) атропин блокирует все подтипы миокардиальных М-холинорецепторов, посредством которых холинергические механизмы оказывают ионо- и метаботропные эффекты и влияют на длительность каждого кардиоинтервала [17, 19], модулируя миогенный механизм ВСР [21]. Полагаем, что этот фактор является определяющим в резком падении мощности всех волн спектра ВСР при атропиновой пробе; 3) блокада М-холинорецепторов нарушает взаимодействия на уровне норадренергических и холинергических терминалей путем ослабления холинергического контроля за выделением норадреналина [17, 19, 22]. В результате усиления норадренергических влияний тормозится миогенный и холинергический механизмы вариабельности кардиоинтервалов, особенно в диапазонов низких и очень низких частот спектра ВСР, учитывая данные, приведенные в работе [21]. Кроме того, в одной из недавних работ [11] нами показано, что атропин уменьшает связывание адреналина эритроцитами крови, в свою очередь это способно привести к росту концентрации свободных катехоламинов в крови и усилению адренергических влияний на сердце через гуморальный канал регуляции. Этот фактор, с учетом теории Р.М. Баевского [1], может быть определяющим в развитии сильной тахикардии.
На фоне блокады вегетативных узлов изменения ВСР после введения атропина в значительной мере были сходны с таковыми при его самостоятельном введении. В качестве особенностей можно отметить, что мощности волн HF и LF снизились в меньшей мере. Абсолютная мощность HF-волн в этой серии оказалась почти вдвое выше, чем в серии с введением только атропина. Вероятно, при блокаде N-холинергической передачи снижается выделение норадреналина из окончаний симпатических нервов, поэтому преобладание симпатических влияний над холинергическими после введения атропина выражено слабее. Следовательно, результаты опытов, по-видимому, показывают вклад норадренергических влияний в изменение мощности волн ВСР после введения атропина, и свидетельствуют об определяющей роли именно блокады М-холинорецепторов в этих сдвигах.
Введение блокатора β-адренорецепторов на фоне естественного функционирования вегетативных узлов вызвало урежение ЧСС на четверть от исходной, некоторое ослабление колебаний в HF- и LF-диапазонах и существенное снижение VLF-волн. Такое снижение вариабельности кардиоинтервалов не совпадает с представлениями о четком антагонизме холинергических и адренергических влияний на ритм сердца, при котором блокада β-адренорецепторов должна приводить к повышению мощности волн из-за сдвига вегетативного баланса к преобладанию парасимпатических влияний, согласно данным, приведенным в работах [4, 8, 15, 17]. Однако другие авторы [6, 12–14] также отмечали, что медленные волны изменяются весьма нестабильно при блокаде β-адренорецепторов, возможен и рост, и снижение их мощности. Причиной таких неоднозначных результатов являются, по-видимому, характерные черты организации адренергических влияний на миокард. Прежде всего, это касается адренорецепторного аппарата кардиомиоцитов. В миокарде присутствуют не только β1-, но и α1-, β2-адренорецепторы, рецепторы серотонина, дофамина [19, 20, 22]. Поэтому блокада β-адренорецепторов с помощью анаприлина не устраняет эффектов стимуляции других адренорецепторов и рецепторов моноаминов. Кроме того, влияния на сердце со стороны вегетативных узлов при блокаде периферических адренорецепторов могут усиливаться благодаря наличию обратных связей [18] с участием не только норадренергических, но и серотонинергических нейронов [22]. Тем не менее, факт снижения вариабельности кардиоинтервалов преимущественно в диапазоне VLF при блокаде β-адренорецепторов свидетельствует, что взаимодействие холинергических и адренергических механизмов в регуляции ритма сердца наиболее активно происходит в диапазоне низких частот ВСР.
Подтверждением значимости функционирования вегетативных узлов для проявления эффектов блокады адренорецепторов миокарда стали результаты комбинированной пробы, когда блокатор β-адренорецепторов на фоне гексаметония не вызвал значимого урежения ЧСС и снижения мощности волн, а напротив, потенцировал рост мощности в диапазоне HF. Последнее может рассматриваться как четкое преобладание автономного контура [1], характеризующегося синхронным взаимодействием миогенного и холинергического механизмов регуляции ритма сердца [21]. Сопоставляя результаты двух серий экспериментов с введением анаприлина, можно прийти к заключению, что блокада вегетативных узлов ослабляет регуляторные влияния (адренергические, серотонинергические и др.), которые могут тормозить или компенсировать сдвиг вегетативного баланса в сторону преобладания холинергических влияний, который ожидается при введении блокатора β-адренорецепторов [6, 8, 12, 14]. Поэтому для более детального анализ роли адренергических механизмов в формировании волн ВСР требуются комбинированные пробы и модели, учитывающие разнообразие рецепторного аппарата кардиомиоцитов и состояние вегетативных нервных узлов, среди которых много симпатических.
Обращаясь к индексу напряжения и индексу централизации необходимо отметить, что введение блокаторов N- и М-холинорецепторов и β-адренорецепторов вызвало в той или иной мере повышение индекса напряжения и снижение индекса централизации. Главной причиной роста индекса напряжения стало ослабление мощности волн ВСР. Самый высокий индекс напряжения зафиксирован в сериях с блокадой М-холинорецепторов, наименьший – в серии с введением анаприлина. При анализе результатов проб с атропином и анаприлином мы говорили о возможных механизмах повышения адренергических влияний и их вкладе в снижение мощности волн ВСР в области низких частот, что можно связать с ростом индекса напряжения. Но повышение индекса напряжения при блокаде вегетативных узлов, вероятнее всего, стало следствием общего ослабления регуляторных влияний на ритм сердца. В этой связи важно помнить, что индекс напряжения – это расчетный показатель, он является производным вариабельности кардиоинтервлаов, то есть мощности волн спектра ВСР.
Снижение индекса централизации во всех экспериментальных сериях вполне закономерно, поскольку в наибольшей мере во всех случаях слабела мощность LF и VLF-волн, так как все примененные блокаторы ограничивали потоки информации к водителю ритма сердца со стороны ЦНС и различных рефлексогенных зон. Весьма низкие величины индекса централизации подтверждают высокую значимость экстракардиальных холинергических и адренергических регуляторных влияний и их взаимодействий в формировании вариабельности кардиоинтервалов.
Проведенные исследования показали, что N-холинергическая передача сигналов через вегетативные узлы обеспечивает поддержание в покое оптимальной ЧСС, вносит значительный вклад в формирование мощности VLF- и LF-волн и в меньшей мере влияет на мощность HF-волн спектра ВСР.
Резко выраженные изменения ЧСС и ВСР после введения атропина свидетельствуют о ведущей роли холинергических влияний посредством М-холинорецепторов в поддержании достаточно низкой ЧСС и формировании мощности волн всех частотных диапазонов спектра ВСР.
Существенное урежение ЧСС и снижение мощности волн ВСР, особенно VLF, при введении анаприлина подтверждает роль адренергических влияний через β-адренорецепторы не только в повышении ЧСС, но и в формировании волн низкочастотной области спектра ВСР.
Блокада N-холинергической передачи в вегетативных узлах несколько ослабляет эффекты блокатора М-холинорецепторов, но весьма существенно отражается на эффектах блокатора β-адренорецепторов в отношении волн ВСР и ЧСС. Результаты свидетельствуют, что очень резкое снижение мощности волн ВСР после введения атропина, снижение VLF-волн и других волн после введения анаприлина могут определяться усилением преимущественно адренергических влияний со стороны вегетативных узлов.
Низкие величины индекса централизации во всех экспериментальных сериях подтверждают ведущую роль экстракардиальных холинергических и адренергических регуляторных влияний в формировании вариабельности кардиоинтервалов.
Таким образом, ведущую роль в формировании ВСР во всех основных частотных диапазонах спектра (HF, LF, VLF) играют холинергические регуляторные влияния через М-холинорецепторы кардиомиоцитов. Их взаимодействие с сигналами, поступающими через вегетативные узлы и β-адренорецепторы, наиболее значимо для мощности LF и VLF-волн. Активность вегетативных узлов влияет на выраженность и характер изменений ритма сердца при воздействии на холино- и адренорецепторы миокарда, что свидетельствует о взаимодействии ганглионарного и эффекторного уровней вегетативной регуляции в формировании ЧСС и вариабельности кардиоинтервалов. Полученные данные позволяют более четко понимать природу основных волн вариабельности ритма сердца, связи между вегетативными индексами и мощностью волн и механизмы, приводящие к их изменениям при введении агонистов и антагонистов холино- и адренорецепторов в экспериментальной и клинической практике.
Список литературы
Баевский Р.М., Иванов Г.Г., Чирейкин Л.В. Гаврилушкин А.П., Довгалевский П.Я., Кукушкин Ю.А., Миронова Т.Ф., Прилуцкий Д.А., Семенов А.В., Федоров В.Ф., Флейшман А.Н., Медведев М.М. Анализ вариабельности сердечного ритма при использовании различных электрокардиографических систем (методические рекомендации). Вестник аритмологии. 24: 65–87. 2002. [Baevsky R.M., Ivanov G.G., Chireikin L.V. Gavrilushkin A.P., Dovgalevsky P.Ya., Kukushkin Yu.A., Mironova T.F., Prilutsky D.A., Semenov A.V., Fedorov V.F., Fleishman A.N., Medvedev M.M. Analysis of heart rate variability using different electrocardiographic systems (guidelines). J. Arrhythmol 24: 65–87. 2002. (In Russ.)].
Мамалыга М.Л., Мамалыга Л.М. Динамика суточной вариабельности сердечного ритма и артериального давления при хронической сердечной недостаточности. Рос. физиол. журн. им. И.М. Сеченова. 102(6): 680–687. 2016. [Mamalyga M.L., Mamalyga L.M. Dynamics daily variability of heart rate and blood pressure in chronic heart failure. Russ. J. Physiol. 102(6): 680–687. 2016. (In Russ.)].
Elghozi J.L., Julien C. Sympathetic control of short-term heart rate variability and its pharmacological modulation. Fundam. Clin. Pharmacol. 21(4): 337–347. 2007.
Fontolliet T., Pichot V., Bringard A., Fagoni N. Adami A., Tam E., Furlan R., Barthélémy J.C., Ferretti G. Testing the vagal withdrawal hypothesis during light exercise under autonomic blockade: a heart rate variability study. J. Appl. Physiol. 6: 1804–1811. 2018.
Garabedian C., Champion C., Servan-Schreiber E., Butruille L. E. Aubry, Sharma D., Logier R., Deruelle P., Storme L., Houfflin-Debarge V., De Jonckheere J. A new analysis of heart rate variability in the assessment of fetal parasympathetic activity: An experimental study in a fetal sheep model. PLoS One. 12(7): e0180653. 2017.
Sergeeva O.V., Akimova I.A., Antonov I.S., Luzina L.S., Alipov N.N., Kuznetsova T.E. Effect of adrenoblockers on slow (LF) waves in rabbit heart rate. Bull. Experim. Biol. Med. 157(3): 295–298. 2014.
Taylor J.A., Myers C.W., Halliwill J.R., Seidel H., Eckberg D.L. Sympathetic restraint of respiratory sinus arrhythmia: implications for vagal-cardiac tone assessment in humans. Am. J. Physiol Heart. Circ. Physiol. 280(6): H2804–H2814. 2001.
Henze M., Tiniakov R., Samarel A., Holmes E., Scrogin K. Chronic fluoxetine reduces autonomic control of cardiac rhythms in rats with congestive heart failure. Am. J. Physiol. Heart. Circ. Physiol. 304(3): H444–H454. 2013.
Курьянова Е.В., Жукова Ю.Д., Трясучев А.В., Горст Н.А. Влияние скополамина, галантамина и их сочетаний с гексаметонием и атропином на спектральные характеристики сердечного ритма нелинейных крыс. Сибирск. научн. мед. журн. 26(3): 5–12. 2016. [Kuryanova E.V., Zhukova Yu.D., Tryasuchev A.V., Gorst N.A. The effect of scopolamine, galantamine and their combinations with hexametonium and atropine on the spectral characteristics of the heart rhythm of nonlinear rats. The Siberian Sci. Med. J. 26(3): 5–12. 2016. (In Russ.)].
Kirillina T.N., Usacheva M.A., Belkina L.M. Peculiarities of autonomic regulation assessed by variability of hemodynamic parameters in rats with different stress resistance. Bull. Experim. Biol. Med. 142(4): 398–402. 2006.
Kuryanova E.V., Tryasuchev A.V., Stupin V.O., Teplyi D.L. Effect of atropine on adrenergic responsiveness of erythrocyte and heart rhythm variability in outbred rats with stimulation of the central neurotransmitter systems. Bull. Experim. Biol. Med. 165(5): 597–601. 2018.
Sergeeva O.V., Alipov N.N., Smirnov V.M. Effect of atropine, propranolol, and atenolol on wave structure of heart rate oscillations in rats. Bull. Experim Biol. Med. 145(4): 387–390. 2008.
Goldstein D.S., Bentho O., Park M.Y., Sharabi Y. LF power of heart rate variability is not a measure of cardiac sympathetic tone but may be a measure of modulation of cardiac autonomic outflows by baroreflexes. Exp. Physiol. 96: 1255–1261. 2011.
Rahman F., Pechnik S., Gross D., Sewell L., Goldstein D.S. LF power reflects baroreflex function, not cardiac sympathetic innervation. Clin. Auton. Res. 21: 133–141. 2011.
Mestivier D., Dabiré H., Chau N.P. Effects of autonomic blockers on linear and nonlinear indexes of blood pressure and heart rate in SHR. Am. J. Physiol. Heart Circ. Physiol. 281(3): H1113–H1121. 2001.
Zhang R., Iwasaki K., Zuckerman J.H., Behbehani K. Mechanism of blood pressure and R-R variability: insights from ganglion blockade in humans. J. Physiol. 543(1): 337–348. 2002.
Леви М.Н., Мартин П.Ю. Нейрогуморальная регуляция работы сердца (Физиология и патофизиология сердца). М. Медицина. 1990. [Levi M.N., Martin P.Yu. Nejrogumoralnaya regulyaciya raboty serdca (Fiziologiya i patofiziologiya serdca) [Neurohumoral regulation of the heart (Physiology and pathophysiology of the heart)]. Moscow. Medicine. 1990].
Ноздрачев А.Д., Фатеев М.М. Звездчатый ганглий. Структура и функции. СПб. Наука. 2002. [Nozdrachev A.D., Fateev M.M. Zvezdchatyj ganglij. Struktura i funkzii [The stellate ganglion. Structure and functions]. St.Peterburg. Nauka. 2002].
Gordan R., Gwathmey J.K., Xie L.H. Autonomic and endocrine control of cardiovascular function. World J. Cardiol. 7(4): 204–214. 2015.
Katzung B.G., Masters S.B., Trevor A.J. Basic and Clinical Pharmacology. McGraw-Hill Companies, Inc. 2012.
Шейх-Заде Ю.Р., Мухамбеталиев Г.Х., Чередник И.Л. Резонансная гипотеза происхождения вариабельности сердечного ритма. Рос. физиол. журн. им. И.М. Сеченова. 95(9): 944–954. 2009. [Sheikh-Zade Yu.Rh., Mukhambetaliev G.H., Cherednik I.L. Resonance hypothesis of heart rate variability origin. Russ. J. Physiol. 95(9): 944–954. 2009. (In Russ.)].
Лычкова А.Э. Серотонинергическая регуляция сердечно-сосудистой и бронхолегочной систем. М. РАМН. 2012. [Lychkova A.E. Serotoninergicheskaya regulyaciya serdechno-sosudistoj i bronholegochnoj sistem [Serotonergic regulation of the cardiovascular and bronchopulmonary systems]. Moscow. RAMN. 2012].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


