Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 11, стр. 1436-1450
Иммуногистохимическое исследование иннервации надпочечника крысы
Е. И. Чумасов 1, 2, *, Е. С. Петрова 1, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет ветеринарной медицины
Санкт-Петербург, Россия
* E-mail: iemmorphol@yandex.ru
Поступила в редакцию 13.06.2020
После доработки 10.07.2020
Принята к публикации 26.07.2020
Аннотация
Целью исследования явилось изучение иннервации коркового и мозгового вещества надпочечника крысы с использованием иммуногистохимических методов. С помощью иммуногистохимического выявления белка PGP 9.5, синаптофизина, тирозингидроксилазы, периферина и серотонина получены оригинальные данные о топографических и нейрохимических особенностях иннервации коркового и мозгового вещества надпочечника половозрелых крыс линии Вистар (n = 8). Установлено, что все зоны коры (гломерулярная, пучковая и сетчатая) иннервируются нервными волокнами различной медиаторной природы. В коре наиболее выражена иннервация гломерулярной зоны, где обнаружено густое терминальное сплетение из варикозных аксонов вокруг островков эндокриноцитов, артериол и групп нервных клеток. В мозговом веществе преобладают парасимпатические нервные аппараты: широкопетлистое сплетение из претерминальных нервных волокон и основная узкопетлистая терминальная синаптическая сеть, состоящая из варикозных аксонов, окружающих группы нейроэндокринных клеток и синусоидные капилляры. В мозговом веществе надпочечника обнаружены парасимпатические и симпатические интрамуральные ганглии, а также хромаффинные клетки с иммунореактивностью к различным катехоламинам и серотонину. Выяснена природа нервных волокон, участвующих в иннервации железы. Сделано предположение о разных источниках симпатической иннервации органа: от нейронов truncus sympathicus (симпатического ствола) и от собственных нейронов, локализующихся в мозговом веществе, что имеет важное значение для регуляции местного кровообращения. Полученные результаты дополняют имеющиеся в литературе данные и могут быть применены как в научных исследованиях, так и для диагностики заболеваний надпочечников.
Надпочечник – один из важнейших парных органов эндокринной системы животных и человека, состоящий из двух частей: мозгового и коркового вещества, которые различаются по происхождению, строению и функциям [1–3]. В корковом веществе локализуется так называемая интерреналовая ткань, которая в онтогенезе образуется из мезодермы. Клетки мозгового вещества надпочечника (супрареналовая ткань) происходят из клеток нервного гребня и относятся к симпато-адреналовой системе. Симпато-адреналовая система включает в себя нервное звено, состоящее из структур симпатической нервной системы, и гормональное звено – из клеток мозгового вещества надпочечников и параганглиев, вырабатывающих катехоламины [1, 4–8]. Клетки мозгового вещества входят в состав APUD-системы и обозначаются как нейроэндокринные. В надпочечнике они локализуются в центре органа и образуют неправильной формы тяжи и “глобулы”, располагающиеся вокруг кровеносных сосудов. В цитоплазме этих клеток имеются гранулы, которые при обработке хромовой кислотой или солями хрома окрашиваются в коричневый цвет, в связи с этой особенностью их называют хромаффинными клетками (ХК). В 70-е годы с помощью применения гистохимических методов и электронной микроскопии среди клеток мозгового вещества надпочечника были дифференцированы адреналин- и норадреналин-продуцирующие хромаффинные клетки [1, 6, 9–11].
Иннервация надпочечников изучалась ранее с применением классических нейрогистологических и гистохимических методов исследования, а также электронной микроскопии. Было показано, что мозговое вещество надпочечников и параганглии обильно иннервируются ветвями блуждающего ствола, частично нейронами спинномозговых и чревных ганглиев. На хромаффинных клетках обнаружены различного типа синаптические аппараты, образованные преганглионарными – эфферентными и сенсорными – афферентными парасимпатическими нервными волокнами [6, 12–15]. Имеются данные о том, что помимо функции выработки гормонов клетки мозгового вещества надпочечника обладают также сенсорной функцией [16]. В последние годы наиболее информативными методами для изучения иннервации различных органов и тканей считаются иммуногистохимические методы выявления специфических нейральных белков, нейропептидов, нейротрансмиттеров и медиаторов. Применительно к надпочечникам такие исследования немногочисленны [17–22].
Цель настоящего исследования – используя ряд иммуногистохимических маркеров, изучить иннервацию коркового и мозгового вещества, а также определить биохимическую природу нервных аппаратов надпочечника крысы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на половозрелых крысах линии Вистар массой 200–250 г (n = 8). Животных содержали в стандартных условиях вивария ФГБНУ “ИЭМ” при свободном доступе к корму и воде, соблюдая “Правила проведения работ с использованием экспериментальных животных” (приложение к приказу МЗ СССР № 755 от 12.08.1977г.). Исследование было одобрено ЛЭК ФГБНУ “ИЭМ” (протокол № 3 от 30.11.2017). Фиксацию надпочечников крыс вместе с окружающей их жировой клетчаткой осуществляли в растворе цинк-этанол-формальдегида в течение суток [23]. После обезвоживания в спиртах возрастающей концентрации и ксилоле материал заливали в парафин. Срезы толщиной 5 мкм изготавливали на ротационном микротоме фирмы Pfm Rotary 3003 (PFM, Германия). Часть срезов окрашивали толуидиновым синим по Нисслю и астровым синим по общепринятым методикам. Иммуногистохимическое выявление антигенов осуществляли на парафиновых срезах по протоколам, описанным ранее [23]. В работе применяли следующие первичные антитела: поликлональные кроличьи антитела к ферменту биосинтеза катехоламинов тирозингидроксилазе (TH) (Abcam, Великобритания), поликлональные кроличьи антитела к серотонину (Leica-Novocastra, Великобритания), поликлональные кроличьи антитела к белку PGP 9.5 (Spring Bioscience, США) [24], поликлональные кроличьи антитела к синаптофизину (СФ) (MONOSAN, Нидерланды) [25], кроличьи поликлональные антитела к периферину (Dako, Дания; сейчас Agilent, США). Для выявления альфа-актина использовали моноклональные мышиные антитела (клон 1A4, Dako, Дания; сейчас Agilent, США). Вторичными реагентами служили реактивы из наборов Reveal Polyvalent HRP/DAB Detection System kit (Spring Bioscience, США) и EnVision + System Labbeled Polymer-HRP Anti-Mouse (K4001) (Dako, Дания; сейчас Agilent, США). Для осуществления отрицательного контроля иммуногистохимических реакций на часть срезов вместо раствора первичных антител наносили их разбавитель (Dako, Дания; сейчас Agilent, США). Анализ гистологических препаратов осуществляли с помощью микроскопа Leica DM 750 (Leica, Германия) и цифровой камеры Leica ICC 50 (Leica, Германия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
С помощью применения иммуногистохимических методов в разных отделах надпочечника обнаружены различные нервные аппараты.
Снаружи надпочечник покрыт соединительнотканной оболочкой и жировой клетчаткой. Оболочка органа относительно тонкая, состоит из волнообразно расположенных пучков коллагеновых волокон и редких пучков свободных гладкомышечных клеток, избирательно выявляющихся на альфа-актин (рис.1).
Рис. 1.
Капсула и гломерулярная зона коры надпочечника крысы. CP – капсула, Gl – гломерулярная зона, F – пучковая зона, AT – жировая клетчатка, стрелки – гладкомышечные клетки. Иммуногистохимическая реакция на альфа-актин. Докраска толуидиновым синим. ×400. Масштабный отрезок равен 50 мкм. Fig. 1. Capsule and glomerular zone of the rat adrenal cortex. CP – capsule, Gl – glomerular zone, F – zona fasciculata, AT – adipose tissue, arrows – smooth muscle cells. Immunohistochemical reaction to alpha-actin, toluidine blue counterstaining. ×400. Scale 50 µm.

В области ворот надпочечника обнаружены нервные стволики (диаметром от 30 до 50 мкм) и сопровождающие их магистральные кровеносные сосуды, объединенные в нервно-сосудистый комплекс, имеющий вид тяжа. С помощью применения иммуногистохимических реакций на белок PGP 9.5 и на периферин внутри нервных стволиков и между сопровождающими сосудами обнаруживаются небольшие группы хромаффинных клеток (параганглии) (рис. 2).
Рис. 2.
Вход нервно-сосудистых стволиков в корковое вещество надпочечника. AT – жировая клетчатка, NVT – нервно-сосудистый пучок, C – корковое вещество, M – мозговое вещество надпочечника. Иммуногистохимическая реакции на белок PGP 9.5. × 100. Масштабный отрезок равен 200 мкм. Fig. 2. The entry of neurovascular trunks into the adrenal cortex. AT – adipose tissue, NVT – neurovascular bundle, C – cortical substance, M – adrenal medulla. Immunohistochemical reaction to PGP 9.5. × 100. Scale 200 µm.
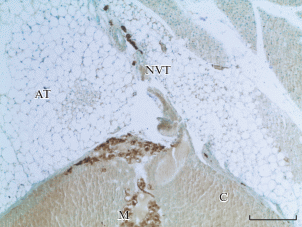
Нервно-сосудистые стволики проходят через жировую клетчатку в корковое вещество, под оболочкой органа делятся и образуют в клубочковой зоне коры густое нервное сплетение. Часть нервных пучков продолжают путь следования через всю кору и вступают в мозговое вещество надпочечника (МВН) (рис. 3).
Рис. 3.
Нервные волокна в коре надпочечника крысы. A, B – общий вид; C – два ТН-иммунонегативных (парасимпатических) нервных стволика, внутри которых видны единичные тонкие пучки симпатических ТН+ аксонов (стрелки) и группы хромаффинных клеток на границе с мозговым веществом. CP – капсула, C – корковое вещество, МВН – мозговое вещество надпочечника, NF – пучки нервных волокон, zR– сетчатая зона, CC – хромаффинные клетки, SC – синусоидные капилляры. Иммуногистохимическая реакция на белок PGP 9.5 (A); CФ (B); ТН (C). Докраска толуидиновым синим (B) и астровым синим (C). Масштабный отрезок равен 200 (A, B) и 50 мкм (C). Fig. 3. Nerve fibers in the rat adrenal cortex. A, B – general view; C – two TH-immunonegative (parasympathetic) nerve trunks, inside of which single thin bundles of sympathetic TH+ axons (arrows) and a group of chromaffin cells at the border with the brain substance are visible. CP – capsule, C – cortical substance, M – adrenal medulla, NF – bundles of nerve fibers, zR – zona reticularis, CC – chromaffin cells, SC – sinusoidal capillaries. Immunohistochemical reaction to PGP 9.5 (A); synaptophysin (B); tyrosine hydroxylase (C). Toluidine blue counterstaining (B) and astra blue counterstaining (C). Scale 200 (A, B) and 50 µm (C).

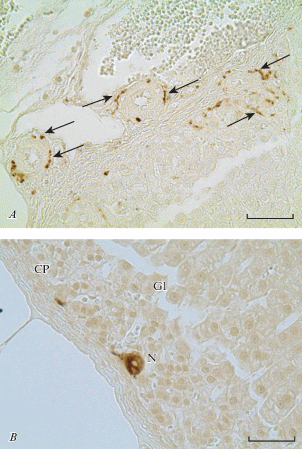
Гломерулярная зона представлена округлыми эпителиальными клетками, располагающимися в виде арок, петель или клубочков, и составляет около 10-15% объема коркового вещества. В ней присутствуют мелкие артериальные и венозные сосуды, артериолы, венулы и капилляры. Как показали иммуногистохимические методы, клубочковая (гломерулярная) зона хорошо иннервирована. В ней выявляется узкопетлистая PGP 9.5+ сеть терминальных варикозных аксонов, которые образуют вокруг арок кортикоцитов, артериальных и венозных сосудов густое терминальное нервное сплетение (рис. 4A). В сплетении иногда выявляются диффузно расположенные мелкие (от 2–4) группы нервных клеток (рис. 4B).
Рис. 4.
Нервные аппараты в гломерулярном слое коры надпочечника крысы. A – иннервация сосудов гломерулярного слоя коры; B – нервные клетки в поверхностной области гломерулярной зоны коры вблизи капсулы. N – нервные клетки, Gl – гломерулярная зона, CP – капсула, стрелки – нервные терминали. Иммуногистохимическая реакция на СФ (A) и белок PGP 9.5 (B). Масштабный отрезок равен 50 мкм. Fig. 4. Nerve apparatus in the glomerular layer of the rat adrenal cortex. A – innervation of the vessels of the cortex glomerular layer; B – neurons in the glomerular zone surface area of the adrenal cortex near the capsule. N – neurons, Gl – glomerular zone, CP – capsule, arrows – nerve terminals. Immunohistochemical reaction to synaptophysin (A), to protein PGP 9.5 (B). Scale 50 µm.
Пучковая зона занимает 75% объема всей коры и состоит из эндокриноцитов кубической формы, располагающихся радиальными колонками, разделенными синусоидными капиллярами. Особенности иннервации этой зоны связаны со спецификой ее структурной организации. Между длинными балками кортикоцитов и параллельно идущими синусоидными капиллярами располагаются тонкие безмиелиновые нервные волокна. Их варикозные аксоны, начинающиеся от поверхностного клубочкового сплетения, следуют в радиальном направлении к МВН. Они не формируют классического сплетения и располагаются в виде перевернутого веера, лучи которого достаточно разреженно располагаются друг от друга.
На некоторых срезах с помощью иммуногистохимических реакций к белку PGP 9.5 (рис. 3A) и СФ (3B) можно видеть, как радиальные варикозные аксоны на значительном протяжении следуют вдоль сопровождающих синусоидных капилляров пучковой зоны и затем переходят в нервно-сосудистое сплетение сетчатой зоны на границе с МВН.
Сетчатая зона значительно тоньше пучковой (рис. 3) и состоит из многочисленных групп мелких кортикоцитов, прилежащих к синусоидным капиллярам. В этой переходной зоне наблюдается объединение клеточных, сосудистых и нервных элементов кортикальной ткани с клетками, сосудами и нервными сплетениями МВН, резкое повышение плотности клеточных и нервно-волокнистых структур по сравнению с другими зонами кортекса. Благодаря гистологической окраске и избирательности иммунных реакций на белок PGP 9.5 и СФ, в этой зоне выявляются особенно тесные нервно-тканевые взаимоотношения между клетками коры и хромаффинными клетками. Здесь обращает на себя внимание также общность кровообращения: видно, что синусоидные капилляры из коркого вещества переходят, не прерываясь, в густую сеть синусоидов МВН.
Наряду с морфологическимим данными, с помощью методов иммуногистохимии удалось установить также биохимическую принадлежность нервных аппаратов коры надпочечника крысы. Нервные стволики, пучки нервных волокнон, составляющие сплетения клубочковой, пучковой и сетчатой зон, а также стенок артериальных и венозных сосудов, как оказалось, состоят из смешанных парасимпатических и симпатических нервных волокон. Сравнительный морфологический анализ, проведенный с помощью методов выявления PGP 9.5 и TH позволил нам дифференцировать среди нервных волокон холинергические и катехоламинергические аксоны и однозначно высказать мнение о преобладании во всех зонах коры надпочечника крысы парасимпатических нервных аппаратов над симпатическими (рис. 3C). Последние выявляются, главным образом, вокруг артериальных и венозных сосудов клубочковой зоны, единичные радиальные аксоны встречаются в нервных тяжах пучковой зоны. Немногочисленные нервные клетки микроганглиев, обнаруженные в клубочковой зоне, являются PGP 9.5+ и имеют парасимпатическую природу.
Мозговое вещество или медулла, как отмечалось ранее, занимает в надпочечнике центральное положение. На светооптических препаратах, окрашенных толуидиновым синим, хорошо различима характерная цитоархитектоника МВН. Паренхима мозгового вещества состоит из относительно крупных эндокриноцитов или хромаффинных клеток овальной, призматической, полигональной или неправильной формы размерами от 9 до 20 мкм. Клетки плотно прилежат друг к другу и образуют различных размеров глобулы, островки и сети из трабекул, окруженных сильно уплощенными клетками – сателлитами. Они находятся в тесных взаимоотношениях с синусоидными капиллярами, которые формируют сеть, связанную с центральной веной. Этот основной кровеносный сосуд МВН имеет довольно широкий просвет (от 100 до 350 мкм), выстлан одним тонким слоем эндотелиоцитов и в него, как известно, по системе синусоидных капилляров собирается обогащенная нейрогормонами венозная кровь.
С помощью применения антител к ТН в мозговом веществе надпочечника обнаружена различной выраженности положительная реакция на катехоламины со стороны популяции хромаффинных клеток (рис. 5A). Визуально выделялись клетки с интенсивной реакцией и со слабо выраженной реакцией. Наблюдались и “переходные” варианты. По нашему предположению, наиболее выраженная реакция у норадренергических хромаффинных клеток, менее выраженная – у адренергических хромаффинных клеток, меньшинство составляет смешанный тип с “переходными” формами. Норадренергические хромаффинные клетки (НА-ХК) локализуются в виде многочисленных островков по периферии МВН, на границе с сетчатой зоной коры, и мелких групп в глубине паренхимы. Подобные скопления хромаффинных клеток были отмечены в нервных стволиках в области ворот, в небольших параганглиях на периферии коркового вещества, под капсулой и в жировой клетчатке органа. Основная масса адренергических хромаффинных клеток (А-ХК) компактно располагалась внутри медуллы в виде оформленных и неоформленных различных размеров глобул.
Рис. 5.
Общий вид (A) и хромаффинные клетки мозгового вещества надпочечника (B). C – кора, M – мозговое вещество надпочечника, CV – центральная вена, S – синусоид. Иммуногистохимическая реакции на ТН (A) и серотонин (B). Докраска астровым синим (A) и толуидиновым синим (B). Масштабный отрезок равен 200 (A) и 50 мкм (B). Fig. 5. General view (A) and chromaffin cells of the adrenal medulla (B). C – the cortex, M – the adrenal medulla, CV – the central vein, S – the sinusoid. Immunohistochemical reaction to TH (A), to serotonin (B). Astra blue counterstaining (A) and toluidine blue counterstaining (B). Scale 200 (A) and 50 µm (B).

Для выявления в МВН серотонин-синтезирующих клеток мы использовали реакцию на 5-НТ (серотонин). Результаты показали, что селективная иммуногистохимическая реакция наблюдалась в клетках глобул, расположенных, главным образом, на периферии МВН. Эти эндокриноциты имеют типичные для НА-ХК морфологические характеристики. Округлую, треугольную или полигональную форму, окрашенное в голубой цвет пузырьковидное ядро и мелко гранулярную цитоплазму, окрашивающуюся в желто-зеленый цвет (рис. 5B). Обращает на себя внимание, что в расположенных по соседству гломерулах хромаффинные клетки (А-ХК) имеют негативную реакцию на серотонин. По морфологическим признакам, по локализации, наличию положительной реакции на ТН содержащие серотонин клетки соответствуют катехоламинергическим элементам НА-ХК. Обнаружение в них наряду с катехоламинами серотонина остается пока непонятным фактом.
С помощью иммуногистохимических реакций на PGP 9.5 и периферин в паренхиме МВН выявляется густое нервное сплетение из тонких миелинизированных и немиелизированных пучков нервных волокон и их претерминальных и терминальных ветвящихся варикозных аксонов, которые направляются к глобулам, островкам и группам хромаффинных клеток, участвуя в их иннервации. В основном сплетении МВН с помощью иммуногистохимического выявления периферина были обнаружены также диффузно расположенные одиночные нервные клетки и микроганглии из 2–3-х нейроцитов (рис. 6).
Рис. 6.
Фрагменты нервных сплетений в мозговом веществе надпочечника крысы (стрелки) и нейроны (N) в нервном сплетении мозгового вещества. Иммуногистохимическая реакция на периферин. Масштабный отрезок равен 50 мкм. Fig. 6. Fragments of the nerve plexuses in the medulla of the rat adrenal gland (arrows) and nerve cells (N) found in the nerve plexus of the medulla. Immunohistochemical reaction to peripherin. Scale 50 µm.

Эти нейроны имеют относительно мелкие размеры: от 20 до 35 мкм, треугольную, грушевидную или веретеновидную форму тела, светлое ядро. От перикариона отходят немногочисленные отростки. Эта разновидность иммунореактивных нейронов, по нашему мнению, относится к парасимпатическому отделу автономной нервной системы, так как после реакции на ТН (на катехоламины) не выявляются, т.е. остаются негативными к данному маркеру.
С помощью иммуногистохимической реакции на ТН в двух случаях в МВН были выявлены катехоламинергические или симпатические нейроны. Одно из таких скоплений из 10–20 рыхло расположенных нервных клеток встретилось на периферии МВН, ближе к границе медуллы и сетчатой зоны коры (рис. 7A).
Рис. 7.
Симпатические нейроны (A) и синаптофизин-положительные терминали (стрелки) (B) в мозговом веществе надпочечника крысы. Иммуногистохимическая реакция на ТН (а) и СФ (B). Докраска астровым синим (A). Масштабный отрезок равен 50 мкм. Fig. 7. Sympathetic neurons (A) and synaptic terminals (arrows) (B) in the medulla of the rat adrenal gland. Immunohistochemical reaction to tyrosine hydroxylase (A), to synaptophysin (B). Astra blue counterstaining (A). Scale 50 µm.
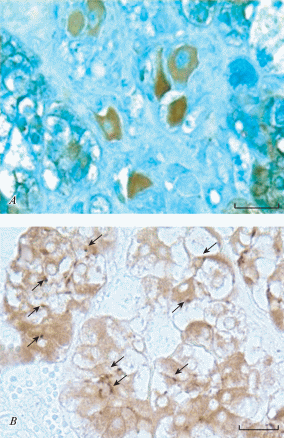
Морфологически эти ТН+ клетки отличаются от более мелких парасимпатических нейроцитов. Они имеют мультиполярную форму, размеры от 30 до 45 мкм, перикарионы окружены сателлитами и соединительной тканью, отростки их в пределах ганглия очень слабо выявляются. Между симпатическими нейронами и вокруг них на границе с кортикоцитами сетчатой зоны коры находятся элементы соединительной ткани, а также обменные и синусоидные капилляры. Вблизи ганглия на том же самом материале выявились фрагменты нервного сплетения из ТН+ варикозных симпатических аксонов, источником которых, по нашему мнению, являются представленные симпатические нейроны МВН. Терминальные веточки ТН+ аксонов этого сплетения распространяются частично в сетчатую и пучковую зоны коры и находятся в тесной связи с кортикоцитами. Эти результаты свидетельствуют о том, что часть кортикоцитов и сосудов коры надпочечника крысы, наряду с парасимпатической, получают и симпатическую иннервацию от нейронов местного симпатического ганглия.
Проведенное иммуногистохимическое исследование с использованием антител к СФ-специфическому маркеру для выявления синаптических аппаратов МВН, показало избирательную выявляемость нервных окончаний на перикарионах хромаффинных клеток. С помощью данного маркера удалось выявить большое количество синаптофизин-положительных терминалей, имеющих вид отдельных крупных бутонов, пуговчатых структур, последовательно расположенных гранул и фрагментов, принадлежащих терминальным аксонам (рис. 7B).
По нашим наблюдениям, синаптические структуры находятся преимущественно, на телах и отростках определенного морфологического типа клеток, а именно, на хромаффинных клетках норадренергической принадлежности (НА-ХК) и отсутствуют на хромаффинных клетках адренергической природы (А-ХК).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как уже отмечалось, надпочечники имеют различные источники иннервации как со стороны центральной, так и периферической нервной системы. В первую очередь они иннервируются ветвями ваго-симпатического нервного ствола, по которым в эмбриогенезе происходит миграция симпатоадреналовых предшественников, врастающих в фетальную кору, позже к ним присоединяются экстрамуральные нервные стволики и узлы вегетативного сплетения, включая чревные ганглии [6]. Кроме того, в иннервации МВН принимают участие ганглии спинномозговых нервов. Несмотря на различные источники иннервации, большинство авторов считает, что функции МВН и системы хромаффинных параганглиев, а по нашим данным и эндокриноцитов коры НП млекопитающих, регулируются, в основном, парасимпатическими нервными волокнами [6, 15, 16].
В настоящей работе были подтверждены данные литературы о преимущественной парасимпатической иннервации тканей НП. С помощью сравнительного анализа с использованием иммуногистохимических реакций на PGP 9.5 и ТН установлено, что нервные сплетения трех зон коры, медуллярной ткани, а также периваскулярные сплетения вокруг артериальных сосудов представлены, главным образом, парасиматическими и в меньшей степени симпатическими нервными волокнами. Разница объясняется тем, что парасимпатические нервные волокна берут начало от топографически разных источников, в то время как основная масса постганглионарных симпатических волокон поступает в надпочечник извне, исключительно от экстрамуральных симпатических ганглиев.
В специальной литературе, посвященной иннервации надпочечника, продолжает обсуждаться вопрос о том, имеются ли в МВН симпатические нейроны. Долгое время существовало представление, что в надпочечнике животных и человека встречаются только интрамуральные парасимпатические микроганглии. В 1991 г. Оomori c соавт. [21] удалось продемонстрировать симпатические нервные клетки с помощью иммуногистохимического маркера на ТН и на электронномикроскопическом уровне. В настоящем исследовании мы подтвердили эти данные. В двух случаях с помощью иммуногистохимической реакции на ТН была выявлена небольшая группа из симпатических нейронов (от 10 до 20) в МВН, на границе коры и медуллы. Возможно, эти симпатические клетки еще в эмбриональном периоде, в качестве симпатобластов, вместе с хромаффиннобластами мигрируют по вагосимпатическому пути краниального отдела из нервного гребня в формирующееся МВН и остаются в нем на все время постнатальной жизни животного. Нами установлено, что отростки этих симпатических нейронов образуют локальное нервное сплетение, которое, по нашему предположению, имеет важное значение для местной иннервации кровеносных сосудов, частично сетчатой зоны коры и медуллярной ткани МВН.
В литературе встречаются отдельные работы, посвященные наличию в МВН и параганглиях, кроме катехоловых, также индольных аминов, в частности, серотонина [26]. Авторами установлено, что в МВН крысы в процессе пренатального развития, начиная с 16–17.5 сут, все адреналин-содержащие хромаффинные клетки (А-ХК) постоянно обнаруживают 5-НТ иммунореактивность, в то время, как НА-содержащие – были иммунонегативны к ней. Предполагается, что 5-НТ иммунореактивность проявляется вместе с началом синтеза катехоламинов и обнаруживается раньше иммунореактивности к дофамину и ферменту ТН. Считается, что экспрессия иммунореактивности к серотонину регулируется независимо и не связана с синтезом катехоламинов. Это обстоятельство побудило нас проверить эти данные. При использовании иммуногистохимической реакции на серотонин в мозговом веществе надпочечника крысы нами были выявлены две разновидности эндокриноцитов. В одних глобулах, соответствующих (НА-ХК), находились клетки с четко выраженной иммунореактивностью к серотонину, в то время как в других она отсутствовала. Полученные результаты указывают на возможность наличия в МВН крысы бифенотипической популяции хромаффинных клеток, вырабатывающих кроме катехоламинов и серотонин. Можно предполагать, что серотонин, экспрессируемый в цитоплазме хромаффинных клеток, по своей природе сходен с таковым нейронов ядер шва (Raphe nuclei) головного мозга. Вопрос о функциональном значении таких хромаффинных клеток требует дальнейшего изучения.
Кратко следует остановиться на иннервации самих хромаффинных клеток. Несмотря на то, что с помощью электронной микроскопии имеющиеся на хромаффинных клетках синапсы описаны в научной литературе [6, 13, 15, 27], многие вопросы синаптогенеза остаются неизученными. Например, вопрос о том, на каких хромаффинных клетках (адренергических или норадреналинергических) локализуются синапсы. Существуют противоречивые данные о типе синапсов, количестве и природе их нейротрансмиттеров [6]. Нами было установлено, что в паренхиме МВН находится густое парасимпатическое нервное сплетение из тончайших нервных пучков, тяжей и отдельных ветвящихся терминальных варикозных аксонов, которые направляются к глобулам, островкам и группам хромаффинных клеток и в различной степени участвуют в их иннервации. При этом выяснилось, что наибольшее количество синаптических терминалей наблюдается на норадренергических клетках (НА-ХК), расположенных по периферии МВН, и значительно реже на популяции адренергических (А-ХК), локализующихся в широкой области вокруг центральной вены.
Дискуссионным остается вопрос об афферентных чувствительных нервных окончаниях в надпочечнике. Ранее были представлены доказательства их присутствия в МВН на светооптическом [28] и электронномикроскопическом уровнях [6, 15]. Недавно появилась работа, в которой изучались рецепторные окончания в мозговом веществе надпочечника крысы [16]. В этой работе был применен новый иммуногистохимический метод определения афферентных или рецепторных чувствительных нервных окончаний с помощью периферической холинацетилтрансферазы (pChAT). Авторы продемонстрировали в паренхиме МВН большую плотность арборизаций нервных волокон и наличие кустиковидных и диффузных чувствительных рецепторных окончаний и, таким образом, подтвердили данные исследования российского нейрогистолога А.С. Догеля [29], выполненного еще в девятнадцатом столетии с помощью суправитальной окраски тканей МВН метиленовым синим. Эти данные свидетельствуют о том, что МВН помимо основной гормональной функции выполняет и хеморецепторную функцию.
ЗАКЛЮЧЕНИЕ
С помощью используемых нейральных иммуногистохимических маркеров получены оригинальные данные о морфологических особенностях иннервации тканей коры и мозгового вещества надпочечника половозрелой крысы. Часть имеющихся в литературе фактов нами подтверждена. Установлено, что все зоны коры (гломерулярная, пучковая и сетчатая) иннервируются парасимпатическими и симпатическими нервными волокнами, которые образуют различной плотности терминальные сплетения из варикозных аксонов. Последние представлены “дистантными синапсами”, находящимися в тесной связи с телами кортикоцитов, эндотелием капилляров и гладкомышечными клетками артерий и артериол. Наиболее выражена иннервация гломерулярной зоны и менее – пучковой и сетчатой зон. В сплетении гломерулярной зоны иногда встречаются группы парасимпатических нейроцитов.
Наиболее интенсивная иннервация обнаружена в МВН. В медуллярном веществе находится густая сеть из варикозных аксонов, которые локализуются вокруг мелких групп и гломерул нейроэндокриноцитов, прилежащих к ним синусоидных капилляров. Иммуногистохимически подтверждено наличие в паренхимие МВН крысы двух основных типов хромаффинных клеток (А-ХК и НА-ХК), двух типов нервных волокон (постганглионарных парасимпатических и симпатических) и, соответственно, двух типов нейронов в микроганглиях. Выяснилось, что парасимпатические нервные аппараты в коре и МВН у крысы преобладают над симпатическими. Предполагаются два источника происхождения постганглионарных симпатических волокон НП: внешний – от экстрамуральных нейронов симпатической цепочки и внутренний – от собственных симпатических нейронов микроганглия в МВН, что имеет важное значение для регуляции сосудистого кровообращения надпочечника. На телах и отростках хромаффинных клеток выявлены перицеллюлярные синаптические аппараты холинергических нервных волокон. По мнению авторов, представленный в работе подбор специальных маркеров (PGP 9.5, СФ, TH и 5-НТ) имеет определяющее значение для селективного выявления нейротрансмиттеров, нейромедиаторов и нейрогормонов МВН не только в норме и при патологии, но и для экспресс-диагностики в клинике и судебной медицине.
Список литературы
Смиттен Н.А. Симпато-адреналовая система в фило- и онтогенезе позвоночных. М.Наука. 1972. [Smitten N.A. Simpato-adrenalovaya sistema v filo- i ontogeneze pozvonochny`x. [Sympatho-adrenal system in vertebrate phylogenesis and ontogenesis] M. Nauka. 1972. (In Russ)].
Кацнельсон З.С., Стабровский Е.М. Гистология и биохимия хромаффинной ткани надпочечников. М. Медицина. 1975. [Katsnelson Z.S., Stabrovsky E.M. Gistologiya i bioximiya xromaffinnoj tkani nadpochechnikov. [Histology and biochemistry of chromaffin adrenal gland tissue] Moscow. Medicina. 1975. (In Russ)].
Поленов А. Л., Кулаковский Э. Е. Происхождение и эволюция нейроэндокринных клеток и нейрогормональной регуляции у Metazoa. В кн.: Нейроэндокринология. СПб. Наука. 13–30. 1993. [Polenov A.L., Kulakovsky E.E. Proisxozhdenie i e`volyuciya nejroe`ndokrinny`x kletok i nejrogormonal`noj regulyacii u Metazoa. Nejroe`ndokrinologiya. [Origin and evolution of neuroendocrine cells and neurohormonal regulation in Metazoa. In: Neuroendocrinology. St. Petersburg. Nauka. 13–30. 1993. (In Russ)].
Пальцев М.А., Кветной И.М. Руководство по нейроиммуноэндокринологии. Москва. Шико. 2014. [Pal`tcev M.A., Kvetnoi I.M. Rukovodstvo po nejroimmunoe`ndokrinologii. [Manual on Neuroimmunoendocrinology]. Moscow. Shiko. 2014. (In Russ)].
Карлсон Б. Основы эмбриологии по Пэттену. М. Мир. 1983. [Carlson B. Osnovy` e`mbriologii po Pe`ttenu. [Patten,s foundations of embryology] Moscow. Mir. 1983. (In Russ)].
Coupland R.E. The natural history of the chromaffin cell-twenty-five years on the beginning. Arch. Histol. Cytol. 52: 331–341. 1989. https://doi.org/10.1679/aohc.52.suppl_331
Folligan K., Bouvier R., Targe F., Morel Y., Trouillas J. Development of the human adrenal glands. Ann. Endocrinol. (Paris). 66(4): 325–332. 2005. https://doi.org/10.1016/s0003-4266(05)81789-5
Соколов В.И., Чумасов Е.И., Атагимов М.З. Гистогенез интерреналовой закладки надпочечника свиньи (Sus domestica). Морфология. 129(3): 59–62. 2006. [Sokolov V.I., Chumasov E.I., Atagimov M.Z. Histogenesis of the interrenal primordium of the pig adrenal gland (Sus domestica). Morfologija. 129 (3): 59–62. 2006. (In Russ)].
Чумасов Е.И., Рейдлер Р.М. Морфология хромаффинных клеток околосердечных параганглиев кошки (люминесцентномикроскопическое исследование). Архив анатомии, гистологии и эмбриологии. 64(2): 68–74. 1973. [Chumasov E.I., Reidler R.M. Morphology of chromaffin cells of the pericardial paraganglia of a cat (luminescent microscopic examination).Archive of Anat., Histol. and Embryology. 64(2): 68–74. 1973. (In Russ)].
Говырин В.А., Леонтьева Г.Р. Медиаторные механизмы регуляции кровеносных сосудов. В кн.: Физиология кровообращения. Регуляция кровообращения. Л. Наука. 154–185. 1985. [Govyrin V.A., Leontieva G.R. Mediatorny`e mexanizmy` regulyacii krovenosny`x sosudov. Fiziologiya krovoobrashheniya. Regulyaciya krovoobrashheniya. [Mediatory mechanisms of regulation of blood vessels. In: Physiology of blood circulation. Blood circulation regulation] Leningrad. Nauka. 154–185.1985. (In Russ)].
Чумасов Е.И., Атагимов М.З., Соколов В.И., Селиверстова В.Г. Развитие хромаффинной ткани надпочечника. Морфология. 123(3): 68–73. 2003. [Chumasov E.I., Atagimov M.Z., Sokolov V.I., Seliverstova V.G. The development of chromaffin adrenal gland tissue. Morphologija. 123(3): 68–73. 2003. (In Russ)].
Pelto-Hujkko M., Salminen T. Localization of calcitonin gene-related peptide (CGRP) in chromaffin cells and nerve terminals in adrenal medulla. In: Histochemical and cell biology of autonomic neurons and paraganglia. Berlin. Plenup Press. 73–77. 1987.
Mohamed A.A., Parker T.L., Coupland R.E. The innervation of the adrenal gland. II. The source of spinal afferent nerve fibres to the guinea-pig adrenal gland. J. Anat. 160: 51–58. 1988.
Charlton B.G., Nkomazana O.F., McGadey J., Neal D.E. A preliminary study of acetylcholinesterase-positive innervation in the human adrenal cortex. J. Anat. 76: 99–104. 1991.
Ноздрачев А.Д., Чумасов Е.И. Периферическая нервная система. СПб. Наука. 1999. [Nozdrachev A.D., Chumasov E.I. Perifericheskaya nervnaya sistema [Peripheral nervous system]. St. Petersburg. Nauka. 1999. (In Russ)].
Elnasharty M.A., Sayed-Ahmed A. Expression and localization of pChAT as a novel method to study cholinergic innervation of rat adrenal gland. Acta Histochem. 116(8): 1382–1389. 2014.
Heym C., Colombo-Benckmann M., Mayer B. Immunohistochemical demonstration of the synthesis enzyme for nitric oxide and of comediators in neurons and chromaffin cells of the human adrenal medulla. Ann. Anat. 176 (1): 11–16. 1994. https://doi.org/10.1016/s0940-9602(11)80406-1
Järvi R., Helén P., Pelto-Huikko M., Hervonen A. Neuropeptide Y (NPY)-like immunoreactivity in rat sympathetic neurons and small granule-containing cells. Neurosci. Lett. 67(2): 223–227. 1986.
Kent C., Coupland R.E. Localisation of chromogranin A and B, met-enkephalin-arg6-gly7-leu8 and PGP9.5-like immunoreactivity in the developing and adult rat adrenal medulla and extra-adrenal chromaffin tissue. J. Anat. 166: 213–225. 1989.
Murabayashi H., Kuramoto H., Kawano H., Sasaki M., Kitamura N., Miyakawa K., Tanaka K., Oomori Y. Immunohistochemical features of substance P-immunoreactive chromaffin cells and nerve fibers in the rat adrenal gland. Arch. Histol. Cytol. 70(3): 183–196. 2007.https://doi.org/10.1679/aohc.70.183
Oomori Y., Okuno S., Fujisawa H., Ono K. Immunoelectron microscopic study of tyrosine hydroxylase immunoreactive nerve fibers and ganglion cells in the rat adrenal gland. Anat. Rec. 229 (3): 407–414. 1991. https://doi.org/10.1002/ar.1092290313
Timokhina E.P., Nazimova S.V., Tsomartova D.A., Yaglova N.V., Obernikhin S.S., Yaglov V.V. Morphological and cytophysiological changes in the adult rat adrenal medulla after prenatal and postnatal exposure to endocrine-disrupting DDT. Sovremennye tehnologii v medicine. 12(2): 50–55. 2020. https://doi.org/10.17691/stm2020.12.2.06
Коржевский Д.Э., Кирик О.В., Петрова Е.С. Теоретические основы и практическое применение методов иммуногистохимии (руководство). СПб. СпецЛит. 2014. [Korzhevskii D.E., Kirik O.V., Petrova E.S. [et al.]. Teoreticheskie osnovy` i prakticheskoe primenenie metodov immunogistoximii (rukovodstvo) [Theoretical foundations and practical application of immunohistochemistry methods]. St. Petersburg. SpetsLit. 2014. (In Russ)].
Коржевский Д.Э., Колос Е.А. Белок PGP 9.5 и его использование в качестве функционального маркера в нейроморфологии. Мед. акад. журн. 13(4): 29–35. 2013. [Korzhevskii D.E., Kolos E.A. Protein PGP 9.5 and its use as a functional marker in neuromorphology. Med. Acad. J. 13 (4): 29–35. 2013. (In Russ)].
Колос Е.А., Григорьев И.П., Коржевский Д.Э. Mаркер синаптических контактов – синаптофизин. Морфология. 147(1): 78–82. 2015. [Kolos E.A., Grigoriev I.P., Korzhevskii D.E. Synaptic contacts marker – synaptophysin. Morphologiia. 147(1): 78–82. 2015. (In Russ)].
Soinila S., Ahonen M., Lahtinen T., Häppölä O. Developmental changes in 5-hydroxytryptamine immunoreactivity of sympathetic cells. Int. J. Dev. Neurosci. 7(5): 553–563. 1989. https://doi.org/10.1016/0736-5748(89)90014-2
Scheuermann D.W. Comparative morphology, cytochemistry and innervation of chromaffin tissue in vertebrates. J. Anat. 183(2): 327–342. 1993.
Ильина В.И. Чувствительная иннервация мозгового вещества надпочечника. В кн.: Морфология чувствительной иннервации внутренних органов. М. Изд-во АМН СССР. 135–148. 1948. [Ilyina V.I. Chuvstvitel`naya innervaciya mozgovogo veshhestva nadpochechnika. Morfologiya chuvstvitel`noj innervacii vnutrennix organov [Sensitive innervation of the adrenal medulla. In: Morphology of the sensitive innervation of internal organs] Moscow. Publ. House of the USSR Acad. of Sci. 135–148. 1948. (In Russ)].
Dogiel A.S. Ueber den Bau der Ganglien in den Geflechten des Darmes und der Gallenblase des Menschen und der Säugethiere. Arch. Anat. Physiol., Anat. Abth.: 130-158. 1899.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


