Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 11, стр. 1421-1435
Мембранный гидролиз углеводов и всасывание глюкозы в тонкой кишке крыс при хроническом иммобилизационном стрессе
Л. В. Громова 1, *, Е. В. Савочкина 1, А. С. Алексеева 1, Ю. В. Дмитриева 1, А. А. Груздков 1
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: gromovalv@infran.ru
Поступила в редакцию 27.05.2020
После доработки 14.07.2020
Принята к публикации 18.08.2020
Аннотация
Хронический стресс как неотъемлемый атрибут жизни человека и животных часто приводит к развитию патологических состояний, выраженность которых зависит от его характера, степени и продолжительности. Цель работы состояла в исследовании адаптации ряда физиологических параметров тонкой кишки к умеренному стрессу при ежедневой 3-часовой иммобилизации крыс в течение 3–16 дней при комнатной (21 ± 2°С) температуре и к аналогичному, но более сильному, стрессу при пониженной (5 ± 1°С) температуре. Исследовалось всасывание глюкозы в тонкой кишке в условиях, максимально близких к физиологическим (без наркоза и хирургических операций), содержание транспортеров глюкозы SGLT1 и GLUT2 в энтероцитах и активность кишечных карбогидраз. Обнаружено, что через 3 дня умеренного стресса при комнатной температуре всасывание глюкозы в тонкой кишке и содержание GLUT2 в апикальной мембране энтероцитов тощей кишки повысились (p < 0.05) по сравнению с контролем (без стресса), но через 10 и 16 дней не отличались от контроля. Активности глюкоамилазы и мальтазы через 3, 10 и 16 дней умеренного стресса сохранялись на уровне контроля. Более сильный стресс (ежедневная иммобилизации крыс при пониженной температуре) через 3, 10 и 16 дней приводил к достоверному повышению по сравнению с контролем всасывания глюкозы (p < 0.001). При этом содержание SGLT1 и GLUT2 в энтероцитах тощей кишки не менялось через 3 и 10 дней, но было выше, чем в контроле, через 16 дней (p < 0.05 для SGLT1). Активности глюкоамилазы и мальтазы после 3 и 10 дней хронической иммобилизации крыс на холоде заметно повышались, но через 16 дней возвращались к контрольным значениям. Поскольку холодовое воздействие усиливает термогенез, можно заключить, что хроническая иммобилизация крыс в сочетании с пониженной температурой существенно замедляет адаптацию системы всасывания глюкозы в тонкой кишке и мембранных карбогидраз к стрессорному воздействию.
Стресс представляет угрозу гомеостазу в организме человека и животных, а хронический стресс является одним из существенных факторов, способствующих развитию таких широко распространенных патологических состояний, как метаболический синдром, ожирение, диабет 2-го типа [1, 2].
Действие хронического стресса на пищеварительную систему изучалось довольно интенсивно [3–10], однако, до сих пор имеется существенный пробел в наших знаниях о реакции на хронический стресс ферментов, осуществляющих мембранное пищеварение, которое является важным звеном в общем метаболизме организма. По-прежнему остаются дискуссионными вопросы, касающиеся реакции на хронический стресс системы всасывания глюкозы в тонкой кишке и, в частности, его влияния на основные мембранные транспортеры глюкозы (SGLT1 и GLUT2) в энтероцитах. В ряде работ [4, 7, 9] показано стимулирующее влияние хронического стресса на всасывание глюкозы в тонкой кишке, тогда как согласно другим работам [3, 6], он оказывает ингибирующее действие на этот процесс. Неоднозначные реакции на хронический стресс описаны и в отношении транспортеров глюкозы (SGLT1 и GLUT2) в энтероцитах [3–10].
Существующие расхождения в работах разных авторов могут быть обусловлены проявлением в некоторых случаях дезадаптации или, напротив, адаптации к повторяющемуся стрессору, а также тем, что для оценки всасывания глюкозы в целом и его отдельных составляющих – активного транспорта, облегченной диффузии – используются подходы, не вполне адекватно отражающие функционирование реальных живых систем.
Ранее при имитации хронического стресса у крыс путем ежедневного введения кортикостерона в повышенных концентрациях мы показали, что уровень всасывания глюкозы в тонкой кишке in vivo, в условиях, наиболее близких к физиологическим (в отсутствие наркоза и хирургических операций), прямо коррелирует с концентрацией кортикостерона в крови [9]. При этом мы наблюдали различную реакцию транспортеров глюкозы SGLT1 и GLUT2 в апикальной мембране энтероцитов на повышение уровня кортикостерона в крови. Однако такая экспериментальная модель стресса достаточно хорошо имитирует физиологическое состояние организма в случае отсутствия адаптации гипоталамо-гипофизарной адренокортикальной системы (ГГАКС) к хроническому стрессору. Представлялось логичным и важным проанализировать связь между уровнем всасывания глюкозы в тонкой кишке и тяжестью хронического стресса на экспериментальных моделях, которые обеспечивают адаптацию ГГАКС к хроническому стрессору.
Цель настоящей работы состояла в том, чтобы впервые в условиях максимально близких к физиологическим исследовать адаптацию всасывания глюкозы в тонкой кишке, транспортеров глюкозы SGLT1, GLUT2 в энтероцитах и мембранных кишечных карбогидраз к умеренному стрессу, вызванному ежедневой 3-часовой иммобилизацией крыс на протяжении 16 дней при комнатной (21 ± 2°С) температуре и к аналогичному, но более сильному, стрессорному воздействию при пониженной (5 ± 1°С) температуре.
МЕТОДЫ ИССЛЕДОВАНИЯ
В опытах использовались взрослые крысы линии Вистар (самцы, исходная масса тела 180–220 г), полученные из ЦКП Биоколлекция Института физиологии им. И.П. Павлова РАН. Эксперименты проводились в полном соответствии с Директивой Европейского Совета (The European Council Directive (86/609/EEC)) по соблюдению этических принципов в работе с лабораторными животными и были одобрены Комиссией по контролю за содержанием и использованием лабораторных животных при ФГБУН “Институт физиологии им. И.П. Павлова РАН”.
Перед началом опытов и при их проведении, исключая периоды стрессорного воздействия, животные содержались в нормальных условиях по температуре и освещению, а также имели свободный доступ к стандартному лабораторному корму и воде.
Всасывание глюкозы в тонкой кишке оценивалось по средней скорости свободного потребления крысами ее концентрированного (200 г/л) раствора. Как было показано нами ранее [11], эта скорость в среднем постоянна в широком временном интервале (от 1 до 5 ч) и почти не зависит от исходной концентрации раствора. Она может служить надежным критерием (хотя и косвенным, но зато объективным и количественным) оценки всасывательной способности тонкой кишки в отношении глюкозы в условиях, близких к естественным (без наркоза и хирургических операций). Чтобы вызвать у животных потребность в свободном питье раствора глюкозы их накануне лишали корма (но не воды) на 18–20 ч.
Эта методика уникальна в том отношении, что только она позволяет проводить многократные опыты по оценке всасывательной способности тонкой кишки на одном и том же животном в течение продолжительного времени (до нескольких месяцев), что особенно важно при исследовании особенностей адаптации системы всасывания глюкозы в тонкой кишке к умеренному и более сильному хроническому стрессу.
Были проведены две серии опытов с регистрацией скорости свободного потребления раствора глюкозы.
В первой серии животных из опытных групп ежедневно подвергали трехчасовой иммобилизации при комнатной температуре в специальных клетках-“норках”, частично ограничивающих их подвижность, а у контрольных – на это время отбирали корм. Такой вид стессорного воздействия является моделью умеренного эмоционального и физического стресса. Опыты с иммобилизацией проводили в дневное время с 10:00 до 13:00.
Сначала в нескольких предварительных экспериментах (до начала опытов со стрессом) у каждого животного в течение 5–6 ч регистрировалась временная динамика свободного потребления раствора глюкозы (200 г/л). Для этого каждое животное помещали в индивидуальную клетку размером 14 × 21 × 11 см с двумя мерными поилками, в одной из которых содержался раствор глюкозы, а в другой – обычная вода. Затем, методом линейной регрессии с использованием программного ресурса ORIGIN 7 (OriginLabCorporation, США) [11] определялось среднее значение исходной скорости всасывания глюкозы в тонкой кишке.
По результатам предварительных опытов было сформировано 4 группы: О1, О2 (опыт) и К1, К2 (контроль) по 7 крыс в каждой с близкими средними значениями скоростей свободного потребления раствора глюкозы (табл. 1).
Таблица 1.
Дизайн опытов с определением всасывания глюкозы в тонкой кишке крыс с иммобилизационнным стрессом при комнатной температуре (21 ± 2°С) Table 1. Design of the experiments on estimation of glucose absorption in the small intestine of rats under immobilization stress at room temperature (21 ± 2°C)
| За 3–4 дня
до стресса 3–4 days before stress |
Время, прошедшее от начала опытов со стрессом, дни Time elapsed from the beginning of the experiments with stress, days |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1–3 | 4 | 5 | 5–10 | 11 | 12 | 12–16 | 17 | 18 | |||||
| 24 | 6–11 | 13–18 | |||||||||||
| О1 (7) | R | О1 (Стресс, Stress) (7) | R | О1 (Стресс, Stress) (7) | R | О1 (Стресс, Stress) (4) | R | ||||||
| К1 (7) | R | К1 (Контр., Contr.) (7) | R | К1(Контр., Conrtr.) ( 7) | R | К1 (Контр., Contr.) (4) | R | ||||||
| О2 (7) | R | О2 (Стресс, Stress) (7) | R | О2 (Стресс, Stress) (7) | R | О2 (Стресс, Stress) (4) | R | ||||||
| К2 (7) | R | К2 (Контр., Contr.) (7) | R | К2 (Контр., Contr.) (7) | R | К2 (Контр., Contr.) (4) | R | ||||||
Уровень всасывания глюкозы в тонкой кишке у всех животных (опытных и контрольных) оценивали по скорости свободного потребления ими раствора глюкозы (200 г/л) на следующий день после предварительного голодания в течение 18–20 ч в интервале 10:00–15:00 ч (в период неактивной фазы питания у крыс). При расчетах на каждом сроке суммировались данные по группам О1 и О2 и по группам К1 и К2.
По результатам предварительных опытов были сформированы еще две группы крыс с близкими средними значениями скоростей свободного потребления раствора глюкозы: О3 (опыт) и К3 (контроль) по 9 крыс в каждой. Они использовались для определения кортикостерона в крови крыс через 3, 10 и 16 дней после начала умеренного стресса (n = 3 на каждом сроке).
Через 3, 10 и 16 дней после начала опытов с хроническим стрессом у каждого животного в состоянии покоя (то есть спустя 22 ч после окончания предыдущего стрессорного воздействия) по указанной выше методике определялась скорость всасывания глюкозы в тонкой кишке. На каждом из сроков в конце опыта с регистрацией скорости свободного потребления раствора глюкозы у части животных из опытных и контрольных групп (n = 5–8) после их декапитации отбирались пробы слизистой оболочки из различных отделов кишечника для оценки в них активности кишечных ферментов и содержания белка. Кроме того, из середины тощей кишки отбирались пробы ткани для анализа содержания транспортеров глюкозы SGLT1 и GLUT2 в апикальной мембране энтероцитов. У животных из опытной (О3) и контрольной (К3) групп в те же сроки (3, 10 и 16 дней) через 30 мин после начала стрессорного воздействия и декапитации отбирались пробы крови для определения в них концентрации кортикостерона.
Активности глюкоамилазы (НФ 3.2.1.3) и мальтазы (НФ 3.2.1.20), а также содержание белка в слизистой оболочке кишечника определялись общепринятыми биохимическими методами, как описано ранее [9]. Ферментативные активности выражали в мкмоль/мин/г белка (удельная активность) и на массу слизистой оболочки участка или всего кишечника (интегральная активность), а содержание белка – в мг/г влажной массы слизистой оболочки (удельное содержание) и на массу слизистой оболочки участка или всего кишечника (интегральное содержание).
Содержание транспортеров глюкозы SGLT1 и GLUT2 в апикальной мембране энтероцитов оценивалось с использованием иммуногистохимии и конфокальной микроскопии, как описано ранее [12]. Готовые срезы просматривали на конфокальном микроскопе Leica TCS SL (Германия). Содержание транспортеров глюкозы в апикальной мембране энтероцитов оценивали полуколичественным способом путем измерения по программе Image J средней интенсивности иммунофлуоресцентного свечения (в относительных единицах) в полосках, охватывающих щеточную кайму энтероцитов, расположенных вдоль периметра ворсинки (в расчет принимались энтероциты из верхней и средней третей кишечной ворсинки).
Концентрацию кортикостерона в плазме крови определяли иммуноферментным анализом с использованием набора реагентов “Кортикостерон крыса/мышь-ИФА” фирмы ХЕМА.
Во второй серии опытов хроническая иммобилизация животных проводилась ежедневно в таких же клетках-“норках”, но помещавшихся в холодильную камеру на 3 ч при пониженной температуре (5 ± 1°С). Контрольные животные в это время не подвергались иммобилизации и содержались при комнатной температуре, но не получали корма и воды.
Как и в первой серии, в нескольких предварительных экспериментах (до начала опытов со стрессом) у каждого животного в течение 5–6 ч регистрировалась временная динамика свободного потребления раствора глюкозы (200 г/л) и определялось среднее значение исходной скорости всасывания глюкозы в тонкой кишке. По результатам этих предварительных опытов было сформировано шесть групп крыс с близкими средними значениями скоростей свободного потребления раствора глюкозы: О1, О2, О3 (опыт) и К1, К2 и К3 (контроль).
Через 3, 10 и 16 дней после начала опытов с мобилизацией крыс при пониженной температуре у каждого животного определялась скорость всасывания глюкозы в тонкой кишке концентрированного (200 г/л) раствора глюкозы. При этом дизайн второй серии (табл. 2) отличался тем, что регистрация потребления крысами раствора глюкозы проводилась в один день у всех шести групп (О1, О2, О3 и К1, К2, К3). В расчетах на каждом сроке суммировались данные по группам О1, О2 и О3 (опыт), а также по группам К1, К2 и К3 (контроль).
Таблица 2.
Дизайн опытов с определением всасывания глюкозы при иммобилизационном стрессе на холоде (5 ± 1°С) Table 2. Design of the experiments on estimation of glucose absorption in the small intestine of rats under immobilization stress in the cold (5 ± 1 °C)
| 3–4 дня до стресса 3–4 days before stress |
Время, прошедшее от начала опытов со стрессом, дни Time elapsed from the beginning of the experiments with stress, days |
||||||
|---|---|---|---|---|---|---|---|
| 1–3 | 4 | 5–10 | 11 | 12–16 | 17 | ||
| О1 (5) | R | О1 (Стресс, Stress) (5) | R | ||||
| К1 (5) | R | К1 (Контр., Contr.)(5) | R | ||||
| О2 (5) | R | О2 (Стресс, Stress) (5) | R | О2 (Стресс, Stress) (5) | R | ||
| К2 (5) | R | К2 (Контр., Contr.) (5) | R | К2 (Контр., Contr.) (5) | R | ||
| О3 (5) | R | О3 (Стресс, Stress) (5) | R | О3 (Стресс, Stress) (5) | R | О3 (Стресс, Stress) (5) | R |
| К3 (5) | R | К3 (Контр., Contr.) (5) | R | К3 (Контр., Contr.) (5) | R | К3 (Контр., Contr.) (5) | R |
После каждого срока хронической иммобилизации у животных из опытных и контрольных групп после их декапитации отбирались пробы слизистой оболочки кишечника для оценки в них активности кишечных ферментов и содержания белка, а из середины тощей кишки отбирались пробы ткани для анализа содержания транспортеров глюкозы SGLT1 и GLUT2 в апикальной мембране энтероцитов. У нескольких животных опытных и контрольных групп (по три из каждой) в те же сроки (3, 10 и 16 дней) через 30 мин после начала стрессорного воздействия и декапитации отбирались пробы крови для определения в них концентрации кортикостерона.
Расчеты. В тексте статьи и на рисунках результаты представлены в виде среднего арифметического (M) со стандартной ошибкой среднего (±m).
Статистика. Обработка результатов опытов проводилась с использованием t-критерия Стъюдента и частично (отмечено в тексте) с использованием непараметрического критерия Вилкоксона–Манна–Уитни. За достоверные принимались различия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Масса тела животных. В первые 3 дня хронической иммобилизации крыс при комнатной температуре прирост массы тела у них несколько снижался по сравнению с контролем. Но в дальнейшем он восстанавливался до уровня близкого к контролю, и через 16 дней масса тела крыс в опытной группе была лишь слегка ниже, чем в контрольной (234.6 ± 6.1 и 243.1 ± 5.2 г, соответственно). В случае аналогичного воздействия при пониженной температуре масса тела животных в первые 3 дня практически не менялась, а затем ее прирост был близок к контролю. К концу экспериментального периода масса тела у крыс после стресса была лишь на 7.7% ниже, чем у контрольных (250.0 ± 8.0 и 270.0 ± 16.0 г, соответственно).
Уровень кортикостерона в плазме крови. После трех дней хронической изоляции крыс при комнатной температуре содержание кортикостерона в плазме крови у них было в 2.5 раза выше, чем в контроле (21.4 ± 2.1 против 8.5 ± 1.4 мкг/дл, p < 0.05 по критерию Вилкоксона–Манна–Уитни). Однако через 10 и 16 дней такого воздействия содержание гормона в плазме крови (12.8 ± 1.6 и 10.6 ± 1.6 мкг/дл соответственно) существенно не отличалось от контроля (10.5 ± 1.5 и 7.1 ± 1.3 мкг/дл соответственно). В случае хронической иммобилизации крыс при пониженной температуре содержание кортикостерона в плазме крови через 3, 10 и 16 дней было значительно (p < 0.001) выше по сравнению с контролем (19.4 ± 0.4; 24.0 ± 2.2 и 19.4 ± 2.1 мкг/дл против 7.3 ± 1.2; 6.0 ± 1.3 и 5.0 ± 0.2 мкг/дл в контроле, соответственно).
Такую реакцию гормона можно рассматривать как адаптивную, так как она направлена на снижение влияния хронического стресса на энергетический баланс.
Содержание белка в слизистой оболочке кишечника. Через 3 и 10 дней хронической иммобилизации крыс при комнатной температуре (рис. 1) наблюдалась тенденция к повышению содержания белка в слизистой оболочке ряда участков кишечника (в расчете на массу слизистой оболочки данного участка). Однако это повышение было статистически достоверным по сравнению с контролем лишь в проксимальном участке тощей кишки через 10 дней (на 44%, p < 0.02 по критерию Вилкоксона–Манна–Уитни).
Рис. 1.
Содержание белка в различных участках кишечника (M ± m, в расчете на массу слизистой оболочки данного участка) в контроле и в ходе хронического иммобилизационного стресса при комнатной (А) и пониженной (B) температуре (n = 5). Обозначения: C – контроль; S – стресс; * p < 0.02; ** p < 0.01 (по критерию Вилкоксона–Манна–Уитни). Fig. 1. The protein content in various parts of the intestinal tract (calculated per mass of mucosa in the given part) during chronic immobilization stress at room (A) and lowed (B) temperature (n = 5). Designations: C – control; S – stress; * p < 0.02; ** p < 0.01 (according to the Wilcoxon–Mann–Whitney criterion).

Через 16 дней такого воздействия содержание белка в различных отделах кишечника было близким к контролю.
В случае хронической иммобилизации крыс при пониженной температуре (рис. 1B) содержание белка в ряде отделов кишечника было сниженным по сравнению с контролем на всех сроках: через 3 дня – в двенадцатиперстной кишке (на 33%, p < 0.02), через 10 дней – в двенадцатиперстной кишке (на 17%, p < 0.02), в подвздошной кишке (на 22%, p < 0.02) и в толстой кишке (на 56%, p < 0.01), а через 16 дней – в дистальном участке тощей кишки (на 48%, p < 0.01 по критерию Вилкоксона–Манна–Уитни).
Всасывание глюкозы. Как было отмечено выше, скорость всасывания глюкозы в тонкой кишке (мкмоль/мин) у крыс оценивалась по скорости свободного потребления этими животными (после предварительного голодания в течение 18–20 ч) концентрированного раствора глюкозы (200 г/л). После 3 дней хронической иммобилизации крыс при нормальной температуре (n = 14) скорость потребления раствора глюкозы повышалась по сравнению с контролем (на 7%, p < 0.01), но через 10 (n = 14) и 16 (n = 8) дней она не отличалась от контроля (рис. 2А).
Рис. 2.
Скорость свободного потребления крысами концентрированного раствора глюкозы (200 г/л) в контроле и в ходе хронического иммобилизационного стресса при комнатной (А) (n = 14, 14 и 8) и пониженной (B) (n = 15, 10 и 5) температурах (M ± m). Обозначения: 1 – опыт (стресс); 2 – контроль (без стресса); * p < 0.01; ** p < 0.001. Fig. 2. The rate of free consumption of concentrated glucose solution (200 g/L) by rats in the control and during chronic immobilization stress at room (A) (n = 14, 14 и 8) and lowed (B) (n = 15, 10 и 5) temperatures (M ± m). Designations: 1 – the experiment (stress); 2 –control (no stress); * p < 0.01; ** p < 0.001.
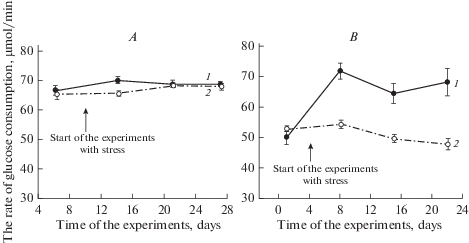
Если принять во внимание приведенные выше данные об изменении уровня кортикостерона в крови на аналогичных сроках, то можно предположить, что именно этот фактор является наиболее существенным в развитии адаптации системы всасывания глюкозы в тонкой кишке к хроническому умеренному стрессу. Такое предположение подкрепляется также другими нашими данными, полученными в предшествующей работе [10], которые свидетельствуют о том, что стимулирующие эффекты кортикостерона в отношении всасывания глюкозы в тонкой кишке зависят от дозы вводимого гормона.
В случае такого же воздействия при пониженной температуре скорость потребления раствора глюкозы на всех сроках была существенно выше, чем в контроле: через 3 дня – на 32%, через 10 – на 30%, и через 16 дней – на 42% (p < 0.001) (рис. 2B).
Содержание транспортеров глюкозы в апикальной мембране энтероцитов. В случае хронической иммобилизации крыс при комнатной температуре отмечалась тенденция к повышению содержания транспортера SGLT1 в апикальной мембране энтероцитов тощей кишки на всех сроках стрессорного воздействия (рис. 3A). При этом содержание транспортера GLUT2 в апикальной мембране энтероцитов тощей кишки было выше, чем в контроле (на 85%, p < 0.05) через 3 дня, но не менялось через 10 и 16 дней.
Рис. 3.
Содержание транспортеров глюкозы SGLT1 и GLUT2 в апикальной мембране энтероцитов тощей кишки крыс (M ± m) в контроле и в ходе хронического иммобилизационного стресса при комнатной (А) (n = 5) и пониженной (B) (n = 5) температурах. Обозначения: C – контроль; S – стресс; * p < 0.01 (по критерию Вилкоксона–Манна–Уитни). Fig. 3. The content of glucose transporters SGLT1 and GLUT2 in the apical membrane of jejunum enterocytes in the rats in the controls and during chronic immobilization stress at room (A) (n = 5) and lowed (B) (n = 5) temperature. Designations: C – control; S – stress; * p < 0.01 (according to the Wilcoxon–Mann–Whitney criterion).
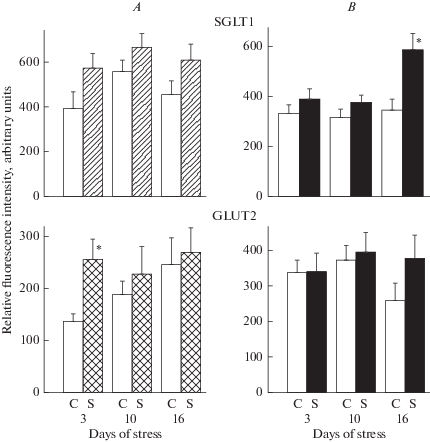
При хронической иммобилизации крыс на холоде содержание транспортеров (как SGLT1, так и GLUT2) в апикальной мембране энтероцитов тощей кишки существенно не менялось через 3 и 10 дней, но было заметно повышенным через 16 дней по сравнению с контролем. Однако достоверным это повышение было только в отношении SGLT1 (на 70%, p < 0.05).
Активности ферментов. На рис. 4 представлены данные об удельной активности глюкоамилазы и мальтазы (мкмоль/мин/г белка, в среднем по всей кишке). Важно отметить, что у обоих ферментов наибольший вклад в их активность вносит тонкая кишка.
Рис. 4.
Удельные активности (M ± m) глюкоамилазы и мальтазы (мкмоль/мин/г белка) в среднем по всей кишке крыс в контроле и в ходе хронического иммобилизационного стресса при комнатной (A) и пониженной (B) температурах. Обозначения: С – контроль; S – стресс; * p < 0.05; ** p < 0.01. Fig. 4. The specific activity of glucoamylase and maltase (μmol/min/g protein) on average throughout the intestine in the controls and during chronic immobilization stress at room (A) and lowed (B) temperatures. Designations: C – control; S – stress; * p < 0.05; ** p < 0.01.

В ходе хронической иммобилизации крыс при комнатной температуре удельная активность обоих ферментов на всех сроках достоверно не менялась по сравнению с контролем. Однако имела место тенденция к снижению активности мальтазы через 3 дня и глюкоамилазы – через 10 дней стрессорного воздействия. В случае хронической иммобилизации крыс при пониженной температуре значения удельной активности глюкоамилазы и мальтазы через 3 (n = 6) и 10 (n = 6) дней были повышенными по сравнению с контролем: для глюкоамилазы – на 26% (p < 0.05) и в 2.2 раза, (p < 0.01), для мальтазы – на 35% (но p > 0.05) и в 1.9 раз (p < 0.01) соответственно. Через 16 дней (n = 6) стрессорного воздействия активности этих ферментов не отличались от контроля. В основном близкие изменения наблюдались и в отношении интегральной (в среднем по всей кишке) активности этих ферментов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как показали наши результаты, ежедневная трехчасовая иммобилизация крыс на протяжении 16 дней как при комнатной температуре, так и на холоде не влияет (за исключением первых трех дней) на прирост массы тела животных. Отсутствие изменений прироста массы тела лабораторных животных в случае их хронической иммобилизации при комнатной температуре отмечали и другие исследователи [13, 14]. Имеются также данные, что и хроническое кратковременное воздействие холода на мышей (4 °С в течение 1–4 ч три раза в неделю) [15] или (4 °С в течение 1 ч на протяжении 7 недель) [16] и на крыс (4 °С в течение 6 ч на протяжении 14 дней) [17] не вызывает изменения массы тела у этих животных.
При определении содержания кортикостерона в плазме крови крыс в ходе их хронической иммобилизации при комнатной температуре мы обнаружили прогрессивное снижение этого показателя на фоне стресса с увеличением длительности стрессорного воздействия, что свидетельствовало об адаптации ГГАКС к этому стрессору. Факт адаптации ГГАКС и некоторых других физиологических показателей организма у лабораторных животных к хроническому иммобилизационному стрессу при нормальной температуре среды отмечался и в других работах [14, 18, 19]. Однако в случае хронической иммобилизации крыс при пониженной температуре в наших опытах уровень кортикостерона в плазме крови на фоне стресса был достоверно выше, чем в контроле при всех сроках этого воздействия (3, 10 и 16 дней). Полученный нами результат хорошо согласуется с данными работы Eshkevari с соавт. [20], где показан повышенный по сравнению с контролем уровень кортикостерона в плазме крови мышей через 1 ч после возвращения животных к нормальной температуре после одночасовой их выдержки на колотом льду (2–5°С) в течение 10 дней. Поскольку у теплокровных животных и человека снижение температуры окружающей среды вызывает усиление термогенеза [15–17], можно предположить, что наличие этого фактора в нашей модели хронической иммобилизации оказывает доминирующее влияние на развитие адаптации ГГАКС к данному стрессору.
Существенные различия между ответами на хроническую иммобилизацию крыс при комнатной температуре и на холоде были обнаружены нами и в отношении содержания белка в слизистой оболочке различных отделов кишечника. Так, в случае хронической иммобилизации крыс при комнатной температуре происходило небольшое повышение содержания белка в слизистой оболочке тощей кишки (в расчете на массу участка кишечника) через 10 дней, без изменения этого показателя на других сроках. Однако при иммобилизации на холоде содержание белка в слизистой оболочке было сниженным (по сравнению с контролем) в ряде отделов кишечника на всех сроках этого воздействия (рис. 1B). Таким образом, только в случае хронической иммобилизации на холоде проявлялось катаболическое действие повышенных уровней кортикостерона в плазме крови (через 3, 10 и 16 дней) в отношении содержания белков в слизистой оболочке кишечника.
Как мы уже упоминали выше, данные литературы о влиянии хронического стресса на всасывание глюкозы в тонкой кишке, в том числе, на две его составляющие – активный транспорт с участием SGLT1 и облегченную диффузию с участием GLUT2 – весьма неоднозначны [3–10]. Эти расхождения могут быть обусловлены, в частности, тем, что для оценки всасывания глюкозы в целом и его составляющих использовались подходы, не вполне адекватно отражающие функционирование реальных живых систем.
В нашей предшествующей работе [9] для определения скорости всасывания глюкозы в тонкой кишке мы применяли методику с регистрацией временной динамики свободного потребления крысами концентрированного раствора глюкозы, что обеспечивало условия максимально близкие к физиологическим. При этом было показано, что ежедневное введение животным кортикостерона в повышенных дозах (соответствующих хроническому стрессу разной степени тяжести) сопровождается усилением всасывания глюкозы в тонкой кишке, причем эффект прямо зависел от дозы гормона. Эти результаты в совокупности с данными литературы позволяли рассматривать такую реакцию системы всасывания глюкозы на глюкокортикоиды (экзогенные или секретируемые при стрессе) как нормальный адаптивный ответ. В настоящей работе впервые в условиях, максимально близких к физиологическим, были проанализированы изменения системы всасывания глюкозы в тонкой кишке на моделях (хроническая иммобилизации животных при нормальной и пониженной температуре среды, соответствующих умеренному и более сильному стрессу), которые проявляют адаптацию физиологических показателей к хроническому стрессору. Важно заметить, что в наших экспериментах регистрация потребления крысами раствора глюкозы проводилась в отсутствие в этот день стрессорного воздействия.
Результаты настоящего исследования показали, что в случае хронической иммобилизации крыс при комнатной температуре небольшое повышение всасывания глюкозы в тонкой кишке (по сравнению с контролем) происходило только через 3 дня, тогда как в сочетании с холодом такая иммобилизация приводила к значительному повышению всасывания глюкозы в тонкой кишке на всех сроках стрессорного воздействия. Эти изменения всасывания глюкозы хорошо коррелировали с изменениями в уровне кортикостерона в плазме крови крыс при тех же воздействиях и на соответствующих сроках, что свидетельствует о важной роли эндогенного кортикостерона в изменении всасывания глюкозы в тонкой кишке в наших моделях хронического стресса.
Известно, что даже кратковременное (на несколько часов в день), но регулярное понижение температуры среды приводит к развитию адаптации организма к холоду, первичным ответом которой является ускорение метаболизма в различных органах, что обеспечивает повышенную выработку тепла для сохранения температуры тела [17, 21]. Воздействие холода на организм сопровождается также повышенным потреблением пищи [15, 16, 22], что, в свою очередь, приводит к увеличению времени воздействия углеводной нагрузки на тонкую кишку. Кроме того, в некоторых работах [22, 23] показано усиление под влиянием холодового стресса скорости поглощения глюкозы в органах, играющих существенную роль в термогенезе: в мышечной ткани, белой и бурой жировых тканях. Учитывая вышесказанное, в наших опытах с хронической иммобилизацией на холоде было вполне резонно ожидать повышения всасывания глюкозы как важного энергетического субстрата. Это повышение скорости всасывания глюкозы, по-видимому, направлено на обеспечение быстрого пополнения энергетических запасов в организме при их повышенном расходе, что хорошо вписывается в схему координированной адаптации всех систем организма млекопитающих к пониженной температуре среды.
Обращают на себя внимание результаты, полученные нами в отношении изменения содержания транспортеров глюкозы SGLT1 и GLUT2 в апикальной мембране энтероцитов при хронической иммобилизации крыс. Оказалось, что небольшое повышение всасывания глюкозы в тонкой кишке, наблюдаемое через 3 дня после начала иммобилизации животных при комнатной температуре, сопряжено в основном с увеличением в апикальной мембране энтероцитов содержания транспортеров облегченной диффузии GLUT2. Примерно такая же реакция в отношении транспортеров GLUT2 в апикальной мембране энтероцитов тощей кишки наблюдалась и в нашей предшествующей работе при имитации хронического стресса у крыс введением повышенных доз кортикостерона [9]. Аналогично нашим данным, Boudry с соавт. [5], используя модель хронического стресса у крыс, вызванного избеганием воды (“water-avoidance stress” [5]), обнаружили повышение экспрессии транспортеров GLUT2 в энтероцитах без изменения в экспрессии транспортеров SGLT1. Этот результат представляется вполне логичным в связи с тем, что в энтероцитах всегда имеется внутриклеточный пул транспортеров GLUT2, и они способны достаточно быстро встраиваться в апикальную мембрану этих клеток в случае необходимости срочного увеличения скорости всасывания глюкозы в тонкой кишке [3]. Однако в отличие от наших данных и результатов Boudry с соавт. [5], в работе Lee [6] сообщается о повышении экспрессии SGLT1 в тощей и подвздошной кишке после хронического стресса, вызванного ограничением подвижности крыс (4 ч ежедневно в течение 8 нед.) по сравнению с контролем. Возможно, что отмеченные различия в реакциях транспортеров глюкозы на хронический стресс связаны с более длительным периодом этого воздействия в опытах Lee [6] по сравнению с тем, что имело место в наших опытах и опытах Boudry с соавт. [5].
Иная картина наблюдалась нами в отношении реакции транспортеров SGLT1 и GLUT2 на хроническую иммобилизацию крыс на холоде. Через 3 и 10 дней этого воздействия, несмотря на повышенное всасывание глюкозы в тонкой кишке, в апикальной мембране энтероцитов не выявлялось существенных изменений в содержании обоих транспортеров по сравнению с контролем. Возможно, это связано с тем, что на данных сроках развития адаптации к умеренному холоду повышенное всасывание глюкозы в тонкой кишке происходит за счет увеличения активности Na+/K+-АТФазы в базолатеральной мембране энтероцитов, обеспечивающей энергией активный транспорт глюкозы через апикальную мембрану с участием SGLT1. В пользу такого предположения свидетельствуют данные о повышении уровня АТФ в клетках многих жизненно важных органов под влиянием хронического холодового прерывистого стресса [17]. Вместе с тем, через 16 дней хронической иммобилизации на холоде, на фоне сохранения повышенного всасывания глюкозы в тонкой кишке, содержание обоих транспортеров в апикальной мембране энтероцитов, особенно SGLT1, заметно увеличилось. Учитывая наши данные в отношении снижения в тощей кишке через 16 дней общего содержания белка, можно предположить, что в этих условиях увеличение содержания транспортеров SGLT1 и GLUT2 в апикальной мембране энтероцитов является компенсаторной реакцией, направленной на сохранение на повышенном уровне скорости всасывания глюкозы в тонкой кишке. Безусловно, этих данных, полученных в отношении только одного небольшого участка из тощей кишки, недостаточно для того, чтобы судить о механизмах, обеспечивающих изменение всасывания глюкозы в тонкой кишке в целом. Кроме того, нельзя исключить, что в повышенное всасывание глюкозы может вносить вклад и подвздошная кишка как резервная зона тонкой кишки в случае чрезмерной углеводной нагрузки на тощую кишку. К сожалению, полученные нами результаты трудно сравнивать с данными других авторов, так как в имеющейся литературе практически нет сведений о реакции различных транспортеров глюкозы в тонкой кишке на холодовой стресс.
Особый интерес представлял анализ реакции ключевых мембранных карбогидраз на хроническую иммобилизацию крыс при комнатной и пониженной температуре. В нашей работе установлено, что в первом случае активности глюкоамилазы и мальтазы (в среднем по всей кишке, как в расчете на мг белка, так и на массу слизистой оболочки кишечника) заметно не менялись по сравнению с контролем на всех сроках этого стрессорного воздействия. Однако при хронической иммобилизации на холоде имело место достоверное повышение активностей обоих ферментов через 3 и 10 дней и их возвращение к значениям в контроле через 16 дней хронического стресса. Известно, что мембранные карбогидразы имеют определенный запас активности, что позволяет сохранить на высоком уровне мембранный гидролиз пищевых олигомеров и всасывание образующейся из них глюкозы в случае повышенной углеводной нагрузки на тонкую кишку. В связи с этим можно было ожидать отсутствия изменения активности исследованных ферментов на фоне незначительного повышении всасывания глюкозы в тонкой кишке в случае хронической иммобилизации животных при комнатной температуре. В то же время адаптация к пониженной температуре среды всегда сопровождается повышенным потреблением пищи [16, 22, 24 ] и, соответственно, увеличенным временем контакта углеводной нагрузки со слизистой оболочкой тонкой кишки, что может служить ключевым фактором для ускорения в ней синтеза ферментов, участвующих в мембранном пищеварении углеводов. Однако через 16 дней хронической иммобилизации крыс на холоде повышения активностей карбогидраз в тонкой кишке в наших опытах не происходило. Возможно, проявлению этого эффекта препятствовало существенно усиленное на этом сроке катаболическое действие эндогенных глюкокортикоидов в отношении белков в слизистой оболочке тонкой кишки.
В целом, проведенная работа показала, что пониженная температура среды в сочетании с хронической иммобилизацией животных существенно модифицирует адаптацию ГГАКС и пищеварительных характеристик тонкой кишки к этому виду стрессорного воздействия. Результаты работы дают новую информацию, важную для понимания временных особенностей развития адаптации системы всасывания глюкозы, транспортеров глюкозы SGLT1 и GLUT2 в энтероцитах, а также ферментов, реализующих мембранный гидролиз углеводов, к умеренному и усиленному хроническому стрессу.
Список литературы
McEwen B.S., Akil H. Revisiting the stress concept: implications for affective disorders. J. Neurosci. 40(1): 12–21. 2020.
Patterson Z.R., Abizaid A. Stress induced obesity: lessons from rodent models of stress. Front. Neurosci. (7): 130. 2013.
Shepherd E.J., Helliwell P.A., Mace O.J., Morgan E.L., Patel N., Kellett G.L. Stress and glucocorticoid inhibit apical GLUT2-trafficking and intestinal glucose absorption in rat small intestine. J. Physiol. 560(Pt.1): 281–290. 2004.
Garriga C., Hunter R.R., Amat C., Planas J.M., Mitchell M.A., Moretó M. Heat stress increases apical glucose transport in the chicken jejunum. Am. J. Physiol. Regul. Integr. Comp. Physiol. 290(1): R195–R201. 2006.
Boudry G., Cheeseman C.I., Perdue M.H. Psychological stress impairs Na+-dependent glucose absorption and increases GLUT2 expression in the rat jejunum brush-border membrane. Am. J. Physiol. Regul. Integr. Comp. Physiol. 292(2): R862–R867. 2007.
Lee C.Y. Chronic restraint stress induces intestinal inflammation and alters the expression of hexose and lipid transporters. Clin. Exp. Pharmacol. Physiol. 40(6): 385–391. 2013.
Toyoda A., Iio W., Matsukawa N., Tsukahara T. Influence of chronic social defeat stress on digestive system functioning in rats. J. Nutr. Sci. Vitaminol. (Tokyo). 61(3): 280–284. 2015.
Li Y., Song Z., Kerr K.A., Moeser A.J. Chronic social stress in pigs impairs intestinal barrier and nutrient transporter function, and alters neuro-immune mediator and receptor expression. PLoS One. 12(2): e01716. 2017. 2017.
Громова Л.В., Дмитриева Ю.В., Грефнер Н.М., Алексеева А.С., Груздков А.А. Функциональные показатели тонкой кишки крыс при имитации хронического стресса введением повышенных доз кортикостерона. Рос. физиол. журн. им. И.М. Сеченова. 104(7): 797–806. 2018. [Gromova L.V., Dmitrieva Y.V., Grefner N.M., Aleksseva A.S., Gruzdkov A.A. Functional indicators of the rat small intestine during imitation of chronic stress by introduction of high doses of corticosterone. Russ. J. Physiol. 104(7): 797–806. 2018. (In Russ)].
Al-Zghoul M.B., Alliftawi A.R.S., Saleh K.M.M., Jaradat Z.W. Expression of digestive enzyme and intestinal transporter genes during chronic heat stress in the thermally manipulated broiler chicken. Poult. Sci. 98(9): 4113–4122. 2019.
Gruzdkov A.A., Dmitrieva Y.V., Alekseeva A.S., Polozov A.S., Gromova L.V. Evaluation of glucose absorption level in the small intestine of different rat strains under natural conditions. J. Evol. Biochem. Phys. 54: 308-315. 2018.
Grefner N.M., Gromova L.V., Gruzdkov A.A., Komissarchik Ya.Yu. Interaction of glucose transporters SGLT1 and GLUT2 with cytoskeleton in enterocytes and Caco2 cells during hexose absorption. Cell Tissue Biol. 9(1): 45–52. 2015.
Gregus A., Wintink A.J., Davis A.C., Kalynchuk L.E. Effect of repeated corticosterone injections and restraint stress on anxiety and depression-like behavior in male rats. Behav. Brain Res. 156(1): 105–114. 2005.
Rabasa C., Delgado-Morales R., Muñoz-Abellán C., Nadal R., Armario A. Adaptation of the hypothalamic-pituitary-adrenal axis and glucose to repeated immobilization or restraint stress is not influenced by associative signals. Behav. Brain Res. 217(1): 232–239. 2011.
Ravussin Y., Xiao C., Gavrilova O., Reitman M.L. Effect of intermittent cold exposure on brown fat activation, obesity, and energy homeostasis in mice. PLoS One. 9(1): e85876. 2014.
Zhu P., Zhang Z.H., Huang X.F., Shi X.F., Khandekar N., Yang H.Q., Liang S.Y., Song ZLin S. Cold exposure promotes obesity and impairs glucose homeostasis in mice subjected to a high‑fat diet. Mol. Med. Rep. 18(4): 3923–3931. 2018.
Wang X., Che H., Zhang W., Wang J., Ke T., Cao R., Meng S., Li D., Weiming O., Chen J., Luo W. Effects of Mild Chronic Intermittent Cold Exposure on Rat Organs. Int. J. Biol. Sci. 11(10): 1171–1180. 2015.
Chagra S.L., Zavala J.K., Hall M.V., Gosselink K.L. Acute and repeated restraint differentially activate orexigenic pathways in the rat hypothalamus. Regul. Pept. 167(1): 70–78. 2011.
Kusek M., Tokarska A., Siwiec M., Gadek-Michalska A., Szewczyk B., Hess G., Tokarski K. Nitric oxide synthase inhibitor attenuates the effects of repeated restraint stress on synaptic transmission in the paraventricular nucleus of the rat hypothalamus. Front. Cell Neurosci. 11: Article 127. 2017.
Eshkevari L., Permaul E., Mulroney S.E. Acupuncture blocks cold stress-induced increases in the hypothalamus-pituitary-adrenal axis in the rat. J. Endocrinol. 217(1): 95–104. 2013.
Blondin D.P., Daoud A., Taylor T., Tingelstad H., Bézaire V., Richard D., Carpentier A.C., Taylor A.W., Harper M.E., Aguer C., Haman F. Four-week cold acclimation in adult humans shifts uncoupling thermogenesis from skeletal muscles to brown adipose tissue. J. Physiol. 595(6): 2099–2113. 2017.
Gasparetti A.L., de Souza C.T., Pereira-da-Silva M., Oliveira R.L., Saad M.J., Carneiro E.M., Velloso L.A. Cold exposure induces tissue-specific modulation of the insulin-signalling pathway in Rattus norvegicus. J. Physiol. 552(Pt. 1): 149–162. 2003
Hao Q., Yadav R., Basse A.L., Petersen S., Sonne S.B., Rasmussen S., Zhu Q., Lu Z., Wang J., Audouze K., Gupta R., Madsen L., Kristiansen K., Hansenet J.B. Transcriptome profiling of brown adipose tissue during cold exposure reveals extensive regulation of glucose metabolism. Am. J. Physiol. Endocrinol. Metab. 308(5): E380–E392. 2015.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


