Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 11, стр. 1412-1420
Трансдукция рекомбинантного аденоассоциированного вирусного вектора гиппокампа млекопитающих в клетки мозжечка молоди кеты Oncorhynchus keta
М. Е. Стуканёва 1, *, Е. В. Пущина 1, 2, А. А. Вараксин 1
1 Национальный научный центр морской биологии им. А.В. Жирмунского, ДВО РАН
г. Владивосток, Россия
2 Институт физиологии им. А. Богомольца, Национальной Академии Наук Украины
Киев, Украина
* E-mail: stykanyova@mail.ru
Поступила в редакцию 21.04.2020
После доработки 09.06.2020
Принята к публикации 05.07.2020
Аннотация
Целью данной работы было исследование возможности трансдукции рекомбинантного аденоассоциированного вирусного вектора гиппокампа млекопитающих (rAAV) в клетки мозжечка годовалой молоди кеты (Oncorhynchus keta) через месяц после интрапаренхиматозной инъекции. Введение 0.2 мкл rAAV в дорсальную область тела мозжечка молоди кеты сопровождалось мониторингом состояния рыб и последующим исследованием мозжечка с помощью флуоресцентной микроскопии. Полученные нами результаты демонстрируют, что rAAV способен эффективно инфицировать клетки мозжечка молоди кеты. Средний размер трансдуцированных клеток составлял 5 и 7 мкм. При трансдукции rAAV в структуры мозжечка было установлено, что наибольшая концентрация клеток характерна для центральной части инъекции и по мере удаления от нее диффузно снижается. На периферии инъекции находится большое число GFP-позитивных гранул, что свидетельствует о начале деградации клеток в ходе иммунного ответа. Результаты исследования демонстрируют, что rAAV способен трансдуцировать субпопуляции клеток, удаленные от зоны инъекции, это предполагает его распространение с помощью диффузии, а также внутриклеточного транспорта.
Встраивание нового гена для восстановления дикого типа (добавление гена), коррекция измененного генома (редактирование гена) и ингибирование/инактивация мутантного гена является одним из перспективных методов при лечении заболеваний ЦНС [1, 2]. Рекомбинантный аденоассоциированный вирус (rAAV) рассматривается как перспективный вектор в генной терапии человека [3]. Он способен инфицировать постмитотические клетки, обеспечивая простую и безопасную доставку генов в ЦНС [4, 5]. rAAV – непатогенный вирус с одноцепочечной ДНК, лишенный оболочки, который не может осуществлять автономную репликацию или завершение своего жизненного цикла без аденовируса [6, 7]. rAAV трансдуцирует клетки, преодолев три физиологических барьера: плазматическую мембрану, эндосомальную мембрану и ядерную оболочку [8]. Вирусные частицы попадают в ядро в течение 20 ч, накапливаясь преимущественно в перинуклеарном компартменте [9]. Было показано, что rAAV осуществляют эффективную и стабильную клеточную трансдукцию без возникновения немедленного иммунного ответа или индукции цитотоксичности [10, 11]. Поскольку они считаются непатогенными, это снизило требования к уровню биобезопасности при работе с rAAV по сравнению с другими популярными вирусными векторными системами [12].
Помимо разработки терапевтических методов, вирусы бешенства, простого герпеса, лентивирусы и rAAV успешно используются нейробиологами при визуализации нервных цепей in vivo [10, 13]. Длительная трансдукция rAAV может наблюдаться через месяцы и годы после первичной инъекции в ЦНС [14, 15]. У приматов экспрессия генов в постмитотических клетках сохранялась более 6 лет [16]. Нативная флуоресценция при инъекции rAAV не требует обязательного дополнительного гистохимического окрашивания и позволяет получить статичное или динамическое изображение из зоны инъекции [17, 18]. Другое преимущество rAAV-опосредованной экспрессии флуоресцентного белка заключается в том, что инфицированные клеточные тела полностью маркируются. Это позволяет точно определить место инъекции и проанализировать, какие типы нейронов имеют проекции аксонов [14]. rAAV могут инфицировать постмитотические клетки, такие как нейроны, что ускорило развитие новых методов манипуляции и реконструкции нервных цепей in vivo [10, 13]. В дальнейшем использование rAAV может расширить наши знания о картировании путей нейронов в интактной и поврежденной ЦНС млекопитающих [19].
В настоящее время активно исследуется трансдукция rAAV в клетки мозга млекопитающих и самым распространенным модельным объектом является мышь (Mus musculus) [20]. Но, как было показано при оценке токсичности, даже такой классический объект исследований имеет некоторые отличия от метаболизма человека [20]. Костистые рыбы используются в качестве модельных животных in vivo в различных областях молекулярной генетики, таких как биология развития [21] и нейробиология [22, 23]. Введение аденовирусных векторов в их мозг способствует генетическому анализу функций нервных клеток и нейронов в составе отдельных нервных цепей [24]. Несмотря на столь перспективное направление, на сегодняшний день существует не так много исследований, демонстрирующих, что человеческий rAAV может инфицировать нервные клетки в мозге костистых рыб [24]. Таким образом, молодь кеты может рассматриваться в качестве модельного объекта для оценки свойств аденовирусных векторов в доклинических исследованиях.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперимент проводили на 10 годовалых особях молоди кеты с длиной тела 11–12.5 см и массой 25–35 г. Животные были получены с Рязановского экспериментального производственного рыбоводного завода в 2019 г. Все экспериментальные манипуляции были проведены в соответствии с правилами, регулируемыми уставом Национального научного центра морской биологии им. А.В. Жирмунского ДВО РАН и Этической комиссией, регламентирующей гуманное обращение с экспериментальными животными. Кету содержали в аквариуме с аэрируемой морской водой при температуре 16–17°C, с одноразовым кормлением за сутки. Соотношение освещенного и темнового периодов в сутках составляло 14/10 ч. Содержание растворенного кислорода в воде составляло 7–10 мг/дм3, что соответствует нормальному насыщению. Для выявления трансдукции клеток использовали rAAV, который кодирует ген зеленого флуоресцентного белка (GFP). В большинстве клинических исследований ЦНС векторы rAAV вводят путем интрапаренхиматозной инъекции [25, 26]. Мы осуществляли введение rAAV при долговременной экспозиции в течение месяца путем интрапаренхиматозной инъекции в дорсальную область тела мозжечка. Животные были разделены на две группы. Рыбам в контрольной группе (n = 5) был введен в мозжечок 0.2 мкл раствора 0.1 М фосфатного буфера (pH 7.2), экспериментальной группе вводили 0.2 мкл rAAV (n = 5). Во всех контрольных экспериментах GFP-позитивная реакция отсутствовала.
Сразу после инъекции животных выпускали в аквариум с морской водой для их восстановления и дальнейшего мониторинга. После инъекции двигательная активность рыб существенно повышалась: они выпрыгивали из воды и совершали вращательные движения. Далее рыбы были анестезированы в растворе трикаин метансульфоната MS-222 (Sigma-Aldrich, США) в течение 10–15 мин при комнатной температуре. Животные выводились из эксперимента и подвергались эвтаназии методом быстрой декапитации. После анестезии внутричерепную полость обездвиженного животного префиксировали с помощью шприца 4%-ным раствором параформальдегида, приготовленным на 0.1 М фосфатном буфере (pH 7.2). После префиксации мозг извлекали из полости черепа и фиксировали в 4%-ом растворе параформальдегида в течение двух часов при 4°C. Затем в течение двух суток выдерживали в 30%-ном растворе сахарозы при 4°C (с семикратной сменой раствора). Серийные фронтальные срезы мозга толщиной 50 мкм изготавливали на замораживающем микротоме Cryo-star HM 560 МВ (Carl Zeiss, Германия). Для исследования каждый третий фронтальный срез мозжечка помещали на предметное стекло и заключали в глицерин.
Визуализация экспрессии GFP была проведена на микроскопе Axiovert 200-M (Carl Zeiss, Германия) в режиме флуоресц. с использованием зеленого светофильтра (488 нм). Измерения проводили в 5 случайно выбранных микроскопических полях для каждой области исследования. Микрофотографии препаратов получали с помощью цифровой камеры Axiovert 200. Обработку полученных данных проводили с использованием программы AxioVision и в графическом редакторе Corel Photo-Paint 12. Количественную обработку полученных результатов выполняли с использованием программных пакетов Statistica 12 и Microsoft Excel 2010. Все данные представлены в виде: среднее ± стандартное отклонение (M ± SD).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
GFP полностью заполняет тела инфицированных rAAV клеток [19] и, демонстрируя интенсивную флуоресценцию, позволяет точно определить область инъекции. В мозжечке молоди кеты контрольной группы экспрессия GFP не была выявлена (рис. 1A).
Рис. 1.
Распределение зеленого флуоресцентного белка (GFP) в мозжечке молоди кеты. A – общий вид контрольного среза при введении фосфатного буфера; B – область инъекции через месяц после введения rAAV, флуоресценция. Белой стрелкой обозначено место инъекции rAAV, серыми стрелками обозначены GFP+ клетки, черными – GFP+ гранулы; C – микрофотография области введения rAAV в режиме фазового контраста, серыми стрелками обозначены GFP+ клетки, черными – GFP+ гранулы; D – соотношение GFP+ клеток после введения rAAV, 1 – инъекция в ростральной части мозжечка, 2 – инъекция в каудальной части, 3 – латеральная зона, 4 – базальная зона. Ml – молекулярный слой, Grl – гранулярный слой, Dz – дорсальная зона, Lz – латеральная зона, Bz – базальная зона. Fig. 1. Distribution of green fluorescent protein (GFP) in the cerebellum of juvenile O. keta. A – general view of a control slice with the introduction of phosphate buffer; B – injection area one month after the introduction of rAAV, fluorescence. The white arrow indicates the injection site of rAAV, the gray arrows indicate GFP+ cells, the black arrows indicate GFP+ granules; C – microphotography of the rAAV injection area in the phase contrast mode, gray arrows indicate GFP+ cells, black arrows indicate GFP+ granules; D – ratio of GFP+ cells after rAAV administration, 1 – injection in the rostral part of cerebellum, 2 – injection in the caudal part of cerebellum, 3 – lateral zone, 4 – basal zone. Ml – molecular layer, Grl – granular layer, Dz – dorsal zone, Lz– lateral zone, Bz – basal zone.

Результаты проведенного исследования показывают, что rAAV векторы способны опосредовать эффективную трансдукцию клеток в мозжечке при интрапаренхиматозной инъекции. Подавляющее большинство GFP+ клеток во всех зонах мозжечка имели размер 4–5 мкм (табл. 1). Встречались единичные крупные GFP+ клетки, размером 7 мкм (табл. 1).
Таблица 1.
Морфометрические параметры* клеток (M ± SD) мозжечка молоди кеты O. keta через месяц после введения rAAV Table 1. Morphometric parameters * of cells (M ± SD) of the cerebellum of juvenile chum O. keta one month after the introduction of rAAV
| Область инъекции Injection area |
Дорсальная зона Dorsal zone | Латеральная зона Lateral zone | Базальная зона Basal area | |
|---|---|---|---|---|
| Клетки молекулярного слоя | 5 ± 0.5/4.3 ± 0.4 | 5.1 ± 0.4/4.4 ± 0.6 | 5.3 ± 0.3/4.8 ± 0.5 | 5.1 ± 0.1/5 ± 0.1 |
| Molecular layer cells | 8.2 ± 0.9/7.1 ± 0.5 | 8 ± 0.5/6.4 ± 0.5 | 7.6 ± 0.6/6.2 ± 0.3 | 7.5 ± 0.5/6.7 ± 0.5 |
| Клетки гранулярного слоя Granular layer cells | 5.1 ± 0.3/4.3 ± 0.2 | – | – | – |
| Гранулы Granules | 2 ± 0.1/2.1 ± 0. 1 | – | – | – |
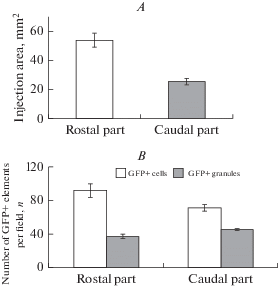
Через месяц после введения rAAV в дорсальную область тела мозжечка в месте инъекции было выявлено максимальное число GFP+ клеток (рис. 1C, 1D). Площадь их распределения составляла 53.5 ± 4.7 мкм2 в ростральной части и 25.3 ± 2.3 мкм2 в каудальной части мозжечка (рис. 2A).
Рис. 2.
A – Распределение GFP+ клеток, показана площадь инъекции (мм2) через месяц после введения rAAV; B – соотношение распределения GFP+ клеток и GFP+ гранул. Белые столбцы обозначают ростральную часть, серые столбцы – каудальную (n = 5 в каждой группе). Fig. 2. A – Distribution of GFP+ cells, shows the injection area (mm2) one month after the introduction of rAAV; B – the ratio of the distribution of GFP+ cells and GFP+ granules. White columns indicate the rostral part, gray columns indicate the caudal part (n = 5 in each group).
Трансдуцированные клетки формировали крупное скопление с равномерным распределением по всей области инъекции, как в молекулярном, так и в гранулярном слоях, что свидетельствует об обширном повреждении тканей.
С помощью фазового контраста было показано, что область инъекции содержит темные включения, которые, очевидно, соответствуют GFP+ клеткам (рис. 1C). При трансдукции rAAV в структуры мозжечка наибольшая концентрация клеток наблюдалась в центральной части инъекции и по мере удаления от нее диффузно снижалась. Помимо GFP+ клеток на периферии области инъекции были расположены менее интенсивно маркированные GFP+ гранулы. Их размеры приведены в таблице. Максимальное число GFP+ клеток находилось в ростральной части и постепенно снижалось в каудальной части мозжечка. В ростральной и каудальной частях мозжечка число гранул было сходным (рис. 2B). Наши результаты демонстрируют, что rAAV не распространяется равномерно по всему мозжечку, но встраивается в области, удаленные от зоны инъекции. Так, в небольшом количестве были выявлены отдельные GFP+ клетки в молекулярном слое латеральной и базальной зон. Доля GFP+ клеток составляла не более 7.5%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При планировании эксперимента с введением вектора необходимо, чтобы прошло достаточно времени для достижения видимой экспрессии генов. Было показано, что две недели после инъекции в мозг мыши – достаточный срок для трансдукции нейронов, определяемой по интенсивной флуоресц. их тел и выявлению аксонов [19]. При удалении от зоны инъекции было установлено большое число гранул, что может свидетельствовать о начале деградации клеток в ходе иммунного ответа. С другой стороны, такой паттерн распределения вирусных частиц может свидетельствовать о диффузном способе их распространения. После вирусной трансдукции и начала экспрессии трансгена, иммунный ответ может привести к очистке трансдуцированных клеток с последующей потерей экспрессии генов и развитием воспаления в ЦНС [3]. При введении серотипа AAV-9 или GFP в стриатум или таламус крысы развивался полный адаптивный иммунный ответ. Усиливалась регуляция МНС II в глие, а такжке лимфоцитарная инфильтрация и воспаление, что приводило к потере значительного числа нейронов и генерации антител против трансгенов [27]. Клеточно-опосредованный иммунный ответ также наблюдался после внутричерепной инъекции вектора AAV1-GFP у приматов (Macaca fascicularis) [28] и инъекции AAV5-α-l-идуронидазы у собаки с синдром Гурлера [29]. Данные на млекопитающих показывают, что в дальнейших исследованиях необходимо учитывать появление иммунного ответа на чужие белки, экспрессируемые векторами AAV [3].
Мы предполагаем, что непосредственное введение вектора в ростральную часть мозжечка объясняет большое количество GFP экспрессирующих клеток в этой зоне. Далее вектор путем диффузии распределялся в каудальную часть, где число клеток было снижено (рис. 2B). В мозге мыши rAAV трансдуцируют как митотические, так и постмитотические клетки [30]. Большая часть серотипов AAV демонстрирует нейрональный тропизм, но некоторые из них также способны трансдуцировать и глиальные клетки [12], в зависимости от экспрессии капсидных белков [31]. Лечение генетических заболеваний ЦНС вызывает затруднения из-за непроницаемости гематоэнцефалического барьера и поражений обширных областей мозга [32]. Интрапаренхиматозная инъекция проникает через гематоэнцефалический барьер, в результате чего экспрессия трансгена ограничена небольшим (1–3 мм) местом введения [33]. Считается, что основной способ распространения вектора в ЦНС – аксональный транспорт, в ретроградном и/или антероградном направлении [30]. Антероградный транспорт rAAV векторов характеризуется трансдукцией клеток в той области мозга, в которую не была введена инъекция, но которая содержала проекции аксонов от нейронов, находящихся в области инъекции. Напротив, при ретроградном транспорте происходит трансдукция нейронов, расположенных в области мозга вдали от места инъекции, но непосредственно иннервирующих место введения [30].
В мозжечке молоди кеты область распространения GFP+ клеток в месте инъекции составляла 0.4–0.6 мм. Наши данные демонстрируют, что rAAV способен трансдуцировать субпопуляции клеток, удаленных от зоны инъекции. Мы предполагаем, что отсутствие трансдуцированных клеток между удаленными зонами и областью инъекции объясняется тем, что трансдукция происходит не только путем диффузии, но и с помощью антероградного транспорта. Так, в небольшом количестве были выявлены отдельные rAAV+ клетки в молекулярном слое латеральной и базальной зон (рис. 1D). Возможность вектора трансдуцировать клетки путем антероградного транспорта способствует его более широкому распространению в ЦНС [34]. По предварительным оценкам полная трансдукция всего мозга человека в младенческом периоде развития для лечения лизосомных нарушений памяти требует от 50 до 350 инъекций [35, 33 ]. Перенос гена на большие расстояния от места инъекции и нацеливание его на уже известные проекции в головном мозге способно снизить число инъекций [36]. Подобное свойство имеет потенциальные преимущества для лечения генетических заболеваний, при которых поражается весь мозг [37]. В исследовании на приматах (cynomolgus) нейроны, удаленные от места инъекции, также были трансдуцированы, что указывало на аксонный транспорт вектора, трансгена или трансгенного продукта [38].
При инъекции серотипа rAAV-2 в кору или глубокие ядра мозжечка мыши сообщалось об эффективной трансдукции клеток Пуркинье. Авторы предполагают, что вирусный вектор распространялся ретроградно по аксонам в тела клеток Пуркинье из глубоких ядер мозжечка [39]. Паренхиматозная инъекция мозжечка примата (Callithrix jacchus) интенсивно трансдуцировала клетки коры мозжечка и его афференты, такие как нейроны мостовых ядер, вестибулярное ядро и нижнее оливарное ядро [40]. В мозжечке молоди кеты после инъекции rAAV отсутствовали GFP+ экспрессирующие клетки Пуркинье и эвридендроидные нейроны.
Таким образом, полученные нами, путем прямого введения rAAV, результаты демонстрируют, что он способен инфицировать клетки мозжечка молоди кеты. Видимо, трансдукция клеток мозжечка молоди кеты осуществляется как локально в зоне инъекции, путем диффузии, так и антероградно. Полученные нами данные являются предварительными и необходимо проводить дальнейшие исследования для выяснения фенотипа GFP+ клеток и особенностей развития иммунного ответа.
Список литературы
Wang L.L.F, Dang L., Liang C., Wang C., He B., Liu J, Li D., Wu X., Xu X., Lu A., Zhang G. In Vivo Delivery Systems for Therapeutic Genome Editing. Int. J. Mol. Sci. 17. pii: E626. 2016.
Lundstrom K. Viral Vectors in Gene Therapy. Diseases. 6(2): E42. 2018.
Ojala D.S., Amara D.P., Schaffer D.V. Adeno-associated virus vectors and neurological gene therapy. Neuroscientist. 21(1): 84–98. 2015.
Towne C., Schneider B.L., Kieran D., Redmond D.E, Aebischer P. Efficient transduction of non-human primate motor neurons after intramuscular delivery of recombinant AAV serotype 6. Gene Ther. 17(1): 141–146. 2010.
Hollis E.R., Kadoya K., Hirsch M., Samulski R.J., Tuszynski M.H. Efficient retrograde neuronal transduction utilizing self-complementary AAV1. Mol. Ther. 16(2): 296–301. 2008.
Buller R.M., Janik J.E., Sebring E.D., Rose J.A. Herpes simplex virus types 1 and 2 completely help adenovirus-associated virus replication. J. Virol. 40(1): 241–247. 1981.
Kay C.N, Ryals R.C, Aslanidi G.V, Min SH., Ruan Q, Sun J, Dyka F.M, Kasuga D, Ayala A.E., Van Vliet K., Agbandje-McKenna M., Hauswirth W.W., Boye S.L., Boye S.E. Targeting photoreceptors via intravitreal delivery using novel, capsid-mutated AAV vectors. PLoS One 2013;8(4): e62097.
Harbison C.E., Chiorini J.A., Parrish C.R. The parvovirus capsid odyssey: from the cell surface to the nucleus. Trends Microbiol. 16(5): 208–214. 2008.
Bartlett J.S., Wilcher R., Samulski R.J. Infectious entry pathway of adeno-associated virus and adeno-associated virus vectors. J. Virol. 74(6): 2777–2785. 2000.
Enquist L.W., Card J.P. Recent advances in the use of neurotropic viruses for circuit analysis. Curr. Opin. Neurobiol.13(5): 603–606. 2003.
Vannucci L., Lai M., Chiuppesi F., Ceccherini-Nelli L., Pistello M. Viral vectors: a look back and ahead on gene transfer technology. New Microbiol. 36(1): 1–22. 2013.
Aschauer D.F., Kreuz S., Rumpel S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain. PLoS One. 8(9): e76310. 2013.
Parr-Brownlie L.C., Bosch-Bouju C., Schoderboeck L., Sizemore R.J., Abraham W.C., Hughes S.M. Lentiviral vectors as tools to understand central nervous system biology in mammalian model organisms. Front Mol. Neurosci. 8: 14. 2015.
Chamberlin N.L., Du B., de Lacalle S., Saper C.B. Recombinant adeno-associated virus vector: use for transgene expression and anterograde tract tracing in the CNS. Brain Res. 793(1–2): 169–175. 1998.
Hadaczek P., Eberling J.L., Pivirotto P., Bringas J., Forsayeth J., Bankiewicz K.S. Eight years of clinical improvement in MPTP-lesioned primates after gene therapy with AAV2-hAADC. Mol. Ther. 18(8): 1458–1461. 2010.
Rivera V.M., Gao G.P., Grant R.L., Schnell M.A., Zoltick P.W., Rozamus L.W., Clackson T., Wilson J.M. Long-term pharmacologically regulated expression of erythropoietin in primates following AAV-mediated gene transfer. Blood. 105(4): 1424–1430. 2005.
Marik S.A, Yamahachi H., McManus J.N., Szabo G., Gilbert C.D. Axonal dynamics of excitatory and inhibitory neurons in somatosensory cortex. PLoS Biol. 8(6): e1000395. 2010.
Mittmann W., Wallace D.J., Czubayko U., Herb J.T., Schaefer A.T., Looger L.L., Denk W., Kerr J.N. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nat. Neurosci.14(8): 1089–1093. 2011.
Harris J.A., Oh S.W., Zeng H. Adeno-associated viral vectors for anterograde axonal tracing with fluorescent proteins in nontransgenic and cre driver mice. Curr. Protoc. Neurosci. 1(20): 1–18. 2012.
Lootens L., Meuleman P., Pozo O.J., Van Eenoo P., Leroux-Roels G., Delbeke F.T. uPA+/+-SCID mouse with humanized liver as a model for in vivo metabolism of exogenous steroids: methandienone as a case study. Clin. Chem. 55(10): 1783–1793. 2009.
Furutani-Seiki M., Wittbrodt J. Medaka and zebrafish, an evolutionary twin study. Mech. Dev.121(7–8): 629–637. 2004.
Asakawa K., Suster M. L., Mizusawa K., Nagayoshi S., Kotani T., Urasaki A., Kishimoto Y., Hibi M., Kawakami K. Genetic dissection of neural circuits by Tol2 transposon-mediated Gal4 gene and enhancer trapping in zebrafish. Proc. Natl. Acad. Sci. USA. 105(4): 1255–1260. 2008.
Neuhauss S.C., Biehlmaier O., Seeliger M.W., Das T., Kohler K., Harris W.A., Baier H. Genetic disorders of vision revealed by a behavioral screen of 400 essential loci in zebrafish. J. Neurosci. 19(19): 8603–8615. 1999.
Suehiro Y., Kinoshita M., Okuyama T., Shimada A., Naruse K., Takeda H., Kubo T., Hashimoto M., Takeuchi H. Transient and permanent gene transfer into the brain of the teleost fish medaka (Oryzias latipes) using human adenovirus and the Cre-loxP system. FEBS Lett. 584(16): 3545–3549. 2010.
Duarte-Neves J., Gonçalves N., Cunha-Santos J, Simões A.T., den Dunnen W. F., Hirai H., Kügler S., Cavadas C., Pereira de Almeida L. Neuropeptide Y mitigates neuropathology and motor deficits in mouse models of Machado-Joseph disease. Hum. Mol. Genet. 24(19): 5451–5463. 2015.
Simões A.T., Gonçalves N., Koeppen A., Déglon N., Kügler S., Duarte C.B., Pereira de Almeida L. Calpastatin-mediated inhibition of calpains in the mouse brain prevents mutant ataxin 3 proteolysis, nuclear localization and aggregation, relieving Machado-Joseph disease. Brain. 135(Pt 8): 2428–2439. 2012.
Ciesielska A., Hadaczek P., Mittermeyer G., Zhou S., Wright J.F., Bankiewicz K.S., Forsayeth J. Cerebral infusion of AAV9 vector-encoding non-self proteins can elicit cell-mediated immune responses. Mol. Ther. 21(1): 158–166. 2013.
Hadaczek P., Forsayeth J., Mirek H., Munson K., Bringas J., Pivirotto P., McBride J.L., Davidson B.L., Bankiewicz K.S. Transduction of nonhuman primate brain with adeno-associated virus serotype 1: vector trafficking and immune response. Hum. Gene Ther. 20(3): 225-237. 2009.
Ciron C., Desmaris N., Colle M.A., Raoul S., Joussemet B., Vérot L., Ausseil J., Froissart R., Roux F., Chérel Y., Ferry N., Lajat Y., Schwartz B., Vanier M.T., Maire I., Tardieu M., Moullier P., Heard J.M. Gene therapy of the brain in the dog model of Hurler’s syndrome. Ann. Neurol. 60(2): 204–213. 2006.
Saraiva J., Nobre R.J., Pereira de Almeida L. Gene therapy for the CNS using AAV: The impact of systemic delivery by AAV9. J. Control Release. 241: 94–109. 2016.
Alves S., Nascimento-Ferreira I., Auregan G., Hassig R., Dufour N., Brouillet E., Pedroso de Lima M.C., Hantraye P., Pereira de Almeida L., Déglon N. Allele-specific RNA silencing of mutant ataxin-3 mediates neuroprotection in a rat model of Machado-Joseph disease. PLoS One. 3(10): e3341. 2008.
Cearley C.N., Wolfe J.H. Transduction characteristics of adeno-associated virus vectors expressing cap serotypes 7, 8, 9, and Rh10 in the mouse brain. Mol. Ther. 13(3): 528–537. 2006.
Cunningham J., Pivirotto P., Bringas J., Suzuki B, Vijay S, Sanftner L., Kitamura M., Chan C., Bankiewicz K.S. Biodistribution of adeno-associated virus type-2 in nonhuman primates after convection-enhanced delivery to brain. Mol. Ther.16(7): 1267–1275. 2008.
Castle M.J., Perlson E., Holzbaur E.L., Wolfe J.H. Long-distance axonal transport of AAV9 is driven by dynein and kinesin-2 and is trafficked in a highly motile Rab7-positive compartment. Mol. Ther. 22(3): 554–566. 2014.
Vite C.H., Passini M.A., Haskins M.E., Wolfe J.H. Adeno-associated virus vector-mediated transduction in the cat brain. Gene Ther. 10(22): 1874–1881. 2003.
Hsiao C.D., Hsieh F.J., Tsai H.J. Enhanced expression and stable transmission of transgenes flanked by inverted terminal repeats from adeno-associated virus in zebrafish. Dev. Dyn. 220(4): 323–336. 2001.
Tervo D.G., Hwang B.Y., Viswanathan S., Gaj T., Lavzin M., Ritola K.D., Lindo S., Michael S., Kuleshova E., Ojala D., Huang C.C., Gerfen C.R., Schiller J., Dudman J.T., Hantman A.W., Looger L.L., Schaffer D.V., Karpova A.Y. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 92(2): 372–382. 2016.
Salegio E.A., Kells A.P., Richardson R.M., Hadaczek P., Forsayeth J., Bringas J., Sardi S.P., Passini M.A., Shihabuddin L.S., Cheng S.H., Fiandaca M.S., Bankiewicz K.S. Magnetic resonance imaging-guided delivery of adeno-associated virus type 2 to the primate brain for the treatment of lysosomal storage disorders. Hum. Gene Ther. 21(9): 1093–1103. 2010.
Kaemmerer W.F., Reddy R.G., Warlick C.A., Hartung S.D., McIvor R.S., Low W.C. In vivo transduction of cerebellar Purkinje cells using adeno-associated virus vectors. Mol. Ther. 2(5): 446–457. 2000.
Matsuzaki Y., Konno A., Mukai R., Honda F., Hirato M., Yoshimoto Y., Hirai H. Transduction Profile of the Marmoset Central Nervous System Using Adeno-Associated Virus Serotype 9 Vectors. Mol. Neurobiol. 54(3): 1745–1758. 2017
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


