Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 11, стр. 1340-1349
Преэклампсия, фиброз и маринобуфагенин
Н. И. Агалакова 1, В. А. Резник 2, Н. И. Колодкин 3, Н. И. Тапильская 4, А. Я. Багров 1, *
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 Санкт-Петербургский государственный педиатрический медицинский университет
Санкт-Петербург, Россия
3 Государственный научно-исследовательский институт особо чистых биопрепаратов
Санкт-Петербург,, Россия
4 НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта
Санкт-Петербург, Россия
* E-mail: aybagrov@gmail.com
Поступила в редакцию 19.04.2020
После доработки 12.07.2020
Принята к публикации 05.09.2020
Аннотация
Преэклампсия – это возникающее во время беременности и затрагивающее несколько систем органов потенциально опасное для жизни заболевание, которое характеризуется повышенным артериальным давлением матери и появлением белка в моче. Частота преэклампсии (3–7%) не снижается, и это заболевание по-прежнему занимает ведущее положение среди осложнений беременности. В этой статье мы представляем “фиброзную концепцию” патогенеза преэклампсии, которая включает в себя систему “Na/К-АТФаза-эндогенные ингибиторы” и, в том числе, маринобуфагенин-зависимое угнетение фактора транскрипции Fli1. Новый подход к лечению преэклампсии включает в себя иммунонейтрализацию эндогенного маринобуфагенина.
Нарушение способности почек выводить ионы натрия является одной из причин развития солечувствительной артериальной гипертензии [1]. Повышение артериального давления в ответ на увеличение потребления хлорида натрия может опосредоваться различными регуляторными системами, в частности, за счет угнетения Na/K-АТФазы в гладкомышечных клетках сосудов эндогенным ингибитором дигиталис-подобной природы [2]. deWardener и соавт., основываясь на многочисленных экспериментальных данных, пришли к заключению, что этим гуморальным медиатором солечувствительной гипертонии является эндогенное вещество с натрийуретической и вазопрессорной активностью [3]. Кардиотонические стероиды (КС), способные подавлять активность Na/K-АТФазы, являются эндогенными физиологическими регуляторами натрийуреза, играющими основную роль в регуляции натриевого насоса в проксимальных почечных канальцах и восходящем сегменте петли Генле [4]. Действительно, у больных и у экспериментальных животных с различными формами артериальной гипертензии концентрация КС в плазме крови коррелирует с показателями артериального давления [3, 5].
Одними из претендентов на роль натрийуретического гормона среди КС являются буфадиенолиды. КС буфадиенолидной природы отличаются от карденолидов, к которым относится оуабаин, наличием дважды ненасыщенного шестичленного лактонного кольца (рис. 1). На протяжении нескольких десятилетий было известно, что некоторые представители класса земноводных, в частности, жабы Bufo marinus могут производить стероиды группы буфадиенолидов [5]. Эндогенный уровень буфадиенолидов у жаб возрастает при миграции из засушливых мест обитания в районы с повышенной влажностью [6]. Принимая во внимание тот факт, что кожа земноводных является важнейшим органом, участвующим в регуляции водно-солевого баланса, было выдвинуто предположение о том, что “натриевый насос” и буфадиенолиды являются регуляторным механизмом транспорта натрия через кожу [7]. Было показано, что уровень буфадиенолидов в мозге и коже жаб Bufo marinus увеличивается при увеличении содержания натрия в окружающей среде [7] и что у земноводных буфадиенолиды представляют собой натрий-экскреторный гормон – эндогенный дигиталисподобный ингибитор Na/K-АТФазы [6]. Было предположено существование эндогенных буфадиенолидов у млекопитающих. Первыми продемонстрировали присутствие буфалин-иммуннореактивных веществ у человека Kieval и соавт. [8] и Goto и соавт. [9]. Вскоре из мочи больных инфарктом миокарда был выделен гормон, по своим масс-спектральным характеристикам неотличимый от маринобуфагенина (МБГ) амфибий [10], а моноклональные антитела к МБГ взаимодействовали с эндогенным ингибитором Na/K-АТФазы in vitro и in vivo [11]. Несколько позже было показано, что МБГ синтезируется клетками коры надпочечников и плаценты путем трансформации желчных кислот цитохромом P450, CYP27A1 [12]. МБГ селективно взаимодействует с α-1 изоформой Na/K-АТФазы, основной изоформой фермента в почках и сосудах, вследствие чего этот стероид является вазоконстриктором и обладает натрийуретической активностью [13, 14]. Содержание МБГ в плазме крови возрастает при задержке натрия и увеличении объема циркулирующей крови, например, у больных артериальной гипертензией и хронической почечной недостаточностью, а также при застойной сердечной недостаточности [15–17].
КАРДИОТОНИЧЕСКИЕ СТЕРОИДЫ, БЕРЕМЕННОСТЬ И ПРЕЭКЛАМПСИЯ
Артериальная гипертензия является одним из наиболее распространенных осложнений (примерно 6–8%) беременности [18]. Диагноз преэклампсии (ПЭ) ставят по сочетанию артериальной гипертензии [19] (артериальное давление ≥140/90 мм рт. ст., выявленное в двух измерениях, проведенных с интервалом ≥6 ч [18]), протеинурии (наличие белка в моче ≥0.3 г/л в суточной пробе или в двух пробах, взятых с интервалом 6 ч), и генерализованных отеков [20]. Патофизиологические механизмы ПЭ многочисленны и включают в себя окислительный стресс, образование КС в плаценте и инсулинорезистентность [21, 22]. Во время ПЭ спиральные артерии плаценты теряют свои эластические свойства, что в конечном итоге приводит к снижению перфузии плаценты [23].
Поскольку нормально протекающая беременность сопровождается задержкой жидкости и позитивным балансом натрия в организме [24, 25], интерес к КС при беременности возник вскоре после их открытия. Graves и соавт. показали, что уровень дигоксиноподобной иммунореактивности умеренно повышается при здоровой беременности и существенно увеличивается при гестационной гипертензии [26, 27]. На основании этих наблюдений авторами было высказано предположение о том, что избыточный синтез КС может являться одним из факторов патогенеза ПЭ [26, 27]. В течение нескольких последующих лет данные Graves и соавт. нашли свое подтверждение в работах других клиницистов [28, 29].
Убедительные данные, свидетельствующие о вкладе КС в патогенез ПЭ, были получены в экспериментальных и клинических исследованиях, проведенных с использованием препарата Digibind, который представляет собой лиофилизированные Fab фрагменты аффинно-очищенных овечьих анти-дигоксиновых антител [31, 32]. Digibind обладает перекрестной иммунореактивностью с несколькими КС [33], и его введение вызывает снижение артериального давления у крыс с объем-зависимой гипертензией и повышением концентрации КС в плазме крови [34]. При беременности местом синтеза КС является плацента [35]. Di Grande и соавт. показали, что Digibind в концентрации 130 мкг/мл вызывает достоверное снижение тонуса сосудов в перфузируемых плацентах, полученных от беременных женщин с ПЭ [36]. Armler и соавт. обнаружили, что развитие ПЭ сопровождается существенным увеличением чувствительности плацентарной Na/K-АТФазы к препаратам дигиталиса [37]. Примечательно, что именно в плацентарных клетках JEG-3 МБГ синтезируется с помощью фермента CYP27A1 из желчных кислот [12].
Данные клинических исследований свидетельствуют в пользу того, что одним из механизмов патогенеза ПЭ является избыточная продукция МБГ [38]. Так, Lopatin и соавт. показали, что у беременных пациенток с тяжелой ПЭ (артериальное давление 161 ± 5/104 ± 3 мм рт. ст.) концентрация МБГ в плазме крови была повышена в 5 раз по сравнению с таковой у женщин с неосложненной беременностью [39]. Позже было показано, что развитие ПЭ средней тяжести (артериальное давление 149 ± 3/93 ± 3 мм рт. ст.) сопровождалось двукратным увеличением уровня МБГ в плазме крови [40]. Повышение концентрации МБГ при ПЭ средней тяжести сопровождалось 50%-ным угнетением активности Na/K-АТФазы в эритроцитах, а антитела к МБГ в отличие от антител к оуабаину восстанавливали активность фермента ex vivo [40]. Эти наблюдения свидетельствуют о том, что МБГ может являться фактором, ответственным за подавление активности Na/K-АТФазы при ПЭ, а также маркером тяжести этого синдрома. В экспериментах in vitro МБГ в патофизиологически значимом диапазоне концентраций (1–3 нмоль/л) вызывал 25%-ное ингибирование Na/K-АТФазы и запускал сокращения изолированных колец брыжеечных артерий человека [39]. Таким образом, уровни МБГ in vivo, наблюдаемые у пациентов с ПЭ, способны повышать сосудистый тонус и существенно ингибировать Na/K-АТФазу [39].
ПРЕЭКЛАМПСИЯ И ФИБРОЗ
В 1935–1936 гг. было предположено, что фиброз является результатом снижения кровотока ворсин плода; такое снижение может быть связано с изменениями в стволовых артериях плода или с сужением артериол ворсин [41]. В более поздних работах было показано, что женщины, которые перенесли ПЭ, чаще страдают гипертонией, ишемической болезнью сердца и инсультами в дальнейшей жизни [41, 42]. Таким образом, ПЭ является не только осложнением беременности, но может свидетельствовать о предрасположенности к развитию сердечно-сосудистых заболеваний на протяжении всей жизни [43]. Эти явления, влияющие друг на друга, связаны с ремоделированием миокарда и сосудов, приводящим наряду с другими процессами к отложению коллагена и потере способности сосудов к расслаблению [43, 44].
Недавно было показано, что наномолярные концентрации МБГ стимулируют синтез коллагена и индуцируют фиброз в тканях сердечно-сосудистой системы и в почках [45]. Одним из механизмов, лежащих в основе профибротического эффекта МБГ, является изменение активности Fli1, ядерного фактора транскрипции и негативного регулятора синтеза коллагена-1 (рис. 2) [45, 46]. EGFR-Src-зависимое и обусловленное PKC-δ фосфорилированием снижение концентрации Fli1 приводит к стимуляции синтеза проколлагена и коллагена-1 в тканях [45]. В ходе экспериментов было показано, что КС повышают синтез коллагена в культуре фибробластов вследствие активации сигнальной функции комплекса МБГ-Na/K-АТФаза, отличной от классической насосной функции натриевого насоса [45, 47]. Введение МБГ in vivo крысам в концентрации, наблюдаемой в плазме крови при почечной недостаточности, вызывало развитие фиброза миокарда [45]. Развитие фиброза сопровождалось активацией сигнального пути, опосредованного Na/К-АТФазой, что подтверждалось увеличением Src и фосфорилированием митоген-активириуемой протеинкиназы (MAPK) в миокарде [45].
Рис. 2.
Схема Fli 1-зависимой сигнализации. МBG–PKCδ – Fli1-проколлаген-коллаген-1 основной путь стимуляции фиброгенеза при ПЭ в отличие от TGFβ–SMAD2/3 пути, который играет роль при гипертензии и сахарном диабете. Fig. 2. Scheme of Fli1-dependent signaling. MBG, acting via stimulation of PKCδ and phosphorylation of Fli1, causes liberation of procollagen from promoter and formation of collagen-1. Unlike MBG signaling in hypertension and diabetes TGFβ-SMAD2/3 is not involved.
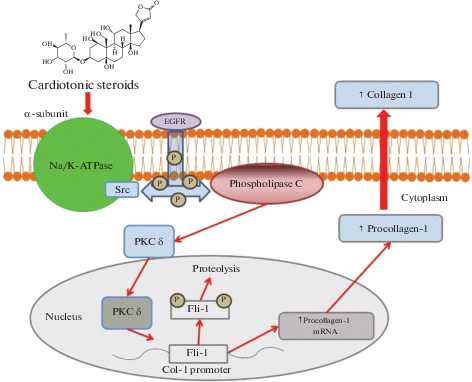
Недавние исследования показали, что Na/K-АТФаза может генерировать внутриклеточную сигнализацию, которая приводит к потере эластичности и фиброзу сосудов [45, 48,]. Низкие концентрации КС, действуя на одну из изоформ PKC – РКСδ, индуцируют ингибирование Fli1 и вызывают увеличение экспрессии коллагена-1, который является ключевым фактором фиброза в кровеносных сосудах, миокарде и почках [45, 49]. Схема развития МБГ-индуцированного фиброза представлена на рис. 2. Необходимо помнить, что помимо описанного механизма профиброзного действия МБГ также способен стимулировать синтез коллагена путем активации факторов TGFβ – SMAD2/3 [50] Кроме того, предполагается, что кровеносные сосуды, подвергшиеся негативному воздействию факторов ПЭ, впоследствии проявляют большую чувствительность к повреждениям, несмотря на исчезновение симптомов ПЭ после родоразрешения [51].
ЛЕЧЕНИЕ ПРЕЭКЛАМПСИИ АНТИТЕЛАМИ К КАРДИОТОНИЧЕСКИМ СТЕРОИДАМ
Идея иммунонейтрализации КС у больных с ПЭ не нова. Сходство структуры карденолидов (дигоксин, оубаин) и буфадиенолидов позволило клинически использовать поликлональные антитела против дигоксина (Digibind) при лечении ПЭ [52, 53]. Digibind и Digifab уже много лет используются для лечения интоксикации дигоксином [54]. В течение последних 20 лет дигоксин-специфичные Fab-фрагменты (Digibind) успешно применялись при отравлении буфадиенолидами жаб и показали свою эффективность у лабораторных животных [55] и человека [56]. Было показано, что Digibind вызывает снижение артериального давления у животных с гипертензией и повышенным уровнем эндогенного дигоксиноподобного фактора [57]. Digibind демонстрирует перекрестную реактивность с буфадиенолидами и карденолидами [58]. В модели ПЭ у крыс лечение Digibind приводило к снижению артериального давления и протеинурии [59]. В клиническом исследовании было показано, что терапия антителами Digibind предотвращает снижение функции почек при тяжелой ПЭ путем нейтрализации КС [52]. В 1988 г. Goodlin сообщил о стойком снижении артериального давления у беременной с ПЭ, развившейся на 26-й неделе беременности, после двукратного внутривенного введения Digibind в дозе 0.087 мг/кг [30]. Adair и соавт. в 1996 г. добились снижения артериального давления у пациентки с ПЭ на фоне комбинации однократного внутривенного введения 5 мг Digibind и 24-часовой инфузии препарата (1 мг в час) [60]. Несколько позже эффективность Digibind была подтверждена в двойном слепом плацебо-контролируемом исследовании на 13 больных с ПЭ, развившейся post partum [61]. Примечательно, что в вышеперечисленных исследованиях Digibind не вызывал у пациентов никаких побочных эффектов. В 2007 г. было завершено многоцентровое двойное слепое плацебо-контролируемое исследование эффективности Digibind у больных с тяжелой ПЭ, которое показало, что Digibind приводит к существенному повышению клиренса креатинина и снижению риска отека легких по сравнению с нелеченными больными [62]. Однако в 2011 г. производство Digibind было прекращено, и единственным препаратом антител к дигоксину, зарегистрированным Администрацией по контролю качества лекарственных препаратов и продуктов питания США (Food and Drug Administration), является Digifab (BTG International Ltd., Великобритания). Сравнительное исследование Digifab и Digibind показало, что они имеют сравнимую кросс-реактивность с КС, а у пациенток с ПЭ увеличение содержания иммунореактивности к МБГ было идентичным как для Digifab, так и для D-igibind, и оба препарата антител восстанавливали активность Na/K-АТФазы [63].
Недавно было показано, что ткани пупочных артерий, полученных от беременных женщин, страдающих ПЭ, содержали большее количество коллагена, экспрессировали меньше Fli1 и обладали более низкой чувствительностью к релаксирующему действию нитропруссида натрия [64, 65]. Ранее было показано, что уровень МБГ повышается в плазме пациенток с ПЭ, параллельно развивалось угнетение Na/К-АТФазы в эритроцитах [11, 58]. Антитела к МБГ ex vivo полностью устраняли ингибирование Na/К-АТФазы [11, 58]. У беременных крыс с экспериментальной ПЭ, индуцированной потреблением воды с избыточным содержанием NaCl, увеличение содержания МБГ сопровождалось развитием типичных симптомов ПЭ, включая повышение артериального давления, протеинурию, уменьшение массы и размера плодов [11]. На этой модели иммунонейтрализация МБГ in vivo с помощью поли- и моноклональных антител оказывала антигипертензивный эффект, связанный с восстановлением активности Na/К-АТФазы в сосудах [11]. В недавнем исследовании было показано, что как в плаценте, так и в пупочных артериях пациенток с ПЭ уровень Fli-1 в плаценте был значительно ниже, а содержание коллагена-1 повышалось по сравнению с таковыми в тканях, полученных от женщин с неосложненной беременностью [66, 67]. Последующая инкубация эксплантов таких пупочных артерий с антителами против МБГ приводила к значительному снижению содержания коллагена-1 [67]. Когда здоровые человеческие артерии пуповины были в течение 24 ч инкубированы в присутствии низких концентраций МБГ, экспрессия Fli1 снижалась, уровень PKC-δ нарастал, а содержание проколлагена-1 увеличивалось в шесть раз [64, 67]. В недавнем исследовании было показано, что введение гуманизированных моноклональных антител к МБГ активирует фосфорилирование белка p38 в клетках цитотрофобласта, что указывает на возможное терапевтическое действие этих антител [68]. Таким образом, при ПЭ повышенный уровень МБГ через Fli1-зависимый механизм стимулирует синтез коллагена в артериях пуповины, что приводит к нарушению вазорелаксации и является причиной сосудистой жесткости при этом синдроме.
Иммунонейтрализация МБГ может стать новым и эффективным направлением в лечении ПЭ и дальнейшей профилактике ее осложнений. В то же время остается открытым вопрос, почему лечение ПЭ нейтрализующими КС антителами не является широко распространенным методом и до настоящего времени ни Digibind, ни Digifab не включены в перечень средств, показанных к применению при ПЭ. Дело в том, что оба препарата представляют собой Fab фрагменты аффинно-очищенных антител к дигоксину, и они никогда не проходили серьезную оценку как антитела, обладающие способностью к связыванию буфадиенолидов. Например, аффинность антител Digibind к дигоксину варьировала в пределах 0.1–50 нмоль/л [69–72 ], что, на наш взгляд, отражало их поликлональную природу. МБГ является веществом, выделенным из тканей млекопитающих [38], его биосинтетический путь достаточно подробно охарактеризован [12], и к нему были произведены специфические моноклональные антитела 4G4 и 3E9 [11]. Наборы, основанные на поликлональных антителах к МБГ, измеряли уровень этого стероида в норме у крыс и человека в очень широком диапазоне концентраций – 0.5–100 нмоль/л – в 200 раз [10, 15, 69, 70], в то время как моноклональные антитела 4G4 – в диапазоне 0.2–0.4 нмоль/л, то есть в допустимых пределах [11]. Таким образом, есть все основания полагать, что иммунонейтрализация МБГ моноклональными антителами станет общепринятым подходом к терапии ПЭ, а Fli1-зависимый механизм синтеза коллагена в артериях пуповины является механизмом патогенеза ПЭ.
Список литературы
Blaustein M.P. Sodium ions, calcium ions, blood pressure regulation and hypertension: a reassessment and a hypothesis. Am. J. Physiol. 232: C167–C173. 1977.
Buckalew V.M. Jr., Nelson D.B. Natriuretic and sodium transport inhibitory activity in plasma of volume-expanded dogs. Kidney Int. 5: 12–22. 1974.
De Wardener H.E., Clarkson E.N. A concept of natriuretic hormone. Physiol. Rev. 65: 658–759. 1985.
Bailly C. Effect of luminal atrial natriuretic peptide on chloride reabsorption in mouse cortical thick ascending limb: inhibition by endothelin. J. Am. Soc. Nephrol. 11: 1791–1797. 2000.
Bagrov A.Y., Shapiro J.I. Endogenous digitalis: pathophysiologic roles and therapeutic applications. Nature Clin. Pract. Nephrol. 4: 378–392. 2008.
Flier J., Edwards M.W., Daly J.W., Myers C.W. Widespread occurrence in frogs and toads of skin compounds interacting with the ouabain site of Na+,K+-ATPase. Science. 208(4443): 503-505. 1980.
Morris J.F., Ismail-Beigi F., Butler V.P. Jr., Gati I., Lichtstein D. Ouabain-sensitive Na+,K(+)-ATPase activity in toad brain. Comp. Biochem. Physiol. A Physiol. 18: 599–606. 1997.
Kieval R.S., Butler V.P. Jr., Derguini F., Bruening R.C., Rosen M.R. Cellular electrophysiologic effects of vertebrate digitalis-like substances. J. Am. Coll. Cardiol. 11: 637–643. 1988.
Goto A., Yamada K., Ishii M., Sugimoto T., Yoshioka M. Immunoreactivity of endogenous digitalis-like factors. Biochem. Pharmacol. 41: 1261–1263. 1991.
Bagrov A.Y., Fedorova O.V., Dmitrieva R.I., Howald W.N., Hunter A.P., Kuznetsova E.A., Shpen V.M. Bufodienolide nature of endogenous inhibitor of Na/K ATPase in the urine from patients with acute myocardial infarction. Hypertension. 31: 1097–1103. 1998.
Fedorova O.V., Simbirtsev A.S., Kolodkin N.I., Kotov A.Y., Agalakova N.I., Kashkin V.A., Tapilskaya N.I., Bzhelyansky A., Reznik V.A., Frolova E.V., Nikitina E.R., Budny G.V, Longo D.L., Lakatta E.G., Bagrov A.Y. Monoclonal antibody to an endogenous bufadienolide, marinobufagenin, reverses preeclampsia-induced Na/K-ATPase inhibition and lowers blood pressure in NaCl-sensitive hypertension. J. Hypertens. 26: 2414–2425. 2008.
Fedorova O.V., Zernetkina V.I., Shilova V.Y., Grigorova Y.N., Juhasz O., Wei W., Marshall C.A., Lakatta E.G., Bagrov A.Y. Synthesis of an endogenous steroidal Na pump inhibitor marinobufagenin, implicated in human cardiovascular diseases, is initiated by CYP27A1 via bile acid pathway. Circulation: Cardiovasc. Genetics. 8: 736–745. 2015.
Fedorova O.V., Bagrov A.Y. Inhibition of Na/K ATPase from rat aorta by two endogenous Na/K pump inhibitors, ouabain and marinobufagenin. Evidence of interaction with different alpha-subinit isoforms. Am. J. Hypertens. 10: 929–935. 1997.
Bagrov A.Y., Fedorova O.V. Effects of two putative endogenous digitalis-like factors, marinobufagenin and ouabain, on the Na/K pump in human mesenteric arteries. J. Hypertens. 16: 1953–1958. 1998.
Fridman A.I., Matveev S.A., Agalakova N.I., Fedorova O.V., Lakatta E.G., Bagrov A.Y. Marinobufagenin, an endogenous ligand of alfa-1 Na/K-ATPase, is a marker of congestive heart failure severity. J. Hypertens. 20: 1189–1194. 2002.
Kolmakova E.V., Haller S.T., Kennedy D.J., Isachkina A.N., Budny G.V., Frolova E.V., Nikitina E.R., Piecha G., Malhotra D., Fedorova O.V., Shapiro J.I., Bagrov A.Y. Endogenous cardiotonic steroids in chronic renal failure. Nephrol. Dial. Transplantat. 26: 2912-2919. 2011.
Bagrov A.Y., Shapiro J.I., Fedorova O.V. Endogenous cardiotonic steroids: physiology, pharmacology and novel therapeutic targets. Pharmacol. Rev. 61: 9–38. 2009.
MacKay A.P., Berg C.J., Atrash H.K. Pregnancy-related mortality from preeclampsia and eclampsia. Obstet. Gynecol. 97: 533–538. 2001.
Sibai B., Dekker G., Kupferminc M. Pre-eclampsia. Lancet. 365: 785–799. 2005.
Thangaratinam S., Coomarasamy A., O’Mahony F., Sharp S., Zamora J., Khan K.S., Ismail K.M.K. Estimation of proteinuria as a predictor of complications of pre-eclampsia: a systematic review. BMC Med. 7: 10. 2009.
Wagner S.J., Craici I.M., Grande J.P., Garovic V.D. From placenta to podocyte: vascular and podocyte pathophysiology in preeclampsia. Clin. Nephrol. 78: 241–249. 2012.
Herse F., LaMarca B. Angiotensin II type 1 receptor autoantibody (AT1-AA)-mediated pregnancy hypertension. Am. J. Reprod. Immunol. 69: 413–418. 2013.
Meekins J.W., Pijnenborg R., Hanssens M., McFadyen I.R., van Asshe A. A study of placental bed spiral arteries and trophoblast invasion in normal and severe pre-eclamptic pregnancies. Br. J. Obstet. Gynaecol. 101: 669–674. 1994.
Gallery E.D.M., Hunyor S.M., Gyory A.Z. Plasma volume concentration: a significant factor in both pregnancy-associated hypertension (pre-eclampsia) and chronic hypertension in pregnancy. Q J Med. 192: 593–602. 1979.
Masilamani S., Baylis C. Pregnant rats are refractory to the natriuretic actions of ANP. Am. J. Physiol. 267: R1611–R1616. 1994.
Graves S.W. The possible role of digitalislike factors in pregnancy-induced hypertension. Hypertension. 10: 184–186. 1987.
Graves S.W., Valdes R. Jr., Brown B.A., Knight A.B., Craig H.R. Endogenous digoxin-immunoreactive substance in human pregnancies. J. Clin. Endocrinol. Metab. 58: 748–751. 1984.
Poston L., Morris J.F., Wolfe C.D., Hilton P.J. Serum digoxin-like substances in pregnancy-induced hypertension. Clin. Sci. (Lond). 77: 189–194. 1989.
Gilson G.J., Graves S.W., Qualls C.R., Curet L.B. Digoxin-like immunoreactive substance and sodium-potassium-adenosine triphosphatase inhibition in normal pregnancy: a longitudinal study. Obstet. Gynecol. 89: 743–746. 1997.
Goodlin R.C. Antidigoxin antibodies in eclampsia. New Engl. J. Med. 318: 518–519. 1988.
Kaminski K., Rechberger T. Concentration of digoxin-like immunoreactive substance in patients with preeclampsia and its relation to severity of pregnancy-induced hypertension. Am. J. Obstet. Gynecol. 165: 733–736, 1991.
Ujhelyi M.R., Robert S., Cummings D.M., Colucci R.D., Green P.J., Sailstad J., Vlasses P.H., Zarowitz B.J. Influence of digoxin immune Fab therapy and renal dysfunction on the disposition of total and free digoxin. Ann. Intern. Med. 119: 273–277. 1993.
Yamada K., Goto A., Hui C., Yagi N., Sugimoto T. Effects of the Fab fragment of digoxin antibody on the natriuresis and increase in blood pressure induced by intracerebroventricular infusion of hypertonic saline solution in rats. Clin. Sci. (Lond). 82: 625–630. 1992.
Krep H., Price D.A., Soszynski P., Tao Q.F., Graves S.W., Hollenberg N.K. Volume sensitive hypertension and the digoxin-like factor. Reversal by a Fab directed against digoxin in DOCA-salt hypertensive rats. Am. J. Hypertens. 8: 921–927. 1995.
Morris J.F., Poston L., Wolfe C.D., Hilton P.J. A comparison of endogenous digoxin-like immunoreactivity and sodium transport inhibitory activity in umbilical arterial and venous serum. Clin. Sci. (Lond). 75: 577–579. 1988.
Di Grande A., Boura A.L., Read M.A., Malatino L.S., Walters W.A. Release of a substance from the human placenta having digoxin-like immunoreactivity. Clin. Exp. Pharmacol. Physiol. 20: 603–607. 1993.
Armler E., Cester N., Salvolini E., Staffolani R., Burkhard M., Mazzanti L., Kotyk A., Romanini C. Human hypertensive placenta contains an increased amount of Na,K-ATPase with higher affinity for cardiac glycosides. Cell Biol. Int. 18: 723–727. 1994.
Bagrov A.Y., Shapiro J.I., Fedorova O.V. Endogenous cardiotonic steroids: physiology, pharmacology, and novel therapeutic targets. Pharmacol. Rev. 61: 9–38. 2009.
Lopatin D.A., Ailamazian E.K., Dmitrieva R.I., Shpen V.M., Fedorova O.V., Doris P.A., Bagrov A.Y. Circulating bufodienolide and cardenolide sodium pump inhibitors in preeclampsia. J. Hypertens. 17: 1179–1187. 1999.
Averina I.V., Tapilskaya N.I., Reznik V.A., Frolova E.V., Fedorova O.V., Lakatta E.G., Bagrov A.Y. Endogenous Na/K-ATPase inhibitors in patients with preeclampsia. Cell. Mol. Biol. (Noisy-le-grand) 52: 19–23. 2006.
Fox H. Fibrosis of placental villi. J. Pathol. Bacteriol. 95: 573–579. 1968.
Hausvater A., Giannone T., Sandoval Y.H., Doonan R.J., Antonopoulos C.N., Matsoukis I.L., Petridou E.T., Daskalopoulou S.S. The association between preeclampsia and arterial stiffness. J. Hypertens. 30: 17–33. 2012.
Orabona R., Sciatti E., Vizzardi E., Bonadei I., Valcamonico A., Metra M., Frusca T. Endothelial dysfunction and vascular stiffness in women with previous pregnancy complicated by early or late pre-eclampsia. Ultrasound Obstet. Gynecol. 49: 116–123. 2017.
Trojanowska M. Cellular and molecular aspects of vascular dysfunction in systemic sclerosis. Nat. Rev. Rheumatol. 6: 453–460. 2010.
Elkareh J., Kennedy D.J., Yashaswi B., Vetteth S., Shidyak A., Kim E.G., Smaili S., Periyasamy S.M., Hariri I.M., Fedorova L., Liu J., Wu L., Kahaleh M.B., Xie Z., Malhotra D., Fedorova O.V., Kashkin V.A., Bagrov A.Y., Shapiro J.I. Marinobufagenin stimulates fibroblast collagen production and causes fibrosis in experimental uremic cardiomyopathy. Hypertension. 49: 215–224. 2007.
Elkareh J., Periyasamy S.M., Shidyak A., Vetteth S., Schroeder J., Raju V., Hariri I.M., El-Okdi N., Gupta S., Fedorova L., Liu J., Fedorova O.V., Kahaleh M.B., Xie Z., Malhotra D., Watson D.K, Bagrov A.Y., Shapiro J.I. Marinobufagenin induces increases in procollagen expression in a process involving protein kinase C and Fli-1: implications for uremic cardiomyopathy. Am. J. Physiol. Renal Physiol. 296: F1219–F1226. 2009.
Nikitina E.R., Mikhailov A.V., Nikandrova E.S., Frolova E.V., Fadeev A.V., Shman V.V., Shilova V.Y., Tapilskaya N.I., Shapiro J.I, Fedorova O.V., Bagrov A.Y. In preeclampsia endogenous cardiotonic steroids induce vascular fibrosis and impair relaxation of umbilical arteries. J. Hypertens. 29: 769–776. 2011.
Orabona R., Sciatti E., Vizzardi E., Bonadei I., Prefumo F., Valcamonico A., Metra M., Frusca T. Ultrasound evaluation of left ventricular and aortic fibrosis after pre-eclampsia. Ultrasound Obstet. Gynecol. 52: 648-653. 2018.
Fedorova O.V., Emelianov I.V., Bagrov K.A., Grigorova Y.N., Wei W., Juhasz O., Frolova E.V., Marshall C.A., Lakatta E.G., Konradi A.O., Bagrov A.Y. Marinobufagenin-induced vascular fibrosis is a likely target for mineralocorticoid antagonists. J. Hypertens. 33: 1602-1610. 2015.
Zhang Y., Wei W., Shilova V., Petrashevskaya N.N., Zernetkina V.I., Grigorova Y.N., Marshall C.A., Fenner R.C., Lehrmann E., Wood W.H. 3rd, Becker K.G., Lakatta E.G., Bagrov A.Y., Fedorova O.V. Monoclonal antibody to marinobufagenin downregulates TGFβ profibrotic signaling in left ventricle and kidney and reduces tissue remodeling in salt-sensitive hypertension. J. Am. Heart Assoc. 8: e012138. 2019.
Pruthi D., Khankin E.V., Blanton R.M., Aronovitz M., Burke S.D., McCurley A., Karumanchi S.A., Jaffe I.Z. Exposure to experimental preeclampsia in mice enhances the vascular response to future injury. Hypertension. 65: 863–870. 2015.
Adair C.D., Buckalew V.M., Graves S.W., Lam G.K., Johnson D.D., Saade G., Lewis D.F., Robinson C., Danoff T.M., Chauhan N., Hopoate-Sitake M., Porter K.B., Humphrey R.G, Trofatter K.F., Amon E., Ward S., Kennedy L., Mason L., Johnston J.A. Digoxin immune Fab treatment for severe preeclampsia. Am. J. Perinatol. 27: 655–662. 2010.
Adair C.D., Buckalew V., Taylor K., Ernest J.M., Frye A.H., Evans C., Veille J.C. Elevated endoxin-like factor complicating a multifetal second trimester pregnancy: treatment with digoxin-binding immunoglobulin. Am. J. Nephrol. 16: 529–531. 1996.
Krep H., Price D.A., Soszynski P., Tao Q-F., Graves S.W., Hollenberg N.K. Volume sensitive hypertension and the digoxin-like factor reversal by a fab directed against digoxin in DOCA-salt hypertensive rats. Am. J. Hypertens. 8: 921–927. 1995.
Chen K.K., Kovarikova A. Pharmacology and toxicology of toad venom. J. Pharm. Sci. 56: 1535–1541. 1967.
Hitt M., Ettinger D.D. Toad toxicity. New Eng. J. Med. 314: 1517–1518. 1986.
Brubacher J.R., Lachmanen D., Ravikumar P.R., Hoffman R.S. Efficacy of digoxin specific Fab fragments (Digibind) in the treatment of toad venom poisoning. Toxicology. 37: 931–942. 1999.
Agunanne E., Horvat D., Uddin M.N., Puschett J. The Treatment of Preeclampsia in a Rat Model Employing Digibind. Am. J. Perinatol. 27: 299–305. 2010.
Ma J., Esplin M.S., Adair C.D., Mason L.A., Graves S.W. Increasing evidence for and regulation of a human placental endogenous digitalis-like factor. Reprod. Sci. 19: 437–448. 2012.
Adair D., Hinshaw A., Russell G., Rose J., Veille J., Buckalew V. Effects of Fab digoxin-specific antibodies on mean arterial pressure in severe preeclampsia. Am. J. Hypertens. 10: 11A. 1997.
Hopoate-Sitake M., Adair C.D., Buckalew V.M., Johnson D.D., Lewis D.F., Robinson C.J., Saade G.R., Graves S.W. Digoxin antibody fragment, antigen binding (Fab), treatment of preeclampsia in women with endogenous digitalis-like factor: a secondary analysis of the DEEP Trial. Am. J. Obstet. Gynecol. 209: 119.e1-6. 2013.
Ishkaraeva-Yakovleva V.V., Fedorova O.V., Solodovnikova N.G., Frolova E.V., Bzhelyansky A.M., Emelyanov I.V., Adair C.D., Zazerskaya I.E., Bagrov A.Y. DigiFab interacts with endogenous cardiotonic steroids and reverses preeclampsia-induced Na/K-ATPase inhibition. Reprod. Sci. 19: 1260–1267. 2012.
Агалакова Н.И., Резник В.А., Надей О.В., Ершов И.А., Рассоха О.С., Васютина М.Л., Тапильская Н.И., Рухляда Н.Н., Галагудза М.М., Багров А.Я. Эндогенные кардиотонические стероиды и фиброз сосудов при преэклампсии. Артериальная гипертензия. 24: 684-692. 2018. [Agalakova N.I., Reznik V.A., Nadei O.V., Ershov I.A., Rassokha O.S., Vasyutina M.L., Tapilskaya N.I., Rukhliada N.N., Galagudza M.M., Bagrov A.Y. Endogenous cardiotonic steroids and vascular fibrosis in preeclampsia. Arterial Hypertension 24: 684–692. 2018. (In Russ)].
Fedorova O.V., Ishkaraeva V.V., Grigorova Y.N., Reznik V.A., Kolodkin N.I., Zazerskaya I.E., Zernetkina V., Agalakova N.I., Tapilskaya N.I., Adair C.D., Lakatta E.G., Bagrov A.Y. Antibody to Marinobufagenin Reverses Placenta-Induced Fibrosis of Umbilical Arteries in Preeclampsia. Int. J. Mol. Sci. 19: 2377. 2018.
Tihtonen K.M., Kööbi T.T., Uotila J.T. Arterial stiffness in preeclamptic and chronic hypertensive pregnancies. Eur. J. Obst. Gynecol. Reprod. Biol. 128: 180–186. 2006.
Agalakova N.I., Reznik V.A., Nadei O.V., Ershov I.A., Rassokha O.S., Vasyutina M.L., Ivanov D.O., Adair E.D., Galagudza M.M., Bagrov A.Y. Antibody against Na/K-ATPase inhibitor lowers blood pressure and increases vascular Fli1 in experimental preeclampsia. Am. J. Hypertens. 33: 514–519. 2020.
Uddin M.N., Wages J.M., Pantho A.F., Larrick J.W., Drever N., Allen S.R., Kuehl. TJ. Novel anti-MBG antibodies protect cytotrophoblast cells from a marinobufagenin-induced preeclampsia phenotype. Am. J. Obstet. Gynecol. 218: S199. 2018.
Pullen M.A., Harpel M.R, Danoff T.M., Brooks D.P. Comparison of non-digitalis binding properties of digoxin-specific Fabs using direct binding methods. J. Immunol. Methods. 31: 235–241. 2008.
Pullen M.A., Brooks D.P., Edwards R.M. Characterization of the neutralizing activity of digoxin-specific Fab toward ouabain-like steroids. J. Pharmacol. Exp. Ther. 310: 319–325. 2004.
Fedorova O.V., Tapilskaya N.I., Bzhelyansky A.M., Frolova E.V., Nikitina E.R., Reznik V.A., Kashkin V.A., Bagrov A.Y. Interaction of Digibind with endogenous cardiotonic steroids from preeclamptic placentae. J. Hypertens. 28: 361–366. 2010.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова



