Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 11, стр. 1350-1369
Иммуннологические и функциональные показатели крыс в модели принудительного плавания с применением потенциальных адаптогенов
Н. В. Гончаров 1, 2, *, Е. А. Корф 1, И. В. Кудрявцев 3, 4, М. К. Серебрякова 3, И. А. Добрылко 1, А. В. Новожилов 1, И. В. Миндукшев 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
2 НИИ гигиены, профпатологии и экологии человека
Ленинградская обл., пос. Кузьмоловский, Россия
3 Институт экспериментальной медицины
Санкт-Петербург, Россия
4 Дальневосточный федеральный университет
Владивосток, Россия
* E-mail: ngoncharov@gmail.com
Поступила в редакцию 30.07.2020
После доработки 07.09.2020
Принята к публикации 22.09.2020
Аннотация
Цель работы состояла в исследовании влияния разных доз двух соединений аммония, хлорида (ХА) и карбоната (КА), а также их сочетания с декофеинизированным экстрактом зеленого чая (ЭЗЧ) на иммунологические показатели периферической крови крыс при физической нагрузке высокой интенсивности. С использованием гематологического анализатора и проточного цитофлуориметра установлены изменения абсолютного и относительного количества гранулоцитов, лимфоцитов, естественных киллеров, наивных и зрелых эффекторных клеток, а также некоторых минорных фракций лимфоцитов через сутки после окончания цикла принудительного плавания. Иммунологические показатели сопоставлены с продолжительностью плавания в последний день нагрузки и со средней продолжительностью плавания за 4 дня предельной нагрузки. Выявленные изменения свидетельствуют о высокой адаптогенной эффективности ХА в дозе 20 мг/кг, поскольку животные этой группы показали высокие функциональные результаты и у них не найдено признаков дезадаптации и перенапряжения иммунитета. КА в дозе 10 мг/кг приводит к аналогичному повышению функциональных результатов, но это сопряжено с мобилизацией клеточного иммунитета крыс. Повышение дозы КА в два раза ведет к срыву адаптации. ЭЗЧ не способствует повышению физической работоспособности, однако оказывает позитивное влияние на состояние иммунной системы животных. Сочетание ЭЗЧ с солями аммония не приводит к существенному улучшению функциональных показателей и в целом негативно влияет на клеточный иммунитет животных группы ЭЗЧ + КА10, в меньшей степени – группы ЭЗЧ + ХА20.
Известно, что умеренные физические нагрузки положительно влияют на иммунитет, обеспечивая лучшую устойчивость к инфекциям и общий иммунологический надзор [1]. Однако физическая нагрузка высокой интенсивности оказывает негативное влияние на иммунные функции [2, 3]. Количество и функциональная активность циркулирующих клеток врожденного и приобретенного иммунитета могут существенно изменяться в зависимости от продолжительности и интенсивности тренировок, тогда как применение некоторых нутрицевтиков и растительных экстрактов способствует улучшению иммунных функций и повышению физических кондиций [4]. Экспериментальные исследования эффективности различных препаратов проводят чаще всего с использованием грызунов в моделях беговой и плавательной нагрузки [5]. Ранее мы показали, что применение декофеинизированного экстракта зеленого чая (ЭЗЧ) в модели принудительного плавания повышает выносливость крыс за счет дополнительного участия в работе медленных мышц, адаптация которых к нагрузке сопряжена с повышением экспрессии генов, ответственных за регуляцию баланса ионов Са2+ [6]. Сравнение ЭЗЧ и одного из эндогенных продуктов метаболизма аминокислот – аммиака, который в виде раствора хлорида аммония (ХА) был апробирован в самостоятельном виде и в сочетании с ЭЗЧ, позволило установить стимулирующий эффект ХА, превышающий действие ЭЗЧ [7]. Исследования ультраструктуры мышечных волокон m. soleus (SOL) и m. extensor digitorum longus (EDL) крыс после цикла принудительного плавания на фоне действия ЭЗЧ и двух разных солей аммония, хлорида или карбоната (КА) в дозе 10 мг/кг показали, что эффективность препаратов зависит, прежде всего, от адаптационных изменений Т-трубочек и митохондрий быстрых мышц, но она повышается при участии медленных мышечных волокон в структурно-функциональной адаптации к предельной физической нагрузке [8]. Сравнение разных доз (10 и 20 мг/кг) ХА и КА на продолжительность плавания и максимальный уровень лактата позволило установить более высокую эффективность ХА в дозе 20 мг/кг по сравнению с 10 мг/кг, тогда как эффективность КА в дозе 10 мг/кг примерно соответствовала эффективности ХА в дозе 20 мг/кг [9]. Из 16 измеренных биохимических показателей эритроцитов наибольшее количество достоверных отклонений от контрольных значений было выявлено у крыс, получавших ХА в дозах 20 и 10 мг/кг, наименьшее количество – у крыс, получавших КА в этих же дозах [10]. Сравнительный анализ уровней восстановленного глутатиона и 2,3-бисфосфоглицерата, активностей 5'-нуклеотидазы, Са- и Na/K-АТФаз свидетельствует о более строгом контроле механизма доставки кислорода в ткани крыс, получавших ХА в дозе 20 мг/кг [10]. По совокупности функциональных и биохимических показателей ХА в дозе 20 мг/кг обладал некоторым преимуществом перед КА в дозе 10 мг/кг, однако никакие выводы об эффективности и безопасности того или иного препарата без учета его влияния на состояние иммунной системы не могут считаться обоснованными. Кроме того, представляет интерес исследование сочетанного воздействия ЭЗЧ и солей аммония на адаптационные возможности организма и роль иммунной системы в механизмах адаптации к экстремальной физической нагрузке.
Цель данной работы – провести сравнительный анализ эффективности двух доз разных солей аммония, хлорида и карбоната, а также их сочетанного действия с ЭЗЧ на функциональные, гематологические и иммунологические показатели крыс через сутки после окончания цикла принудительного плавания.
МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты выполнены в соответствии с Правилами проведения работ с животными, утвержденными комиссией по этике Института эволюционной физиологии и биохимии им. И.М. Сеченова РАН. Подробно методика плавательной нагрузки была представлена ранее [7]. Коротко, крыс-самцов массой 200 ± 10 г предварительно адаптировали к воде в течение 5 дней. На 6-е сутки проводили тестирование с грузом, составлявшего 7% от массы тела. По результатам тестирования было сформировано 9 групп: 1-я – интактные животные (отрицательный контроль, n = 17); 2-я – положительный контроль: плавание и пероральное введение NaCl (физиологический раствор) в дозе 10 мг/кг (n = 12) за 5 мин до начала нагрузки; 3-я и 4-я группы –введение ХА в дозе 10 (n = 7) и 20 мг/кг (n = 19) соответственно за 5 мин до начала нагрузки; 5-я и 6-я группы –введение КА в дозе 10 (n = 20) и 20 мг/кг (n = 8) соответственно за 5 мин до начала нагрузки; 7-я группа (ЭЗЧ, n = 9) – введение перорально водного раствора препарата ЭЗЧ в дозе 12 мг/кг в пересчете на катехины за 2 ч до нагрузки и через 2 ч после окончания нагрузки (суточная доза катехинов 24 мг/кг); 8-я группа (ЭЗЧ + ХА, n = 8) – плавание на фоне введенного ЭЗЧ (доза и режим введения, как в 7-й группе) в сочетании с ХА (20 мг/кг за 5 мин до начала нагрузки); 9-я группа (ЭЗЧ + КА, n = 8) – плавание на фоне ЭЗЧ (доза и режим введения, как в 7-й группе) в сочетании с КА (10 мг/кг за 5 мин до начала нагрузки). Все препараты вводили, начиная со 2-й недели эксперимента. В течение пяти суток 2-й недели и шести суток 3-й недели эксперимента крыс подвергали нормированной нагрузке: общая продолжительность плавания составляла 50–60% от показателей тестирования. На шестые сутки 2-й недели эксперимента проводили промежуточное тестирование. В течение четырех дней 4-й недели эксперимента крыс ежедневно подвергали предельной нагрузке. Через сутки после последней нагрузки животных умерщвляли посредством декапитации, смешанную кровь собирали в гепаринизированные пробирки. Гематологический анализ выполняли на анализаторе Medonic M20 (Boule Medical AB, Швеция), подсчитывали лейкоциты (WBC), абсолютное и процентное содержание лимфоцитов (LYM), нейтрофилов (GRAN) и моноцитов (MON). Для выявления основных субпопуляций лимфоцитов периферической крови в пробирки 10 × 75 мм (Beckman Coulter, США) вносили по 50 мкл цельной крови, после чего образцы окрашивали препаратами антител, конъюгированных с различными флуорохромами (все антитела производства Biolegend, США). Для выявления основных субпопуляций лимфоцитов периферической крови использовали следующий набор антител: CD45-APC/Cy7, CD3-APC, CD4-PE/Cy7, CD8a-PerCP, CD161a-PE и CD45RA-FITC. Данная комбинация антител применялась для выделения общей популяции Т-лимфоцитов – клеток, экспрессирующих CD3 на своей поверхности, а также популяций Т-хелперов и цитотоксических Т-клеток, несущих на своей поверхности, помимо CD3, еще и CD4 или CD8a соответственно. В-клетки периферической крови определялись как CD3–CD45RA+, тогда как натуральные киллерные клетки (NК-клетки) обладали фенотипом CD3–CD161a+. Кроме того, определяли содержание NКТ-клеток – Т-лимфоцитов, коэкспрессировавших CD161a на своей поверхности (фенотип CD3+CD161a+). С использованием антител против CD44H, конъюгированных с FITC, и против CD62L, конъюгированных с РЕ, Т-хелперы и цитотоксические Т-клетки были разделены на следующие субпопуляции: “наивные” клетки с фенотипом CD44–CD62L+, клетки центральной памяти (CD44+CD62L+), клетки эффекторной памяти (CD44+CD62L–) и зрелые эффекторные клетки (CD44–CD62L–). Анализ образцов проводили на проточном цитофлуориметре Navios™ (Beckman Coulter, США), оснащенном двумя диодными лазерами 488 и 638 нм. Для каждого из образцов анализировали не менее 20 000 лимфоцитов. Математическую обработку цитофлуориметрических данных проводили при помощи программ Navios Software v.1.2 и Kaluza™ v.1.3 (Beckman Coulter, США).
Статистический анализ. Рассчитывали средние значения, медианы, квартили Q1–Q3. Для оценки значимости различий между группами использовали критерий Краскела–Уоллиса. Уровень корреляции рассчитывали по Спирмену (значение rho, 2-сторонняя). Различия считали значимыми при уровне достоверности более 95% (p < 0.05). Расчеты проводили в двух совместимых средах Excel 2016 и Past 3.24, использовали лицензионные программы.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
У крыс контрольной группы продолжительность плавания в последние сутки эксперимента, как и средняя продолжительность плавания за 4 суток предельной нагрузки, значимо не изменилась по отношению к исходному уровню. Крысы, получавшие ХА в дозе 10 мг/кг (группа ХА10), также не демонстрировали статистически значимого повышения выносливости. В группе ХА20 средняя продолжительность плавания увеличилась на 35%, а продолжительность плавания в последний день нагрузки – в полтора раза по сравнению с контролем (рис. 1A, B). Однако в группах, получавших КА, увеличение дозы не привело к повышению продолжительности плавания крыс: если у крыс группы КА10 показатели продолжительности плавания практически совпадали с показателями группы ХА20, то у крыс группы КА20 не наблюдалось даже тенденции к повышению этого показателя. Применение ЭЗЧ, а также сочетание ЭЗЧ с хлоридом и карбонатом аммония в дозах 20 и 10 мг/кг соответственно не привело к повышению средней продолжительности плавания, однако, показатели 4-го дня у животных группы ЭЗЧ + КА10 близки к показателям групп ХА20 и КА10 (рис. 1B).
Рис. 1.
Средняя продолжительность плавания крыс в течение 4 дней предельной нагрузки (А) и продолжительность плавания в последний день (B), медианы (min; max). *, ** – отличия от группы положительного контроля (PC) статистически значимы (р < 0.05 и р < 0.01 соответственно). Расшифровка аббревиатур: PC – положительный контроль (введение раствора NaCl за 5 мин до нагрузки); ACl10 – введение хлорида аммония в дозе 10 мг/кг; ACl20 – введение хлорида аммония в дозе 20 мг/кг; ACr10 – введение карбоната аммония в дозе 10 мг/кг; ACr20 – введение карбоната аммония в дозе 20 мг/кг; GTE – введение водного раствора ЭЗЧ в дозе 12 мг/кг в пересчете на катехины за 2 ч до нагрузки и через 2 ч после окончания нагрузки (суточная доза катехинов 24 мг/кг); GTE + ACl – введение ЭЗЧ дважды в день и ХА (20 мг/кг) за 5 мин до начала нагрузки; GTE + АCr – введение ЭЗЧ дважды в день и КА (10 мг/кг) за 5 мин до начала нагрузки. Fig. 1. Average swimming time of rats during 4 days of maximum load (A) and swimming time on the last day (B), median (min; max). *, ** – differences from the positive control (PC) group are statistically significant (p < 0.05 and p < 0.01 respectively). The meaning of abbreviations: PC – positive control (introduction of NaCl solution 5 min before the load); ACl10 – administration of ammonium chloride at a dose of 10 mg/kg; АCl20 – administration of ammonium chloride at a dose of 20 mg/kg; ACr10 – introduction of ammonium carbonate at a dose of 10 mg/kg; АCr20 – introduction of ammonium carbonate at a dose of 20 mg/kg; GTE – the introduction of an aqueous solution of GTE at a dose of 12 mg/kg in terms of catechins 2 h before the load and 2 h after the end of the load (daily dose of catechins 24 mg/kg); GTE + ACl20 – administration of GTE twice a day and ACl (20 mg/kg) 5 min before the start of the load; GTE + ACr10 – administration of GTE twice a day and ACr (10 mg/kg) 5 min before the start of the load.

Гематологический анализ. По данным гематологического анализа, у крыс группы ХА10 выявлен максимальный уровень эритроцитов, который статистически значимо в среднем на 10% превышал соответствующий уровень у крыс отрицательного и положительного контроля, на 6% – уровень группы ХА20 и на 20% – уровень группы ЭЗЧ + КА10 (рис. 2).
Рис. 2.
Количество эритроцитов в разных группах крыс через сутки после окончания цикла принудительного плавания. *, ** – отличия между группами статистически значимы (р < 0.05 и р < 0.01 соответственно). NC – отрицательный контроль (интактные животные); остальные обозначения те же, что на рис. 1. Fig. 2. The number of erythrocytes in different groups of rats one day after the end of the forced swimming cycle. *, ** – differences between the groups are statistically significant (p < 0.05 and p < 0.01 respectively). NC – negative control (intact animals); other designations are the same as in fig. 1.

Достоверное снижение уровня тромбоцитов на 40% (p < 0.05) выявлено лишь у крыс группы ЭЗЧ + КА10 относительно отрицательного контроля, хотя следует отметить тенденцию (p < 0.1) к уменьшению количества тромбоцитов в этой же группе относительно групп ХА20 и КА10, представители которых показали лучшие результаты продолжительности плавания (рис. 3).
Рис. 3.
Количество тромбоцитов в разных группах крыс через сутки после окончания цикла принудительного плавания. Обозначения те же, что на рис. 1 и 2. Fig. 3. The number of platelets in different groups of rats one day after the end of the forced swimming cycle. Designations are the same as in fig.1 and 2.

Физиологические реакции при интенсивной физической нагрузке обычно сопровождаются ускоренной инфильтрацией лейкоцитов, дифференцировкой лимфоцитов и продукцией провоспалительных цитокинов [11]. Нейтрофилы, как известно, являются полностью дифференцированными короткоживущими клетками. Время их циркуляции в крови составляет около 10 ч, затем они мигрируют в ткани, где подвергаются спонтанному апоптозу в течение 1–2 дней и фагоцитируются тканевыми макрофагами [12]. Количественный характер перераспределения лимфоцитов и гранулоцитов в разных группах необходимо трактовать, памятуя о преобладании лимфоцитов в лейкоцитарном профиле грызунов, в отличие от преобладания нейтрофилов в аналогичном профиле человека.
Интенсивная физическая нагрузка в нашем эксперименте не вызвала каких-либо изменений уровня лейкоцитов, который был примерно одинаков во всех группах животных; незначительные отличия между группами не попадали даже под определение “тенденции” (0.05 < р < 0.1). Абсолютные количества лимфоцитов, гранулоцитов и моноцитов также не имели достоверных отличий между группами, однако, выявлены статистически значимые относительные изменения уровня лимфоцитов у крыс группы КА10 (повышение на 4–10% по отношению к группам ХА20, КА20 и ЭЗЧ + ХА20) и уровня гранулоцитов у крыс этой же группы (понижение на 10–30% по отношению к группам ХА10, ХА20 и КА20) (рис. 4A, B). Эти изменения могут свидетельствовать об адаптивном дисбалансе клеточного иммунитета у крыс группы КА10, что связано с демонстрацией относительно высоких функциональных результатов и, вероятно, сопутствующим повреждением мышечных волокон. Поскольку мы не выявили изменений относительного и абсолютного количества В-лимфоцитов в разных группах животных по отношению к интактному (отрицательному) контролю (здесь не показано), наблюдаемые изменения лимфоцитарного профиля должны быть обусловлены субпопуляциями клеточного иммунитета.
Рис. 4.
Доля (%) лимфоцитов (A) и гранулоцитов (B) в разных группах крыс через сутки после цикла принудительного плавания. Обозначения те же, что на рис. 1 и 2. Fig. 4. The proportion (%) of lymphocytes (A) and granulocytes (B) in different groups of rats one day after the forced swimming cycle. Designations are the same as in fig. 1 and 2.

Показатели в группах животных, которым вводили ХА, оставались на уровне интактного контроля, тогда как более значительная разница с группой КА20 обусловлена отклонением показателей этой группы от показателей контроля, что может свидетельствовать о перенапряжении или даже срыве адаптации животных при повышении дозировки карбонатной соли аммония в два раза. Следует также отметить, что, согласно полученным медианам, применение ЭЗЧ в сочетании с КА10 оказывает аддитивный эффект на изменение доли лимфоцитов и эффект потенцирования на изменение доли гранулоцитов, хотя сравнительно малая выборка групп ЭЗЧ и ЭЗЧ + КА10 не позволила получить статистически значимые отличия. Однако эти предположения частично подтверждаются изменениями относительного и абсолютного количества NK-клеток: достоверные отличия в 2 и 1.5 раза соответственно выявлены между группами ЭЗЧ + КА10 и ХА20, в первой из которых уровень NK-клеток повышен, а во второй понижен относительно контроля (рис. 5А, B). Повышение уровня и/или активности NK-клеток происходит не только при инфицировании клеток вирусами или злокачественном перерождении, как это считалось не так давно. Например, активация NK-клеток отмечена при иктогенезе в пилокарпиновой модели судорог у грызунов [13]. Более того, по данным работы [14], наибольшее увеличение (в среднем в 5.6 раза) NK-клеток наблюдается сразу после максимальной нагрузки, затем происходит их перераспределение в тканях, в том числе, из-за миграции NK-клеток в места повреждения мышц [15]. Уровень NK-клеток может значимо изменяться в зависимости от интенсивности физической нагрузки, что также определяет уровень содержания NK-лимфоцитов в восстановительный период [16]. Таким образом, у животных группы ЭЗЧ + КА10, вероятно, происходит повреждение миоцитов и развитие воспалительного процесса, острая фаза которого, связанная с распознаванием антигена, либо недавно миновала, либо подходит к концу, и процесс переходит в эффекторную фазу иммунного ответа. Можно предположить, что фаза распознавания антигена слабо выражена у крыс, т.к. предельную нагрузку они ранее не испытывали и соответствующие антигены не были экспрессированы миоцитами. Возможно, по этой причине активация лимфоцитов на следующей стадии иммунного ответа обеспечивается, главным образом, NK-клетками.
Рис. 5.
Относительное (%, A) или абсолютное количество (×109 кл./л, B) NK-клеток в разных группах крыс через сутки после окончания цикла принудительного плавания. Обозначения те же, что на рис. 1 и 2. Fig. 5. Relative (%, A) or absolute number (×109 cells/L, B) of NK cells in different groups of rats one day after the end of the forced swimming cycle. Designations are the same as in fig. 1 and 2.

Минорные субпопуляции Т-лимфоцитов. На самой ранней стадии дифференцировки Т-лимфоциты (тимоциты) не экспрессируют корецепторы CD4 и CD8 и определяются как двойные негативные, CD4–CD8– или DN (double negative). На следующей стадии созревания тимоциты экспрессируют оба маркера, CD4+CD8+ или DP (double positive). В циркулирующей крови DN и DP встречаются в малых количествах, динамика этих клеток при экстремальных состояниях и заболеваниях даже у человека очень слабо изучена, а при физических нагрузках не изучена вовсе, так что наши данные, полученные на крысах, являются во многих отношениях пионерскими. Анализ минорных субпопуляций Т-лимфоцитов не выявил существенных отличий между группами по относительному и абсолютному уровню DP лимфоцитов. Повышенный уровень этой субпопуляции выявлен при некоторых онкологических и инфекционных заболеваниях и может быть обусловлен преждевременным выходом DP-клеток из тимуса [17–19]. В то же время, у крыс группы ЭЗЧ отмечено повышение уровня абсолютного количества DN-клеток по отношению к группам отрицательного и положительного контроля (р < 0.05), а у крыс группы ЭЗЧ + КА10 – повышение относительного количества DN-клеток по отношению к группам положительного контроля, ХА10 и ХА20 (рис. 6A, B). Здесь следует сказать о двух дополнительных особенностях DN-клеток. Первая особенность состоит в том, что в их плазматической мембране экспрессированы рецепторы интерлейкина 2, IL-2Rα и IL-2Rβ, которые также являются специфическими маркерами регуляторных Т-клеток [20]. Вторая особенность – экспрессия рецептора Notch1, активация которого – необходимое условие дифференцировки DN-клеток в Т-лимфоциты, в отсутствие которой дифференцировка DN-клеток происходит по другим путям с образованием NK-лимфоцитов, B-лимфоцитов или миелоидных клеток [21]. Уровень экспрессии и степень активации этих рецепторов заслуживает отдельного исследования, однако, принимая во внимание отсутствие изменений количества В-лимфоцитов, наряду с повышенным уровнем абсолютного и относительного количества NK-клеток в группах ЭЗЧ и ЭЗЧ+КА10 соответственно, можно предположить нарушение экспрессии и/или активации рецептора Notch1 в этих группах, и, как следствие, – нарушение дифференцировки DN-клеток.
Рис. 6.
Относительное (%, A) или абсолютное количество (×109 кл./л, B) DN-клеток в разных группах крыс через сутки после окончания цикла принудительного плавания. Обозначения те же, что на рис. 1 и 2. Fig. 6. Relative (%, A) or absolute number (×109 cells/L, B) DN-cells in different groups of rats one day after the end of the forced swimming cycle. Designations are the same as in fig. 1 and 2.

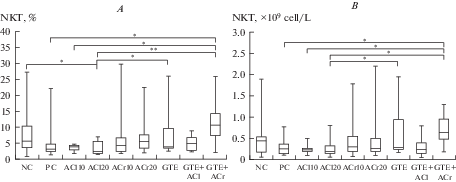
Субпопуляция Т-лимфоцитов, получившая название NKT-клеток, экспрессирует как маркеры NK-клеток (у человека это CD16 и CD56, у крыс CD161a+), так и Т-клеточные дифференцировочные антигены (в первую очередь CD3+) и относятся к клеткам врожденного иммунитета. Они представляют собой минорную популяцию Т-клеток, которая благодаря своей аутореактивности и способности быстро продуцировать различные цитокины, обеспечивает связь между врожденным и адаптивным звеньями иммунитета [22]. Анализ содержания NKT-клеток в периферической крови крыс через сутки после окончания цикла принудительного плавания выявил редкое совпадение (в нашем эксперименте – единственное) статистически значимых изменений относительного и абсолютного количества клеток, характер которых при этом был во многом похож на относительные изменения DN-клеток: максимальное увеличение по отношению к отрицательному контролю – в группе ЭЗЧ+КА10, максимальное уменьшение – в группе ХА20, достоверные отличия относительных и абсолютных показателей группы ЭЗЧ+КА10 по отношению к показателям групп положительного контроля, ХА10 и ХА20, а также показателей группы ЭЗЧ по отношению к группе ХА20 (рис. 7A, B). В отличие от NK-клеток, где изменения могут быть зарегистрированы сразу после физической нагрузки, в другой модели длительной физической нагрузки (бег на тредмилле с нарастающей интенсивностью) значимые изменения уровня NKT-клеток в крови крыс были выявлены лишь через 7 суток после окончания цикла продолжительностью 9 нед. [23, 24]. Снижение количества NKT-клеток сопровождалось уменьшением соотношения хелперов 1-го и 2-го типа, что свидетельствует об усилении гуморальной и ослаблении клеточной составляющей иммунитета и в целом расценивается авторами исследования как отрицательный эффект перенагрузки, связанный с ослаблением иммунитета. К сожалению, в этой модели не была предусмотрена оценка функциональной эффективности, акцент был сделан на получении эффекта физической перенагрузки как таковой и ее связи с уровнем напряжения иммунитета, в отличие от нашей модели принудительного плавания, где главная задача состояла в поиске корреляций и причинно-следственных связей между функциональной эффективностью препаратов и физиолого-биохимическими (в том числе иммунологическими) показателями. В нашей модели изменения уровня NKT-клеток выявлены гораздо раньше, через сутки после окончания цикла плавательной нагрузки, причем у животных, показавших максимальную функциональную эффективность (группа ХА20), уровень NKT-клеток уменьшается, тогда как повышение уровня этих клеток выявлено в группе крыс, показавших минимальную эффективность (группа ЭЗЧ+КА10). Однако мы не склонны связывать полученные изменения исключительно с негативной модуляцией иммунитета, поскольку именно функциональный критерий является определяющим в оценке качества адаптации, физиологического и иммунологического статуса животных. Для уточнения механизмов адаптации иммунной системы к предельным нагрузкам необходимо рассмотреть изменение соотношения основных субпопуляций Т-лимфоцитов (цитотоксических и хелперов), а также выявить корреляционную зависимость индивидуальных иммунологических показателей крыс с индивидуальной продолжительностью плавания.
Рис. 7.
Относительное (%, A) или абсолютное количество (×109 кл./л, B) NKT-клеток в разных группах крыс через сутки после окончания цикла принудительного плавания. Обозначения те же, что на рис. 1 и 2. Fig. 7. Relative (%, A) or absolute number (×109 cells/L, B) of NKT cells in different groups of rats one day after the end of the forced swimming cycle. Designations are the same as in fig. 1 and 2.
Анализ субпопуляций цитотоксических Т-лимфоцитов (Tc). Известно, что по мере дифференцировки Т-клетки изменяют поверхностный фенотип и свои функциональные особенности. На основании экспрессии CD44 (определяет способность к миграции в не-лимфоидные ткани) и CD62L (способность к миграции через высокий эндотелий лимфатического русла) каждая из основных популяций Т-клеток может быть разделена на субпопуляции. Так, “наивные” цитотоксические Т-клетки (CD44–62L+) обладают высоким пролиферативным потенциалом, продуцируют IL-2, способны к миграции в ткани и не имеют эффекторных функций. Клетки центральной памяти (CD44+62L+) способны к пролиферации при непосредственном контакте с антигеном без этапа его презентации дендритными клетками и макрофагами, продуцируют IL-2 и интерферон-γ (IFN-γ), но не имеют киллерной активности. Клетки эффекторной памяти (CD44+62L–) и зрелые эффекторы (CD44–62L–) продуцируют в основном IFN-γ и TNF-α, обладают цитотоксической активностью [3].
Согласно данным нашего эксперимента, повышение доли наивных цитотоксических Т-клеток имеет характер тенденции (p < 0.1) в группах ХА10 и ХА20 (рис. 8A), однако, определение абсолютного количества этих клеток позволило выявить статистически значимое повышение количества клеток этой субпопуляции в этих же группах экспериментальных животных (рис. 8B). В группах ЭЗЧ+ХА20 и особенно ЭЗЧ+КА10, наоборот, выявлены статистически значимые изменения доли наивных цитотоксических Т-клеток по сравнению с группой ХА10 (для обеих сравниваемых групп), а также по сравнению с группами NaCl, ХА20 и КА10 (только для группы ЭЗЧ+КА10) (рис. 8A). Абсолютное количество этих клеток в группах с ЭЗЧ не имеет статистически значимых отличий от показателей других групп (рис. 8B).
Рис. 8.
Относительное (%) или абсолютное количество (×109 кл./л) цитотоксических лимфоцитов в разных группах крыс через сутки после окончания цикла принудительного плавания: “наивные” клетки (A, B), клетки эффекторной памяти (C, D), зрелые эффекторные клетки (E, F). Обозначения те же, что на рис. 1 и 2. Fig. 8. Relative (%) or absolute number (×109 cells/L) of cytotoxic lymphocytes in different groups of rats one day after the end of the forced swimming cycle: “naive” cells (A, B), effector memory cells (C, D), mature effector cells (E, F). Designations are the same as in fig. 1 and 2.
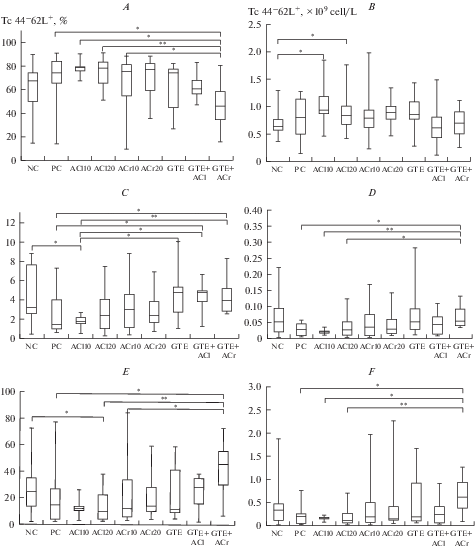
Что касается клеток эффекторной памяти и зрелых эффекторов (3-я и 4-я стадии дифференцировки Т-клеток соответственно), то их относительное уменьшение статистически значимы в группах ХА10 и ХА20 соответственно (рис. 8B, E). В то же время в группах ЭЗЧ, ЭЗЧ+ХА20 и ЭЗЧ+КА10 выявлено достоверное увеличение относительного количества этих субпопуляций клеток по сравнению с группами положительного контроля (NaCl), ХА10, ХА20 и КА10. Более того, в группе ЭЗЧ+КА10 выявлено достоверное увеличение абсолютного количества клеток эффекторной памяти и зрелых эффекторов по отношению к группам NaCl, ХА10, ХА20 и КА10, это отличие достигало почти 600% (например, зрелые эффекторы в группе ЭЗЧ+КА10 по сравнению с группой ХА20, рис. 8D, F). Известно, что оптимальная, неизнурительная физическая нагрузка приводит к повышению уровня наивных Т-клеток, это является признаком стимуляции/укрепления иммунной системы спортсменов. Однако перетренировка обусловливает изменение баланса – уменьшение доли наивных и увеличение доли зрелых эффекторов, что свидетельствует об ослаблении иммунитета и восприимчивости к заболеваниям, в частности, к вирусным инфекциям [3].
Анализ субпопуляций Т-хелперов (Th). Максимальное увеличение доли наивных Th выявлено у крыс группы ХА10, максимальное уменьшение – у крыс группы ЭЗЧ+ХА20, разница между медианами этих групп составила 14% (р < 0.01). Снижение доли наивных Th в группе ЭЗЧ+ХА20 имеет статистически значимый характер по отношению не только к группе ХА10, но также к группам отрицательного и положительного контроля, ХА20, КА10 и КА20. Несколько меньшее снижение доли Th выявлено у крыс группы ЭЗЧ+КА10, достоверность изменений установлена для всех перечисленных групп за исключением группы КА10, по отношению к которой изменения имеют характер тенденции (р < 0.1). Также следует отметить достоверность отличий между группой ХА10, с одной стороны, и группами КА10 и ЭЗЧ, с другой стороны (рис. 9A). Профиль абсолютного количества наивных Th по группам выглядел несколько по-другому: если минимальное количество также было выявлено у крыс группы ЭЗЧ+ХА20, то максимальное количество оказалось, как ни странно, у крыс группы ЭЗЧ (рис. 9B), разница между ними составила 65% (р < 0.05). Далее, в порядке убывания, расположились группы положительного контроля, ХА20 и ХА10, у представителей которых отклонения от показателей группы ЭЗЧ+ХА20 также имело статистически значимый характер, тогда как отклонения от отрицательного контроля имело характер тенденции (р < 0.1).
Рис. 9.
Относительное (%) или абсолютное количество (×109 кл./л) Т-хелперов в разных группах крыс через сутки после окончания цикла принудительного плавания: “наивные” клетки (A, B), клетки центральной памяти (C, D), клетки эффекторной памяти (E, F). Обозначения те же, что на рис. 1 и 2. Fig. 9. Relative (%) or absolute number (×109 cells/L) of T-helpers in different groups of rats one day after the end of the forced swimming cycle: “naive” cells (A, B), central memory cells (C, D), effector memory cells (E, F). Designations are the same as in fig. 1 and 2.

На следующей стадии дифференцировки распределение относительного количества хелперов центральной памяти выглядит следующим образом: минимум – у представителей группы ХА10, достоверность отличий выявлена по отношение ко всем другим группам за исключением группы КА20 (рис. 9C); максимум – у представителей групп ЭЗЧ+ХА20 и ЭЗЧ+КА10, превышение минимального уровня более чем радикальное – в 2.5 раза, достоверность отличий выявлена по отношению к группам положительного контроля, ХА10, ХА20, КА10 и КА20. Распределение медиан абсолютного количества Т-хелперов достаточно хорошо соответствует распределению относительного количества этих клеток: минимум у крыс групп ХА10 и КА20, хотя по количеству достоверных отличий по отношению к другим группам группа КА20 опережает группу ХА10; максимум с разницей в 2 раза – у крыс групп ЭЗЧ и ЭЗЧ+КА10, но и здесь, если судить по количеству достоверных отличий, группа ЭЗЧ впереди (рис. 9D).
Относительное количество Т-хелперов эффекторной памяти повышено во всех экспериментальных группах, но максимальное их количество и статистически значимые отличия в 1.5–2 раза от групп отрицательного контроля, ХА10 и ХА20 выявлены в группах ЭЗЧ+ХА20 и ЭЗЧ+КА10 (рис. 9E). Абсолютное количество этой субпопуляции хелперов максимально в группах КА10 и ЭЗЧ + ХА20 (достоверные отличия в 2 раза от группы отрицательного контроля, несколько меньше – у крыс положительного контроля и ЭЗЧ+КА10 (р < 0.1 по отношению к отрицательному контролю) (рис. 9F).
Среди зрелых эффекторов, клеток последней стадии дифференцировки, не выявлено достоверных отличий между группами по относительному количеству клеток, тем не менее, отметим максимальное значение медианы группы КА20 (р < 0.1 по отношению к отрицательному контролю и ЭЗЧ). Что касается абсолютного количества зрелых эффекторов, мы не выявили отличий между группами даже на уровне тенденции (здесь не показано).
Корреляционный анализ функциональных (продолжительность плавания) и иммунологических показателей не выявил статистически значимых корреляций в пяти группах экспериментальных животных: ХА10, ХА20, ЭЗЧ, ЭЗЧ+ХА20, ЭЗЧ+КА10. В их число вошли животные, которым вводили хлорид аммония (обе дозы) и ЭЗЧ в разных вариантах – самостоятельно и в сочетании с обеими солями аммония. Достоверность корреляций выявлена в группе положительного контроля и группах животных, которым вводили карбонат аммония (обе дозы). Наибольшее их количество выявлено в группе положительного контроля (9 и 13 при сравнении с продолжительностью плавания в 4-й день и средней продолжительностью за 4 дня соответственно), на втором месте с большим отрывом следует группа КА10 (2 и 1 соответственно) и на третьем месте – группа КА20 (2 и 0 соответственно) (табл. 1). Уже из этих данных со всей очевидностью следует, что выполнение предельной физической нагрузки контрольными животными сопряжено с усиленной мобилизацией системы клеточного иммунитета. Количество достоверных корреляций со средней продолжительностью плавания за 4 дня нагрузки почти в 1.5 раза (13 против 9) превышает количество корреляций с продолжительностью плавания в последний, 4-й день нагрузки, что свидетельствует об отсутствии особого “прогресса” в продолжительности плавания в течение четырех дней нагрузки и формировании иммунного ответа в организме условных “рекордсменов” с первого же дня выполнения серии предельных нагрузок. Спектр показателей, по которым выявлены статистически значимые корреляции группы положительного контроля, указывает не только на структуру иммунного ответа, но и дополнительно свидетельствует о негативных сдвигах в системе клеточного иммунитета: это отрицательные корреляции по абсолютному количеству лимфоцитов, соотношению абсолютного количества Th и Tc, относительному и абсолютному количеству “наивных” Th и Tc-клеток, относительному и абсолютному количеству DP-клеток; с другой стороны, это положительные корреляции по относительному количеству цитотоксических зрелых эффекторов, хелперов центральной и эффекторной памяти, DN-клеток, NK- и NKT-клеток. Структура иммунного ответа контрольных животных свидетельствует о высокой “цене”, которую приходится “платить” организму за физическое перенапряжение, связанное с демонстрацией высоких результатов.
Таблица 1.
Корреляция иммунологических показателей с продолжительностью плавания крыс Table 1. Correlation of immunological parameters with the duration of swimming of rats
| Иммунологические показатели Immunological parameters → | Lym, абс. abs. | CD4/CD8 | NK, отн. rel. | NKT, отн. rel. | CD4–CD8–, отн. rel. | CD4–CD8–, абс. abs. | CD4+CD8+, отн. rel. | CD4+CD8+, абс. abs. | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Группа Group ↓ | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. |
| (+)контроль (PC) | –0.59* | –0.60* | –0.44 | –0.62* | 0.33 | 0.53* | 0.34 | 0.65* | 0.78* | 0.52* | 0.01 | –0.13 | –0.67* | –0.65* | –0.82* | –0.84* |
| ХА20 (ACl20) | 0.31 | 0.34 | 0.05 | –0.02 | –0.08 | –0.10 | –0.01 | 0.02 | –0.04 | –0.18 | 0.28 | 0.23 | 0.27 | 0.31 | 0.30 | 0.36 |
| КА10 (ACr10) | 0.37 | 0.17 | –0.16 | 0.07 | 0.07 | 0.04 | 0.18 | 0.02 | 0.60* | 0.42* | 0.60* | 0.35 | –0.22 | 0.04 | 0.08 | 0.07 |
| КА20 (ACr20) | 0.24 | 0.16 | –0.24 | –0.11 | 0.12 | 0.18 | 0.53 | 0.35 | 0.46 | 0.26 | 0.52 | 0.43 | –0.26 | 0.07 | 0.17 | 0.48 |
| ХА10 (ACl10) | 0.25 | 0.32 | 0.07 | –0.04 | –0.46 | –0.39 | –0.29 | –0.18 | 0.43 | 0.51 | 0.33 | 0.43 | –0.32 | –0.18 | 0.04 | 0.21 |
| ЭЗЧ (GTE) | 0.07 | –0.27 | –0.37 | 0.00 | –0.12 | –0.39 | 0.20 | –0.09 | –0.25 | –0.55 | 0.03 | –0.39 | 0.10 | 0.14 | 0.28 | 0.07 |
| ЭЗЧ + КА10 (GTE+ACr10) |
0.41 | 0.47 | 0.06 | 0.00 | –0.64 | –0.57 | –0.08 | –0.10 | –0.24 | –0.19 | 0.12 | 0.21 | 0.26 | 0.14 | 0.43 | 0.36 |
| ЭЗЧ + ХА20 (GTE + ACl20) |
0.00 | –0.02 | –0.42 | –0.29 | 0.16 | 0.05 | –0.14 | –0.24 | 0.52 | 0.66 | 0.22 | 0.26 | –0.20 | –0.13 | –0.12 | –0.12 |
| Иммунологические показатели Immunological parameters → | Th44–62L+, отн. rel. | Th44–62L+, абс. abs. | Th44+62L+, отн. rel. | Th44+62L–, отн. rel. | Tc44–62L+, отн. rel. | Tc44–62L+, абс. abs. | Tc44–62L–, отн. rel. | Tc44–62L–, абс abs. | ||||||||
| Группа Group ↓ | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. | 4-й 4th | Сред. Av. |
| (+)контроль (PC) | –0.78* | –0.66* | –0.70* | –0.74* | 0.53 | 0.70* | 0.79* | 0.52 | –0.60* | –0.70* | –0.50 | –0.56* | 0.58* | 0.60* | 0.35 | 0.40 |
| ХА20 (ACl20) | –0.20 | –0.16 | 0.35 | 0.33 | 0.17 | 0.22 | 0.30 | 0.29 | 0.01 | –0.04 | 0.28 | 0.36 | –0.19 | –0.17 | –0.07 | –0.03 |
| КА10 (ACr10) | –0.07 | 0.02 | 0.22 | 0.14 | 0.09 | 0.02 | –0.04 | –0.05 | –0.30 | –0.14 | 0.25 | 0.05 | 0.20 | 0.02 | 0.33 | 0.08 |
| КА20 (ACr20) | 0.07 | 0.10 | 0.06 | 0.14 | 0.22 | 0.08 | –0.13 | –0.18 | –0.66 | –0.44 | 0.23 | 0.25 | 0.76* | 0.58 | 0.78* | 0.59 |
| ХА10 (ACl10) | –0.07 | –0.21 | 0.39 | 0.43 | –0.18 | 0.00 | 0.18 | 0.36 | 0.00 | 0.14 | –0.11 | 0.00 | –0.04 | –0.14 | 0.04 | –0.07 |
| ЭЗЧ (GTE) | 0.01 | 0.40 | –0.08 | –0.07 | –0.14 | –0.32 | –0.11 | –0.56 | 0.05 | 0.42 | 0.09 | 0.05 | –0.01 | –0.44 | –0.08 | –0.45 |
| ЭЗЧ + КА10 (GTE + ACr10) |
0.32 | 0.24 | 0.36 | 0.33 | 0.18 | 0.14 | –0.38 | –0.33 | 0.06 | 0.05 | 0.32 | 0.43 | –0.12 | –0.14 | 0.29 | 0.33 |
| ЭЗЧ + ХА20 (GTE + ACl20) |
–0.30 | –0.29 | –0.11 | –0.14 | 0.64 | 0.62 | –0.58 | –0.57 | 0.30 | 0.31 | 0.14 | 0.05 | –0.30 | –0.33 | –0.06 | –0.14 |
Приведены данные по тем показателям, у которых имеется достоверная корреляция хотя бы в одной из групп. 4-й: корреляция с продолжительностью плавания в 4-й день предельной нагрузки. Сред.: корреляция со средней продолжительностью плавания за 4 дня предельной нагрузки. * p < 0.05. Обозначения групп приведены в тексте.
The data are given for those indicators that have a significant correlation in at least one of the groups. 4th: Correlation with swimming time on day 4 of maximum exercise. Avg.: Correlation with the average swim duration over 4 days of maximum load. * p < 0.05. The group designations are given in the text.
Две из трех достоверных корреляций иммунологических показателей крыс группы КА10 с продолжительностью выполнения ими предельной плавательной нагрузки совпадают по знаку и почти совпадают по величине с достоверными корреляциями группы положительного контроля по одному показателю – относительное количество двойных негативных клеток; этот показатель имеет положительную корреляцию с продолжительностью плавания в 4-й день и со средним значением за 4 дня. Третья достоверная корреляция группы КА10 выявлена по абсолютному количеству двойных негативных клеток, но только применительно к функциональному результату последнего, 4-го дня предельной нагрузки. Таким образом, относительное количество двойных негативных клеток является наиболее чувствительным, но наименее специфичным иммунологическим биомаркером, свидетельствующим о степени физического напряжения животных. Необходимо отметить, что в группе крыс ХА20 не выявлено корреляции с продолжительностью плавания по этому показателю (как и по многим другим) даже на уровне тенденции, в группах КА20, ХА10 и ЭЗЧ+ХА20 корреляции положительные на уровне тенденции, тогда как на противоположном “полюсе” по данному показателю (наиболее выраженные отрицательные значения) находится группа ЭЗЧ, что свидетельствует о позитивном влиянии этого нутрицевтика на состояние клеточного иммунитета животных, выполняющих максимальную для данной группы нагрузку. Наиболее специфичным иммунологическим показателем группы положительного контроля можно считать абсолютное количество двойных позитивных клеток, поскольку этот показатель имеет максимально выраженную отрицательную корреляцию как по результату 4-го дня, так и по среднему значению за 4 дня, притом что в других группах либо нет корреляции этого показателя с продолжительностью плавания, либо имеется тенденция к положительной корреляции (группы ХА20 и ЭЗЧ+КА10). Для группы КА20 наиболее специфичным показателем является абсолютное количество зрелых цитотоксических эффекторов, имеющим положительную корреляцию с функциональным результатом 4-го дня, т.к. в других группах нет достоверных корреляций этого показателя с продолжительностью выполнения физической нагрузки. Относительное количество этих клеток также достоверно коррелирует с показателем продолжительности плавания 4-го дня, но достоверная корреляция имеется и в группе контроля. Положительная корреляция относительного и абсолютного количества цитотоксических клеток последней стадии дифференцировки, наряду с тенденцией по другим иммунологическим показателям (Tc44–62L+, отн.; CD4–CD8–, отн. и абс.; NKT, отн.), позволяет предположить, что карбонат аммония в дозе 20 мг/кг в наименьшей степени из всех исследованных адаптогенов способствует адаптации к предельной нагрузке в разработанной нами модели принудительного плавания.
Отрицательная корреляция с продолжительностью плавания абсолютного количества лимфоцитов у крыс группы положительного контроля означает, что условные “рекордсмены” этой группы даже через сутки имеют пониженный иммунологический статус. У спортсменов высокой квалификации снижение уровня лимфоцитов наблюдается через 2 ч после предельной физической нагрузки (“окно” восприимчивости к инфекции [25]), восстановление обычно происходит уже через 4 ч, так что пониженный их уровень через сутки свидетельствует о срыве адаптации. Для сравнения – положительная корреляционная зависимость по этому показателю (на уровне статистической тенденции, р < 0.1) в группах ХА20, КА10 и ЭЗЧ+КА10. Соотношение Th и Tc (CD4+/CD8+) также понижено у “рекордсменов” группы контроля, однако максимально отрицательная корреляция, как уже было сказано, отмечена по абсолютному количеству DP-клеток, что может свидетельствовать о нарушении созревания Т-клеток в тимусе, но с учетом особенностей экспериментальной модели разумным представляется предположение о дополнительном участии этой минорной фракции в цитотоксических процессах за пределами сосудистого русла [19].
Снижение уровня лимфоцитов, соотношения CD4+/CD8+ и уровня DP-клеток у “рекордсменов” группы контроля компенсируется повышением доли NK-клеток, предназначение которых состоит не только в быстрой атаке на инфицированные клетки, но также в генерации значительного количества INF-γ, который служит стимулом для активации макрофагов и созревания “наивных” хелперов [26], последние, в свою очередь, активируют и/или способствуют дифференцировке Т‑киллеров, B-лимфоцитов и моноцитов. Вероятно, результатом этой активации является снижение относительного и абсолютного количества “наивных” Тс-клеток, что сопряжено с повышением относительного и абсолютного количества цитотоксических зрелых эффекторов в группе контроля при попытке “установить рекорд”. Важно отметить, что близкая корреляционная зависимость количества этих субпопуляций Тс-клеток с продолжительностью плавания наблюдается у крыс группы КА20 (табл. 1).
ЗАКЛЮЧЕНИЕ
В разработанной нами модели принудительного плавания максимальное повышение выносливости в течение 4 дней предельной нагрузки демонстрируют крысы групп ХА20 и КА10. Применение ЭЗЧ в самостоятельном виде и в сочетании с эффективными дозами солей аммония не приводит к достоверному повышению средней за 4 дня продолжительности плавания, однако животные группы ЭЗЧ+КА10 в последний день нагрузки показали достоверное повышение продолжительности плавания. Гематологический анализ выявил максимальный уровень эритроцитов у крыс группы ХА10, тогда как минимальный уровень не только эритроцитов, но и тромбоцитов выявлен у крыс группы ЭЗЧ+КА10.
Интенсивная физическая нагрузка не вызвала изменений уровня лейкоцитов, абсолютного количества лимфоцитов, гранулоцитов и моноцитов, относительного и абсолютного количества В-лимфоцитов во всех группах экспериментальных животных относительно интактного (отрицательного) контроля, однако, выявлено статистически значимое повышение относительного количества лимфоцитов у крыс группы КА10 по отношению к группам ХА20, КА20 и ЭЗЧ+ХА20 и понижение относительного количества гранулоцитов у крыс этой же группы по отношению к группам ХА10, ХА20 и КА20. Эти изменения свидетельствуют о негативных сдвигах в системе клеточного иммунитета крыс группы КА10, однако, без срыва адаптации.
Статистически значимые отличия выявлены между группами ЭЗЧ+КА10 и ХА20 по относительному и абсолютному количеству NK-клеток, в 2 и 1.5 раза соответственно, в результате повышения относительно контроля уровня NK-клеток в группе ЭЗЧ+КА10 и понижения в группе ХА20. У крыс группы ЭЗЧ + КА10 также повышено относительное количество DN-клеток по отношению к группам положительного контроля, ХА10 и ХА20. Кроме того, в периферической крови крыс группы ЭЗЧ+КА10 выявлено максимальное увеличение по отношению к отрицательному контролю относительного и абсолютного количества NKT-клеток, тогда как в группе ХА20 – максимальное уменьшение их количества. В группах ЭЗЧ+КА10 и ХА20 выявлены разнонаправленные изменения доли “наивных” цитотоксических Т-клеток (уменьшение и увеличение соответственно), а также Тс-клеток эффекторной памяти и зрелых эффекторов (здесь наоборот, увеличение и уменьшение соответственно).
Максимальное увеличение доли “наивных” T-хелперов выявлено у крыс группы ХА10, максимальное уменьшение их относительного количества – у крыс группы ЭЗЧ+ХА20, хотя у крыс группы ЭЗЧ+КА10 также наблюдается уменьшение, а у крыс группы ХА20 – увеличение, разница между показателями групп статистически значима. Наиболее выраженные отличия найдены по относительному количеству Т-хелперов центральной памяти между группами ЭЗЧ+ХА20 и ЭЗЧ+КА10, с одной стороны (повышенный уровень), и группами положительного контроля, ХА10, ХА20, КА10 и КА20, с другой стороны (пониженный уровень).
Максимальное относительное количество Т-хелперов эффекторной памяти выявлено в группах ЭЗЧ+ХА20 и ЭЗЧ+КА10, минимальное – в группах отрицательного контроля, ХА10 и ХА20, хотя следует особо отметить увеличение абсолютного количества клеток этой субпопуляции хелперов в группе КА10 (достоверные отличия в 2 раза от группы отрицательного контроля, превышающее этот показатель у крыс групп положительного контроля и ЭЗЧ+КА10. В отличие от цитотоксических Т‑клеток по количеству Т-хелперов последней стадии дифференцировки (зрелые эффекторы) не выявлено статистически значимой разницы между группами.
Корреляционный анализ функциональных (продолжительность плавания) и иммунологических показателей выявил наибольшее количество статистически значимых корреляций в группе положительного контроля. Наряду с количеством, перечень положительных и отрицательных корреляций свидетельствует о дисбалансе системы клеточного иммунитета контрольных животных при выполнении ими предельной физической нагрузки: это отрицательные корреляции по абсолютному количеству лимфоцитов, соотношению CD4+/CD8+, относительному и абсолютному количеству “наивных” хелперов и цитотоксических клеток, относительному и абсолютному количеству двойных позитивных клеток; с другой стороны, это положительные корреляции по относительному количеству цитотоксических зрелых эффекторов, хелперов центральной и эффекторной памяти, двойных негативных, естественных киллеров и NKT-клеток. Три статистически значимые корреляции иммунологических показателей крыс группы КА10 совпадают по знаку и почти совпадают по величине с корреляциями группы положительного контроля по относительному и абсолютному количеству двойных негативных клеток, тогда как в группе крыс ХА20 по большинству иммунологических показателей не выявлено корреляций с продолжительностью плавания даже на уровне тенденции. Наиболее специфичным иммунологическим показателем группы положительного контроля является абсолютное количество двойных позитивных клеток. Данные корреляционного анализа свидетельствуют о том, что ЭЗЧ оказывает позитивное влияние на состояние клеточного иммунитета животных, выполняющих предельную нагрузку, тогда как карбонат аммония в дозе 20 мг/кг в наименьшей степени способствует адаптации к предельной нагрузке.
Полученные нами данные свидетельствует о максимально высокой адаптогенной эффективности хлорида аммония в дозе 20 мг/кг, так как, наряду с высокими функциональными результатами, у животных этой группы не выявлено признаков дезадаптации и дисбаланса иммунитета. Показатели животных группы КА10 свидетельствуют о максимальной мобилизации у них клеточного иммунитета при физической нагрузке, тогда как повышение дозы карбоната аммония в два раза ведет к срыву адаптации. Экстракт зеленого чая не способствует повышению физической работоспособности, однако оказывает в целом позитивное влияние на состояние иммунной системы животных. Наши данные также свидетельствуют о перенапряжении животных группы ЭЗЧ+КА10, в меньшей степени – группы ЭЗЧ+ХА20. Такие сочетания нутрицевтиков не обладают адаптогенными свойствами, т.к. не только не способствуют повышению физической работоспособности крыс, но вызывают активацию у них неспецифического звена клеточного иммунитета, нарушение дифференцировки DN-клеток.
Наши данные подтверждают имеющиеся предположения о том, что нельзя считать любую форму предельной физической нагрузки иммуносупрессивной, при определенных условиях иммунная компетентность может быть повышена [1]. Важно подчеркнуть, что позитивный эффект можно получить без применения допинговых препаратов, но с помощью нутрицевтиков, к которым относятся некоторые конечные продукты метаболизма, считавшиеся еще совсем недавно токсичными.
Список литературы
Campbell J.P., Turner J.E. Debunking the Myth of Exercise-Induced Immune Suppression: Redefining the Impact of Exercise on Immunological Health Across the Lifespan. Front. Immunology. 9: 648. 2018.
Maggini S., Pierre A., Calder P.C. Immune Function and Micronutrient Requirements Change over the Life Course. Nutrients. 10(10). 2018. pii: E1531.
Teixeira A.M., Rama L., Carvalho H.M., Borges G., Carvalheiro T., Gleeson M., Alves F., Trindade H., Paiva A. Changes in naïve and memory T-cells in elite swimmers during a winter training season. Brain Behav. Immun. 39: 186–193. 2014.
Goncharov N., Maevsky E., Voitenko N., Novozhilov A., Kubasov I., Jenkins R., Avdonin P. Nutraceuticals in sports activities and fatigue. In: Nutraceuticals: Efficacy, Safety and Toxicity. Gupta R.C. (Ed.). Amsterdam. Acad. Press/Elsevier. 177–188. 2016.
Novozhilov A.V., Tavrovskaya T.V., Voitenko N.G., Maslova M.N., Goncharov N.V., Morozov V.I. Efficacy of green tea extract in two exercise models. Bull. Exp. Biol. Med. 158(3): 42–345. 2015.
Korf E.A., Kubasov I.V., Novozhilov A.V., Matrosova E.V., Tavrovskaya T.V., Goncharov N.V., Vonsky M.S., Runov A.L., Kurchakova E.V. Green tea extract increases the expression of genes responsible for regulation of calcium balance in rat slow-twitch muscles under conditions of exhausting exercise. Bull. Exp. Biol. Med. 164(1): 6–9. 2017.
Гончаров Н.В., Миндукшев И.В., Новожилов А.В., Корф Е.А., Тавровская Т.В., Терпиловский М.А., Хмелевской Д.А., Скверчинская Е.А., Кривченко А.И. Адаптивные биохимические изменения эритроцитов крысы после цикла принудительного плавания с применением экстракта зеленого чая и аммонийного прекондиционирования. Рос. физиол. журн. 104(12): 1428–1441. 2018. [Goncharov N.V., Mindukshev I.V., Novozhilov A.V., Korf E.A., Tavrovskaya T.V., Terpilovsky M.A., Khmelevskoy D.A., Skverchinskaya E.A., Krivchenko A.I. Adaptive biochemical changes of rat erythrocytes after the cycle of forced swimming with the use of green tea extract and ammonium preconditioning. Russ. J. Physiol. 104(12): 1428–1441. 2018. (In Russ)].
Baidyuk E.V., Sobolev V.E., Korf E.A., Mindukshev I.V., Krivchenko A.I., Goncharov N.V. Ultrastructural Characteristics of Slow and Fast Twitch Muscle Fibers of Rats after a Forced Swimming Cycle against a Background of Introduction of Green Tea Extract and Ammonium Salts. Cell and Tissue Biol. 14(1): 65–73. 2020.
Korf E.A., Mindukshev I.V., Novozhilov A.V., Krivchenko A.I., Goncharov N.V. Ammonium Salts Increase Physical Performance and Reduce Blood Lactate Level in Rats in a Model of Forced Swimming. Bull. Exp. Biol. Med. 168(5): 610–613. 2020.
Novozhilov A.V., Mindukshev I.V., Korf E.A., Krivchenko A.I., Goncharov N.V. Ammonium salts promote the functional adaptation of rat erythrocytes in the model of forced swimming. Bull. Exp. Biol. Med. 168(4): 444–448. 2020.
Greenham G., Buckley J.D., Garrett J., Eston R., Norton K. Biomarkers of Physiological Responses to Periods of Intensified, Non-Resistance-Based Exercise Training in Well-Trained Male Athletes: A Systematic Review and Meta-Analysis. Sports Med. 48(11): 2517–2548. 2018. https://doi.org/10.1007/s40279-018-0969-2
Squier M.K., Sehnert A.J., Cohen J.J. Apoptosis in leukocytes. J. Leukoc. Biol. 57(1): 2–10. 1995.
Marchi N., Johnson A.J., Puvenna V., Johnson H.L., Tierney W., Ghosh C., Cucullo L., Fabene P.F., Janigro D. Modulation of peripheral cytotoxic cells and ictogenesis in a model of seizures. Epilepsia. 52(9): 1627–1634. 2011.
Gustafson M.P., DiCostanzo A.C., Wheatley C.M., Kim C.H., Bornschlegl S., Gastineau D.A., Johnson B.D., Dietz A.B. A systems biology approach to investigating the influence of exercise and fitness on the composition of leukocytes in peripheral blood. J. Immunother. Cancer. 5: 30. 2017. https://doi.org/10.1186/s40425-017-0231-8
Timmons B.W., Cieslak T. Human Natural Killer Cell Subsets and Acute Exercise: A Brief Review. Exerc. Immunol. Rev. 14: 8–23. 2008.
Terra R., Gonçalves da Silva S.A., Pinto V.S., Dutra P.M.L. Effect of exercise on immune system: response, adaptation and cell signaling. Rev. Bras. Med. Esporte. 18(3): 208–214. 2012.
Nascimbeni M., Pol S., Saunier B. Distinct CD4+ CD8+ double-positive T cells in the blood and liver of patients during chronic hepatitis B and C. PLoS One. 6(5): e20145. 2011.
de Meis J., Aurélio Farias-de-Oliveira D., Nunes Panzenhagen P.H., Maran N., Villa-Verde D.M., Morrot A., Savino W. Thymus atrophy and double-positive escape are common features in infectious diseases. J. Parasitol. Res. 2012: 574020. 2012.
Overgaard N.H., Jung J.W., Steptoe R.J., Wells J.W. CD4+/CD8+ Double-Positive T Cells: More Than Just a Developmental Stage? J. Leukoc. Biol. 97(1): 31–38. 2015. https://doi.org/10.1189/jlb.1RU0814-3822015
Kim H.P., Imbert J., Leonard W.J. Both Integrated and Differential Regulation of Components of the IL-2/IL-2 Receptor System. Cytokine Growth. Factor Rev. 17(5): 349–366. 2006. https://doi.org/10.1016/j.cytogfr.2006.07.003
Barnett J.B. Consequences of Blocking the Choreography of Double Negative Thymocyte Maturation. In: Signaling Mechanisms Regulating T Cell Diversity and Function. J. Soboloff & D.J. Kappes (Eds.). Boca Raton (FL): CRC Press/Taylor & Francis. Chapter 1. PMID: 30427639 NBK532331 2018. https://doi.org/10.1201/9781315371689-1
Савченко А.А., Борисов А.Г., Кудрявцев И.В., Мошев А.В. Роль Т- и В-клеточного иммунитета в патогенезе онкологических заболеваний. Вопр. онкологии. 61(6): 867–875. 2015. [Savchenko A.A., Borisov A.G., Kudryavtsev I.V., Moshev A.V. Role of t- and b-cell immunity in the pathogenesis of cancer. Problems in Oncology. 61(6): 867–875. 2015. (In Russ)].
Wang R., Chen P.J. Modulation of Dendritic Cells and NKT Cells by Excessive Exercise in Rats. J. Med. Biol. Engineering. 29(4): 190–194. 2009.
Wang R., Chen P. Modulation of NKT Cells and Th1/Th2 Imbalance After alpha-GalCer Treatment in Progressive Load-Trained Rats. Int. J. Biol. Sci. 5(4): 338–343. 2009. https://doi.org/10.7150/ijbs.5.338
Kakanis M.W., Peake J., Brenu E.W., Simmonds M., Gray B., Hooper S.L., Marshall-Gradisnik S.M. The Open Window of Susceptibility to Infection After Acute Exercise in Healthy Young Male Elite Athletes. Exerc. Immunol. Rev. 16: 119–137. 2010.
Vivier E., Raulet D. H., Moretta A., Caligiuri M. A., Zitvogel L., Lanier L. L., Yokoyama W. M., Ugolini S. Innate or adaptive immunity? The example of natural killer cells. Science. 331(6013): 44–49.2011. https://doi.org/10.1126/science.1198682011
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


