Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 12, стр. 1571-1584
Эффективность доставки генов в клетки мозга рыб при помощи рекомбинантных аденоассоциированных вирусов гиппокампа мыши
Е. В. Пущина 1, 2, *, Я. Н. Александрова 1, А. А. Вараксин 1, Д. К. Обухов 3
1 Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
Владивосток, Россия
2 Институт физиологии им. Богомольца Национальной академии наук Украины
Киев, Украина
3 Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
* E-mail: puschina@mail.ru
Поступила в редакцию 11.04.2020
После доработки 04.06.2020
Принята к публикации 26.08.2020
Аннотация
Вирусные векторы представляют собой гибкую систему, которая может эффективно доставлять экзогенный генетический материал в различные клетки-мишени и, таким образом, является потенциально мощным инструментом для генетических манипуляций. Для доставки вирусных генов проводилась инъекция рекомбинантных аденоассоциированных векторов по методу Wallace [1]. Использование рекомбинантных аденоассоциированных векторов позволяет вирусным частицам сравнительно легко диффундировать из области инъекции и достаточно быстро воспроизводиться в клетках мозга. Целью работы было исследование эффективности инфекции аденоассоциированных вирусных векторов млекопитающих в различных областях мозга кеты Oncorhynchus keta в возрасте 2 лет при краткосрочных (4 и 8 дней) и долговременном (10 недель) интервалах с последующей ультраструктурной диагностикой нервной ткани в области инъекции. Было установлено, что аденоассоциированный вектор гиппокампа мыши AAV-1 эффективно инфицировал клетки мозга кеты. Инъекция AAV в различные области мозга: конечный мозг, мозжечок, мезэнцефалический тектум и тегментум кеты индуцировала экспрессию репортерных генов в паллиальных (Dd и Dm) областях конечного мозга, крыше и покрышке среднего мозга, в дорсальной части ствола мозга, а также в мозжечке (valvula и corpus cerebellum). Методами флуоресцентной микроскопии показано, что наличие зеленой флуоресценции связано с экспрессией зеленого флуоресцентного протеина (GFP) в клетках мозга кеты. Данные ультраструктурного анализа подтвердили наличие субклеточных вирусных частиц в клетках мозга и межклеточном пространстве, что свидетельствует о способности к диффузному распространению аденоассоциированного вектора в нервной ткани мозга кеты.
В настоящее время аденовирусные векторы все чаще используются для доставки генетического материала в различные клетки организма. Однако согласно данным [2], аденоассоциированные векторы в ряде случаев обладают токсическим действием на организм млекопитающих, что снижает эффективность их использования. Известно, что аденовирусы способны заражать все классы позвоночных животных, однако менее патогенны для низших позвоночных, в частности, рыб. Для нейрогенетических исследований рыбы все чаще используются в качестве модельных животных, что связано с относительной простотой их содержания по сравнению с дорогостоящими млекопитающими (особенно приматами), а также с упрощенными биоэтическими нормами при работе с водными позвоночными. Таким образом, аденовирусные системы являются перспективными для генной трансдукции в клетки рыб с целью вакцинации или других экспериментальных исследований, связанных с экспрессией специфических генов. Исследования на медаке и данио показали, что трансдукция AAV в культивируемые соматические клетки Сертоли приводит к эффективной экспрессии трансгенов, это позволяет использовать аденовирусы в качестве хромосомно-неинтегрирующей векторной системы [3]. В исследованиях на белом осетре Acipenser transmontanus был выделен отдельный высокоспецифичный штамм аденовируса с уникальной последовательностью, позволяющей его рассматривать в качестве нового таксономически независимого класса аденовирусов [4, 5].
В исследованиях, проведенных в Национальном институте генетики (Япония), было установлено, что аденовирус (Ad) эффективно вводит двухцепочечную ДНК в клетки, экспрессирующие аденовирусный рецептор Коксаки, но не интегрируется в геном хозяина [6]. Результаты разработок отдела геномной терапии Сайтамского медицинского университета показали, что хелпер-зависимый вектор (с удаленным вирусным геномом) является менее цитотоксичным, чем E1-делеционный вектор, и поэтому может использоваться для достижения множественного инфицирования [7]. Тем не менее, в Университете Осака было разработано более масштабное клонирования хелпер-зависимых векторов, облегчающих репарацию генов посредством гомологичной рекомбинации в эмбриональные стволовые клетки мыши и приматов [8]. Исследования, проводимые на кафедре радиационной генетики университета Киото, показали, что адено-ассоциированный вирус (AAV) является перспективным вектором для генного таргетинга и относится к другому, отличному от Ad типу вируса, который с низкой частотой вводит одноцепочечную ДНК в клетки генома хозяина [9]. Аденоассоциированные вирусы с успехом были использованы для коррекции доминантной мутации в мезенхимальных стволовых клетках у пациентов с несовершенным остеогенезом [10]. Таким образом, оба типа вирусов являются достаточно эффективными для быстрой доставки генетического материала и могут быть использованы для генной терапии.
Ранее в исследованиях на радужной форели было показано, что аденовирусные векторы человека 5-го типа могут эффективно доставлять трансгены в культивируемые клетки мышц [11]. В других работах была установлена эффективная экспрессия репортерных генов в клетках эмбриональной линии (CHSE-214) китайского лосося, папулезной эпителиомы карпа, лейкоцитах американского угря (PBLE), гонад (RTG-2), жабер (RT-GillW1) и селезенки (RTS-34) радужной форели [12]. Исследования на нервной системе рыб в настоящее время ограничиваются данными на эмбрионах данио [13] и медаке Oryzias latipes [14]. Целью настоящей работы было исследование эффективности инфекции in vivo аденоассоциированных вирусных векторов AAV-1 в различных областях мозга кеты Oncorhynchus keta при кратковременных (4 и 8 дней) и долговременной (10 недель) инкубации с последующей ультраструктурной диагностикой нервной ткани в области инъекции.
МЕТОДЫ ИССЛЕДОВАНИЯ
В работе было использовано 24 особи тихоокеанской кеты Oncorhynchus keta в возрасте 23–24 мес., с длиной тела 30–35 см и массой 285–330 г. Рыбы были получены с Рязановского экспериментального производственного рыбоводного завода в 2017 г. Молодь кеты содержали в аквариуме с аэрируемой морской водой при температуре 16–17°C, с одноразовым кормлением в течение суток. Соотношение освещенного и темнового периодов в сутках составляло 14/10 ч. Содержание растворенного кислорода в воде составляло 7–10 мг/дм3, что соответствует нормальному насыщению. Все экспериментальные манипуляции с животными были проведены в соответствии с правилами, регулируемыми уставом ННЦБМ и Этической комиссией, регламентирующей гуманное обращение с экспериментальными животными.
Введение аденоассоциированного вирусного вектора. В работе использовали готовые рекомбинантные аденоассоциированные вирусы гиппокампа мыши AAV-1. Camc2a.GCaMP6f.WPRE.bGHpA (Inscopix, США). Упаковка, очистка, и определение векторных титров были выполнены в Стэндфордском университете (Inscopix, США). Рекомбинантные векторы очищали с использованием метода осаждения CsCl, и титры геномной копии были определены, как описано ранее [15]. Титры инъекций были оптимизированы по концентрации и составляли 1.68Е (13 мкг/мл), что функционально подтверждено для кальциевой визуализации пирамидных нейронов в дорсальном СА1 гиппокампе мыши.
Рыбы были анестезированы в 0.1%-ном растворе трикаин-метансульфоната MS222 (Sigma, США) в течение 5–10 мин. После анестезии первой группе животных в область правого полушария теленцефалона с помощью шприца Гамильтона вводили 0.2 мкл раствора рекомбинантного ААV на 0.1 М фосфатном буфере (n = 4 для каждой группы). Контрольные животные получали 0.2 мкл 0.1 М фосфатного буфера (n = 4). Через 4 дня после инъекции животные выводились из эксперимента и подвергались эвтаназии методом быстрой декапитации. Второй группе животных в область мозжечка, правого полушария тектума и тегментума вводили аналогичный объем раствора рекомбинантного ААV (n = 4 для каждой группы), а контрольные животные получали соответствующее количество 0.1 М фосфатного буфера (n = 4). Через 8 дней после инъекции животные выводились из эксперимента. Третьей группе животных в область мозжечка вводили раствор ААV (n = 4 для каждой группы), группа контрольных животных (n = 4) получала 0.1 М фосфатный буфер. Через 10 недель после инъекции животные третьей группы выводились из эксперимента аналогичным способом.
Головной мозг инъецированных рыб префиксировали в 4%-ном растворе параформальдегида, приготовленном на 0.1 М фосфатном буфере (pH 7.2). После префиксации мозг извлекали из полости черепа и фиксировали в том же растворе в течение 2 ч при температуре 4°C. Затем в течение двух суток промывали в 30%-ном растворе сахарозы при 4°C, с пятикратной сменой раствора. Серийные фронтальные срезы мозга кеты толщиной 50 мкм изготавливали с помощью замораживающего микротома (Cryo-star HM 560 MV, Thermo Scientific, США).
Микроскопия. В работе для визуализации и проведения морфологического анализа был использован моторизированный инвертированный микроскоп исследовательского класса с флуооресцентным модулем и приставкой улучшенного контрастирования при работе с люминесценцией Axiovert 200 M с модулем ApoTome (Carl Zeiss, Германия). Для исследования микрофотографии препаратов и анализ материала осуществляли с помощью программы Axio Vision (Carl Zeiss, Германия). Измерения проводили при использовании объективов с увеличением 10×, 20× и 40× в 10 случайно выбранных полях зрения для каждой области исследования. Подсчет количества GFP-экспрессирующих клеток в поле зрения осуществляли при увеличении 200×. Морфометрический анализ параметров клеточных тел (измерение большого и малого диаметров сомы нейронов) проводили с помощью программного обеспечения микроскопа Axio Vision.
Трансмиссионная электронная микроскопия. Различные отделы мозга кеты в соответствии со схемой введения AVV (4 дня, 8 дней и 10 недель соответственно) были зафиксированы в 2.5%-ном глютаральдегиде на 0.1 М какодилатном буфере и постфиксировали в 2%-ном растворе осмия на 0.1 М какодилатном буфере. Материал заливали в смолу LR White. Ультратонкие срезы толщиной 60 нм были получены на ультрамикротоме Ultracut Leica UC6 (Leica Microsystems, Германия). Срезы контрастировали уранилацетатом и цитратом свинца и исследовали с помощью трансмиссионного электронного микроскопа SIGMA 300 VP (Zeiss AG, Карл Цейсс, Германия).
Статистическая обработка данных. Количественная обработка результатов была выполнена с помощью программ Описательная статистика Microsoft Excel 2010 и Statistica 12. Плотность распределения и размерные характеристики клеток оценивались с помощью методов вариационной статистики. Для количественной оценки результатов находились средние значения и стандартное отклонение (М ± SD). Измерения в группах сравнивались с использованием одностороннего дисперсионного анализа (ANOVA). Значения при р ≤ 0.05 считались статистически значимыми.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате однократного введения AVV в различные отделы головного мозга кеты были выявлены GFP-экспрессирующие клетки в областях инъекции и в отдельных случаях в прилежащих проекционных областях мозга (рис. 1А–F).
Рис. 1.
Экспрессия GFP в различных областях мозга кеты Oncorhynchus keta после инъекции аденоассоциированного вектора гиппокампа мыши (AAV). А – зеленый флуоресцентный протеин (GFP)-экспрессирующие клетки (красные стрелки) вокруг области инъекции в теленцефалон через 4 дня после введения AAV, на врезке – увеличенный фрагмент (в желтом прямоугольнике), красным прямоугольником в правом верхнем углу показана область инъекции; Dd – дорсальная, Dm – медиальная, Dl – латеральная, Dc – центральная зоны паллиума. B – срез теленцефалона контрольного животного. C – GFP-экспрессирующие клетки вокруг области инъекции (показана белой звездочкой) в мозжечок через 8 дней после введения AAV. D – вокруг области инъекции в оптический тектум (ТеО), CA – передняя комиссура, TL – продольный торус. E – GFP-экспрессирующие клетки в тегментуме через 8 дней после введения AAV; PVZ – перивентрикулярная зона тегментума, MRF – мезенцефалическая ретикулярная формация, BT – базальный тегментум. F – GFP-экспрессирующие клетки в дорсо-латеральной ретикулярной формации (DLRF) через 10 недель после введения AAV в мозжечок. Флуоресцентная микроскопия. Масштабный отрезок 200 мкм. Fig. 1. GFP expression in various brain regions of chum salmon Oncorhynchus keta after AAV injection. A – GFP-expressing cells (red arrows) around the injection area in the telencephalon 4 days after the injection of AAV, the inset shows the enlarged fragment (in the yellow rectangle), the injection area is shown in the red rectangle in the upper right corner; Dd – dorsal, Dm – medial, Dl – lateral, Dc – central pallium zone. B – section of the telencephalon of the control animal. C – GFP-expressing cells around the injection area (indicated by a white star) in the cerebellum 8 days after the injection of AAV. D – around the area of injection into the tectum opticum (TeO), PC – anterior commissure, TP – torus longitudinalis. E – GFP-expressing cells in tegmentum 8 days after the injection of AAV; PVZ – periventricular zone of the tegmentum, MRF – mesencephalic reticular formation, and BT – basal tegmentum. F – GFP-expressing cells in the dorsolateral reticular formation (DLRF) 10 weeks after the injection of AAV into the cerebellum. Fluorescence microscopy. The scale bar – 200 microns.
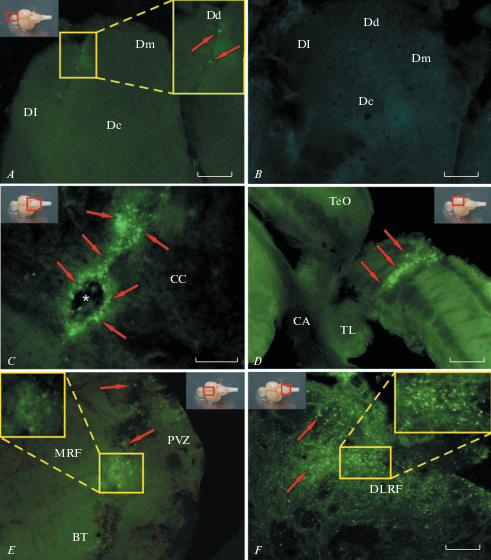
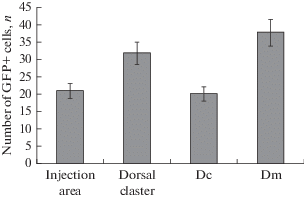
Через 4 дня после введения AAV в правое полушарие конечного мозга вокруг области инъекции были выявлены отдельные GFP-экспрессирующие клетки (рис. 1А). После инъекции в дорсальную зону паллиума кеты GFP-экспрессирующие клетки были также обнаружены в дорсальном скоплении (Dd), медиальной части паллиума (Dm) и в центральной (Dc) зоне (табл. 1, рис. 2). Во всех областях паллиума, содержащих трансгенную экспрессию AAV, преобладали клетки небольших размеров за исключением центральной области, содержащей более крупные нейроны (табл. 1). Сравнительное распределение GFP-экспрессирующих клеток показано на рис. 2. В центральной области и участках, ограничивающих зону инъекции, количество клеток, экспрессирующих репортерные гены, было ниже, чем в поверхностных слоях дорсальной и медиальной паллиальных зон (рис. 2). На контрольных препаратах GFP-экспрессирующие клетки выявлены не были (рис. 1B).
Таблица 1.
Морфометрические параметры* GFP-экспрессирующих клеток в теленцефалоне кеты Oncorhynchus keta через 4 дня после инъекции AAV Table 1. Morphometric parameters* of GFP-expressing cells in the telencephalon of chum salmon Oncorhynchus keta 4 days after AAV injection
| Типы клеток Cell types |
Область инъекции Injection area |
Дорсальное
скопление Dorsal cluster |
Медиальная
зона паллиума Dm |
Центральная
зона паллиума Dc |
|---|---|---|---|---|
| Размеры клеток (M±SD), мкм Cell sizes (M±SD), µm |
7.8 ± 0.6/5.8 ± 0.7 5.8 ± 0.6/4.6 ± 0.8 |
7.6 ± 0.4/5.6 ± 0.5 6.2 ± 0.7/5.1 ± 0.6 |
7.8 ± 0.6/5.8 ± 0.7 5.8 ± 0.6/4.6 ± 0.8 |
12.8 ± 0.6/10.4 ± 1.4 9.5 ± 0.2/7.7 ± 0.9 7.9 ± 0.6/6.0 ± 0.6 |
Рис. 2.
Сравнительное распределение GFP-экспрессирующих клеток (M ± SD) в различных областях теленцефалона кеты Oncorhynchus keta через 4 дня после введения AAV. Fig. 2. Comparative distribution of GFP-expressing cells (M ± SD) in various regions in the telencephalon of chum salmon Oncorhynchus keta 4 days after the injection of AAV.
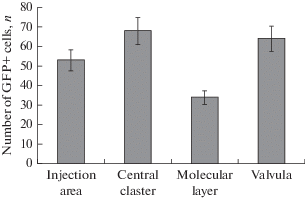
Через 8 дней после введения AAV в дорсальную часть тела мозжечка вокруг области инъекции визуализировались многочисленные GFP-экспрессирующие клетки (рис. 1C). Нейроны, экспрессирующие трансгены и образующие другую центрально расположенную популяцию, были обнаружены в каудальной части тела мозжечка, а также в заслонке мозжечка, дистанционно удаленной от зоны инъекции (табл. 2 , рис. 3). Морфометрические параметры GFP-экспрессирующих клеток свидетельствуют о гетерогенности популяции, содержащей трансгены в указанном временном диапазоне. Большинство GFP-экспрессирующих клеток было выявлено в молекулярном слое (рис. 3). Наличие большого количества клеток, экспрессирующих трансгены в заслонке мозжечка, свидетельствует о способности AAV к антероградному транспорту в трансцеребеллярную зону (рис. 3).
Таблица 2.
Морфометрические параметры GFP-экспрессирующих клеток в мозжечке кеты Oncorhynchus keta через 8 дней после инъекции AAV Table 2 . Morphometric parameters* of GFP-expressing cells in the cerebellum of chum salmon Oncorhynchus keta 8 days after AAV injection
| Типы клеток Cell types |
Область
инъекции Injection area |
Центральное
скопление Central cluster |
Молекулярный слой Molecular layer |
Заслонка Valvulla cerebelli |
| Размеры клеток (M±SD), мкм Cell sizes (M±SD), µm |
10.2 ± 0.2/7.3 ± 0.6 8.9 ± 0.6/7.1 ± 0.6 7.2 ± 0.6/6.1 ± 0.7 |
11.3 ± 0.6/10.0 ± 0.5 9.3 ± 0.4/8.3 ± 0.9 |
8.0 ± 0.5/5.3 ± 0.5 6.8 ± 0.3/4.9 ± 0.6 5.0 ± 0.7/3.8 ± 0.6 |
10.2 ± 0.4/7.1 ± 0.2 7.8 ± 0.4/5.9 ± 0.8 6.3 ± 0.7/5.4 ± 0.8 |
Рис. 3.
Сравнительное распределение GFP-экспрессирующих клеток (M ± SD) в различных областях мозжечка кеты Oncorhynchus keta через 8 дней после введения AAV. Fig. 3. Comparative distribution of GFP-expressing cells (M ± SD) in various regions in the cerebellum of chum salmon Oncorhynchus keta 8 days after the injection of AAV.
Введение AAV в медиальную часть оптического тектума и более глубокие слои покрышки среднего мозга через аналогичный промежуток времени показало наличие GFP-экспрессирующих нейронов в зрительном тектуме (рис. 1D) и в различных регионах тегментума (рис. 1Е, табл. 3). Морфометрический анализ различных областей мезенцефалона выявил более крупные клетки, содержащие репортерные гены, чем в конечном мозге и мозжечке (табл. 1–3 ). Высокая морфологическая гетерогенность позволяет выделять несколько типов GFP-экспрессирующих клеток в тектуме, перивентрикулярных и субвентрикулярных областях тегментума, мезенцефалической ретикулярной формации и базальном тегментуме (табл. 3). Анализ распределения GFP-экспрессирующих клеток показал, что в данном временном диапазоне наибольшее количество нейронов, содержащих трансгены, выявлено в оптическом тектуме и MRF (рис. 4).
Таблица 3.
Морфометрические параметры GFP-экспрессирующих клеток в мезенцефалоне кеты Oncorhynchus keta через 8 дней после инъекции AAV Table 3. Morphometric parameters of GFP-expressing cells in the mesencephalon of chum salmon Oncorhynchus keta 8 days after AAV injection
| Типы клеток Cell types |
Зрительный тектум Tectum opticum |
Тегментум ПВЗ и СВЗ Tegmentum PVZ, SVZ |
Мезенцефалическая ретикулярная формация MRF |
Базальный
тегментум Basal tegmentum |
|---|---|---|---|---|
| Размеры клеток (M±SD), мкм Cell sizes (M±SD), µm |
17.0 ± 0.8/10.8 ± 2.4 14.8 ± 1.0/11.0 ± 1.9 11.2 ± 1.0/8.3 ± 1.5 8.8 ± 0.5/7.9 ± 0.3 |
19.8 ± 1.2/15.9 ± 0.8 11.9 ± 0.9/9.8 ± 1.8 8.9 ± 0.6/7.6 ± 0.9 7.2 ± 0.6/4.9 ± 0.8 |
11.0 ± 1.4/8.6 ± 2.4 8.6 ± 0.7/6.4 ± 0.7 7.0 ± 0.6/5.7 ± 0.7 5.8 ± 0.2/4.8 ± 1.4 |
11.3 ± 0.6/9.8 ± 0.8 8.8 ± 0.5/6.7 ± 0.7 6.9 ± 0.7/5.8 ± 1.0 |
Рис. 4.
Сравнительное распределение GFP-экспрессирующих клеток (M ± SD) в различных областях мезенцефалона кеты Oncorhynchus keta через 8 дней после введения AAV. Fig. 4. Comparative distribution of GFP-expressing cells (M ± SD) in various regions in the mesencephalon of chum salmon Oncorhynchus keta 8 days after the injection of AAV.

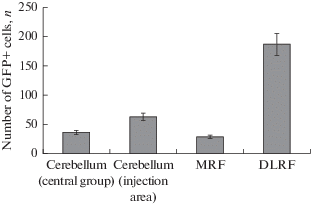
Через 10 нед. после инъекции AAV в тело мозжечка популяции GFP-экспрессирующих клеток были обнаружены как в области инъекции и прилежащей центральной зоне мозжечка, так и в составе антероградных экстрацеребеллярных проекций ростральной части ствола – дорсо-латеральной ретикулярной формации (DLRF) и медиальной ретикулярной формации (MRF) (табл. 4). Большая популяция GFP-экспрессирующих нейронов была выявлена в DLRF (рис. 1F, рис. 5). В составе MRF были выявлены наиболее крупные нейроны, содержащие репортерные гены (табл. 4).
Таблица 4.
Морфометрические параметры GFP-экспрессирующих клеток в мозжечке и ростральной части ствола мозга кеты Oncorhynchus keta через 10 недель после инъекции AAV Table 4. Morphometric parameters of GFP-expressing cells in the cerebellum and rostral part of brainstem of chum salmon Oncorhynchus keta 10 weeks after AAV injection
| Типы клеток Cell types |
Мозжечок (центральная группа) Cerebellum (central group) |
Мозжечок (зона инъекции) Cerebellum (injection area) |
Мезенцефалическая ретикулярная формация MRF |
Дорсо-латеральная ретикулярная
формация DLRF |
|---|---|---|---|---|
| Размеры клеток (M±SD), мкм Cell sizes (M±SD), µm |
10.2 ± 0.3/7.0 ± 0.5 8.6 ± 0.5/7.0 ± 0.5 7.0 ± 0.2/6.3 ± 0.3 |
11.0 ± 1.1/8.2 ± 1.3 8.8 ± 0.6/7.0 ± 0.9 7.2 ± 0.3/6.0 ± 0.7 |
58.6 ± 3.1/33.2 ± 2.7 41.6 ± 2.8/30.0 ± 4.5 33.2 ± 2.2/20.2 ± 5.6 19.4 ± 1.8/14.2 ± 0.3 14.3 ± 1.4/11.2 ± 2.1 |
12.8 ± 0.5/9.5 ± 1.2 10.5 ± 0.6/8.5 ± 1.0 |
Рис. 5.
Сравнительное распределение GFP-экспрессирующих клеток (M ± SD) в мозжечке и ростральной части ствола мозга кеты Oncorhynchus keta через 10 недель после инъекции AAV. Fig. 5. Comparative distribution of GFP-expressing cells (M ± SD) in the cerebellum and rostral part of brainstem of chum salmon Oncorhynchus keta 10 weeks after the injection of AAV.
Долговременная 10-недельная экспозиция после инъекции AAV привела к широкому распространению клеток, экспрессирующих трансгены, и частиц субклеточного размера в области инъекции, а также в составе антероградных, ретроградных и, возможно, реципрокных проекционных областей ствола (рис. 6А). Исследование данных областей в режиме фазового контраста показало наличие большого числа плотных телец темного цвета в области локализациии GFP-экспрессирующих клеток (рис. 6B). При увеличении данных областей AAV-содержащие участки продолговатого мозга выглядели как темные оптически-плотные скопления, хорошо различимые в режиме проходящего света (рис. 6C). Ультраструктурное исследование данных областей показало, что скопления аденоассоциированных вирусов выглядят как темные гранулосодержащие внутри- и внеклеточные структуры, в составе которых различимы отдельные вирусные частицы (рис. 6D).
Рис. 6.
Экспрессия репортерных генов в продолговатом мозга кеты Oncorhynchus keta через 10 недель после инъекции AAV. А – GFP-экспрессирующие клетки (красная стрелка) в области crista cerebellaris, в белом квадрате скопление трансгенных клеток; MO – продолговатый мозг, CrC – мозжечковый крест. B – срез мозга (на А) в режиме фазового контраста, в черном квадрате скопление трансгенных клеток. C – увеличенный фрагмент мозга, содержащий скопления аденовирусных частиц (на B), на врезке (левый верхний угол) показаны нейроны (желтые стрелки). D – ультраструктурная организация фрагмента crista cerebellaris, в квадрате показано гранулосодержащее скопление аденовирусных частиц (увеличенный фрагмент на врезке), красными стрелками показаны скопления различной плотности вирусных капсидов внутри ядер (ncl) клеток и межклеточном пространстве. А – флуоресцентная микроскопия, B, C – фазово-контрастная микроскопия, D – трансмиссионная электронная микроскопия. Масштабный отрезок: А, B – 200 мкм, C – 100 мкм, D – 2 мкм. Fig. 6. Expression of reporter genes in the medulla oblongata of chum salmon Oncorhynchus keta 10 weeks after AAV injection. A – GFP-expressing cells (red arrow) in the region of crista cerebellaris, in a white square the accumulation of transgenic cells; MO – medulla oblongata, СrC – crista cerebellaris. B – brain section (on A) in phase contrast mode, in a black square accumulation of transgenic cells. C – an enlarged fragment of the brain containing clusters of AAV particles (on B), neurons (yellow arrows) are shown in the inset (upper left corner). D – ultrastructural organization of the crista cerebellaris fragment; the granule-containing cluster of AAV particles (enlarged fragment in the inset) is shown in the square; red arrows show clusters of different density of viral capsids inside the cell nuclei (ncl) and intercellular space. A –fluorescence microscopy, B, C – phase contrast microscopy, D – transmission electron microscopy. Scale bar: A, B – 200 microns, C – 100 microns, D – 2 microns.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты проведенного исследования показали, что AAV может эффективно трансдуцироваться в клетках мозга кеты. При различных сроках инкубации вирусного вектора GFP-экспрессирующие клетки обнаруживались как вблизи зоны инъекции, так и в удаленных от инъекции областях, куда, очевидно, вектор доставлялся с помощью внутриклеточного транспорта. В настоящее время механизмы аденовирусной транспортировки до конца не ясны [16]. В исследованиях вентральной тегментальной области (VTA) млекопитающих, получавших инъекции различных серотипов AAV, было установлено, что после долговременной экспозиции вектора (1 месяц и более) вирусные частицы выявлялись в антероградных и ретроградних проекциях VTA [16] и вдоль проводящих путей [17]. При однократных инъекциях AAV-1, AAV-9 или AAV-Rh.10 обнаруживалась экспрессия кДНК лизосомального фермента β-глюкуронидазы, что приводило к переносу аденовирусного генома в области дистальной проекции VTA [18]. Кроме того, в некоторых случаях вектор способен самостоятельно транспортироваться по нейрональным путям [19, 20]. Это приводит к доставке AAV даже на очень удаленные расстояния в мозгу, показывая таким образом, что два транспортных механизма способны работать синергетически.
В наших исследованиях на кете краткосрочная (4 дня) экспозиция AAV в теленцефалон приводила в основном к трансдукции вирусных генов в нейроны, прилежащих к области инъекции, хотя GFP-экспрессирующие клетки обнаруживались и в более удаленных областях (Dc и Dm). Тем не менее, непродолжительный срок инкубации вектора в данном случае определял сравнительно ограниченный паттерн экспрессии репортерных генов в теленцефалоне кеты.
При более долгосрочной (8 дней) экспозиции AAV в мозжечке и мезенцефалоне мы наблюдали более обильное биораспределение трансгенов в области инъекции, при котором количество GFP-экспрессирующих клеток достоверно (р < 0.05) превышало таковое в теленцефалоне (рис. 7). В данном варианте эксперимента GFP-экспрессирующие клетки были обнаружены в удаленных проекционных областях – заслонке, MRF и базальном тегментуме, что, очевидно, свидетельствует о внутриклеточном перемещении вирусных частиц с помощью антероградного транспорта.
Рис. 7.
Сравнительное соотношение GFP-экспрессирующих клеток (М ± SD) в области инъекции AAV. По оси абсцисс: 1 – через 4 дня, теленцефалон; 2 – через 8 дней, мозжечок; 3 – через 8 дней, оптический тектум; 4 – через 10 недель, мозжечок (n = 4 в каждой группе; # – значимые межгрупповые отличия). Односторонний дисперсионный анализ (ANOVA). Fig. 7. Comparative ratio of GFP-expressing cells (M ± SD) in the area of AAV injection. On the absicissa axis: 1 – after 4 days, telencephalon; 2 – after 8 days, the cerebellum; 3 – after 8 days; the optical tectum; 4 – after 10 weeks, the cerebellum (n = 4 in each group; # – significant intergroup differences). One-way analysis of variance (ANOVA).
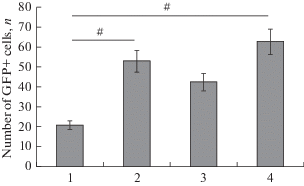
Исследования долговременной (10 нед.) экспозиции AAV после инъекции в мозжечок кеты показало обширное распространении GFP-экспрессирующих клеток в DLRF (рис. 5). В области инъекции в мозжечок было выявлено относительно небольшое количество GFP-экспрессирующих клеток по сравнению c 8-дневным периодом (рис. 7). Наличие обширной популяции клеток, содержащих трансгены в составе DLRF, свидетельствует об интенсивном распространении AAV в составе мозжечковых ножек, по которым, очевидно, вектор с помощью аксонального транспорта был доставлен в дорсальные слои crista cerebellaris. Исследование в режиме фазового контраста показало наличие большого количества темных плотных вирусных частиц в данной области мозга кеты. Данные трансмиссионной электронной микроскопии показали скопления различной плотности вирусных капсидов внутри ядер клеток ретикулярной формации и межклеточном пространстве, где эти частицы были представлены в виде эписом. В литературе, описывающей исследования с вирус-опосредованной доставкой трансгенов в нервную ткань, в основном, сделан акцент на описании внутриклеточных событий [2, 3]. Тем не менее, полученные на кете данные подтверждают диффузный способ распространения AAV [1], в том числе и в межклеточном пространстве, что является интересным и значимым наблюдением. Таким образом, долговременная экспозиция AAV в мозжечке и ретикулярной формации ствола кеты не вызывала заметных токсических эффектов при достаточно интенсивном распространении вирусных частиц в мозге животного, что соответствует предположению о низкой токсичности аденоассоциированных вирусных векторов для мозга рыб [11]. У животных в возрасте 2 лет в каудальных отделах мозга – мозжечке и продолговатом мозге – уже достаточно хорошо развиты проекционные двигательные системы нисходящих и восходящих проводящих путей в составе ретикулярной формации ствола. Наличие такой развитой нейрональной и проводящей инфраструктуры обеспечивает возможность для эффективного распространения вирусных частиц с помощью антеро-/ретроградного транспорта, что многократно повышает эффективность использования аденовирусных векторов для исследования экспрессии специфических генов в ЦНС лососевых рыб. Ранее аденовирусные векторы были использованы лишь в культуре клеток рыб [11, 12] и других тканевых системах рыб [3, 13, 14]. Исследования на эмбрионах данио показало, что использование аденовирусов, содержащих усиленный зеленый флуоресцентный протеин (Ad-EGFP) вызывает довольно высокую смертность в раннем постэмбриональном периоде, что, вероятно, объясняется накопительными цитотоксическими эффектами [13]. Результаты использования AAV на различных отделах мозга 2-летней кеты при краткосрочных и долгосрочных временных интервалах свидетельствуют об эффективном распространении трансгенов в клетках ЦНС in vivo и низкой цитотоксичности используемых аденоассоциированных векторов.
Список литературы
Wallace D.J., Meyer zum Alten Borgloh S., Astori S.,YangY., Bausen M., Kügler S. Single-spike detection in vitro and in vivo with a genetic Ca2+ sensor. Nat. Methods. 5: 797–804. 2008. https://doi.org/10.1038/nmeth.1242
Zirger J.M., Puntel M., Bergeron J., Wibowo M., Moridzadeh R., Bondale N., Barcia C., Kroeger K.M., Liu C., Castro M.G. Immune-mediated loss of transgene expression from virally transduced brain cells is irreversible, mediated by IFNγ, perforin, and TNFα, and due to the elimination of transduced cells. Mol. Ther. 20: 808–819. 2012.
Kawasaki T., Saito K., Mitsui K., Ikawa M., Yamashita M., Taniguchi Y., Takeda S., Mitani K., Sakai N. Introduction of a foreign gene into zebrafish and medaka cells using adenoviral vectors. Zebrafish. 6: 3. 2009. doi: 10.1089/zeb.2009.0596
Benko M., Harrach B. Molecular evolution of adenoviruses. In: Current Topics in Microbiological and Immunology. Doerfler W., Böhm P. (Eds.). Berlin. Springer. V. 272. 4–35. 2003.
Kovácsa G.M., LaPatrab S.E., D’Halluinc J.C., Mária Benko. Phylogenetic analysis of the hexon and protease genes of a fish adenovirus isolated from white sturgeon (Acipenser transmontanus) supports the proposal for a new adenovirus genus. Virus Res. 98: 27–34. 2003.
Bergelson J.M., Cunningham J.A., Droguett G., Kurt-Jones E.A., Krithivas A., Hong J.S. Isolation of a common receptor for Coxsackie B viruses and adenoviruses 2 and 5. Science. 275: 1320–1323. 1997.
Palmer D.J., Ng P. Helper-dependent adenoviral vectors for gene therapy. Hum. Gene Ther. 6: 1–16. 2005.
Ohbayashi F., Balamotis M.A., Kishimoto A., Aizawa E., Diaz A., Hasty P. Correction of chromosomal mutation and random integration in embryonic stem cells with helper-dependent adenoviral vectors. Proc. Natl. Acad. Sci. USA. 102: 13628–13633. 2005.
Suzuki K., Mitsui K., Aizawa E., Hasegawa K., Kawase E., Yamagishi T. Highly efficient transient gene expression and gene targeting in primate embryonic stem cells with helper-dependent adenoviral vectors. Proc. Natl. Acad. Sci. USA. 105: 13781–13786. 2008.
Chamberlain J.R., Schwarze U., Wang P.R., Hirata R.K., Hankenson K.D., Pace J.M. Gene targeting in stem cells from individuals with osteogenesis imperfecta. Science. 303: 1198–1201. 2004.
Overturf K., LaPatra S., Renolds P.N. The effectiveness of adenoviral vectors to deliver and express genes in rainbow trout, Oncorhynchus mykiss (Walbaum). J. Fish Diseases. 26: 91–101. 2003.
Rainbow A.J., Zacal N.J. Expression of an adenovirus encoded reporter gene and its reactivation following UVC and oxidative damage in cultured fish cells. Int. J. Radiat. Biol. 84(6): 455–466. 2008.
Gulías P., Guerra-Varela J., Gonzalez-Aparicio M., Ricobaraza A., Vales A., Gonzalez-Aseguinolaza G., Hernandez-Alcoceba R., Sánchez L. Danio rerio as model organism for adenoviral vector evaluation. Genes. 10: 1053. 2019. https://doi.org/10.3390/genes10121053
Suehiro Y., Kinoshita M., Okuyama T., Shimada A., Naruse K., Takeda H., Kubo T, Hashimoto M., Takeuchi H. Transient and permanent gene transfer into the brain of the teleost fish medaka (Oryzias latipes) using human adenovirus and the Cre-loxP system. FEBS Letters. 584: 3545–3549. 2010.
Gao G., Qu G.,Burnham M. S., Huang J.,Chirmule N., Joshi B.,Yu Q.C., Marsh J.A., Conceicao C.M., Wilson J.M. Purification of recombinant adenoassociated virus vectors by column chromatography and its performance in vivo. Hum. Gene Ther. 11: 2079–2091. 2000.
Cearley C.N., Wolfe J.H. A single Injection of an adenoassociated virus vector into nuclei with divergent connections results in widespread vector distribution in the brain and global correction of a neurogenetic disease. J. Neurosci. 27(37): 9928–9940. 2007.
Luca T., Givogri M.I., Perani L., Galbiati F., Follenzi A, Naldini L., Bongarzone E.R. Axons mediate the distribution of arylsulfatase A within the mouse hippocampus upon gene delivery. Mol. Ther. 12: 669–679. 2005.
Dodge J.C., Clarke J., Song A., Bu J., Yang W., Taksir T.V., Griffiths D., Zhao M.A., Schuchman E.H., Cheng S.H., O’Riordan C.R., Shihabuddin L.S., Passini M.A., Stewart G.R. Gene transfer of human acid sphingomyelinase corrects neuropathology and motor deficits in a mouse model of Niemann-Pick type A disease. Proc. Natl. Acad. Sci. USA. 102: 17822–17827. 2005.
Passini M.A., Lee E.B., Heuer G.G., Wolfe J.H. Distribution of a lysosomal enzyme in the adult brain by axonal transport and by cells of the rostral migratory stream. J. Neurosci. 22: 6437–6446. 2002.
Hennig A.K., Levy B., Ogilvie J.M., Vogler C.A., Galvin N., Bassnett S., Sands M.S. Intravitreal gene therapy reduces lysosomal storage in specific areas of the CNS in mucopolysaccharidosis VII mice. J. Neurosci. 23: 3302–3307. 2003.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


