Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 12, стр. 1564-1570
Влияние ролипрама на осморегулирующую функцию почек у крыс с различным уровнем вазопрессина в крови
П. Д. Правикова 1, *, Т. С. Курляндчик 2, Л. Н. Иванова 1, 2
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
2 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
* E-mail: pollypravi@yandex.ru
Поступила в редакцию 14.08.2020
После доработки 28.09.2020
Принята к публикации 04.10.2020
Аннотация
Исследовано влияние селективного ингибитора фосфодиэстеразы 4 (ФДЭ-4) ролипрама, устраняющего деградацию цАМФ, на осморегулирующую функцию почек у крыс линий WAG и Brattleboro с различным уровнем вазопрессина в крови. У крыс WAG с высоким уровнем вазопрессина в крови при введении ролипрама наблюдалось значительное ускорение диуреза, обусловленное увеличением экскреции натрия, а также снижением реабсорбции осмотически свободной воды. Функциональные параметры сопровождались нарастанием гистохимически выявляемых гликозаминогликанов, определяющих проницаемость интерстициального матрикса гормон-чувствительной зоны почечной медуллы. В то же время для вазопрессин-дефицитных крыс линии Brattleboro со сниженной активностью аденилатциклазной системы в почке введение ролипрама сопровождалось развитием антидиуретической реакции без существенных изменений как параметров натрийуретической функции, так и состояния интерстициального матрикса почки. Результаты исследования свидетельствуют о значительном влиянии ролипрама, устраняющего деградацию цАМФ путем блокады ФДЭ-4, на осморегулирующую функцию почек, изменение параметров которой определяется, главным образом, уровнем вазопрессина и интеграцией эффектов, опосредованных рецепторами вазопрессина V2- и V1a-типа.
В системе регуляции водно-электролитного баланса у млекопитающих главная роль принадлежит почке, способной в широких пределах изменять реабсорбцию воды и натрия при отклонениях объема или осмоляльности внеклеточной жидкости. Ведущую роль в регуляции осмотического гомеостаза у млекопитающих играет нейрогипофизарный гормон вазопрессин, реализующий свой антидиуретический эффект как путем влияния на трансэпителиальный транспорт воды и ионов натрия в собирательных трубках почки [1, 2], так и путем контроля проницаемости интерстициального матрикса, основным компонентом которого является кислый гликозаминогликан гиалуронан, разделяющий элементы противоточного механизма почечной медуллы [3]. Вазопрессин способен оказывать стимулирующий или ингибирующий эффект на транспорт воды и натрия в эпителии почечных канальцев в зависимости от вовлечения рецепторов V2- или V1a-типа, обладающих различной аффинностью [4]. V2-рецепторы базолатеральной мембраны, активируя аденилатциклазную систему, являются триггером гидроосмотического эффекта вазопрессина, в то время как функциональная роль V1а-рецепторов апикальной мембраны – торможение транспорта натрия [4, 5]. Ключевой посредник эффекта вазопрессина – цАМФ, концентрация которого определяется соотношением активности аденилатциклазы и специфических фосфодиэстераз (ФДЭ-4, 7, 8), деградирующих цАМФ [6]. Несмотря на то, что в последние годы достигнут существенный прогресс в понимании молекулярных механизмов действия вазопрессина в эпителии почечных канальцев, выявление новых звеньев в регуляции транспорта воды и ионов остается одной из наиболее интенсивно развиваемых проблем физиологии почек. Цель настоящей работы – исследование морфофункциональных особенностей почек крыс линий WAG и Brattleboro с различным уровнем эндогенного вазопрессина в крови в условиях устранения дергадации цАМФ путем введения ролипрама, селективного ингибитора ФДЭ-4 [7].
МЕТОДЫ ИССЛЕДОВАНИЯ
В опытах использованы крысы из центра коллективного пользования вивария конвенциональных животных Института цитологии и генетики СО РАН, содержавшиеся в условиях стандартного рациона со свободным доступом к питьевой воде и сухому корму. Эксперименты проведены на половозрелых крысах инбредной линии WAG (Wistar Albino Glaxo) с высоким уровнем вазопрессина в крови и гомозиготных крысах линии Brattleboro, лишенных гормона вследствие мутации гена вазопрессина [8]. Исследование выполнено в соответствии с международными рекомендациями по работе с экспериментальными животными [9]. Крысы в возрасте 60-ти дней и массой 150–200 г были разделены на 4 экспериментальные группы (по 9 особей в каждой): контрольные крысы WAG и Brattleboro, которым внутрибрюшинно вводился физиологический раствор в объеме 0.1 мл/100 г массы тела и экспериментальные особи линий WAG и Brattleboro с внутрибрюшинным введением ингибитора ФДЭ-4 ролипрама (Sigma, США) в дозе 0.4 мг/100 г массы тела дважды с интервалом 120 мин между иъекциями [10]. Ролипрам предварительно растворяли в капле 96%-ного этанола, а затем разводили в физиологическом расворе. С учетом действия препарата [11, 12], через 30 мин после второй инъекции животных помещали в индивидуальные клетки с проволочным дном для сбора спонтанно выделяющейся мочи в течение 90 мин. По окончании эксперимента животных, предварительно анестезированных тиопенталом натрия (10 мг/100 г массы тела), декапитировали и забирали пробы крови, а также образцы почечной ткани. Осмоляльность мочи и плазмы крови определяли криоскопическим методом (миллиосмометр ОСКР-1М КИВИ, Россия). Концентрацию креатинина в моче и сыворотке крови определяли методом Яффе на спектрофотометре (BioPhotometr plus, “Eppendorf”, Германия, 490 нм). Содержание катионов натрия в пробах мочи и плазмы крови измеряли методом пламенной фотометрии (Flame photometer 410 Sherwood, Великобритания). По стандартным формулам рассчитывали клиренс осмотически активных веществ (Сосм), максимальную реабсорбцию осмотически свободной воды ($T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{\text{C}}}$), экскрецию натрия (ЕNa) и экскретируемую фракцию натрия (FENa). Подготовку почечной ткани для гистохимического анализа (окрашивание альциановым синим на уровне средней трети сосочка почки) проводили по стандартному протоколу [13]. Гистологические препараты изучали с использованием светового микроскопа Axioscop 40 (Carl Zeiss, Германия).
Проверку значимости фактора генотипа и действия препарата ролипрама выполняли с помощью двухфакторного дисперсионного анализа (ANOVA) в программе Statistica 8.0. Данные представлены в виде среднего значения ± ошибка среднего (M ± SEM). Достоверность межлинейных различий оценивали с помощью апостериорного критерия Дункана (posthoc Duncan’s test) для множественных сравнений. Для парного сравнения средних внутри линий применялся критерий Стьюдента для независимых выборок. Различия считались статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Гидруретическая функция у контрольных крыс линий WAG и крыс Brattleboro, содержавшихся на стандартном водно-пищевом рационе, существенно различалась (табл. 1). У крыс WAG зарегистрирована низкая скорость мочеотделения и положительные значения показателей реабсорбции осмотически свободной воды, отражающие высокий уровень эндогенного вазопрессина. В то же время крысы линии Brattleboro, лишенные эндогенного вазопрессина, характеризовались высокой скоростью диуреза и отрицательными показателями реабсорбции воды.
Таблица 1.
Влияние ингибитора ФДЭ-4 ролипрама на гидруретическую функцию крыс линий WAG и Brattleboro Table 1. Effect of rolipram treatment on the hydrouretic function in WAG and Brattleboro rats
| Показатель Parameter |
Экспериментальные группы Groups |
|||
|---|---|---|---|---|
| WAG | Brattleboro | |||
| контроль control |
ролипрам rolipram |
контроль control |
ролипрам rolipram |
|
| Диурез (V), мкл/мин Diuresis (V), μl/min |
1.35 ± 0.18 | 3.2 ± 0.16*** | 23.50 ± 2.80*** | 17.0 ± 2.10# |
| Реабсорбция осмотически свободной воды ($T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{\text{C}}}$), мкл/мин Solute-free water reabsorption ($T_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}^{{\text{C}}}$), μl/min |
10.68 ± 0.83 | 7.5 ± 0.49* | –11.49 ± 2.61*** | –6.78 ± 2.00 |
Все значения представлены как среднее ± ошибка среднего. Различия достоверны при * p < 0.05; *** p < 0.001 – сравнение с контрольной группой крыс линии WAG; #p < 0.05 – сравнение с контрольной группой линии Brattleboro. All values are presented as mean ± SEM. * p < 0.05; *** p < 0.001 compared to WAG control; #p < 0.05 compared to Brattleboro control.
Параметры натрийуретической функции у крыс двух линий также достоверно отличались (табл. 2). У вазопрессин-дефицитных крыс линии Brattleboro были выявлены более высокие показатели осмотического очищения, скорости экскреции и экскретируемой фракции натрия по сравнению с крысами линии WAG. Введение ролипрама, устраняющего деградацию цАМФ путем блокады ФДЭ-4, индуцировало принципиально различные реакции почек у крыс WAG и Brattleboro. У крыс WAG наблюдались значительные изменения натрийуретической функции: увеличение показателя осмотического очищения и скорости экскреции натрия в результате резкого нарастания экскретируемой фракции катиона (табл. 2). Торможение реабсорбции натрия у крыс WAG, по-видимому, привело к уменьшению внутрипочечного концентрационного градиента, что явилось причиной снижения реабсорбции осмотически свободной воды (табл. 1). У вазопрессин-дефицитных крыс Brattleboro в базальных условиях все показатели натрийуретической функции были достоверно выше, чем у крыс WAG, но изменения экскретируемой фракции натрия и скорости его экскреции при введении ролипрама оказались несущественными (табл. 2). Снижение диуреза при введении ролипрама у крыс Brattleboro было связано с нарастанием реабсорбции воды (табл. 1).
Таблица 2.
Влияние ингибитора ФДЭ-4 ролипрама на натрийуретическую функцию крыс линий WAG и Brattleboro Table 2. Effect of rolipram treatment on the natriuretic function in WAG and Brattleboro rats
| Показатель Parameter |
Экспериментальные группы Groups |
|||
|---|---|---|---|---|
| WAG | Brattleboro | |||
| контроль control |
ролипрам rolipram |
контроль control |
ролипрам rolipram |
|
| Клиренс осмотически активных веществ (Сосм), мкл/мин Сlearance of osmotic active compounds (Сosm), μl/min |
7.59 ± 0.94 | 11.78 ± 1.03** | 12.68 ± 0.34** | 10.97 ± 0.66 |
| Cкорость экскреции натрия (ENa), мкмоль/мин Sodiumexcretion (ENa), μmol/min |
0.03 ± 0.005 | 0.30 ± 0.04*** | 0.18 ± 0.04* | 0.23 ± 0.03 |
| Экскретируемая фракция натрия
(FENa), % Fractional excretion of sodium (FENa), % |
0.10 ± 0.002 | 1.28 ± 0.16*** | 0.26 ± 0.01* | 0.35 ± 0.01 |
Как известно, вазопрессин, помимо регуляции факультативной реабсорбции воды, оказывает существенное влияние на транспорт натрия в эпителии почечных канальцев [14, 15], направленность которого зависит от аффинности различного типа рецепторов вазопрессина и определяется его концентрацией в крови [5, 15]. При нормальном физиологическом уровне секреции вазопрессина проявляется антинатрийуретическая реакция, обусловленная активацией V2-рецепторов. В то же время при увеличении секреции вазопрессина в условиях дегидратации активируются V1а-рецепторы апикальной мембраны, трансдукция сигналов которых приводит к усилению скорости выведения натрия [4]. Исходя из этого, обнаруженные особенности реакции на ролипрам у крыс WAG, очевидно, были обусловлены интеграцией эффектов активации V2- и V1a-типа рецепторов вазопрессина, обладающих различной аффинностью к гормону [4, 15]. У крыс линии WAG ролипрам повышал содержание трансмиттера гормона (цАМФ) до характерных высокому уровню вазопрессина в крови значений, что способствовало активации V1a-рецепторов, трансдукция сигнала которых по фосфолипазному сигнальному пути в условиях повышения внутриклеточного содержания Ca2+ [16, 17] приводила к подавлению реабсорбции натрия и проявлению значительного натрийуреза [4]. Выявленное снижение концентрирующей функции у крыс WAG в условиях введения ролипрама является следствием негативной модуляции антидиуретического эффекта вазопрессина, обусловленное, по всей видимости, снижением проницаемости канальцев почки для солей и воды, стимулированной V2-рецепторами вазопрессина [18]. У крыс линии Brattleboro со сниженной активностью всех изоформ аденилатциклазы [19] ролипрам повышал уровень цАМФ до значений, характерных для активации V2-рецепторов, соответственно вызывая нарастание реабсорбции воды и падение диуреза без значительных изменений экскреции натрия (табл. 1, 2).
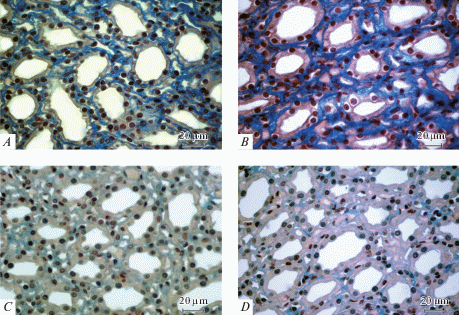
Барьер на пути движения воды и солей из канальцев в кровоток, как известно, представлен не только эпителием, но также внеклеточным матриксом, основным компонентом которого является гликозаминогликан гиалуронан, разделяющий элементы концентрирующей противоточной системы и, в зависимости от полимерности его молекул, определяющий скорость диффузии воды и солей в интерстиции почечной медуллы по осмотическому градиенту [20]. Как известно, продуцентом гиалуронана в медуллярной зоне почки являются интерстициальные клетки, секреторная активность которых зависит от осмоляльности интерстициальной жидкости и регулируется как системными гормонами (вазопрессином, ангиотензином и др.), так и локальными почечными факторами (ПГЕ2, NO и др.), рецепторы которых экспрессируются на клеточной мембране интерстициальных клеток [21, 22]. При гистохимическом исследовании срезов почечной ткани контрольных крыс WAG, экскретирующих мочу с осмоляльностью выше 1800 мОсм/кг H2O выявлена типичная для действия вазопрессина структура медуллярной зоны: уплощенный эпителий собирательных трубок, открытая дренажная сеть множества капилляров и слабое окрашивание кислых гликозаминогликанов интерстиция (рис. 1A). При введении ролипрама у крыс WAG развитие диуреза и снижение осмоляльности мочи, обусловленное торможением реабсорбции воды, сопровождалось повышением высоты клеток эпителия собирательных трубок и увеличением интенсивности окрашивания гиалуронана интерстициального матрикса по сравнению с контролем (рис. 1B). Для интактных гомозиготных вазопрессин-дефицитных крыс линии Brattleboro характерно практически полное отсутствие гистохимически выявляемых гликозаминогликанов интерстициального матрикса почечной медуллы (рис. 1C) [3], структура которого при введении ролипрама на фоне отсутствия изменений параметров осморегулирующей функции не претерпевает значимых изменений (рис. 1D).
Рис. 1.
Влияние ФДЭ-4 ингибитора ролипрама на локализацию гиалуронана средней трети сосочка у крыс WAG и крыс Brattleboro. А – WAG контроль (1819 мОсм/кг H2O); B – WAG, введение ролипрама (891 мОсм/кг H2O); C – Brattleboro контроль (123 мОсм/кг H2O); D – Brattleboro, введение ролипрама (310 мОсм/кг H2O). В скобках дано значение осмоляльности мочи. Окрашивание алциановым синим, объектив ×63. Снимки выполнены с помощью цифровой фотонасадки AxioCam.
Fig. 1. Effect of selective PDE-4 inhibitor (rolipram) on localization of hyaluronan in the middle third of the renal papilla in WAG and Brattleboro rats. A – WAG control (1819 mOsm/kg H2O); B – WAG, injection of rolipram (891 mOsm/kg H2O); C – Brattleboro control (123 mOsm/kg H2O); D – Brattleboro, injection of rolipram (310 mOsm/kg H2O). Remarks: values of urine osmolality are given in brackets. Alcian blue staining, lens x63. The photos were taken with the AxioCam digital camera attachment.
Таким образом, результаты исследования свидетельствуют о значительном эффекте ролипрама, оказывающего влияние на аденилатциклазную систему путем устранения деградации цАМФ, на осморегулирующую функцию почек, изменение параметров которой определяется уровнем вазопрессина в крови и интеграцией эффектов его рецепторов V1a- и V2-типа.
Список литературы
Agre P., King L.S., Yasui M., Guggino Wm.B., Ottersen O.P., Fujiyoshi Y., Engel A., Nielsen S. Aquaporin water channels – from atomic structure to clinical medicine. J. Physiol. 542: 3–16. 2002.
Pearce D., Soundararajan R., Trimpert C., Kashlan O.B., Deen P.M.T., Kohan D. E. Collecting duct principal cell transport processes and their regulation. Clin. J. Am. Soc. Nephrol. 10: 135–146. 2015.
Ivanova L.N., Babina A.V., Baturina G.S., Katkova L.E. Effect of vasopressin on the expression of genes for the key enzymes of hyaluronan turmover in WAG and Brattleboro rat kidney. Exp Physiol. 98(11): 1608–1619. 2013.
Perucca J., Bichet D.G., Bardoux P., Bouby N., Bankir L. Sodium excretion in response to vasopressin and selective vasopressin receptor antagonists. J. Am. Soc. Nephrol. 19: 1721–1731. 2008.
Golosova D.V., Karavashkina T.A., Kutina A.V., Marina A.S., Natochin Y.V. Effects of Selective Agonists of V1a, V2, and V1b Receptors on Sodium Transport in Rat Kidney. Bull. Exp. Biol. Med. 160(6): 751–754. 2016.
Francis S.H., Blount M.A., Corbin J.D. Mammalian cyclic nucleotide phosphodiesterases: molecular mechanisms and physiological functions. Physiol. Rev. 91: 651–690. 2011.
Coffey A.K., O’Sullivan D.J., Homma S., Dousa T.P., Valtin H. Induction of intramembranous particle clusters in mice with nephrogenic diabetes insipidus. Am. J. Physiol. Renal Fluid Electrolyte Physiol. 261: F640–F646. 1991.
Valtin H., Schroeder H.A. Familial hypothalamic diabetes insipidus in rats (Brattleboro rata).1964 [classical article]. J. Am. Soc. Nephrol. 8: 1333–1341. 1997.
Hubrecht R., Kirkwood J. Hertfordshire S.T. (Eds). The UFAW Handbook on the Care and Managementof Laboratory Animals. 2010.
Ding H., Bai F., Cao H., Xu J., Fang L., Wu J., Yuan Q., Zhou Y., Sun Q., He W., Dai C., Zen K., Jiang L., Yang J. PDE/cAMP/Epac/C/EBP-beta signaling cascade regulates mitochondria biogenesis of tubular epithelial cells in renal fibrosis. Antioxid. Redox Signal. 29: 637–652. 2018.
Tanahashi M., Hara S., Yoshida M., Suzuki-Kusaba M., Hisa H., Satoh S. Effects of rolipram and cilostamide on renal functions and cyclic AMP release in anesthetized dogs. J. Pharmacol. Exp. Ther. 289: 1533–1538. 1999.
Ahloulay M., Bankir L., Lugnier C., Le Bec A., Poirel O. Cyclic AMP-phosphodiesterases inhibitor improves sodium excretion in rats with cirrhosis and ascites. Liver Int. 25: 403–409. 2005.
Bancroft J., Gamblee M. Theory and practice of histological techniques. London. 2002.
Cheng C.Y., Chu J.Y., Chow B.K. Vasopressin-independent mechanisms in controlling water homeostasis. J. Mol. Endocrinol. 43: 81–92. 2009.
Bankir L., Bichet D.G., Bouby N. Vasopressin V2 receptors, ENaC, and sodium reabsorption: a risk factor for hypertension? Am. J. Physio. Renal Physiol. 299: F917– F928. 2010.
Thibonnier M., Coles P., Thibonnier A., Shoham M. Molecular pharmacology and modeling of vasopressin receptors. Prog. Brain Res. 139: 179 –196. 2002.
Koshimizu T., Nakamura K., Egashira N., Hiroyama M., Nonoguchi H., Tanoue A., Vasopressin V1a and V1b receptors: from molecules to physiological systems. Physiol. Rev. 92. 1813–1864. 2012.
Ledderhos C., Matsin D.L., Skelton M.M., Cowley A.W. In vivo diuretic actions of renal vasopressin V1 receptor stimulation in rats. Am. J. Physiol. Regul. Integr. Compar. Physiol. 268: 796–807. 1995.
Schen T., Suzuki Y., Poyard M., Miyamoto N., Defer N., Hanoune J. Expression of adenylyl cyclase mRNAs in the adult, in developing, and in the Brattleboro rat kidney. Am. J. Physiol. Cell Physiol. 273: 323–330. 1997.
Stridh S., Palm F., Hansell P. Renal interstitial hyaluronan: functional aspects during normal and pathological conditions. Am. J. Physiol. Regul. Integr. Compar. Physiol. 302(11): R1235–R1249. 2012.
Göransson V., Johnsson C., Nylander O., Hansell P. Renomedullary and intestinal hyaluronan content during body water excess. A comparative study in rats and gerbils. J. Physiol. 542(1): 315–322. 2002.
Rügheimer L., Johnsson C., Maric C., Hansell P. Hormonal regulation of renomedullary hyaluronan. Acta Physiol. (Oxford) 193: 191–198. 2008.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


