Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 12, стр. 1496-1511
Возрастная динамика функционального состояния сетчатки у мышей с наследственной дегенерацией фоторецепторов
А. А. Горяченков 1, А. Ю. Ротов 1, *, М. Л. Фирсов 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова
Санкт-Петербург, Россия
* E-mail: rotovau@gmail.com
Поступила в редакцию 02.09.2020
После доработки 27.09.2020
Принята к публикации 05.10.2020
Аннотация
Стандартным модельным объектом для исследования наследственных патологий сетчатки являются мыши линии C3H, имеющие мутацию в гене Pde6b. У таких животных нарушается работа фосфодиэстеразы палочек, что приводит к гибели фоторецепторов и полной потере зрения к 4-й неделе жизни. Было показано, что у мышей C3H, происходящих из питомников “Charles River Laboratories” – линии C3H/Crl – встречается дополнительная мутация в гене Gpr179, которая приводит к нарушению работы трансдукционного каскада ON-биполярных клеток сетчатки. Несмотря на широкое распространение мышей линии C3H/Crl в качестве объектов исследований, детального изучения особенностей процесса дегенерации фоторецепторов до сих пор не проводилось. Целью данной работы было изучение временной динамики морфологических и функциональных изменений, происходящих в раннем возрасте в сетчатке мышей линии С3Н/Crl. В качестве контрольной группы были взяты мыши дикого типа – линии C57Bl/6J. Для оценки функционального состояния сетчатки использовали метод электроретинографии in vivo, морфологический анализ проводили на гистологических препаратах тканей глаза. Показано, что у мышей линии С3Н/Crl ответы сетчатки на световую стимуляцию лишены вклада палочек и ON-биполярных клеток в течение всего периода измерений, начиная с 18-го дня жизни, а ответ колбочек исчезает к 25-му дню. Количество фоторецепторов и нейронов внутреннего ядерного слоя сетчатки у мышей линии С3Н/Crl оказывается сниженным уже к 16-му дню жизни, а к 25-му дню фоторецепторы почти полностью дегенерируют. В то же время было показано, что амплитуда ответов и чувствительность сетчатки мышей дикого типа не претерпевают значимых изменений в раннем возрасте. Полученные данные позволяют составить картину развития патологии сетчатки у животных линии C3H/Crl.
Термином “пигментный ретинит” (ПР) обозначается группа наследственных заболеваний со сходной клинической картиной, которые характеризуются прогрессирующей дегенерацией фоторецепторных клеток и нарушениями в функционировании пигментного эпителия сетчатки. Среди наследственных заболеваний ПР является наиболее распространенной причиной потери зрения и имеет распространенность во всем мире от 1 : 3000 до 1 : 7000 человек [1]. Как правило, патологическое состояние развивается в два этапа: на начальной стадии происходит гибель палочек, прогрессирующая от периферии к центру, что проявляется как потеря зрения в темное время суток; в дальнейшем погибают колбочки, в результате чего поле зрения сужается, и затем наступает полная слепота [2, 3].
В настоящее время активно изучаются механизмы, приводящие к дегенерации фоторецепторов, а также разрабатываются подходы к замедлению этого процесса или частичной компенсации зрительной функции после ее потери [4–6]. Классическим модельным объектом для изучения ПР являются мыши, выведенные на основе обнаруженной в 1924 г. природной популяции с патологическим фенотипом, получившим обозначение “rd1" (retinal degeneration type 1, дегенерация сетчатки 1 типа) [7, 8]. Было показано, что причиной гибели фоторецепторов у этих животных является мутация в гене, кодирующем β-субъединицу фосфодиэстеразы 6 типа (Pde6b), которая регулирует внутриклеточную концентрацию циклического гуанозинмонофосфата (цГМФ) в палочках [9]. Данная мутация включает в себя два изменения в нуклеотидной последовательности гена: вставку ретровирусного геномного фрагмента в 1-ом интроне (8.5 тысяч п.о.) и нонсенс-мутацию в 7-ом экзоне, приводящую к синтезу укороченного, нефункционального белка [10, 11].
Согласно морфологическим данным, у мышей с фенотипом rd1 подавляющее большинство палочек погибает в период с 8-го по 20-й день жизни, что, в свою очередь, приводит к уменьшению амплитуды электрических ответов и чувствительности сетчатки к свету по сравнению со здоровой сетчаткой [12]. Примечательно, что на 18-й день жизни ответы колбочек соответствуют таковым у здоровой сетчатки, это говорит о том, что на данном этапе они оказываются не затронутыми процессом дегенерации. Однако вскоре после полной потери палочек происходит и стремительная дегенерация колбочек, причины которой к настоящему времени остаются неясными [12, 13].
Наиболее часто при изучении особенностей фенотипа rd1 или апробации терапевтических подходов используются лабораторные мыши C3H. Существует несколько линий C3H, реализуемых различными питомниками и различающихся по генетическому фону. Было обнаружено, что у животных из питомника “Charles River Laboratories” (линия 3H/Crl), а также в нескольких его региональных подразделениях, присутствует дополнительная мутация в гене Gpr179 [14]. Этот ген кодирует орфанный рецептор, связанный с G-белком, который является важной частью сигнального каскада ON-биполярных клеток сетчатки. Ретровирусная вставка в 1-ом интроне гена (6.5 тысяч п.о.) приводит к нарушению синтеза белка и потере функциональности каскада [15]. Таким образом, у мышей линии C3H/Crl, помимо прогрессирующей гибели фоторецепторов, нарушается работа ON-биполярных клеток, что существенно отличает их от фенотипа rd1.
Несмотря на широкое распространение линии C3H, детального изучения особенностей процесса дегенерации фоторецепторов у мышей этой линии не проводилось, что ставит под вопрос соответствие результатов, получаемых на этих животных, стандартной модели ПР [16]. Вследствие этого остается неизвестным, в каких аспектах они соответствуют стандартному фенотипу ПР rd1, а в каких – отличаются. Известно, что патологический процесс у мышей с фенотипом rd1 не ограничивается гибелью фоторецепторных клеток, а включает в себя морфологические перестройки других клеток сетчатки (см. обзор [17]). Наиболее сильные изменения происходят в нейронах внутреннего ядерного слоя, т.е., в том числе и в ON-биполярных клетках. Поэтому разумно будет предположить, что мутация в гене Gpr179, приводящая к потере функциональной связи биполярных клеток с фоторецепторами, может повлиять на эти перестройки на ранних этапах дегенерации, когда зрительная функция еще сохраняется.
В данной работе была изучена временная динамика морфологических и функциональных изменений сетчатки в раннем возрасте у мышей линии С3Н/Crl в сравнении с контрольными животными дикого типа.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объект, схема эксперимента
В качестве экспериментальной группы животных с мутациями в генах Pde6b и Gpr179 использовались мыши линии C3H/Crl (питомник Пущино, Московская область).
В качестве контрольной группы животных без нарушений зрительной функции использовались мыши линии C57Bl/6J (питомник Рапполово, Ленинградская область). Работа была проведена с соблюдением принципов гуманности (Директивы Совета Европейских сообществ 1986 г. 86/609/EEC), одобренных биоэтическим комитетом Института эволюционной физиологии и биохимии РАН. Животные содержались в стандартных условиях при 12-часовом световом цикле с неограниченным доступом к воде и корму.
Экспериментальная часть работы состояла из трех этапов: генотипирования, гистологического анализа морфологического состояния сетчатки и электрофизиологического анализа функционального состояния сетчатки. Забор проб ДНК мышей, прибывших из питомника, и генотипирование проводились перед скрещиванием животных для получения потомства. У родившихся мышат отслеживалась возрастная динамика изменений электрограммы (ЭРГ) в раннем возрасте: с момента открытия глаз (17–18-й день после рождения), на 18-й, 20-й, 22-й и 25-й день после рождения, к которому, согласно данным литературы, полностью теряют зрение мыши с фенотипом rd1 [12]. Также на 16-й и 25-й дни жизни у некоторых животных производился забор препаратов сетчатки для последующего гистологического анализа. Схема эксперимента приведена на рис. 1.
Рис. 1.
Схема эксперимента. Исследовали динамику функционального и морфологического состояния сетчатки у мышей в раннем возрасте. Для обеих линий (C57Bl/6J и C3H/Crl) мышей несколько животных проходили процедуру регистрации ЭРГ 4 раза: на 18-й, 20-й, 22-й и 25-й день жизни. Отдельно, у других мышей, на 16-й и 25-й дни жизни производили забор препаратов глаз для последующего гистологического анализа.
Fig. 1. Schematic outline of study. We studied the dynamics of retinal functionality and morphology in mice at an early age. Several animals from both mouse strains (C57Bl/6J and C3H/Crl), were used for ERG registration 4 times: on 18th, 20th, 22th and 25th days of postnatal life. Separately, on 16th and 25th days of postnatal life, eye tissues were collected for further histological analysis.

Генотипирование
Выделение ДНК. Перед проведением основного экспериментального протокола было проверено соответствие генов Pde6b и Gpr179 мутантной аллели или дикому типу у линейных животных. Для выделения ДНК из фрагментов мышиных хвостов длиной 1–1.5 мм использовался метод HotSHOT [18]. Образцы ткани инкубировали в 50 мкл лизирующего буфера (25 мM NaOH + 0.2 мM EDTA) в течение 60 мин при 95°С, затем добавляли 50 мкл нейтрализующего буфера (40 мM Трис-HCl). Все компоненты буферов были приобретены у Sigma-Aldrich, США. До проведения дальнейших манипуляций пробы с ДНК хранились при температуре –20°С.
Полимеразная цепная реакция. Для проведения полимеразной цепной реакции (ПЦР) по данным литературы были подобраны праймеры, специфичные либо к мутантной аллели, либо к аллели дикого типа для генов Pde6B и Gpr179. В зависимости от того, для каких конкретных праймеров происходит отжиг на матрицу ДНК, образуются продукты разной длины. Последовательности праймеров представлены в табл. 1.
Таблица 1.
Нуклеотидные последовательности праймеров, использованных для генотипирования Table 1. Nucleotide sequences of primers used for genotyping
| Ген Gene | Прямой праймер (5'→3') Forward primer (5'→3') | Обратный праймер (5'→3') Reverse primer (5'→3') | Размер продукта, п.о. Product size, bp | Ссылка на лит. источник Ref. |
|---|---|---|---|---|
| Gpr179 | TGTGCCTGGGTATCTGTTGA | Wild type GCTTACACACTTACACACAGATAGAT |
100 | [16] |
| Mutant allele GCATGTGCCAAGGGTATCTT |
400 | |||
| Pde6b | TGACAATTACTCCTTTTCCCTCAGTCTG | Wild type TACCCACCCTTCCTAATTTTTCTCACGC |
400 | [19] |
| Mutant allele GTAAACAGCAAGAGGCTTTATTGGGAAC |
550 |
Для проведения ПЦР к 3 мкл раствора исследуемого образца геномной ДНК добавляли 17 мкл реакционной смеси следующего состава: Taq M-ДНК-полимераза, 0.1 е. а.; буфер для Taq М-полимеразы, 70 мM Трис-HCl, pH 8.6, 16.6 мM (NH4)2SO4; раствор MgCl2, 4 мM (все – Алкор-Био, Россия); смесь дезоксинуклеотидтрифосфатов, каждый по 0.25 мM (Медиген, Россия); прямой и обратные праймеры для мутантной аллели и дикого типа, каждый по 0.8 мкМ (ДНК-синтез, Россия). Амплификацию проводили в термоциклере Mastercycler Personal (Eppendorf, Германия) по программе, включавшей “горячий старт” – 95°С, 3 мин, и 45 циклов: денатурация – 95°С, 15 с, отжиг праймеров – 63°С, 20 с, элонгация – 72°С, 45 с.
Гель-электрофорез. После завершения ПЦР проводился электрофорез продуктов амплификации в 2%-ном агарозном геле на трис-ацетатном буфере (Thermo Fisher Scientific, США). Для визуализации ампликонов ДНК с помощью системы ChemiDoc MP Imaging System (Bio-rad Laboratories, США) в гель добавлялся бромистый этидий (1.4 мкг/мл, Хеликон, Россия).
Электрофизиологический анализ
Регистрация ответов сетчатки на свет. Для оценки функционального состояния сетчатки использовался метод электроретинографии in vivo, позволяющий регистрировать изменение потенциала на роговице, возникающее вследствие ответов сетчатки на световые стимулы.
Мыши проходили предварительную темновую адаптацию в течение 12 ч, после чего на время эксперимента наркотизировались с помощью наркозного аппарата Minor Vet (Zoomed, Россия) газовой смесью изофлурана (2.5%, Laboratorios Karizoo, Испания) и кислорода. Все манипуляции с животными проводились в темноте с использованием красных фонарей.
На оба глаза животного предварительно наносили местный анестетик оксибупрокаин (инокаин 0.4%-ный раствор, Сентисс Рус, Россия) и расширитель зрачка тропикамид (мидримакс 0.8%-ный раствор, Сентисс Русс, Россия). ЭРГ регистрировали с помощью волосковых серебряных электродов, помещенных на роговицу левого глаза (стимулируется светом) и на роговицу правого глаза (держится в темноте). Заземляющий электрод подкожно закрепляли под холкой животного. Система световой стимуляции включала в себя два независимых канала на основе одинаковых светодиодов с максимумом излучения λmax 525 нм, контроль интенсивности осуществлялся с помощью серых нейтральных светофильтров и тока светодиода. Сигнал с электродов через усилитель (Model 3000, A-M Systems, США) с аналоговым низкочастотным фильтром 3 кГц записывали с частотой дискретизации 1 мс/точку. Запись данных, а также управление временем подачи, длительностью и интенсивностью стимулов во время эксперимента осуществляли при помощи плат и программ LabView (National Instruments, Austin, TX).
Экспериментальный протокол. На первом этапе проводилась регистрация электрических ответов на короткие (10–100 мс) вспышки с возрастающей интенсивностью у животного в состоянии темновой адаптации. На втором этапе стимуляции включали постоянную фоновую засветку интенсивностью 25.4 кд/м2, переводящую палочки в насыщенное состояние (см. протокол [20]). По прошествии 8–10 мин, необходимых для световой адаптации сетчатки, регистрировали ответы на вспышки света по тому же протоколу, что и на первом этапе, но при включенном фоне. Таким образом, выделялась компонента ЭРГ, отражающая работу исключительно колбочек. Палочковую компоненту ЭРГ вычисляли как разность между ответом темноадаптированного животного и соответствующим ответом, записанном при фоновой засветке.
Последующая обработка записанных ответов включала корректировку нулевой линии и дополнительную фильтрацию (низкочастотный фильтр Бесселя 30 Гц). Затем определялись экстремальные точки, соответствующие пикам основных компонентов ЭРГ: нисходящей a-волне (отражает ответ фоторецепторов) и восходящей b-волне (отражает ответ ON-биполярных клеток). Амплитуду для a-волны отсчитывали от нулевой линии, а для b-волны – от пика а-волны. В случае, если эти компоненты невозможно было выделить на фоне шума, их амплитуду для дальнейшего анализа считали равной нулю.
Гистологический анализ. Для получения препаратов сетчатки мыши умерщвлялись путем цервикальной дислокации. После выделения глаз у них срезали переднюю камеру и удаляли хрусталик. Полученные глазные бокалы фиксировали в глутаровом альдегиде (1% в 0.1 M фосфатном буфере) в течение 1.5 ч и затем в параформальдегиде (2% в 0.1 М фосфатном буфере) – 12 ч. Далее препараты подвергали отмывке в фосфатном буфере, дегидратации в этаноле и заливке в акриловую смолу LR White (Sigma-Aldrich, США) согласно протоколу, описанному ранее [21].
С помощью ультрамикротома LKB 4800A (LKB Produkter AB, Швеция) изготовляли срезы глазных бокалов толщиной 5–8 мкм и окрашивали их с помощью толуидинового синего и эозина. Для дальнейшего анализа выбирались срезы, сделанные в центральной области глазного бокала. Анализ срезов сетчатки проводился с использованием светового микроскопа Olympus BH-2 и цифрового фотоаппарата Canon E05 1000D. Для каждого среза измерялись толщины наружного и внутреннего ядерных слоев (расположение тел фоторецепторов и горизонтальных/биполярных/амакриновых клеток соответственно). Измерения проводились в области сетчатки, соответствующей ее центральной трети. Для каждого препарата глазного бокала толщины слоев сетчатки определялись как средние значения по всем изготовленным с этого препарата срезам.
Статистический анализ. Статистическую обработку данных проводили с помощью пакетов программ Microsoft Excel (Microsoft Corp., США), IBM SPSS Statistics 22 (IBM Corp., США) и GraphPad Prism 8 (GraphPad Software, США). Проверку нормальности значений в выборках проводили по критерию Шапиро–Уилка.
Для сравнения параметров электрических ответов сетчатки использовали U-критерий Манна–Уитни. Для анализа морфологических параметров сетчатки применяли однофакторный дисперсионный анализ (ANOVA) и апостериорный критерий Тьюки для попарного анализа выборок с поправкой на множественные сравнения. Перед применением дисперсионного анализа проводилась проверка на однородность дисперсий по критерию Брауна–Форсайта. Анализ возрастной динамики параметров ЭРГ проводили с помощью критерия Фридмана для связанных выборок и апостериорного T-критерия Уилкоксона для попарного сравнения групп.
Различия считались значимыми при уровне значимости p ≤ 0.05. На рисунках данные представлены в виде среднее ± стандартная ошибка среднего или медиана ± межквартильный интервал.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Генотипирование
Для проведения типирования по генам Pde6b и Gpr179 использовали реакционную смесь для ПЦР, включающую 3 праймера: единый прямой и два обратных, комплементарных к нуклеотидной последовательности либо для гена дикого типа, либо для вирусной вставки в мутантной аллели, и образующих совместно с прямым праймером продукты разной длины.
Результаты генотипирования мышей линий C57Bl/6J и C3H/Crl приведены на рис. 2. Анализ электрофореграмм для обоих исследуемых генов показал, что для проб ДНК мышей линии C57Bl/6J в ходе ПЦР амплифицируются только те фрагменты, которые соответствуют праймерам для дикого типа. Для проб ДНК мышей линии C3H/Crl, напротив, наблюдаются фрагменты, соответствующие праймерам для мутантных аллелей.
Рис. 2.
Генотипирование мышей линий C57Bl/6J и C3H/Crl. A – электрофореграмма продуктов ПЦР-амплификации на 6 пробах ДНК, взятых от 3 различных мышей линии C57Bl/6J и 3 мышей линии C3H/Crl. Мыши C3H/Crl оказались гомозиготны по мутантной аллели гена Pde6B (продукт 550 п.о.). N – проба с отрицательным контролем; B – электрофореграмма продуктов ПЦР-амплификации на 4 пробах ДНК, взятых от 2 различных мышей линии C57Bl/6J и 2 мышей линии C3H/Crl. Результат подтверждает, что мыши линии C3H/Crl гомозиготны по мутантной аллели гена Gpr179 (продукт 400 п.о.). N – проба с отрицательным контролем.
Fig. 2. Genotyping of C57Bl/6J and C3H/Crl mice. A – electrophoregram of PCR amplification products for 6 DNA samples taken from 3 different C57Bl/6J mice and 3 C3H/Crl mice. C3H/Crl mice are homozygous for the mutant allele of the Pde6B gene (550 bp product). N – negative control sample; B – electrophoregram of PCR amplification products for 4 DNA samples taken from 2 different C57Bl/6J mice and 2 C3H/Crl mice. The result confirms that C3H/Crl mice are homozygous for the mutant allele of the Gpr179 gene (product 400 bp). N – negative control sample.
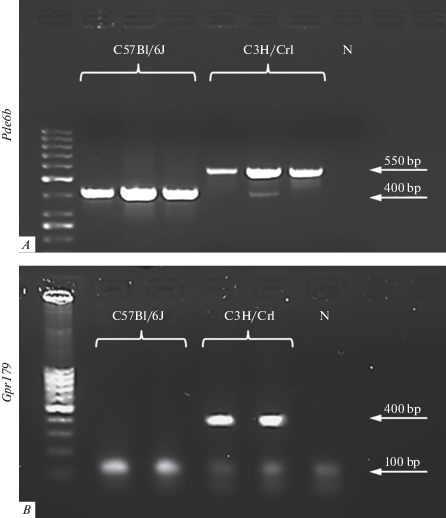
Таким образом, мы доказали, что экспериментальные животные линии C3H/Crl имеют вирусные вставки в генах Pde6b и Gpr179 и соответствуют выбранной модели дегенерации сетчатки. У животных линии C57Bl/6J мутаций не выявлено, поэтому они могут использоваться в качестве контрольной группы.
Динамика амплитуды компонент ЭРГ у мышей линий C57Bl/6J и C3H/Crl
Анализ фотоответов, отражающих палочковую и колбочковую составляющие ЭРГ, показал, что уже на 18-й день жизни у мышей линии C3H/Crl форма ЭРГ значительно отличается от таковой у животных дикого типа (рис. 3). В течение всего периода регистрации ЭРГ для их ответов оказалось невозможным выделить на фоне шума a-волну палочек, а также b-волны палочек и колбочек. У мышей линии C57Bl/6J в каждый из экспериментальных дней наблюдалась ЭРГ типичной формы, включающая все перечисленные выше компоненты (значимые отличия от мышей C3H/Crl, U-критерий Манна–Уитни, p < 0.05, рис. 4A, B, D).
Рис. 3.
Палочковые и колбочковые компоненты ЭРГ мышей линий C57Bl/6J и C3H/Crl. Приведены ответы, отражающие палочковую компоненту ЭРГ мышей линий C57Bl/6J (A) и C3H/Crl (C). Интенсивности стимулов: 0.2; 0.06; 0.006; 0.0003 кд с/м2. Также приведены ответы, отражающие колбочковую компоненту ЭРГ мышей линий C57Bl/6J (B) и C3H/Crl (D). Интенсивности стимулов: 31.6; 6.3; 0.6; 0.06 кд с/м2. Момент стимуляции совпадает с нулевой отметкой времени. У мышей линии C3H/Crl детектируется только колбочковая компонента а-волны.
Fig. 3. Rod- and cone-derived ERG components for C57Bl/6J and C3H/Crl mice. Representative rod-derived ERG components for C57Bl/6J (A) and C3H/Crl (C) mice. Stimuli intensity: 0.2; 0.06; 0.006; 0.0003 cd s/m2. Representative cone-derived ERG components for C57Bl/6J (B) and C3H/Crl (D) mice. Stimuli intensity: 31.6; 6.3; 0.6; 0.06 cd s/m2. The light stimulus was presented at the zero time moment. For C3H/Crl mice, only the cone-derived component of the a-wave can be detected.

Рис. 4.
Возрастная динамика амплитуды компонент ЭРГ у мышей линий C57Bl/6J и C3H/Crl. А – динамика палочковой а-волны, B – палочковой b-волны, C – колбочковой a-волны. Для данных компонент в каждый из экспериментальных дней амплитуда ответа у контрольных животных была значительно выше, чем у мышей C3H/Crl. D – динамика колбочковой b-волны. На 25-й день жизни амплитуда ответа у мышей C3H/Crl стала ниже, чем у контрольных животных. Количество животных в каждой группе n = 4. Статистически значимые различия между животными разных линий (U-критерий Манна–Уитни): * p < 0.05. Статистически значимые возрастные изменения амплитуды у мышей C57Bl/6J (критерий Фридмана для связанных выборок): # p < 0.05. Данные представлены в виде медиана ± межквартильный интервал.
Fig. 4. Age-related dynamics of ERG components amplitude for C57Bl/6J and C3H/Crl mice. A – dynamics for rod-derived a-wave, B – for rod-derived b-wave, C – for cone-derived a-wave. D – dynamics for cone-derived b-wave. For components A, B, D, on each of the experimental days, the response amplitude in the control animals was significantly higher than in the C3H/Crl mice. For cone-derived a-wave (D) on the 25th day of life, the amplitude of the response in C3H/Crl mice became significantly lower than in control animals. The number of animals in each group n = 4. Statistically significant differences between animals from different strains (Mann–Whitney U-test): * p < 0.05. Statistically significant age-related changes in the amplitude in C57Bl/6J mice (Friedman’s test for related samples): # p < 0.05. Data are presented as median ± interquartile range.
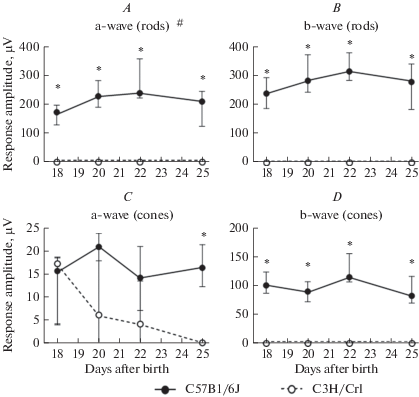
Однако у мышей линии C3H/Crl оказалась различима колбочковая компонента a-волны. Статистически значимое уменьшение ее амплитуды по сравнению с мышами дикого типа было выявлено только на 25-й день жизни (U-критерий Манна–Уитни, p = 0.03, рис. 4C), но не на более ранних сроках (18-й день: p = 0.69, 20-й день: p = 0.34, 22-й день: p = 0.2). Примечательно, что на 25-й день жизни у всех рассматриваемых мышей линии C3H/Crl эта компонента была не детектируема на фоне шума, что свидетельствует об окончательной потере ими зрительной функции.
Дополнительно мы проанализировали временную динамику изменений амплитуды компонент ЭРГ у животных линии C57Bl/6J, сравнив значения, полученные в разные дни жизни (рис. 4). Значимых отличий не было выявлено для a-волны колбочек (критерий Фридмана для связанных выборок, p = 0.06), b-волны палочек (p = 0.19) и b-волны колбочек (p = 0.27). Анализ с помощью критерия Фридмана показал наличие значимых изменений в амплитуде a-волны палочек (p = 0.04), однако, при попарном сравнении групп, соответствующих 18-му, 20-му, 22-му и 25-му дням жизни, статистически значимые различия не обнаружились (T‑критерий Уилкоксона, p > 0.05).
Динамика световой чувствительности у мышей линии C57Bl/6J
Чувствительность сетчатки к свету оценивали по значениям полунасыщающих интенсивностей (ПНИ) для различных компонент ЭРГ в разные дни эксперимента. Расчет ПНИ проводили стандартным методом – путем подгонки параметров кривой, задаваемой функцией Хилла, к экспериментальным зависимостям нормированной амплитуды ответа от интенсивности стимула (рис. 5A) [22]. Для мышей линии C57Bl/6J мы проанализировали динамику чувствительности для трех компонентов ЭРГ: а-волны палочек, b-волны палочек и b-волны колбочек. Рассчитать ПНИ для а-волны колбочек (для животных обеих линий) не удалось, так как диапазон интенсивностей стимулов в экспериментальной установке позволял получить не более 2–3 записей ЭРГ с надежно детектируемой данной компонентой. Этого количества экспериментальных точек недостаточно для надежного описания функцией Хилла. Поскольку у мышей линии C3H/Crl три компоненты ЭРГ не наблюдаются, для них анализ изменений чувствительности также не проводили.
Рис. 5.
Возрастная динамика чувствительности компонент ЭРГ мышей линии C57Bl/6J. A – пример описания экспериментальных значений нормированной амплитуды а-волны палочек функцией Хилла. Наилучшая подгонка дает значение для полунасыщающей интенсивности (ПНИ) = 0.13 кд с/м2, коэффициент детерминации R2 = 0.99. B – динамика палочковой a-волны, C – палочковой b-волны, D – колбочковой b-волны. Статистически значимых изменений ни в одном случае не обнаружено (критерий Фридмана для связанных выборок). Количество животных в каждой группе n = 4. Данные представлены в виде медиана ± межквартильный интервал.
Fig. 5. Age-related dynamics of ERG components sensitivity for C57Bl/6J and C3H/Crl mice. A – example fitting of normalized component amplitude data (rod-derived a-wave) by the Hill function. The best fit gives the value for the half-saturating intensity (HSI) = 0.13 cd s/m2, the coefficient of determination R2 = 0.99. B – dynamics for rod-derived a-wave, C – for rod-derived b-wave, D – dynamics for cone-derived b-wave. The number of animals in each group n = 4. Statistically significant age-related changes in the amplitude in C57Bl/6J mice (Friedman’s test for related samples) were not found. Data are presented as median ± interquartile range.
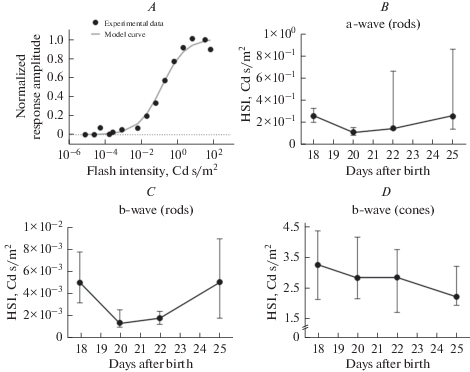
Статистический анализ не выявил значимых изменений величины ПНИ в течение 18–25 дней жизни у мышей дикого типа (рис. 5B–D) для а-волны палочек (критерий Фридмана для связанных выборок, p = 0.06), b-волны палочек (p = 0.11) и b‑волны колбочек (p = 0.75).
Гистологический анализ
Забор препаратов сетчатки у мышей линии C3H/Crl производили на 16-й и 25‑й дни жизни. Поскольку из данных литературы известно, что сетчатка мышей дикого типа достигает морфологически зрелого состояния к 13-му дню после рождения [23], в качестве контрольной группы для дальнейшего анализа использовали препараты, взятые у мышей линии C57Bl/6J только на 16-й день жизни (рис. 6A).
Рис. 6.
Гистологический анализ срезов сетчатки мышей линий C57Bl/6J и C3H/Crl в разном возрасте. A – фотографии репрезентативных срезов сетчатки 16-дневной мыши C57Bl/6J, 16- и 25-дневных мышей C3H/Crl. Представлены данные для толщины наружного (B) и внутреннего (C) ядерных слоев сетчатки мышей (ONL и INL соответственно). У мышей линии C3H/Crl наблюдается дегенерация обоих ядерных слоев. Размер каждой выборки n = 3. Достоверные различия по критерию Тьюки: * p < 0.05; ** p < 0.001. Данные представлены в виде среднее ± стандартная ошибка среднего.
Fig. 6. Histological analysis of retinal sections for C57Bl/6J and C3H/Crl mice at different ages. A – photographs of representative retinal sections of 16 days old C57Bl/6J mice, 16 and 25 day old C3H/Crl mice. Data of thickness of the outer (B) and inner (C) nuclear layers of the mouse retina (ONL and INL respectively) are presented. Degeneration of both nuclear layers is observed in C3H/Crl mice. The size of each sample is n = 3. Significant differences according to Tukey’s test: * p < 0.05; ** p < 0.001. Data are presented as mean ± standard error of the mean.

Однофакторный дисперсионный анализ показал, что у мышей линии C3H/Crl в возрасте 16- и 25-ти дней толщина наружного ядерного слоя меньше, чем у контрольных животных (попарные сравнения критерием Тьюки, p < 0.001). От 16-го к 25-му дню наружный ядерный слой сетчатки мышей C3H/Crl становится еще тоньше, в результате чего сохраняются только одиночные тела фоторецепторов (попарные сравнения по критерию Тьюки, p = 0.02, рис. 6B).
Внутренний ядерный слой, включающий тела горизонтальных, биполярных и амакриновых клеток, оказывается тоньше у мышей линии C3H/Crl обоих возрастов по сравнению с мышами линии С57Bl/6J (попарные сравнения по критерию Тьюки, p < 0.05). Между значениями толщины внутреннего ядерного слоя мышей C3H/Crl в возраст 16- и 25-ти дней статистически значимые различия выявлены не были (попарные сравнения по критерию Тьюки, p = 0.88, рис. 6C).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мыши линии C3H с фенотипом дегенерации сетчатки rd1 являются наиболее распространенной животной моделью пигментного ретинита во многом благодаря тому, что стали исторически первыми описанными лабораторными животными с подобной патологией. Несмотря на открытие и искусственное выведение новых линий, воспроизводящих ход развития заболевания более близкий к клинической картине человека [24], мыши с фенотипом rd1 остаются востребованными для исследовательских задач. Мы предполагаем, что для этого существует две основные причины: во-первых, на данный момент механизмы дегенерации фоторецепторов при быстро развивающемся ПР остаются изученными не в полной мере. Предполагается, что ведущую роль в этом процессе играет повышение внутриклеточной концентрации цГМФ вследствие дисфункции фосфодиэстеразы палочек. Это приводит к тому, что катионные каналы наружных сегментов палочек остаются в открытом состоянии, что ведет к повышенному входу ионов кальция в клетку и запуску механизмов апоптоза. Однако было показано, что в дегенерацию фоторецепторов вовлечены и другие процессы, заметно влияющие на скорость развития патологии: некроз палочек, развитие окислительного стресса, ответ на несвернутый белок [4, 25]. Таким образом, появляется возможность на одной модельной линии исследовать сразу несколько механизмов клеточной гибели, а также их взаимодействие друг с другом.
Во-вторых, высокая скорость дегенерации фоторецепторов у мышей rd1 оказывается полезной в рамках исследований способов возвращения зрения после его полной утраты. В ситуации, когда клетки, способные преобразовать энергию света в электрический ответ, полностью погибают, задачей терапии становится воссоздание в сетчатке некой структуры, способной взять на себя эту функцию. Основными подходами к решению этой задачи являются протезирование с помощью светочувствительных микрочипов, введение стволовых клеток – предшественников фоторецепторов, модификация нейронов второго порядка методами оптогенетики и оптофармакологии [26–28]. Быстрое тестирование различных вариаций этих методик становится возможным благодаря тому, что мыши rd1 полностью теряют зрение уже к 4-й неделе жизни [8].
В 2015 г. Nishiguchi с соавт. обнаружили мутацию в гене Gpr179 у мышей линии C3H/Crl после попытки применения метода генной терапии для устранения мутации в гене Pde6b и, соответственно, восстановлении функции фоторецепторов [14]. Было показано, что, несмотря на успешное восстановление фоторецепторной функции, ЭРГ после терапии сильно отличалась от ЭРГ здоровой сетчатки. На ней присутствовала а-волна, но b-волна по-прежнему не регистрировалась, что говорило о нарушении в работе трансдукционного каскада ON-биполярных клеток. У изученной ранее линии мышей, имеющих изолированную мутацию в гене Gpr179, описана аналогичная форма ЭРГ, в то время как изменений в общей морфологии сетчатки и синаптических контактов между фоторецепторами и биполярными клетками не наблюдалось [15]. В дальнейшем Chang провел дополнительный скрининг нескольких линий C3H, реализуемых различными поставщиками [16]. В качестве вывода по итогам проведенного исследования автор отметил важность тщательной проверки генотипа в будущих работах, выполняемых на животных с предполагаемым фенотипом rd1. Других работ, посвященных проблеме дополнительной мутации в гене Gpr179, к настоящему моменту не опубликовано.
Несмотря на наличие большого количества работ, посвященных изучению процесса дегенерации фоторецепторов у мышей с мутацией в гене Pde6b [4, 8, 12, 23] а также нескольких исследований дисфункции ON-биполярных клеток, вызываемой мутацией в гене Gpr179 [15, 29], совместный эффект обеих мутаций на состояние сетчатки в раннем возрасте ранее не исследовался. Помимо фундаментального интереса, эти данные могут представлять ценность для разработки подходов к протезированию сетчатки, задействующих ON-биполярные клетки [27].
Мы показали, что у мышей линии C3H/Crl с момента открытия глаз в ЭРГ отсутствуют палочковая и колбочковая компоненты b-волны, а также палочковая компонента a-волны. Этот феномен вполне ожидаемо следует из наличия у этих животных мутации в гене Gpr179, которая лишает функциональности каскад ON-биполярных клеток, чей ответ и составляет b-волну ЭРГ. Отсутствие a-волны палочек, в свою очередь, связано с мутацией в гене Pde6b, радикально снижающей активность фосфодиэстеразы – важнейшего участника каскада фототрансдукции. В колбочках экспрессируется другой тип фосфодиэстеразы, что объясняет наличие колбочкового ответа у мышей линии C3H/Crl на 18–22-й дни жизни [30]. Однако к 25-му дню жизни электрические ответы колбочек также полностью исчезают, это говорит о том, что процесс дегенерации затронул и эти рецепторы. Этот результат согласуется с данными Nishiguchi с соавт., также наблюдавшими полную потерю зрительной функции у взрослых мышей линии C3H/Crl [14]. Результаты нашего исследования можно сопоставить с работой Gibson с соавт., где приводится детальное описание функциональных изменений в сетчатке мышей с фенотипом rd1 [12]. Согласно их результатам, ответ на световую стимуляцию у таких животных пропадает к 20–21-му дню жизни, т.е. на несколько дней раньше, чем у мышей линии C3H/Crl, как следует из наших данных. Однако данное расхождение невелико и, вероятно, является следствием разного генетического фона животных, использованных в этих исследованиях, нежели влиянием мутации в гене Gpr179. Gibson с соавт. успешно регистрировали ЭРГ уже на 16-й день жизни, это говорит о том, что у мышей rd1 глаза открывались раньше, чем у C3H/Crl. Известно, что повышение уровня освещенности ускоряет гибель палочек у мышей с наследственной дегенерацией сетчатки, и за счет этого эффекта могло возникнуть получившееся расхождение [31].
Толщина наружного и внутреннего ядерных слоев у мышей линии C3H/Crl существенно меньше, чем у животных дикого типа уже на 16-й день жизни, это свидетельствует о том, что гибель фоторецепторов горизонтальных и биполярных клеток начинается еще до того момента, как у животного откроются глаза. К 25-му дню жизни дегенерация фоторецепторов прогрессирует, а число внутренних нейронов не претерпевает значимых изменений по сравнению с 16-ым днем. Следует отметить, что на 16-й день жизни у мышей C3H/Crl уже не наблюдается слой, соответствующий наружным сегментам палочек, это свидетельствует о том, что их развитие нарушается еще до открытия глаз животным. Эти результаты хорошо согласуются с данными, полученными на мышах с фенотипом rd1 [8].
Уменьшение толщины внутреннего ядерного слоя позволяет предположить, что происходит частичная гибель внутренних нейронов сетчатки, что, однако, не согласуется с данными, полученными на мышах с фенотипом rd1, у которых гибель биполярных и горизонтальных клеток происходит гораздо позже потери реакции на свет [17]. Возможным объяснением данного несоответствия может быть эффект мутации в гене Gpr179, ускоряющий дегенерацию биполярных клеток, а также изначально меньшее число созревающих биполяров у мышей C3H/Crl по сравнению с диким типом. Поскольку биполярные клетки созревают на поздних стадиях онтогенеза сетчатки [32], на их развитие может оказать влияние развивающийся в раннем возрасте процесс дегенерации фоторецепторов.
В работе Gibson с соавт. также было показано, что амплитуда а- и b-волны у мышей C57Bl/6J заметно возрастает в период с 16-го по 18-й день жизни, после чего вплоть до 24-го дня эти параметры не претерпевают значимых изменений [12]. Следует отметить, что авторы исследовали динамику амплитуды и чувствительности для компонент тотальной ЭРГ, не выделяя отдельно палочковую и колбочковую составляющие. Результаты нашего исследования согласуются с этими данными и дополняют их, поскольку указывают на то, что функциональное состояние как палочек, так и колбочек остается неизменным в период с 18-го по 25-й день жизни. Таким образом, исключается возможность того, что Gibson с соавт. наблюдали взаимно компенсирующие друг друга изменения в функциональном состоянии этих рецепторов и их сигнальных путей.
Полученные нами результаты позволяют составить картину развития дегенерации сетчатки у мышей линии С3Н/Crl в раннем возрасте. Сравнение их с результатами, полученными другими исследователями на мышах с фенотипом rd1, позволяет предположить, что мутация в гене Gpr179 не оказывает существенного влияния на скорость дегенерации сетчатки, однако, приводит к более ранней гибели биполярных и горизонтальных клеток.
Список литературы
Ferrari S., Di Iorio E., Barbaro V., Ponzin D., S Sorrentino F., Parmeggiani F. Retinitis pigmentosa: genes and disease mechanisms. Curr. Genomics. 12(4): 238–249. 2011.
Hamel C. Retinitis pigmentosa. Orphanet. J. Rare Dis. 1(1): 40. 2006.
Hartong D.T., Berson E.L., Dryja T.P. Retinitis pigmentosa. Lancet. 368(9549): 1795–1809. 2006.
Sancho-Pelluz J., Arango-Gonzalez B., Kustermann S., Romero F.J., Van Veen T., Zrenner E., Ekström P., Paquet-Durand F. Photoreceptor cell death mechanisms in inherited retinal degeneration. Mol. Neurobiol. 38(3): 253–269. 2008.
Guadagni V., Novelli E., Piano I., Gargini C., Strettoi E. Pharmacological approaches to retinitis pigmentosa: a laboratory perspective. Prog. Retin. Eye Res. 48: 62–81. 2015.
Duncan J.L., Pierce E.A., Laster A.M., Daiger S.P., Birch D.G., Ash J.D., Iannaccone A., Flannery J.G., Sahel J.A., Zack D.J., Zarbin M.A. Inherited retinal degenerations: current landscape and knowledge gaps. Transl. Vis. Sci. Technol. 7(4): 6–16. 2018.
Keeler C.E. The Inheritance of a retinal abnormality in white mice. Proc. Natl. Acad. Sci. USA. 10: 329–333. 1924
Han J., Dinculescu A., Dai X., Du W., Smith W.C., Pang J. The history and role of naturally occurring mouse models with Pde6b mutations. Mol. Vis. 19: 2579–2589. 2013.
Bowes C., Li T., Danciger M., Baxter L.C., Applebury M.L., Farber D.B. Retinal degeneration in the rd mouse is caused by a defect in the beta subunit of rod cGMP-phosphodiesterase. Nature. 347: 677–680. 1990.
Pittler S.J., Baehr W. Identification of a nonsense mutation in the rod photoreceptor cGMP phosphodiesterase beta-subunit gene of the rd mouse. Proc. Natl. Acad. Sci. USA. 88(19): 8322–8326. 1991.
Bowes C., Li T., Frankel W.N., Danciger M., Coffin J.M., Applebury M.L., Farber D.B. Localization of a retroviral element within the rd gene coding for the beta subunit of cGMP phosphodiesterase. Proc. Natl. Acad. Sci. USA. 90(7): 2955–2959. 1993.
Gibson R., Fletcher E.L., Vingrys A.J., Zhu Y., Vessey K.A., Kalloniatis M. Functional and neurochemical development in the normal and degenerating mouse retina. J. Comp. Neurol. 521(6): 1251–1267. 2013.
Carter-Dawson L.D., LaVail M.M., Sidman R.L. Differential effect of the rd mutation on rods and cones in the mouse retina. Invest. Ophthalmol. Vis. Sci. 17: 489-498. 1978.
Nishiguchi K.M., Carvalho L.S., Rizzi M., Powell K., kleine Holthaus S.M., Azam S.A., Duran Y., Ribeiro J., Luhmann U.F.O., Bainbridge J.W.B., Smith A.J., Ali R.R. Gene therapy restores vision in rd1 mice after removal of a confounding mutation in Gpr179. Nat. Commun. 6(1): 1–10. 2015.
Peachey N.S., Ray T.A., Florijn R., Rowe L.B., Sjoerdsma T., Contreras-Alcantara S., Baba K., Tosini G., Pozdeyev N., Iuvone P.M., Bojang P.Jr., Pearring J.N., Simonsz H.J., van Genderen M., Birch D.G., Traboulsi E.I., Dorfman A., Lopez I., Ren H., Goldberg A.F.X., Nishina P.M., Lachapelle P., McCall M.A., Koenekoop R.K., Bergen A.A.B., Kamermans M., Gregg R.G. GPR179 is required for depolarizing bipolar cell function and is mutated in autosomal-recessive complete congenital stationary night blindness. Am. J. Hum. Genet. 90(2): 331–339. 2012.
Chang B. Survey of the nob5 mutation in C3H substrains. Mol. Vis. 21: 1101–1105. 2015.
Strettoi E. A survey of retinal remodeling. Front. Cell. Neurosci. 9: 494. 2015.
Truett G.E., Heeger P., Mynatt R.L., Truett A.A., Walker J.A., Warman M.L. Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris (HotSHOT). Biotechniques. 29(1): 52–54. 2000.
Bearer E.L., Falzone T.L., Zhang X., Biris O., Rasin A., Jacobs R.E. Role of neuronal activity and kinesin on tract tracing by manganese-enhanced MRI (MEMRI). Neuroimage. 37: S37–S46. 2007.
Benchorin G., Calton M.A., Beaulieu M.O., Vollrath D. Assessment of murine retinal function by electroretinography. Bio Protoc. 7(7): e2218. 2017.
Rotov A.Yu., Astakhova L.A., Sitnikova V.S., Evdokimov A.A., Boitsov V.M., Dubina M.V., Ryazantsev M.N., Firsov M.L. New experimental models of retinal degeneration for screening molecular photochromic ion channel blockers. Acta Naturae. 10(1): 75–84. 2018.
Vinberg F., Kolesnikov A.V., Kefalov V.J. Ex vivo ERG analysis of photoreceptors using an in vivo ERG system. Vision Res. 101: 108–117. 2014.
Kim K.H., Puoris’ haag M., Maguluri G.N., Umino Y., Cusato K., Barlow R.B., de Boer J.F. Monitoring mouse retinal degeneration with high-resolution spectral-domain optical coherence tomography. J. Vis. 8(1): 1–11. 2008.
Chang B., Hawes N.L., Hurd R.E., Davisson M.T., Nusinowitz S., Heckenlively J.R. Retinal degeneration mutants in the mouse. Vision Res. 42(4): 517–525. 2002.
Power M., Das S., Schütze K., Marigo V., Ekström P., Paquet-Durand F. Cellular mechanisms of hereditary photoreceptor degeneration–focus on cGMP. Prog. Retin. Eye Res. 74: 100772. 2020.
Yue L., Weiland J.D., Roska B., Humayun M.S. Retinal stimulation strategies to restore vision: Fundamentals and systems. Prog. Retin. Eye Res. 53: 21–47. 2016.
Baker C.K., Flannery J.G. Innovative optogenetic strategies for vision restoration. Front. Cell. Neurosci. 12: 316. 2018.
Stern J.H., Tian Y., Funderburgh J., Pellegrini G., Zhang K., Goldberg J.L., Ali R.R., Young M., Xie Y., Temple S. Regenerating eye tissues to preserve and restore vision. Cell Stem Cell. 22(6): 834–849. 2018.
Balmer J., Ji R., Ray T.A., Selber F., Gassmann M., Peachey N.S., Gregg R.G., Enzmann V. Presence of the Gpr179nob5 allele in a C3H-derived transgenic mouse. Mol. Vis. 19: 2615–2625. 2013.
Wensel T.G. Signal transducing membrane complexes of photoreceptor outer segments. Vision Res. 48(20): 2052–2061. 2008.
Kutsyr O., Sánchez-Sáez X., Martínez-Gil N., de Juan E., Lax P., Maneu V., Cuenca N. Gradual Increase in Environmental Light Intensity Induces Oxidative Stress and Inflammation and Accelerates Retinal Neurodegeneration. Invest. Ophthalmol. Vis. Sci. 61(10): 1. 2020.
Hoon M., Okawa H., Della Santina L., Wong R.O. Functional architecture of the retina: development and disease. Prog. Retin. Eye Res. 42: 44–84. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


