Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 12, стр. 1512-1523
Флавоноид кверцетин уменьшает двигательную активность и повышает эмоциональную реактивность у крыс
М. В. Чернышев 1, *, Д. В. Белан 1, О. А. Сапач 1, И. В. Екимова 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: netmisha@mail.ru
Поступила в редакцию 20.05.2020
После доработки 03.08.2020
Принята к публикации 22.09.2020
Аннотация
Работа посвящена исследованию эффектов полифенольного флавоноида кверцетина, обладающего широким спектром фармакологических свойств, на двигательную активность, эмоциональное и тревожно-подобное поведение у крыс в нормальных условиях. Обнаружено, что однократное внутрибрюшинное введение кверцетина в дозе 5 мг/кг вызывает появление отдельных признаков тревожно-подобного поведения в тесте открытое поле (ОП) через 2 ч после инъекции. На это указывало сокращение времени пребывания животного в центральной зоне и увеличение в периферической зоне. Подобный эффект не наблюдался в тесте приподнятый крестообразный лабиринт (ПКЛ). Кроме того, в тесте ОП кверцетин вызывал усиление эмоциональной реактивности, о чем свидетельствовало увеличение длительности замираний и числа дефекаций. В этом же тесте наблюдалось заметное снижение уровня горизонтальной двигательной активности: число пройденных секций в центральной и периферической зоне снижалось. Вместе с тем в обоих тестах падал уровень вертикальной двигательной активности, судя по уменьшению числа вертикальных стоек с упором, что является признаком ослабления исследовательского поведения. Полученные факты указывают на анксиогенную направленность действия кверцетина. Изменения в поведении не были сопряжены с изменением содержания стресс-индуцируемого шаперона Hsp70 в структурах головного мозга, вовлеченных в регуляцию двигательного и эмоционального поведения. Высказана гипотеза, что индуцированные кверцетином уменьшение двигательной активности и повышение эмоциональной реактивности у животных связаны с его модулирующим действием на внутриклеточные сигнальные пути киназ, играющих важную роль в нейробиологических процессах.
Кверцетин (3,3',4',5,7-пентагидроксифлавон) является полифенольным флавоноидом, который в большом количестве содержится в различных фруктах и овощах (яблоках, вишнях, капусте, луке, помидорах, ягодах, чае, какао, красном вине и др.) [1–3]. Кверцетин обладает широким спектром биологических активностей: противораковым, антиоксидантным, противовоспалительным, иммуностимулирующим действием [3–5]. Его эффекты также были изучены на различных типах и моделях вирусной инфекции, включая Коронавирус-2 (SARS-CoV-2), в которых кверцетин проявил многообещающее противовирусное действие [6]. Перечисленные защитные эффекты кверцетина связаны с его способностью ингибировать перекисное окисление липидов [7] и активность большого набора киназ [8], влиять на метаболизм арахидоновой кислоты, модулировать сигнальные пути киназ и липидкиназ, а также влиять на функцию тирозиновых протеинов и серин/треонинкиназ [9, 10], таких как фосфатидилинозитол (PI)-3-киназа и индуцибельная синтаза оксида азота (NOS2) [11, 12].
На уровне поведения эффекты кверцетина в наиболее яркой форме проявляются при различных видах стрессорных воздействий. Стоит отметить ряд работ, выявивших антидепрессантный и анксиолитический эффекты кверцетина. Недавно было показано, что хроническое системное введение кверцетина предотвращало развитие тревожно-подобного и депрессивного поведения, а также нарушение пространственной памяти, индуцированное иммобилизационным стрессом, бульбэктомией, хроническим окислительным стрессом у животных [13–15]. Данный эффект авторы связывают с антиоксидантным свойством кверцетина. В другой работе был обнаружен анксиолитический эффект кверцетина при лечении мозговой травмы средней тяжести у мышей [16]. Положительный терапевтический эффект кверцетина показан в модели непредсказуемого стресса, приводившего к широкому спектру поведенческих изменений у крыс: повышение уровня тревожности в сочетании с депрессивно-подобным состоянием, ухудшение кратковременной и долговременной ассоциативной памяти [17]. Следует подчеркнуть определенную особенность представленных исследований – это использование протокола хронического воздействия, где курсовое введение кверцетина применялось для смягчения последствий длительного стрессора, вызывающего, как правило, окислительные процессы в нервной ткани.
Однако, несмотря на широкий круг своего превентивного и терапевтического потенциала, кверцетин обладает и негативным свойством, о чем крайне редко попадаются публикации в литературе. В частности, он способен ингибировать экспрессию стресс-индуцируемых белков теплового шока (Hsp27, Hsp70), влияя на активность транскрипционного фактора HSF2 и в меньшей степени – на HSF1 [18]. Стресс-индуцируемые шапероны являются одной из наиболее консервативных систем защиты клеток и организмов от стресса и различных повреждающих факторов [19]. Они играют ключевую роль в спасении чувствительных к стрессу ферментативных и регуляторных белков. Таким образом, с одной стороны, кверцетин при длительном применении проявляет накопительный эффект и способен стимулировать защитные реакции в организме, влияя на антиоксидантные системы и различные сигнальные пути клетки, но с другой стороны, он способен подавлять важную защитную молекулярную систему на уровне клетки и организма. Так, при изучении гипербарического стресса [20] кверцетин подавлял защитные эффекты индуктора экспрессии Hsp70 геранилгеранилацетона у крыс. В исследованиях in vitro показано, что повышенная экспрессия Hsp70 в нейронах гиппокампа предохраняла ЦНС крыс от токсичного воздействия кислорода за счет подавления активности нитроксидсинтазы, уровень которой был значительно повышен в результате воздействия гипербарического кислорода. Указывается, что предварительное оральное вскармливание животных кверцетином препятствовало развитию нейропротективных эффектов Hsp70, а также полностью отменяло выявленный в опытах in vivo противосудорожный эффект геранилгеранилацетона [20]. Кроме того, однократное введение кверцетина приводило к снижению уровня Hsp70 в гиппокампе, таламусе и мозолистом теле и оказывало проконвульсантный эффект в модели NMDA-индуцированных судорог [21]. Дальнейшие исследования этих авторов показали негативный эффект кверцетина на патогенез болезни Паркинсона в модели протеасомной дисфункции нигростриатной системы у крыс [22]. Указывалось, что превентивное введение кверцетина препятствовало лактацистин-индуцированной экспрессии Hsp70 в черной субстанции, ключевой структуре мозга, определяющей главные признаки болезни Паркинсона, и приводило к усилению нейродегенерации в нигростриатной системе мозга, а также к нарушению моторного поведения в модели доклинической стадии болезни Паркинсона.
Таким образом, представленные данные проведенных исследований убедительно свидетельствуют о том, что кверцетин, обладая, несомненно, полезными свойствами, одновременно способен создавать серьезное препятствие для нормального протекания тех биохимических, физиологических и поведенческих процессов, регуляция которых тесным образом связана с экспрессией Hsp70. Кроме того, учитывая его модулирующее влияние на ряд сигнальных киназ, пока остаются неясными его ситуативные эффекты (“здесь и сейчас”) на паттерны эмоционального и двигательного поведения не при патологии. Такие данные в литературе отсутствуют. В настоящей работе была поставлена задача изучить эффекты однократного введения кверцетина на двигательную активность, эмоциональное и тревожно-подобное поведение у крыс в нормальных условиях.
МЕТОДЫ ИССЛЕДОВАНИЯ
Животные. Работа выполнена на 36 самцах крыс линии Вистар в возрасте 4 мес. и массой тела 220–280 г. Животных содержали в стандартных условиях вивария Института эволюционной физиологии и биохимии РАН по 5 особей в клетке при температуре окружающей среды 24 ± 1°С с предоставлением воды и корма ad libitum. Эксперименты проводили с 14:00 до 19:00 ч. Манипуляции с животными осуществляли в соответствии с протоколом, утвержденным комитетом по охране животных Института эволюционной физиологии и биохимии РАН, находящимся в соответствии с национальными и международными требованиями.
Введение кверцетина. Биофлаваноид кверцетин (ICN, США) вводили животным внутрибрюшинно (в/б) в дозе 5 мг/кг. Препарат растворяли в 20 мкл диметилсульфоксида (DMSO) и доводили до объема 0.2 мл физиологическим раствором (0.9%-ным раствором NaCl). Контрольным крысам делали в/б инъекцию 0.2 мл физиологического раствора с добавлением 20 мкл DMSO.
Поведенческие тесты. В первой серии экспериментов оценивалось влияние кверцетина на показатели исследовательской и двигательной активности, а также эмоционального поведения и тревожности. Учитывая, что при внутривенном введении период полувыведения кверцетина составляет 0.7–2.4 ч [23], поведенческие тесты у крыс проводили через 2 ч после введения препарата (n = 17) или его растворителя (n = 19). Каждый из тестов по оценке поведения проводился в отдельный день. Крыс за 12 ч до тестирования переносили в помещение, где располагалась соответствующая установка. После тестирования каждого животного установки дезодорировали 3%-ным раствором перекиси водорода. Видеорегистрация тестов с последующей обработкой паттернов поведения осуществлялась с помощью компьютерной программы RealTimer 1.21 (НПК Открытая Наука, Москва).
Открытое поле (ОП). Тест использовался для оценки двигательной активности, исследовательского поведения, эмоциональной реактивности, а также тревожности [24]. Установка ОП представляла собой пластиковую конструкцию, состоящую из круглой арены диаметром 97 см, ограниченной по периметру стенкой высотой 42 см. Область арены была поделена на 12 секций периферической (преферентной) зоны (ПЗ) и 7 секций центральной (аверсивной) зоны (ЦЗ). Ширина ЦЗ – 30 см, ширина ПЗ – 20 см. Тест начинался с помещения животного в центр арены, после чего производилась 5-минутная видеосъемка. Регистрировались количественные и временные характеристики стандартных паттернов активности животного в разных зонах ОП: горизонтальная двигательная активность (секции, пройденные в ПЗ и ЦЗ, а также их сумма), вертикальная двигательная активность (вертикальные стойки с упором), исследовательская активность (вертикальные стойки с упором и отношение секций, пройденных в ЦЗ к ПЗ), эмоциональная реактивность (вертикальные стойки без упора, замирания, груминг, дефекации и уринации), тревожность (отношение времени пребывания в ЦЗ к ПЗ).
Приподнятый крестообразный лабиринт (ПКЛ). Тест использовался для оценки тревожности, эмоциональной реактивности, а также двигательной и исследовательской активностей [25]. Установка ПКЛ представляла собой крестообразную пластиковую конструкцию, приподнятую на высоту 50 см от пола. Лабиринт состоял из 2 закрытых (преферентных) рукавов (ЗР) и 2 открытых (аверсивных) рукавов (ОР). Длина каждого из рукавов составляла 50 см с высотой бортов для ЗР 40 см. Тест начинался с помещения животного в центр пересечения четырех рукавов, после чего производилась 10-минутная видеосъемка. Регистрировались количественные и временные характеристики стандартных паттернов активности животного в разных рукавах ПКЛ. Оценивались следующие домены поведения: тревожность (входы в ОР и их отношение ко всем входам), а также горизонтальная двигательная активность (входы в ЗР), вертикальная двигательная активность (вертикальные стойки с упором), эмоциональная реактивность (груминг и дефекации).
Вестерн-блоттинг. Учитывая, что кверцетин является ингибитором экспрессии стресс-индуцируемого белка Hsp70, мы во второй серии экспериментов с помощью Вестерн-блоттинга исследовали содержание Hsp70 в вентральном стриатуме, амигдале, голубом пятне, черной субстанции и прилегающей к ней вентральной тегментальной области (ЧС/ВТО) среднего мозга, вовлеченных в механизмы регуляции двигательной активности, эмоционального и тревожно-подобного поведения [26, 27]. Для этой цели крыс декапитировали через 2 ч после внутрибрюшинного введения кверцетина (n = 5) или контрольного раствора (n = 6), а затем извлекали головной мозг. Мозг помещали на холодную подложку и согласно атласу Paxinos и Watson [28] выделяли указанные выше структуры головного мозга. Образцы тканей головного мозга лизировали с использованием High RIPA-буфера и гомогенизировали металлической палочкой. Лизаты центрифугировали (13 000 об/мин, 10 мин), концентрацию суммарного белка в супернатантах измеряли по методу Bradford [29], белки осаждали ацетоном. Осадок растворяли в однократном буфере для нанесения проб (SDS – 2%, Tris HCl pH 6.8–62.5 мM, глицерол – 10%, бромфеноловый синий, β-меркаптоэтанол – 10%) и инкубировали при температуре 99°С в течение 5 мин. В лунки полиакриламидного геля наносили пробы, содержащие одинаковое количество белка, и разделяли с помощью электрофореза по Laemmli [30] в течение 100 мин при постоянном токе 30 мА. После электрофореза белки из геля переносили на PVDF-мембрану Immobilon-P с размером пор 0.45 мкм (Millipore Corporation, США). Для предотвращения неспецифического связывания антител мембраны инкубировали в фосфатном буфере с добавлением 0.1% Tween-20 и 3% бычьего сывороточного альбумина в течение 1 ч при комнатной температуре. Иммуномечение проводили с использованием первичных моноклональных антител мыши к индуцируемому Hsp70 (клон 3C5, любезно предоставлен г. н. с. лаборатории защитных механизмов клетки Института цитологии РАН Б.А. Маргулисом) или GAPDH (1 : 1000; Abcam, Великобритания) и вторичных антител осла к мыши, конъюгированных с пероксидазой хрена (1 : 10 000; Abcam, Великобритания). Визуализацию пероксидазной реакции проводили с помощью метода усиленной хемилюминесценции в темной комнате с использованием рентгеновской пленки. Денситометрический анализ количества белка был осуществлен с помощью программы ImageJ. Уровень серого бендов Hsp70 был скорректирован по фоновому сигналу и нормирован на сигнал GAPDH, выявляемый для определения общего количества белка в пробах.
Статистический анализ данных, полученных в двух независимых группах сравнения (контрольной и экспериментальной), проводили с помощью программы Statistica 7.1. Для выявления различий между группами использовался параметрический t-критерий Стьюдента, поскольку полученные данные имели нормальное распределение по тесту Колмогорова–Смирнова. Полученные результаты считались статистически значимыми при p ≤ 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
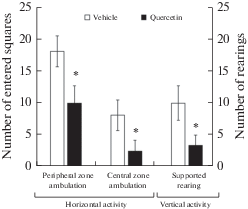
Анализ поведения животных в тестах ОП и ПКЛ выявил ряд статистически значимых различий между экспериментальной группой, получавшей в/б инъекцию кверцетина, и контрольной. На рис. 1 представлены данные, показывающие эффект действия кверцетина на показатели двигательной активности в тесте ОП. Выяснено, что кверцетин уменьшает число секций, пройденных в ПЗ в 1.8 раза (р < 0.05) и ЦЗ в 3.3 раза (р < 0.05), что указывает на снижение уровня горизонтальной двигательной активности в экспериментальной группе по сравнению с контрольной. Одновременно с этим отмечалось снижение вертикальной двигательной активности, выражавшейся в уменьшении числа вертикальных стоек с упором в тесте ОП в 3.3 раза (р < 0.05), что вместе с предыдущими данными может указывать на снижение уровня исследовательской активности.
Рис. 1.
Влияние кверцетина на локомоторное поведение крыс в тесте ОП через 2 ч после его введения. По оси абсцисс: Horizontal activity (peripheral zone ambulation – перемещение в переферической зоне, central zone ambulation – перемещение в центральной зоне; Vertical activity (supported rearing – вертикальные стойки с упором. По оси ординат: Number of entered squares – число пройденных секций. * p ≤ 0.05.
Fig. 1. Alterations in locomotor behavior in the open field test in rats 2 h after a single intraperitoneal administration of quercetin. The significance of differences in experimental group (quercetin) relative to control group (vehicle) * p < 0.05.
Уменьшение числа вертикальных стоек с упором наблюдалось и в тесте ПКЛ в 3.4 раза (р < 0.05) (табл. 2). Важно отметить, что в тесте ОП у экспериментальных животных наблюдалось смещение временного баланса пребывания в исследуемых зонах (табл.1) – время в ПЗ увеличивалось в 1.1 раза (р < 0.01), а время в ЦЗ уменьшалось в 5 раз (р < 0.01), что является базовым признаком усиления тревожности. Кроме этого, в тесте ОП (табл. 1) у животных экспериментальной группы было обнаружено увеличение времени замираний в 2.4 раза (р < 0.05) и возрастание числа болюсов дефекации в 3.4 раза (р < 0.05), что может указывать на повышенный уровень эмоциональной реактивности и тревожности. Эффекта действия кверцетина на другие исследуемые показатели (в тесте ОП: число актов замираний; в тестах ОП и ПКЛ: число и время актов груминга; в тесте ПКЛ: число входов и время пребывания в ЗР, число входов и время пребывания в ОР, отношение числа входов в ОР к общему числу входов, число заглядываний в ОР, число свешиваний с ОР) выявлено не было (табл. 1 и 2).
Таблица 1.
Влияние кверцетина на показатели эмоционального и тревожно-подобного поведения у крыс в тесте ОП Table 1. Effects of quercetin on parameters of emotional and anxiety-like behavior in the open field test
| Параметры поведения/Направленность эффекта Parameters/Trend |
Контрольная группа Control group |
Экспериментальная группа Experimental group |
|---|---|---|
| Время пребывания в ПЗ, с/+ Time spent in the PZ, s /+ |
279.3 ± 4.5 | 295.6 ± 2.9 ** |
| Время пребывания в ЦЗ, с /– Time spent in the CZ, s/– |
20.7 ± 4.5 | 4.4 ± 2.9 ** |
| Время замираний, с/+ Time of freezing, s/+ |
45.4 ± 14 | 108 ± 26 * |
| Число актов замираний/+ Number of freezings/+ |
1.9 ± 0.6 | 2.8 ± 0.4 |
| Время груминга, с/0 Time of grooming, s/0 |
7.7 ± 2.6 | 10.8 ± 2.8 |
| Число актов груминга/0 Number of groomings/0 |
1.2 ± 0.4 | 0.9 ± 0.2 |
| Число дефекаций/+ Number of fecal boli/+ |
0.7 ± 0.4 | 2.4 ± 1* |
ПЗ – периферическая зона; ЦЗ – центральная зона. + увеличение, – уменьшение, 0 – отсутствие значимых изменений. M ± SEM, достоверность различий в экспериментальной группе относительно контрольной * p < 0.05, ** p < 0.01. PZ – peripheral zone, CZ – central zone. + increased, – decreased, 0 – no changes. M ± SEM, the significance of differences in experimental group relative to control group * p < 0.05, ** p < 0.01.
Таблица 2.
Влияние кверцетина на показатели двигательного, эмоционального и тревожно-подобного поведения у крыс в тесте ПКЛ Table 2. Effects of quercetin on locomotor, emotional and anxiety-like behavior in the elevated plus maze test
| Параметры поведения/Направленность эффекта Parameters/Trend |
Контрольная группа Control group |
Экспериментальная группа Experimental group |
|---|---|---|
| Число входов в ЗР/0 Number of entries in the CA/0 |
2.7 ± 0.52 | 2.22 ± 0.64 |
| Время пребывания в ЗР, с/0 Time spent in the CA, s/0 |
272.8 ± 7.47 | 278 ± 5.2 |
| Число входов в ОР/0 Number of entries in the OA/0 |
2.4 ± 0.45 | 2.11 ± 0.68 |
| Время пребывания в ОР, с/0 Time spent in the CA s/0 |
24.9 ± 7.58 | 15.44 ± 5.26 |
| Отношение числа входов в ОР, %/0 Percentage of entries in the CA, %/0 |
47 ± 8.88 | 49 ± 15.8 |
| Число заглядываний в ОР/0 Number of protected head dips in the OA /0 |
4.4 ± 1 | 4 ± 1.37 |
| Число свешиваний с ОР/0 Number of unprotected head dips in the OA /0 |
2.6 ± 0.78 | 2.11 ± 0.79 |
| Число актов груминга /0 Number of groomings/0 |
0.8 ± 0.47 | 0.56 ± 0.38 |
| Время груминга, c/0 Time of grooming, s/0 |
13.8 ± 8.78 | 13.67 ± 9.5 |
| Число вертикальных стоек с упором/– Number of supported rearings/– |
9.7 ± 1.51 | 2.89 ± 0.86** |
| Число дефекаций Number of fecal boli/0 |
2.1 ± 0.8 | 1.7 ± 0.7 |
ОР – открытые рукава; ЗР – закрытые рукава. + увеличение, – уменьшение, 0 – отсутствие значимых изменений. M ± SEM, достоверность различий в экспериментальной группе относительно контрольной * p ≤ 0.05, ** p ≤ 0.01. CA – closed arms, OA – open arms. + increased, – decreased, 0 – no changes. M ± SEM, the significance of differences in experimental group relative to control group * p ≤ 0.05, ** p ≤ 0.01.
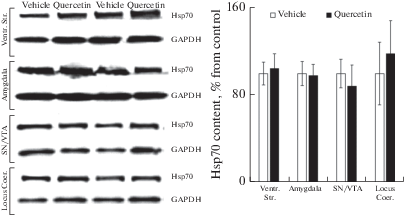
Выявленные нами изменения в двигательной активности и эмоциональном поведении после введения кверцетина не сопровождались изменением уровня Hsp70 в вентральном стриатуме, амигдале, голубом пятне и ЧС/ВТО по сравнению с контролем (рис. 2).
Рис. 2.
Содержание Hsp70 в вентральном стриатуме (Ventr. Str.), амигдале (Amygdala), черной субстанции, вентральной тегментальной области (SN/VTA) и голубом пятне (Locus Coer.) крыс в контроле (Vehicle) и через 2 ч после однократного внутрибрюшинного введения кверцетина (Quercetin). Слева представлены иммуноблоты. На графике по вертикали – оптическая плотность Hsp70, % от контроля.
Fig. 2. Hsp70 content in ventral striatum (Ventr. Str.), Amygdala (Amygdala), substantia nigra, ventral tegmental area (SN/VTA) and locus coeruleus (Locus Coer.) of rats 2 h after a single intraperitoneal administration of quercetin. The left part of the figure shows immunoblots.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Настоящее исследование является продолжением ранее проведенной серии экспериментов, нацеленной на изучение роли шаперона Hsp70 в молекулярных механизмах регуляции различных форм поведения [31]. Эти эксперименты показали, что тепловое прекондиционирование (ТП), повышающее экспрессию стресс-индуцируемого белка Hsp70 в головном мозге, приводит к снижению уровня тревожности в тесте ПКЛ у крыс. Отмечалось увеличение числа и времени входов в ОР, а также процентного отношения числа входов в ОР к общему числу всех входов. В настоящей работе, где применялся ингибитор экспрессии Hsp70 кверцетин, позволяющий ожидать противоположный результат, в том же тесте не удалось выявить влияние кверцетина на тревожно-подобное поведение крыс. Однако в тесте ОП наблюдалось отчетливое уменьшение времени пребывания в ЦЗ (параметр, аналогичный времени входов в ОР для ПКЛ) на фоне его увеличения в ПЗ, что является наиболее индикативным свидетельством повышения уровня тревожности в этом тесте [32, 33].
Более того, на усиление тревожности крыс в этом тесте может также указывать и выявленное увеличение числа замираний, одного из этологических паттернов поведения, показывающих высокую чувствительность к изменениям уровня тревожности и эмоциональной реактивности [24, 32, 33]. Сюда же следует отнести и обнаруженное увеличение числа болюсов дефекаций. Хотя этот показатель традиционно относят к индексу эмоциональности, однако, рост числа болюсов, как правило, коррелирует с ростом тревожности животного. Таким образом, выявленный в работе анксиогенный профиль сопровождался повышенной эмоциональной реактивностью. Следует отметить, что в исследовании с использованием ТП по этим последним показателям не было обнаружено изменений. Можно заключить, что в двух сравниваемых исследованиях профиль эффектов в тревожно-подобном поведении был несколько различным и показывал противоположный результат: применение ТП характеризовалось анксиолитическим эффектом, а введение кверцетина, напротив, вызывало анксиогенный эффект.
Кроме того, в настоящем исследовании обнаружено выраженное снижение общей двигательной активности крыс под действием кверцетина, что также контрастирует с сопоставляемыми данными предыдущей работы, в которой было показано увеличение числа входов в ЗР лабиринта после воздействия ТП. Несмотря на то, что именно по этому показателю нам не удалось выявить значимых различий между группами при анализе эффектов кверцетина в ПКЛ, негативное влияние на горизонтальную двигательную активность довольно убедительно проявилось в тесте ОП: отмечалось существенное уменьшение числа секций, пройденных во всех зонах арены, т.е. в ПЗ и ЦЗ (рис. 1). Более того, наблюдалось экстенсивное падение уровня вертикальной двигательной активности, судя по уменьшению числа вертикальных стоек с упором как в тесте ОП (рис. 1), так и в ПКЛ (табл. 2). Этот показатель в совокупности с предыдущими параметрами поведения в значительной мере может отображать уровень исследовательской активности [34, 35], а полученный результат в виде ее снижения является противоположным по отношению к результату действия ТП в ПКЛ.
Следует отметить, что исследовательское поведение тоже имеет взаимосвязь с тревожностью. Существует достаточно обоснованная гипотеза о том, что реализация исследовательской активности является результатом инактивации поведенческого ингибирования, обусловленного фактором тревожности [36]. Иначе говоря, наблюдается обратно пропорциональная зависимость – чем ниже уровень тревожности, тем выше уровень исследовательской активности, и наоборот. Полученные в работе результаты указывают на смещение кверцетином баланса данной системы в негативную сторону или комплексного анксиогенного профиля.
Однако уменьшение двигательной активности и повышение эмоциональной реактивности при введении кверцетина животным не дает серьезного основания объяснять наблюдаемые эффекты с позиции только ингибирующего действия кверцетина на экспрессию шаперонов. В наших опытах мы не наблюдали уменьшения содержания Hsp70 в структурах головного мозга, участвующих в регуляции тревожно-подобного и двигательного поведения. Это может быть связано с тем, что снижение количества Hsp70 происходит достаточно постепенно, и 2 ч после ингибирования фактора транскрипции шаперонов HSF является слишком коротким периодом, чтобы увидеть какие-либо изменения с помощью Вестерн-блоттинга. Мы полагаем, что в изменение эмоционального и двигательного поведения в этот период может вносить вклад в способность кверцетина влиять на внутриклеточные сигнальные пути киназ, играющих важную роль в нейробиологических процессах. Кверцетин проявляет ингибирующую активность на ферменты фосфоинозитид-3-киназы (PI3K), протенкиназу Б (Akt), тирозинкиназу, МАР-киназу и др. [8]. Ингибирующее или стимулирующее действие на этих путях могут оказать влияние на клеточные функции, пролифирацию и гибель клеток, нейротрансмиссию, формирование синаптической пластичности [8, 37]. Показано, что сигнальный каскад PI3K–AKT–GSK3β–CREB играет важную роль в модуляции тревожно-подобного поведения [38], а дисрегуляция GSK-3β пути приводит к развитию депрессивно- и маниакально-подобного поведения [39, 40].
Сопоставляя полученные нами данные с работами других авторов, следует, прежде всего, обратить внимание на некоторые отличительные особенности, характерные для результатов работ, связанных с изучением влияния кверцетина на поведение животных в моделях стресс-индуцируемой тревожности [13], мозговой травмы [16] и непредсказуемого стресса [17] у животных. Их общей чертой является выраженный анксиолитический эффект кверцетина при его многократном применении в течение 14–21 дней. Это указывает на то, что реализация анксиолитического эффекта кверцетина достигается за счет “накопительного” длительного действия, а не ситуативного. В наших опытах оценивалось ситуативное действие кверцетина “здесь и сейчас” – через 2 ч после применения препарата в нормальных условиях (не при патологии). В этом случае кверцетин оказывал анксиогенный эффект с ослаблением двигательной активности.
Таким образом, проведенное нами исследование показало, что кверцетин, обладающий широким спектром биологической активности, способен оказывать влияние на отдельные формы поведения животных. Выявленный в работе отчетливый негативный эффект на двигательную активность является немаловажным основанием для пересмотра профиля назначения его в качестве терапевтического препарата, широко используемого в современной фармацевтике и аптечном секторе (таксифолин, дигидрокверцетин и другие его изоформы). Более того, обнаруженное подавление исследовательского поведения и усиление эмоциональной реактивности с появлением отдельных признаков тревожности при однократном введении кверцетина также подчеркивают значимость учета фармакологических свойств этого препарата.
Список литературы
Anand David A.V., Arulmoli R., Parasuraman S. Overviews of Biological Importance of Quercetin: A Bioactive Flavonoid. Pharmacogn. Rev. 10: 84–89. 2016.
Almeida A.F., Borge G.I.A., Piskula M., Tudose A., Tudoreanu L., Valentova K., Williamson G., Santos C.N. Bioavailability of Quercetin in Humans with a Focus on Interindividual Variation. Compar. Rev. Food Sci. Food Saf. 17: 714–731. 2018.
Boots A.W., Haenen R., Bast A. Health effects of quercetin: From antioxidant to nutraceutical. Eur. J. Pharmacol. 585: 325–337. 2008. https://doi.org/10.1016/j.ejphar.2008.03.008
Brito A.F., Ribeiro M., Abrantes A.M., Pires A.S., Teixo R.J., Tralhão J.G., Botelho M.F. Quercetin in cancer treatment, alone or in combination with conventional therapeutics? Curr. Med. Chem. 22: 3025–3039. 2015. https://doi.org/10.2174/0929867322666150812145435
Qin M., Chen W., Cui J., Li W., Liu D., Zhang W. Protective efficacy of inhaled quercetin for radiation pneumonitis. Exp. Ther. Med. 14(6): 5773–5778. 2017. https://doi.org/10.3892/etm.2017.5290
Colunga Biancatelli R.M.L., Berrill M., Catravas J.D., Marik P.E. Quercetin and Vitamin C: An Experimental, Synergistic Therapy for the Prevention and Treatment of SARS-CoV-2 Related Disease (COVID-19). Front. Immunol. 11: 1451. 2020. https://doi.org/10.3389/fimmu.2020.01451
Cai Q., Rahn R.O., Zhang R. Dietary flavonoids, quercetin, luteolin and genistein, reduce oxidative DNA damage and lipid peroxidation and quench free radicals. Cancer Lett. 119(1): 99–107. 1997. https://doi.org/10.1016/s0304-3835(97)00261-9
Boly R., Gras T., Lamkami T., Guissou P, Serteyn D., Kiss R., Dubois J. Quercetin inhibits a large panel of kinases implicated in cancer cell biology. Int. J. Oncol. 38(3): 833–842. 2011. https://doi.org/10.3892/ijo.2010.890
Davies S.P., Reddy H., Caivano M., Cohen P. Specificity and mechanism of action of some commonly used protein kinase inhibitors. Biochem. J. 351(Pt. 1): 95–105. 2000. https://doi.org/10.1042/bj3510095
Huang Y.T., Hwang J.J., Lee P.P. Effects of luteolin and quercetin, inhibitors of tyrosine kinase, on cell growth and metastasis-associated properties in A431 cells overexpressing epidermal growth factor receptor. Br. J. Pharmacol. 128(5): 999–1010. 1999. https://doi.org/10.1038/sj.bjp.0702879
Agullo G., Gamet-Payrastre L., Manenti S., Viala C., Rémésy C., Chap H. Relationship between flavonoid structure and inhibition of phosphatidylinositol 3-kinase: a comparison with tyrosine kinase and protein kinase C inhibition. Biochem. Pharmacol. 53(11): 1649–1657. 1997. https://doi.org/10.1016/S0006-2952(97)82453-7
Peet G.W., Li J. IkappaB kinases alpha and beta show a random sequential kinetic mechanism and are inhibited by staurosporine and quercetin. J. Biol. Chem. 274(46): 32655–32661. 1999. https://doi.org/10.1074/jbc.274.46.32655
Samad N., Saleem A., Yasmin F., Shehzad M.A. Quercetin protects against stress-induced anxiety- and depression-like behavior and improves memory in male mice. Physiol. Res. 67(5): 795–808. 2018.
Holzmann I., da Silva L.M., Corrêa da Silva J.A., Steimbach V.M., de Souza M.M. Antidepressant-like effect of quercetin in bulbectomized mice and involvement of the antioxidant defenses, and the glutamatergic and oxidonitrergic pathways. Pharmacol. Biochem. Behav. 136: 55–63. 2015. https://doi.org/10.1016/j.pbb.2015.07.003
Khan K., Najmi A.K., Akhtar M.A. Natural Phenolic Compound Quercetin Showed the Usefulness by Targeting Inflammatory, Oxidative Stress Markers and Augment 5-HT Levels in One of the Animal Models of Depression in Mice. Drug Res. (Stuttg). 69(7): 392–400. 2019. https://doi.org/10.1055/a-0748-5518
Kosari-Nasab M., Shokouhi G., Ghorbanihaghjo A., Mesgari-Abbasi M., Salari A.A. Quercetin mitigates anxiety-like behavior and normalizes hypothalamus-pituitary-adrenal axis function in a mouse model of mild traumatic brain injury. Behav. Pharmacol. 30(2): 282–289. 2019. https://doi.org/10.1097/FBP.0000000000000480
Mehta V., Parashar A., Udayabanu M. Quercetin prevents chronic unpredictable stress induced behavioral dysfunction in mice by alleviating hippocampal oxidative and inflammatory stress. Physiol. Behav. 171: 69–78. 2017. https://doi.org/10.1016/j.physbeh.2017.01.006
Hosokawa N., Hirayoshi K., Nakai A., Hosokawa Y., Marui N., Yoshida M., Sakai T., Nishino H., Aoike A., Kawai K. Flavonoids inhibit the expression of heat shock proteins. Cell Struct. Funct. 15(6): 393–401. 1990.
Hartl F.U. Molecular chaperones in cellular protein folding. Nature. 381: 571–579. 1996.
Yi H., Huang G., Zhang K., Liu S., Xu W. HSP70 protects rats and hippocampal neurons from central nervous system oxygen toxicity by suppression of NO production and NF-κB activation. Exp. Biol. Med. (Maywood). 243(9): 770–779. 2018. https://doi.org/10.1177/1535370218773982
Ницинская Л.Е., Екимова И.В., Гужова И.В., Фейзулаев Б.А., Пастухов Ю.Ф. Влияние кверцетина на тяжесть химически индуцированных судорог и содержание белка теплового шока 70 Кда в структурах головного мозга крыс. Рос. физиол. журн. им. И.М. Сеченова. 96(3): 283–292. 2010. [Nitsinskaya L.E., Ekimova I.V., Guzhova I.V., Feizulaev B.A., Pastukhov Y.F. Effect of quercetin on the severity of chemically induced seizures and thecontentofheatshockprotein70intheratbrainstructures. Russ. J. Physiol. 96(3): 283-292. 2010. (In Russ)].
Екимова И.В., Плаксина Д.В. Влияние кверцетина на нейродегенеративные и компенсаторные процессы в нигростриатной системе в модели преклинической стадии болезни Паркинсона у крыс. Рос. физиол. журн. им. И.М. Сеченова. 102(6): 647–658. 2016. [Ekimova I.V., Plaksina D.V. Effect of quercetin on neurodegenerative and compensatory processes in nigrostriatal system in a model of preclinical parkinson’s disease stage in rats. Russ. J. Physiol. 102(6): 647–658. 2016. (In Russ)].
Graefe E.U., Derendorf H., Veit M. Pharmacokinetics and bioavailability of the flavonol quercetin in humans. Int. J. Clin. Pharmacol. Ther. 37(5): 219–233. 1999.
Буреш Я., Бурешова О., Хьюстон Дж. П. Методики и основные эксперименты по изучению мозга и поведения. М. Высш. школа. 1991. [Bures J., Buresova O., Huston J. Techniques and basic experiments for the study of brain and behavior. New York. Elsevier Science Publ. 1983 (Bures J., Buresova O., Huston J. Techniques and basic experiments for the study of brain and behavior. Moscow. Vyschaya shkola. 1991. (In Russ)].
Walf A.A., Frye C.A. The use of the elevated plus maze as an assay of anxiety-related behavior in rodents. Nat. Protoc. 2(2): 322–328. 2007.
Cardinal R.N., Hall J., Everitt B.J., Parkinson J.A. The contribution of the amygdala, nucleus accumbens, and prefrontal cortex to emotion and motivated behaviour. Int. Congr. Ser. 1250: 347–370. 2003.
McCall J.G., Siuda E.R., Bhatti D.L., Lawson L.A., McElligott Z.A., Stuber G.D., Bruchas M.R. Locus coeruleus to basolateral amygdala noradrenergic projections promote anxiety-like behavior. Elife. 6: e18247. 2017. https://doi.org/10.7554/eLife.18247
Paxinos G., Watson C. The rat brain in stereotaxic coordinates: hard cover edition. Acad. Press. 2006.
Bradford M.M. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding. Anal. Biochem. 72(1): 248–254. 1976.
Cleveland D.W., Fischer S.G., Kirschner M.W., Laemmli U.K. Peptide mapping by limited proteolysis in sodium dodecyl sulfate and analysis by gel electrophoresis. J. Biol. Chem. 252(3): 1102–1106. 1997.
Чернышев М.В., Сапач О.А. Тепловое прекондиционирование снижает уровень тревожности у крыс. Рос. физиол. журн. им. И.М. Сеченова. 105(5): 556–564. 2019. [Chernyshev M.V., Sapach О.A. Thermal preconditioning decreases a level of anxiety in rats. Russ. J. Physiol. 105(5): 556–564. 2019. (In Russ)].
Carola V., D’Olimpio F., Brunamonti E., Mangia F., Renzi P. Evaluation of the elevated plus-maze and open-field tests for the assessment of anxiety-related behaviour in inbred mice. Behav. Brain Res. 134(1–2): 49–57. 2002.
Kalueff A.V. Experimental modeling in anxiety and depression research. Psychopharmacol. Bio-l. Narcol. 4(2–3): 663–670. 2004.
Петров Е.С. Изучение нейробиологических основ сложных безусловных рефлексов в Физиологическом отделе им. И.П. Павлова: итоги последних лет. Рос. физиол. журн. им. И.М. Сеченова. 84(121): 1669–1681. 1990. [Petrov E.S. A study of neurobiological basis of complex unconditioned reflexes in I.P. Pavlov Physiological department: resumes of the last years. Russ. J. Physiol. 84(121): 1669–81. 1990. (In Russ)].
Sturman O., Germain P.L., Bohacek J. Exploratory rearing: a context- andstress-sensitive behavior recorded in the open-field test. Stress. 21(5): 443–452. 2018. https://doi.org/10.1080/10253890.2018.1438405
Montgomery K.C. The relationship between fear induced by novel stimulation and exploratory behaviour. J. Compar. Physiol. Psychol. 48: 254–60. 1955.
Duman R.S., Voleti B. Signaling pathways underlying the pathophysiology and treatment of depression: novel mechanisms for rapid-acting agents. Trends Neurosci. 35(1): 47–56. 2012. https://doi.org/10.1016/j.tins.2011.11.004
Qiao X., Gai H., Su R. PI3K-AKT-GSK3β-CREB signaling pathway regulates anxiety-like behavior in rats following alcohol withdrawal. J. Affect. Disord. 235: 96–104. 2018. https://doi.org/10.1016/j.jad.2018.04.039
Polter A., Beurel E., Yang S. Deficiency in the inhibitory serine-phosphorylation of glycogen synthase kinase-3 increases sensitivity to mood disturbances. Neuropsychopharmacology. 35(8): 1761–1774. 2010. https://doi.org/10.1038/npp.2010.43
Diniz B.S., Talib L.L., Joaquim H.P., de Paula V.R., Gattaz W.F., Forlenza O.V. Platelet GSK3B activity in patients with late-life depression: marker of depressive episode severity and cognitive impairment? World J. Biol. Psychiatry. 12(3): 216–222. 2011. https://doi.org/10.3109/15622975.2010.551408
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


