Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 3, стр. 342-355
Характеристики ЭЭГ в процессе кратковременных самопроизвольных пробуждений разной длительности при изменениях в психомоторной деятельности, вызванных засыпанием
Е. А. Черемушкин 1, *, Н. Е. Петренко 1, М. С. Генджалиева 2, Д. Г. Малахов 3, В. Б. Дорохов 1
1 Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова
Москва, Россия
3 НИЦ “Курчатовский институт”
Москва, Россия
* E-mail: ivnd@mail.ru
Поступила в редакцию 23.12.2019
После доработки 20.01.2020
Принята к публикации 21.01.2020
Аннотация
Во время дневного сна у 17 здоровых испытуемых изучали изменения спектральных характеристик ЭЭГ в периоды восстановления выполнения психомоторного теста при спонтанных кратковременных пробуждениях. Тест содержит два последовательно чередующихся задания: счет “про себя” от 1 до 10, сопровождаемый синхронными нажатиями на кнопку, и только счет “про себя”. Монотонный характер теста ведет к быстрому снижению уровня бодрствования и в большинстве случаев вызывает засыпание. Появление нажатий является поведенческим показателем возобновления когнитивных процессов, заторможенных во время сна. Сравнивали ситуации с малым (2–5) и относительно большим (6–10) числом нажатий на кнопку. Началу нажатий предшествует появление генерализованного альфа-ритма, который снижается в процессе выполнения психомоторной деятельности. Его мощность при этом всегда больше в ситуации с более длительными периодами наблюдаемой поведенческой активности. Окончание нажатий возвращает значения мощностных показателей альфа-активности к тем, которые наблюдались до пробуждения. Альфа-ритм ЭЭГ при сниженном уровне бодрствования во время кратковременных пробуждений, по-видимому, характеризует действие таламо-кортикального активирующего механизма и является необходимым условием для моторного взаимодействия организма с внешней средой. Отсутствие различий в лобных областях на начальном этапе при осуществлении кратковременной и более длительной деятельности, приближающейся к выполнению полного цикла нажатий, позволяет предположить, что в этот период они задействованы в одинаковой степени, независимо от числа нажатий. Этот результат может служить косвенным подтверждением того, что наблюдаемая психомоторная активность, даже при малом числе нажатий, не является автоматической, бессознательной, а сопровождается сниженным, фрагментарным сознанием.
Исследования переходных состояний цикла “сон–бодрствование” в основном касаются процессов засыпания и в существенном меньшей степени – пробуждения. Последнее изучается преимущественно в опытах с ночным сном и только в редких случаях, по условиям эксперимента – существенно позже самого момента пробуждения, сопровождается когнитивной активностью испытуемого.
Показаны особенности активации различных структур мозга при пробуждении из разных стадий сна [1]. По сравнению с состоянием покоя перед засыпанием, дефолтные (default-mode network) и гиппокампальные нейронные сети при пробуждении сохраняли одинаковые уровень связности и спектральную мощность; в сенсорно-моторной сети эти показатели снижались, а связь таламуса с неокортексом существенно усиливалась. Самые существенные изменения при этом наблюдались тогда, когда просыпанию предшествовал глубокий сон [1]. Ведущая роль таламуса при пробуждении, а также наличие регионарной специфики в зависимости от того, было ли оно самопроизвольным или вызванным условиями эксперимента, выявлена при исследовании ночного сна у больных эпилепсией [2]. Зависимость частоты альфа-ритма от длительности пробуждений во время ночного сна показана в работе [3]. Краткие просыпания (менее 5 мин) сопровождались более низкими частотами альфа-активности по сравнению с длительными. При этом и в том, и в другом случае у здоровых испытуемых частота альфа-ритма была снижена по сравнению с состоянием спокойного бодрствования.
Особенности выполнения когнитивных задач после пробуждения исследуется преимущественно в парадигме “инерции сна”. Было показано, что после ночного сна его влияние на функциональное состояние головного мозга сохранялось по разным данным от 10 мин до нескольких часов. Оно отражалось в увеличении мощности низкочастотных составляющих ЭЭГ (1–9 Гц) и снижении мощности высоких частот – по сравнению с периодом перед засыпанием [4–7]. Самые существенные изменения в поведенческих показателях, умственной деятельности и функциональной связности мозга были отмечены при пробуждении из глубокого сна [7]. Уменьшение мощности ЭЭГ в процессе выполнения когнитивных задач после пробуждения по сравнению с их выполнением перед сном показано японскими исследователями [8]. Отметим, что сам переход от состояния сна к деятельности никто из этих авторов не исследовал.
Ранее в опытах с дневным сном мы исследовали активность мозга в периоды, предшествующие спонтанному пробуждению и восстановлению выполнения психомоторной деятельности [9]. В процессе пробуждения показан рост мощности ЭЭГ в дельта- и альфа-диапазонах, который, по всей вероятности, отражает действие таламо-кортикального активирующего механизма [1, 2, 10].
Целью нашей работы было исследование ЭЭГ-коррелятов, непосредственно предшествующих и сопровождающих короткие периоды поведенческой активности при пробуждении во время дневного сна. В задачи входил анализ амплитудно-частотных характеристик дельта- и альфа- ритмов ЭЭГ перед началом и в кратковременные периоды когнитивной деятельности, различающиеся по длительности восстановления психомоторного теста.
МЕТОДЫ ИССЛЕДОВАНИЯ
Испытуемые. 34 человека (26 женщин и 8 мужчин, возраст от 19 до 22 лет), практически здоровые люди, правши, студенты московских вузов. Все были ознакомлены с процедурой опыта и дали согласие на участие в нем. Исследование соответствовало этическим нормам Хельсинской декларации Всемирной медицинской ассоциации “Этические принципы проведения научных медицинских исследований с участием человека” с поправками 2000 г.
Процедура исследования. Время эксперимента: с 13.00 до 16.00. Продолжительность – от 55 мин до 1 ч 10 мин. Перед опытом для оценки параметров сна в ночь, которая предшествовала обследованию, испытуемый заполняли дневник сна, а для самооценки дневной сонливости – опросник KSS (Каролинскую шкалу сонливости).
Испытуемый располагался на кушетке в затемненном и звукоизолирующем помещении с комфортной температурой. В течение 5 мин проводилась запись ЭЭГ в состоянии спокойного бодрствования при закрытых глазах. Чтобы получить ряд последовательных периодов засыпания―пробуждения использовали непрерывно-дискретный психомоторный тест, предложенный нами ранее [9, 11, 12]. Испытуемый считал “про себя” от 1 до 10, при этом одновременно при каждом счете он нажимал на кнопку большим пальцем правой руки (1-я фаза теста), которая была закреплена на указательном пальце. Далее он продолжал считать “про себя” от 1 до 10, но уже без нажатий (2-я фаза). Чередование счета с нажатиями и без нажатий (1-я и 2-я фазы) длилось до тех пор, пока исследуемый не засыпал, или же до конца опыта. В случае засыпания и последующего самопроизвольного пробуждения он должен был возобновить выполнение заданий психомоторного теста. В инструкции, которая давалась после записи ЭЭГ с закрытыми глазами, подчеркивалось, что при просыпании необходимо сначала выполнять счет с нажатием на кнопку (1-я фаза) и только потом без нажатия.
В течение опыта с поверхности головы регистрировали ЭЭГ от 17 отведений, расположенных в соответствии со схемой 10–20% (F3, F4, F7, F8, Fz, C3, C4, Cz, T3, T4, P3, P4, Pz, T5, T6, O1, O2). Отведение было монополярным, референтный электрод – объединенный ушной. Также записывалась электроокулограмма (ЭОГ), миограмма (ЭМГ) и механограмма нажатий на кнопку. Регистрацию всех показателей проводили с помощью системы Neocortex–Pro (Neurobotics, Россия). Частота дискретизации – 250 Гц. Полоса пропускания частот: 0.5–70 Гц. ЭЭГ регистрировали с помощью шлема с хлорсеребряными электродами с сопротивлением, не превышающим 5 КОм.
Отбор и анализ данных. Выделяли испытуемых, которые при самопроизвольном пробуждении из второй стадии сна хотя бы по одному разу воспроизводили задание 1-й фазы психомоторного теста с меньшим (2–5) и бо́льшим (6–10) числом нажатий. Использование приема повторных наблюдений у одного и того же субъекта при сопоставлении характеристик альфа-ритма, сопровождающего эти разные по длительности поведенческие паттерны, позволяет избежать влияния на получаемые результаты различий в его мощности, которые присутствуют в ЭЭГ испытуемых. Этот прием также позволяет сопоставлять промежутки времени от появления широко распространенного по коре альфа-ритма до момента начала нажатий, которые варьируют от испытуемого к испытуемому и зависят от числа нажатий.
Рассматривали ситуации, при которых очередная последовательность нажатий фиксировалась в механограмме через минуту и более. Исключали тех, у кого разница между короткими и более продолжительными эпизодами реализации 1-й фазы теста после пробуждения была меньше 3 нажатий. Далее для последующего анализа у каждого испытуемого брали по одной реализации с меньшим и бо̒льшим числом нажатий так, чтобы упомянутая разница была максимальной. Таким образом, мы в определенной мере разделяли уровни активации субъекта в эпизодах восстановления деятельности после пробуждения. В результате отобрали 17 человек (13 женщин и 4 мужчин, возраст от 19 до 22 лет). Средняя продолжительность ночного сна накануне опыта – 6.0 ± 0.5 ч, его качество и самочувствие после утреннего пробуждения оценивались испытуемыми как хорошее и удовлетворительное (3.8 ± 0.3 и 3.2 ± 0.3 соответственно, 5-балльные шкалы, 5 – наилучшая оценка). Уровень сонливости перед опытом – повышенный (5.3 ± 0.5, 7-балльная шкала, 7 – самая высокая сонливость).
Анализировали 40-секундные отрезки записи ЭЭГ, на середину которых приходилось возобновление нажатий на кнопку. Для оценки амплитудных изменений электрических колебаний применяли метод анализа вариационных кривых [13]. Предварительно на основе Фурье-преобразования фильтровали отобранные отрезки в диапазонах 0.5–3.5, 4–7.5, 8–10.5 и 11–13.5 Гц (дельта-, тета-, низкочастотный и высокочастотный альфа-ритмы). Далее на 1-секундных интервалах со скользящим окном 100 мс и сдвигом 10 мс для каждого отведения ЭЭГ определяли функцию вариации и усредняли ее значения. По определению вариационная кривая является произведением амплитуды потенциала на его частоту. Однако, учитывая малые изменения частотной структуры электрических колебаний на относительно небольшом отрезке времени (1 с), можно говорить о ней как о показателе мощностного, амплитудного типа [13]. Впоследствии оказалось, что выбор относительно коротких 1-секундных временны́х интервалов в качестве эпохи анализа при статистической оценке изменений амплитудных характеристик ЭЭГ для данного исследования являлся избыточным. В связи с этим полученные значения функции вариации мы усредняли по 2 с. На результатах это не сказалось, зато на иллюстрирующих их рисунках сглаженные таким образом кривые стали лучше отражать тренды этих изменений. Полученные величины по каждому выделенному частотному диапазону анализировали с помощью дисперсионного анализа методом повторных измерений (ANOVA RM). При этом мы фокусировали внимание на интервале времени, сопоставимом с длительностью выполнения 1 фазы теста (10 с, или пять 2-секундных интервалов), т.е. периоде нажатий на кнопку после пробуждения. Рассматривали влияние на амплитудно-мощностные характеристики ЭЭГ факторов “психомоторная активность” (2 уровня: до начала нажатий и после), “длительность нажатий” (2 уровня: 2–5 и 6–10 нажатий), и “время” (5 уровней: пять 2-секундных временны́х отрезков). Анализ проводили как по усредненным амплитудным значениям всех отведений ЭЭГ для каждого отсчета (т.е. суммарно), так и по отдельности для каждого отведения. После анализа полученных результатов в данном дизайне дисперсионного анализа возникла необходимость дополнительной обработки с учетом их региональных особенностей. Дополнительно рассматривали влияние на вычисленные мощностные характеристики ЭЭГ факторов “регион отведения” (2 уровня: передне-центральный и каудальный) и “отведение ЭЭГ” (6 уровней: для передне-центрального региона – F3, F4, F7, F8, C3, C4; для каудального – P3, P4, T5, T6, O1, O2). Статистические результаты получали с использованием поправки Гринхауза―Гессера. На каждом интервале времени с помощью парного критерия Вилкоксона сравнивали характеристики исследуемых ритмов ЭЭГ. Все статистические вычисления проводили с помощью пакета программ SPSS 13.0.
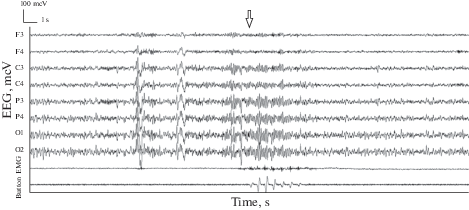
Рис. 1.
Пример ЭЭГ, ЭМГ и механограммы при пробуждении и возобновлении выполнения психомоторного теста. Сверху вниз: отведения ЭЭГ, ЭМГ и механограмма. Вертикальными линиями отмечены 1-секундные интервалы времени. Стрелка – начало фиксации нажатий. Fig. 1. An example of an EEG, EMG, and mechanograms on waking up and resuming a psychomotor test. From top to bottom: EEG, EMG and mechanogram leads. Vertical lines indicate 1-second time intervals. Arrow – the clicks fixation beginning.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
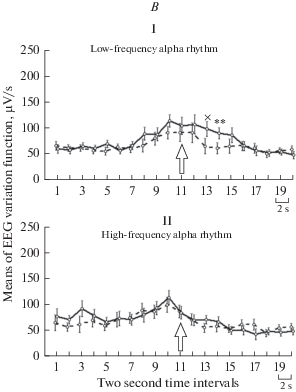
В целом по всем отведениям показано влияние фактора “психомоторная активность” на мощность дельта-ритма (F(1;16) = 20.0, p < 0.001) и на уровне тенденции – на мощность альфа-ритмов обоих исследуемых диапазонов (F(1;16) = 3.7, p = 0.07 и F(1;16) = 3.7, p = 0.07 соответственно); фактора “длительность нажатий” на мощность низкочастотного и высокочастотного альфа-ритма ЭЭГ (F(1;16) = 11.0, p = 0.004 и F(1;16) = 9.4, p = 0.007 соответственно). Также для низкочастотного альфа-ритма на уровне тенденции показано влияние на его мощность сочетания факторов “психомоторная активность” и “длительность нажатий” (F(1;16) = 3.8, p = 0.07). Средние значения мощности ЭЭГ суммарно по всем отведениям для исследуемых поддиапазонов альфа-ритма приведены на рис. 2A, а для дельта-ритма – на рис. 3A. Мы не получили достоверного влияния исследуемых факторов на мощностные характеристики тета-ритма и поэтому исключили их из дальнейшего анализа.
Рис. 2.
Спектральные характеристики низкочастотного и высокочастотного альфа-ритма при разной длительности периода нажатий на кнопку во время восстановления выполнения психомоторного теста после спонтанного пробуждения. I – низкочастотный альфа-ритм, II – высокочастотный; A – суммарно по всем отведениям ЭЭГ; пунктирная линия – 2–5 нажатий, сплошная – 6–10; по вертикали – величина спектральной оценки, мкВ/с, по горизонтали – время, 2-секундные отрезки; стрелка – начало нажатий после пробуждения; “x”, “*” и “**”– различия (p < 0.1, 0.05 и 0.01 соответственно); показан интервал, на котором проводился дисперсионный анализ; показана ошибка среднего; B – результаты дисперсионного анализа по отдельным отведениям ЭЭГ; приведены карты с достоверными различиями для отдельных факторов и их сочетания; светло-серый, темно-серый и черный цвет отведений – p < 0.1, 0.05 и 0.01 соответственно. Fig. 2. The spectral characteristics of the low-frequency and high-frequency alpha rhythm with different lengths of the period the button is pressed during the restoration of the psychomotor test after spontaneous awakening. I – low-frequency alpha rhythm, II – high-frequency; A – total for all EEG leads; dashed line – 2–5 clicks, solid – 6–10; vertically – spectrum power, μV/s, horizontally – time, 2-second segments; arrow – the beginning of clicks after waking up; “х”, “*" and “**” are the differences (p < 0.1, 0.05 and 0.01, respectively); the interval over which the analysis of variance was carried out is shown; average error is shown; B – the results of analysis of variance for EEG leads; map-schemes with significant differences for individual factors and their combinations are given; light gray, dark gray and black color of assignments – p < 0.1, 0.05 and 0.01 respectively.

Рис. 2.
Окончание
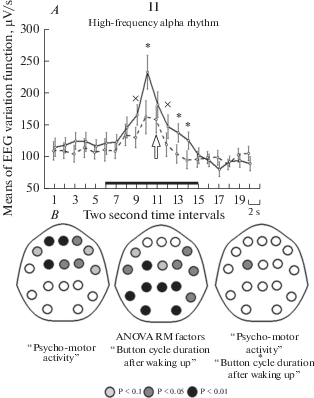
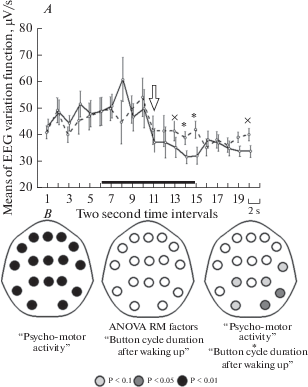
Рис. 3.
Спектральные характеристики дельта-ритма при разной длительности периода нажатий на кнопку во время восстановления выполнения психомоторного теста после спонтанного пробуждения. Обозначения, как на рис. 2. Fig. 3. The spectral characteristics of the delta-rhythm with different durations of the period the button is pressed during recovery of the psychomotor test after spontaneous awakening. Designations as in fig. 2.
Результат влияния факторов “психомоторная активность” и “длительность нажатий”, а также их взаимодействия на характеристики спектральной мощности отдельных отведений ЭЭГ приведены на рис. 2B и рис. 3B.
Показано влияние на мощностные характеристики низкочастотного альфа- ритма сочетания факторов “психомоторная активность” и “регион отведения” (F(1;16) = 14.1, p = 0.002), “длительность нажатий” и “регион отведения” (F(1;16) = 7.6, p = 0.014), а также “психомоторная активность”, “длительность нажатий” и “регион отведения” (F(1;16) = 6.7, p = 0.02). Для высокочастотного альфа-ритма показано влияние на мощность сочетания факторов “длительность нажатий” и “регион отведения” (F(1;16) = 35.3, p = 0.0001). Для дельта-ритма показано влияние сочетания факторов “психомоторная активность”, “длительность нажатий” и “регион отведения” (F(1;16) = 8.7, p = 0.01).
Отметим, что при данном дизайне дисперсионного анализа была показана значимость влияния на мощность низкочастотного и высокочастотного альфа-ритма изолированного фактора “длительность нажатий” (F(1;16) = 13.4, p = 0.002 и F(1;16) = 11.1, p = 0.004).
Начало выполнения психомоторного теста приходится на широко распространенный по коре альфа-ритм, который в процессе деятельности снижается. Существуют данные, что альфа-ритм появляется в энцефалограмме во время кратких эпизодов бодрствования, прерывающих сон (WASOs) и во время пробуждения от сна [2, 3, 14, 15]. Можно предполагать, что альфа-ритм ЭЭГ при сниженном уровне бодрствования является необходимым условием для моторного взаимодействия организма с внешней средой.
Результаты парных сравнений мощностных характеристик ЭЭГ для отведений ЭЭГ в периоды до нажатий на кнопку приведены на рис. 4. Мы сочли возможным привести на этом и других рисунках не только статистически значимые результаты, но и результаты на уровне тенденции по следующим соображениям. Исследуемые нами отрезки ЭЭГ приходятся на переходные состояния цикла “сон–бодрствование”, сопровождаемые периодом психомоторной деятельности и активизацией сознания. В качестве подхода к оценке этого феномена мы взяли поведенческий показатель – разное число нажатий в этих переходных состояниях. Мерой для оценки мозгового обеспечения локализованных на коротком интервале времени процессов пробуждения–засыпания, психомоторной деятельности и появления–угасания сознания в данном исследовании были выбраны мощностные характеристики колебаний электрической корковой активности мозга. Детальное описание региональных различий в ЭЭГ при данной параметризации комплекса наблюдаемых явлений, как нам представляется, позволит читателю получить о них более полную информацию. Разумеется, это не исключает критического отношения к результатам, полученным на уровне тенденции.
Рис. 4.
Карты-схемы результата парных сравнений спектральных характеристик ЭЭГ, которая предшествует началу нажатий на кнопку: сравниваются ситуации, когда впоследствии будет наблюдаться малое (от 2 до 5) и большее (от 6 до10) число нажатий. I, II и III – низкочастотный, высокочастотный альфа-ритм и дельта-ритм соответственно; 1–5 – 2-секундные интервалы времени; стрелка – момент начала нажатий; светло-серый, темно-серый и черный цвет отведений – p < 0.1, 0.05 и 0.01 соответственно; знак “прямоугольник с бо́льшим зачернением” – мощность больше в случае последующей ситуации с 2–5-ю нажатиями, “прямоугольник с меньшим зачернением” – мощность больше в случае последующей ситуации с 6–10-ю нажатиями. Fig. 4. Map-schemes of the result of pairwise comparisons of the spectral characteristics of the EEG, which precedes the start of pressing the button: situations when a small number (from 2 to 5) and a larger number (from 6 to 10) of clicks will subsequently be observed. I, II and III – low-frequency, high-frequency alpha rhythm and delta rhythm, respectively; 1–5 – 2 second time intervals; arrow – the moment of the start of pressing; light gray, dark gray and black color of assignments – p < 0.1, 0.05 and 0.01 respectively; the sign “rectangle with greater blackening” – power is greater in the case of a subsequent situation with 2–5 clicks, “rectangle with lower blackening” – power is greater in the case of the subsequent situation with 6–10 clicks.
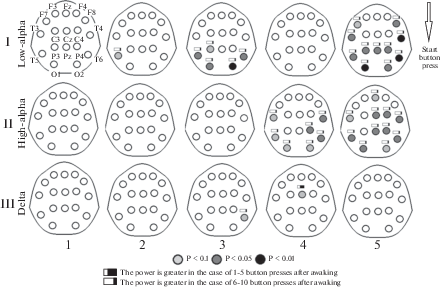
Мы показали, что перед началом психомоторной активности характеристики альфа-ритма выше в том случае, когда испытуемый впоследствии дольше нажимал на кнопку. Эти различия наблюдаются в низкочастотном альфа-ритме за 5–6 с до начала нажатий с вовлечения каудальных областей и непосредственно перед нажатиями в течение 2 с (рис. 4, I). В высокочастотном альфа- ритме эта разница отмечается позднее (за 3–4 с до начала нажатий) в каудальных и передне-височных областях, а непосредственно перед началом деятельности распространяются и на области Fz, Сz и C4 (рис. 4, II). Передне-височная кора играет важную роль в обеспечении рабочей памяти [16]. Латеральная префронтальная кора участвует в организации систем направленного внимания и нисходящего (top–down) когнитивного контроля [17–19]. В нашем исследовании активация, опережающая начало деятельности в передне-височной и вентролатеральной префронтальной коре, может отражать процессы, связанные с извлечением инструкции из рабочей памяти, на основании которой планируются дальнейшие действия.
Различия в мощности альфа-колебаний в центральной области правого полушария отражает подготовку к более длительной моторной деятельности, приближающейся по времени к полному циклу нажатий психомоторного теста. Известно, что изменения в ЭЭГ, связанные с реализацией движений конечностями, наиболее выражены в полушарии, контралатеральном конечности (в частности, руке), которой совершается движение [20, 21]. Можно предположить, что подготовка к началу моторной реакции также осуществляется в контралатеральном полушарии.
Различия в дельта-ритме перед паттернами нажатий разной длительности практически отсутствуют (рис. 4, III).
Результаты парных сравнений мощностных характеристик ЭЭГ для отведений ЭЭГ в периоды до нажатий на кнопку приведены на рис. 5. Характеристики альфа-ритма также могут служить показателем длительности бодрствования в исследуемые периоды пробуждения. Относительно продолжительный период нажатий сопровождается в целом более высокими амплитудными значениями альфа-ритма по сравнению с более коротким периодом (рис. 5, I и II). Окончание нажатий и в том, и в другом случае возвращает величины мощностных показателей альфа-активности к тем, которые наблюдались до пробуждения.
Рис. 5.
Карты-схемы результата парных сравнений спектральных характеристик ЭЭГ между ситуациями с малым и большим числом нажатий при восстановлении выполнения психомоторного теста после спонтанных пробуждений. 1–6 – 2-секундные интервалы времени. Остальные обозначения, как на рис. 4. Fig. 5. Map-schemes of the pairwise comparisons result of the EEG spectral characteristics between situations with a small and a large number of clicks when restoring the psychomotor test after spontaneous awakenings. 1–6 – 2 second time intervals. Other designations as in fig. 4.

Менее выраженные различия между ситуациями с различной длительностью временны́х периодов поведенческой активности отмечены в дельта-ритме. При реализации деятельности во время относительно продолжительного периода нажатий его мощностные характеристики несколько снижаются, а во время короткого практически не меняются (рис. 5, III). Отметим, что даже небольшое снижение мощности дельта-ритма в ситуации, когда испытуемый приближался к полному воспроизведению цикла нажатий психомоторного теста, привело к появлению значимых различий, наиболее выраженных на 7–10-й с от момента начала нажатий. Сохранение низкочастотной активности, характерной для состояния сна после пробуждения, т.н. инерция сна описана в литературе [4–7].
Отметим, что термин “инерция сна” принято использовать при исследовании нарушений деятельности после продолжительного дневного и ночного сна, включающего стадию глубокого сна (третья стадия). Деятельность субъекта при этом изучается не непосредственно после пробуждения, а через какое-то время. В условиях нашего исследования периоды сна, предшествующие спонтанным пробуждениям, были относительно непродолжительными, а сам сон достигал только второй стадии. Существуют работы, показывающие, что после короткого сна, в котором отсутствует третья стадия, вместо сонливости наблюдается активация мозга [22]. Учитывая все это, использовать данный термин для объяснения изменений в ЭЭГ во время наблюдаемых нами явлений не совсем корректно. Однако категорически отрицать влияние последействия сна на кратковременное пробуждение, психомоторную деятельность, осуществляемую в этот период, а впоследствии быстрое засыпание, – не представляется очевидным.
Таким образом, мощность дельта-ритма в определенной мере также может рассматриваться как характеристика длительности кратковременных пробуждений.
Отсутствие различий в лобных областях в альфа-ритме на начальном этапе осуществления психомоторной деятельности разной продолжительности (кратковременной и более длительной, приближающейся к выполнению полного цикла нажатий) свидетельствует, что эти области задействованы в одинаковой степени независимо от числа нажатий (рис. 6).
Рис. 6.
Спектральные характеристики низкочастотного и высокочастотного альфа-ритма лобных областей отведения ЭЭГ при разной длительности периода нажатий на кнопку во время восстановления выполнения психомоторного теста после спонтанного пробуждения. A – F3, B – F4. Остальные обозначения, как на рис. 2. Fig. 6. Spectral characteristics of the low-frequency and high-frequency alpha-rhythm of the EEG leads frontal areas with different durations of the button presses during the restoration of the psychomotor test after spontaneous awakening. A – F3, B – F4. Other designations as in fig. 2.

Рис. 6.
Окончание
Данный результат может служить подтверждением того, что наблюдаемая психомоторная активность не является автоматической, неосознаваемой, а сопровождается сниженным, фрагментарным сознанием [23, 24]. Мы полагаем, что число нажатий при выполнении психомоторного теста во время переходных процессов от сна к деятельности и от деятельности снова ко сну свидетельствует об уровне сознания, которое проявляется при этом. Надеемся, что наше исследование дает пищу для размышления и поиска новых экспериментальных парадигм в исследовании сознания и его нейрональных коррелятов.
Список литературы
Tsai P.J., Chen S.C., Hsu C.Y., Wu C.W., Wu Y.C., Hung C.S., Yang A.C., Liu P.Y., Biswal B., Lin C.P. Local awakening: regional reorganizations of brain oscillations after sleep. Neuroimage. 102(2): 894–903. 2014.
Peter-Derex L., Magnin M., Bastuji H. Heterogeneity of arousals in human sleep: A stereo–electroencephalographic study. Neuroimage. 123: 229–244. 2015.
Schwabedal J., Riedl M., Penzel Th., Wessel N. Alpha–wave frequency characteristics in health and insomnia during sleep. J. Sleep. Res. 25: 278–286. 2016.
Ferrara M., Curcio G., Fratello F., Moroni F., Marzano C., Pellicciari M.C., Gennaro L.D. The electroencephalographic substratum of the awakening. Behav. Brain Res. 167: 237–244. 2006.
Marzano C., Ferrara M., Moroni F., De Gennaro L. Electroencephalographic sleep inertia of the awakening brain. Neuroscience. 176: 308–17. 2011.
Trotti L. Waking up is the hardest thing I do all day: Sleep inertia and sleep drunkenness. Sleep Med. Rev. 35: 76–84. 2017.
Vallat R., Meunier D., Nicolas A., Ruby P. Hard to wake up? The cerebral correlates of sleep inertia assessed using combined behavioral, EEG and fMRI measures. Neuroimage. 184: 266–278. 2019.
Ikeda H., Hayashi M. Effect of sleep inertia on switch cost and arousal level immediately after awakening from normal nocturnal sleep. Sleep and Biol. Rhythms. 6: 120–125. 2008.
Черемушкин Е.А., Петренко Н.Е., Генджалиева М.С., Яковенко И.А., Малахов Д.Г., Дорохов В.Б. ЭЭГ активность мозга, предшествующая спонтанному восстановлению психомоторной деятельности после эпизодов микросна. Росс. физиол. журн. им. И.М. Сеченова. 105(8): 1002–1012. 2019. [Cheremushkin E.A., Petrenko N.E., Gendzhalieva M.S., Yakovenko I.A., Malakhov D.G., Dorokhov V.B. EEG activity preceding spontaneous restoration of psychomotor activity after microsleep episodes. Russ. J. Physiol. 105(8): 1002–1012. 2019. (In Russ)].
Hale J.R., White T.P., Mayhew S.D., Wilson R.S., Rollings D.T., Khalsa S., Arvanitis T.N., Bagshaw A.P. Altered thalamocortical and intra-thalamic functional connectivity during light sleep compared with wake. Neuroimage. 125: 657–667. 2016.
Дорохов В.Б. Альфа-веретена и К-комплекс-фазические активационные паттерны при спонтанном восстановлении нарушений психомоторной деятельности на разных стадиях дремоты. Журн. высш. нерв. деят. 53(4): 502–511. 2003. [Dorokhov V.B. Alpha bursts and K-complex- phasic activation pattern during spontaneous recovery of correct psychomotor performance at different stages of drowsiness. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 53(4): 502–511. 2003. (In Russ)].
Dorokhov V.B., Malakhov D.G., Orlov V.A., Ushakov V. Experimental Model of Study of Consciousness at the Awakening: FMRI, EEG and Behavioral Methods: Proc. of the Ninth Annual Meeting of the BICA Society. In: Biologically Inspired Cognitive Architectures. 82–87. 2018.
Козлов М.К. Оценка достоверности вариационных характеристик пре‑ и постстимульной кривой ЭЭГ по критерию хи‑квадрат. Журн. высш. нерв. деят. 59(2): 281–290. 2009. [Kozlov M.K. Estimation of the Validity of Variational Characteristics of Pre-and Poststimulus EEG by the Chi-Square Test. Zh. Vyssh. Nerv. Deiat. Im. I.P. Pavlova. 59(2): 281–290. 2009. (In Russ)].
Steriade M., McCormick D.A., Sejnowski T.J. Thalamocortical oscillations in the sleeping and aroused brain. Science. 262: 679–685. 1993.
Halász P., Terzano M., Parrino L., Bodizs R. The nature of arousal in sleep. J. Sleep. Res. 13: 1–23. 2004.
Petrides M., Pandya D. The Frontal Cortex. In: The Human Nervous System. Eds. Paxinos G., Mai U. Acad. Press. Amsterdam. 950–972. 2004
Kostandov E.A. The role of implicit estimation of time intervals and set plasticity in facial expression processing. In: Cognitive Systems Monographs. 25: 349–366. 2015.
Morales J., Lau H., Fleming S.M. Domain–General and Domain–Specific patterns of activity supporting metacognition in human prefrontal cortex. J. Neurosci. 38(14): 3534–3546. 2018.
Nyberg L. Cognitive control in the prefrontal cortex: A central or distributed executive? Scand. J. Psychol. 59(1): 62–65. 2018.
Pfurtscheller G., Neuper C. Movement and ERD/ERS. In: The Bereitschafts potential. Movement related cortical potentials. Eds. Jahanshahi M., Hallett M.N.Y. Kluver Acad. Plenum Publ. 191–206. 2003.
Kostandov E.A., Cheremushkin E.A., Yakovenko I.A., Petrenko N.E. Relationships between the flexibility of cognitive performance and the α-rhythm response to conditioning stimuli. Human Physiology. 41(5): 468–477. 2015.
George P.T. The psycho-sensory wake drive—a power source for power naps and other common sleep-wake phenomena: a hypothesis. Sleep Breathing Physiology and Disorders. Review. 22(1): 41–48. 2018.
Fazekas P., Overgaard M. Multidimensional Models of Degrees and Levels of Consciousness. Trends in Cognitive Sci. 20(10): 715–716. 2016.
Fazekas P., Overgaard M. Multiple factors and multiple mechanisms determine the quality of conscious experiences: a reply to Anzulewicz and Wierzchon. Cogn. Sci. 42 (6): 2101–2103. 2018.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


