Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 3, стр. 356-372
Изменение поведения и экспрессии генов ионотропных рецепторов глутамата в мозге взрослых крыс после неонатальных введений бактериального липополисахарида
А. Н. Трофимов 1, *, А. Ю. Ротов 1, 2, Е. А. Вениаминова 1, К. Фомалонт 1, А. П. Шварц 1, 2, О. Е. Зубарева 1, 2
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова
Санкт-Петербург, Россия
* E-mail: alexander.n.trofimov@gmail.com
Поступила в редакцию 23.12.2019
После доработки 21.01.2020
Принята к публикации 21.01.2020
Аннотация
Большое количество исследований указывает на роль раннего опыта, в частности неонатальных инфекций, в формировании высокого уровня тревожности в последующей жизни. Одним из механизмов таких изменений может быть нарушение функциональной активности ионотропных глутаматных рецепторов, связанное с перестройкой их субъединичного состава. Целью данной работы явилось изучение показателей тревожности и уровня экспрессии в медиальной префронтальной коре, вентральной и дорзальной областях гиппокампа генов субъединиц NMDA-рецепторов (Grin1, Grin2a, Grin2b) и AMPA-рецепторов (Gria1, Gria2) у взрослых крыс, которым в раннем возрасте вводили бактериальный липополисахарид (ЛПС) в дозах, индуцирующих развитие нейровоспалительных процессов. Экспрессию генов изучали методом ОТ-ПЦР в реальном времени. Показано, что введение крысятам-самцам Вистар на 15-е, 18-е и 21-е сутки жизни ЛПС в дозе 25 или 50 мкг/кг индуцирует усиление экспрессии генов провоспалительных цитокинов: интерлейкина-1β и фактора некроза опухоли в областях гиппокампа. Через 3 месяца после введений ЛПС выявлено усиление экспрессии генов Grin2b, Gria1, Gria2 в вентральной области гиппокампа (после инъекций 50 мкг/кг ЛПС) и гена Gria2 в дорзальной области гиппокампа (после введения 25 мкг/кг ЛПС). Эти изменения сопровождаются нарушением исследовательского поведения в тесте Открытое поле и снижением уровня тревожности в Приподнятом крестообразном лабиринте. Проведенное исследование показало, что введение бактериального ЛПС в раннем постнатальном онтогенезе, приводит к отставленным во времени изменениям экспрессии генов субъединиц NMDA- и AMPA-рецепторов в гиппокампе и связанных с ними форм поведения.
Тревожные расстройства являются наиболее распространенными психическими заболеваниями во всем мире: по данным разных исследований от 3.8 до 33.7% взрослых людей сталкиваются с подобными проблемами хотя бы единожды в жизни [1, 2], при этом молекулярные механизмы высокой предрасположенности к развитию тревожных расстройств остаются малоизученными.
Большое количество исследований указывает на роль раннего опыта, в частности пренатальных и неонатальных стрессов и инфекционных заболеваний, в формировании высокого уровня тревожности в последующей жизни [3, 4].
Экспериментальной моделью неонатальных инфекционных заболеваний является введение животным бактериального липополисахарида (ЛПС, эндотоксина) – элемента клеточной стенки грамотрицательных бактерий. Связываясь с Toll-like рецепторами IV типа (TLR4), ЛПС индуцирует в клетках иммунной и нервной систем синтез провоспалительных цитокинов – интерлейкинов (ИЛ)-1β и -6 и фактора некроза опухоли (ФНО) [5], что приводит к развитию продромального синдрома, включающего повышение температуры тела, нарушение пищевой и исследовательской мотиваций, подавлению социальной активности, преобладанию медленноволнового сна, активацию гипоталамо-гипофизарно-надпочечниковой системы [6]. При введении умеренных доз эндотоксина эти эффекты у взрослых непродолжительны, однако введение тех же доз ЛПС в раннем онтогенезе может оказывать долговременное повреждающее действие на функции ЦНС. В частности, показано, что у потомства крыс, получавших ЛПС во время беременности, и у крысят, которым вводили ЛПС в первые дни жизни, в подростковом возрасте повышена локомоторная активность [7], развивается депрессивно-подобное и тревожное поведение [8–10], а во взрослом возрасте отмечаются депрессивно-подобные изменения поведения [10–12].
Предполагается, что одним из факторов возникновения психоэмоциональных расстройств, связанных с негативными влияниями среды в раннем возрасте, может быть нарушение формирования NMDA- и AMPA-глутаматных рецепторов в клетках ЦНС [13]. Общепризнанной является роль этих рецепторов в регуляции процессов нейропластичности, обучения и памяти [14–17]. Однако также обсуждается вовлеченность NMDA- и AMPA-рецепторов в патогенез биполярных расстройств [18–20], поскольку уровень экспрессии NMDA-рецепторов в гиппокампе коррелирует с показателями тревожности [21], а внутригиппокампальное введение их агонистов модулирует уровень тревожности экспериментальных животных [22].
Функциональная активность NMDA- и AMPA-рецепторов напрямую связана с их субъединичным составом [23–25]. NMDA-рецепторный комплекс представляет собой гетеротетрамер, состоящий из обязательных GluN1 и вариантных GluN2 (a–d) либо GluN3 (a, b) субъединиц, благодаря которым обеспечивается большая функциональная и региональная вариативность NMDA-рецепторов [24]. Субъединицы NMDA-рецепторов кодируются генами Grin1, Grin2a–Grin2d, Grin3a, Grin3b. A-MPA-рецепторы состоят из 4 субъединиц GluA (1–4), чаще это димер димеров из двух GluA2 и двух других (GluA1, GluA3 либо GluA4) субъединиц [26]. Субъединицы AMPA-рецепторов кодируются генами Gria1–Gria4. GluA2-содержащие рецепторы, в отличие от не содержащих эти субъединицы, непроницаемы для ионов кальция [27].
Критическим периодом для формирования субъединичного состава NMDA- и AMPA-рецепторных комплексов в мозге крысы является ранний постнатальный онтогенез. Созревание рецепторов выражается в изменении их конструкции, процесс имеет разную динамику в различных областях мозга и подтипах нейронов [28–32]. В гиппокампе крыс существенные возрастные перестройки субъединичного состава NMDA-рецепторов происходят на 2–3-й неделях жизни [33–35]. Они выражаются, в частности, в усилении продукции GluN2a и, как следствие, увеличении доли NMDA-рецепторов, содержащих эту субъединицу. Примерно в те же сроки происходит дозревание AMPA-рецепторов нейронов коры [36, 37]. Незрелые синапсы содержат кальций-проницаемые AMPA-рецепторы, которые по мере созревания мозга заменяются на содержащие GluA2 кальций-непроницаемые рецепторы [38]. Данные о влиянии неонатальных инфекций на формирование субъединичного состава NMDA- и AMPA-рецепторов в критический период их созревания немногочисленны и разрозненны.
В данной работе исследованы показатели тревожности и уровень экспрессии генов субъединиц NMDA- и AMPA-рецепторов в клетках мозга, наблюдаемые у взрослых крыс, которым вводили бактериальный ЛПС в течение 3-й недели жизни – периода активного формирования субъединичного состава NMDA- и AMP-A-рецепторов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Объект, схема эксперимента
Работа выполнена на крысятах Вистар с соблюдением принципов гуманности (Директивы Европейского Сообщества № 86/609 ЕС), одобренных Локальным этическим комитетом ФГБНУ “ИЭМ”. Разведение животных производили в условиях вивария Института, поскольку стресс, связанный с перевозкой беременных самок, мог существенно повлиять на поведение потомства. Крысята содержались со своими матерями до возраста 30 дней, после чего их отсаживали и содержали в стандартных условиях. Всего в работе использовано 73 крысы из 18 пометов (31 в поведенческих и 42 в биохимических экспериментах). Количество крысят в пометах выравнивали (по 8–9 животных). Крысят-самок при необходимости оставляли в помете, но в работе не использовали. Крысят-самцов из каждого помета делили на 3 группы: животные двух групп получали внутрибрюшинные введения ЛПС в умеренно пирогенных дозах 25 или 50 мкг/кг в 15-й, 18-й и 21-й дни жизни, крысятам контрольной группы производили внутрибрюшинное введение эквивалентного объема апирогенного физиологического раствора в те же сроки. Выбранная доза ЛПС является умеренно пирогенной, поскольку вызывает повышение температуры тела на 0.6–1.9°С у большинства животных через 2–4 ч после введения, что было определено в предварительных экспериментах. ЛПС вводили троекратно с целью моделирования частых детских инфекций. Во время введений крысят разлучали с матерью не более чем на 15 с. Схема эксперимента представлена на рис. 1.
Рис. 1.
Схема эксперимента. Бактериальный ЛПС вводили крысам на 15-е, 18-е и 21-е сутки. Экспрессию генов провоспалительных цитокинов изучали в медиальной префронтальной коре (мПФК), дорзальном и вентральном гиппокампе (ДГ, ВГ) через 2 ч после последней инъекции. В возрасте 3–3.5 месяцев уровень исследовательского и тревожного поведения был оценен в Открытом поле и Приподнятом крестообразном лабиринте. Экспрессию генов субъединиц NMDA- и AMPA- рецепторов определяли в том же возрасте в mPFC, DH, и VH в отдельной группе животных. Fig. 1. Schematic outline of study. Rat pups received LPS injections on P15, P18 and P21. Expression of pro-inflammatory genes in the medial prefrontal cortex (mPFC), dorsal and ventral hippocampus (DH, VH) was studied 2 h post-injection. At the age of 3–3.5 m.o., the levels of exploratory and anxiety-like behaviors were assessed in the Open field and Elevated plus maze. Gene expression levels of NMDA- and AMPA- receptor subunits in the mPFC, DH, and VH were analyzed at the same age in a separate cohort of animals.

Для характеристики использованной экспериментальной модели, в частности, для доказательства способности использованных доз ЛПС запускать воспалительные процессы в мозге, часть экспериментальных и контрольных животных декапитировали через 2 ч после последней инъекции с последующим анализом экспрессии в клетках мозга генов провоспалительных цитокинов: ИЛ-1β, ИЛ-6, ФНО.
Изучение отдаленного влияния введений ЛПС в течение 3-й недели жизни на экспрессию генов субъединиц NMDA- и AMPA-рецепторов и глутамат-зависимые формы поведения проводили на отдельных группах экспериментальных и контрольных животных в возрасте 3–3.5 месяцев.
Открытое поле
Оценку ориентировочно-исследовательского поведения, локомоторной активности и уровня тревожности крыс проводили в тесте Открытое поле, представляющем собой круглую арену диаметром 100 см с бортами высотой 40 см и двойным дном, в котором имеется 16 отверстий диаметром 3.5 см и глубиной 1 см – “норок”. Тестирование проводилось однократно в течение 3 мин. Эксперимент проводили в промежуток времени с 18 до 22 ч при освещенности поля 25 лк. Арену после каждой крысы протирали 0.6%-ным раствором перекиси водорода для удаления запахов, затем водой для удаления перекиси, после чего вытирали насухо. О поведении животных судили по длительности проявления поведенческих паттернов исследовательского поведения (стойки с упором, исследование норок), тревожности (вертикальные стойки без упора, груминг), локомоторной активности (локомоция, движения на месте).
Приподнятый крестообразный лабиринт
Оценку тревожности и исследовательского поведения животных проводили также в Приподнятом крестообразном лабиринте, который состоял из двух открытых и двух закрытых, расположенных перпендикулярно друг другу рукавов длиной по 50 см, шириной 10 см. Высота стенок двух закрытых рукавов составляла 40 см, высота установки от пола – 60 см. Тестирование проводилось однократно в течение 5 мин при освещенности открытых рукавов 25 лк через 5 мин после тестирования в Открытом поле. О тревожности крыс судили по суммарному времени, проведенному в открытых рукавах, об исследовательской активности – по суммарной длительности выглядываний из закрытых рукавов.
Подсчет длительности поведенческих актов в обоих тестах производили в режиме реального времени с использованием этологической программы Field 4, разработанной в Физиологическом отделе им. И.П. Павлова Института экспериментальной медицины.
Оценка уровня экспрессии генов
Об уровне экспрессии генов судили по содержанию мРНК гена интереса относительно количества мРНК референсного гена внутреннего хозяйства Gapdh. Животных в возрасте 3–3.5 месяцев декапитировали, извлекали мозг, немедленно его замораживали в жидком азоте и хранили при –70°С до проведения биохимических исследований.
Производили выделение тотальной РНК из изучаемых структур мозга, реакцию обратной транскрипции с последующей полимеразной цепной реакцией (ОТ-ПЦР) в режиме реального времени.
Выделение РНК
Извлечение медиальной префронтальной области коры (мПФК) и дорзальной и вентральной областей гиппокампа (ДГ, ВГ) из замороженного мозга осуществляли на срезах, производимых с помощью микротома-криостата Thermo Scientific MICRO-M HM 525 при –20°С, согласно схеме, основанной на “Атласе мозга крысы в стереотаксических координатах” [39] – соответственно, ростральная и каудальная границы выделения относительно брегмы для мПФК: от 4.20 до 2.52 мм; для ДГ: от –2.64 до –5.28 мм; для ВГ: от –4.56 до –5.28 мм.
Выделение тотальной РНК из структур мозга проводили методом одношаговой кислой гуанидин-изотиоцианат-фенол-хлороформной экстракции согласно протоколу, прилагаемому к TRI-реагенту. Немедленно после извлечения структуры мозга помещали в тризол (TRI Reagent®; Molecular Research Center, Inc., США) и гомогенизировали. Затем к полученному раствору добавляли хлороформ. Через 10 мин после интенсивного минутного перемешивания раствор центрифугировали при 12 000 g в течение получаса, а полученную в результате центрифугирования верхнюю водную фазу, содержащую РНК, отбирали в отдельную пробирку и оставляли на 12–15 ч с эквивалентным объемом изопропилового спирта при +4°С. Затем данный раствор центрифугировали при 12 000 g в течение 15 мин, а полученный осадок РНК помещали в 70%-ный раствор этанола для хранения при –20°С до проведения реакции обратной транскрипции – получения кодирующей ДНК (кДНК) на матрице РНК.
ОТ-ПЦР
Высушенные осадки РНК растворяли в обработанной диэтилпирокарбонатом деионизированной воде. Концентрацию РНК измеряли с помощью спектрофотометра Nano Drop 2000 (Thermo Fisher Scientific, Inc., США) по оптической плотности на длине волны 260 нм. Для проведения обратной транскрипции брали 1 мкг РНК каждого образца. Отжиг oligo-dT праймеров на РНК производили при +70°С в течение 5 мин. После краткого охлаждения и центрифугирования в пробы добавляли реакционную смесь, содержащую буфер для обратной транскриптазы, нуклеотиды, ингибитор РНКаз, обратную транскриптазу M-MLV в количествах согласно протоколу, прилагаемому к обратной транскриптазе M-MLV (Promega, Fitchburg, США). Пробы помещали на 70 мин в амплификатор C1000 Touch™ Thermal Cycler (Bio-Rad Laboratories, США) для проведения реакции синтеза кДНК на матрице РНК при температуре +42°С. После остановки реакции в течение 10 мин при +65°С полученные пробы кДНК хранили при –20°С до проведения полимеразной цепной реакции в режиме реального времени.
Для проведения ПЦР по технологии TaqMan к 1 мкл кДНК образцов добавляли реакционную смесь, содержащую Taq-буфер, раствор MgCl2, нуклеотиды, прямой и обратный праймеры, зонд, Taq-полимеразу в количествах согласно протоколу, прилагаемому к TaqM-полимеразе (ООО Алкор-Био, Санкт-Петербург, Россия). Амплификацию проводили в термоциклере C1000 Touch™ ThermalCycler с оптико-реакционным модулем CFX96 Touch™ Real-Time PCR Detection System (Bio-Rad Laboratories, США) по следующей программе: “горячий старт” – +95°С, 300 с; денатурация – +95°С, 5 с, отжиг праймеров и элонгация с регистрацией флуоресценции – +60°С, 10 с (50 циклов). Анализ каждой пробы проводили в двух параллелях. Использовали отрицательный контроль без добавления матрицы, а также отрицательный контроль обратной транскрипции (образцы РНК, к которым не добавляли ревертазу в реакционную смесь для ОТ). Нуклеотидные последовательности праймеров и зондов представлены в табл. 1.
Таблица 1.
Нуклеотидные последовательности праймеров и зондов Table 1. Nucleotide sequences of primers and probes used for qRT-PCR analysis
| Ген (GeneBank) кодируемый белок Gene (GeneBank) encoded protein |
Нуклеотидные последовательности (5' → 3'): прямой праймер, обратный праймер, зонд Nucleotide sequences (5' → 3'): forward primer, reverse primer, probe |
Ссылка Ref. |
|---|---|---|
| Gapdh (NM_017008) |
TGCACCACCAACTGCTTAG GGATGCAGGGATGATGTTC HEX-ATCACGCCACAGCTTTCCAGAGGG-BHQ-1 |
[40] |
| IL1beta (NM_031512) ИЛ-1β (Il-1β) |
CACCTCTCAAGCAGAGCACAG GGGTTCCATGGTGAAGTCAAC FAM-TGTCCCGACCATTGCTGTTTCCTAGG-BHQ-1 |
[41] |
| IL6 (NM_012589) ИЛ-6 (Il-6) |
CAAGACCATCCAACTCATCTTG CACAGTGAGGAATGTCCACAAAAC FAM-TCGGCAAACCTAGTGTGCTATGCCTAAGCA-BHQ-1 |
[41] |
| Tnf (NM_012675) ФНО (TNF) |
CCAGGTTCTCTTCAAGGGACAA CTCCTGGTATGAAATGGCAAATC FAM-CCCGACTATGTGCTCCTCACCCACA-BHQ-1 |
[41] |
| Grin1 (NM_012573) GluN1 |
GTTCTTCCGCTCAGGCTTTG AGGGAAACGTTCTGCTTCCA FAM-CGGCATGCGCAAGGACAGCC-BHQ-1 |
[42] |
| Grin2a (NM_012573) GluN2a |
GCTACACACCCTGCACCAATT CACCTGGTAACCTTCCTCAGTGA FAM-TGGTCAATGTGACTTGGGATGGCAA-BHQ-1 |
[43] |
| Grin2b (NM_012574) GluN2b |
CCCAACATGCTCTCTCCCTTAA CAGCTAGTCGGCTCTCTTGGTT FAM-AGACGCCAAACCTCTAGGCGGACAG-BHQ-1 |
[43] |
| Gria1 (NM_031608) GluA1 |
TCAGAACGCCTCAACGCC TGTAGTGGTACCCGATGCCA ROX-TCCTGGGCCAGATCGTGAAGCTAGAAAA-BHQ-2 |
[44] |
| Gria2 (NM_017261) GluA2 |
CAGTGCATTTCGGGTAGGGA TGCGAAACTGTTGGCTACCT FAM-TCGGAGTTCAGACTGACACCCCA-BHQ-1 |
[44] |
Анализ кривых амплификации производили в программе Bio-Rad CFX Manager™ 2.1 (Bio-Rad Laboratories, США) методом пороговой линии. Эффективность праймеров в мультиплексных ПЦР была проверена в отдельных экспериментах. Определение относительного количества мРНК в исследуемых образцах производили 2-ΔΔCt -методом относительно уровня мРНК гена домашнего хозяйства Gapdh [45] и усредненных значений контрольной группы.
Статистический анализ
Для статистической обработки данных использовали программы Microsoft Excel (Microsoft Corp., США), SPSS Statistics 20 (IBM Corp., США) и GraphPad Prism 8 (GraphPad Software, Inc., США). Нормальность распределения выборочных данных проверяли с применением критерия Колмогорова–Смирнова. Поскольку многие из исследованных показателей не имели нормального распределения, для сравнения групп использовали H-критерий Краскела–Уоллиса с апостериорным попарным сравнением критерием Данна. Различия считали достоверными при p < 0.05. На графиках представлены медианы и интерквартильный интервал.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Введение ЛПС в раннем возрасте повышает уровень экспрессии провоспалительных генов в гиппокампе
В результате проведенного исследования было выявлено повышение уровня экспрессии гена интерлейкина-1β IL1beta в дорзальной и вентральной областях гиппокампа крысят через 2 ч после заключительной инъекции ЛПС на 21-й день постнатального развития по сравнению с контрольными животными, получавшими физиологический раствор, при этом в дорзальном отделе гиппокампа статистически значимое повышение данного показателя также обнаружено при введении более низкой дозы ЛПС 25 мкг/кг (физ.р-р–ЛПС25 p = 0.03, физ.р-р–ЛПС50 p = 0.09, попарное сравнение критерием Данна; рис. 2(B)), а в вентральном – при введении более высокой дозы ЛПС 50 мкг/кг (физ.р-р–ЛПС25 p = 0.13, физ.р-р–ЛПС50 p < 0.01, попарное сравнение критерием Данна; (рис. 2C). В медиальной префронтальной коре данный показатель не изменяется при введении обеих доз ЛПС по сравнению с животными контрольной группы (p > 0.05, критерий Краскела–Уоллиса; рис. 2A).
Рис. 2.
Увеличение уровня экспрессии генов провоспалительных цитокинов в гиппокампе после введения ЛПС в раннем возрасте. Н – достоверные различия между группами по критерию Краскела–Уоллиса; * – p < 0.05, ** – p < 0.01 по сравнению с контрольной группой, апостериорный критерий Данна. n = 4–8. Данные представлены в виде медианы и интерквартильного интервала. Fig. 2. Neonatal LPS administration elevates gene expression of pro-inflammatory cytokines in the hippocampus. In the mPFC, early-life LPS treatment did not change mRNA levels of (A) IL1beta gene 2 h post treatment (p > 0.05), while its expression increased in (B) dorsal and (C) ventral areas of the hippocampus compared to vehicle-treated control. (D–F) Expression of IL6 mRNA did not differ between the groups in the studied brain areas. (G) Observable LPS-induced elevation of Tnf expression was not statistically significant (p = 0.50). TNF mRNA was elevated in the (H) dorsal, but not (I) ventral hippocampus (p > 0.05) of LPS-treated animals in comparison with control rats. Н – significant differences between groups by Kruskal — Wallis test; *p < 0.05, **p < 0.01 versus control, Dunn’s post hoc test. n = 4–8. Data presented as Median and Interquartile range.

Уровень экспрессии гена интерлейкина-6 IL6 достоверно не изменялся через 2 ч после введений ЛПС ни в мПФК, ни в областях гиппокампа (p > 0.05, критерий Краскела–Уоллиса; (рис. 2D–F).
Повышенный уровень экспрессии гена фактора некроза опухоли Tnf по сравнению с контрольной группой был выявлен в дорзальном гиппокампе животных через 2 ч после инъекции 50, но не 25 мкг/кг ЛПС (физ.р-р–ЛПС25 p = 0.51, физ.р-р–ЛПС50 p = 0.03, попарное сравнение критерием Данна; рис. 2(H)), при этом в ВГ количество мРНК данного гена не отличалось от контроля после введения обеих доз ЛПС (p > 0.05, критерий Краскела–Уоллиса; рис. 2(I)). В мПФК наблюдаемое увеличение продукции мРНК Tnf после введения ЛПС не достигало уровня статистической значимости (H = 5.7, p = 0.051, критерий Краскела–Уоллиса; (рис. 2G).
Введение ЛПС в раннем возрасте приводит к отдаленным нарушениям ориентировочно-исследовательского поведения
Тестирование животных в Открытом поле выявило снижение исследовательской активности взрослых животных, получавших ЛПС в течение 3-й недели, по сравнению с животными контрольной группы, которое выражалось в сниженной суммарной длительности стоек с упором (H = 6.10; p = 0.047; попарное сравнение критерием Данна –физ.р-р–ЛПС25, p = 0.04; (рис. 3A)). Такая же тенденция была по показателю общего числа стоек с упором, но различия не достигали статистической значимости (H = 5.75; p = 0.057). По другим показателям исследовательского поведения: общей длительности обследования норок в Открытом поле и времени выглядывания из закрытых рукавов Приподнятого крестообразного лабиринта – различий между группами не выявлено (соответственно, H = 2.9, p = 0.23 и H = 2.9, p = 0.24, критерий Краскела–Уоллиса; (рис. 3C, D)).
Рис. 3.
Отдаленные изменения ориентировочно-исследовательского поведения животных в результате введения ЛПС в раннем возрасте. Н – достоверные различия между группами по критерию Краскела–Уоллиса; * – p < 0.05, ** – p < 0.01 по сравнению с контрольной группой, апостериорный критерий Данна. n = 6–14. Данные представлены в виде медианы и интерквартильного интервала. Fig. 3. Adult animals treated with LPS during early postnatal period display aberrant exploratory and anxiety-like behaviors. Early-life LPS administration on P15, P18, P21 led to a (A) decreased total duration of climbing in the Open field (OF) compared to control, while no differences in (B) total number of climbing (OF), (C) duration of hole exploration (OF), (D) total duration of peeping out in the Elevated plus maze (EPM) were observed between the groups. (E) total duration of grooming (OF) increased in LPS-treated groups statistically insignificant, while (F) total time spent in the open arms of EPM increased after LPS 50 µg/kg compared with control. (G) While animals treated with 25 µg/kg LPS were less horizontally active in comparison with control rats, (H) no differences of total time of movement on place were observed. Н – significant differences between groups by Kruskal–Wallis test; *p < 0.05, **p < 0.01 versus control, Dunn’s post hoc test. n = 6–14. Data presented as Median and Interquartile range.
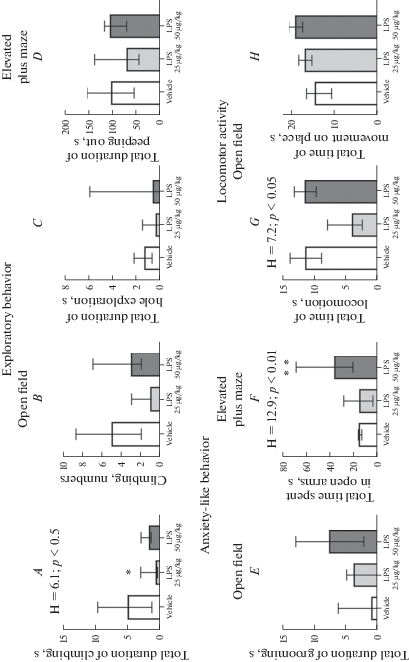
Тревожность взрослых животных, получавших в раннем периоде постнатального онтогенеза ЛПС, была ниже, чем у контрольных крыс, что выразилось в увеличении времени пребывания в открытых рукавах Приподнятого крестообразного лабиринта (H = 12.87; p = 0.002, физ.р-р–ЛПС50 p = 0.004, попарное сравнение критерием Данна; (рис. 3F). Увеличение времени груминга у животных, получавших ЛПС, не достигало уровня статистической значимости (H = 4.3, p = 0.12, критерий Краскела–Уоллиса; (рис. 3E)).
Длительность локомоторной активности была пониженной у крыс с введением 25 мкг/кг ЛПС (H = 7.20; p = 0.028; физ.р-р–ЛПС25, p = 0.051, попарное сравнение критерием Данна; (рис. 3G)). По показателю движения на месте животные трех групп достоверно не различались (H = 5.4, p = 0.07, критерий Краскела–Уоллиса; (рис. 3H)). Поскольку явных качественных нарушений двигательных функций у экспериментальных крыс не отмечалось, можно предположить, что снижение локомоции в новом пространстве было связано с пониженной исследовательской мотивацией.
Таким образом, введение ЛПС в течение третьей недели жизни, приводило к умеренным нарушениям исследовательского поведения и снижению уровня тревожности экспериментальных животных.
Введение ЛПС в раннем возрасте вызывает отдаленные изменения уровня экспрессии генов субъединиц NMDA-и AMPA-рецепторов в гиппокампе
В результате ПЦР-анализа количества мРНК генов субъединиц глутаматных NMDA-рецепторов Grin1, Grin2a, Grin2b, а также отношения Grin2a/Grin2b не было выявлено различий в мПФК и ДГ между контрольной группой и группами животных, получавших в раннем возрасте ЛПС в обеих дозах (критерий Краскела–Уоллиса, мПФК: Grin1 H = 2.6, p = 0.28; (рис. 4A); Grin2a H = 0.8, p = 0.68; (рис. 4D); Grin2b H = 0.7, p = 0.73; (рис. 4G); Grin2a/Grin2b H = 2.2, p = 0.34; (рис. 4J); ДГ: Grin1 H < 0.1, p = 0.96; (рис. 4B); Grin2a H = 2.3, p = 0.34; (рис. 4E); Grin2b H = 2.3, p = 0.34; (рис. 4H); Grin2a/Grin2b H = 3.2, p = 0.21; (рис. 4K)).
Рис. 4.
Изменения уровня экспрессии генов субъединиц NMDA-рецепторов в мозге взрослых крыс в результате введения ЛПС в раннем возрасте. Н – достоверные различия между группами по критерию Краскела–Уоллиса; ** – p < 0.01 по сравнению с контрольной группой, апостериорный критерий Данна. n = 5–9. Данные представлены в виде медианы и интерквартильного интервала. Fig. 4. Early postnatal LPS administration affects mRNA expression of genes encoding NMDA receptor subunits in the brain of adult rats. In the mPFC and DH of 3.5 m.o. animals, no effects of LPS injections on P15, P18, P21 compared to control were found regarding mRNA expression of NMDA receptor subunit genes (A, B) Grin1 (encodes GluN1 subunit), (D, E) Grin2a (encodes GluN2a subunit), (G, H) Grin2b (encodes GluN2b subunit), as well as (J, K) ratio of Grin2a/Grin2b mRNA expression (p > .05). mRNA expression levels of (C) Grin1 and (F) Grin2a in the VH also did not differ between LPS- and vehicle-treated groups (p > 0.05), whereas (I) Grin2b expression was upregulated and (L) Grin2a/Grin2b ratio decreased in the VH of adult rats that have been injected with 50 µg/kg LPS during early development. Н – significant differences between groups by Kruskal–Wallis test; *p < 0.05, **p < 0.01 versus control, Dunn’s post hoc test. n = 5–9. Data presented as Median and Interquartile range.

В вентральной области гиппокампа также не было выявлено различий между группами по уровню экспрессии генов GluN1- и GluN2a-субъединиц (критерий Краскела–Уоллиса, Grin1 H = 3.4, p = 0.18; (рис. 4C); Grin2a H = 1.2, p = 0.57; (рис. 4F)). При этом выявлено повышение уровня продукции мРНК GluN2b-субъединицы в ВГ взрослых животных, получавших в течение 3-й недели ЛПС в дозе 50 мкг/кг, по сравнению с контрольной группой (физ.р-р–ЛПС25 p = 0.64, физ.р-р–ЛПС50 p < 0.01, попарное сравнение критерием Данна; (рис. 4I)), а также снижение отношения количества мРНК генов Grin2a/Grin2b в вентральном гиппокампе таких животных в сравнении с контролем (физ.р-р–ЛПС25 p = 0.12, физ.р-р–ЛПС50 p < 0.01, попарное сравнение критерием Данна; (рис. 4L)).
Уровень экспрессии гена GluA1-субъединицы AMPA-рецепторов не различается у взрослых животных трех групп в мПФК (H = 3.2, p = 0.21, критерий Краскела–Уоллиса; (рис. 5A)) и повышен в дорзальной и вентральной областях гиппокампа, причем уровня статистической значимости описываемые различия достигают после введения ЛПС в дозе 25 мкг/кг для дорзальной области (физ.р-р–ЛПС25 p < 0.01, физ.р-р–ЛПС50 p = 0.08, попарное сравнение критерием Данна; (рис. 5B)) и 50 мкг/кг – для вентральной (физ.р-р–ЛПС25 p = 0.83, физ.р-р–ЛПС50 p < 0.01, попарное сравнение критерием Данна; (рис. 5C)).
Рис. 5.
Изменения уровня экспрессии генов субъединиц AMPA-рецепторов в мозге взрослых крыс в результате введения ЛПС в раннем возрасте. Н – достоверные различия между группами по критерию Краскела–Уоллиса; * – p < 0.05, ** – p < 0.01 по сравнению с контрольной группой, апостериорный критерий Данна. n = 5–8. Данные представлены в виде медианы и интерквартильного интервала. Fig. 5. mRNA expression of genes encoding AMPA receptor subunits in the brain of adult rats is violated by early postnatal LPS administration. Expression of genes (A) Gria1 (encodes GluA1 subunit) and (D) Gria2 (encodes GluA2 subunit) in the mPFC of LPS- and vehicle-treated animals was found to be equal among the groups (p > 0.05). In the DH of adult rats, (B) expression of Gria1 is upregulated by neonatal LPS 25 µg/kg injections compared to control, while (E) Gria2 mRNA expression was not changed (p > 0.05). Administration of 50 µg/kg LPS on P15, P18, P21 led to increased mRNA levels of (C) Gria1 and (F) Gria2 genes in the VH of adult animals. Н – significant differences between groups by Kruskal — Wallis test; *p < 0.05, **p < 0.01 versus control, Dunn’s post hoc test. n = 5–8. Data presented as Median and Interquartile range.
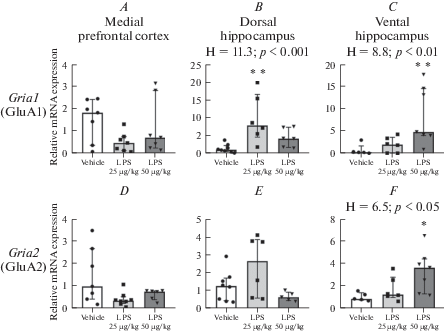
В вентральной области гиппокампа также выявлено более высокое содержание мРНК GluA2-субъединицы AMPA-рецептора после введений ЛПС в дозе 50 мкг/кг в сравнении с контрольными животными (физ.р-р–ЛПС25 p = 0.80, физ.р-р–ЛПС50 p = 0.03, попарное сравнение критерием Данна; (рис. 5F)). Различий по уровню экспрессии гена Gria2 в мПФК и ДГ взрослых животных трех групп не выявлено (соответственно H = 4.8, p = 0.09; H = 4.2, p = 0.12, критерий Краскела–Уоллиса; (рис. 5D, E)).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенное исследование выявило отсроченные нарушения исследовательского поведения, снижение уровня тревожности и изменение экспрессии генов субъединиц ионотропных глутаматных рецепторов в гиппокампе крыс после введения в раннем постнатальном периоде бактериального ЛПС в дозах, индуцирующих развитие воспалительных реакций (повышенный синтез провоспалительных цитокинов) в мозге.
Наиболее близким аналогом нашей работы являются исследования Е.-М. Harré с соавт. [46], исследовавшими особенности экспрессии генов субъединиц NMDA- рецепторов у крыс, которым однократно вводили бактериальный ЛПС в различные периоды раннего постнатального онтогенеза. Отличия проведенного нами исследования заключались в том, что кроме субъединиц NMDA-рецепторов были исследованы изменения экспрессии генов субъединиц AMPA-рецепторов, ЛПС вводили курсом, а для однократных введений были использованы более низкие дозы ЛПС (25 и 50 мкг/кг против 100 мкг/кг, использованных Е.-М. Harré с соавт.). Кроме того, в нашей работе был проведен дифференциальный анализ изменений, происходящих в вентральной и дорзальной областях гиппокампа. Последнее было важно в связи с появлением в последние годы исследований, доказывающих различную функциональную роль вентральной и дорзальной областей гиппокампа [47–49].
Проведенные нами исследования показали, что курсовое введение ЛПС в течение 3-й недели жизни усиливает экспрессию гена GluN2b-субъединицы NMDA-рецептора, а также приводит к уменьшению соотношения мРНК GluN2a/2b в вентральном, но не дорзальном гиппокампе и не в медиальной префронтальной коре. Этот результат согласуется с данными, полученными Е.-М. Harré с соавт., выявившими увеличение продукции мРНК GluN2b в клетках гиппокампа крыс после введения им ЛПС на 14-е сутки жизни [46]. В отличие от названных авторов мы не выявили усиления экспрессии гена GluN2b-субъединицы во фронтальной коре и не обнаружили усиления экспрессии гена GluN2a-субъединицы в гиппокампе, что может быть связано с более низкой дозой ЛПС, использованной в наших экспериментах.
Экспрессия генов субъединиц AMPA-рецепторов глутамата в работе Е.-М. Harré с соавт. не изучалась, однако она была исследована М.А. Galic с соавт. в другой экспериментальной модели – после интрацеребровентрикулярного введения на 14-й день жизни PolyI:C (синтетическая молекула, введение которой моделирует вирусную инфекцию). Во взрослом возрасте у данных экспериментальных крыс отмечалось усиление экспрессии гена GluA1-субъединицы в гиппокампе [50], что соответствует результатам, полученным нами на модели с введением бактериального ЛПС. Кроме того, мы выявили усиление продукции мРНК GluA2-субъединицы в вентральном гиппокампе, что не отмечалось в модели с введением PolyI:C [50].
Обращает на себя внимание, что наиболее выраженные изменения экспрессии генов как провоспалительных цитокинов, так и субъединиц ионотропных рецепторов глутамата выявлены нами в гиппокампе, но не в медиальной префронтальной коре. Большая чувствительность нейронов гиппокампа по сравнению с нейронами медиальной префронтальной коры к системному введению ЛПС была продемонстрирована в электрофизиологических исследованиях [51]. Было показано, что системное введение ЛПС приводит к появлению спайк-волновых разрядов в гиппокампе, но не в коре. Некоторые авторы предполагают селективную повышенную чувствительность гиппокампа к действию провоспалительных агентов [47]. Возможно, это связано с высокой плотностью в клетках гиппокампа рецепторов провоспалительного цитокина интерлейкина-1 [52], опосредующего центральные эффекты ЛПС.
В нашем исследовании у взрослых крыс, которым вводили ЛПС в течение 3-й недели жизни, более выраженные изменения экспрессии генов субъединиц NMDA- и AMPA-рецепторов обнаружены в вентральном (по сравнению с дорзальным) гиппокампе. Поскольку вентральный гиппокамп играет важную роль в регуляции эмоционального поведения, в частности, уровня тревожности [47], в связи с полученными результатами представлялось актуальным оценить влияние неонатальных введений ЛПС на тревожное поведение взрослых животных.
Было показано, что курсовое введение ЛПС в течение 3-й недели жизни приводит к незначительному снижению исследовательского поведения в Открытом поле и уменьшению уровня тревожности в Приподнятом крестообразном лабиринте.
Влияние неонатальных инъекций ЛПС на данные формы поведения ранее были оценены в ряде работ. Большинство исследователей осуществляли инъекции ЛПС в первые дни жизни экспериментальных животных. Повышение тревожности, в том числе в Приподнятом крестообразном лабиринте, было показано у крыс-подростков, получавших инъекции ЛПС в дозе 50 мкг/кг на 5-е и 7-е сутки жизни [53]. Также высокий уровень тревожности выявлен у взрослых крыс, которым вводили 25 мкг/кг ЛПС в первый день жизни [54] либо 50 мкг/кг на 3-й и 5-й день жизни [55]. Однако другие авторы в тех же моделях (введение 50 мкг/кг ЛПС на 3-е и 5-е сутки жизни) отмечают пониженную тревожность у подростков [56] и взрослых животных [57].
Работ, в которых ЛПС вводился бы в течение 3-й недели жизни, значительно меньше. V.M. Doenni с соавт. было показано, что инъекции ЛПС в дозе 100 мкг/кг на 14-й день жизни приводят к нарушению угасания страха в ответ на условный стимул у взрослых обученных животных, при этом поведение в Приподнятом крестообразном лабиринте не нарушается [58]. S.J. Spencer с соавт. в аналогичной экспериментальной парадигме не обнаружили изменения уровня тревожности, хотя показали нарушение исследовательского поведения [59]. Возможно, влияние неонатальных инъекций ЛПС на уровень тревожности зависит от дозы эндотоксина и сроков его введения.
Снижение уровня тревожности, выявленное нами, может быть связано с обнаруженными изменениями экспрессии генов NMDA-рецепторов в вентральном гиппокампе. Вовлеченность данных рецепторов в регуляцию тревожного поведения ранее была показана в нескольких фармакологических исследованиях. Так, было выявлено, что введение самого N-метил-D-аспартата в вентральный гиппокамп увеличивало время пребывания в открытых рукавах Приподнятого крестообразного лабиринта, что свидетельствует о снижении тревожности [60]. Кроме того, инъекции в ту же зону мозга антагониста NMDA-рецепторов D-AP5 отменяло анксиолитические эффекты морфина [61].
В целом, проведенное нами исследование показало, что введение бактериального ЛПС в период активного формирования NMDA- и AMPA-глутаматных рецепторов, приводит к отставленным во времени изменениям экспрессии генов субъединиц этих рецепторов и связанных с ними форм поведения.
Список литературы
Bandelow B., Michaelis S. Epidemiology of anxiety disorders in the 21st century. Dialogues Clin. Neurosci. 17(3): 327–335. 2015.
Remes O., Brayne C., van der Linde R., Lafortune L. A systematic review of reviews on the prevalence of anxiety disorders in adult populations. Brain Behav. 6(7): e00497. 2016.
Maccari S., Krugers H.J., Morley-Fletcher S., Szyf M., Brunton P.J. The consequences of early-life adversity: neurobiological, behavioural and epigenetic adaptations. J. Neuroendocrinol. 26(10): 707–723. 2014.
Goodwin R.D. Association between infection early in life and mental disorders among youth in the community: a cross-sectional study. BMC Public Health. 11: 878. 2011.
Buchanan M.M., Hutchinson M., Watkins L.R., Yin H. Toll-like receptor 4 in CNS pathologies. J. Neurochem. 114(1): 13–27. 2010.
Dantzer R. Cytokine, sickness behavior, and depression. Immunol. Allergy Clin. North Am. 29(2): 247–264. 2009.
Ling Z., Zhu Y., Tong C.W., Snyder J.A., Lipton J.W., Carvey P.M. Prenatal lipopolysaccharide does not accelerate progressive dopamine neuron loss in the rat as a result of normal aging. Exp. Neurol. 216(2): 312–320. 2009.
Majidi J., Kosari-Nasab M., Salari A.-A. Developmental minocycline treatment reverses the effects of neonatal immune activation on anxiety- and depression-like behaviors, hippocampal inflammation, and HPA axis activity in adult mice. Brain Res. Bull. 120: 1–13. 2016.
Majidi-Zolbanin J., Azarfarin M., Samadi H., Enayati M., Salari A.-A. Adolescent fluoxetine treatment decreases the effects of neonatal immune activation on anxiety-like behavior in mice. Behav. Brain Res. 250: 123–132. 2013.
Dinel A.-L., Joffre C., Trifilieff P., Aubert A., Foury A., Le Ruyet P., Layé S. Inflammation early in life is a vulnerability factor for emotional behavior at adolescence and for lipopolysaccharide-induced spatial memory and neurogenesis alteration at adulthood. J. Neuroinflammation. 11: 155. 2014.
Doosti M.-H., Bakhtiari A., Zare P., Amani M., Majidi-Zolbanin N., Babri S., Salari A.-A. Impacts of early intervention with fluoxetine following early neonatal immune activation on depression-like behaviors and body weight in mice. Prog. Neuropsychopharmacol. Biol. Psychiatry. 43: 55–65. 2013.
Tishkina A., Stepanichev M., Kudryashova I., Freiman S., Onufriev M., Lazareva N., Gulyaeva N. Neonatal proinflammatory challenge in male Wistar rats: Effects on behavior, synaptic plasticity, and adrenocortical stress response. Behav. Brain Res. 304: 1–10. 2016.
Sun H., Jia N., Guan L., Su Q., Wang D., Li H., Zhu Z. Involvement of NR1, NR2A different expression in brain regions in anxiety-like behavior of prenatally stressed offspring. Behav. Brain Res. 257: 1–7. 2013.
Sweatt J.D. Neural plasticity and behavior – sixty years of conceptual advances. J. Neurochem. 139 Suppl: 179–199. 2016.
Diering G.H., Huganir R.L. The AMPA Receptor Code of Synaptic Plasticity. Neuron. 100(2): 314–329. 2018.
Lisman J. Glutamatergic synapses are structurally and biochemically complex because of multiple plasticity processes: long-term potentiation, long-term depression, short-term potentiation and scaling. Philos. Trans. R Soc. Lond. B Biol. Sci. 372(1715). 2017.
Sarantis K., Antoniou K., Matsokis N., Angelatou F. Exposure to novel environment is characterized by an interaction of D1/NMDA receptors underlined by phosphorylation of the NMDA and AMPA receptor subunits and activation of ERK1/2 signaling, leading to epigenetic changes and gene expression in rat hippoca. Neurochem. Int. 60(1): 55–67. 2012.
Du J., Quiroz J., Yuan P., Zarate C., Manji H.K. Bipolar disorder: involvement of signaling cascades and AMPA receptor trafficking at synapses. Neuron Glia Biol. 1(3): 231–243. 2004.
Du J., Creson T. K., Wu L.-J., Ren M., Gray N.A., Falke C., Wei Y., Wang Y., Blumenthal R., Machado-Vieira R., Yuan P., Chen G., Zhuo M., Manji H.K. The role of hippocampal GluR1 and GluR2 receptors in manic-like behavior. J. Neurosci. 28(1): 68–79. 2008.
Machado-Vieira R., Henter I.D., Zarate C.A. New targets for rapid antidepressant action. Prog. Neurobiol. 152: 21–37. 2017.
Barkus C., McHugh S.B., Sprengel R., Seeburg P.H., Rawlins J.N.P., Bannerman D.M. Hippocampal NMDA receptors and anxiety: at the interface between cognition and emotion. Eur. J. Pharmacol. 626(1): 49–56. 2010.
Solati J. Dorsal hippocampal N-methyl-D-aspartate glutamatergic and δ-opioidergic systems modulate anxiety behaviors in rats in a noninteractive manner. Kaohsiung J. Med. Sci. 27(11): 485–493. 2011.
Gielen M., Siegler Retchless B., Mony L., Johnson J.W., Paoletti P. Mechanism of differential control of NMDA receptor activity by NR2 subunits. Nature. 459(7247): 703–707. 2009.
Hansen K.B., Yi F., Perszyk R.E., Furukawa H., Wollmuth L.P., Gibb A.J., Traynelis S.F. Structure, function, and allosteric modulation of NMDA receptors. J. Gen. Physiol. 150(8): 1081–1105. 2018.
Henley J.M., Wilkinson K.A. Synaptic AMPA receptor composition in development, plasticity and disease. Nat. Rev. Neurosci. 17(6): 337–350. 2016.
Greger I.H., Esteban J.A. AMPA receptor biogenesis and trafficking. Curr. Opin. Neurobiol. 17(3): 289–297. 2007.
Liu S., Lau L., Wei J., Zhu D., Zou S., Sun H.-S., Fu Y., Liu F., Lu Y. Expression of Ca(2+)-permeable AMPA receptor channels primes cell death in transient forebrain ischemia. Neuron. 43(1): 43–55. 2004.
Wenzel A., Fritschy J. M., Mohler H., Benke D. NMDA receptor heterogeneity during postnatal development of the rat brain: differential expression of the NR2A, NR2B, and NR2C subunit proteins. J. Neurochem. 68(2): 469–478. 1997.
Babb T. L., Mikuni N., Najm I., Wylie C., Olive M., Dollar C., MacLennan H. Pre- and postnatal expressions of NMDA receptors 1 and 2B subunit proteins in the normal rat cortex. Epilepsy Res. 64(1–2): 23–30. 2005.
du Bois T.M., Huang X.-F. Early brain development disruption from NMDA receptor hypofunction: relevance to schizophrenia. Brain Res. Rev. 53(2): 260–270. 2007.
Lippman-Bell J.J., Zhou C., Sun H., Feske J.S., Jensen F.E. Early-life seizures alter synaptic calcium-permeable AMPA receptor function and plasticity. Mol. Cell Neurosci. 76:11–20. 2016.
Yuan T., Bellone C. Glutamatergic receptors at developing synapses: the role of GluN3A-containing NMDA receptors and GluA2-lacking AMPA receptors. Eur. J. Pharmacol. 719(1–3): 107–111. 2013.
Szczurowska E., Mareš P. NMDA and AMPA receptors: development and status epilepticus. Physiol. Res. 62. Suppl 1: S21–S38. 2013.
Monyer H., Burnashev N., Laurie D.J., Sakmann B., Seeburg P.H. Developmental and regional expression in the rat brain and functional properties of four NMDA receptors. Neuron. 12(3): 529–540. 1994.
Guilarte T.R., McGlothan J.L. Hippocampal NMDA receptor mRNA undergoes subunit specific changes during developmental lead exposure. Brain Res. 790(1–2): 98–107. 1998.
Farhy-Tselnicker I., Allen N.J. Astrocytes, neurons, synapses: a tripartite view on cortical circuit development. Neural. Dev. 13(1): 7. 2018.
Kumar S.S., Bacci A., Kharazia V., Huguenard J.R. A developmental switch of AMPA receptor subunits in neocortical pyramidal neurons. J. Neurosci. 22(8): 3005–3015. 2002.
Blanco-Suarez E., Liu T.-F., Kopelevich A., Allen N.J. Astrocyte-Secreted Chordin-like 1 Drives Synapse Maturation and Limits Plasticity by Increasing Synaptic GluA2 AMPA Receptors. Neuron. 100(5): 1116–1132.e13. 2018.
Paxinos G., Watson C. The Rat Brain in Stereotaxic Coordinates, 6th Edition. Acad. Press. 2007.
Lin W., Burks C.A., Hansen D.R., Kinnamon S.C., Gilbertson T.A. Taste receptor cells express pH-sensitive leak K+ channels. J. Neurophysiol. 92(5): 2909–2919. 2004.
Rioja I., Bush K.A., Buckton J.B., Dickson M.C., Life P.F. Joint cytokine quantification in two rodent arthritis models: kinetics of expression, correlation of mRNA and protein levels and response to prednisolone treatment. Clin. Exp. Immunol. 137(1): 65–73. 2004.
Giza C.C., Maria N.S.S., Hovda D.A. N-methyl-D-aspartate receptor subunit changes after traumatic injury to the developing brain. J. Neurotrauma. 23(6): 950–961. 2006.
Floyd D.W., Jung K.-Y., McCool B.A. Chronic ethanol ingestion facilitates N-methyl-D-aspartate receptor function and expression in rat lateral/basolateral amygdala neurons. J. Pharmacol. Exp. Ther. 307(3): 1020–1029. 2003.
Malkin S.L., Amakhin D.V., Veniaminova E.A., Kim K.K., Zubareva O.E., Magazanik L.G., Zaitsev A.V. Changes of AMPA receptor properties in the neocortex and hippocampus following pilocarpine-induced status epilepticus in rats. Neuroscience. 327: 146–155. 2016.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 25(4): 402–408. 2001.
Harré E.-M., Galic M.A., Mouihate A., Noorbakhsh F., Pittman Q.J. Neonatal inflammation produces selective behavioural deficits and alters N-methyl-D-aspartate receptor subunit mRNA in the adult rat brain. Eur. J. Neurosci. PMC Canada manuscript submission. 27(3): 644–653. 2008.
Gulyaeva N.V. Functional Neurochemistry of the Ventral and Dorsal Hippocampus: Stress, Depression, Dementia and Remote Hippocampal Damage. Neurochem. Res. 44(6): 1306–1322. 2019.
Fanselow M.S., Dong H.-W. Are the dorsal and ventral hippocampus functionally distinct structures? Neuron. Elsevier Inc. 65(1): 7–19. 2010.
Floriou-Servou A., von Ziegler L., Stalder L., Sturman O., Privitera M., Rassi A., Cremonesi A., Thöny B., Bohacek J. Distinct Proteomic, Transcriptomic, and Epigenetic Stress Responses in Dorsal and Ventral Hippocampus. Biol. Psychiatry. 84(7): 531–541. 2018.
Galic M.A., Riazi K., Henderson A.K., Tsutsui S., Pittman Q.J. Viral-like brain inflammation during development causes increased seizure susceptibility in adult rats. Neurobiol. Dis. 36(2): 343–351. 2009.
Mamad O., Islam M. N., Cunningham C., Tsanov M. Differential response of hippocampal and prefrontal oscillations to systemic LPS application. Brain Res. 1681: 64–74. 2018.
Farrar W.L., Kilian P.L., Ruff M.R., Hill J.M., Pert C.B. Visualization and characterization of interleukin 1 receptors in brain. J. Immunol. 139(2): 459–463. 1987.
Custódio C.S., Mello B.S.F., Filho A.J.M.C., de Carvalho Lima C.N., Cordeiro R.C., Miyajima F., Réus G.Z., Vasconcelos S.M.M., Barichello T., Quevedo J., de Oliveira A.C., de Lucena D.F., Macedo D.S. Neonatal Immune Challenge with Lipopolysaccharide Triggers Long-lasting Sex- and Age-related Behavioral and Immune/Neurotrophic Alterations in Mice: Relevance to Autism Spectrum Disorders. Mol. Neurobiol. 55(5): 3775–3788. 2018.
Benmhammed H., El Hayek S., Nassiri A., Bousalham R., Mesfioui A., Ouichou A., El Hessni A. Effects of lipopolysaccharide administration and maternal deprivation on anxiety and depressive symptoms in male and female Wistar rats: Neurobehavioral and biochemical assessments. Behav. Brain Res. 362: 46–55. 2019.
Sominsky L., Fuller E.A., Bondarenko E., Ong L.K., Averell L., Nalivaiko E., Dunkley P.R., Dickson P.W., Hodgson D.M. Functional programming of the autonomic nervous system by early life immune exposure: implications for anxiety. PLoS One. 8(3): e57700. 2013.
Rico J.L.R., Ferraz D.B., Ramalho-Pinto F.J., Morato S. Neonatal exposure to LPS leads to heightened exploratory activity in adolescent rats. Behav. Brain Res. 215(1): 102–109. 2010.
Claypoole L.D., Zimmerberg B., Williamson L.L. Neonatal lipopolysaccharide treatment alters hippocampal neuroinflammation, microglia morphology and anxiety-like behavior in rats selectively bred for an infantile trait. Brain Behav. Immun. 59: 135–146. 2017.
Doenni V.M., Song C.M., Hill M.N., Pittman Q.J. Early-life inflammation with LPS delays fear extinction in adult rodents. Brain Behav. Immun. 63: 176–185. 2017.
Spencer S.J., Heida J.G., Pittman Q.J. Early life immune challenge–effects on behavioural indices of adult rat fear and anxiety. Behav. Brain Res. 164(2): 231–238. 2005.
Bina P., Rezvanfard M., Ahmadi S., Zarrindast M.R. Anxiolytic-Like Effects and Increase in Locomotor Activity Induced by Infusions of NMDA into the Ventral Hippocampus in Rat: Interaction with GABAergic System. Basic Clin. Neurosci. 5(4): 267–276. 2014.
Motevasseli T., Rezayof A., Zarrindast M.-R., Nayer-Nouri T. Role of ventral hippocampal NMDA receptors in anxiolytic-like effect of morphine. Physiol. Behav. 101(5): 608–613. 2010.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


