Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 3, стр. 294-300
Насосная функция желудочка сердца у радужной форели Oncorhynchus mykiss при предсердной электрической стимуляции в условиях низкой температуры
Н. А. Киблер 1, *, В. П. Нужный 1, С. Н. Харин 1, Д. Н. Шмаков 1
1 Институт физиологии Коми научного центра Уральского отделения РАН
Сыктывкар, Россия
* E-mail: natanadya@mail.ru
Поступила в редакцию 03.12.2019
После доработки 14.01.2020
Принята к публикации 14.01.2020
Аннотация
Исследована насосная функция желудочка сердца у акклиматизированной к температуре 5–7°С радужной форели Oncorhynchus mykiss при увеличении частоты сердечных сокращений. Динамику внутриполостного давления желудочка регистрировали путем трансмуральной катетеризации. Частоту сердечных сокращений изменяли посредством электрокардиостимуляции. Увеличение частоты сердечных сокращений у радужной форели от исходного ритма до 60 уд/мин привело к уменьшению максимального систолического давления в желудочке сердца, увеличению диастолического и конечно-диастолического давления, к снижению максимальных скоростей прироста и падению давления. Увеличение частоты стимуляции предсердия до 60 уд/мин вызывало значительное снижение сократимости миокарда и ухудшение насосной функции желудочка сердца. Частота сердечных сокращений 60 уд/мин оказалась верхней границей нормальной функциональной деятельности желудочка сердца у радужной форели, адаптированной к температуре среды обитания 5–7°С.
В связи с гипотезой о глобальном потеплении большое внимание уделяется адаптации сердечно-сосудистой системы рыб к условиям окружающей среды, адаптация этой системы реализуется в первую очередь за счет увеличения частоты сердечных сокращений (ЧСС) и изменения сердечного выброса [1]. Частота сердечного ритма является одним из факторов, ограничивающих адаптацию к изменившимся потребностям организма к повышению температуры [2–4]. Во всем диапазоне от низких до высоких ЧСС у большинства видов млекопитающих происходит увеличение силы сокращения, т.е. наблюдается положительная корреляция между частотой и силой сокращений [5]. Вместе с тем, эти соотношения зависят от видов животных, так, в миокарде желудочков хомяка отрицательная корреляция последовательно наблюдается во всем диапазоне частот стимуляции, а у крысы и мыши – в низкочастотном диапазоне. На частотах, близких к физиологической частоте сердцебиений корреляция между частотой и силой сокращений с отрицательной изменяется на положительную [5]. В опытах in vitro на отдельных трабекулах показано [6–8], что у большинства видов рыб сила сокращения миокарда уменьшается с увеличением частоты сокращения, что приводит к отрицательному отношению частота – сила. Установлено, что в отличие от млекопитающих основная роль в активации сокращения миокарда желудочка рыб принадлежит потоку внеклеточного Ca2+ через сарколемму, а не внутриклеточному Ca2+ саркоплазматического ретикулума [6–8].
Анализ работ [2–4] по изучению влияния ЧСС на сократимость миокарда у рыб показал, что исследования выполнены в основном при температуре водной среды в диапазоне от оптимальной до верхней температурной границы среды обитания рыб (15°С и выше). Так, на перфузируемых сердцах радужной форели установлено [9], что ударный объем желудочка достигает своего максимума при оптимальной для нее температуре среды 15°С, а при повышении температуры до 20°С наряду с увеличением ЧСС происходит его снижение. При исследовании механических и электрофизиологических свойств полосок миокарда желудочков у акклиматизированной к 10°C радужной форели не выявлено существенного влияния частоты стимуляции на сократимость миокарда при 4, 10 и 18°C [10]. Следует заметить, что перенос результатов, полученных на трабекулах миокарда и перфузируемых сердцах, на организм in vivo требует особой осторожности, так как в данных исследованиях используются физиологические растворы, отсутствует нервная и гуморальная регуляция сердечной деятельности и др. Поскольку частота сердечного ритма является одним из лимитирующих факторов адаптации организма рыб к условиям обитания, остается открытым вопрос о том, как влияет ЧСС на сократимость желудочка у рыб in vivo при низкой температуре окружающей среды.
Цель работы – исследование влияния увеличения ЧСС на сократительную функцию желудочка сердца радужной форели Oncorhynchus mykiss в условиях низкой температуры среды обитания in vivo.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено в соответствии с международными правилами обращения с экспериментальными животными (Guide for the Care and Use of Laboratory Animals – публикация the US National Institutes of Health (NIH Publication No. 85-23, ред. 1996) и одобрено локальным этическим комитетом Института физиологии Коми НЦ УрО РАН.
Эксперименты проведены на 15 радужных форелях Oncorhynchus mykiss обоего пола массой тела 1.1 ± 0.2 кг (масса сердца – 2.1 ± 0.8 г; масса желудочка – 1.9 ± 0.8 г), адаптированных в садках прудового хозяйства к естественной температуре воды 5–7°С. Животных фиксировали в дорсальном положении тела в лотке, наполненном речной водой при температуре 5–7°С. В ротовую полость вставляли резиновый шланг, по которому для обеспечения искусственного дыхания через жабры под небольшим давлением непрерывно пропускали речную воду из пруда через аэратор, также при температуре 5–7°С. Продольным разрезом вскрывали грудную полость и перикард, затем обнажали сердце. ЧСС изменяли посредством электрокардиостимуляции при помощи диагностического электрокардиостимулятора ЧЭЭКС п-3 “Вектор-МС”. На предсердие подавали электрические импульсы длительностью 2 мс и амплитудой 2–4 V с интервалами 10 уд/мин.
Динамику внутриполостного давления желудочка регистрировали путем трансмуральной катетеризации на установке Prucka Mac-Lab 2000, для этого заполненный гепаринизированным физиологическим раствором однопросветный катетер (внутренний диаметр 1 мм) вводили через стенку желудочка в полость сердца. Измеряли гемодинамические показатели: систолическое, диастолическое и конечно-диастолическое внутрижелудочковое давление, параметры изоволюмического сокращения (показатель сократимости) dP/dtmax и изоволюмического расслабления dP/dtmin. Для контроля электрофизиологического состояния сердца при измерении давления синхронно регистрировали ЭКГ в отведениях от конечностей (плавников). Температуру тела экспериментальных животных в процессе исследования поддерживали в пределах 5–7°С.
Статистическую обработку полученных результатов проводили с помощью программы BIOSTAT 4.03. с использованием критерия Уилкоксона и Манна–Уитни. Различия признавались достоверными при уровне значимости p < 0.05. Данные представлены как среднее ± стандартное отклонение (М ± σ).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При синусовом ритме при температуре 5–7°C ЧСС находилась в пределах от 18 до 27 (21.6 ± 4.9) уд/мин. При спонтанном синусовом ритме 21.6 ± 4.9 уд/мин в условиях низких температур (5–7°C) максимальное систолическое давление желудочка составляло 35.2 ± 10.2 мм рт. ст.; диастолическое давление желудочка – 0.8 ± 0.7 мм рт. ст.; конечно-диастолическое давление желудочка – 2.1 ± 1.0 мм рт. ст.; максимальная скорость прироста давления (изоволюмический индекс сократимости) dP/dtmax – 161.2 ± ± 98.9 мм рт. ст./с; максимальная скорость падения давления (изоволюмический индекс расслабления) dP/dtmin – 151.0 ± 103.1 мм рт. ст./с (рис. 1).
Рис. 1.
Гемодинамические показатели сердца радужной форели при увеличении ЧСС: А – максимальное систолическое давление желудочка (МСДЖ); B – конечно-диастолическое давление желудочка (КДДЖ); С – максимальная скорость прироста давления в желудочке (dP/dtmax); D – максимальная скорость падения давления в желудочке (dP/dtmin). sa – синусовый ритм; ap – предсердная стимуляция. * p < 0.05 – по отношению к синусовому ритму. Fig. 1. Hemodynamic parameters of the heart of rainbow trout with an increase in heart rate: А – the maximum systolic pressure of the ventricle (MSVP); B – end-diastolic pressure of the ventricle (EDVP); С – the maximum rate of the ventricular pressure rise (dP/dtmax); D – the maximum rate of the pressure fall (dP/dtmin. sa – sinus rhythm; ap – atrium pacing rhythm. 30, …, 60 – HR in beats/min, respectively. * p < 0.05 – in relation to the sinus-atrial rhythm.
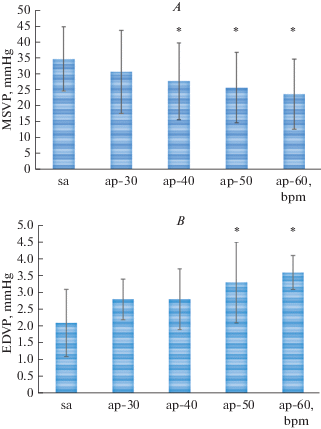
Рис. 1.
Окончание
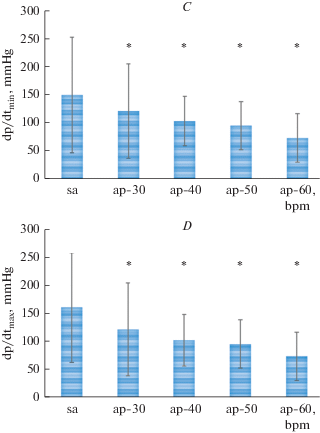
При навязанных ритмах от 30 до 60 уд/мин происходило значительное изменение всех гемодинамических показателей желудочка сердца по отношению к синусовому ритму (рис. 1). Их максимальное изменение произошло при 60 уд/мин: максимальное систолическое давление желудочка уменьшилось с 35.2 ± 10.2 до 24.0 ± 11.5 мм рт. ст. (p < 0.05), конечно-диастолическое давление увеличилось с 2.1 ± 1.0 до 3.6 ± 0.5 мм рт. ст. (p < 0.05), показатель изоволюмического сокращения уменьшился с 161.2 ± 98.9 до 74.0 ± 43.2 мм рт. ст./с (p < 0.05) и изоволюмического расслабления – с 151.0 ± 103.1 до 74.2 ± 43.3 мм рт. ст./с (p < 0.05). В процентном отношении увеличение ЧСС у радужной форели in vivo привело к уменьшению dP/dtmax при ЧСС 30 уд/мин – на 20%; 40 уд/мин – на 35%; 50 уд/мин – на 40%; 60 уд/мин – на 54%. Уменьшение показателей dP/dtmin происходило приблизительно в той же пропорции: при ЧСС 30 уд/мин – на 19%; 40 уд/мин – на 30%; 50 уд/мин – на 36%; 60 уд/мин – на 51%. В результате изменения гемодинамических показателей произошло снижение сократимости миокарда и ухудшение насосной функции желудочка сердца радужной форели.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Одним из критериев сократимости миокарда, характеризующим способность развивать определенные силу и скорость сокращений миокардиальных волокон является максимальная скорость нарастания внутрижелудочкового давления (dP/dtmax). Увеличение ЧСС у радужной форели до 60 уд/мин привело к уменьшению dP/dtmax на 54%, по сравнению с исходным ритмом (21.6 ± 4.9) уд/мин. Полученные нами данные в экспериментах in vivo свидетельствуют о снижении сократимости миокарда, что подтверждает результаты исследований, полученных на полосках миокарда [7] и на перфузируемых изолированных сердцах [9]. Однако эти данные не согласуются с результатами M.D. Coune с соавт. [10] об отсутствии влияния ЧСС на сократительную функцию миокарда радужной форели.
Повышение частоты сердечных сокращений по отношению к исходному ритму 21.6 ± 4.9 уд/мин привело к падению максимального систолического давления и повышению конечного диастолического давления. Повышение конечного диастолического давления свидетельствует об увеличении преднагрузки, которая возможно происходит за счет усиления вклада α-адренорецепторов, что компенсирует время снижения наполнения желудочка [11]. Вероятно, при увеличенной преднагрузке и сниженной сократимости желудочка сердца включается механизм регулирования физиологических функций миокарда. В результате этого в наших экспериментах при температуре 5–7°С предельной оказалась частота 60 уд/мин, сверх которой возникали нарушения в функциональной деятельности желудочка сердца радужной форели. Снижение сократимости, систолического давления в желудочке и увеличение на этом фоне конечного диастолического давления можно считать проявлением признаков функциональной недостаточности желудочка сердца у радужной форели при высокой частоте стимуляции в условиях низкой температуры. Последнее обусловлено нарушением функционирования губчатого миокарда в активной сократительной деятельности сердца в форме целенаправленных движений трабекул. Скорость и последовательность сокращений таких движений регулируется через ускоряющие адренергические нервы, тормозные холинергические нервы и проводящие пучки сердца [12], что обеспечивает тем самым адекватное внутрижелудочковое соотношение оксигенированной и деоксигенированной крови и эффективную сократительную деятельность сердца.
При адаптации организма к среде обитания немаловажное значение играет пространственно-временная организация процесса возбуждения миокарда, которая во многом определяет сократительную и насосную функцию сердца [13]. Ранее нами [14] было показано, что при предсердной электрической стимуляции у радужной форели при температуре водной среды 5–7°C при ЧСС свыше 60 уд/мин происходит нарушение электрофизиологических процессов в миокарде. Не исключено, что в другом диапазоне температур ЧСС и показатели насосной функции были бы другими, так как ионные токи в клетках миокарда рыб под воздействием температуры претерпевают значительные изменения [8, 9, 15, 16]. Возможно, дезорганизация функциональной деятельности сердца у радужной форели при ЧСС выше 60 уд/мин, как и при температурной адаптации [17], также была связана с нарушением функционирования натриевых каналов, ионные токи которых являются “самым слабым звеном”, ограничивающим адаптацию к температуре среды [17]. Кроме того, на показатели сократимости и насосной функции сердца при температуре 5–7°С могло оказать возможное ремоделирование миокарда. Так, при исследовании влияния температуры на морфометрические показатели миокарда желудочка у радужной форели было установлено [18], что относительная масса желудочка у самцов рыб, акклиматизированных к 4°C, была значительно больше, чем у особей в контрольной группе, адаптированных к 12°C, а их компактный миокард был более тонким, и количество губчатого миокарда было увеличено. Вопрос о том, каким образом морфологическое ремоделирование миокарда влияет на сократимость и насосную функцию желудочка сердца рыб в зависимости от температуры окружающей среды, требует отдельного исследования.
У радужной форели, адаптированной к температуре 5–7°С при синусовом ритме в диапазоне частот (21.6 ± 4.9 уд/мин) насосная функция сердца находилась, вероятно, в пределах верхней границы физиологической нормы. Увеличение частоты сердечных сокращений у радужной форели от исходного ритма до 60 уд/мин привело к уменьшению максимального систолического давления в желудочке сердца, увеличению диастолического и конечно-диастолического давления, и к снижению максимальных скоростей прироста и падения давления.
Таким образом, повышение ЧСС для радужной форели Oncorhynchus mykiss при низкой температуре среды обитания не является приспособительным адаптационным механизмом, так как приводит к снижению сократимости миокарда и к ухудшению насосной функции желудочка сердца.
Список литературы
Farrell A.P., Eliason E., Sandblom E., Clark T.D. Fish cardiorespiratory physiology in an era of climate change. Canad. J. Zool. 87(10): 835–851. 2009.
Casselman M.T., Anttila K., Farrell A.P. Using maximum heart rate as a rapid screening tool to determine optimum temperature for aerobic scope in Pacific salmon Oncorhynchus spp. J. Fish Biol. 80: 358–377. 2012.
Anttila K., Couturier C.S., Overli O., Johnsen A., Marthinsen G., Nilsson G.E., Farrell A.P. Atlantic salmon show capability for cardiac acclimation to warm temperatures. Nat. Commun. 5: Article number 4252. 2014.
Gradill K.J., Shawn R., Garnerl S.R., Chris C., Wilson C.C., Anthony P., Farrell A.P., Neffl B.D. Relationship between cardiac performance and environment across populations of Atlantic salmon (Salmo salar): a common garden experiment implicates local adaptation. Evol. Ecol. 30: 877–886. 2016.
Endoh M. Force–frequency relationship in intact mammalian ventricular myocardium: physiological and pathophysiological relevance. Europ. J. Pharmacol. 500: 73–86. 2004.
Shiels H.A., Farrell A.P. The effect of temperature and adrenaline on the relative importance of the sarcoplasmic reticulum in contributing calcium to force development in isolated ventricular trabeculae from rainbow trout. J. Exp. Biol. 200: 1607–1621. 1997.
Shiels H.A., Vornanen M., Farrell A.P. The force–frequency relationship in fish hearts–a review. Comp. Biochem. Physiol. Part A. 132: 811–826. 2002.
Vornanen M., Shiels H.A., Farrell A.P. Plasticity of excitation–contraction coupling in fish cardiac myocytes. Comp. Biochem. Physiol. Part A. 132: 827–846. 2002.
Farrell A.P., Gamperl A.K., Hicks J.M.T., Shiels H.A., Jain K.E. Maximum cardiac performance of rainbow trout (Oncorhynchus mykiss) at temperatures approaching their upper lethal limit. J. Exp. Biol. 199: 663–672. 1996.
Coyne M.D., Kim K.C., Cameron J.S., Gwathmey K. Effects of temperature and calcium availabilityon ventricular myocardium from rainbow trout. Am. J. Physiol. Regulatory Integrative Comp. Physiol. 278: R1535–R1544. 2000.
Sandblom E., Axelsson M. Baroreflex mediated control of heart rate and vascular capacitance in trout. J. Exp. Biol. 208: 821–829. 2005.
Sedmera D., Reckov M., DeAlmeida A., Sedmero M., Biermann M., Volejnik J., Sarre A., Raddat E., McCarthy R.A., Gourdie R.G., Thompson R.P. Functional and morphological evidence for a ventricular conduction system in zebrafish and Xenopus hearts. Am. J. Physiol. Heart Circ. Physiol. 284: 1152–1160. 2003.
Шмаков Д.Н., Рощевский М.П. Активация миокарда. Сыктывкар. Изд. ИФ КНЦ УрО РАН. 1997. [[Shmakov D.N., Roshchevsky M.P. Aktivaciya miocarda [Myocardial activation]. Publishing house of the IP KSC UB RAS. Syktyvkar. 1997. (In Russ)].
Киблер Н.А., Нужный В.П., Харин С.Н., Шмаков Д.Н. Влияет ли предсердная электрическая стимуляция на последовательность деполяризации желудочка сердца радужной форели Oncorhynchus mykiss?. Журн. эвол. Биохим. физиол. 56(1): 60–65. 2020. [N.A. Kibler, V.P. Nuzhny, S.N. Kharin, and D.N. Shmakov. Does Atrial Electrical Stimulation to the Sequence of Depolarization of the Ventricles of Rainbow Trout Oncorhynchus mykiss? Zn. Evol. Biokhim. Fiziol. 56(1): 60–65. 2020 (In Russ)].
Abramochkin D.V., Vornanen M. Seasonal acclimatization of the cardiac potassium currents (IK1 and IKr) in an arctic marine teleost, the navaga cod (Eleginus navaga). J. Comp. Physiol. B. 185: 883–890. 2015.
Haverinen J., Vornanen M. Significance of Na+ current in the excitability of atrial and ventricular myocardium of the fish heart. J. Exp. Biol. 209: 549–555. 2006.
Vornanen M., Haverinen J., Egginton S. Acute heat tolerance of cardiac excitation in the brown trout (Salmo trutta fario). J. Exp. Biol. 217(Pt 2): 299–309. 2014.
Klaiman J.M., Fenna A.J., Shiels H.A., Macri J., Gillis T.E. Cardiac remodeling in fish: strategies to maintain heart function during temperature Change. PLoS One 6: e24464. 2011.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


