Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 3, стр. 301-314
Микроэлектрофизиологическое изучение соотношения возбудительных и тормозных синаптических процессов в кортико-нигральной проекции на модели болезни Паркинсона
М. В. Погосян 1, Л. М. Хачатрян 1, М. А. Даниелян 1, З. А. Аветисян 1, Дж. С. Саркисян 1, *
1 Институт физиологии им. Л.А. Орбели НАН РА
Ереван, Армения
* E-mail: johnsarkissyan@gmail.com
Поступила в редакцию 21.10.2019
После доработки 06.12.2019
Принята к публикации 16.01.2020
Аннотация
В сериях экспериментов на 23 белых крысах cамцах (250 гр.) проведен анализ импульсной активности одиночных нейронов Substantia Nigra pars compacta – SNc (242 нейрона, n = 11) и Substantia Nigra pars reticulata – SNr (289 нейронов, n = 12) при высокочастотной стимуляции первичной моторной коры мозга (M1) в норме и на ротеноновой модели болезни Паркинсона (БП). В нейронах SNc на модели БП полностью отсутствовали депрессорные эффекты, вызванные стимуляцией, но тетаническая потенциация, сопровождаемая посттетанической потенциацией и депрессией, 1.65 и 2.02-кратно превысила таковую в норме. В нейронах SNr в норме тетаническая потенциация, сопровождаемая посттетанической потенциацией и депрессией, оказалась 2.37-кратно выше тетанической депрессии, а на модели БП уровни как депрессорной, так и возбудительной активности, вызванной стимуляцией, оказались ниже нормы. В нейронах SNc и SNr на модели БП частота спайковой активности, предшествующая стимуляции и сопровождающая ее, значительно превысила норму. Это свидетельствует о эксайтотоксичности, сопровождаемой нейродегенеративным повреждением, завершаемым апоптозом и гибелью нейронов. В нейронах SNr как депрессорные, так и возбудительные реакции, сопровождающие стимуляцию, оказались резко превалирующими над таковыми в нейронах SNc, что свидетельствует о большей выраженности корковой проекции к SNr. Более того, выявлена большая подверженность патологическим изменениям постстимульных депрессорных эффектов нейронов SNc в сравнении с SNr, с формированием в них более выраженных возбудительных эффектов, что свидетельствует о большем вовлечении SNc в БП. На модели БП при отсутствии вызванных стимуляцией депрессорных эффектов и более выраженных возбудительных в нейронах SNc, нейроны SNr сохраняют депрессорные реакции и относительно сниженные возбудительные, что свидетельствует о меньшей подверженности нейронов SNr эксайтотоксичности, чрезмерного повышения возбудимости сохранившихся нейронов, компенсирующих отсутствие возбудимости погибших.
Черная субстанция (Substatia nigra – SN) – важная нейрональная структура, осуществляющая регуляцию деятельности базальных ганглиев (БГ). Постеро-медиальная область SN – pars compacta (SNc), будучи в составе допаминергических (ДА) ядер мозга [1], главным образом связана с дорзальным стриатумом [2]. Антеро-латеральная зона SN – pars reticulate (SNr) – состоит из ГАМКергических нейронов, воспринимающих афференты от стриатума и субталамического ядра и, в свою очередь, проецирующихся к вентральному переднему таламическому ядру [3]. SN, осуществляя регуляцию БГ [4], в условиях патологии содействует развитию различных нейрологических болезней, в частности, болезни Паркинсона (БП) [5], шизофрению [6], патологические склонности и пагубные пристрастия [7]. Продемонстрирована обширная подкорковая сеть для SNc и SNr [8–10]. Согласно данным на грызунах, SNr – большая выходная инстанция БГ, воспринимающая информацию от мозговой коры через прямой тормозный, непрямой возбудительный, вовлекающий паллидум и субталамус и прямой возбудительный – через суббталамус [11]. Недавно доказано существование кортико-нигральной проекции у людей. Магнитно-резонансной томографией, с целью дифференциации взаимоотношений SNc и SNr с мозговой корой посредством таламуса, показана связь SNc с префронтальной корой (ПФК), а SNr – преимущественно с моторной и премоторной корой [9]. Описана связь SN с различными стуктурами мозга (мозолистое тело, первичная сенсорная кора, премоторная кора, хвостатое ядро, скорлупа, прилегающее ядро перегородки, височно-затылочные доли, вентральная часть моста, передняя доля мозжечка, наружная капсула) [12]. Согласно ранним работам, одностороннее удаление фронтальной коры сопровождается истощением глутаминовой кислоты в ипсилатеральной SN, при неизменном содержании ГАМК, что свидетельствует о глутамате в качестве передатчика в кортико-нигральном тракте [13]. Несмотря на относительную недостаточную выраженность коркового входа к среднему мозгу у приматов, он оказался богатым глутаматными рецепторами [14]. Корковый контроль среднего мозга – важный механизм, которым глутаматергический вход управляет ДА клетками [15]. Обнаружено, что связи SN с мозговой корой у человека вовлекают префронтальную кору (ПФК), пре- и постцентральную извилины и верхнюю париетальную долю, что позволяет вникнуть в механизм развития патофизиологии таких нейрологических болезней, как БП, шизофрения, патологическая зависимость. Тем самым, подкреплена гипотеза, что SN не только часть сети подкорковых БГ, но также связана с корой, посредством дополнительного кортико-нигрального пути у людей, подтверждая предварительно существующие данные на животных [16]. Таким образом, продемонстрировано наличие прямой кортико-нигральной связи, детально описанной у кошек, грызунов и приматов, но лишь предполагаемой у людей. Эта связь может служить основанием для последующих биохимических и физиологических исследований корковой регуляции базальных ганглиев. Продолжает оставаться недостаточно доказанной большая выраженность связей моторной и премоторной коры с SNr, по сравнению с SNc, на основе вышеотмеченного современного трактографического изучения у людей. Предметом настоящего изучения явилось дальнейшее исследование, в норме и на модели БП, сравнительной степени выраженности кортико-нигральных связей в микроэлектрофизиологическом исследовании на примере соотношения возбудительных и тормозных процессов в нейронах SNc и SNr, в условиях активации первичной моторной коры мозга (М1), что может содействовать новому пониманию механизмов контроля моторики и когнитивных функций мозга на уровне ствола мозга, в условиях изменения его пластичности при нейродегенеративных болезнях.
МЕТОДЫ ИССЛЕДОВАНИЯ
Проводили электрофизиологические исследования на 23 белых беспородных крысах-самцах (230 ± 30 г) в двух сериях экспериментов: интактных (n = 11) и на модели БП, индуцированной унилатеральным введением ротенона на 4 нед. выдерживания животных (n = 12). Введение ротенона осуществляли в условиях нембуталового наркоза (40 мг/кг, в/б) из расчета 12 μг в 0.5 μл Димексида (со скоростью 0.1 μл/мин) в “medial forebrain bundle” по координатам стереотаксического атласа [17] (AP + 0.2; L ± 1.8; DV + 8 мм). Исследование проводилось в соответствии с принципами Базельской декларации и рекомендациями руководства ARRIVE [18]. В стереотаксическом аппарате производили трепанацию черепа от брегмы до лямбды и вскрывали твердую мозговую оболочку. После краниотомии, раздражающий электрод вживляли в ипсилатеральную М1 по стереотаксическим координатам (АР + 2.1, L ± 2.6, DV + 1.6 мм), а cтеклянные микроэлектроды с диаметром кончика 1-2 µM, заполненные 2M NaCl, вводили в SNс (AP-5.0; L ± 2.0; DV + 8.1 мм) и SNr (АР-5.1, L ± 2.0, DV + 8.6 мм) для экстраклеточной регистрации спайковой активности одиночных нейронов. Осуществляли высокочастотную стимуляцию (ВЧС) МI посредством прямоугольных толчков тока (длительностью 0.05 мс, амплитудой 0.12–0.18 мВ, силой тока 0.32 мА и частотой 100 Гц в течение 1 с). Операции осуществляли на наркотизированных уретаном животных (urethane 1.5 г/кг и/п) в следующей очередной последовательности: фиксация черепа в стереотаксическом аппарате, краниотомия с удалением костей от брегмы до лямбды и отсепаровкой твердой мозговой оболочки. Предварительно животные обездвиживались 1% дитилином (Dithylin – Suxamethonium iodide, 25 мг/кг в/б) и переводились на искусственное дыхание. В целом, была зарегистрирована активность 531 нейронов.
Активность нейронов проявлялась в виде тетанической депрессии и потенциации (ТД и ТП), сопровождаемых посттетанической депрессией и потенциацией (ПТД и ПТП). Проводили анализ одиночной спайковой активности 531 нейронов SNc и SNr. Применен специальный алгоритм для расчета средней частоты спайков. Производили далее многоуровневую статистическую обработку для пре- и постстимульного отрезков времени. Для избираемых сравниваемых групп спайковой активности строили суммированные и усредненные перистимульные (РЕТН Average) гистограммы и гистограммы частоты (Frequency Average). Анализ полученных данных производили по специально разработанному алгоритму. Однородность двух независимых выборок контролировалась t-критерием Стьюдента. Поскольку число спайков превышало 30, распределение можно считать асимптотически нормальным, следовательно применение критерия Стьюдента оправдано и по нему показано, что в представленных нами графиках изменение средней величины спайков достоверно. Учет критических значений в сравнении с таковыми нормального распределения при уровнях значимости 0.05, 0.01 и 0.001 показывает, что в большинстве случаев статистически значимое изменение достигало как минимум уровня 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведен cравнительный анализ импульсной активности одиночных нейронов SNc и SNr на ВЧС M1 в норме (107 нейронов, n = 4 и 135 нейронов, n = 7 соответственно) и на модели БП (105 нейронов, n = 5 и 184 нейрона, n = 7). В указанных условиях были обнаружены cледующие изменения тормозных и возбудительных тетанических и посттетанических реакций в обеих постстимульных последовательностях (ТД ПТД, ТД ПТП и ТП ПТП, ТП ПТД).
При оценке относительной степени выраженности вышеотмеченных эффектов, на примере диаграмм усредненной частоты спайков, выведенных на основе растеров пре – и постстимульных разнонаправленных проявлений спайковой активности нейронов SNc при ВЧС М1 в норме, с указанием средних цифровых значений в реальном времени 20 с до и после стимуляции, включая время ВЧС, получены значения (рис. 1–3), представленные в виде дисковых диаграмм для оценки степени выраженности в процентах (рис. 4, 5).
Рис. 1.
A–F – гистограммы суммы спайков предшествующих и сопровождающих постстимульные проявления активности: депрессорные – ТД ПТД (A), депрессорно-возбудительные – ТД ПТП (B), возбудительные ТП ПТП (C, E), в сочетании с депрессорными – ТП ПТД (D, F), в реальном времени 20 с (до и после стимуляции) нейронов SNc, вызванных ВЧС М1 в норме (A–D) и на модели БП (E, F). Здесь и в остальных рисунках: диаграммы частоты спайков, представленных в гистограммах, с усредненными значениями (М) для временных отрезков до стимуляции (BE – before event), на время тетанизации (TT – time tetanization) и после стимуляции (PE – post event). Справа от диаграмм – количество испытаний (n). Fig 1. A–F – histograms of the sum of spikes, prior and accompanying post-stimulus manifestations of activity: depressor – TD PTD (A), depressor-excitatory – TD PTP (B), excitatory – TP PTP (C, E), combined with depressor – TP PTD (D, F), in real time 20 s (before and after stimulation) of neurons SNc, evoked by HFS MI in norm (A–D) and on the model of PD. Here and in the rest of the figures: spike frequency diagrams, presented in histograms, with averaged meanings (M) for time segments before stimulation ((BE – before event), at the time of tetanization (TT – time tetanization) and after stimulation (PE – post event). To the right of the diagrams – number of tests (n).
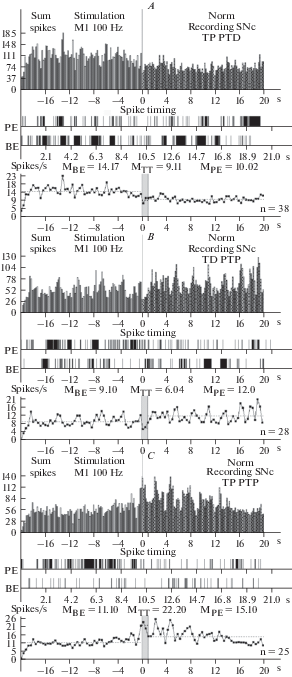
Рис. 1.
Окончание
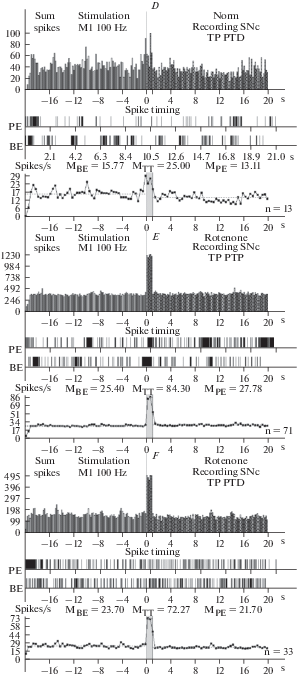
Рис. 2.
A–D – гистограммы суммы спайков предшествующих и сопровождающих постстимульные проявления активности: депрессорные (A), депрессорно-возбудительные (B), возбудительные (C), в сочетании с депрессорными – ТП ПТД (D), в реальном времени 20 с (до и после стимуляции) нейронов SNr, вызванных ВЧС М1 в норме. Справа от диаграмм – количество испытаний (n). Fig. 2. А–D – histograms of the sum of spikes, prior and accompanying post-stimulus manifestations of activity: depressor – TD PTD (A), depressor-excitatory – TD PTP (B), excitatory – TP PTP (C), combined with depressor – TP PTD (D), in real time 20 s (before and after stimulation) of neurons SNr, evoked by HFS MI in norm. To the right of the diagrams – number of tests (n).
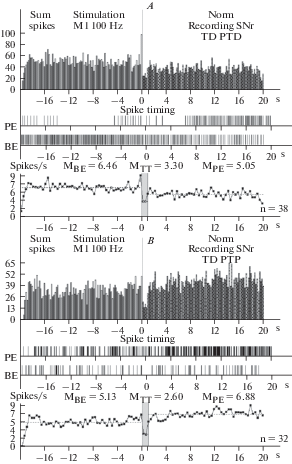
Рис. 2.
Окончание
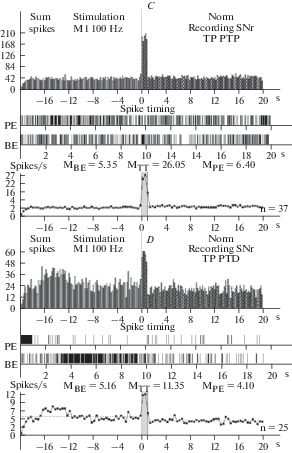
Рис. 3.
A–D – гистограммы суммы спайков, предшествующих и сопровождающих постстимульные проявления активности: депрессорные (A), депрессорно-возбудительные (B), возбудительные (C), в сочетании с депрессорными (D), в реальном времени 20 с (до и после стимуляции) нейронов SNr, вызванных ВЧС М1 на модели БП. Справа от диаграмм – количество испытаний (n). Fig. 3. А–D – histograms of the sum of spikes, prior and accompanying post-stimulus manifestations of activity: depressor – TD PTD (A), depressor-excitatory – TD PTP (B), excitatory – TP PTP (C), combined with depressor – TP PTD (D), in real time 20 s (before and after stimulation) of neurons SNr, evoked by HFS MI on the model of PD. To the right of the diagrams – number of tests (n).
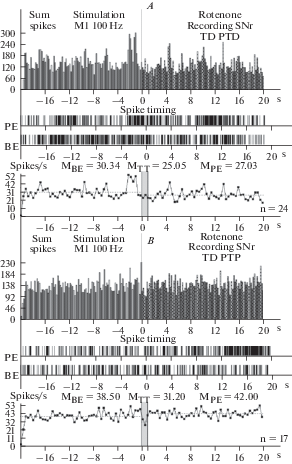
Рис. 3.
Окончание
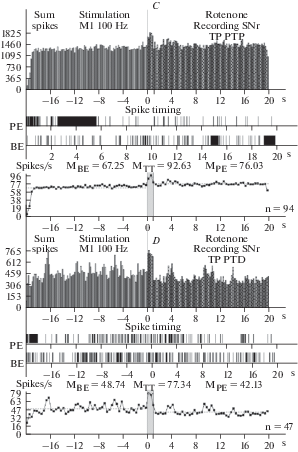
Рис. 4.
A–H – процентное соотношение степени выраженности депрессорных (A), депрессорно-возбудительных (B), возбудительных (C) и возбудительно-депрессорных (D) изменений усредненной частоты импульсной активности в одиночных нейронах SNс, предшествующих и сопровождающих ВЧС М1 на модели БП, в сравнении с нормой. Обозначения: степ. выраж. – степень выраженности, престим. – престимульный, постстим. – постстимульный. Fig. 4. А–H – the percentage of degree of evidence of depressor (A), depressor-excitatory (B), excitatory (C) and excitatory-depressor (D) changes of average frequency in single neurons of SNc, previous and accompanying HFS of MI at the rotenone model of PD, in comparison with the norm. Designations: degree of evidence. – degree of evidence, Prestimul. – Prestimulus, Poststimul. – Post stimulus.
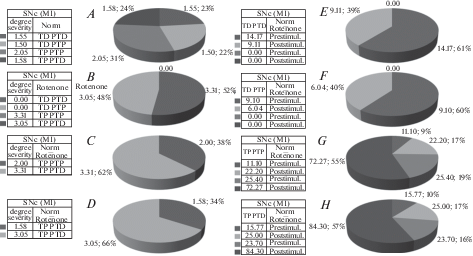
Рис. 5.
A–J – процентное соотношение степени выраженности депрессорных (A), депрессорно-возбудительных (B), возбудительных (C) и возбудительно-депрессорных (D) изменений усредненной частоты импульсной активности в одиночных нейронах SNr, предшествующих и сопровождающих ВЧС М1 на модели БП, в сравнении с нормой. Обозначения: степ. выраж. – степень выраженности, престим. – престимульный, постстим. – постстимульный. Fig. 5. А–J – the percentage of degree of evidence (on average frequency) of depressor (A), depressor-excitatory (B), excitatory (C) and excitatory-depressor (D) changes of average frequency in single neurons of SNr, previous and accompanying HFS of MI at the rotenone model of PD, in comparison with the norm.. Designations: degree of evidence. – degree of evidence, Prestimul. – Prestimulus, Poststimul. – Post stimulus.

В нейронах SNc на ВЧС М1 в норме значения занижения (ТД) и завышения (ТП) престимульной активности, в одно- и разнонаправленных постстимульных последовательностях, исчислялись в следующих пределах. В депрессорной последовательности ТД достигало 1.55-кратного занижения престимульной активности, в депрессорно-возбудительной – 1.5-кратного занижения (рис. 1A, B; 4A); в возбудительной последовательности ТП завышала престимульную активность и выявлялась в пределах 2.05-кратного, а в возбудительно-депрессорной – 1.58-кратного (рис. 1C, D; 4A).
На модели БП постстимульные проявления депрессорной активности в нейронах SNc полностью отсутствовали. В возбудительной постстимульной активности ТП в двух последовательностях достигала 3.31 и 3.05-кратности превышения престимульной активности (рис. 1E, F; 4B–D). Очевидна эксайтотоксичность в SNc нейронах на модели БП, свидетельствующая о их нейродегенеративном поражении. В нейронах SNr на ВЧС М1 в норме значения занижения (ТД) и завышения (ТП) престимульной активности, в одно- и разнонаправленных постстимульных последовательностях, исчислялись в следующих пределах. В депрессорной последовательности ТД достигало 2.05-кратногозанижения, в депрессорно-возбудительной – 2.07‑кратного (рис. 2A, B; 5A). В возбудительной последовательности ТП исчислялась в пределах 5.07-кратного завышения, а в возбудительно- депрессорной – 2.20-кратного (рис. 2C, D; 5A). Иными словами, ТП в нейронах SNr оказалось выше ТД, преимущественно в однонаправленной последовательности. На модели БП в н ейронах SNr ТД в обеих последовательностях достигала лишь 1.21- и 1.23-кратного занижения престимульной активности (рис. 3A, B; 5B–D). Однако, ТП в обеих последовательностях также исчислялись в небольших пределах, порядка 1.40- и 1.60-кратного превышения (рис. 3C, D; 5B, E, F). Иными словами, в нейронах SNr уровни как депрессорной, так и возбудительной постстимульной активности на модели БП оказались ниже нормы. В нейронах SNc на ВЧС МI уровни частоты престимульной активности, предшествующие двум возбудительным постстимульным проявлениям активности на модели БП, в сравнении с нормой, достигали значений превышающих таковые в норме, в пределах 25.4 и 23.7 против 11.10 и 15.77, т.е. 2.30- и 1.50- кратно (рис. 1; 4G, H). Что же касается постстимульной частоты активности нейронов SNc, сопровождающей постстимульные возбудительные проявления активности, то они исчислялись порядка 84.3 и 72.27 и против 22.2 и 25.0, т.е. она достигла в патологии значительных уровней, превышающих норму 3.25- и 3.37-кратно (рис. 1; 4G, H). Таким образом, сравнительный анализ пре- и постстимульной частоты активности нейронов SNc на модели БП, в сравнении с нормой, привел к заключению о эксайтотоксичности, сопровождаемой неизбежным и значительным нейродегенеративным повреждением.
В нейронах SNr на ВЧС МI уровни частоты престимульной активности, предшествующие двум постстимульным депрессорным последовательностям, на модели БП в сравнении с нормой, определялись в пределах 30.34 и 38.5 против 6.46 и 5.13, тем самым превысив норму порядка 4.7- и 7.5-кратно (рис. 2; 3; 5G, H). Частота активностинейронов SNr, предшествующая двум возбудительным последовательностям на модели БП, в сравнении с нормой достигала 67.25 и 48.74 против 5.35 и 5.16, т.е. 12.57- и даже 9.44-кратного превышения нормы (рис. 2, 3; 5I, J). Постстимульная частота активности нейронов SNr, сопровождаемая двумя соответствующими депрессорными последовательностями на модели БП, в сравнении с нормой, исчислялась в пределах 25.05 и 31.2 против 3.3 и 2.6 (7.6- и 12-кратно выше нормы), а частота, сопровождаемая возбудительными последовательностями, соответственно 92.63 и 77.34 против 26.05 и 11.35 (3.55- и 6.81-кратно выше нормы) (рис. 5G–J). Иными словами, уровни как пре-, так и постстимульной частоты активации нейронов SNr в патологии показали мощное превышение, по сравнению с нормой, больше со стороны престимульной фоновой активности, что свидетельствует о компенсаторной эксайтотоксичности, способствующей выраженной нейродегенерации, содействующей апоптозу и гибели нейронов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно современным представлениям, ротенон вызывает селективную дегенерацию нигростриатного дофаминергического пути, избирательное окислительное повреждение полосатого тела и образование убиквитин- и а-синуклеинпозитивных включений в нигральных клетках, которые сходны с тельцами Леви при БП [19]. В свою очередь, “эксайтотоксичность” при нейродегенеративных болезнях, в том числе при БП, является результатом сверхактивации глутаматных NMDA и AMPA рецепторов, приводящей к серъезному повреждению нейронов [20], с их гибелью [21, 22]. Возникает она в результате неизбежного развития целого ряда отрицательных явлений, включающих нарушение кальциевой “буферизации”, генерацию свободных радикалов, активацию митохондриальной проницаемости и вторичной эксайтотоксичности [23]. Выступая в качестве компенсации возбуждения сниженного в результати гибели нейронов, она сохранившихся нейронов, в конечном счете, приводит к их апоптозу и гибели. С целью предотвращения неизбежной эксайтотоксичности необходимо восстановление и углубление постстимульных депрессорных эффектов, несущих протекторную нагрузку, и снижения чрезмерных возбудительных [24 ] .
В настоящих экспериментах проведен cравнительный анализ импульсной активности одиночных нейронов SNc и SNr на ВЧС M1 в норме и на модели БП. Анализ относительной степени частотной выраженности вышеотмеченных депрессорных и возбудительных эффектов, на основе диаграмм усредненной частоты спайков, представленных в виде дисковых диаграмм (в %), привел к следующим заключениям. В нейронах SNr при активации М1 коры мозга, в целом, как депрессорные, так и возбудительные постстимульные реакции оказались резко превалирующими, над таковыми в нейронах SNc (2.05, 2.07, 4.87, 2.21 против 1.55, 1.5, 2.0, 1.58), что свидетельствует о большей выраженности корковой проекции к SNr, в сравнении с SNc. Более того, выявлена большая недостаточность депрессорных постстимульных проявлений активности нейронов SNc в сравнении с SNr, в условиях патологии, с формированием чрезмерной возбудительной активности (эксайтотоксичности). На модели БП, в сравнении с нормой, при полном отсутствии депрессорных постстимульных эффектов и более выраженных возбудительных в нейронах SNc (3.05, 3.32 против 2.0, 1.58), нейроны SNr сохраняют депрессорные постстимульные реакции, хотя и сниженные, но снижены и возбудительные (1.21, 1.23, 1.38, 1.6 в патологии против 2.05, 2.07, 4.87, 2.21 в норме), что свидетельствует также о меньшей подверженности нейронов SNr эксайтотоксичности, в сравнении с таковыми SNc.
Список литературы
Nestler E.J., Hyman S.E., Malenka R.C. Molecular Neuropharmacology: A foundation for clinical neuroscience. New York, NY: McGraw-Hill Medical. 2009.
Voorn P., Vanderschuren L.J., Groenewegen H.J., Robbins T.W., Pennartz C.M. Putting a spin on the dorsal-ventral divide of the striatum. Trends Neurosci. 27: 468–474. 2004.
Zhou F.M., Lee C.R. Intrinsic and integrative properties of substantia nigra pars reticulata neurons. Neuroscience. 198: 69–94. 2011.
Guatteo E., Cucchiaroni M.L., Mercuri N.B. Substantia nigra control of basal ganglia nuclei. J. Neural Transm. Suppl. 73: 91–101. 2009.
Carman J.B. Anatomic basis of surgical treatment of Parkinson’s disease. N. Engl. J. M. 17: 919–930. 1968.
Weinberger, D.R. Implications of the normal brain development for the pathogenesis of schizophrenia. Arch. Gen. Psychiatry. 44: 660–669. 1987.
Wise R.A. Trends Roles for nigrostriatal–not just mesocorticolimbic–dopamine in reward and addiction. Neurosci. 32: 517–524. 2009.
Düzel E., Bunzeck N., Guitart-Masip M., Wittmann B., Schott B.H., Tobler P.N. Functional imaging of the human dopaminergic midbrain. Trends Neurosci. 32: 321–328. 2009.
Menke R.A., Jbabdi S., Miller K.L., Matthews P.M., Zarei M. Connectivity-based segmentation of the substantia nigra in human and its implications in Parkinson’s disease. Neuroimage. 52: 1175–1180. 2010.
Chowdhury R., Lambert C., Dolan R.J., Düzel E. Parcellation of the human substantia nigra based on anatomical connectivity to the striatum. Neuroimage. 81: 191–198. 2013.
Kolomiets B.P., Deniau J.M., Glowinski J., Thierry A.M. Basal ganglia and processing of cortical information: functional interactions between trans-striatal and trans-subthalamic circuits in the substantia nigra pars reticulata. Neuroscience. 117 (Issue 4): 931–938. 2003.
Kwon H.G., Jang, S.H. Differences in neural connectivity between the substantia nigra and ventral tegmental area in the human brain. Front. Hum. Neurosci. 8: 41. 2014.
Kornhuber J. The cortico-nigral projection: reduced glutamate content in the substantia nigra following frontal cortex ablation in the rat. Brain Res. 322: 124–126. 1984.
Frankle W.G., Laruelle M., Haber S.N. Prefrontal cortical projections to the midbrain in primates: evidence for a sparse connection. Neuropsychopharmacology. 31: 1627–1636. 2006.
Sesack S.R., Carr D.B. Selective prefrontal cortex inputs to dopamine cells: implications for schizophrenia. Physiol. Behav. 77: 513–517. 2002.
Cacciola, A., Milardi, D., Quartarone, A. Role of cortico-pallidal connectivity in the pathophysiology of dystonia. Brain, 2016.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. Elsevier, Academic Press, 5th ed. 2005.
Kilkenny C., Browne W.J., Cuthill I.C., Emerson M., Altman D.G. Improving Bioscience Research Reporting: The ARRIVE Guidelines for Reporting Animal Research. PLoS Biol. 8(6): e1000412. 2010.
Schmidt W., Alam M.J. Controversies on new animal models of Parkinson’s disease pro and con: the rotenone model of Parkinson’s disease (PD). J. Neural Transmission. Supplementum 70: 273–276. 2006.
Matthew R.H., Heather L.S., Peter R.D. Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer’s disease. NCI. 45(Iss. 5): 583–595. 2004.
Lucas D.R., Newhouse J.P. The toxic effect of sodium L-glutamate on the inner layers of the retina. AMA Archives of ophthalmology 58(2): 193–201. 1957.
Olney J.W. Brain lesions, obesity, and other disturbances in mice treated with monosodium glutamate. Science. 164 (3880): 719–721. 1969.
Xiao-xia Dong, Yan Wang, Zheng-hong Qin. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases. Acta Pharmacologica Sinica. 30: 379–387. 2009. Саркисян Дж.С., Погосян М.В., Даниелян М.А., Степанян А.Ю., Варданян А.В. Назначение депрессорных синаптических процессов в условиях специфической нейродегенеративной патологии и протекции. LAP LAMBERT Academic Publishing RU. 2018. [Sarkissian J.S., Poghosyan M.V., Danielyan M.A., Stepanyan H.Y, Vardanyan A.V. The assign of depressor synaptic processes in condition of specific neurodegenerative pathology and protection. LAP LAMBERT Academic Publishing RU. 2018. (in Russ.]
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


