Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 3, стр. 315-328
Кросскорреляционный и когерентный анализ электрокортикограмм крыс, перенесших черепно-мозговую травму
Ю. И. Сысоев 1, 2, *, В. А. Пьянкова 1, К. А. Крошкина 1, В. Е. Карев 3, С. В. Оковитый 1
1 Санкт-Петербургский государственный химико-фармацевтический университет
Санкт-Петербург, Россия
2 Институт трансляционной биомедицины, Cанкт-Петербургский государственный
университет
Санкт-Петербург, Россия
3 Детский научно-клинический центр инфекционных болезней
Санкт-Петербург, Россия
* E-mail: susoyev92@mail.ru
Поступила в редакцию 21.11.2019
После доработки 16.01.2020
Принята к публикации 17.01.2020
Аннотация
Черепно-мозговая травма (ЧМТ) является одной из ведущих причин смертности и стойкой утраты трудоспособности молодым населением как в РФ, так и за рубежом. Разработка адекватных и воспроизводимых моделей ЧМТ у лабораторных животных, а также объективных методов оценки степени возникающих неврологических нарушений позволит оптимизировать поиск и изучение новых эффективных нейрореабилитационных лекарственных средств. Цель исследования заключалась в проведении сравнительного кросскорреляционного и когерентного анализа электрокортикограмм условно здоровых крыс и животных, перенесших ЧМТ. После предварительной трепанации открытую проникающую ЧМТ моделировали методом контролируемого кортикального удара по области двигательной коры левого полушария. Регистрирующие нихромовые кортикографические электроды имплантировали билатерально в области первичной и вторичной двигательной коры, а также в область первичной соматосенсорной коры (над гиппокампом). Запись электрокортикограмм осуществляли на 3-и и 7-е сутки после операции в условии домашней клетки и состояния покоя. Кросскорреляционный анализ включал в себя расчет коэффициента кросскорреляции, средней частоты и максимального размаха кросскорреляционной функции. Для пар регистрируемых отведений рассчитывали среднюю мощность когерентности дельта-, тета-, альфа- и бета-ритмов. Одностороннее травматическое повреждение двигательной коры и нижележащих структур приводит к нарушению работы межполушарных и внутриполушарных связей, эти изменения фиксируются не только в области удара, но и в отдаленных участках коры на 3-и и на 7-е сутки после травмы. Выявленные изменения параметров кросскорреляции и когерентности ЭКоГ, возникающие у крыс в результате ЧМТ, сходны с таковыми, наблюдаемыми у пациентов в клинической практике, поэтому можно предположить, что данная экспериментальная модель может быть использована для нейрофизиологических и фармакологических исследований.
Черепно-мозговая травма (ЧМТ) традиционно является одной из самых частых патологий ЦНС и охватывает наиболее социально активную часть общества – лиц молодого и среднего возраста, приводя к потере трудоспособности, инвалидизации или гибели [1]. Медикаментозное лечение при тяжелой ЧМТ в острый период направлено на устранение отека мозга, внутричерепной гипертензии, а также на предотвращение развития ранних судорожных припадков. Диуретики, глюкокортикоиды и противосудорожные препараты успешно применяются для купирования вышеуказанных осложнений и являются стандартом клинических рекомендаций [2]. Однако неврологические расстройства, среди которых часто встречаются, например, двигательные нарушения и/или ухудшение когнитивных функций, слабо поддаются медикаментозному лечению. Средства с нейропротекторным (церебропротекторным) действием, направленные на снижение выраженности неврологического дефицита, редко включаются в существующие стандарты лечения вследствие недостаточного уровня доказанности клинического эффекта [3]. Исходя из этого, поиск новых средств, способных увеличивать выживаемость нейронов после перенесенной ЧМТ, и тем самым улучшать функциональное состояние пациентов, является важной задачей нейрофармакологии. Для успешного поиска и изучения новых перспективных нейропротекторных средств необходимы адекватные экспериментальные модели ЧМТ и других патологий ЦНС, которые будут иметь патогенетическое сходство с реальной клинической ситуацией. Кроме того, важно наличие методик и критериев, по которым можно объективно оценивать эффективность использования того или иного лекарственного средства в условиях эксперимента.
Оценивать тяжесть возникающих неврологических нарушений у экспериментальных животных, а также эффективность использования того или иного нейропротекторного средства можно с помощью поведенческих/функциональных тестов [4–6], биохимических [4, 7] и гистологических методик [8]. Все перечисленное широко используется в нейрофармакологических исследованиях, однако, каждый из подходов имеет свои недостатки. Например, поведенческие/функциональные тесты часто субъективны, во многом зависят от внешних факторов, а полученные результаты бывает сложно интерпретировать. Биохимические и гистологические исследования требуют дорогостоящего оборудования и расходных материалов, кроме того, обычно в данном случае испытуемое животное можно обследовать только один раз.
В клинической практике при ведении пациентов, перенесших ЧМТ, крайне важна полная и точная диагностика, затрагивающая как нейровизуализационные методы (магнитно-резонансная томография, компьютерная томография, позитронно-эмиссионная томография), так и нейрофизиологические (электроэнцефалография (ЭЭГ) и метод вызванных потенциалов) [9]. ЭЭГ позволяет определить нарушения при легкой ЧМТ, когда незаметны морфологические нарушения, предсказать исход для больных в состоянии комы и подходит для обследования детей [10]. Данный метод отличается простотой, неинвазивностью и позволяет оценивать течение заболевания в динамике. В экспериментальных исследованиях на лабораторных животных более распространен метод регистрации биологической активности мозга непосредственно “с коры” – электрокортикография (ЭКоГ) [11–13].
Математический анализ ЭЭГ/ЭКоГ позволяет получить и оценить различные электрофизиологические параметры мозга. Одним из ведущих методов является корреляционный анализ ЭЭГ, который применялся еще для анализа первых бумажных ЭЭГ, когда расчеты проводились вручную. Он включает в себе автокорреляцию (анализ взаимосвязи участков одного сигнала) и кросскорреляцию (анализ взаимосвязи разных сигналов). Кросскорреляционная функция отражает степень связи процессов в разных точках мозга путем выделения периодических составляющих, общих для двух ЭЭГ. Степень корреляции выражается коэффициентом корреляции в диапазоне от –1 (ЭЭГ противофазны) до +1 (ЭЭГ идентичны) [14]. С развитием компьютерной техники корреляционный анализ ЭЭГ значительно потеснил когерентный анализ, который позволяет определить степень схожести колебательных электрофизиологических процессов двух или более участков головного мозга [15]. Коэффициенты корреляции и когерентности меняют свои значения при различной патологии (например, болезнь Альцгеймера, депрессия, ЧМТ) и могут опосредованно характеризовать умственные способности [16]. Это позволяет использовать корреляционный и когерентный анализ как для диагностики ЧМТ, так и для прогнозирования ее течения, а также для оценки влияния различных лекарственных препаратов на динамику заболевания. Мы предполагаем, что корреляционный и когерентный анализ на экспериментальной модели ЧМТ у крыс может быть использован для выявления потенциального нейропротекторного эффекта новых лекарственных средств на доклиническом этапе исследований. Однако для проверки данной гипотезы необходимо предварительно определить, насколько значения параметров кросскорреляции и когерентности ЭКоГ могут свидетельствовать об органических поражениях головного мозга у крыс с ЧМТ. Кроме того, необходимо оценить, являются ли эти изменения аналогичными тем, что наблюдают у пациентов в клинической практике.
В связи с вышесказанным, целью данной работы было определение характерных изменений параметров кросскорреляции и когерентности электрокортикограмм крыс, перенесших ЧМТ, по сравнению с условно здоровыми животными в рамках пилотного эксперимента.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование проводили в соответствии с принципами Базельской декларации, Приказом Минздрава РФ от 01.04.16 г. № 199н “Об утверждении правил надлежащей лабораторной практики” и рекомендациями биоэтической комиссии ФГБОУ ВО СПХФУ Минздрава России. Крыс содержали в стандартных условиях вивария на обычном пищевом рационе, со свободным доступом к воде. Все опытные и контрольные животные были взяты из одной партии и прошли карантин в течение 14 сут.
Эксперименты были выполнены на 10-ти белых беспородных крысах самцах массой 250–300 г, полученных из ФГУП ПЛЖ “Рапполово” (Ленинградская область). Каждому животному присваивали свой идентификационный номер и проводили разделение на две группы – условно здоровые (норма) и ЧМТ, путем рандомизации методом случайных чисел. В обеих экспериментальных группах было по 5 животных.
Кортикографические электроды изготавливали из нихромовой проволоки диаметром 0.5 мм (для регистрирующих и референтного электродов) и диаметром 0.16 мм – для заземляющего электрода. Изоляцию осуществляли термоусадочной трубкой, длина регистрирующей (неизолированной) части ≈1 мм. Все электроды объединялись в гнездо на кабель BLS-8 c шагом 2.54 мм.
Для проведения хирургических манипуляций животных предварительно наркотизировали хлоралгидратом (400 мг/кг). Перед проведением операции на глаза животных наносился офтагель (Santen OY, Финляндия) для предотвращения пересыхания роговицы глаз. После подготовки поверхности черепа (удаление мышечно-фасциального слоя, надкостницы и коагуляции кровоточащих участков) просверливали отверстия соответствующих диаметров для электродов и фиксирующих винтов (глубина погружения сверла – до 1 мм). Для предупреждения нагревания головного мозга сверление осуществляли короткими интервалами. Далее у крыс условно здоровой группы осуществляли имплантацию кортикографических электродов и вкручивание фиксирующих винтов в соответствующие отверстия, а у животных второй группы предварительно моделировали черепно-мозговую травму в соответствии с описанной ранее методикой [6, 17]. У животных проводили трепанацию черепа в левой лобной части над зоной сенсомоторной коры. Центр трепанационного отверстия находился на 2.0 мм ростральнее и 1.5 мм медиальнее брегмы. После этого в трепанационное отверстие помещали подвижный стальной поршень диаметром 3 мм с ходом 4 мм, по которому с высоты 10 см ударял скользящий в стальной трубке груз массой 50 г. Высверленную пластину возвращали на место, имплантировали электроды и вкручивали фиксирующие винты. Координаты расположения электродов определяли с помощью стереотаксического атласа мозга крысы Paxinos и Watson [18]. Электроды FP1 и FP2 располагались в области, иннервирующей передние конечности (вторичная двигательная кора, AP = +2.0, ML = 1.5, DV = 1.0), С3 и С4 – иннервирующей задние конечности (первичная двигательная кора, AP = –1.0, ML = 2.0, DV = 1.0), а O1 и O2 – над гиппокампом (первичная соматосенсорная кора, AP = –4.0, ML = 2.0, DV = 1.0) (рис. 1B). Выбор конкретных точек регистрации сигнала обусловлен тем, что дополнительно мы регистрировали и анализировали соматосенсорные вызванные потенциалы у данных животных (электроды FP1, FP2 и C3, C4 при стимуляции срединного и седалищного нервов соответственно), а также гиппокампальную активность при исследовательском поведении (электроды O1 и O2). Референтный электрод устанавливали в носовую кость, заземляющий – под кожу в области шеи. Дополнительную фиксацию конструкций в черепе осуществляли с помощью стоматологической пластмассы Виллакрил С (Zhermack, Италия). После этого ушивали разрез кожи, проводили антисептическую обработку швов и прилежащей области.
Рис. 1.
A – Внешний вид крысы с имплантированными электродами во время записи ЭКоГ. B – схематичное расположение регистрирующих (FP1, FP2, C3, C4, O1 и O2) и референтного (Ref) электродов. C – пример записи электрокортикограммы здоровой крысы в спокойном состоянии. Fig. 1. А – Rat with implanted EEG electrodes during the ECoG recording. B – schematic situation of recording (FP1, FP2, C3, C4, O1 and O2) and reference (Ref) electrodes. C – example of ECoG record in non-injured rat during resting state condition.

После оперативного вмешательства крыс содержали в индивидуальных клетках со свободным доступом к воде и корму в течение всего периода исследования. Состояние животных отслеживали сразу после выхода из наркоза и далее ежедневно утром и вечером, по необходимости обрабатывали швы раствором йода. Во избежание обезвоживания крысам вводили подкожно физиологический раствор в течение первых 3-х дней после операции. Мы осознанно отказались от использования антибиотиков, анальгетиков и противовоспалительных средств, поскольку большинство из них в той или иной степени могут влиять на течение патологических процессов при травматическом поражении головного мозга, тем самым искажая результаты исследования.
Запись кортикографической активности животных осуществляли на 3-и и 7-е cутки после операции с помощью 8-канального энцефалографа Нейрон-Спектр-1 (Нейрософт, Россия) c полосой пропускания 0.5–35 Гц и частотой квантования 500 Гц. Выбор временны́х точек тестирования был обусловлен тем, что представлялось интересным оценить функциональное состояние головного мозга травмированных крыс в острый (3-и сутки) и промежуточный период (7-е сутки) после ЧМТ.
Из полученных 5-минутных кортикограмм отбирали участки записи, во время которых тестируемые животные находились в спокойном бодрствующем состоянии (отсутствие двигательной или исследовательской активности, а также груминга). Далее проводили кросскорреляционный и когерентный анализы, после чего сравнивали результаты двух экспериментальных групп. Длина эпохи анализа – 5 с. Кросскорреляционный анализ включал в себя расчет коэффициента кросскорреляции (Ккр) пар электродов FP1–C3, FP2–C4, C3–O1, C4–O2, FP1–FP2, C3–C4 и O1–O2, а также средней частоты (Гц) и максимального размаха кросскорреляционной функции (ККФ, мкВ). Для этих же пар отведений рассчитывали среднюю мощность когерентности дельта- (0.5–4.0 Гц), тета- (4.0–8.0 Гц), альфа- (8.0–14.0 Гц) и бета-ритмов (низкочастотных, НЧ – 14.0–20.0 Гц и высокочастотных, ВЧ – 20.0–35.0 Гц).
На 7-й день после проведения всех экспериментов животных эвтанизировали углекислым газом. Извлеченный головной мозг фиксировали 10%-ным нейтральным формалином в течение 24-х ч. Для гистологического исследования фиксированный головной мозг вскрывался таким образом, чтобы вертикальный разрез проходил через середину очага травматического повреждения и через соответствующие отделы контрлатерального полушария. Вырезались образцы ткани в виде пластин толщиной 0.2–0.3 см. Полученные образцы ткани подвергали гистологической проводке, пропитыванию и заливке в парафин по общепринятой методике. Из парафиновых блоков при помощи ротационного микротома изготавливали срезы ткани, размещали на предметные стекла, окрашивали гематоксилином и эозином, после чего обезвоживали и заключали под покровные стекла. Гистологические препараты подвергали тотальному сканированию при помощи сканирующей системы для лабораторных исследований с комплектом программ для обработки изображений Pannoramic MIDI (3D Histech Kft, Венгрия).
Статистическую обработку полученных данных проводили с помощью пакета программы GraphPad Prism 7.00. Данные представлены в виде: среднее ± стандартная ошибка среднего. Мы использовали классический вариант кросскорреляционного анализа, базирующийся на вычислении коэффициентов кросскорреляции Пирсона с последующим усреднением полученных результатов [19, 20], несмотря на то, что есть другие подходы к анализу [21], Значимость различий оценивали с помощью непараметрического U-критерия Манна–Уитни. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В результате проведенных экспериментов было установлено, что у условно здоровых крыс имеется высокая степень взаимосвязи ритмически протекающих биоэлектрических процессов между различными отделами коры головного мозга. Наиболее высокий Ккр, т.е. величина, количественно характеризующая величину функциональной связи между двумя любыми отведениями, наблюдался между парами электродов FP1–FP2, C3–C4, O1–O2, FP1–C3 и FP2–C4. В среднем для указанных пар данный показатель варьировал от 0.87 до 0.92 как на 3-и, так и на 7-е сутки после операции. Несколько меньший Ккр был выявлен между парами электродов С3–О1 и С4–O2: от 0.77 до 0.8 (рис. 3B). Аналогичным образом менялась величина средней мощности когерентности дельта-, тета-, альфа- и бета-ритмов – у пар с наименьшим Ккр данный показатель был также меньше. Патоморфологические изменения в зоне повреждения (рис. 2) на 3-и сутки после травмы представлены преимущественно процессами повреждения в виде формирования зоны некроза с выраженным перифокальным отеком, распространенной экссудативной клеточной реакцией и распространенной глиальной реакцией мозговой ткани вокруг фокуса повреждения. На 7-е сутки после травмы отмечено значительное снижение содержания некротического детрита в зоне повреждения, развитие выраженной экссудативной клеточной реакции в ней, уменьшение отека и формирование перифокальной зоны выраженного глиоза мозговой ткани. При этом ткань контрлатерального полушария головного мозга не претерпевала структурных изменений.
Рис. 2.
Патоморфологическая картина очага повреждения головного мозга крыс на 3-и и 7-е сутки после ЧМТ. A – головной мозг здорового полушария травмированного животного на 3-и сутки после травмы; B – головной мозг здорового полушария травмированного животного на 7-е сутки после травмы; C – головной мозг травмированного полушария на 3-и сутки после травмы; D – головной мозг травмированного полушария на 7-е сутки после травмы. Объяснения в тексте. Fig. 2. Pathomorphological picture of brain lesion in rats on the 3rd and 7th day after TBI. A – brain tissue of non-injuried hemisphere on the 3rd day after the trauma; B – brain tissue of non-injuried hemisphere on the 7th day after the trauma; C – brain tissue of traumatized hemisphere on the 3rd day after the trauma; D – brain tissue of traumatized hemisphere on the 7th day after the trauma. Explanations in the text.

Рис. 3.
A – пример графиков кросскорреляционных функций пар электродов FP1-FP2, C3-C3 и O1-O2 условно здоровой (норма) и травмированной (ЧМТ) крыс. B, C, D – коэффициенты кросскорреляции (Ккр), средняя частота ККФ и максимальный размах ККФ пар электродов крыс условно здоровой (норма) и травмированной (ЧМТ) групп на 3-и и 7-е сутки после операции. * – p < 0.05, ** – p < 0.01 – статистически значимое отличие по сравнению с условно здоровой группой. Fig. 3. A – graphs of crosscorrelation functions of pairs FP1-FP2, C3-C3 and O1-O2 of non-injured rat (норма) and rat with TBI (ЧМТ). B, C, D – crosscorrelation function parameters in FP1-C3, FP2-C4, C3-O1, C4-O2, FP1-FP2, C3-C4 и O1-O2 in non-injured and TBI rats on the 3rd and 7th day after the operation. * - p < 0.05, ** – p < 0.01 – significant difference in comparison with non-injured rats.
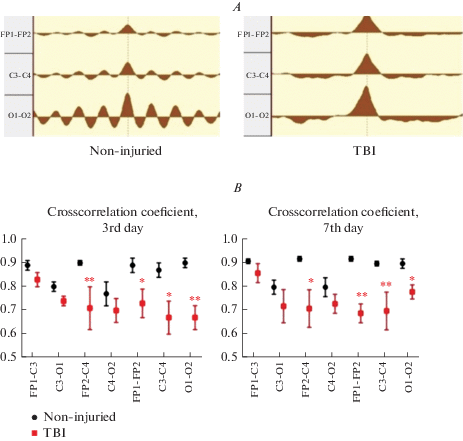
Рис. 3.
Окончание
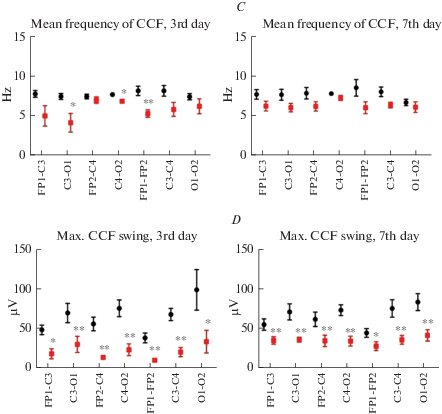
Травматическое повреждение зоны двигательной коры и нижележащих отделов у крыс приводило к статистически значимому снижению Ккр пар электродов FP1–FP2, C3–C4 и O1–O2 (межполушарные связи) в среднем на 33% (p < 0.05 и p< 0.01) на 3-и сутки и на 19% (p < 0.05 и p < 0.01) на 7-е сутки. Также у животных с ЧМТ Ккр у пары С4–О2 был ниже по сравнению с условно здоровыми животными: на 21% (p < 0.01) на 3-й и на 23% (p < 0.05) на 7-й день после травмы (рис. 3A, B). Средняя частота ККФ также отличалась у крыс с ЧМТ: наблюдали уменьшение величины данного показателя в среднем на треть (p < 0.05, p < 0.01) для пар электродов FP1–FP2, C3–O1 и C4–O2 на 3-и сутки с постепенным восстановлением до величины условно здоровых животных к 7-м суткам после травмы (рис. 3C). Другим показателем кросскорреляции, который также изменялся у крыс в результате ЧМТ, был максимальный размах ККФ. У травмированных животных этот показатель был ниже по сравнению с нормой как на 3-и (в среднем на 67% для всех отведений, соответственно p < 0.05 и p < 0.01) и на 7-е сутки (на 45% для всех отведений, p < 0.05 и p < 0.01) после травмы (рис. 3D).
Схожим образом черепно-мозговая травма влияла на когерентности анализируемых ритмов. Например, у группы ЧМТ на 3-и сутки после операции наблюдалось статистически значимое снижение средней мощности когерентности дельта-, тета- и альфа- ритмов на 12% (p < 0.05, p < 0.01) для пар отведений FP1–FP2, C3–C4 и O1–O2 (межполушарные связи). Аналогичные изменения работы межполушарных связей, однако, уже менее выраженные в области травмы, были зафиксированы и в отношении бета-НЧ и ВЧ-ритмов (рис. 4). Средние мощности когерентностей ритмов, характеризующие внутриполушарные связи (FP1–C3, FP2–C4, C3–O1 и C4–O2) также снижались, а наиболее выраженные изменения касались когерентностей дельта-ритмов (рис. 4). Описанные изменения регистрировали у травмированных крыс и на 7-е сутки после операции, при этом наблюдалась тенденция к медленному произвольному восстановлению значений средней мощности когерентностей к значениям нормы (рис. 4).
Рис. 4.
Средние мощности когерентностей пар электродов тестируемых животных (A – условно здоровая группа, B – ЧМТ) на 3-и и 7-е сутки после операции. * p < 0.05, ** p < 0.01 – статистически значимое отличие по сравнению с условно здоровой группой. Fig. 4. Coherence of different pairs of electrodes in tested animals (A – non-injured rats, B – rats with TBI) on the 3rd and the 7th day after the operation. * p < 0.05, ** p < 0.01 – significant difference in comparison with non-injured rats;

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Использованная модель ЧМТ вызывает у крыс повреждение как двигательной коры, так и нижележащих отделов головного мозга, в частности, стриатума и мозолистого тела [22]. На сегодняшний день для экспериментальных моделей ЧМТ нет общепринятого способа классификации тяжести травмы (легкая, средняя, тяжелая), однако, в клинической практике ушиб мозга тяжелой степени (сопровождающийся разрушением мозговой ткани и разрывами мягкой мозговой оболочки) принято рассматривать как тяжелую ЧМТ [23]. Кроме того, ранее было показано, что у крыс с данной моделью травмы возникает тяжелая степень неврологического дефицита, проявляющаяся в выраженном снижении общей двигательной и поисково-исследовательской активности в тесте Открытое поле на 3-и сутки после повреждения [5, 6]. Также у этих крыс наблюдали стойкие двигательные нарушения, выявляемые в тестах Цилиндр, Сужающаяся дорожка, Staircase test и Постановка конечности на опору и на 3-и, и на 7-е сутки после травмы [4–6]. Кроме того, анализ общего белка спинномозговой жидкости показал, что у таких животных имеется выраженное нарушение барьерной функции гематоэнцефалического барьера [6]. Следовательно, на основании проведенных ранее экспериментов можно сделать вывод, что в проведенных исследованиях мы используем модель тяжелой ЧМТ.
В рамках настоящей работы оценивали состояние головного мозга травмированных крыс в острый (3-и сутки) и промежуточный период (7-е сутки) после ЧМТ. Клинически для острого периода характерно выпадение мозговых функций, сопровождающееся нарушением сознания и снижением психической деятельности. Кроме того, церебральный отек, образование детрита, крупно- и мелкоочаговые кровоизлияния, а также нарастание аутоиммунных реакций – типичная патоморфологическая картина данного периода [24].
Промежуточный период характеризуется частичным восстановлением общемозговых функций, хотя такие нарушения как двигательные и статокоординационные все еще могут выявляться. В области очага повреждения обнаруживаются очаговые и диффузные посттравматические процессы с разнонаправленными изменениями вещества головного мозга (регенеративные процессы/фагоцитоз мертвой ткани). Также происходит регрессия церебрального отека [24].
Для используемой нами модели характерно снижение (вплоть до полного отсутствия) общей двигательной активности у травмированных крыс на 3-и сутки после травмы с постепенным восстановлением данного показателя к 7-му дню [6]. Патоморфологически картина очага повреждения у таких животных характеризуется преобладанием процессов альтерации с сохранением в зоне повреждения некротического детрита, выраженного перифокального отека, формированием умеренной экссудативной клеточной реакции и распространенной перифокальной глиальной реакции на 3-и сутки и значительным преобладанием экссудативной клеточной реакции, текущей элиминацией некротического детрита из очага повреждения, снижением выраженности отека и формированием выраженной ограниченной перифокальной глиальной реакции на 7-е сутки после ЧМТ (рис. 2). Мы не анализировали степень церебрального отека на данной модели, однако данные других авторов свидетельствуют, что у крыс он развивается в первые два дня, разрешаясь к пятому–седьмому дню [25]. Таким образом, на данной модели выбранные временные точки тестирования можно рассматривать как острый и подострый период после травмы.
В настоящем исследовании показано, что одностороннее травматическое повреждение зоны двигательной коры и нижележащих отделов у крыс приводит к нарушению межполушарных и внутриполушарных функциональных связей как в области травмы, так и в отдаленных отделах головного мозга. Эти негативные изменения могут быть выявлены посредством кросскорреляционного и когерентного анализов на 3-и и на 7-е сутки после ЧМТ. При проведении кросскорреляционного анализа характерными проявлениями указанных нарушений являются уменьшение коэффициента кросскорреляции и средней частоты ККФ, а также увеличение максимального размаха ККФ пар регистрируемых отведений. Последний параметр является наиболее чувствительным к ЧМТ, поскольку он статистически значимо изменялся у всех пар отведений. Стоит отметить, что средняя частота ККФ может косвенно свидетельствовать о динамике патологических процессов, происходящих в головном мозге после ЧМТ, так как на 7-е сутки данный показатель у травмированных крыс приближался к показателям здоровых животных. Когерентный анализ демонстрирует, что у крыс с ЧМТ снижается средняя мощность когерентности дельта-, тета-, альфа- и бета-ритмов, при этом, когерентности высокочастотных бета-ритмов наименее чувствительны к травматическому воздействию.
Снижение степени кросскорреляции и средней мощности когерентности пар регистрируемых отведений неоднократно было отмечено не только у людей с ЧМТ, но и с другими очаговыми органическими повреждениями головного мозга. Исследования кросскорреляционных функции ЭЭГ при разной локализации очага показали, что в зависимости от зоны поражения мозга устанавливаются различные патологические взаимоотношения между областями коры. Оказалось, что корреляционные связи зоны непосредственного поражения мозга с отдельными участками коры резко снижаются. В то же время в зоне поражения возникают особые патологические корреляции с другими отделами мозга и устанавливаются патологические связи между отдаленными от очага, первично не поврежденными зонами коры [26].
В исследовании Е.В. Шаровой и соавт. было показано, что у людей с посткоматозным бессознательным состоянием, перенесших тяжелую ЧМТ, большинство когерентных связей в основных частотных диапазонах ЭЭГ статистически значимо снижены по сравнению с нормой. Авторы особо подчеркивают факт резкого ослабления межполушарного взаимодействия, варьирующего от 30 до 80% относительно нормы и связывают его не только с непосредственным повреждением лобных долей и комиссуральных трактов, но также и поражением (дисфункцией) регуляторных структур разного уровня [19]. В похожем исследовании А.В. Климаша и соавт. у пациентов наблюдалось снижение когерентности в диапазонах альфа- и бета-ритмов [20].
Таким образом, использованная нами модель ЧМТ вызывает у крыс изменения параметров ККФ и когерентности электрокортикограмм, сходные с наблюдаемыми у пациентов с фокальными повреждениями головного мозга и, в особенности, с тяжелой черепно-мозговой травмой. Это позволяет предположить, что оценку параметров ККФ и когерентности на модели ЧМТ у крыс можно использовать как объективный показатель эффективности проводимой фармакотерапии при изучении потенциальных нейропротекторных средств. Однако в связи с тем, что исследование носит пилотный характер, полученные в рамках данной работы результаты нельзя с достаточной уверенностью транслировать на большие группы животных или людей. Для валидации предлагаемой нами модели необходимо проведение подтверждающих экспериментов с большим количеством крыс в группах. Представленные нами данные могут быть использованы для расчета оптимального объема выборки в больших исследованиях, например, методом анализа мощности или другими методами, основанными на предварительных результатах [27].
Список литературы
Corrigan J.D., Selassie A.W., Orman J.A. The epidemiology of traumatic brain injury. J. Head Trauma Rehabil. 25(2): 72–80. 2010.
Тяжелая черепно-мозговая травма. Клинические рекомендации. Ассоциация нейрохирургов России. 2017. [Traumatic brain injury. Clinical recommendations. Russian neurosurgeons’ association. 2017. (In Russ)].
Потапов А.А., Крылов В.В., Гаврилов А.Г. Кравчук А.Д., Лихтерман Л.Б., Петриков С.С., Талыпов А.Э., Захарова Н.Е., Ошоров А.В., Сычев А.А., Александрова Е.В., Солодов А.А. Рекомендации по диагностике и лечению тяжелой черепно-мозговой травмы. Часть 2. Интенсивная терапия и нейромониторинг. Вопр. нейрохирургии. 1: 98–106. 2016. [Potapov А.А., Krylov V.V, Gavrilov A.G., Kravchuk A.D., Likhterman L.B., Petrikov S.S., Talypov A.E., Zaharova N.E., Oshorov A.V., Sychev A.A., Alexandrova E.V., Solodov A.A. Guidelines for the diagnosis and treatment of severe traumatic brain injury. Part. Intensive care and neuromonitoring. Voprosy neirokhirurgii. Burdenko’s J. Neurosurgery. 1: 98–106. 2016. (In Russ)].
Isaev N.K., Novikova S.V., Stelmashook E.V., Barskov I.V., Silachev D.N., Khaspekov L.G., Skulachev V.P., Zorov D.B. Mitochondria-targeted plastoquinone antioxidant skqr1 decreases trauma-induced neurological deficit in rat. Biochemistry (Moscow). 77(9): 996–999. 2012.
Сысоев Ю.И., Оковитый С.В., Узуегбунам Б. Влияние нового производного диэтиламиноэтанола на выраженность неврологического дефицита у крыс после черепно-мозговой травмы. Биомедицина. 14(2): 95–105. 2018. [Sysoev Yu.I., Okovityi S.V., Uzuegbunam B. The influence of new diethylaminoethanol compound on the neurologic deficit in rats after traumatic brain injury. Biomedicina. 14(2): 95–105. 2018. (In Russ)].
Сысоев Ю.И., Дагаев С.Г., Кубарская Л.Г., Гайкова О.Н., Узуегбунам Б.Ч., Модисе К., Маквана Л.Т., Оковитый С.В. Нейропротекторная активность агониста альфа-2 адренорецепторов мафедина на модели черепно-мозговой травмы у крыс. Биомедицина. 15(1): 62–77. 2019. [Sysoev Yu.I., Dagaev S.G., Kubarskaja L.G., Gaikova O.N., Uzuegbunam B.C., Modise K., Makwana T.L., Okovityi S.V. Neuroprotective activity of alpha-2 adrenoreceptor agonist mafedine in the rat traumatic brain injury model. Biomedicina. 15(1): 62–77. 2019. (In Russ)].
Chen X., Wu S., Chen C., Xie B., Fang Z., Hu W., Chen J., Fu H., He H. Omega-3 polyunsaturated fatty acid supplementation attenuates microglial-induced inflammation by inhibiting the HMGB1/TLR4/NF-κB pathway following experimental traumatic brain injury. J. Neuroinflammation. 14(1): 143. 2017.
Chen S.F., Hsu C.W., Huang W.H., Wang J.Y. Post-injury baicalein improves histological and functional outcomes and reduces inflammatory cytokines after experimental traumatic brain injury. Br. J. Pharmacol. 155(8): 1279–1296. 2008.
Зенков Л.Р. Клиническая электроэнцефалография (с элементами эпилептологии). Руководство для врачей. 8-е изд. М. МЕДпрессинформ. 2017. [Zenkov L.R. Klinicheskaya elektroencefalografiya (s elementami epileptologii). Rukovodstvo dlya vrachej. [Clinical electroencephalography (with elements of epileptology). Guidelines for doctors.] 8th ed. Moscow. MEDpressinform. 2017. (In Russ)].
Карпов С.М., Шарай Е.А. Электроэнцефалографические показатели у детей с разными формами закрытой черепно-мозговой травмы. Пробл. эксперимент. мед. 8(1): 15–17. 2008. [Karpov S.M., Sharay Е.А. Electroencephalographic factors beside children with different forms locked skull-brain trauma. Problemy` e`kspertizy` v medicine. 8(1): 15–17. 2008. (In Russ)].
Авалиани Т.В., Константинов К.В., Сизов В.В., Цикунов С.Г. Особенности пространственно-временной организации биоэлектрической активности мозга у потомства от крыс латерализованной травмой мозга. Рос. физиол. журн. им. И.М. Сеченова. 99 (10): 1149–1159. 2013. [Avaliani T.V., Konstantinov K.V., Sizov V.V., Tsikunov S.G. Features of an existential organization of an bioelectric activity of the brain at posterity from rats with a lateral injury of the brain. Russ. J. Physiol. 99(10): 1149–1159. 2013. (In Russ)].
Калинина Д.С., Вольнова А.Б., Алексеева О.С., Журавин И.А. Электрическая активность неокортекса у взрослых крыс после пренатальной гипоксии и при моделировании эпилепсии. Журн. эволюц. биохимии и физиологии. 52(5): 321–327. 2016. [Kalinina D.S., Alekseeva O.S., Zhuravin I.A., Vol’nova A.B. Electrical activity of the neocortex in adult rats after prenatal hypoxia and in epilepsy model. J. Evol. Biochem. Physiol. 52(5): 321–327. 2016. (In Russ)].
Costecalde T., Aksenova T., Torres-Martinez N., Eliseyev A., Mestais C., Moro C., Benabid A.L. A Long-Term BCI Study With ECoG Recordings in Freely Moving Rats. Neuromodulation. 21(2): 149–159. 2018.
Русинов В.С., Гриндель О.М., Болдырева Г.Н., Вакар Е.М. Биопотенциалы мозга человека. М. Медицина. 1987. [Rusinov V.S., Grindel О.М., Boldyreva G.N., Vakar Е.М. Biopotencialy mozga cheloveka. [Biopotencials of the human brain.] Мoscow. Medicina. 1987. (In Russ)].
Bowyer S.M. Coherence a measure of the brain networks: past and present. Neuropsychiatr. Electrophysiol. 2: 1. 2016.
Thatchera R.W., Northa D., Bivera C. EEG and intelligence: Relations between EEG coherence, EEG phase delay and power. Clin. Neurophysiol. 116(9): 2129–2141. 2005.
Dixon C.E., Clifton G.L., Lighthall J.W., Yaghmai A.A, Hayes R.L. Controlled cortical impact model of traumatic brain injury in the rat. J. Neurosci. Methods. 39(3): 253–262. 1991.
Paxinos G., Watson C. The rat brain in stereotaxic coordinates. 7th edition. Acad. Press. 2013.
Шарова Е.В., Челяпина М.В., Коробкова Е.В., Куликов М.А., Зайцев О.С. ЭЭГ-корреляты восстановления сознания после тяжелой черепно-мозговой травмы. Вопр. нейрохирургии. 1: 14–18. 2014. [Sharova Е.V., Cheljapina М.V., Korobkova Е.V., Kulikov M.A., Zajcev O.S. EEG-correlates of consciousness revovery after severe traumatic brain injury. Vopr. neirokhirurgii. (1): 14–18. 2014. (In Russ)].
Климаш А.В., Цицерошин М.Н., Шеповальников А.Н., Зайцева Л.Г., Кондаков Е.Н., Боровикова В.Н. Нарушения пространственной организации биоэлектрической активности мозга у больных с тяжелой черепно-мозговой травмой при различной выраженности угнетения сознания. Физиология человека. 35(5): 49–65. 2010. [Klimash А.V., Ciceroshin М.N., Shepovalnikov А.N., Zajceva L.G., Kondakov E.N., Borovikova V.N. Disorders of the spatiotemporal organization of the brain’s bioelectrical activity in patients with different depressions of consciousness after severe head injury. Fiziologiya cheloveka. 35(5): 49–65. 2010. (In Russ)].
Трифонов М.И., Панасевич Е.А. Методические аспекты кросскорреляционного анализа ЭЭГ. Рос. физиол. журн. им. И.М. Сеченова. 104(7): 856–871. 2018. [Trifonov M.I. Panasevich E.A. Methodological aspects of cross-correlation analysis of EEG data. Russ. J. Physol. 104(7): 856–871. 2018. (In Russ)].
Сысоев Ю.И., Крошкина К.А., Оковитый С.В. Особенности соматосенсорных вызванных потенциалов у крыс после черепно-мозговой травмы. Рос. физиол. журн. им. И.М. Сеченова. 105(6): 749–760. 2019. [Sysoev Yu.I., Kroshkina К.А., Okovityi S.V. Characteristic of somatosensory evoked potentials in rats after traumatic brain injury. Russ. J. Physol. 105(6): 749–760. 2019. (In Russ)].
Коновалов А.Н., Лихтерман Л.Б., Потапов А.А. Клиническое руководство по черепно-мозговой травме. Т. 1. М. Антидор. 1998. [Konovalov А.N., Lihterman L.B., Potapov А.А. Klinicheskoe rukovodstvo po cherepno-mozgovoj travme. [Traumatic brain injury clinical recommendations.] V. 1. Мoscow. Antidor. 1998. (In Russ)].
Лихтерман Л.Б. Черепно-мозговая травма. Диагностика и лечение. М. ГЭОТАР-Медиа. 2014. [Likhterman L.B. Cherepno-mozgovaya travma. Diagnostika i lechenie. [Traumatic brain injury. Diagnosis and treatment.] Мoscow. GEOTAR-Media. 2014. (In Russ)].
Bareyre F., Wahl F., McIntosh T.K., Stutzmann J.M. Time course of cerebral edema after traumatic brain injury in rats: effects of riluzole and mannitol. J. Neurotrauma. 14(11): 839–849. 1997.
Русинов В.С., Майорчик В.Е., Гриндель О.М. Клиническая электроэнцефалография. М. Медицина. 1973. [Rusinov V.S., Majorchik V.Е., Grindel О.М. Klinicheskaya elektroencefalografiya. [Clinical encephalography.] Мoscow. Medicina. 1973. (In Russ)].
Исламов Р.А. Методология эксперимента с использованием лабораторных животных. Вестник КазНМУ. 1: 489–492. 2016. [Islamov R.A. The methology of the experiment using laboratory animals. KazNMU J. 1: 489–492. 2016. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


