Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 4, стр. 486-503
Ганглиозные клетки с фоновой активностью сетчатки рыб и их возможная функция в оценке зрительной сцены
Е. М. Максимова 1, А. Т. Алипер 1, И. З. Дамянович 1, А. А. Зайчикова 1, 2, П. В. Максимов 1, *
1 Институт проблем передачи информации им. А.А. Харкевича РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: pmaximov@iitp.ru
Поступила в редакцию 31.01.2020
После доработки 17.02.2020
Принята к публикации 17.02.2020
Аннотация
Регистрировали экстраклеточно импульсную фоновую активность одиночных ганглиозных клеток от окончаний их аксонов в тектум оптикум живой обездвиженной рыбы. Размеры рецептивных полей ON- и OFF-элементов с фоновой активностью (ЭФА) составляли 4°–5° и были сопоставимы с таковыми детекторов признаков. Для возникновения импульсного разряда ЭФА необходимо наличие контраста между центром и периферией рецептивного поля. В отсутствие контраста импульсная активность не возникает. Величина реакции монотонно зависела от степени этого контраста. ЭФА как ON-, так и OFF-типа связаны с тремя типами колбочек (L, M, S). Как в центре, так и на периферии рецептивного поля обнаружена цветовая оппонентность, причем центр и периферия рецептивного поля оппонентны по этому признаку. Иными словами, ЭФА являются дважды оппонентными и, следовательно, могут принимать участие в цветоразличении. Совместная работа детекторов признаков и ганглиозных клеток с фоновой активностью, разделенной по ON- и OFF-каналам, представленная ретинотопически, может обеспечить нейроны тектум оптикум необходимой информацией о зрительной сцене для осуществления его функции – контроля внешнего внимания.
Поведение рыб во многом определяется зрением [1]. Врожденные зрительно управляемые формы поведения: фототаксис, оптомоторная реакция, охотничье поведение (prey-catch) и оборонительный рефлекс – избегание (avoidance) наблюдаются уже у четырехдневных мальков и сохраняются во взрослом состоянии [2, 3]. В организации всех этих разных форм поведения участвует тектум оптикум (ТО) – главный первичный зрительный центр рыб [4]. Удаление ТО или определенных его нейронов приводит к устранению или нарушению этих поведенческих реакций [5, 6]. Нейроны ТО имеют дело уже с результатами первичной обработки изображения внешнего мира, формируемого оптикой глаза на матрице фоторецепторов. Эта обработка осуществляется параллельно ансамблями биполярных, горизонтальных, амакриновых клеток и завершается на дендритах ганглиозных клеток (ГК) – выходных нейронах сетчатки. В сетчатке рыб описано два десятка морфофункциональных типов ГК, каждый из которых сформирован специфическими связями его дендрита с входными нейронами [7, 8]. Дендритные мозаики ГК каждого типа полностью покрывают всю поверхность сетчатки на своем уровне стратификации внутреннего синаптического слоя (ВСС) сетчатки, практически не перекрываясь (тайлинг) [9–12]. Так, соответственно количеству морфофункциональных типов ГК уже в сетчатке формируются около двух десятков разных “описаний” картины внешнего мира. Эти “описания” в виде импульсных реакций ГК поступают по зрительным волокнам в 10 первичных зрительных центров [13, 14]. У рыб 98% аксонов ГК приходит в ТО. Аксоны входят в ростральный отдел контралатерального ТО, распределяются ретинотопически и оканчиваются на разных уровнях ретинореципиентного слоя (Stratum Fibrosum et Griseum Superficiale – SFGS), где контактируют с дендритами нейронов собственно ТО [4, 8, 15–18].
Методом микроэлектродной экстраклеточной регистрации от окончаний аксонов ГК в ТО живой рыбы обнаружены реакции тринадцати разных типов детекторов признаков. Это реакции шести типов дирекционально избирательных ГК, или детекторов направления движения; два типа детекторов ориентированных линий (горизонтального и вертикального края); детекторы малого белого и черного пятна; цвето-оппонентные ГК (одного типа из многих, описанных в сетчатке) и ГК ON- и OFF- типов с лабильной фоновой активностью [19–22].
Окончания ГК, детектирующих разные признаки изображения, образуют ретинотопические карты выделяемого ими признака, каждый тип на своем уровне. Оценено и взаиморасположение одиночных источников этих ретинальных реакций друг относительно друга и нейронов собственно ТО [21]. Набор (комплект) из нескольких карт признаков (таких как знак контраста стимула относительно фона, его размер, направление движения, ориентация), расположенных стопкой друг под другом составляют ретино-тектальную карту значимых признаков (saliency map). Считается, что в ТО по карте значимых признаков происходит выбор главного объекта, видимого в поле зрения (pop-out stimulus), и переключение на него внимания [6, 23–28].
Наблюдение за свободно плавающими (и частично обездвиженными) мальками Данио (в возрасте от четырех до двенадцати дней после оплодотворения) дает представление о том, реакции каких специализированных ГК – детекторов признаков, описанных выше, используются в поведении. В охотничьем поведении – это детекторы малых пятен и дирекционально избирательных ГК. Объекты, меньшие 5°, интерпретируются как пищевые, и вызывают охотничье поведение; объекты, превышающие 10°, вызывают реакцию избегания [2, 29]. Реакции детекторов ориентированных линий (вертикального и горизонтального края), вероятно, используются в оптомоторной реакции (Поведение рыбы в оптомоторном барабане – экспериментальный вариант стайного поведения) [30–33].
Для целостного восприятия зрительной сцены животному необходимы сведения не только о потенциальных хищниках и пищевых объектах, которые поставляют детекторы признаков. Освещенность обстановки, равномерность или неоднородность этого освещения, его интенсивность, цвет – важные факторы внешней среды. Такой информации ни дирекционально избирательные ГК, ни детекторы ориентированных линий, ни детекторы пятна, предоставить не могут, так как работают практически по принципу “все или ничего” в широком диапазоне освещенностей вне зависимости от их уровня, реагируя только на “свои” стимулы [22, 34–36]. Более того, детекторы признаков вообще не реагируют на общее изменение освещенности.
Сведения об освещенности могут поставлять в ТО ГК, обладающие некоторым лабильным уровнем фоновой активности. У одних из них он градуально повышается на свету и тормозится затемнением, у других, напротив, усиливается в темноте и тормозится светом [21, 37].
Настоящая работа посвящена изучению свойств OFF- и ON-элементов с фоновой активностью (ЭФА) – структуре рецептивных полей (РП), контрастной чувствительности, связи с разными типами колбочек – для ответа на вопрос о предполагаемой функции этих ГК.
МЕТОДЫ ИССЛЕДОВАНИЯ
Основным объектом исследования был серебряный карась (Carassius gibelio). Опыты ставили также на карпах (Cyprinus carpio), плотве (Rutilus rutilus), окуне (Perca fluviatilis). Проведены опыты на восьми карпах, двадцати девяти карасях, четырех плотвицах и двух окунях. Работа проводилась на компьютеризованной установке собственной оригинальной конструкции, позволяющей предъявлять разнообразные зрительные стимулы и записывать ответные импульсные реакции в разных форматах. Стандартные экспериментальные процедуры, используемые при стимуляции (обмер РП, контрастная чувствительность и др.) оформлены в виде программных инструментов. Установка содержит усилитель переменного тока (полоса пропускания 100 Гц–3.5 кГц), аналого-цифровой преобразователь (частота дискретизации 25 кГц) и систему из трех взаимосвязанных и синхронизированных компьютерных модулей. Она была подробно описана в наших предыдущих работах [38–40]. Результаты опытов и их offline обработка заносились в базу данных. В процессе опыта картину импульсации наблюдали на экране осциллографа С1-73 и прослушивали через громкоговоритель.
Рыбу, обездвиженную тубокурарином (0.3 мг на 100 г массы тела), помещали в естественном положении в аквариум из плексигласа, через прозрачную стенку которого она смотрела правым глазом на экран монитора (LG Flatron 775 FT) стимулирующего компьютера. Расстояние рыбы до экрана было около 30 см. Рыбу перфузировали аэрируемой водой через жабры. Уровень воды в аквариуме поддерживался постоянно на таком уровне, чтобы глаза находились под водой, но вода не заливалась в мозг. В опыте циркулировало примерно 10 л воды. Работали в основном в боковых полях зрения.
Для доступа к зрительным долям тектума у рыбы с левой стороны черепа, контралатерально относительно “рабочего” правого глаза, удаляли теменно-затылочную кость, убирали жировую клетчатку и вскрывали мягкую оболочку мозга. С рыбами обращались в соответствии с директивой European Communities Council от 24 ноября 1986 г. Экспериментальные процедуры были одобрены этическим комитетом ИППИ РАН (Протокол № 1 от 24 апреля 2018 г.).
Ответы ганглиозных клеток регистрировали от окончаний их аксонов в ретинореципиентном слое – stratum fibrosum et griseum superficiale (SFGS) ТО самодельными, заключенными в стекло металлическими платинированными микроэлектродами с платиновой шляпкой диаметром 3–5 мкм и сопротивлением 200–500 кОм на частоте 1 кГц [41]. Под контролем бинокуляра (Olympus SZ51) с помощью микроманипулятора (MP-225, Sutter Instrument) подводили микроэлектрод к интересующей области поверхности тектума согласно ретинотопической проекции [15]. Осторожно погружая микроэлектрод, добивались стабильного одиночного отведения, о чем судили по одинаковой величине импульсов, значительно превышающей шум, и их звучанию. Глубина регистрируемых реакций оценивалась относительно поверхности ТО по показаниям на экране микроманипулятора.
Типичные размеры РП ретинальных элементов обычно составляют единицы градусов, поэтому в ходе опытов не было нужды двигать стимулы по всей поверхности экрана (размером 45° × 35°). Область стимуляции обычно ограничивали квадратом со стороной около 11°. На остальной части экрана поддерживалась неизменная яркость. В экспериментах, описанных в настоящей статье, использовались как ахроматические, так и цветные стимулы (о чем рассказано подробнее в соответствующих разделах статьи).
Измерение рецептивных полей
Положение и размер РП (точнее, его возбудительной части – reactive receptive field) оценивали методом “шахматной доски” (“random checkerboard”). Последовательно в псевдослучайном порядке на экране в пределах квадратной области стимуляции 11° × 11° предъявляли вспыхивающие пятна (квадратные) небольшого размера (1.5°) и записывали величины реакций (количество спайков за стандартное время). Как правило, выбирали 7 × 7 = 49 положений стимулов. При обработке данных зависимость величины ответа от положения стимула в области стимуляции представляли в виде двумерной гауссианы. Для определения ее параметров по полученным экспериментальным данным рассчитывали моменты распределения – математические ожидания, дисперсии и ковариацию. Полученные математические ожидания характеризуют положение найденного центра РП клетки в области стимуляции, а дисперсии и ковариация характеризуют размер и форму возбудительной части РП. Границей возбудительной части РП считали эллипс, являющийся пересечением рассчитанной двумерной гауссианы с плоскостью f = fmax/e, где fmax – максимум гауссовой функции, e ≈ 2.72 – основание натурального логарифма. При этом длины большой и малой осей этого эллипса получаются равными $2\sqrt 2 $ от рассчитанных для гауссианы максимального и минимального среднеквадратических отклонений. За размер возбудительной части РП принимали среднее геометрическое от длин осей этого эллипса. Результаты обработки представляли в виде карты в географической палитре.
Контрастная чувствительность
Для систематического измерения контрастной чувствительности применялся специальный программный инструмент. На фоне некоторой задаваемой экспериментатором яркости в центре РП вперемежку предъявлялись стимулы (движущиеся границы или вспыхивающие пятна) разных яркостей и строились графики зависимости среднего количества импульсов в залпе ГК от яркости стимула [38]. При измерении контрастной чувствительности на периферии РП яркость изменялась сразу по всей периферии (при неизменной яркости в центре РП).
Общие свойства
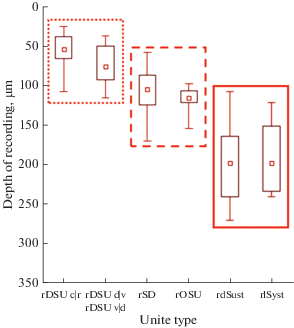
Реакции элементов с фоновой активностью (ЭФА) регистрируются на глубине 190–200 мкм от поверхности, глубже шести типов дирекционально избирательных ГК, двух типов ориентационно избирательных элементов и двух типов детекторов пятна (рис. 1).
Рис. 1.
Три кластера в ретинореципиентном слое ТО, где экстраклетоточно отводятся реакции ГК – детекторов разных признаков от окончаний их аксонов. Применен критерий Краскела–Уоллиса при p < 0.05. Данные представлены в виде медиана ± интерквартильный размах. Прямоугольниками выделены три кластера, между которыми есть статистически значимые различия. Слева – дирекционально избирательные ГК; в центре – детекторы ориентированных линий, детекторы малых пятен; справа – ГК с фоновой активностью (ЭФА) ON- и OFF-типов. Обозначения: rDSU c|r, rDSU d|v, rDSU v|d – ретинальные дирекционально-избирательные элементы каудо-рострального (41 элемент), дорзо-вентрального и вентро-дорзального предпочтительных направлений соответственно (в сумме 25 элементов); rSD – ретинальные детекторы малых пятен (29 элементов); rOSU – ретинальные ориентационно-избирательные элементы (15 элементов); rdSust и rlSust – ЭФА OFF- и ON-типов соответственно (45 и 13 элементов соответственно). Fig. 1. Three clusters in retinorecipient layer of TO; the responses were recorded extracellularly from the axon terminals of retinal ganglion cells (GCs). We used Kruskal-Wallis test with p < 0,05. Data are presented as median ± interquartile range. Three statistically different clusters are indicated by rectangles. From left to right: DSGCs; group formed by OSGCs, spot detectors; sustained GCs (SGCs) of OFF- and ON-types. Designations: rDSU c|r, rDSU v|d, rDSU d|v – retinal direction-selective units of the caudo-rostral (41 unit), ventro-dorsal and dorso-ventral preferred directions, respectively (25 units in total); rSD – retinal spot detectors (29 units); rOSU – retinal orientation-selective units (15 units); rdSust and rlSust – SGCs of OFF- and ON-types (45 and 13 units, respectively).
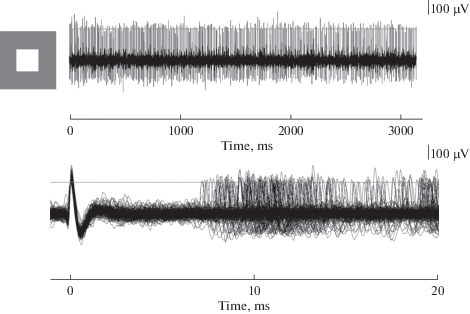
Одни из них активируются в темноте и тормозятся светом (OFF-тип), другие, напротив, активируются на свету и тормозятся затемнением (ON-тип). Как правило, суммарная активность тех и других регистрируется одновременно. При этом на слух, по высоте звука, отчетливо различаются спайки элементов с темновой активностью, звук у которых ниже, чем у элементов со световой активностью. По субъективной оценке на слух не вызывает сомнений то, что фоновая активность, усиливающаяся при посветлении, регистрируется глубже темновой, т.е., что генераторы этой активности – терминали аксонов ГК – располагаются чуть глубже генераторов темновой фоновой активности. Однако по результатам измерений глубины регистрации ЭФА ON- и OFF-типов оказываются в одном кластере (рис. 1). Выделение одиночной (элементарной) реакции ЭФА из общего хора длящейся активности требует определенного навыка и выполнено нами впервые. Показателем одиночности отведения (кроме оценки на слух и одинаковости амплитуды спайков в разряде) служит отсутствие импульсов в период рефрактерности при записи реакции на ждущей развертке (рис. 2).
Рис. 2.
Критерии одиночности экстраклеточного отведения. Сверху – длящаяся импульсная активность ЭФА ON-типа, отмечен порог (250 мкВ) для амплитудной дискриминации; внизу – запись активности на ждущей развертке (наблюдается отсутствие спайков в рефрактерный период). Слева – конфигурация стимула (размер белого пятна составляет 11°). Fig. 2. The criteria of single unit response recorded extracellularly. The maintained response of an USR of ON‑type; the threshold (250 μV) for amplitude discrimination is marked by horizontal line; below – the same discharge represented in spike driven extended sweep. The stimulus configuration (11° white spot) – on the left.
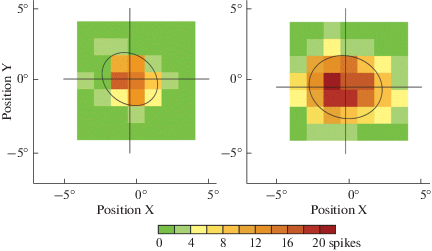
Рецептивные поля элементов с фоновой активностью OFF- и ON-типов
ЭФА реагируют не только на изменение общего освещения, но и на движение границы или пятна в их поле зрения. Реагируют они и на мелькающее пятно небольшого, примерно 1.5°, размера. Это позволяет картировать их рецептивное поле, а точнее его центральную возбудительную область (reactive receptive field), стандартным методом “шахматной доски” (см. “Методы исследования”) (рис. 3).
Рис. 3.
Рецептивные поля ЭФА OFF-типа (слева) и ON-типа (справа), картированные методом “шахматной доски”. Эллипсами обозначены оценки границ возбудительных зон рецептивных полей. Fig. 3. Receptive field (RF) maps of the USRs of OFF- and ON- types (left and right, respectively), measured by the random checkerboard method. Ellipses indicate the estimated borders of the reactive receptive fields. Below is a scale in the geographic palette.
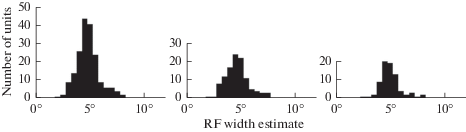
Проведено картирование РП 112 OFF-элементов черными пятнышками на белом фоне и 77 ON-элементов белыми пятнышками на черном фоне. Распределение размеров РП представлено на рис. 4.
Рис. 4.
Гистограммы распределения размеров рецептивных полей 189 ЭФА. Размеры представлены в виде: среднее ± среднеквадратичное отклонение. Слева – суммарная выборка из 189 ЭФА обоих типов (5.0° ± 1.13°), в центре – выборка из 112 темновых ЭФА (OFF-тип) (4.8° ± 1.19°), справа – выборка из 77 световых (ON-тип) (5.2° ± 0.99°). Fig. 4. Histograms of the distribution of USR RFs by size. On the left is the total sample (189 USRs): 5.0° ± 1.13° (mean ± SD); OFF-USRs in the center (112 USRs): 4.8° ± 1.19°; ON USRs on the right (77 USRs): 5.2° ± 0.99°.
Зависимость реакции ЭФА от характера освещения
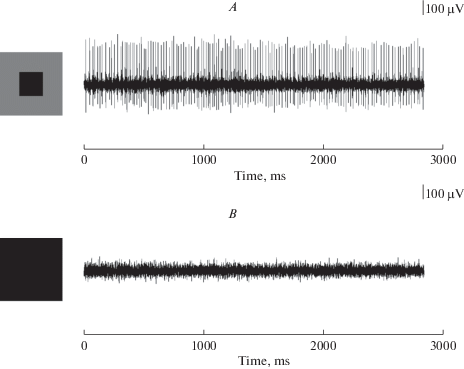
РП большинства ГК имеют центрально-периферическую оппонентную организацию. Затемнение или освещение периферии сказывается обычно на величине центральной реакции ГК, но само по себе не вызывает реакции клетки. Отличительным свойством ЭФА является то, что стимуляция только периферии поля (при неизменном центре) вызывает отчетливую реакцию. Так ЭФА ON-типа реагируют на освещение центра РП и на затемнение периферии. ЭФА OFF-типа отвечают на затемнение центра РП и на осветление периферии. Непременным условием возбуждения ЭФА является наличие контраста центра и периферии РП (рис. 5A, 6A). Самая мощная длящаяся реакция тех и других (ON- и OFF-ЭФА) возникает при условии максимального контраста центра и периферии их РП. Эта импульсация прекращается (или сильно ослабевает), если периферию РП сделать неотличимой по контрасту от центра (рис. 5B, 6B). Неожиданно было впервые увидеть, что на затемнение всего поля зрения (экрана монитора 45° × 35°) отсутствует (или прекращается) реакция ЭФА OFF-типа. Также и ЭФА ON-типа не отвечают на равномерно освещенный экран. Это говорит о том, что процессы возбуждения в центре РП и торможения с периферии так уравновешены, что одновременная однородная стимуляция той и другой областей РП не приводит к генерации импульсного разряда (рис. 5B, 6B).
Рис. 5.
Условие возникновения реакции ЭФА OFF-типа. Вверху (A) – установившаяся импульсная реакция ЭФА OFF-типа при затемненном центре РП и более светлой дальней периферии; внизу (B) – полное торможение реакции этого элемента при затемненной дальней периферии (отсутствии контраста центра и окружения). Слева – конфигурация стимулов. Fig. 5. Maintained spike activity of the OFF-type USR observed when the center of its RF is darker then far surround (above), and absence of the activity when far surround is dark too (in the absence of contrast between the center and the surround). The stimuli configurations are shown on the left.
Появление минимального контраста между центром РП и периферией сразу вызывает ответную реакцию ЭФА. Контрастную чувствительность и зависимость величины реакции от степени контраста стимула и фона в центре РП измеряли двумя способами: движущейся контрастной границей по неизменному фону или мелькающим в центре поля пятном, по размеру близким к размеру центра РП.
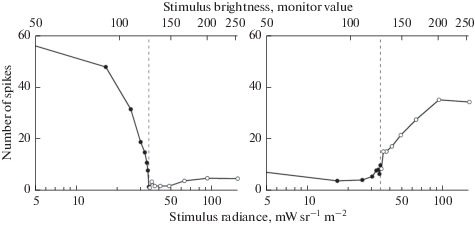
Проведено исследование зависимости величины реакции (количества спайков) от яркости центра и периферии РП. На 114 ЭФА OFF-типа и 60 ЭФА ON-типа произведены измерения контрастной чувствительности при изменяющейся яркости в центре РП и неизменной яркости периферии. На 35 ЭФА OFF-типа и 23 ЭФА ON-типа проведены измерения при изменяющейся яркости периферии и неизменной яркости в центре РП. Рис. 7 иллюстрирует результаты такого опыта на ЭФА OFF-типа.
Рис. 6.
Условие возникновения реакции ЭФА ON-типа. Вверху (A) – установившаяся импульсная реакция ЭФА ON-типа при светлом центре РП и более темной дальней периферии; внизу (B) – значительно сниженная импульсная активность при освещенной дальней периферии РП (отсутствии контраста центра и окружения). Слева – конфигурация стимулов. Fig. 6. Maintained spike activity of the ON-type USR observed when the center of its RF is brighter then far surround; significantly reduced spike activity in the absence of contrast between the center and its surround. Other conventions are the same as on the previous figure.
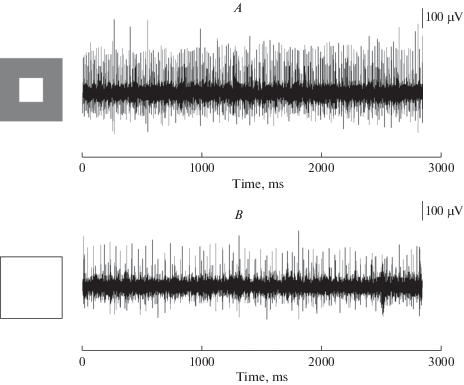
Рис. 7.
Зависимости реакций ЭФА OFF-типа от контраста стимула и фона в центре РП и от контраста центра и окружения. Слева – реакция на вспыхивающее в центре РП пятно размером 11°. По оси абсцисс – яркость стимула (в мониторных и энергетических величинах), по оси ординат – число импульсов в ответе клетки за время вспышки (700 мс). Вертикальной штриховой линией обозначена яркость фона. Справа – реакция на изменение яркости далекого окружения (60 × 40 угловых градусов) при отсутствии изменений в центральной области (серое пятно размером 11°). По оси абсцисс – яркость далекого окружения (в мониторных и энергетических величинах), по оси ординат – число импульсов в ответе клетки за время вспышки дальней периферии (700 мс). Вертикальной штриховой линией обозначена яркость центрального пятна. Fig. 7. Dependences of the responses of the OFF-type USR on the contrast of the stimulus and the background in the center of the RF and on the contrast of the center and surround. On the left is a response to a big spot (11°) flashing in the center of the RF on the grey background. On the abscissa axis is the stimulus brightness (in monitor and energy values), on the ordinate axis is the number of spikes in the unit discharge during the flash (700 ms). The vertical dashed line indicates the brightness of the background. On the right is the response to a change in the brightness of the far surround (60 × 40 angular degrees) in the absence of changes in the center of the RF (gray spot 11° in size). On the abscissa axis is the brightness of the far surround (in monitor and energy values), on the ordinate axis is the number of spikes in the unit discharge during the flash of the far periphery (700 ms). The vertical dashed line indicates the brightness of the central spot.
Иногда при одном положении электрода можно зарегистрировать одновременно одиночные реакции ON- и OFF-ЭФА [21]. Положения РП таких элементов практически совпадают. Можно думать, что такая пара ГК конвергирует на один тектальный нейрон, который по соотношению мощности импульсации этих элементов составляет свое представление об освещении в данной области пространства.
У рыб четырех видов наблюдается совпадение таких характеристик исследованных клеток, как размеры РП, зависимость мощности реакции от интенсивности стимула в центре РП и зависимости реакции от контраста периферии и центра РП.
Цветовые свойства ЭФА ON- и OFF-типов
Рыбы в поведении демонстрируют хорошее цветное зрение [42]. В сетчатке взрослых карасей и карпов имеется три типа колбочек с максимумами чувствительности 623, 535, и 454 нм [43–45]. Богатый набор цветооппонентных клеток в сетчатке (биполяров, горизонтальных и ганглиозных клеток) свидетельствует о соответствующей обработке сигналов от колбочек разных типов [46–53]. В то же время показано, что многие типы ганглиозных клеток, проецирующиеся в ТО, будучи связаны со всеми тремя типами колбочек, не обладают цветоразличительными способностями и демонстрируют принцип унивариантности [54–56]. Мы постарались выяснить, каковы цветовые свойства ЭФА. В свете гипотезы о том, что они формируют представление об освещенности обстановки, цветоразличение было бы весьма полезно.
Кривые спектральной чувствительности колбочек (L – длинноволновых, M – средневолновых, S – коротковолновых) перекрываются. Вследствие этого возбудить отдельные типы колбочек насыщенными узкополосными спектральными стимулами от темноты невозможно. Можно, однако, от некоторого общего уровня возбуждения добавить или убавить возбуждение одного выбранного типа колбочек (или двух). Такие инкрементные (+) и декрементные (–) стимулы были рассчитаны для L, M, и S колбочек карася, исходя из возможностей монитора (LG Flatron 775FT) [55, 56]. Исследование цветовых свойств ЭФА при помощи селективной стимуляции каждого из трех типов (L, M, S) колбочек проведено на 176 элементах ЭФА OFF-типа и на 59 элементах ЭФА ON-типа. (Цветовые свойства ЭФА мы изучали только на двух видах – карасе и карпе, т.к. кривые спектральной чувствительности колбочек окуня и плотвы в точности неизвестны).
С помощью этих стимулов показано, что и темновые, и световые ЭФА связаны со всеми тремя типами колбочек, причем не единообразно. У темновых ЭФА выделено три основных типа связей: 1) длящаяся реакция вызывается стимулами (L+ −, M−, S+); 2) другие реагируют на стимулы (L−, M+ −, S+); 3) третьи – на стимулы (L+ −, M+ −, S+ −).
То, что уменьшение возбуждения любого типа колбочек (декрементные стимулы) вызывает реакцию в ЭФА OFF-типа ожидаемо и нормально. Но наличие ON-реакции на увеличение возбуждения по какому-либо из каналов (L, M, S) в ЭФА OFF-типа кажется парадоксальным (рис. 8).
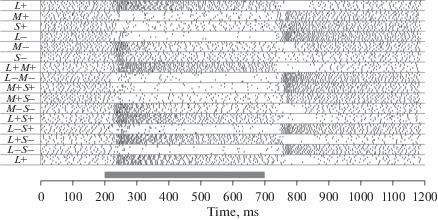
Рис. 8.
Растровое представление реакций ЭФА OFF-типа на цветные селективные стимулы, включаемые в центре РП при неизменной серой периферии. Серая полоса обозначает время действия стимула. Каждый стимул предъявлялся шесть раз. Цвета селективных инкрементных (+) и декрементных (−) стимулов представлены буквами, соответствующими типу возбуждаемых ими колбочек. Обратите внимание на парадоксальную реакцию на включение L+ стимула. Fig. 8. Raster plot of OFF-type USR responses to central flashes of selective colors on the grey background. Grey bar indicates the stimulus presentation time. Each stimulus is presented six times. Selective increment (+) and decrement (−) stimuli are marked by letters, corresponding to the cones which they excite. Please pay attention to the paradoxical response of the OFF-unit to the L + stimulus.
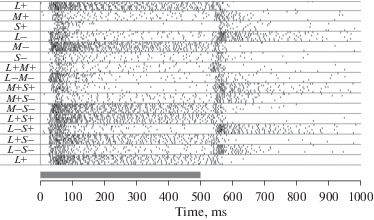
При помощи стимулов, предъявляемых в центре РП, возбуждающих различные типы колбочек попарно, обнаружено тормозное и (в редких случаях) усилительное взаимодействие сигналов от разных типов колбочек. Реакция на совместное возбуждение стимулом (L+M+) была всегда меньше, чем реакции на каждый из стимулов (L+ и M+) в отдельности. Даже в том случае, когда реакция на стимул M+ отсутствовала, а на L+ была большая, реакция на стимул (L+M+) была меньше, чем на L+, а то и совсем исчезала (рис. 8). С учетом этих оппонентных взаимодействий между входами становится объяснимо, что при ахроматических стимулах одновременное увеличение возбуждения всех трех входов (L+M+S+) не вызывает реакции темновых ЭФА. Сложные взаимодействия цветовых каналов (в частности, оппонентное взаимодействие между L и M каналами при инкрементной стимуляции этих каналов и усилительное при декрементной) невозможны в унистратифицированных OFF ГК.
Световые ЭФА также разнообразны по признаку зависимости величины реакции от селективного возбуждения L, M, S колбочек. Обычно это реакции на инкрементный стимул для L и декрементные стимулы для М и S колбочек (L+, M−, S−) (рис. 9). Иногда отмечалась и реакция на декрементный стимул для L-колбочек. Наличие достаточно выраженной реакции ЭФА ON-типа на уменьшение возбуждения по каждому из трех типов колбочек (L, M, S) остается парадоксальным (рис. 9).
Рис. 9.
Растровое представление реакций ЭФА ON-типа на цветные селективные стимулы, включаемые в центре РП. Наблюдается незначительная фоновая активность до предъявления стимула. Обозначения как на рис. 8. Fig. 9. Raster plot of USR of ON-type responses to selective color stimuli flashing on the grey background in the center of the RF. Slight sustained activity can be seen before the presentation of the stimulus. Other conventions are the same as on the Fig. 8.
С учетом этих оппонентных взаимодействий между входами становится объяснимо, что при ахроматических стимулах одновременное увеличение возбуждения всех трех входов (L+M+S+) не вызывает реакции темновых ЭФА, а уменьшение возбуждения по всем трем типам колбочек (L, M, S) не вызывает реакции ЭФА ON-типа (у некоторых ЭФА ON-типа наблюдается сниженная фоновая активность в отсутствие контраста центра и периферии РП). Темновые и световые ЭФА при ахроматической стимуляции выглядят как OFF- и ON-элементы (соответственно) и представлялись нам ранее как ганглиозные клетки, унистратифицированные во внутреннем синаптическом слое (ВСС) сетчатки, получающие входные сигналы, темновые – от OFF-типа, световые – от ON-типа биполяров, в соответствующих стратах ВСС. Обнаруженные в данной работе сложные взаимодействия цветовых каналов в реакциях ЭФА затрудняют такое толкование [57].
Наличие цветовой оппонентности и взаимодействий цветовых каналов, выявленных в реакциях в центре РП ЭФА ON- и OFF-типов говорит о возможном участии этих ГК в цветоразличении.
Оппонентность центра и периферии
Как уже говорилось, гомогенное освещение (или затемнение) большой области экрана тормозит спонтанную импульсацию как темновых, так и световых ЭФА. Включение тех же цветных стимулов, которыми исследовали центральную часть РП, на всей периферии РП восстанавливает длящуюся активность. Причем эта реакция, вызванная стимуляцией периферии РП, оппонентна той, которую вызывали эти стимулы в центре. Это хорошо видно на рис. 10.
Рис. 10.
Цветовая оппонентность в центре и на периферии РП ЭФА OFF-типа. Слева – растровое представление ответов элемента на цветные селективные стимулы, включаемые в центре РП при неизменной периферии. Справа – растровое представление ответов элемента на селективные изменения цвета на всей периферии при неизменном центре. Обозначения как на рис. 8. Fig. 10. Color opponency in the center and on the periphery of the RF of an OFF-type USR. On the left – raster plot of central responses of the unit to the selective color stimuli. On the right – raster plot of unit responses to surround flashes of selective colors with unchanged gray color in the center. Other conventions are the same as in Fig. 8.
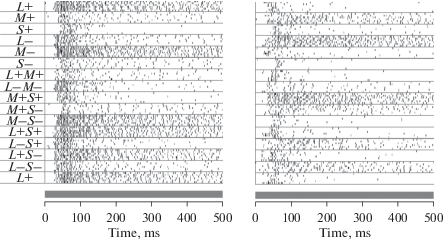
В колонке слева растровая запись темнового ЭФА (того же, что и на рис. 8), в колонке справа – реакция этого же элемента на возбуждение периферии его РП теми же стимулами. Аналогичную картину мы видим и на рис. 11, где представлены реакции светового ЭФА на возбуждение центра и периферии его РП. У этого светового ЭФА (того же, что на рис. 9) гомогенное освещение не полностью затормаживало длящуюся активность. Предъявление стимула (L+) в центре РП вызывало повышение уровня этой активности, а на периферии РП существенно ее тормозило. Такие же противоположные (оппонентные) эффекты наблюдаются для всех без исключения стимулов. Таким образом, ЭФА и ON- и OFF-типов являются дважды оппонентными цветными клетками.
Рис. 11.
Цветовая оппонентность в центре и на периферии РП ЭФА ON-типа. Слева – растровое представление ответов элемента на цветные селективные стимулы, включаемые в центре РП при неизменной периферии. Справа – растровое представление ответов элемента на селективные изменения цвета на всей периферии при неизменном центре. Обозначения как на рис. 8. Fig. 11. Color opponency in the center and on the periphery of the RF of an ON-type USR. On the left – raster plot of central responses of the unit to the selective color stimuli. On the right – raster plot of unit responses to surround flashes of selective colors with unchanged gray color in the center. Other conventions are the same as in Fig. 8.

По нашим представлениям оппонентное влияние далекого окружения на реакцию ЭФА обеспечивается с помощью горизонтальных клеток. В сетчатке рыб существует три типа колбочковых горизонтальных клеток. Горизонтальные клетки каждого типа по преимуществу связаны с одним из типов колбочек. Объединенные в независимые электрические синцитии щелевыми контактами эти горизонтальные клетки передают сигнал о возбуждении колбочек на далекие расстояния. Посредством обратной связи с горизонтальных клеток на колбочки и осуществляется оппонентность центра и периферия РП ГК [58–60].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Мы регулярно регистрировали глубоко в ретинореципиентном слое ТО у рыб четырех видов ЭФА ON- и OFF-типов. Наблюдается полное совпадение таких характеристик исследованных клеток, как размеры РП, зависимость мощности реакции от интенсивности стимула в центре РП и зависимость реакции от контраста периферии и центра РП. Во многих отношениях эти элементы выглядят как позитив и негатив.
ЭФА были отмечены ранее в ТО и у других видов рыб [19, 20]. Длящаяся активность, усиливающаяся при потемнении, описана и у лягушки Rana pipiens в глубоких слоях ТО [61]. ГК двух типов с фоновой активностью (maintained activity) с аналогичными свойствами описаны и в сетчатке мыши. Это альфа-OFF и альфа-ON ГК. Куда, в какие первичные зрительные центры проецируются эти ГК неизвестно, т.к. работы проводились на изолированной сетчатке [62, 63].
Темновые и световые ЭФА у рыб при ахроматической стимуляции выглядят как OFF- и ON-элементы (соответственно) и ранее представлялись нам тоже (как и у мыши) как ГК, унистратифицированные в OFF- и ON- подпластинах ВСС сетчатки, получающие входные сигналы, темновые – от биполяров OFF-типа, световые – от биполяров ON-типа в соответствующих стратах ВСС. Однако парадоксальные свойства, касающиеся характера связи этих ГК с колбочками разных типов, обнаруженные в данной работе, противоречат такому представлению. Была предложена эмпирическая модель организации коннектомов ЭФА [57]. Это бистратифицированные ГК, возбуждение на которые передается от биполярных клеток ON- и OFF-типов, у каждого из которых присутствуют связи со всеми тремя типами колбочек посредством разных типов синапсов (ионо- и метаботропных). Вопрос о морфологическом субстрате ЭФА обоих типов не может быть решен экспериментально нашей методикой, он требует дальнейшего исследования.
Интересно отметить, что у цветокодирующих ON-элементов лягушки, проецирующихся в ядро Беллончи, тоже наблюдается парадоксальная реакция на уменьшение света при введении синего фильтра в стимулирующий пучок белого света [64]. Это напоминает реакции ЭФА ON-типа карася на декрементный стимул (M−), уменьшающий возбуждения средневолново-чувствительных колбочек.
Одно несомненно, что темновые и световые ЭФА являются дважды оппонентными по цвету ГК. Наличие такого рода нейронов в каком-либо отделе зрительной системы является признаком наличия у животного цветного зрения [65].
ЭФА, изучаемые в настоящей работе, отличаются от описанных нами ранее цветооппонентных элементов R/G типа, проецирующихся в ТО рыб [66]. Последние встречаются крайне редко на том же уровне SFGS, что детекторы пятна и детекторы ориентированных линий, и не имеют фоновой активности. ЭФА образуют отчетливо звучащий мощный слой в глубине SFGS и подразделяются на ON- и OFF-типы. Раньше мы предполагали, что у рыб основная информация о цвете из сетчатки поступает не в ТО, но в некое (неизвестное нам) специализированное ядро – аналог ядра Беллончи у лягушки [64]. Теперь мы видим, что в ТО рыб поступают сведения о цвете от трех типов дважды оппонентных ГК, проецирующихся в разные подслои SFGS.
В одном треке микроэлектрода, погружаемого нормально к поверхности ТО, РП последовательно регистрируемых элементов разных типов полностью или частично перекрываются и находятся в пределах (5°) области, т.е. передают сигналы практически об одной и той же площадке фоторецепторов [21].
Принцип обработки изображения в сетчатке универсален и во многом схож у разных животных, далеких как эволюционно (рыбы, амфибии, рептилии, птицы, млекопитающие), так и экологически (хищные и травоядные, водные и наземные). ГК, детектирующие такие признаки видимых объектов, как размер, ориентация, направление и скорость движения, приближение, удаление, цвет, степень контраста относительно фона, описаны в сетчатках нескольких видов рыб, у черепах, мышей, кролика [12, 15, 19, 34, 67–74]. Логично сделать вывод, что детектирование этих признаков изображения является основой для узнавания видимых объектов. ЭФА передают сведения о неравномерном освещении, об изменении его интенсивности и цвете, а детекторы признаков передают сведения о размере, форме, направлении и скорости перемещения объектов на этом фоне.
ТО – главный первичный зрительный центр рыб – обладает полной информацией об окружающей видимой среде. Здесь формируется карта значимых признаков, соотнесенная с картой тела. С участием нейронов ТО и премоторных ядер выделяется главный объект внимания в поле зрения и выбирается тип поведенческой реакции.
ЗАКЛЮЧЕНИЕ
1. Изучены свойства световых и темновых элементов с фоновой активностью (ЭФА), проецируюшихся в ТО рыб. Показана высокая контрастная чувствительность, монотонная (в некоторых пределах) зависимость частоты импульсации от интенсивности освещения центра поля при контрастной ему периферии.
2. Размеры РП ЭФА составляют в среднем 5°, что сопоставимо с таковыми детекторов признаков.
3. Показано, что ЭФА как ON-, так и OFF-типов связаны с тремя типами колбочек.
4. РП ЭФА имеют дважды оппонентную по цвету структуру.
5. Наличие слоя проекций дважды оппонентных по цвету ГК в ТО свидетельствует о существовании цветоразличения на уровне ТО.
6. Представленная ретинотопически, совместная работа детекторов признаков и ЭФА с описанными свойствами, может обеспечить нейроны ТО богатой необходимой информацией о зрительной сцене.
Список литературы
Cronin T.W., Douglas R.H. Seeing and doing: how vision shapes animal behaviour. Phil. Trans. R. Soc. B 369. 2014.
Bianco I.H., Kampff A.R., Engert F. Prey capture behavior evoked by simple visual stimuli in larval zebrafish. Front. Syst. Neurosci. 5: 10. 2011.
Dunn T.W., Gebhardt C., Naumann E.A., Riegler C., Ahrens M.B., Engert F., Del Bene F. Neural circuits underlying visually evoked escapes in larval zebrafish. Neuron. 89: 613–628. 2016.
Northmore D.P.M. The optic tectum. Encyclopedia of fish physiology: From genome to environment. A.P. Farrell (Ed.) 131–142. London. UK: Elsevier. 2011.
Springer A.D., Easter S.S., Agranoff B.W. The role of the optic tectum in various visually mediated behaviors of goldfish. Brain Res. 128: 393–404. 1977.
BarkerA.J., Baier H. Sensorimotor decision making in the zebrafish tectum. Curr. Biol. 25: 2804-2814. 2015.
Mangrum W.I., Dowling J.E., Cohen E.D. A morphological classification of ganglion cells in the zebrafish retina. Visual Neurosci. 19: 767–779. 2002.
Robles E., Filosa A., Baier H. Precise lamination of retinal axons generates multiple parallel input pathways in the tectum. J. Neurosci. 33: 5027–5039. 2013.
Cook J.E., Becker D.L., Kapila R. Independent mosaics of large inner-and outer-stratified ganglion cells in the goldfish retina. J. Comp. Neurol. 318: 355–366. 1992.
Cook J.E., Podugolnikova T.A., Kondrashev S.L. Species-dependent variation in the dendritic stratification of apparently homologous retinal ganglion cell mosaics in two neoteleost fishes. Vision Res. 39: 2615–2631. 1999.
Field G.D., Chichilnisky E.J. Information processing in the primate retina: Circuitry and coding. Annu. Rev. Neurosci. 30: 1–30. 2007.
Masland R.H. The neuronal organization of the retina. Neuron 76: 266–280. 2012.
Johnston J., Lagnado L. What the Fish’s Eye Tells the Fish’s Brain. Neuron 76: 257–259. 2012.
Robles E., Laurell E., Baier H. The retinal projectome reveals brain-area-specific visual representations generated by ganglion cell diversity. Curr. Biol. 24: 2085–2096. 2014.
Jacobson M., Gaze R.M. Types of visual response from single units in the optic tectum and optic nerve of the goldfish. Q. J. Exp. Physiol. 49: 199–209. 1964.
Nikolaou N., Lowe A.S., Walker A.S., Abbas F., Hunter P.R., Thompson I.D., Meyer M.P. Parametric functional maps of visual inputs to the tectum. Neuron. 76: 317–324. 2012.
Kassing V., Engelman G., Kurtz R. Monitoring of single-cell responses in the optic tectum of adult zebrafish with dextrancoupled calcium dyes delivered via local electroporation. PLoS One 8: e62846. 2013.
Preuss S.J., Triverdi C.A., Berg-Maurer C.M., Ryu S., Bollman J.H. Classification of objectsize in retinotectal microcircuits. Curr. Biol. 24: 2376–2385. 2014.
Zenkin G.M., Pigarev I.N. Detector properties of the ganglion cells of the pike retina. Biofizika. 14: 763–772. 1969.
Максимова Е.М., Орлов О.Ю., Диментман А.М. Исследование зрительной системы нескольких видов морских рыб. Вопр. ихтиол. 11: 893–899. 1971. [Maximova E.M., Orlov O.Yu., Dimentman A.M. Investigation of visual system of some marine fishes. Voprocy Ichtiologii 11: 893–899. 1971. (In Russ)].
Aliper A.T., Zaichikova A.A., Damjanović I., Maximov P.V., Kasparson A.A., Gačić Z., Maximova E.M. Updated functional segregation of retinal ganglion cell projections in the tectum of a cyprinid fish – Further elaboration based on microelectrode recordings. Fish Physiol. Biochem. 45: 773–792. 2019.
Maximova E.M., Aliper A.T., Damjanović I., Zaichikova A.A., Maximov P.V. On the organization of receptive fields of retinal spot detectors projecting to the fish tectum: Analogies with the local edge detectors in frogs and mammals. J. Comp. Neurol. 1–13. 2019. https://doi.org/10.1002/cne.24824
Mysore S.P., Knudsen E.I. The role of a midbrain network in competitive stimulus selection. Curr. Opin. Neurobiol. 21: 653–660. 2011.
Krauzli R.J., Lovejoy L.P., Zéno A. Superior colliculus and visual spatial attention. Annu. Rev. Neurosci. 36: 165–182. 2013.
Sridharan D., Schwarz J.S., Knudsen E.I. Selective attention in birds. Curr. Biol. 24: R510–R513. 2014.
Ben-Tov M., Donchin O., Ben-Shahar O., Segev R. Pop-out in visual search of moving targets in the archer fish. Nat. Commun. 6: 1–11. 2015.
Kardamakis A.A., Saitoh K., Grillner S. Tectal microcircuit generating visual selection commands on gaze-controlling neurons. Proc. Natl. Acad. Sci. USA. 112: E1956–E1965. 2015.
Zhaoping L. From the optic tectum to the primary visual cortex: Migration through evolution of the saliency map for exogenous attentional guidance. Curr. Opin. Neurobiol. 40: 94–102. 2016.
Bianco I.H., Engert F. Visuomotor transformations underlying hunting behavior in zebrafish. Curr. Biol. 25: 831–846. 2015.
Neave D.A. The development of visual acuity in larval plaice (Pleuronectes platessa L.) and turbot (Scophthalmus maximus L.). J. Exp. Mar. Biol. Ecol. 78: 167–175. 1984.
Schaerer S., Neumeyer C. Motion detection in goldfish investigated with the optomotor response is color blind". Vision Res. 36: 4025–4034. 1996.
Dobberfuhl A.P., Ullmann J.F.P., Shumway C.A. Visual acuity, environmental complexity, and social organization in African cichlid fishes. Behav. Neurosci. 119: 1648–1655. 2005.
Haug M.F., Biehlmaier O., Mueller K.P., Neuhauss S.C.F. Visual acuity in larval zebrafish: Behavior and histology. Front. Zool. 7: 8. 2010.
Maximov V.V., Maximova E.M., Maximov P.V. Direction selectivity in the goldfish tectum revisited. Ann. N. Y. Acad. Sci. 1048: 198–205. 2005.
Damjanović I., Maximova E.M., Maximov V.V. On the organization of receptive fields of orientation-selective units recorded in the fish tectum. J. Integr. Neurosci. 8: 323–344. 2009.
Maximov V.V., Maximova E.M., Damjanović I., Maximov P.V. Detection and resolution of drifting gratings by motion detectors in the fish retina. J. Integr. Neurosci. 12: 117–143. 2013.
Алипер А.Т. Размеры рецептивных полей спонтанно-активных ганглиозных клеток сетчатки серебряного карася. Сенсорные системы 32: 8-13. 2018. [Aliper A.T. Receptive field sizes of sustained ganglion cells in the goldfish retina. Sensornye Sistemy 32: 8–13. 2018. (In Russ)].
Максимов В.В., Максимова Е.М., Максимов П.В. Классификация дирекционально-избирательных элементов, регистрируемых в тектуме карася. Сенсорные системы 19: 322–335. 2005. [Maximov V.V., Maximova E.M., Maximov P.V. Classification of direction-selective units recorded in the goldfish tectum. Sensornye Sistemy 19: 322–335. 2005. (In Russ)].
Damjanović I., Maximova E.M., Maximov V.V. Receptive field sizes of direction-selective units in the fish tectum. J. Integr. Neurosci. 8: 77–93. 2009.
Maximov P.V., Maximov V.V. A hardware-software complex for electrophysiological studies of the fish visual system. Internat. Symposium “Ivan Djaja’s (Jaen Giaja) Belgrade School of Physiology”. Belgrade. Serbia. Book of Abstracts. 151. 2010.
Gesteland R.C., Howland B., Lettvin J.Y., Pitts W.H. Comments on microelectrodes. Proc. IRE 47: 1856–1862. 1959.
Neumeyer C. Tetrachromatic color vision in goldfish. Evidence from color mixture experiments. J. Comp. Physiol. A 171: 639–649. 1992.
MacNichol E.F. Jr. A unifying presentation of photopigment spectra. Vision Res. 26: 1543–1556. 1986.
Govardovskii V.I., Fyhrquist N., Reuter T., Kuzmin D.G., Donner K. In search of the visual pigment template. Vision Neurosci. 17: 509–28. 2000.
Maximova E.M., Govardovskii V.I., Maximov P.V., Maximov V.V. Spectral sensitivity of direction-selective ganglion cells in the fish retina. Ann. N.Y. Acad. Sci. 1048: 433–434. 2005.
Svaetichin G., MacNichol E.F.Jr. Retinal mechanisms for chromatic and achromatic vision. Ann. N.Y. Acad. Sci. 74: 385–404. 1958.
MacNichol E.F. Jr., Wolbarsht M.L., Wagner H.G. Electrophysiological evidence for a mechanism of color vision in the goldfish. In: Light and Life. McElroy W.D., Glass B. (Eds). 795–814. Baltimore. Johns Hopkins Press. 1961.
MacNichol E.F. Jr. Three-pigment color vision. Sci. Amer. 211: 48–56. 1964.
Orlov O.Yu., Maximova E.M. S-potential sources as excitation pools. Vision Res. 5: 573–582. 1965.
Mitarai G. Chromatic properties of S-potentials in fish. In: The S-potential. Drujan B.D., Laufer M. (Eds). 137–150. New York. Liss. 1982.
Stell W.K., Kretz R., Lightfoot D.O. Horizontal cell conectivity in goldfish. In: The S-potential. Drujan B.D., Laufer M. (Eds). 51–75. New York. Liss. 1982.
Li Y.N., Matsui J.I., Dowling J.E. Specificity of the horizontal cell-photoreceptor connections in the zebrafish (Danio rerio) retina. J. Comp. Neurol. 516: 442–453. 2009.
Meier A., Nelson R., Connaughton V.P. Color Processing in Zebrafish Retina. Front. Cell. Neurosci. 12: 327. 2018.
Maximov V.V., Maximova E.M., Damjanović I., Maximov, P.V. Color properties of the motion detectors projecting to the goldfish tectum: I. A color matching study. J. Integr. Neurosci. 13: 465–484. 2014.
Maximov V.V., Maximova E.M., Damjanović I., Aliper A.T., Maximov P.V. Color properties of the motion detectors projecting to the goldfish tectum: II. Selective stimulation of different chromatic types of cones. J. Integr. Neurosci. 14: 31–52. 2015.
Maximova E.M., Maximov, P.V., Damjanović I., Aliper A.T., Kasparson A.A., Maximov V.V. Color properties of the motion detectors projecting to the goldfish tectum: III. Color-opponent interactions in the receptive field. J. Integr. Neurosci. 14: 441–454. 2015.
Maximov P.V., Aliper A.T., Maximova E.M. Colour-specific responses of the goldfish retinal ganglion cells revealed by cone-isolated visual stimulation. The 25th Symposium of the Internat. Colour Vision Society. Riga, Latvia. Book of Abstracts. 107. 2019.
Бызов А.Л. Горизонтальные клетки ретины как регуляторы синаптической трансмиссии. Физиол. журн. СССР им. И.М. Сеченова. 53: 1115–1123. 1967. [Byzov A.L. Horizontal cells of the retina as regulators of synaptic transmission. Sechenov. Fiziol. Zh. USSR. 53: 1115–1123. 1967. (In Russ)].
Maximova E.M. Effect of intracellular polarization of horizontal cells on the activity of the ganglion cells in the fish retina. Biofizika. 14: 537–544. 1969.
Kamermans M., Vandijk B.W., Spekreijse H. Color opponency in cone-driven horizontal cells in carp retina – aspecific pathways between cones and horizontal cells. J. Gen. Physiol. 97: 819–843. 1991.
Lettvin J.Y., Maturana H.R., McCulloch W.S., Pitts W.H. What frog’s eye tells to the frog’s brain. Proc. IRE 47: 1940–1951. 1959.
Margolis D.J., Detwiler P.B. Different mechanisms generate maintained activity in ON and OFF retinal ganglion cells. J. Neurosci. 27: 5994–6005. 2007.
Krieger B., Qiao M., Rousso D.L., Sanes J.R., Meister M. Four alpha ganglion cell types in mouse retina: Function, structure, and molecular signatures. PLoS ONE 12: e0180091. 2017.
Maximov V., Orlov O., Reuter T. Chromatic properties of the retinal afferents in the thalamus and the tectum of the frog (Rana temporaria). Vision Res. 25: 1037–1049. 1985.
Daw N.W. Goldfish retina: organization for simultaneous color contrast. Science 58: 942–944. 1967.
Maximova E.M., Dimentman A.M., Maximov V.V., Nikolayev P.P., Orlov O.Yu. The physiological mechanisms of colour constancy. Neirofiziologiya. 7: 16–20. 1975.
Cronly-Dillon J.R. Units sensitive to direction of movement in goldfish tectum. Nature. 203: 214–215. 1964.
Liège B., Galand G. Types of single-unit visual responses in the trout’s optic tectum. In: Visual information processing and control of motor activity. Gudikov A. (Ed). 63–65. Publ. House Bulg. Acad. Sci. Sofia. 1971.
Granda A.M., Fulbrook J.E. Classification of turtle retinal ganglion cells. J. Neurophysiol. 62: 723–737. 1989
O'Brien B.J., Isayama T., Berson D.M. Light responses of morphologically identified cat ganglion cells. Investigative Ophthalmology & Visual Science 40: ARVO Abstract 815. 1999.
van Wyk M., Taylor W.R., Vaney D.I. Local edge detectors: A substrate for fine spatial vision at low temporal frequencies in rabbit retina. J. Neurosci. 26: 13250–13263. 2006
Venkataramani S., Taylo W.R. Orientation selectivity in rabbit retinal ganglion cells is mediated by presynaptic inhibition. J. Neurosci. 30: 15664–15676. 2010.
Damjanović I., Maximova E.M., Aliper A.T., Maximov P.V., Maximov V.V. Opposing motion inhibits responses of direction-selective ganglion cells in the fish retina. J. Integr. Neurosci. 14: 53–72. 2015.
Baden T., Berens P., Franke K., Roson M. R., Bethge M., Euler T. The functional diversity of retinal ganglion cells in mouse. Nature. 529: 345–350. 2016.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


