Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 4, стр. 474-485
Разнообразие и адаптивные свойства зрительных пигментов рыб с изменяемой окраской роговицы
С. Л. Кондрашев *
Национальный научный центр морской биологии им. А.В. Жирмунского ДВО РАН
Владивосток, Россия
* E-mail: navodon@rambler.ru
Поступила в редакцию 26.01.2020
После доработки 25.02.2020
Принята к публикации 26.02.2020
Аннотация
В статье описаны свойства зрительных пигментов у нескольких видов рыб, обладающих уникальным физиологическим механизмом изменения окраски роговицы в зависимости от уровня освещенности. С помощью микроспектрофотометрии для бурого терпуга Hexagrammos octogrammus и пяти видов рыб отряда Tetraodontiformes (рыбы-фугу, иглобрюхи и др.) получены спектры поглощения зрительных пигментов и спектральные характеристики роговицы. У всех видов фоторецепторы сетчатки содержали смесь родопсина (A1) и порфиропсина (A2) в разных пропорциях от 0 до 100%. Cмещение спектрального поглощения двойных колбочек в длинноволновую область спектра у рыб-фугу по сравнению с большинством других морских мелководных рыб связано, по-видимому, с наличием желто-оранжевых каротиноидных переменных фильтров роговицы. Эксперименты с колбочками в бесхлорной среде выявили смещение λмакс наружных члеников двойных колбочек в сторону коротких длин волн (ионохромный эффект), что позволяет предположить присутствие одного пигмента LWS-типа у рыб-фугу (λмакс = A2_567 нм) и двух LWS-пигментов у терпуга (λмакс = A2_625 и A1_560 нм).
Сенсорные системы рыб демонстрируют впечатляющее богатство решений, обеспечивающих выживание и эволюционный успех этого класса позвоночных животных. Пресноводные и морские рыбы традиционно используются в качестве многочисленных примеров и экспериментальных моделей при изучении морфо-физиологических и биохимических адаптаций, в том числе и в исследованиях адаптивных свойств зрительной системы на разных уровнях организации [1].
В зрительной системе рыб были обнаружены разнообразные, в том числе – уникальные механизмы, регулирующие количество и спектральный состав света, попадающего на сетчатку глаза [2]. Среди них изменяемая окраска роговицы, впервые описанная у морской рыбы, бурого терпуга Нexagrammos octogrammus [3]. Изменение окраски роговицы обратимо, регулируется уровнем освещенности окружающей среды и в диапазоне от максимальной до максимальной плотности занимает от 1 до 1.5 ч [3, 4]. Оно является следствием миграции желтых и оранжевых каротиноидных пигментов в специализированных хроматофорах, тела которых расположены по периферии роговицы, а длинные отростки перекрывают ее центральную зону [5–8].
Некоторые виды терпуговых (Hexagrammidae) имеют в состоянии световой адаптации, по-видимому, наиболее оптически плотные роговичные фильтры. Кроме того, у одного из них, бурого терпуга, колбочки содержат наиболее длинноволновые зрительные пигменты, известные для морских рыб, содержащие в качестве хромофора 3-дегидроретиналь [9, 10]. Для пигментов терпуга характерно необычное поведение: состав смесей родопсина и порфиропсина в фоторецепторах всех типов способен меняться в зависимости от продолжительности непрерывной световой или темновой адаптации (несколько недель): на свету в сетчатке преобладает порфиропсин (A2), а в темноте – родопсин (A1). Следует отметить, что эти изменения у терпуга противоположны обычно наблюдаемым у других видов рыб [10, 25]. Указанные свойства зрительной системы делают терпугов особо интересными объектами для исследования структуры роговицы, различных аспектов физиологической регуляции роговичных хроматофоров [4, 5, 11, 12], и свойств зрительных пигментов [9, 13].
Скрининг на наличие механизма переменной окраски роговицы среди рыб других семейств выявил его еще у нескольких десятков видов. Наиболее интенсивные желто-оранжевые изменяемые фильтры роговицы (кроме терпугов) имеет ряд представителей семейств Tetraodontidae (рыбы-фугу, иглобрюхи и др.), Stichaeidae и Cottidae [4, 7, 14–18].
Вполне понятно, что цветные фильтры оптики глаза, отрезая существенную коротковолновую часть видимого спектра, неизбежно должны влиять на результирующую спектральную чувствительность фоторецепторов. Ранее мы обнаружили, что чем выше оптическая плотность роговичного фильтра, тем более смещен в длинноволновую область спектра диапазон значений максимумов чувствительности колбочек сетчатки у терпугов [13]. Однако до сих пор неясна принадлежность зрительных пигментов этих рыб к определенному ”молекулярно-генетическому типу” (LWS, RH2, SWS2, SWS1 [19]). Сведения о спектрах зрительных пигментах рыб из отр. Tetraodontiformes, насчитывающего более 400 видов, ограничиваются данными о λмакс у семи тропических видов, без указания на типы хромофоров и опсинов [18, 20]. Расширение списка видов с известными зрительными пигментами представляет интерес для оценки того, насколько отмечаемая “подстройка” роговичного и сетчаточного механизмов универсальна и характерна не только для терпугов, но и для других рыб, а также для понимания того, какие зрительные пигменты в этом задействованы.
Из-за чрезвычайно компактного генома [21] рыбы-фугу и иглобрюхи представляют большой интерес как “модельные” объекты молекулярно-генетических исследований позвоночных животных по многим направлениям, включая физиологию адаптаций и эволюцию зрительных пигментов [22]. Однако их спектральные свойства неизвестны даже у видов, давно введенных в лабораторную аквакультуру (Takifugu rubripes и пресноводные иглобрюхи),
Основной задачей данного исследования было определение спектров поглощения и других свойств зрительных пигментов у морских и пресноводных тетрадонтов (представителей Tetraodontiformes). В связи с тем, что соответствие между молекулярной структурой их опсинов и данными о спектральной чувствительности пока не установлено, мы оценили возможную принадлежность обнаруженных зрительных пигментов к определенным молекулярным типам с помощью сопоставления с некоторыми данными литературы и с помощью ионохромного эффекта – изменения спектра поглощения в среде, лишенной ионов хлора, характерного для пигментов LWS-типа с особой организацией связи между опсином и хромофором [23, 24]. Этот эффект также использовали для получения дополнительных сведений о природе зрительных пигментов бурого терпуга, отличающихся особой длинноволновой чувствительностью [9].
МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были морские и пресноводные рыбы из семейств Tetraodontidae, Monanacanthidae, Hexagrammidae (табл. 1, [26]). Пресноводных аквариумных иглобрюхов Dichotomyctere (Tetraodon) fluviatilis и Pao (Tetraodon) leiurus приобретали в торговой сети. Морских рыб отлавливали в мае–июле в зал. Восток (зал. Петра Великого, Японское море) донными ловушками или ставной сетью. Эксперименты были проведены на рыбах, отловленных не более чем за неделю до опытов, чтобы избежать известного влияния длительного содержания в иных условиях на состав зрительных пигментов [10, 25]. Перед экспериментами морских рыб содержали в ваннах с проточной водой при температуре 10–15°C при освещении светодиодными осветителями СДО-5 (FATO Group, КНР; цветовая температура 6500 K), суточный световой режим 12 : 12. Освещенность (около 6000 лк) контролировали люксметром Ю-116 (Машприборинторг, Москва). Длительная темновая адаптация (в необходимых случаях до одного месяца) достигалась содержанием рыб в ваннах, постоянно закрытых сверху непрозрачным материалом.
Таблица 1.
Максимумы спектров поглощения и хромофорный состав зрительных пигментов фоторецепторов сетчатки бурого терпуга и рыб отр. Tetraodontoidei Table 1. The maximum absorption spectra and the chromophore composition of the visual pigments of the photoreceptors of the retina of brown rasp and fish neg. Tetraodontoidei
| Вид Species |
n | Палочки Rods |
Одиночные колбочки Single cones |
Двойные колбочки Double cones |
|||
|---|---|---|---|---|---|---|---|
| MW | MW_Cl– | LW | LW_Cl– | ||||
| Бурый терпуг Masked greenling Hexagrammos octogrammus |
9 | – | – | 543 (15) 525 & 562 0.4/0.6 |
523 (16) | 582 (18) 560 & 625 0.4/0.6 |
547 (12) |
| Бурый терпуг Hexagrammos octogrammus; После 1 месяца содержания в темноте Masked greenling after 1 month of dark adaptation |
3 | 502 500 & 525 0.85/0.15* |
505 500 & 525 0.7/0.3* |
530 (22) 525 & 562 0.6/0.4 |
520 (21) | 565 (12) 560 & 625 0.8/0.2 |
520 (21) |
| Takifugu xanthopterus | 5 | 502_A1 (33) | 448_A2 (31) | 525 (54) 520 & 555 0.76/0.24 |
525 (11) | 567_A2 (41) | 550 (11) |
| Takifugu rubripes | 2 | 505 (10) 502 & 527 0.78/0.22 |
445 (19) A1_A2-?? |
524 (21) 520 & 555 0.73/0.27 |
– | 567_A2 (19) | – |
| Takifugu chinensis | 1 | 502_A1 (5) | 445_A2 (11) | 523 (15) 520 & 555 0.84/0.16 |
– | 566_A2 (16) | – |
| Thamnaconus modestus | 3 | 495_A1 (4) | 409 (17) A1_A2?? |
486 (16)
478 & 494 0.46/0.54 |
– | 523_A2 (12) | – |
| Dichotomyctere (Teraodon) fluviatilis |
2 | 519_A2 (8) | 463_A2 (8) | 555_A2 (21) | – | 610_A2 (17) | – |
| Pao (Tetraodon) leiurus** | 6 | 530_A2 | 530_A2 | 570_A2 | – | 630_A2 | – |
* [13]. ** [37]. n – число изученных рыб; MW − средневолновый и LW – длинноволновый членики двойных колбочек; MW Cl– и LW Cl– – то же самое в бесхлорной среде. Курсивом выделены максимумы поглощения для смесей пигментов. Сумма двух значений максимума указывает на наличие смеси двух пигментов (родопсина A1 и порфиропсина A2), доли которых приведено ниже; в скобках – количество снятых спектров. Латинские названия видов приводятся по современной номенклатуре [26]. n is the number of fish studied; MW – medium wave and LW – long wave segments of double cones; MW Cl– and LW Cl– are the same in a chlorine-free medium. Italics highlighted absorption maxima for pigment mixtures. The sum of the two maximum values indicates the presence of a mixture of two pigments (rhodopsin A1 and porphyropsin A2), the proportions of which are given below; in parentheses is the number of spectra taken.
Спектры поглощения роговицы
После 5–6 ч световой адаптации рыб обездвиживали, помещая в раствор MS222 (Sigma Co., США), затем декапитировали. Для изготовления препарата роговицы рыб использовали метод, описанный ранее [7]. Роговицу выделяли из глаза, после чего помещали под покровное стекло в нескольких каплях фосфатного буфера. Спектры пропускания на отдельных участках целой роговицы измеряли с помощью спектрометра USB2000+ (Ocean Optics Co.) [13]. Для подведения и отведения света использовали световоды с диаметром 0.6 мм и источник с галогенной лампой HL-2000 этой же фирмы.
Микроспектрофотометрия
Методика микроспектрофотометрического исследования фоторецепторов сетчатки подробно и неоднократно была описана ранее [27, 28]. Для измерений использовали микроспектрофотометр оригинальной конструкции [29] с записью результатов в файлы на персональном компьютере. Регистрировали спектры поглощения наружных сегментов изолированных фоторецепторов (25 рыб, 470 учтенных спектров). Записи обрабатывали с помощью компьютерной программы MSP-PRO, переданной нам ее автором В.И. Говардовским (ИЭФБ РАН, Санкт-Петербург), и принципы работы которой были описаны ранее [27]. Программа аппроксимирует данные измерений в предположении, что результат представляет собой суперпозицию спектров пары пигментов в определенной пропорции, построенных из одного и того же опсина и разных хромофоров – ретиналя (A1) или 3-дегидроретиналя (А2). Таким образом были определены состав зрительных пигментов (А1-родопсины, А2-порфиропсины или их смесь) и средние величины максимумов поглощения (λмакс). Стандартное отклонение λмакс для всех типов фоторецепторов составляло 2–5 нм.
Использовали два вида простых физиологических растворов (pH 7.2–7.4): один – стандартный, содержащий ионы Cl– в форме NaCl в обычной концентрации для морских (0.9%-ный или 170 мM) или пресноводных (0.6%-ный) рыб, а другой – без ионов Cl–, в котором использовалась бидистиллированная вода, и где NaCl был заменен на NaNO3 в той же концентрации (170 мM). Эксперименты с влиянием бесхлорной среды проводили только с сетчаткой морских рыб спустя 1 ч после вымачивания сетчатки в этом растворе при 2–4°С. Поскольку известно, что ионохромный эффект проявляется на зрительных пигментах типа LWS [23, 24], его наличие проверялось только у двойных колбочек, имевших наиболее длинноволновые пигменты. Продолжительность каждого эксперимента с записями спектров не превышала 2 ч, во время которых полностью сохранялась целостность наружных сегментов фоторецепторов.
Условия экспериментов соответствовали правилам работы с животными, установленными Комитетом по этике Национального научного центра морской биологии им. А.В. Жирмунского ДВО РАН.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Спектры поглощения роговицы и фоторецепторов в обычном физиологическом растворе
После содержания рыб на свету в течение 2 ч оптическая плотность роговицы у T. xantopterus, Takifugu chinensis и D. fluviatilis достигала максимально возможных значений от 0.5 до 2 лог. единиц (полная световая адаптация). Пересчет спектров в виде кривой пропускания сглаживает максимумы, характерные для каротиноидов, и показывает, что на ярком свету эти роговицы максимально поглощают свет от 40 до 99% в диапазоне 420–500 нм (рис. 1A, D)
Рис. 1.
Микроспектрофотометрия колбочек и роговиц рыб отряда Tetraodontiformes. Средние значения положения максимумов кривых, состав смесей А1/А2 и количество измерений представлены в таблице. Кривые для пигментов получены после наилучшей аппроксимации стандартными кривыми для A1, A2 или их комбинации (A1 + A2) [27]. А – Рыбы-фугу. Takifugu xanthopterus: короткий штрих – одиночные колбочки, длинный штрих – MW-членик, сплошная линия – LW-членик. Правая ось ординат – пропускание дорсальной части роговицы: пунктир – T. chinensis; штрих-пунктир – T. xanthopterus. B – Двойные колбочки рыбы-фугу T. xanthopterus в нормальном растворе (заливка) и в бесхлорной среде (открытые символы). 1, 3 – LW-членики; 2, 4 – MW-членики. Черные кривые – аппроксимация, серая кривая – сглаживание экспериментальных данных методом скользящей средней. C – Cпинорог Thamnaconus modestus. 1 – LW-членики двойных колбочек; 2 – MW-членики двойных колбочек; 3 – одиночные колбочки. Кривая для 1 – A2, кривая для 2 – комбинация A1/A2. Штриховая кривая для 3 – комбинация 50% A1 + 50% A2. D. Колбочки и роговица иглобрюха Dichotomyctere fluviatilis. Аппроксимация стандартной кривой для порфиропсина: 1 – LW-членики двойных колбочек; 2 – MW членики двойных колбочек; 3 – одиночные колбочки. 4 – пропускание роговицы в состоянии максимальной световой адаптации, относится к правой шкале Y. Fig. 1. MSP data of absorbance spectra of cones and corneas of some species from Tetraodontiformes. Mean λmax value of the pigment mixtures and its components, corresponding A1/A2 ratio of the components and the number of cell measured are presented in the Table. Smooth curves for the pigments are the best fits of the normalized data using templates for A1 and A2 pigments [27]. A – Fugu-fish. Takifugu xanthopterus: short dash – single cones; long dash – MW member of double cones; solid line – LW member of double cones. Right Y-axis—transmittance of the dorsal part of the cornea: dotted line – T. chinensis, dash-dotted – T. xanthopterus. B – Double cones of the puffer T. xanthopterus in normal solution (filled symbols) and Cl-free medium (substitution of NaCl for NaNO3, open symbols). 1, 3 – LW-members, 2, 4 – MW-members. Black curves – template fitting, grey curve – smoothing of the data by the method of running average. C – Filefish Thamnaconus modestus. 1 – LW-members of double cones; 2 – MW-members of double cones; 3 – single cones. Curves for 1 and 2 data – template fits for A2 and A1/A2, correspondingly. Short dash – superposition of templates for 50% A1 + 50% A2. D. Cones and cornea of the pufferfish Dichotomyctere fluviatilis. Best fit by the A2-templates: 1—LW-members of double cones, 2 – MW-members of double cones, 3 – single cones. 4 – corneal transmittance after maximal light adaptation (refer to the right Y-axis).
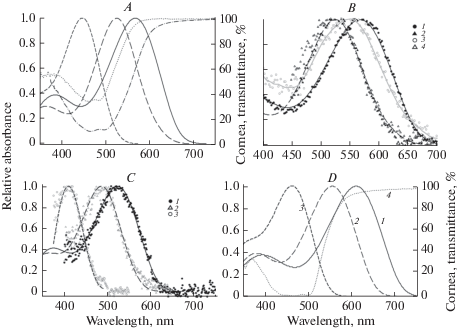
У всех исследованных 6 видов тетрадонтов имеются многочисленные тонкие (диаметром менее 2 мкм) палочки, а также одиночные и двойные колбочки. Три морских вида рода Takifugu (рыбы-фугу) имели почти одинаковый состав пигментов, незначительно различаясь лишь составом смесей родопсина (A1) и порфиропсина (A2), судя по результатам аппроксимации стандартными кривыми (табл. 1; рис. 1А). Данные для одиночных колбочек T. rubripes не удалось трактовать однозначно, поэтому мы приняли для λмакс среднее значение 445 нм между крайними величинами, соответствующими либо родопсину либо порфиропсину (447–442 нм).
Зрительные пигменты спинорога Thamnaconus modestus (Monacanthidae) отличались другой особенностью: все типы фоторецепторов оказались более ”коротковолновыми” по сравнению с найденными у других видов. Наибольшее значение λмакс зрительных пигментов спинорога зафиксировано для одного из члеников двойных колбочек – всего 523 нм (табл. 1; рис. 1С). Пигменты представлены как родопсином (палочки), порфиропсином (длинноволновый, LW – членик двойных колбочек), так и их смесью в средневолновом (MW) членике двойных колбочек. Как и в случае с T. rubripes, для λмакс одиночных колбочек было принято среднее значение 409 нм между крайними величинами для пары родопсина и порфиропсина (406–412 нм).
Два пресноводных вида иглобрюхов имели более красно-чувствительные пигменты по сравнению с другими рыбами отряда (табл. 1). Наибольшие значения λмакс характерны для таиландского иглобрюха Pao (Tetraodon) leiurus, у которого один из компонентов двойных колбочек имеет λмакс = 630 нм. Судя по результатам аппроксимации спектральных данных, все пигменты у этих рыб являются порфиропсинами (тип А2) (рис. 1D).
У T. xanthopterus при использовании бесхлорной среды сдвиг λмакс на 17 нм наблюдали только для LW-членика двойных колбочек (550 нм против 567 нм). Спектр поглощения MW-членика в норме хорошо совпадал с показателями поглощения, измеренными в бесхлорной среде по всему длиноволновому плечу спектра (рис. 1B). Так как все использованные в работе рыбы-фугу имели практически одинаковый набор зрительных пигментов, то опыты с другими видами не проводили.
Ионохромный эффект у бурого терпуга отчетливо проявлялся в том, что λмакс у LW-члеников двойных колбочек смещался в сторону коротких волн на 35 нм (с 582 до 547 нм), а у MW-члеников – на 20 нм (с 543 до 523 нм) (табл. 1, рис. 2А). Такая картина наблюдалась в колбочках летом, когда в сетчатке преобладал порфиропсин [9].
Рис. 2.
Спектры поглощения пигментов в члениках двойных колбочек бурого терпуга Hexagrammos octogrammus. Сплошные и штриховые кривые – результаты аппроксимации стандартными кривыми усредненных данных для LW- и MW-члеников в нормальном растворе. А – Свежевыловленные рыбы из моря, обычные условия содержания. Результаты изменения спектров в бесхлорной среде: 1 – LW-членики, 2 – MW-членики. B – Рыбы через месяц после содержания в темноте в бассейне. Символы на панели (B) соответствуют поглощению, измеренному в бесхлорном растворе в обоих члениках. Fig. 2. Normalized absorbance spectra of visual pigments in LW- and MW-members of doubles cones of greenling, Hexagrammos octogrammus. (A) Fish from the sea. Solid and dashed curves are the results of fitting of mean data for LW- and MW-members, correspondingly. Absorbance in the Cl-free medium: 1 – LW-members, 2 – MW-members. (B) Fish after 1 month of dark adaptation in the water tank. Symbols on panel (B) correspond to equal absorbance in both members of double cones in the Cl-free medium.
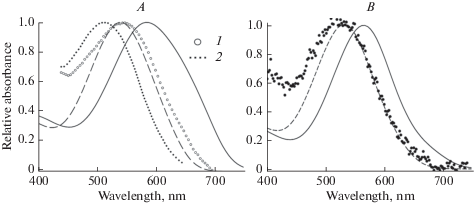
Серия экспериментов с продолжительным содержанием рыб в темноте была направлена на выявление вклада в ионохромный эффект отдельных компонентов, входящих в состав смеси зрительных пигментов. После длительной непрерывной темновой адаптации (до одного месяца) соотношение пигментов в сетчатке изменилось в сторону родопсина (10, табл. 1). В результате, в бесхлорном растворе было обнаружено смещение максимума поглощения LW-членика примерно на 45 нм, а MW-членика на 10 нм (рис. 2B).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Спектральные свойства зрительных пигментов и роговиц
Микроспектрофотометрическое исследование показало, что три близкородственных вида рыб-фугу имеют единообразный состав зрительных пигментов c λмакс = 502–505 нм (палочки), 445 нм (одиночные колбочки) и 524/567 нм (двойные колбочки) (рис. 1А). Значения для палочек и одиночных колбочек вполне соответствуют величинам для большинства прибрежных рыб Японского моря c переменными фильтрами роговицы, изученных нами ранее (503 ± 2, 450 ± 5 нм), но λмакс двойных колбочек у рыб-фугу отличались в большую сторону по сравнению со средними для других рыб (520 ± 5, 553 ± 8 нм) [28]. Почти все зрительные пигменты рыб-фугу являются исключительно порфиропсинами (особенно в колбочках), либо представлены смесью порфиропсина и родопсина в разной пропорции (табл. 1). Наличие А2 хромофора в сетчатке T. rubripes было подтверждено также с помощью хроматографии [30].
Пигментные фильтры роговицы этих рыб в состоянии максимальной плотности лишь частично ограничивают уровень средневолнового излучения. Во всяком случае, “cинечувствительные” одиночные колбочки у этих рыб могут быть функционально значимыми в диапазоне 440–500 нм даже при полной световой адаптации роговичного фильтра. Здесь мы находим аналогию с некоторыми видами терпугов в случаях, когда при неполной световой адаптации плотность роговицы мала [13].
Зрительные пигменты колбочек спинорога Thamnaconus modestus имеют на 35–45 нм меньшие величины λмакс по сравнению с пигментами рыб-фугу (табл. 1, рис. 1C). Это согласуется со свойствами пигментов других видов спинорогов и многих рыб с коралловых рифов, где вода более чистая [18]. Судя по результатам аппроксимации, разные членики двойных колбочек спинорога содержат равное количество порфиропсина. Примечателен коротковолновый спектр поглощения одиночных колбочек у этого вида (λмакс = 409 нм), хотя судить о природе хромофора в них затруднительно. Оптические среды глаза, включая роговицу, у спинорога совершенно бесцветны и, по-видимому, не ограничивают доступ света с длиной волны >400 нм к сетчатке.
Фоторецепторы иглобрюхов содержат чистый порфиропсин (рис. 1D), что типично для многих пресноводных рыб. Обращает на себя внимание большое сходство набора порфиропсинов в колбочках у пресноводного P. leiurus и типичной морской рыбы, бурого терпуга, летом или при длительной адаптации к свету [9]: λмакс = 530 и 525 нм, 570 и 562 нм, 630 и 625 нм соответственно и отсутствие “обычных” для прибрежных морских рыб синечувствительных колбочек с максимумом поглощения около 450 нм. Такое сходство систематически и экологически очень далеких видов можно объяснить наличием очень плотных желто-оранжевых фильтров роговицы, делающих такие фоторецепторы неэффективными при почти полной “блокаде” сине-зеленой части спектра при дневном освещении [9, 13]. Остается неясным, однако, почему в сетчатке близкородственного вида D. fluviatilis имеются колбочки с λмакс = 463 нм, попадающими в область минимального пропускания этого плотно окрашенного фильтра (рис. 1D)? Возможно, это можно объяснить особенностями экологии (выбор местообитания, суточная активность при разных световых условиях и др.) когда пигментный фильтр в роговице находится преимущественно в неполном светоадаптированном состоянии.
Типы зрительных пигментов
Результаты, полученные с помощью ионохромного эффекта, как и микроспектрофотометрические данные, не могут служить окончательных указанием на молекулярный тип зрительных пигментов. Для этого необходимы дополнительные молекулярно-генетические и иммунологические исследования. Способ определения λмакс аппроксимацией стандартными кривыми для пигментов A1 и A2 имеет известные ограничения по точности [27], поэтому более точные сведения о наличии пигментов с разными хромофорами обычно получают с помощью хроматографии [30]. Принятие во внимание только максимума поглощения может привести к ошибкам, так как нередко в одном наружном сегменте содержится смесь нескольких пигментов [31], а спектральные диапазоны для разных молекулярных типов пигментов перекрываются. Например, известны случаи нахождения весьма “коротковолновых” LWS-пигментов (λмакс = 509–516 нм у некоторых млекопитающих [32]; λмакс = 512 нм у японского анчоуса [33]).
Тем не менее в отношении изученных нами объектов можно сделать определенные заключения, сопоставив наши данные с немногочисленными результатами молекулярно-генетических исследований опсинов у тетрадонтов.
Поскольку ионохромное смещение характерно лишь для LWS-пигментов и наблюдалось только у одного членика двойных колбочек T. xantopterus, имеющего в норме λмакс = 567 нм (рис. 1B), то можно полагать, что у фугу имеется всего один пигмент LWS-типа. Так как все виды рыбы-фугу имели практически идентичный набор пигментов, то этот вывод можно отнести и к ним. Это соответствует результатам молекулярно-генетических исследований рыбы-фугу T. rubripes, одного из объектов нашего исследования, у которой показано наличие всего одной копии гена LWS-опсина [22]. Эти же авторы не нашли гена SWS1 ни у рыбы-фугу, ни у иглобрюха Tetraodon nigroviridis, что подтверждается нашими результатами об отсутствии ультрафиолетовых зрительных пигментов. Пигменты MW-членика двойных колбочек c λмакс = A1_520 и A2_555 нм, построенные на одном и том же опсине, очевидно, соответствуют единственному функциональному гену RH2, установленному для фугу и иглобрюха [22].
У бурого терпуга мы имеем более сложное проявление ионохромного эффекта в связи с тем, что колбочки содержат смесь двух пигментов. В отсутствие данных о типах опсинов терпуга мы изначально предполагали, что в каждом из члеников двойных колбочек терпуга пигменты построены на основе одного опсина, но имеют разные хромофоры. Результаты, опубликованные ранее, этому не противоречат [9, 10, 13]. В литературе имеются сведения о ко-экспресии разных молекулярных типов пигментов в одной колбочке: например, у японского анчоуса [10], гуппи и мыши [32]. Однако мы не рассматриваем такую возможность для терпуга ввиду отсутствия в настоящее время надежных молекулярно-генетических данных.
Сдвиг λмакс длинноволнового членика двойных колбочек на 35 нм (рис. 2А) можно объяснить только тем, что применение NaNO3 в бесхлорной среде привело к смещению максимума поглощения каждого из компонентов смеси в коротковолновую сторону (обычно от 18 до 44 нм для разных пигментов [23]). Если бы в этой смеси из двух пигментов был только один LWS-пигмент с λмакс = 625 нм, то при примерно равной доле содержания компонентов (табл. 1) следовало бы ожидать смещение максимума поглощения смеси до значения более чем 560 нм. Однако мы имеем смещенный спектр с максимумом около 540 нм, что указывает на то, что и второй компонент с λмакс = 560 нм также проявляет ионохромные свойства и, следовательно, является пигментом LWS-типа.
Этот вывод дополнительно подтверждается результатами эксперимента после длительного содержания рыбы в темноте (около одного месяца) в параллельной серии экспериментов [10]. В этих условиях в LW-члениках содержался преимущественно пигмент A1_560, что привело к сдвигу максимума поглощения смеси пигментов на 45 нм (рис. 2B).
Менее определенно можно судить о молекулярных типах пигментов в MW-членике двойных колбочек бурого терпуга. Ионохромный сдвиг происходит, но он меньше (20 нм) по сравнению с результатом для LW-члеников. Это можно объяснить тем, что, как было отмечено в предыдущем абзаце, для разных пигментов величина сдвига может различаться. После длительной темновой адаптации, при уменьшении содержания A2_562 в MW-членике до 40% (табл. 1) был зафиксирован еще меньший сдвиг – всего 10 нм, что приближается к точности определения максимума поглощения на спектральной кривой.
При этом экспериментальные данные для LW- и MW-членика в бесхлорной среде неразличимы и практически совпадают с длинноволновым плечом спектральной кривой поглощения для MW-членика в нормальном растворе (рис. 2B).
Если предположить, что в бесхлорной среде максимумы поглощения каждого из пигментов-компонентов смеси в MW-членике сдвигаются, как и в LW-членике, примерно на 40 нм, то следовало бы предположить, что ионохромный сдвиг происходит только для пигмента с λмакс = A2_562 нм. Но это означало бы, что другой компонент смеси принадлежит к другому молекулярному типу. Это возможно, но требует дополнительных весомых доказательств. Таким образом, учитывая довольно противоречивые данные, у нас нет уверенности в том, что какой-либо из зрительных пигментов сетчатки бурого терпуга из MW-членика относится к LWS-типу.
Физиологическая роль фильтров роговицы
Возможная физиологическая роль каротиноидных фильтров роговицы обсуждалась неоднократно, однако до сих пор нет надежных экспериментальных данных, подтверждающих какую-либо из гипотез [16, 34, 35]. Несомненно, что привлечение максимума сведений о свойствах зрительных пигментов и спектральных характеристиках роговицы в сочетании с данными по зрительной экологии многих видов рыб будут способствовать прояснению этой проблемы. Можно предположить, что, как у для терпугов, переменные фильтры роговицы у мелководных дневных представителей тетрадонтов выполняют роль защиты от яркого света [13], в особенности – от влияния ультрафиолета. В то же время у рыб-фугу сдвиг максимумов поглощения пигментов в длинноволновую часть спектра из-за наличия фильтров роговицы, “компенсирующее” потерю общей чувствительности сетчатки, оказалось меньше, чем у терпугов. Оно было выражено только у двойных колбочек, очевидно из-за сравнительно невысокой оптической плотности роговицы.
Присутствие порфиропсина в сетчатке делает более эффективным поглощение длинноволнового излучения, поэтому этот факт считается адаптацией к освоению рыбами пресных и солоноватых водоемов, имещих иной спектр распределения энергии света по сравнению с морем [30]. Таким образом, с одной стороны, наличие порфиропсина в фоторецепторах большинства видов рыб с желто-оранжевыми роговицами [9, 13] можно считать адаптацией к изменению спектрального состава света, попадающего на сетчатку. С другой стороны неясно, какое преимущество могут дать колбочки с порфиропсином при λмакс = 523 нм у спинорога – типичной морской рыбы (рис. 1C)? Интересно отметить, что у 4х других видов спинорогов из того же семейства, обитающих на коралловых рифах, имеется желтая роговица c переменной окраской [14, 16, 18, 20], однако диапазоны значений спектральной чувствительности их колбочек совпадают с положением λмакс колбочек спинорога, описанных нами (λмакс = (398–407) и (476–492)/(510–522) нм против 409 и 486/523 нм). Очевидно, это объясняется близостью систематического положения видов, а также незначительным влиянием фильтров низкой плотности на результирующие эффективные спектры зрительных пигментов. Расчет для спинорога Rhinecanthus aculeatus показал, что роговица лишь слегка модифицирует поглощение, “срезая” в основном бета-полосы спектров зрительных пигментов, и не влияет на способность рыб использовать цветовое зрение в поведенческих опытах [20].
Несмотря на хорошее качество регистрируемых спектров, микроспектрофотометрические данные необходимо в будущем подкрепить с помощью хроматографии и других методов. Если порфиропсины (включая коротковолновые) у морских Tetraodontoidei действительносуществуют, то не есть ли это следствие каких-то более глубоких, родственных (генетических) связей между видами этого отряда, лежащих в основе общих биохимических и физиологических механизмов, адаптивность которых не всегда ясна? Можно надеяться, что эта группа рыб, благодаря уникальным свойствам их генома, будет успешно использоваться в качестве перспективной модели для исследований по эволюции сенсорных систем и физиологии адаптаций [22, 36].
Список литературы
Collin S.P., Davies W.L., Hart N.S., Hunt D.M. The evolution of early vertebrate photoreceptors. Philos. Trans. R. Soc. Lond. B Biol. Sci. 364(1531): 2925–2940. 2009.
Collin S.P. Specialisations of the teleost visual system: adaptive diversity from shallow-water to deep-sea. Acta Physiol. Scand. 161 (Suppl. 638): 5–24. 1997.
Orlov O.Y., Gamburtzeva A.G. Changeable coloration of cornea in the fish Hexagrammos octogrammus. Nature. 263: 405–406. 1976.
Kondrashev S.L., Gnyubkin V.F. The effect of temperature on the light-induced pigment movement in fish corneal chromatophores. Pigment Cell Res. 12: 193–198. 1999.
Гамбурцева А.Г., Орлов О.Ю. Красящие клетки роговицы терпуга. Цитология. 18(6): 676–682. 1976. [Gamburtzeva A.G., Orlov O.Yu. Staining cells of the cornea of greenling. Tsitilogiya. 18(6): 676–682. 1976. (In Russ)].
Орлов О.Ю., Гамбурцева А.Г. Динамика окраски роговицы терпуга. Биофизика. 21(2): 362–365. 1976. [Orlov O.Yu., Gamburtzeva A.G. Dynamics of corneal coloration of greenling. Biofizika. 21(2): 362–365. 1976. (In Russ)].
Гамбурцева А.Г., Гнюбкина В П., Кондрашев С.Л., Орлов О.Ю. Хроматофоры и окраска роговицы рыб Японского моря. Биология моря. 6: 44–51. 1979. [Gamburtseva A.G., Gnyubkina V.P., Kondrashev S.L., Orlov O.Yu. Chromatophores and changeable coloration of cornea of fishes from the Sea of Japan. Biologiya morya. 6: 44–51. 1979. (In Russ)].
Гамбурцева А.Г., Свиткина Т.М., Тинт И.С., Кондрашев С.Л., Сахаров В.Б. Особенности строения поверхности хроматофоров в роговице с переменной окраской у рыб. Цитология. 35(4): 49–53. 1993. [Gamburtzeva A.G., Svitkina T.M., Tint I.S., Kondrashev S.L., Sakharov V.B. Peculiarities of the chromatophore surface structure in the fish cornea with changeable coloration. Tsitologiya. 35(4): 49–53. 1993. (In Russ)].
Kondrashev S.L. Long-wave sensitivity in the masked greenling (Hexagrammos octogrammus), a shallow-water marine fish. Vision Res. 48: 2269–2274. 2008.
Kondrashev S.L., Lamash, N.E. Unusual A1/A2–visual pigment conversion during light/dark adaptation in marine fish. Comp. Biochem. Physiol. Part A. 238: 110560. 2019.
Kondrashev S.L., Khodtsev A.S. Light-dependent and humoral control of pigment transport in corneal chromatophores in marine fishes. Zool. Jb. Physiol. 88: 317–325. 1984.
Гнюбкин В.Ф. Реакции пигментированной роговицы глаза пятнистого терпуга на изменение освещения. Биология моря. 1: 25–32. 1989. [Gnyubkin V.F. Responses of the pigmented cornea of the white-spotted greenling to changes in illumination. Biologiya morya. 1: 25–32. 1989. (In Russ)].
Kondrashev S.L. Spectral sensitivity of photoreceptors and screening function of the eye cornea of greenlings (Hexagrammidae). Russ. J. Mar. Biol. 45: 22–30. 2019.
Kondrashev S.L., Gamburtzeva A.G., Gnjubkina V.P., Orlov O.J., Pam Thi My. Coloration of corneas in fish. A list of species. Vision Res. 26: 287–290. 1986.
Appleby S.J., Muntz W.R.A. Occlusable yellow corneas in Tetraodontidae. J. Exp. Biol. 83: 249–259. 1979.
Siebeck U.E., Marshall N.J. Ocular media transmission of coral reef fish-can coral reef fish see ultraviolet light? Vision Res. 41(2): 133–149. 2001.
Siebeck U.E., Collin S.P., Ghoddusi M., Marshall N.J. Occlusable corneas in toadfishes: light transmission, movement and ultrastructure of pigment during light- and dark-adaptation. J. Exp. Biol. 206: 2177–2190. 2003.
Losey G.S., McFarland W.N., Loew E.R., Zamzow J.P., Nelson P.A., Marshall N.J. Visual biology of Hawaiian coral reef fishes. I. Ocular transmission and visual pigments. Copeia. 3: 433–454. 2003.
Bowmaker J.K. Evolution of vertebrate visual pigments. Vision Res. 48: 2022–2041. 2008.
Pignatelli V., Champ C., Marshall J., Vorobyev M. Double cones are used for colour discrimination in the reef fish, Rhinecanthus aculeatus. Biol. Lett. 6: 537–539. 2010.
Brenner S., Elgar G., Sanford R., Macrae A., Venkatesh B., Aparicio, S. Characterization of the pufferfish (Fugu) genome as a compact model vertebrate genome. Nature. 366: 265–268. 1993.
Neafsey D.E., Hartl D.I. Convergent loss of an anciently duplicated, functionally divergent RH2 opsin gene in the fugu and Tetraodon pufferfish lineages. Gene. 350: 161–171. 2005.
Kleinschmidt J., Harosi F.I. Anion sensitivity and spectral tuning of cone visual pigments in situ. Proc. Natl. Acad. Sci. U S A. 89: 9181–9185. 1992.
Zak P.P., Ostrovsky M.A., Bowmaker J.K. 2001. Ionochromic properties of long-wave-sensitive cones in the goldfish retina: an electrophysiological and microspectrophotometric study. Vision Res. 41: 1755–1763. 2001.
Bridges C.D.B. The rhodopsin-porphyropsin visual system. In: Handbook of sensory physiology. Vol. 7/1. Springer. Berlin. 417–480. 1972.
Eschmeyers catalog of fishes: Genera, Species, References. Fricke R., Eschmeyer W. N. & R. van der Laan. (Eds.). 2019. (http://researcharchive.calacademy.org/research/ichthyology/catalog/fishcatmain.asp). Electronic version accessed 15.01.2020.
Govardovskii V.I., Fyhrquist N., Reuter T., Kuzmin D.G., Donner K. In search of the visual pigment template. Vis. Neurosci. 17(4): 509–528. 2000.
Kondrashev S.L. Spectral sensitivity and visual pigments of retinal photoreceptors in near-shore fishes of the Sea of Japan. Russ. J. Mar. Biol. 36: 443–451. 2010.
Говардовский В.И., Зуева Л.В. Простой высокочувствительный регистрирующий спектрофотометр. Цитология. 30(4): 499–502. 1988. [Govardovskii V.I., Zueva L.V. A simple high-sensitive recording microspectrophotometer. Tsitologiya. 30(4): 499–502. 1988. (In Russ)].
Toyama M., Hironaka M., Yamahama Y., Horiguchi H., Tsukada O., Uto N., Ueno Y., Tokunaga F., Seno K., Hariyama T. Presence of rhodopsin and porphyropsin in the eyes of 164 fishes, representing marine, diadromous, coastal and freshwater species - a qualitative and comparative study. Photochem. Photobiol. 84: 996–1002. 2008.
Isayama T., Makino C.L. Pigment mixtures and other determinants of spectral sensitivity of vertebrate retinal photoreceptors. In: Akutagawa E., Ozaki K. (Eds.). Photoreceptors: Physiology, Types and Abnormalities. Nova Science Publishers. 1–31. 2012.
Yokoyama S., Radlwimmer F.B. The molecular genetics of red and green color vision in mammals. Genetics. 153: 919–932. 1999.
Kondrashev S.L., Miyazaki T., Lamash, N. E., Tsuchiya, T. Three cone opsin genes determine the properties of the visual spectra in the Japanese anchovy Engraulis japonicus (Engraulidae, Teleostei). J. Exp. Biol. 216: 1041–1052. 2013.
Орлов О.Ю. Зрительная система терпуга. Механизмы зрения животных. М. Наука. 180–199. 1978. [Orlov O.Yu. Visual system of greenlings. In: Mekhanizmy zreniya zhivotnykh (Mechanizms of animal’ vision). Moscow. Nauka. 180–199. 1978. (In Russ)].
Heinermann P. H. Yellow intraocular filters in fishes. Exp. Biol. 43: 127–147. 1984.
Yamanoue Y., Miya M., Matsuura K., Katoh M., Sakai H., Nishida M. A new perspective on phylogeny and evolution of tetraodontiform fishes (Pisces: Acanthopterygii) based on whole mitochondrial genome sequences: Basal ecological diversification? BMC Evol. Biol. 8: 212. 2008.
Кондрашев С.Л., Орлов О.Ю., Говардовский В.И. Фоторецепторы сетчатки и переменная окраска роговицы иглобрюха Tetraodon leiurus. Х Всес. совещание эвол. физиол. Ленинград, 28-30 ноября 1990 г. Тезисы докладов. Л. Наука. 71–72. 1990. [Kondrashev S.L., Orlov O.Yu., Govardovskii V.I. Retinal photoreceptors and changeable colouration of the cornea in pufferfish, Tetraodon leiurus. X Vsesoyuznoye soveshchaniye po evolyutsionnoi fiziologii. Leningrad, 28–30 Nov. 1990. Abstracts. Leningrad. Nauka. 71–71. 1990. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


