Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 4, стр. 448-461
Особенности цАМФ-зависимой регулировки каскада фототрансдукции в колбочках
В. С. Ситникова 1, *, Л. А. Астахова 1, М. Л. Фирсов 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: viktoriya_sergeevna_sitnikova@mail.ru
Поступила в редакцию 19.02.2020
После доработки 25.02.2020
Принята к публикации 25.02.2020
Аннотация
Фоторецепторы сетчатки – колбочки и палочки – способны к световой адаптации в широком диапазоне освещенностей за счет комплекса регулирующих механизмов. Среди них наиболее изученными являются кальциевые обратные связи, способные объяснить примерно 50% реальной регулировки светочувствительности. Есть и другие регуляторные механизмы, также способствующие настройке реакции фоторецептора на свет в зависимости от уровня освещенности, в частности, регулирование каскада фототрансдукции в течение суточного ритма. Во время “темной” фазы суточного цикла в фоторецепторах увеличивается уровень цАМФ и повышается чувствительность палочек, что можно считать адаптивным действием. Для колбочек, которые работают при высоких освещенностях, а в сумерках почти утрачивают свой вклад в зрение, увеличение чувствительности в “темную” фазу может не иметь адаптивного значения. В настоящей работе исследовалось, как изменение [цАМФ]in влияет на работу каскада фототрансдукции в колбочках карася. Повышение [цАМФ]in достигалось путем инкубации клеток с активатором аденилатциклазы – форсколином. Показано, что в колбочках форсколин замедляет обе фазы фотоответа – нарастание и выключение. Как следствие, в колбочках, в отличие от палочек, форсколин не увеличивает чувствительность к свету, но почти в два раза уменьшает темновой ток. Таким образом, реакция каскада фототрансдукции колбочки на повышение [цАМФ]in существенно отличается от реакции в палочках. Для колбочек такой эффект [цАМФ]in также может иметь адаптивное значение, но не в форме увеличения чувствительности, а в форме уменьшения метаболической нагрузки на клетки, не функционирующие в “темную” фазу.
Фоторецепторы позвоночных способны к адаптации в очень широком диапазоне интенсивностей. Способность к адаптации обеспечивается целым комплексом регулирующих механизмов, использующих разные медиаторные системы. Исторически первой и наиболее изученной является группа механизмов, регулируемых внутриклеточной концентрацией кальция [1–6]. Источником регулирующего воздействия для всех этих механизмов является изменение баланса входа и выхода кальция через плазматическую мембрану наружного сегмента фоторецептора. Активация фоторецептора светом приводит к частичному или полному закрытию цГМФ-управляемых каналов плазматической мембраны и к уменьшению или прекращению входа в наружный сегмент ионов натрия и кальция, в то время как откачка кальция из цитоплазмы наружу при помощи Na,K/Ca обменника продолжается с прежней скоростью и не зависит от уровня активации фоторецептора светом [7]. Концентрация кальция в цитоплазме уменьшается, вследствие чего а) увеличивается активность родопсинкиназы GRK1 (у палочек) или GRK7 (у колбочек), б) увеличивается активность гуанилатциклазы (ГЦ) retGC1 и retGC2 и в) увеличивается сродство цГМФ-управляемых каналов плазматической мембраны к цГМФ. Во всех трех случаях непосредственными кальциевыми сенсорами являются не родопсинкиназа, гуанилатциклаза и каналы, а специальные белки-посредники – рековерин, GCAP и кальмодулин. В результате работы кальциевой обратной связи фоторецептор быстрее возвращается к пре-стимульному состоянию, а также уменьшается его возбуждение в ответ на последующую стимуляцию, что позволяет ему оставаться в рамках динамического диапазона реакции на свет. Конечный результат всех вышеперечисленных механизмов – ускорение процесса выхода фоторецептора из состояния насыщения и оптимальное сочетание реакции на постоянную и переменную составляющую светового стимула.
Три вышеперечисленных механизма кальциевой обратной связи способны объяснить примерно 50% реальной регулировки чувствительности, происходящей в фоторецепторах в ответ на свет, что свидетельствует о существовании и других регуляторных механизмов. Так, нами показан механизм ускорения выключения активированной светом фосфодиэстеразы (ФДЭ) [8]. Существуют и другие регуляторные механизмы, также способствующие настройке величины реакции фоторецептора на свет в соответствии со средним уровнем освещенности. Эти механизмы работают в существенно более медленной временной шкале, чем вышеописанные. К ним относятся процессы светоиндуцированного транспорта некоторых ключевых белков, участвующих в работе каскада фототрансдукции. Так, при очень высоких уровнях освещенности неизвестный пока механизм запускает транспорт трансдуцина из наружного сегмента во внутренний [9], уменьшая таким образом концентрацию трансдуцина в наружном сегменте и снижая коэффициент усиления каскада фототрансдукции. Другой механизм, также пока не идентифицированный, запускает транспорт аррестина из внутреннего сегмента в наружный, усиливая тем самым способность к выключению остаточной активности родопсина [10].
Регулирование работы каскада необязательно должно включать непосредственную реакцию на уровень светового фона. Так, другие механизмы могут регулировать работу каскада в течение суточного ритма, когда циклические изменения цАМФ в палочковом фоторецепторе ([11, 12], обзор в [13]), приводят к изменению чувствительности каскада фототрансдукции [14]. В указанной работе мы показали, что аппликация 2 мкМ активатора аденилатциклазы (АЦ) форсколина в 2.5 раза увеличивает внутриклеточную концентрацию цАМФ ([цАМФ]in) и в 2 раза увеличивает чувствительность палочки лягушки к свету. Детальный анализ показал, что причинами изменения чувствительности являются изменение базальной активности ФДЭ, а также изменение светоиндуцированной активности ФДЭ и изменение активности ГЦ. Последние два эффекта могли бы быть объяснены регулирующим воздействием концентрации кальция, и действительно, в работе [15] было также показано, что увеличение [цАМФ]in приводит к увеличению в 1.6 раза концентрации кальция в цитоплазме. С другой стороны, в современной модели каскада фототрансдукции нет описания кальций-зависимой регулировки базальной активности ФДЭ, и природа этого эффекта остается неизвестной.
Рост чувствительности палочки в условиях повышенного [цАМФ]in сопровождается также усилением низкочастотной компоненты, так называемого непрерывного темнового шума [16–18], однако общее отношение сигнал/шум увеличивается в два раза и оказывается более благоприятным для детекции одноквантовых ответов. Этот эффект, очевидно, должен способствовать обеспечиваемому палочками зрению в условиях низкой освещенности, в ночную фазу суточного цикла. Механизм, обеспечивающий циклическое изменение [цАМФ]in в фоторецепторных клетках является дофамин-зависимым. В соответствии с общими представлениями циркадные ритмы в сетчатке основаны на реципрокных изменениях внеклеточной концентрации двух нейромедиаторов – дофамина и мелатонина, которые регулируют многочисленные функции во всех клетках сетчатки. При этом мелатонин вырабатывается в фоторецепторах и воздействует на дофаминергические амакриновые клетки, вырабатывающие дофамин (обзоры [19, 20]). Фоторецепторы являются одной из главных мишеней циркадной дофаминовой регуляции, однако эффекты аппликации дофамина на палочки лягушки позволяют предположить, что регуляторный эффект дофамина реализуется не только через изменения [цАМФ]in, но и, возможно, через прямое, цАМФ-независимое регулирование [Ca2+]in [21].
Во время “темной” фазы циркадного цикла в фоторецепторных клетках увеличивается уровень [цАМФ]in и повышается чувствительность палочек, что можно трактовать как полезный адаптивный эффект. Вклад колбочковой системы в обеспечение чувствительности уменьшается с понижением общей освещенности, и после определенной величины исчезает совсем. Отсюда следует, что для колбочек возможное повышение чувствительности в темновую фазу суточного цикла не должно иметь адаптивного значения. С другой стороны, эффект увеличения [цАМФ]in на каскад фототрансдукции в колбочках неизвестен, и нет оснований полагать, что он должен быть идентичен эффекту увеличения [цАМФ]in в палочках. Репертуар элементов каскада фототрансдукции в палочках и колбочках очень близок, однако каждый компонент каскада существует в соответствующей специфической изоформе. Стехиометрическое соотношение между элементами каскада также может сильно отличаться в палочках и колбочках, что в свою очередь выражается в существенных функциональных различиях [22]. Кроме того, было показано, что уровень экспрессии некоторых белков-участников каскада в палочках и колбочках в ходе суточного цикла меняется противоположным образом [23]. Поэтому целью настоящей работы было изучение повышения внутриклеточной концентрации цАМФ на работу каскада фототрансдукции в колбочках. В качестве объекта изучения были выбраны колбочки рыбы Carassius carassius, повышение [цАМФ]in достигалось аппликацией во внеклеточную среду 2 мкМ активатора АЦ, форсколина. Мы выяснили, что в колбочках форсколин влияет на обе стадии, формирующие фотоответ – развитие ответа и выключение ответа, замедляя каждую из них. В результате, в колбочках, в отличие от палочек, форсколин достоверно не увеличивает чувствительность клеток. Кроме того, в колбочках форсколин существенно (почти в два раза) уменьшает темновой ток фоторецептора. Таким образом, реакция каскада фототрансдукции колбочки на повышение [цАМФ]in существенно отличается от реакции палочкового каскада. Такое поведение колбочкового каскада во время темновой фазы суточного цикла также может иметь адаптивное значение, но не в отношении увеличения чувствительности (как у палочек), а в отношении уменьшения метаболической нагрузки на клетки, не функционирующие во время темновой фазы.
МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор и подготовка экспериментальных животных
Все эксперименты выполнены на сетчатке рыб вида Carassius carassius, поскольку в их сетчатке, как и у большинства рыб, преобладают колбочки. Колбочки Carassius carassius достаточно крупные и хорошо переносят длительные экспериментальные протоколы. Содержание животных и забор материала производились в соответствии с Guide for the Care and Use of Laboratory Animals (1996, National Academy of Sciences, Washington, DC), а также с правилами, утвержденными биоэтической комиссией ИЭФБ РАН. Рыбы содержались в аквариуме в лаборатории при температуре воды 24°С, с двенадцатичасовым циклом день/ночь.
Ночью перед экспериментом животные 12 ч адаптировались к темноте. Глаза извлекались при свете красного фонаря, а дальнейшее отделение сетчатки от остальных оболочек глаза и ее разделение на более мелкие части осуществлялось под бинокулярной лупой с инфракрасной подсветкой. Полученная суспензия из небольших фрагментов сетчатки и изолированных фоторецепторов перемещалась в камеру для перфузии в составе экспериментальной установки, после чего проводился поиск и всасывание клетки в пипетку. Все манипуляции выполнялись при комнатной температуре (18°С).
Используемые растворы
Для перфузии и подготовки препаратов фоторецепторов применяли раствор Рингера следующего состава (концентрация в мМ): NaCl 102, KCl 2.6, MgCl2 1, D-глюкоза 5, CaCl2 1, NaHCO3 28, HEPES 5 и БСА 50 мг/л, pH 7.8–8.0.
Растворы исследуемых фармакологических агентов – форсколин (2 мкМ) и ролипрам (10 мкМ) в растворе Рингера – получали из ранее приготовленных маточных растворов в диметилсульфоксиде (DMSO) с концентрацией 10 мМ. Все перечисленные реагенты были приобретены у Sigma-Aldrich, США.
Регистрация тока фоторецепторов и стимуляция светом
В данном исследовании использовался метод, описанный D.A. Baylor с соавт. [24]. Эксперимент включал регистрацию токовых ответов колбочек, прикрепленных к сетчатке. При переключении входного потока перфузирующий раствор заменялся во всей камере для перфузии в течение 2.5 мин. Стимуляция светом осуществлялась по двум каналам, в одном из которых источником света служил зеленый (519 нм), а в другом – красный (632 нм) светодиод. Интенсивность, длительность и частота следования световых стимулов контролировались программой и платой LabView (National Instruments, Austin, TX). Световая стимуляция на двух разных длинах волн применялась для определения спектрального типа колбочек. Контроль интенсивности световых стимулов осуществлялся с помощью серых нейтральных светофильтров и тока светодиода. Стандартная длительность вспышки составляла 2 мс.
Экспериментальный протокол
После помещения во всасывающую пипетку у колбочек в определенном порядке записывались ответы на световые стимулы возрастающей интенсивности, в том числе насыщающей интенсивности, после чего перфузирующий раствор заменялся на раствор, содержащий форсколин или ролипрам. В новом растворе клетки инкубировались около 20 мин, после чего протокол записи ответов повторялся.
В ходе исследований оценивался эффект форсколина (2 мкМ) и ролипрама (10 мкМ) на характеристики фотоответов, а также были проведены контрольные эксперименты с тем же протоколом, но без добавления исследуемых фармакологических агентов для сравнения. В каждом эксперименте (с инкубацией в растворах форсколина и ролипрама) или при записи контрольных экспериментов в нормальном растворе Рингера оценивались параметры фотоответов колбочек (описаны ниже) до и после их двадцатиминутной инкубации в заданном растворе.
Результаты для контрольных колбочек по всем исследуемым параметрам фотоответов использовались для статистического сравнения с группами колбочек, подвергшихся воздействию форсколина или ролипрама.
Исследуемые параметры фотоответов
Мы оценивали эффекты исследуемых веществ на чувствительность колбочек к свету, уровень темнового тока и кинетику фотоответа как на слабые, так и на насыщающие стимулы.
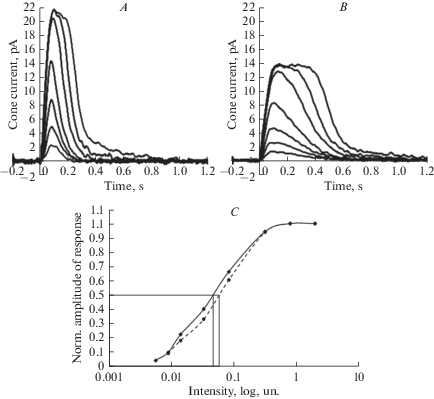
Изменение чувствительности клетки оценивалось двумя способами: по сдвигу кривой “ответ–интенсивность” (рис. 1С), сдвиг кривой оценивался на уровне 50% от максимального ответа клетки, и дополнительно – по изменению величины нормированного фотоответа на слабые, ненасыщающие, стимулы.
Рис. 1.
Ответы колбочек на стимулы возрастающей интенсивности в чистом растворе Рингера (A) и в растворе Рингера с форсколином (2 мкМ) (В). Интенсивность вспышки для каждого ответа на рис. A совпадает с интенсивностью для соответствующего ответа на рис. В. C – анализ изменения чувствительности колбочки по положению кривой ответ-интенсивность (сплошная кривая – ответы в нормальном растворе Рингера; пунктирная кривая - ответы после инкубации в течение 20 мин в растворе, содержащем форсколин). Fig. 1. Responses of cones to stimuli of increasing intensity in normal Ringer’s solution (A) and in Ringer’s solution with forskolin (2 μМ) (B). The flash intensity for each response from the panel A coincides with the intensity for the corresponding response in the panel B. C – analysis of the sensitivity change by the shift of the response-intensity curve (solid curve shows are responses in normal Ringer’s solution; the dashed curve shows responses after incubation in forskolin-containing solution for 20 min).
Изменения уровня темнового тока определялись как отношение амплитуды насыщенного ответа клетки после инкубации препарата с исследуемым веществом к амплитуде ответа в нормальном растворе Рингера.
Для анализа кинетики ответов на ненасыщающие стимулы оценивалась восходящая фаза ответов, как усредненные значения всех фотоответов одной интенсивности (до инкубации, после инкуации в растворе Рингера и после инкубации в растворе с форсколином) (рис. 2), а нисходящая фаза фотоответа аппроксимировалась одноэкспоненциальной функцией в программе Microsoft Excel (рис. 3), участок нисходящей фазы ответа, пригодный для аппроксимации, выбирался на основании визуальной оценки. Такая аппроксимация давала постоянную времени выключения фотоответа. Кинетика выключения насыщенных ответов изучались посредством оценки времени пребывания ответа в насыщении (время до 20% восстановления темнового тока после начала фотоответа, рис. 4). Для всех параметров сравнительный анализ проводился на основе данных, зарегистрированных в стандартном растворе Рингера и в растворе Рингера с добавлением 2 мкМ форсколина или 10 мкМ ингибитора ФДЭ 4 типа, ролипрама.
Рис. 2.
Усредненные ответы всей группы клеток в растворе Рингера до инкубации, после инкубации (в течение 20 мин) в чистом растворе Рингера (контроль) и после инкубации в растворе, содержащем 2 мкМ форсколина. Fig. 2. Flash responses averaged over the entire group of cells in Ringer’s solution before incubation, after incubation (for 20 min) in normal Ringer’s solution (control), and after incubation in a solution containing 2 µM Forskolin.
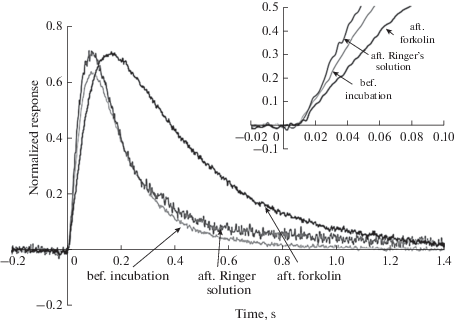
Рис. 3.
Сравнение кинетики ненасыщенных ответов с использованием экспоненциального приближения нисходящей фазы, τoff – постоянная времени экспоненты. Fig. 3. Comparison of the kinetics of non-saturated responses using the exponential approximation of the declining phase, τoff – time constant extracted from approximating exponent function.
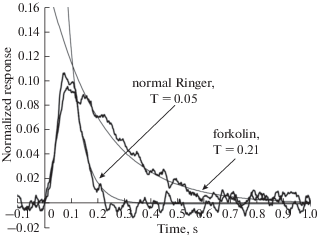
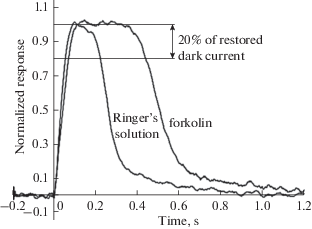
Рис. 4.
Время пребывания колбочки в насыщении после яркой вспышки света в растворе Рингера и в растворе форсколина. Fig. 4. Time in saturation after bright flash of light, in normal Ringer’s solution and in forskolin-containing solution.
Обработка данных
Обработка экспериментальных данных производилась при помощи программ Microsoft Excel (Microsoft), GraphPad Prism 8 (GraphPad Software) и пакета программ LabVIEW (National Instruments).
Статистическую обработку проводили при помощи пакета программ SPSS Statistics 22 (IBM). Нормальность распределения выборочных данных проверялась с применением критерия Шапиро–Уилка. Поскольку многие из исследованных показателей не имели нормального распределения, для сравнения групп использовался H-критерий Краскела–Уоллиса с апостериорным попарным сравнением критерием Манна–Уитни с поправкой Бонферрони на множественные сравнения. Различия считались достоверными при уровне значимости нулевой гипотезы p ≤ 0.05 (с поправкой Бонферрони p ≤ 0.025). Данные на рисунках представлены как медианы и квартили (рис. 5).
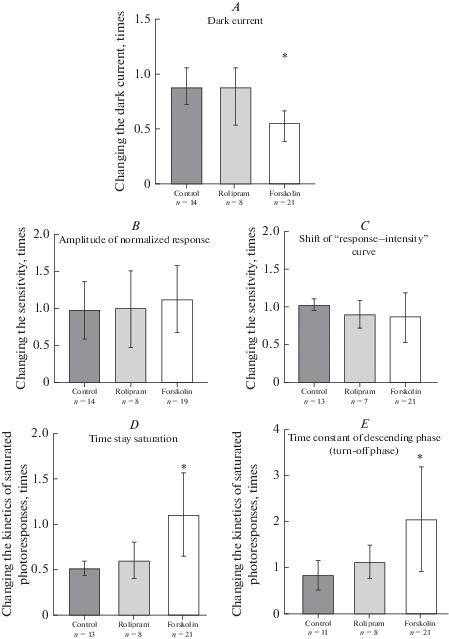
Рис. 5.
Диаграммы сравнения изменения параметров под воздействием вещества относительно контрольной группы клеток, n – количество колбочек в группе: A) изменение амплитуды темнового тока; B) изменение чувствительности по амплитуде нормированного ответа; C) изменение чувствительности по сдвигу кривой “ответ–интенсивность”; D) сравнение кинетики насыщенных фотоответов путем определения времени ответа в насыщении; E) сравнение кинетики выключения фотоответа путем определения постоянной времени выключения (τ). * – достоверные различия по U критерию Манна–Уитни с поправкой Бонферрони (p ≤ 0.025) между контрольной группой клеток и группой клеток, инкубировавшихся в растворе с форсколином. Данные выражены как медиана и квартили. Fig. 5. Comparison of parameter changes under the action of a substance relative to the control group of cells, n is the number of cones in the group: A) change of the dark current; B) change of the sensitivity assessed by normalized response amplitude; C) change of the sensitivity assessed by the shift of the “response vs. intensity” curve; D) comparison the kinetics of saturated photoresponses by determining the time in saturation; E) the kinetics the photoresponse turn-off by determining the time constant of the response decay (τ). * – significant differences in the U Mann–Whitney test with Bonferroni correction (p ≤ 0.025) between the control group of cells and the group of cells incubated in the solution with forskolin. The data presented as a Median and Interquartile range
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Всасывающая пипетка позволяет регистрировать внеклеточный ток. При работе с палочками амфибий возможны варианты регистрации тока как в конфигурации attached cell (клетка прикреплена к небольшому фрагменту сетчатки и относительно интактна), так и в конфигурации isolated cell. В последнем случае возможна конфигурация inner segment in (внутренний сегмент внутри пипетки, наружный сегмент доступен для фармакологического воздействия, в том числе для быстрой замены перфузирующего раствора) или outer segment in. В настоящей работе для регистрации тока фоторецептора использовалась конфигурация attached cell, при которой наружный сегмент колбочки находится внутри регистрирующей пипетки, а внутренний сегмент экспонирован наружу. Ранее на изолированных препаратах палочек лягушки мы показали, что эффект форсколина практически инвариантен к конфигурации записи (outer segment in или inner segment in) [16], поэтому в рамках данной работы мы ожидали, что форсколин, воздействующий на внутренний сегмент колбочки в конфигурации attached cell, вызывал такой же эффект, как если бы он воздействовал на свободный наружный сегмент колбочки.
В ответ на стимуляцию короткой (2 мс) вспышкой света колбочка генерирует однополярную волну уменьшения тока (рис. 1A, набор ответов на стимулы нарастающей интенсивности в нормальном растворе Рингера). Для всех ответов были проанализированы изменения величины темнового тока (Id), кинетика нарастания и спада фотоответа (τoff), а также изменения чувствительности. Для всех колбочек строились кривые чувствительности к красному и зеленому стимулу, после чего протокол регистрации фотоответов на стимулы нарастающей интенсивности проводился при стимуляции зеленым светом. Спектральный тип колбочки определялся после окончания эксперимента при обработке данных. Общее количество красных колбочек составляло ¼ от общего количества зеленых колбочек. В общей статистике данных (21 клетка), мы не делали разделения на красные и зеленые колбочки.
Контроль влияния всасывающей пипетки. В нормальном растворе Рингера за 20 мин, что приблизительно соответствует времени полного развития реакции колбочки на инкубацию в 2 мкМ растворе форсколина, темновой ток снижался на 13 ± 6% (n = 14). Остальные параметры фотоответа – чувствительность и скорости нарастания и спада, не показали статистически достоверных изменений.
Форсколин влияет на темновой ток колбочек и кинетику фотоответа. 20-минутная инкубация в 2 мкМ форсколина приводит к почти двукратному уменьшению темнового тока (табл. 1). Кроме того, в растворе с форсколином замедляются оба процесса, формирующие фотоответ колбочки – нарастание ответа и спад ответа. Этот эффект хорошо виден на рис. 2, на котором представлены ответы на стимул одинаковой интенсивности, усредненные по всем включенным в анализ клеткам и зарегистрированные в нормальном растворе Рингера до инкубации в любом из растворов, после 20-минутной инкубации в нормальном растворе Рингера и после 20-минутной инкубации в растворе Рингера, содержащем 2 мкМ форсколина. Для количественной оценки замедления спада ответа колбочки на вспышку света нисходящая фаза ответа аппроксимировалась экспоненциальной функцией (рис. 3). Постоянная времени спада ответа увеличивалась под действием форсколина более чем в два раза (табл. 1).
Таблица 1.
Сводная таблица результатов (среднее значение ± стандартная ошибка среднего значения) Table 1. Summary table of results (mean value ± standard error of the mean)
| Отношение параметров parameters ratio (after action/before action) | |||||
|---|---|---|---|---|---|
| темновой ток dark current |
чувствительность sensitivity | кинетика выключения фотоответа kinetic of turn-off photoresponse | |||
| сравнение амплитуд amplitude of normalized response | по сдвигу кривой shift of “response–intensity”-curve | постоянная времени выключения time constant of falling phase | время ответа в насыщении time of stay in saturation | ||
| Контроль control | 0.87 ± 0.06 | 0.98 ± 0.12 | 1.03 ± 0.02 | 0.83 ± 0.06 | 1.03 ± 0.02 |
| Ролипрам rolipram (10 µМ) | 0.78 ± 0.11 | 1.00 ± 0.14 | 0.91 ± 0.11 | 1.12 ± 0.09 | 1.21 ± 0.05 |
| Форсколин forskolin (2 µМ) | 0.58 ± 0.05 | 1.12 ± 0.1 | 0.87 ± 0.07 | 2.05 ± 0.26 | 2.23 ± 0,.0 |
Анализ эффекта форсколина на кинетику восходящей фазы ненасыщенного ответа проводился по усредненным для всех анализируемых клеток ответам на вспышку одной и той же интенсивности до и после воздействия исследуемого вещества. У каждой индивидуальной колбочки такой анализ не представляется возможным из-за шума фотоответа. Степень изменения скорости активации каскада была оценена по усредненным для всех клеток ответам, в норме и после инкубации в форсколине (рис. 2). Уменьшенный вследствие усреднения шум экспериментальной кривой делает возможным сравнение двух кривых и показывает замедление скорости нарастания ответа под действием форсколина.
Форсколин влияет на время насыщения колбочки, но не на чувствительность фотоответа. Известно, что достаточно яркая вспышка света вызывает гидролиз свободной фракции внутриклеточного пула цГМФ до уровня, при котором закрываются все цГМФ-зависимые каналы плазматической мембраны. В результате цГМФ-зависимый фототок прекращается, и клетка входит в состояние насыщения, а время пребывания в насыщении зависит от интенсивности вспышки и от чувствительности каскада фототрансдукции. Таким образом, время пребывания клетки в состоянии насыщения косвенно характеризует чувствительность клетки. Наши результаты показали, что инкубация в форсколине увеличивает время пребывания колбочки в состоянии насыщения в 2.2 раза (табл. 1, рис. 4).
Изменение чувствительности оценивалось по изменению величины нормированного фотоответа на вспышки стандартной интенсивности или по изменению положения полунасыщающей интенсивности стимула на кривой “нормированный ответ–интенсивность” (рис. 1С). Последнее является более объективной оценкой чувствительности, так как принимает в расчет величину не одного, а нескольких ответов клетки на стимулы разной интенсивности. Оказалось, что чувствительность статистически значимо не изменялась ни по одному из исследуемых параметров (рис. 5, табл. 1).
Ролипрам не влияет на величину темнового тока, чувствительность и кинетические параметры фотоответа колбочки. Возможное влияние ингибитора ФДЭ 4 типа – ролипрама изучалось по протоколу, аналогичному протоколу с использованием форсколина. Сравнительный анализ параметров, описывающих работу каскада фототрансдукции, показал, что уровень темнового тока в результате 20-минутной перфузии раствором, содержащим ролипрам, уменьшается на 22 ± 11% (n = 8), что сопоставимо с величиной 13 ± 6%, полученной в контрольных экспериментах с перфузией раствором Рингера. Чувствительность под действием ролипрама упала до 91 ± 11% от контрольной (n = 7, р = 0.71). Выключение ответа колбочки на вспышку за время перфузии с ролипрамом замедлилось в 1.12 ± 0.09 раза (n = 8, p = 0.13) (в 1.3 раза в контрольных экспериментах). Таким образом, никакие из оцененных параметров работы каскада фототрансдукции не демонстрируют статистически значимой зависимости от аппликации ролипрама (рис. 5).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Аппликация форсколина и повышение внутриклеточной концентрации цАМФ. Влияние форсколина на уровень [цАМФ]in в наружных сегментах палочки лягушки Rana ridibunda было нами ранее показано экспериментально [14]. Мы установили, что инкубация изолированной сетчатки лягушки в течение 17 мин в растворе Рингера, содержащем 2 мкМ форсколина, увеличивает [цАМФ]in в наружных сегментах фоторецепторов, которые представлены на 98% палочками, в 2.5 раза. В настоящей работе мы не проводили прямое измерение [цАМФ]in в наружных сегментах фоторецепторов рыбы, однако известно, что воздействие 1 и 10 мкМ форсколина на изолированную сетчатку курицы, в которой, как и в сетчатке рыбы, доминируют колбочки, вызывало рост уровня цАМФ в сетчатке в 2.1 и 2.3 раза соответственно [27].
Влияние повышения [цАМФ]in на работу каскада фототрансдукции в колбочках. Основной вывод настоящей работы состоит в том, что реакция каскада фототрансдукции колбочек на повышение [цАМФ]in заметно отличается от реакции каскада в палочках лягушки. Первое отличие заключается в реакции темнового тока фоторецептора на увеличение [цАМФ]in – у палочек лягушки он достоверно не меняется, а у колбочек рыбы уменьшается почти в два раза (рис. 1А, В, табл. 1).
Второе отличие состоит в изменении светочувствительности палочек и колбочек в ответ на увеличение [цАМФ]in. С одной стороны, форсколин увеличивает время пребывания колбочки в насыщенном состоянии (рис. 4, табл. 1) в 2.2 раза, что примерно совпадает с реакцией палочек на форсколин [14]. Время пребывания в насыщении определяется интегралом фотоответа клетки, который, как хорошо видно на рис. 4, значительно увеличивается под воздействием форсколина.
У палочки при увеличении [цАМФ]in не изменяется скорость нарастания ответа, но замедляется его выключение. Вследствие этого ответ палочки на свет увеличивается по амплитуде более чем в два раза [14]. У колбочек выключение фотоответа также замедляется в два раза, однако достоверного увеличения амплитуды ответа не происходит из-за того, что скорость нарастания ответа также уменьшается. В результате чувствительность клетки, определяемая по амплитуде нормированного ответа на ненасыщающий световой стимул, не изменяется.
Можно предложить следующее объяснение разницы в реакции каскада фототрансдукции палочек и колбочек на [цАМФ]in. У палочек форсколин и повышение [цАМФ]in приводит к увеличению в 1.6 раза внутриклеточной концентрации кальция, однако уровень [цГМФ]in и темновой ток не изменяются из-за компенсаторного влияния цАМФ на темновую активность ФДЭ6 (объяснения в [14]). К сожалению, в колбочках, из-за особенностей кинетики их ответов, определить возможные изменения [Ca2+]in тем же способом (по кинетике обменного тока) не представляется возможным, однако можно предположить, что [Ca2+]in, как и в палочках, увеличивается. В таком случае, хорошо известный эффект уменьшения активности ГЦ под воздействием повышенного [Ca2+]in [28, 29] и отсутствие у колбочек компенсаторного уменьшения активности ФДЭ6 объясняет уменьшение темнового тока. Замедление выключения фотоответа у колбочек может быть объяснено, по аналогии с палочками, увеличением внутриклеточной концентрации кальция.
Таким образом, принципиально различными остаются реакции на увеличение [цАМФ]in темновой активности ФДЭ6 и скорости нарастания фотоответа, а именно – повышенный уровень [цАМФ]in уменьшает темновую активность ФДЭ6 в палочках, но не в колбочках, и повышенный уровень [цАМФ]in замедляет нарастание фотоответа в колбочках, но не в палочках. Имеющиеся данные не позволяют сделать окончательный вывод о причине этой разницы кроме общего аргумента о том, что каскады фототрансдукции в палочках и колбочках представлены различными наборами белков, хотя и с аналогичными функциями, но довольно различными свойствами [22, 26]. Несомненно, однако, что описанное поведение каскада фототрансдукции колбочек может иметь адаптивное значение [29]. Концентрация цАМФ в фоторецепторе повышается во время темной фазы суточного цикла, когда уровень освещения недостаточен для работы колбочек. В таком случае снижение уровня темнового тока и замедление всех реакций каскада фототрансдукции можно интерпретировать как переход в режим метаболической экономии.
Ролипрам. Инкубация колбочек рыбы с ролипрамом в конфигурации “attached cell, outer segment in” не приводила к статистически значимым изменениям ни одного из исследуемых параметров фотоответов колбочек. Ролипрам является селективным ингибитором ФДЭ4, и наличие реакции фоторецепторной клетки на ролипрам могло бы служить косвенным подтверждением присутствия ФДЭ4 в колбочках рыбы. Такие доказательства были получены нами ранее для палочек лягушки – инкубация изолированных палочек в конфигурации “inner segment in” в 10 мкМ ролипрама вызывала эффекты, близкие к эффекту инкубации в 2 мкМ форсколина. Возможным объяснением отсутствия эффекта ролипрама в случае колбочек могут быть 1) недоступность мишени ролипрама, ФДЭ4, из-за инвертированной конфигурации расположения клетки (наружный сегмент колбочки находится внутри пипетки), или 2) отсутствие ФДЭ4 в колбочках. Против первого предположения говорит тот факт, что другие агенты, также воздействующие на мишени, находящиеся в наружном сегменте фоторецептора, в конфигурации “inner segment in” вызывают сходный эффект, как и в конфигурации “outer segment in” (форсколин, [14]; IBMX, неопубликованные данные). Поэтому более вероятно второе объяснение – контур синтеза-гидролиза цАМФ в колбочках, в отличие от палочек, не включает ФДЭ 4 типа. Возможно, в его состав входят другие цАМФ-специфичные ФДЭ.
Список литературы
Molday R.S., Moritz O.L. Photoreceptors at a glance. J. Cell Sci. 128.22: 4039–4045. 2015.
Chen C.K. The vertebrate phototransduction cascade: amplification and termination mechanisms. Rev. Physiol. Biochem. Pharmacol. 154: 101–121. 2005.
Pugh E.N. Jr., Lamb T.D. Phototransduction in Vertebrate Rods and Cones: Molecular Mechanisms of Amplification, Recovery and Adaptation. Handbook Biol. Physics. V. 3. 183–225. 2000.
Arshavsky V.Y., Burns M.E. Photoreceptor Signaling: Supporting Vision across a Wide Range of Light Intensities. J. Biol. Chem. 287(3): 1620–1626. 2012.
Vinberg F., Kefalov V.J. Investigating the Ca2+-dependent and Ca2+-independent mechanisms for mammalian cone light adaptation. Sci. Rep. 8(1): 15864. 2018.
Lamb T.D., Hunt D.M. Evolution of the calcium feedback steps of vertebrate phototransduction. Open Biol. 8(9). 2018.
Schnetkamp P.P., Jalloul A.H., Liu G., Szerencsei R.T. The SLC24 family of K+-dependent Na+-Ca2+ exchangers: structure-function relationships. Curr. Top Membr. 73: 263–287. 2014.
Astakhova L.A., Firsov M.L., Govardovskii V.I. Kinetics of turn-offs of frog rod phototransduction cascade. J. Gen. Physiol 132(5): 587–604. 2008.
Sokolov M., Lyubarsky A.L., Strissel K.J., Savchenko A.B., Govardovskii V.I., Pugh E.N. Jr., Arshavsky V.Y. Massive light-driven translocation of transducin between the two major compartments of rod cells: a novel mechanism of light adaptation. Neuron. 34(1): 95–106. 2002.
Peterson J.J., Tam B.M., Moritz O.L., Shelamer C.L., Dugger D.R., McDowell J.H., Hargrave P.A., Papermaster D.S., Smith W.C. Arrestin migrates in photoreceptors in response to light: a study of arrestin localization using an arrestin-GFP fusion protein in transgenic frogs. Exp. Eye Res. 76(5): 553–563. 2003.
Nir I., Haque R., Iuvone P.M. Regulation of cAMP by light and dopamine receptors is dysfunctional in photoreceptors of dystrophic retinal degeneration slow(rds) mice. Exp. Eye Res. 73(2): 265–272. 2001.
Chaurasia S.S., Haque R., Pozdeyev N., Jackson C.R., Iuvone P.M. Temporal coupling of cyclic AMP and Ca/calmodulin-stimulated adenylyl cyclase to the circadian clock in chick retinal photoreceptor cells. J. Neurochem. 99(4): 1142–1150. 2006.
Tosini G.., Pozdeyev N., Sakamoto K., Iuvone P.M. The circadian clock system in the mammalian retina. Bioessays. 30(7): 624–633. 2008.
Astakhova L.A., Samoiliuk E.V., Govardovskii V.I., Firsov M.L. cAMP controls rod photoreceptor sensitivity via multiple targets in the phototransduction cascade. J. Gen. Physiol. 140(4): 421–433. 2012.
Астахова Л.А., Капицкий С.В., Говардовский В.И., Фирсов М.Л. цАМФ как регулятор каскада фототрансдукции. Рос. физиол. журн. им. И.М. Сеченова. 98(11): 1273–1285. 2012. [Astakhova L.A., Kapitskii S.V., Govardovskii V.I., Firsov M.L. cAMP as a regulator of the phototransduction cascade. Russ. J. Physiol. 98(11): 1273–1285. 2012. (In Russ)].
Astakhova L.A., Nikolaeva D.A., Fedotkina T.V., Govardovskii V.I., Firsov M.L. Elevated cAMP improves signal-to-noise ratio in amphibian rod photoreceptors. J. Gen. Physiol. 149(7): 689–701. 2017.
Baylor D.A., Matthews G., Yau K.W. Two components of electrical dark noise in toad retinal rod outer segments. J. Physiol. 309: 591–621. 1980.
Rieke F., Baylor D.A. Molecular origin of continuous dark noise in rod photoreceptors. Biophys. J. 71(5): 2553–2572. 1996.
Witkovsky P. Dopamine and retinal function. Doc. Ophthalmol. 108(1): 17–40. 2004.
Popova E. Role of dopamine in distal retina. J. Comp. Physiol. A. Neuroethol. Sens. Neural Behav. Physiol. 200(5): 333–358. 2014.
Nikolaeva D.A., Astakhova L.A., Firsov M.L. The effects of dopamine and dopamine receptor agonists on the phototransduction cascade of frog rods. Mol. Vision. 25: 400–414. 2019.
Ingram N.T., Sampath A.P., Fain G.L. Why are rods more sensitive than cones? J. Physiol. 594(19): 5415–5426. 2016.
Abalo X.M., Lagman D., Heras G., Del Pozo A., Eggert J., Larhammar D. Circadian regulation of phosphodiesterase 6 genes in zebrafish differs between cones and rods: Implications for photopic and scotopic vision. Vision Res. 166: 43–51. 2020.
Baylor D.A., Lamb T.D., Yau K.W. The membrane current of single rod outer segments. J. Physiol. 288: 589–611. 1979.
Lamb T.D., Pugh E.N. Jr. A quantitative account of the activation steps involved in phototransduction in amphibian photoreceptors. J. Physiol. 449: 719–758. 1992.
Astakhova L., Firsov M., Govardovskii V. Activation and quenching of the phototransduction cascade in retinal cones as inferred from electrophysiology and mathematical modeling. Mol. Vision. 21: 244–263. 2015.
Nowak J.Z., Sek B., Zurawska E. Activation of D2 dopamine receptors in hen retina decreases forskolin-stimulated cyclic AMP accumulation and serotonin N-acetyltransferase (NAT) activity. Neurochem. Internat. 16(1): 73–80. 1990.
Koch K.W., Stryer L. Highly cooperative feedback control of retinal rod guanylate cyclase by calcium ions. Nature. 334: 64–66. 1988.
Dizhoor A.M., Lowe D.G., Olshevskaya E.V., Laura R.P., Hurley J.B. The human photoreceptor membrane guanylyl cyclase, RetGC, is present in outer segments and is regulated by calcium and a soluble activator. Neuron. 12(6): 1345–1352. 1994.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


