Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 4, стр. 462-473
Световая адаптация палочек сетчатки, адаптационная память и последовательные образы
А. Ю. Ротов 1, *, Л. А. Астахова 1, М. Л. Фирсов 1, В. И. Говардовский 1
1 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: rotovau@gmail.com
Поступила в редакцию 01.02.2020
После доработки 11.02.2020
Принята к публикации 11.02.2020
Аннотация
GPCR-сигнальный каскад в фоторецепторных клетках сетчатки – палочках и колбочках – обеспечивает высокое усиление сигнала и позволяет палочкам надежно реагировать на одиночные кванты света. При этом палочки сохраняют работоспособность при световых потоках до 105 квантов в секунду, что поддерживается высокоэффективной системой световой адаптации. Световая адаптация основана на цепях отрицательной обратной связи, в основном через изменения внутриклеточной концентрации ионов Са2+. Надежно идентифицированы три петли кальциевой регуляции – ускорение выключения фотоактивированного родопсина, ускорение синтеза цГМФ гуанилатциклазой и повышение сродства цГМФ-управляемых ионных каналов к нуклеотиду. Известно, однако, что существуют еще один или два высокоэффективных механизма адаптации, один из которых регулирует время жизни активированнной фосфодиэстеразы; для второго мишень регуляции неизвестна. Неизвестны также посредники этих регуляций. При исследовании этих механизмов мы обнаружили новый феномен, упущенный в предыдущих работах. Мы нашли, что восстановление темнового тока палочки после выключения ненасыщающего адаптирующего света может занимать 20–30 с. Более того, после формального возвращения мембранного тока к темновому уровню чувствительность клетки к тестирующим стимулам остается пониженной еще в течение одной–двух минут. Мы назвали это явление “адаптационной памятью”. Адаптационная память напоминает феноменологию последовательных образов. Постепенное возвращение мембранного тока к темновому уровню могло бы соответствовать затуханию положительного последовательного образа. Длительное понижение чувствительности фоторецепторов к добавочной стимуляции может обеспечить возникновение негативного образа. Насколько мы знаем, это первая экспериментальная физиологическая демонстрация возможности генерации последовательных образов уже на уровне одиночных фоторецепторов.
Исходной целью этой работы было исследование механизмов световой адаптации палочек сетчатки. Фоторецепторные клетки сетчатки – палочки и колбочки – используют GPCR-сигнальный каскад для генерации электрического сигнала в ответ на поглощение света молекулами рецепторного белка – родопсина. Двухступенчатый каскад ферментативного усиления использует фосфодиэстеразу (ФДЭ) цГМФ как эффекторный фермент, а цГМФ служит внутриклеточным посредником, регулируя ионную проницаемость плазматической мембраны клетки. Высокое усиление в каскаде позволяет палочкам надежно регистрировать одиночные кванты света [1, 2].
Несмотря на предельно высокую чувствительность, палочки сохраняют работоспособность при световых потоках до 105 фотонов на клетку в секунду. Такой широкий динамический диапазон поддерживается механизмами световой адаптации, которые регулируют чувствительность и быстродействие каскада. Световая адаптация обеспечивается отрицательной обратной связью, основанной на изменениях внутриклеточной концентрации ионов Са2+ при освещении (см. рис. 1). Твердо установлены три мишени кальция. Во-первых, светоиндуцированное падение [Са2+] ускоряет выключение активированного родопсина (R*), снижая в итоге каталитическую активность ФДЭ. Во-вторых, понижение [Са2+] активирует гуанилатциклазу, ускоряя возврат концентрации цГМФ к темновому уровню. В-третьих, при низкой [Са2+] увеличивается сродство цГМФ-управляемых каналов к цГМФ, так что они удерживаются в открытом состоянии при более низкой концентрации посредника. Все три механизма способствуют восстановлению “темнового” состояния фоторецептора и противодействуют насыщению фотоответа при высоких освещенностях [3–6].
Рис. 1.
Схема возбуждения и адаптации каскада фототрансдукции в фоторецепторах сетчатки позвоночных. R, светочувствительный GPCR белок родопсин. R*, фотоактивированный родопсин. Т, гетеротримерный ГТФ-связывающий белок трансдуцин. PDE, фосфодиэстераза циклического ГМФ. GC, гуанилатциклаза. Channel, цГМФ-управляемые катионные каналы плазматической мембраны. Некоторые компоненты каскада (родопсинкиназа, аррестин и рековерин в блоке “Inactivation”, RGS9-Gβ5-комплекс выключения PDE, кальций-чувствительный белок GCAP, активирующий GC, Na,K/Ca обменник в плазматической мембране) не показаны, чтобы не загромождать рисунок. Стрелки 1, 2 и 3 показывают надежно установленные цепи Ca2+ обратной связи, ускоряющие фотоответ и управляющие световой адаптацией. Штриховая стрелка показывает путь регуляции выключения PDE [8], посредник которой неизвестен. Fig. 1. A simplified scheme of activation and adaptation of the phototransduction cascade in vertebrate retinal photoreceptors. R, light-sensitive GPCR protein rhodopsin. R*, photoactivated rhodopsin. T, heterotrimeric GTP-binging protein transducin. PDE, cyclic GMP phosphodiesterase. GC, guanylate cyclase. Channel, cGMP-gated cationic channels of the plasma membrane. Some components of the cascade (rhodopsin kinase, arrestin and recoverin in the “Inactivation” block, RGS9-Gβ5 complex of PDE turn-off, Ca2+-sensitive protein GCAP that activates guanylate cyclase, and Na,K/Ca exchanger in the plasma membrane) are not shown to avoid clutter. Arrows 1, 2, 3 point to firmly established pathways of Ca2+ feedback that accelerates the photoresponse and controls light adaptation. Dashed arrow points to the mechanism that controls the rate of PDE* turn-off [8] whose messenger is unknown.

Было, однако, показано, что механизмы световой адаптации не ограничиваются тремя уже известными. Суммарная регуляция чувствительности всеми известными механизмами недостаточна для объяснения полного диапазона работы палочки. Существует медленный (десятки секунд) механизм адаптации, который обеспечивает дополнительную регулировку чувствительности примерно на порядок, и мишени которого и участвующие посредники пока неизвестны [7]. Недавно мы нашли, что вдобавок к уже известным регуляциям, в ходе световой адаптации ускоряется выключение светоиндуцированной активности ФДЭ, что также препятствует насыщению фотоответа [8]. Посредник, регулирующий выключение активированной ФДЭ, и временной ход этой регуляции тоже неизвестны.
Мы начали детальное экспериментальное исследование упущенных механизмов световой адаптации и обнаружили новый феномен, каким-то образом незамеченный в предыдущих работах. Мы нашли, что восстановление темнового тока (= темнового мембранного потенциала) палочки после выключения ненасыщающего адаптирующего света может занимать 20–30 с. Более того, после формального возвращения мембранного тока к темновому уровню чувствительность клетки к тестирующим стимулам остается пониженной еще в течение более минуты. Мы назвали это явление “адаптационной памятью”.
Поведение палочки после выключения светоадаптирующего стимула напоминает феноменологию последовательных образов. Постепенное возвращение мембранного тока к темновому уровню могло бы соответствовать затуханию положительного последовательного образа. Длительное понижение чувствительности фоторецепторов к добавочной стимуляции может обеспечить возникновение негативного образа. По-видимому, это первая экспериментальная физиологическая демонстрация возможности генерации последовательных образов уже на уровне одиночных палочек.
Данная работа посвящена описанию и первичному анализу этого феномена.
МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные животные и подготовка препаратов
Эксперименты были проведены на озерных лягушках Rana ridibunda, отловленных в Астраханской области. Животных содержали в виварии ИЭФБ РАН при температуре 15–18°С и естественном цикле день–ночь, и кормили мучными червями. Обращение с экспериментальными животными соответствовало требованиям Директивы Совета Европейских сообществ 1986 г. 86/609/EEC и рекомендациям биоэтического комитета ИЭФБ РАН. Перед началом эксперимента животные находились в течение 12 часов в условиях темновой адаптации. Затем лягушек декапитировали, глаза извлекали и из глазного бокала выделяли сетчатку. Из сетчатки готовили суспензию фоторецепторных клеток в растворе Рингера. Все манипуляции проводили при свете красного фонаря и под контролем системы наблюдения в инфракрасном свете.
Раствор
Для приготовления препаратов фоторецепторных клеток и их перфузии во время эксперимента использовали раствор Рингера для амфибий. Он готовился перед каждым экспериментом и содержал (в мМ): NaCl 90, KCl 2.5, MgCl2 1.6, CaCl2 1, NaHCO3 5, HEPES 5, глюкозу 10, EDTA 0.05, pH корректировали до 7.6 гидроксидом натрия. Все компоненты раствора были приобретены у Sigma-Aldrich, США.
Регистрация токовых ответов фоторецепторных клеток
Ток одиночных фоторецепторов регистрировали при помощи всасывающей пипетки [9]. Палочки всасывались в стеклянную пипетку наружным или внутренним сегментом внутрь, и их ток регистрировался при различных режимах световой стимуляции. Система световой стимуляции включала в себя два независимых канала на основе мощных светодиодов с максимум излучения λmax 525 нм, интенсивность задавалась током через светодиоды и набором серых нейтральных светофильтров. Ответы пропускали через аналоговый фильтр низких частот с граничной частотой 100 Гц и записывали с частотой дискретизации 2 мс/точку. Захват данных, время подачи и длительность стимулов, а также интенсивность стимулов контролировали при помощи плат и программ LabView (National Instruments, Austin, TX). При необходимости зарегистрированные ответы могли дополнительно подвергаться цифровой Гаусс-фильтрации с окном от 5 до 50 мс. Все расчеты выполнялись в пакете MathCad 15 PTC.
Экспериментальный протокол
Типичный экспериментальный протокол включал: а) регистрацию ответов на стимулы возрастающей интенсивности для определения рабочего диапазона конкретной палочки и б) регистрацию ответов на сочетания длительной фоновой засветки (10–40 с) по одному каналу и подаваемых с равным интервалом коротких световых стимулов длительностью 2 мс или 2 с по второму каналу. Пример такого комбинированного протокола световой стимуляции показан на рис. 2.
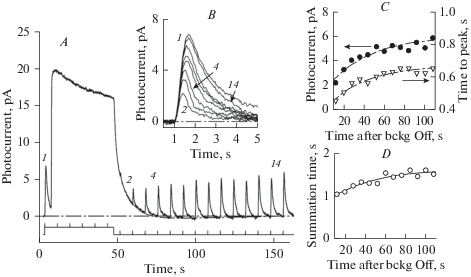
Рис. 2.
Ответ палочки лягушки на периодические короткие вспышки, с наложенным 40-секундным адаптирующим фоном. (А) – непрерывная запись. Под кривой показана отметка стимула. Вспышка 1 подана в состоянии темновой адаптации. Ответы на вспышки на адаптирующем фоне не видны вследствие уменьшенной чувствительности. Вспышка 2 отмечает первый фотоответ, видимый в фазе восстановления. Вспышка 4 соответствует моменту полного восстановления темнового уровня тока. Однако чувствительность к вспышкам остается сниженной еще в течение 1.5 мин (вспышка 14). (B) – изменение амплитуды и кинетики ответов на вспышки, выделенные из записи (А) в ходе темновой адаптации. (C) – амплитуда (относится к левой шкале y) и время до пика (относится к правой шкале y) ответов на вспышки, выделенные из записи (А). (D) – изменение времени интегрирования фотответа в ходе темновой адаптации. Вспышки длительностью 2 мс, 0.7 фотона мкм–2 за вспышку. 40-секундная адаптирующая фоновая засветка 30 фотонов мкм–2 с–1. Усреднение 9 записей, Гаусс-фильтрация 50 мс. Fig. 2. Response of a frog rod to periodically applied short flashes with superimposed 40-s adapting background. (A), continuous record. Stimulus timing mark is shown below the curve. Flash # 1 was applied in a dark-adapted state. Responses to following flashes against the adapting background are not detectable due to greatly reduced sensitivity. Flash # 2 refers to the response that is first seen during the recovery phase. Flash # 4 marks full recovery of the dark current. However, sensitivity to test flashes remains suppressed for extra 1.5 minutes, until the flash #14. (B) shows the changes of amplitude and time course of test flash responses in course of dark adaptation. (C) shows amplitude (refers to the left y-axis) and time to peak (refers to the right y-axis) of flash responses during dark adaptation. (D) shows changes of the summation time of the flash response during the adaptation. Flash duration 2 ms, intensity 0.7 photon mm–2 per flash. Light-adapting background illumination of 40 s duration, intensity 30 photons mm–2 s–1. Average of 9 scans, Gauss-filtered with 50-ms window.
Специально следует оговорить принятую здесь форму представления ответов палочек на свет. В состоянии темновой адаптации, при высокой концентрации цГМФ, катионные каналы плазматической мембраны открыты, и через них течет входящий ток. Петля тока замыкается через калиевые каналы внутреннего сегмента. Этот темновой ток регистрируется всасывающей пипеткой. При освещении каналы наружного сегмента закрываются, ток уменьшается и при достаточно ярких стимулах падает до нуля. Таким образом, ответ фоторецептора на свет – это уменьшение темнового тока. Однако в большинстве физиологических работ ответ принято изображать как положительный сигнал. Поэтому на наших рисунках нулевой уровень соответствует темноадаптированному состоянию клетки, т.е. максимальному току через каналы. Уменьшение тока в ответ на свет называется фототоком и изображается отклонением вверх. Таким образом, максимальный фотоответ при ярких стимулах соответствует нулевому току через каналы.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Рис. 2 показывает результаты типичного эксперимента. Палочка периодически стимулируется короткими вспышками, вызывающими ответ, составляющий примерно 30% от насыщенного. После первой вспышки, поданной в состоянии темновой адаптации, включается стационарный фоновый стимул длительностью 40 с. Он вызывает ответ, который вначале близок к насыщенному, а затем частично спадает, демонстрируя процесс световой адаптации. В течение всего периода действия фона ответы на вспышки отсутствуют, так как чувствительность к ним подавлена. После выключения фона фототок возвращается к темновому уровню примерно по экспоненте с постоянной времени около 6 с. По мере восстановления темнового тока градуально восстанавливаются и ответы на вспышки. Однако и в момент формально полного восстановления темнового тока (достижения темнового состояния) через 25 с после выключения фона амплитуда ответа на вспышки составляет только примерно половину от исходной темноадаптированной (вспышка 4 на панелях рис. 2А, В). Полное восстановление чувствительности не достигается даже через полторы минуты темновой адаптации (сравните ответы на вспышки 1 и 14 на рис. 2А, В).
На панели В рис. 2 показаны изменения ответов на вспышки в ходе адаптации. Панель С рис. 2 показывает изменение амплитуды ответа (кружки) и времени до пика (треугольники) в зависимости от времени после выключения адаптирующего стимула. Обе зависимости удается удовлетворительно аппроксимировать одноэкспоненциальными функциями с близкими постоянными времени (штриховые кривые).
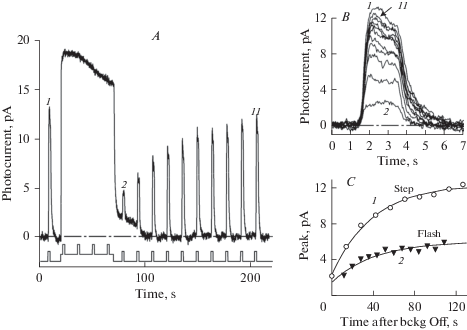
Рис. 2 демонстрирует изменение чувствительности клетки к коротким вспышкам света. Однако при естественных условиях наблюдения изменение освещенности в каждой точке сетчатки может соответствовать достаточно длительным по времени изменениям интенсивности. Поэтому мы также провели эксперименты с использованием тестирующих стимулов в виде световых стимулов длительностью 2 с (рис. 3). При такой стимуляции эффект “адаптационной памяти” оказался более выраженным (см. панели С на рис. 2 и рис. 3).
Рис. 3.
Влияние длительности тестирующего стимула на ход темновой адаптации. (А) – тот же протокол, что и на рис. 2, но вместо 2-миллисекундных вспышек использованы 2-секундные стимулы с интенсивностью 8 фотонов мкм–2 с–1. Адаптирующая фоновая засветка длительностью 50 с, 225 фотонов мкм–2 с–1. Одиночная запись, Гаусс-фильтрация 50 мс. (B) – форма ответов на тестирующие стимулы. (C) – сравнение хода темновой адаптации при тестировании короткими вспышками и 2-секундными стимулами. Диапазон изменения чувствительности к 2-секундным стимулам значительно шире, чем к вспышкам, вследствие изменения времени интегрирования (рис. 2, панели В, С). Сплошные кривые – одноэкспоненциальные аппроксимации с практически одинаковыми постоянными времени (39 с для ступенек и 42 с для вспышек). Fig. 3. Effect of the duration of test stimuli on deduced time course of dark adaptation. (A), same stimulus sequence as in Fig. 2, but 2-s steps of light are used instead of 2-ms flashes as testing stimuli. Test step intensity was 8 photons μm–2 s–1. Intensity of adapting 50-s background illumination intensity was 225 photons μm–2 s–1. Single record, Gauss-filtered with 50-ms window. (B) shows the shape of responses to test steps. (C). Comparing the time course of dark adaptation as tested by 2 ms flashes vs. 2 s steps. The extent of change of sensitivity to steps markedly exceeds that to flashes, evidently due to changing summation time (Fig. 2B, C). Solid lines show single-exponential approximations of the data. Time constants of the exponentials are virtually identical.
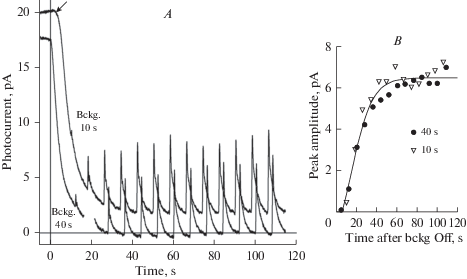
Мы также исследовали эффект изменения длительности адаптирующего фона на восстановление чувствительности. На рис. 4A две записи с длительностью фонового освещения 10 и 40 с смещены вдоль оси времени так, что момент выключения фона на каждой кривой совпадает с 0. Запись для фона 10 с смещена по вертикали, чтобы уменьшить перекрытие с записью для 40-секундного фона и облегчить их сравнение. Интересно, что при короткой (10 с) световой адаптации восстановление темнового тока начинается с задержкой в несколько секунд после выключения фона (стрелка на рис. 4А). При 40-секундной световой адаптации восстановление темнового тока начинается немедленно после выключения фона. Этот феномен, не имеющий пока объяснения, был обнаружен ранее [7]. Несмотря на это различие, восстановление чувствительности к вспышкам после выключения 10- и 40-секундного фона происходит практически одинаково (рис. 4B).
Рис. 4.
Влияние длительности адаптирующей засветки на восстановление чувствительности в ходе темновой адаптации. (А) – две записи с одинаковой интенсивностью тестирующих вспышек и адаптирующего фона. Длительность фоновых засветок 10 и 40 с. Записи сдвинуты вдоль оси времени так, чтобы моменты выключения фона приходились на 0 с. Кривая для 10-секундной фоновой засветки дополнительно сдвинута вертикально для меньшего перекрытия с кривой для 40 с фона. Стрелка у кривой для 10-секундной фоновой засветки указывает на задержку начала восстановления темнового тока после выключения фона. При 40-секундной фоновой засветке такой задержки нет. (В) – восстановление чувствительности после адаптации к 10- и 40-секундным фоновым засветкам происходит по сходной кинетике. Фоновая засветка 225 фотонов мкм–2 с–1, вспышка 2 мс, 0.88 фотонов мкм–2 за вспышку, усреднение 10 записей, Гаусс-фильтрация 50 мс. Fig. 4. Effect of the duration of the adapting steps on recovery of sensitivity during dark adaptation. (A), two records with identical adapting and testing intensities, but with the adapting durations of 10 s and 40 s. The records are shifted along the time axis to place the background turn-off at 0 s. 10-s background curve is additionally shifted vertically to reduce curves’ overlap. Arrow at the 10-s background curve points to a few-second delay between the background turn-off and the start of the recovery of the dark current. The delay is absent at 40-s background. (B). After either 10-s or 40-s light adaptation, the recovery of sensitivity follows the same time courses. Steps of 225 photons μm–2 s–1. Test flash duration 2 ms, intensity 0.88 photons μm–2 per flash. Average of 10 scans, Gauss-filtered with 50-ms window.
Сложная феноменология световой и темновой адаптации не имеет пока очевидного объяснения в рамках современных знаний о каскаде фототрансдукции и требует дальнейшего детального исследования. Некоторые особенности полученных результатов, однако, позволяют провести интерпретацию в терминах известных механизмов и их возможного функционального значения.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Механизмы изменения чувствительности в ходе световой и темновой адаптации
Сравнение ответов на короткие вспышки света в состоянии темновой адаптации и в ходе восстановления чувствительности после выключения светоадаптирующего фона показывает, что в ходе адаптации крутизна фронта ответов не изменяется. Начальные участки всех кривых совпадают, а различная амплитуда ответов связана с изменениями длительности фазы активации, т.е. момента достижения пика и начала возврата к пре-стимульному состоянию (рис. 2B, C). Это предполагает, что при световой/темновой адаптации не происходит изменения коэффициента усиления в каскаде, т.е. скорости активации в цепочке R*–T*–PDE*–гидролиз цГМФ. Световая адаптация контролируется процессами, обеспечивающими ускорение выключения активированного каскада. Это позволяет фоторецептору эффективно обменивать чувствительность на быстродействие.
Темновая адаптация в значительной мере (но не полностью) есть обращение световой адаптации [10]. Увеличение длительности ответов на вспышки при выходе из насыщения параллельно с увеличением их амплитуды означает, что при темновой адаптации увеличивается время интегрирования фотоответа (рис. 2D). Время интегрирования ti определяется как
где r(t) – фотоответ, rmax – его пиковое значение, а T – полная длительность.Увеличение времени интегрирования должно дополнительно повышать чувствительность к длительным стимулам (ступенькам света). Действительно, ответ на 2-секундные стимулы изменяется в ходе темновой адаптации в большей мере, чем ответ на вспышки (рис. 3А–С).
Сложившееся сейчас представление о механизмах световой адаптации приписывает изменения чувствительности и скорости фотоответа кальциевой обратной связи (стрелки 1–3 на рис. 1). Очевидно, что скорость таких регуляций определяется скоростью светоиндуцированных изменений концентрации свободного цитоплазматического Са2+. Предполагается, что эти изменения примерно соответствуют кинетике ответа на вспышки и укладываются в несколько секунд [3–8]. Математические модели возбуждения и адаптации, построенные на основе этих соображений, хорошо описывают экспериментальные ответы на вспышки [8, 11–13]. Описание ответов палочки на действие длительных (десятки секунд) стимулов менее удовлетворительно и требует введения ad hoc дополнительных механизмов, возможно, контролируемых не Са2+, а другими посредниками со специально сконструированной кинетикой [14]. Кроме того, экспериментально обнаружено, что существует медленная фаза регулировки чувствительности при световой адаптации, механизм которой не идентифицирован [7]. Мы также показали, что в ходе световой адаптации регулируется время жизни активированной ФДЭ – механизм, также не включенный в существующую схему (штриховая стрелка с вопросительным знаком на рис. 1) [8].
Наши новые результаты дополнительно усложняют проблему. Мы показываем, что через 20–25 с после выключения адаптирующей засветки ток фоторецептора возвращается к темновому уровню (рис. 2A). В существующей схеме (рис. 1) это должно соответствовать восстановлению “темновой” концентрации Са2+ и возвращению всех компонентов каскада в темноадаптированное состояние. В действительности чувствительность палочки остается пониженной, а кинетика ответа существенно ускоренной еще в течение более минуты при сохранении стабильного темнового тока (рис. 2–4). Мы назвали этот эффект “адаптационной памятью”. Адаптационная память предполагает существование длительной модификации компонентов фототрансдукционного каскада, возможно, зависящей не от Са2+, а, например, от фосфорилирования каких-то белков. Идентификация этих мишеней и участвующих посредников должна быть задачей дальнейшей работы.
Адаптационная память и последовательные образы
Последовательные образы возникают после действия на сетчатку интенсивных локальных стимулов. Выключение такого индуцирующего стимула оставляет светлое пятно, которое постепенно затухает и в конце концов исчезает – положительный последовательный образ. При наличии стационарного освещения достаточно обширной области зрительного поля, за затуханием положительного образа возникает отрицательный образ – темное пятно на светлом фоне. При ахроматическом локальном стимуле его последовательный образ также ахроматичен. При цветном освещении положительный образ имеет тот же цвет, что и индуцирующий стимул, а отрицательный образ – дополнительный к нему (пары зеленый–пурпурный, красный–циан, желтый–синий).
В самом общем смысле, основа последовательных образов достаточно очевидна. Возбуждение на некоторых уровнях зрительной системы не исчезает мгновенно после выключения индуцирующего стимула, а затухает постепенно, создавая положительный последовательный образ. С другой стороны, индуцирующий стимул вызывает локальную световую адаптацию, снижая чувствительность системы. Поэтому при наличии светлого окружающего фона стимулированная область выглядит темной (отрицательный образ).
Исследование свойств последовательных образов и механизмов их генерации имеет более чем вековую историю. Известно, что источником последовательных образов служит периферия. Если экспериментально блокировать передачу сигнала из глаза в мозг на время действия индуцирующего стимула, а потом ее восстановить, последовательный образ все равно возникает [15]. С другой стороны, в формировании субъективного восприятия последовательного образа (цвет, временной ход, зависимость от окружения и т.п.) большую роль играют центральные механизмы. Так, например, последовательные образы чувствительны к контекстному окружению в зрительном поле, в частности, к наличию отчетливых контуров у индуцирующих стимулов [16, 17]. При работе со стимулами в виде мозаичных многоцветно окрашенных поверхностей (картин Мондриана) последовательные образы, как и реальные объекты, демонстрируют константность воспринимаемого цвета в значительной мере независимо от спектрального состава освещения [18].
Тем не менее, вопрос об источниках последовательных образов в глазу остается нерешенным. Это могли бы быть сами фоторецепторные клетки, которые продолжали бы сигнализировать некоторое время после выключения света, и более длительно сохранять пониженную чувствительность из-за адаптационной памяти. Это могли бы быть и нейронные сети внутренней сетчатки, если бы возбуждение в них поддерживалось и после выключения света, а адаптационные перестройки сохранялись достаточно долгое время. Разумеется, эти две гипотезы не исключают друг друга [19, 20].
Наши результаты показывают, что необходимые для последовательных образов свойства обнаруживаются уже на самом первом уровне – в выходных сигналах фоторецепторов. Идея о том, что последовательные образы вызываются обесцвечиванием родопсина, была высказана уже давно [21–23]. Разумеется, это безусловно правильно, поскольку первичным источником зрительного сигнала является поглощение света зрительным пигментом. В ранних работах в основном не специфицировалось, каким образом обесцвечивание пигмента вызывает последовательный образ, конечно, из-за отсутствия конкретных биохимических и физиологических знаний о работе каскада фототрансдукции. Современный уровень исследованности каскада позволяет достаточно надежно идентифицировать молекулярные механизмы, ответственные за затухающую сигнализацию (положительный образ) и изменение чувствительности фоторецептора (отрицательный образ).
Прежде всего, поглощение кванта света вызывает серию реакций активации, а затем инактивации сигнального каскада, которые в палочках лягушки имеют характерные времена от 1 до 5 с. В результате выходной сигнал фоторецептора (фототок или мембранный потенциал в синаптической области) в ответ на короткую вспышку света имеет вид волны со временем затухания около 5 с. При увеличении интенсивности стимула амплитуда ответа градуально увеличивается, а затем насыщается. Время нахождения в насыщении может достигать 30–50 с и определяется в основном кинетикой выключения светоактивированного родопсина [10]. Важно отметить, что такие длительные ответы достигаются при интенсивностях стимула, обесцвечивающих около 10 000 молекул пигмента на палочку, т.е. меньше 0.001% наличного родопсина. Поэтому обесцвечивание как таковое (потеря родопсина) пренебрежимо и не может быть причиной понижения чувствительности после индукции последовательного образа.
Показано, что дальнейшее увеличение интенсивности стимула резко замедляет выход палочки из насыщения и последующее восстановление темнового тока [10]. При обесцвечивании ≈0.5% родопсина, по-прежнему пренебрежимом в отношении снижения поглощения, выход из насыщения начинается через 5 мин, а полное восстановление темнового тока занимает больше 20 мин. Медленность восстановления связана с накоплением и последующим распадом промежуточных продуктов фотолиза, которые с низкой вероятностью возбуждают каскад фототрансдукции. Наконец, восстановление чувствительности после значительного (десятки процентов) обесцвечивания родопсина (полная темновая адаптация) требует регенерации обесцвеченного родопсина и у человека занимает больше часа.
Таким образом, темновая адаптация палочек, в зависимости от уровня обесцвечивания, обеспечивается двумя группами механизмов. Быстрая (“биохимическая”) фаза создается теми же процессами выключения каскада фототрансдукции, что формируют кинетику ответа на короткие стимулы умеренной яркости (фосфорилирование родопсина, выключение активированной ФДЭ, активация гуанилатциклазы и цГМФ-управляемых каналов). Резкое замедление адаптации при высоких обесцвечениях (“фотохимическая” фаза) связана с потерей родопсина и накоплением его фотопродуктов, длительно стимулирующих каскад [10]. Очевидно, что при различных уровнях обесцвечивания может изменяться вклад периферических (фоторецепторы) и центральных (нейронные сети сетчатки и зрительных центров мозга) механизмов в генерацию и восприятие последовательных образов. Поэтому реального противоречия между фотохимической и нервной теорией возникновения последовательных образов, вероятно, нет.
В наших экспериментах использовались умеренные интенсивности стимулов, находящиеся в пределах биохимической фазы адаптации. Соответственно, восстановление темнового тока после выключения адаптирующего фона (затухание положительного последовательного образа) происходит достаточно быстро и соответствует выключению активированных компонентов каскада (родопсина и ФДЭ). В рамках имеющейся схемы (рис. 1), полное восстановление темнового тока должно означать полное возвращение компонентов каскада в исходное темновое состояние. Мы, однако, показываем, что после возврата тока к темновому уровню чувствительность палочки остается пониженной в течение 1–2 мин (рис. 2–4). Чувствительность подавлена в результате медленно обратимых процессов, ускоряющих выключение активированного каскада на свету (адаптационной памяти). Адаптационная память может отвечать за возникновение отрицательных последовательных образов.
Список литературы
Pugh Jr., Edward N., Lamb T.D. Phototransduction in vertebrate rods and cones: molecular mechanisms of amplification, recovery and light adaptation. In: Handbook of biological physics. V. 3. 183–255. North-Holland. 2000.
Arshavsky V.Y., Lamb T.D., Pugh E.N. Jr. G proteins and phototransduction. Annu. Rev. Physiol. 64: 153–187. 2002.
Фирсов М.Л., Говардовский В.И. Световая адаптация фоторецепторов: смысл и механизмы. Сенс. сист. 15(2): 101–113. 2001. [Firsov M.L., Govardovskii V.I. Photoreceptor light adaptation: meanings and mechanisms. Sens. Syst. 15(2): 101–113. 2001. (In Russ)].
Arshavsky V.Y., Burns M.E. Photoreceptor signaling: supporting vision across a wide range of light intensities. J. Biol. Chem. 287(3): 1620–1626. 2012.
Chen J., Woodruff M.L., Wang T., Concepcion F.A., Tranchina D., Fain G.L. Channel modulation and the mechanism of light adaptation in mouse rods. J. Neurosci. 30(48): 16232–16240. 2010.
Vinberg F., Chen J., Kefalov V.J. Regulation of calcium homeostasis in the outer segments of rod and cone photoreceptors. Prog. Retin. Eye Res. 67: 87–101. 2018.
Calvert P.D., Govardovskii V.I., Arshavsky V.Y., Makino C.L. Two temporal phases of light adaptation in retinal rods. J. Gen. Physiol. 119(2): 129–146. 2002.
Astakhova L.A., Firsov M.L., Govardovski V.I. Kinetics of turn-offs of frog rod phototransduction cascade. J. Gen. Physiol. 132(5): 587–604. 2008.
Baylor D.A., Lamb T.D., Yau. K.-W. The membrane current of single rod outer segments. J. Physiol. 288: 589–611. 1979.
Firsov M.L., Kolesnikov A.V., Golobokova E.Y. Govardovskii V.I. Two realms of dark adaptation. Vision Res. 45(2): 147–151. 2005.
Hamer R.D., Nicholas S.C., Tranchina D., Lamb T.D., Jarvinen J.L. Toward a unified model of vertebrate rod phototransduction. Vision Neurosci. 22: 417–436. 2005.
Invergo B.M., Dell’Orco D., Montanucci L., Koch K.W., Bertranpetit J. A comprehensive model of the phototransduction cascade in mouse rod cells. Mol. Biosystems. 10(6): 1481–1489. 2014.
Кузьмин Д.Г., Травников С.В., Фирсов М.Л., Говардовский В.И. Математическое моделирование фототрансдукции и световой адаптации в палочках сетчатки лягушки. Сенс. сист. 18 (4): 305–316. 2004. [Kuzmin D.G., Travnikov S.V., Firsov M.L., Govardovskii V.I. Mathematical Model of Phototransduction and Light Adaptation in Frog Retinal Rods. Sens. Syst. 18 (4): 305–316. 2004. (In Russ)].
Morshedian A., Fain G.L. Molecular mechanism of adaptation in vertebrate rods. In: Vertebrate Photoreceptors. 73–90. Springer. Tokyo. 2014.
Craik K.J.W. Origin of visual after-images. Nature. 145: 512. 1940.
van Lier R., Vergeer M., Anstis S. Filling-in afterimage colors between the lines. Curr. Biol. 19(8): R323–R324. 2009.
Powell G., Bompas A., Sumner P. Making the incredible credible: Afterimages are modulated by contextual edges more than real stimuli. J. Vision. 12(10): 1–13. 2012.
Zeki S., Cheadle S., Pepper J., Mylonas D. The constancy of colored after-images. Front. Hum. Neurosci. 11: 229. 2017.
Loomis J.M. The photopigment bleaching hypothesis of complementary after-images. Vision Res. 12: 1587–1594. 1972.
Virsu V., Laurinen P. Long-lasting afterimages caused by neural adaptation. Vision Res. 17(7): 853–860. 1977.
Brindley G.S. The discrimination of after-images. J. Physiol. (London). 147: 194–203. 1959.
Barlow H.B., Sparrock J.M.B. The role of afterimages in dark adaptation. Science. 144: 1309–1314. 1964.
MacLeod D.I.A. Rod origin of prolonged afterimages. Science. 185: 1171–1172. 1974.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


