Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 5, стр. 654-662
Двигательная активность и уровни экспрессии мРНК белков NAP-22 и GAP-43 у крыс со спонтанной гипертензией
А. С. Альдекеева 1, С. Я. Резник 2, Ю. С. Крайнова 1, Н. З. Клюева 1, *
1 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 Зоологический институт РАН
Санкт-Петербург, Россия
* E-mail: KluevaNZ@infran.ru
Поступила в редакцию 05.02.2020
После доработки 18.03.2020
Принята к публикации 19.03.2020
Аннотация
Цель исследования – выявить различия в двигательной активности крыс линии SHR и WKY и оценить уровень экспрессии мРНК белков NAP-22 и GAP-43 в нейронах теменной коры и гиппокампа. Двигательную активность крыс линий SHR и WKY (4 животных в каждой группе) фиксировали телеметрическим методом в течение 3 суток. Уровни экспрессии мРНК белков NAP-22 и GAP-43 в нейронах теменной коры и гиппокампа у других групп крыс этих линий (по 10 животных каждой линии) определялись методом ПЦР в реальном времени. Работа выполнена с использованием животных из Биоколлекции ИФ РАН. Найдено, что двигательная активность крыс линии SHR была выше, чем крыс линии WKY, но статистически эти различия были достоверны только во время темновой фазы. Уровень экспрессии мРНК белков NAP-22 и GAP-43 у крыс линии SHR был ниже, чем у крыс линии WKY как в теменной коре, так и в гиппокампе. Заключается, что большая подвижность крыс линии SHR отражает характерную для крыс этой линии гиперактивность, что делает их удобной моделью синдрома дефицита внимания с гиперактивностью. Изменения в уровне экспрессии мРНК белков NAP-22 и GAP-43 могут быть связаны с поведенческими нарушениями.
В последнее время крысы со спонтанной гипертензией (линии SHR) широко используются в качестве экспериментальной модели синдрома дефицита внимания с гиперактивностью у детей (СДВГ). При сравнении крыс линий SHR с их нормотензивным контролем, линией WKY, наблюдаются выраженные межлинейные отличия [1–3]. Крысы линии SHR имеют более высокий уровень двигательной активности в целом, а также отличаются по распределению активности в темное и светлое время суток (световую и темновую фазу) от крыс линии WKY [4, 5]. Однако механизмы возникновения таких отличий и возможные молекулярные и клеточные процессы, влияющие на уровень активности, остаются недостаточно исследованными. СДВГ – это широко распространенное, хроническое, неврологическо-поведенческое расстройство развития, которое проявляется с раннего детского возраста и выражается в нарушениях концентрации внимания и гиперактивности (встречается примерно у 5% детского населения [6]), у взрослых может перерасти в снижение интеллекта и трудности с восприятием информации. Для крыс линии SHR характерны генетически детерминированные нарушения обмена кальция в клетке, проявляющиеся в изменении структуры и функционирования кальциевых каналов разных типов [7], что приводит к перегрузке цитозоля клеток несвязанными ионами Ca2+. Также у этих животных имеются серьезные отличия в обмене катехоламинов [8].
Структуры, осуществляющие реализацию и регуляцию суточных ритмов, включают разнообразные осцилляторы, важнейшим из которых является супрахиазматическое ядро гипоталамуса [9], функционирование которого играет ведущую роль в поддержании энергетического баланса, сна, терморегуляции, пищевого поведения и двигательной активности [10].
Ранее было показано, что крысы линии SHR демонстрируют отличия в уровне двигательной активности по сравнению с крысами линии WKY, и максимальные межлинейные различия отмечаются в возрасте от 4 до 16 недель. В этом возрасте в тесте открытое поле у крыс линии SHR была существенно выше горизонтальная и вертикальная активность, общая измеренная длина пробега [5].
Другим следствием нарушения обмена кальция в клетке у крыс линии SHR являются изменения в уровне экспрессии мРНК таких мажорных субстратов протеинкиназы С (ПКС), как белки GAP-43 и NAP-22. Среди широкого спектра функций этих белков в мозге – регуляция концентрации кальмодулина, ускорение роста аксонов, усиление ветвления нервных окончаний, регуляция высвобождения нейротрансмиттера [11]. Исследуемые белки участвуют в кальциевом пути передачи внутриклеточного сигнала, непосредственно взаимодействуя с протеинкиназой С и кальмодулином. В предыдущих исследованиях мы обнаружили, что в раннем постнатальном онтогенезе содержание этих белков в различных структурах головного мозга, в частности в теменной коре и гиппокампе, у крыс линии SHR достоверно выше, чем у крыс линии WKY [12]. Это указывает на изменение кальций-зависимых каскадов передачи внутриклеточного сигнала. Известно также, что содержание ионов кальция в нейронах супрахиазматического ядра, регулирующего суточные ритмы, само подчиняется этим ритмам [13].
Кроме того, показано, что структуры гиппокампа непосредственно влияют на суточную ритмику двигательной активности. Разрушение этой структуры ведет к нарушению динамики двигательной активности, характерной для этих животных [14]. Также, в реализации ритма локомоторной активности у крыс, кроме супрахиазматического ядра, участвуют структуры дорсального отдела стриатума и теменной коры [15].
Таким образом, цели настоящего исследования – анализ суточного распределения двигательной активности крыс со спонтанной гипертензией (линии SHR) и крыс линии WKY (нормотензивный контроль), а также оценка влияния нарушений обмена кальция в нейронах у этих животных на изменение уровня экспрессии мРНК белков NAP-22 и GAP-43, задействованных в кальций-зависимых каскадах передачи внутриклеточного сигнала в теменной коре и гиппокампе, что связано с непосредственным участием их в формировании суточной ритмики двигательной активности.
МЕТОДЫ ИССЛЕДОВАНИЯ
В опытах использовали 4 взрослых самца линии SHR массой 180–250 г, АД выше 170 мм рт. ст., и 4 взрослых самца линии WKY такой же массы, АД ниже 125 мм рт. ст. (в качестве контроля) в возрасте 12–14-ти недель. Регистрация АД у всех животных производилась манжеточным методом перед и после эксперимента (с помощью окклюзионной манжетки и электроманометра “ELEMA”). Рассчитывалось среднее значение системного АД по результатам трех последних измерений. Для оценки уровня двигательной активности был разработан специальный биотелеметрический комплекс, в камерах которого в процессе опыта поддерживалась температура 20°С, длительность светового дня составляла 12 ч (с 10:00 до 22:00). Все клетки были сконструированы согласно санитарным правилам по устройству, оборудованию и содержанию вивариев от 6 апреля 1973 г. со свободным доступом к еде и воде. Крысы получали сухой корм производства ЗАО “Гатчинский комбикормовый завод” (рецепт № ПК-120 сх_1492 для лабораторных животных) и обычную питьевую воду. Работа выполнена с использованием животных из Биоколлекции ИФ РАН, при проведении экспериментов соблюдались все требования комиссии по контролю по содержанию и использованию лабораторных животных при Институте физиологии им И.П. Павлова РАН. Это исследование проводилось в соответствии с принципами Базельской декларации, Международными стандартами по работе с лабораторными животными, и с разрешения комиссии по биоэтике ФГБУН “Институт физиологии имени И.П. Павлова” РАН (протокол № 01/08 от 01.08.19 г.).
Регистрация двигательной активности
Двигательную активность крыс регистрировали в течение трех суток методом телеметрии с использованием установленных по бокам клеток оптических датчиков барьерного типа, которые фиксировали прерывание луча при перемещении крысы из одной части клетки в другую. Высота расположения и чувствительность датчиков были рассчитаны таким образом, чтобы, по возможности, исключить ложные срабатывания. Сигналы от всех датчиков собирались аппаратно и обрабатывались на компьютере, суммирующем число пересечений по 5-минутным интервалам, а затем эти данные были усреднены для световой и темновой фаз трех дней наблюдения за каждой особью.
Исследование уровня экспрессии мРНК белков – мажорных субстратов ПКС
В этом опыте использовали другие группы самцов линии SHR массой 180–250 г и самцов линии WKY той же массы и возраста, содержащиеся в таких же условиях. Для определения уровня экспрессии мРНК этих белков в образцах нервной ткани (теменная кора и гиппокамп) животные были декапитированы под легким эфирным наркозом с последующим забором проб. Из образцов нервной ткани крыс обеих линий была выделена суммарная мРНК с помощью набора Quick-RNA™ MiniPrepKit (ZymoResearch, США) согласно протоколу исследования. Далее осуществляли синтез комплементарной ДНК обратной транскрипцией. Уровни экспрессии NAP-22 и GAP-43 определяли методом ПЦР в реальном времени с использованием специфических праймеров на амплификаторе АНК-32 (ИАП РАН, Россия). В качестве референса для нормировки результатов амплификации использовали ген β-актина. В табл. 1 приведены последовательности праймеров и зондов для детекции транскриптов генов NAP-22, GAP-43 и β-актина. Условия проведения ПЦР: 1. 95°С 300 с – 1 цикл; 2. 60°С 40 с, 95°С 15 с – 50 циклов. Количественное выражение результатов проводилось с помощью расчета разницы экспрессии исследуемого гена относительно нормировочного гена по формуле 2–∆∆CT [16]. Всего в этом опыте использовано по 10 самцов каждой линии.
Таблица 1.
Праймеры и зонды для детекции транскриптов генов белков NAP-22, GAP-43 и β-актина Table 1. Primers and probes for the detection of the NAP-22, GAP-43 and β-actin genes transcripts
| Ген белков Gene |
Праймеры и зонды Primers and probes | Последовательность (5'–3') Sequence (5'–3') |
|---|---|---|
| NAP-22 | rNAP22-F2 | AACTCCAAGATGGGAGGCAAG |
| rNAP22-R2 | CAGCCTTCTTGTCTTTGTCCTT | |
| rNAP-22 probe ROX | (ROX)CTACAATGTGAACGACGAGAAGGCCA(BHQ-2) | |
| GAP-43 | GAP43-up | GAAGAGAGGAGGAAAGGAGAG |
| GAP43-low | TCAACCTGTTTGGTTCTTCTCATA | |
| rGAP43 probe ROX | (ROX)CAGCATGGTGGTATGTTCCCCTGCC(BHQ-2) | |
| β-актин | Rat_ACTB_u | AGCCATGTACGTAGCCATCCA |
| Rat_ACTB_l | TCTCCGGAGTCCATCACAATG | |
| Rat_ACTB_Pr_up2 | (FAM)TGTCCCTGTATGCCTCTGGTCGTACCAC(RTQ1) |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
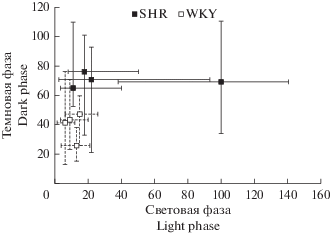
Данные о средней двигательной активности каждой особи каждой из двух линий во время световой и темновой фаз опыта представлены на рис. 1. На этом рисунке хорошо видны и межлинейные различия (двигательная активность SHR выше, чем WKY) и различия между особями одной линии. При этом межлинейные различия в двигательной активности статистически достоверны по критерию Манна–Уитни в темную (p < 0.05), но не в светлую (p > 0.05) фазы суточного цикла.
Рис. 1.
Двигательная активность крыс линий SHR и WKY. Каждый символ соответствует одной особи. Приведены медианы и квартили двигательной активности за час трехдневных наблюдений для световой и темновой фаз суточного цикла (n = 36). Fig. 1. Locomotor activity of SHR and WKY strain rats. Each symbol corresponds to one individual. Medians and quartiles of hourly locomotor activity for the light and dark phases of the 3 days of observations are shown (n = 36).
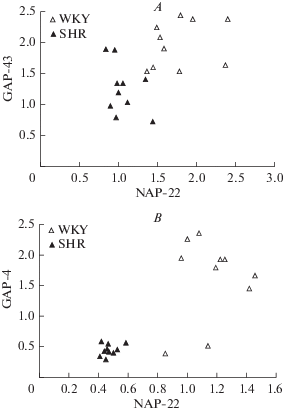
Из рис. 2 видно, что уровни экспрессии мРНК белков NAP-22 и GAP-43 в нейронах теменной коры и гиппокампа крыс линии SHR ниже, чем у крыс линии WKY. Достоверность этих межлинейных различий по критерию Манна–Уитни достаточно высока (р < 0.01) и для обоих белков и для обеих структур головного мозга.
Рис. 2.
Уровни экспрессии мРНК белков NAP-22 и GAP-43 в нейронах теменной коры (А) и гиппокампа (В) крыс линий SHR и WKY. Каждый символ соответствует одной особи. Fig. 2. The expression levels of mRNA of NAP-22 and GAP-43 proteins in the neurons of the parietal cortex (A) and hippocampus (B) of SHR and WKY strain rats. Each symbol corresponds to one individual.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наличие индивидуальных внутрилинейных различий у крыс со спонтанной гипертензией можно объяснить тем, что генетически детерминированные нарушения обмена кальция у этих животных могут проявляться в разной степени в зависимости от выраженности нарушений функционирования молекулярных механизмов, обеспечивающих поддержание постоянной концентрации ионов кальция в цитоплазме. Наши исследования показали, что и у крыс линии WKY (нормотензивный контроль) могут частично проявляться генетически детермированные нарушения обмена кальция в клетке, что может проявляться в обнаруженных различиях между отдельными особями. Следует отметить, что у некоторых животных могут включаться компенсаторные механизмы (например, связанные с изменением уровня поступления экзогенного кальция), и может меняться степень вовлечения внутриклеточных механизмов, участвующих в обмене кальция (например, активность кальциевых АТФаз).
Изменения уровня экспрессии мРНК белков, основных субстратов ПКС в нейронах теменной коры и гиппокампа, могут косвенно отражать изменения функционирования соответствующего кальций-зависимого каскада передачи внутриклеточного сигнала в нейронах этих структур. Наличие у крыс линии SHR таких изменений подтверждает, что генетически детерминированные нарушения обмена кальция в клетках этих животных [7, 17] могут затрагивать не только функционирование структур сердечно-сосудистой системы (в том числе гладкомышечных клеток сосудистой стенки и кардиомиоцитов), но и структур ЦНС. Также у крыс со спонтанной гипертензией, из-за низкого уровня содержания ионов кальция во внеклеточной среде, начинается выработка в паращитовидных железах особого паратиреоидного гипертензивного фактора (ПГФ, представляющего собой связанный с фосфолипидом олигопептид), который исследовался в первой декаде 21 века. ПГФ специфически воздействует на систему адренорецепторов, является пролонгированным вазопрессором, повышает чувствительность к экзогенным катехоламинам, и, возможно, замедляет их катаболизм [18]. Воздействие ПГФ осуществляется на фоне существенных различий в активности гипоталамо-гипофизарной адреналовой оси по сравнению с крысами линии WKY [8]. Можно полагать, что наблюдаемые нами эффекты являются также следствием вышеописанных изменений функционирования адренергической системы в теменной коре и гиппокампе, и полученные нами данные могут использоваться для количественной оценки воздействия тех или иных фармакологических агентов (в частности, адреностимуляторов и адреноблокаторов).
Особенности обмена белка NAP-22 у крыс со спонтанной гипертензией могут быть полезны для понимания значения этого белка, которое, учитывая его многообразную регуляторную функцию [11], представляет собой интересный предмет исследований. Эти данные полезны для понимания особенностей функционирования кальций-зависимых каскадов передачи внутриклеточного сигнала в условиях генетически детерминированных нарушений обмена кальция в клетке. Белки NAP-22 и GAP-43 в процессе онтогенеза активно участвуют в образовании нейронных сетей, а у взрослых животных в обеспечении процессов нейропластичности, и нарушения или изменения их обмена в нейронах могут свидетельствовать о нарушениях этих процессов [19], что, в свою очередь, может оказаться одним из механизмов реализации характерных для СДВГ поведенческих нарушений [20]. Исследование белков – основных субстратов ПКС открывает возможности для ранней диагностики (в том числе пренатальной и ранней постнатальной) этого заболевания и поиска новых приемов для нормализации таких отклонений. В отличие от GAP-43 белок NAP-22 не является исключительно нейроспецифичным, поэтому исследование его обмена обладает более высокой диагностической ценностью.
ЗАКЛЮЧЕНИЕ
Двигательная активность крыс линии SHR выше, чем у крыс линии WKY. Уровни экспрессии мРНК белков NAP-22 и GAP-43 в нейронах теменной коры и гиппокампа крыс линии SHR ниже, чем у крыс линии WKY.
Исследование белков – основных субстратов ПКС позволяют выявить связь наблюдаемых молекулярных закономерностей именно с генерализованной патологией, что и имеет место у крыс линии SHR – генетически детерминированные нарушения обмена кальция в клетках, общее повышение артериального давления, а также такие симптомы СДВГ, как гиперактивность, импульсивность, сложности с обучением. Полученные нами данные дополняют характеристику крыс линии SHR в качестве модели СДВГ по динамике распределения двигательной активности, а также в качестве животных с генетически детерминированными нарушениями метаболизма катехоламинов и кальция в клетках.
Список литературы
Sagvolden T., Johansen E.B. Rat models of ADHD. In: Stanford C., Tannock R. (Eds.) Behavioral neuroscience of attention deficit hyperactivity disorder and its treatment. Berlin/Heidelberg. Springer. 2012: 301–315.2012. https://doi.org/10.1007/7854_2011_126
Fan X., Bruno K.J., Hess E.J. Rodent models of ADHD In: Stanford C., Tannock R. (Eds.) Behavioral neuroscience of attention deficit hyperactivity disorder and its treatment. Berlin/Heidelberg. Springer. 273–300. 2012. https://doi.org/10.1007/7854_2011_121
Tsai M.L., Kozłow2ska A., Li Y.S., Shen W.L., Huang A.C.W. Social factors affect motor and anxiety behaviors in the animal model of attention-deficit hyperactivity disorders: A housing-style factor. Psychiatry Res. 254: 290–300. 2017. https://doi.org/10.1016/j.psychres.2017.05.008
Lai C.T., Chen C.Y., Kuo T.B., Chern C.M., Yang C.C. Sympathetic hyperactivity, sleep fragmentation, and wake-related blood pressure surge during late-light sleep in spontaneously hypertensive rats. Am. J. Hyperten. 29(5): 590–597. 2015. https://doi.org/10.1093/ajh/hpv154
Hsieh Y.L., Yang C.C. Age-series characteristics of locomotor activities in spontaneously hypertensive rats: a comparison with the Wistar–Kyoto strain. Physiol. Behav. 93(4–5): 777–782. 2008. https://doi.org/10.1016/j.physbeh.2007.11.032
Заваденко Н.Н. Синдром дефицита внимания и гиперактивности: новое в диагностике и лечении. Вестник Северн. (Арктического) федер. универ. Серия: Мед.-биол. науки. 1: 31–39. 2014. [Zavadenko N.N. Attention deficit hyperactivity disorder: new in the diagnosis and treatment. – Vestnik Severn. (Arkticheskogo) federal. univer. Seriya: Mediko-Biol. Sci. 1: 31–39. 2014. (In Russ)].
Cox R.H., Rusch N.J. New expression profiles of voltage-gated ion channels in arteries exposed to high blood pressure. Microcirculation. 9(4): 243–257. 2002. https://doi.org/10.1038/sj.mn.7800140
Berg T. Altered β1-3-adrenoceptor influence on α2-adrenoceptor-mediated control of catecholamine release and vascular tension in hypertensive rats. Front.Physiol. 6: 120. 2015. https://doi.org/10.3389/fphys.2015.00120
Takahashi J.S. Transcriptional architecture of the mammalian circadian clock. Nat. Rev. Genetics. 18(3): 164. 2017. https://doi.org/10.1038/nrg.2016.150
Huang W., Ramsey K.M., Marcheva B., Bass J. Circadian rhythms, sleep, and metabolism. J. Clin. Invest. 121 (6): 2133–2141. 2011. https://doi.org/10.1172/JCI46043
Mosevitsky M.I. Nerve ending “signal” proteins GAP-43, MARCKS, and BASP1. Int. Rev. Cytol. 245: 245–325. 2005. https://doi.org/10.1016/S0074-7696(05)45007-X
Клюева Н.З., Руденко Е.Д., Альдекеева А.С., Плеханов А.Ю., Чернышев Ю.И., Антонова О.С. Влияние солевой нагрузки на уровень обмена белка NAP 22 – мажорного субстрата протеинкиназы С – в гиппокампе и теменной коре крыс со спонтанной гипертензией. Артер. гипертенз. 23(4): 325–331. 2017. [Klyueva N.Z., Rudenko E.D., Aldekeeva A.S., Plekhanov A.Y., Chernyshev Y.I., Antonova O.S. Metabolism of the major protein kinase C substrate NAP-22 in hippocampus and parietal cortex of spontaneously-hypertensive rats: the impact of dietary salt load. Arter. Hypertens. 23(4): 325–331. 2017. https://doi.org/10.18705/1607-419X-2017-23-4-325-331
Enoki R., Ono D., Kuroda S., Honma S., Honma K.I. Dual origins of the intracellular circadian calcium rhythm in the suprachiasmatic nucleus. Scient. Rep. 7: 41733. 2017. https://doi.org/10.1038/srep41733(2017)
Арушанян Э.Б., Попов А.В. Современные представления о роли супрахиазматических ядер гипоталамуса в организации суточного периодизма физиологических функций. Успехи физиол. наук. 42(4): 39–58. 2011. [Arushanyan E.B., Popov A.V. Modern ideas about the role of the suprachiasmatic nuclei of the hypothalamus in the organization of daily periodism of physiological functions. Advanc. Physiol. Sci. 2011; 42(4): 39–58. 2011. (In Russ)].
Natsubori A., Honma K., Honma S. Dual regulation of clock gene Per2 expression in discrete brain areas by the circadian pacemaker and methamphetamine-induced oscillator in rats. Eur. J. Neurosci. 39(2): 229–240. 2014. https://doi.org/10.1111/ejn.12400
Schmittgen T.D., Livak K.J. Analyzing real-time PCR data by the comparative C (T) method. Nat. Protoc. 3(6): 1101–1108. 2008. https://doi.org/10.1038/nprot.2008.73
Cox R.H., Fromme S. Expression of calcium channel subunit variants in small mesenteric arteries of WKY and SHR. Am. J. Hypertens. 28(10): 1229–1239. 2015. https://doi.org/10.1093/ajh/hpv024
Чурина С.К., Клюева Н.З., Антонова О.С., Руденко Е.Д., Петрова Е.И., Макаров В.Л., Борисова И.Ю. Генетически детерминированные механизмы развития артериальной гипертензии при дефиците экзогенного кальция (паратиреоидный гипертензивный фактор). Артер. гипертенз. 20(5): 343–348. 2014. [Churina S.K., Klyueva N.Z., Antonova O.S., Rudenko E.D., Petrova E.I., Makarov V.L., Borisova I.Y. Genetically determined mechanisms of arterial hypertension related to dietary calcium deficiency (parathyroid hypertensive factor). Arter. Hypertens. 20(5): 343–348. 2014. https://doi.org/10.18705/1607-419X-2014-20-5-342-348 (In Russ)].
Kropotova E., Klementiev B., Mosevitsky M. BASP1 and its N-end fragments (BNEMFs) dynamics in rat brain during development. Neurochem. Res. 38(6): 1278–1284. 2013. https://doi.org/10.1007/s11064-013-1035-y
Zhou R., Bai Y., Yang R., Zhu Y., Chi X., Li L., Chen L. Abnormal synaptic plasticity in basolateral amygdala may account for hyperactivity and attention-deficit in male rat exposed perinatally to low-dose bisphenol-A. Neuropharmacology. 60(5): 789–798. 2011. https://doi.org/10.1016/j.neuropharm.2011.01.031
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


