Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 5, стр. 631-653
Сравнительная характеристика липидного состава и морфофункциональных показателей ядерных и безъядерных эритроцитов в условиях гипоксии
В. В. Ревин 1, Н. В. Громова 1, *, Э. С. Ревина 1, И. П. Грунюшкин 1, Т. П. Кузьменко 1, Т. О. Ошкина 1, С. С. Бочкарева 1
1 Национальный исследовательский Мордовский государственный университет
им. Н.П. Огарева
Саранск, Россия
* E-mail: nataly_grom@mail.ru
Поступила в редакцию 26.02.2020
После доработки 02.04.2020
Принята к публикации 04.04.2020
Аннотация
Проведено сравнительное исследование свойств ядерных и безъядерных эритроцитов в условиях экспериментальной гипоксии. Определяли фосфолипидный и жирнокислотный состав индивидуальных фосфолипидов, содержание свободных жирных кислот в составе безъядерных и ядерных эритроцитов при помощи тонскослойной хроматографии. Методом лазерной интерференционной микроскопии изучали морфометрические характеристики ядерных и безъядерных эритроцитов и распределение гемоглобина. Методом спектроскопии комбинационного рассеяния изучали конформационные изменения гемопорфирина ядерных и безъядерных эритроцитов в условиях гипоксии. Показано, что в условиях гипоксии в мембранах как ядерных, так и безъядерных эритроцитов происходят изменения в фосфолипидном и жирнокислотном составе, ведущие к накоплению лизоформ фосфолипидов, диацилглицерола и свободных жирных кислот, а также к повышению степени насыщенности жирных кислот в составе фосфолипидов. Данные изменения свидетельствуют о структурных перестройках в мембране безъядерных и ядерных эритроцитов и, вследствие этого о функциональных изменениях как со стороны эритроцита в целом, так и основного кислородтранспортного белка эритроцитов – гемоглобина.
В результате многочисленных исследований детально доказана роль изменений сердечно-сосудистой и дыхательной систем в развитии кислородной недостаточности тканей, тогда как значение кислородтранспортной функции крови в возникновении гипоксии, развитии и прогрессировании гипоксически обусловленных состояний изучена недостаточно. В настоящее время считается, что одним из основных механизмов возникновения сердечно-сосудистых заболеваний является нарушение структуры и функции эндотелия сосудов [1, 2].
При этом первичные звенья патогенеза эндотелиальной дисфункции, в частности, возможная роль гемической и тканевой гипоксии в ее развитии остаются недостаточно исследованными. Так, не уделено серьезного внимания одному из важнейших звеньев системы транспорта кислорода – гемоглобину эритроцитов. В то же время известно, что изменение морфологических и функциональных характеристик эритроцитов существенно влияет на эффективность переноса кислорода в организме, определяя развитие многих патологических состояний [3–5].
Также важной причиной нарушений кислородтранспортной системы может быть изменение свойств гемоглобина, определяющих его сродство к кислороду, связанное с нарушением конформации гемопорфирина [6–8].
Важными составляющими в регуляции функциональных характеристик эритроцитов и находящегося в нем гемоглобина являются состояние и динамика липидного бислоя мембран. В зрелом эритроците человека нет ядра, при действии протеаз и липаз разрушаются рибосомы и митохондрии [9]. Как известно, основная (кислородтранспортная) функция эритроцитов не является энергозависимой [10]. Тем не менее, для поддержания стабильности мембран эритроцитов важное значение имеет способность клеток к синтезу АТФ [11–13].
Утрата ядра и митохондрий, таким образом, может играть определенную роль в перераспределении гемоглобина в клетке и тем самым влиять на его кислородтранспортные способности, а лекарственные средства, усиливающие метаболическую активность эритроцита, могут способствовать усилению кислородтранспортных свойств, что можно установить в сравнительном эксперименте на ядерных и безъядерных эритроцитах.
МЕТОДЫ ИССЛЕДОВАНИЯ
Постановка эксперимента
Объектом исследования служили эритроциты периферической крови человека, полученные из цельной крови доноров на Республиканской станции переливания крови. Донорами являлись практически здоровые люди (n = 39) мужского пола в возрасте от 25 лет до 39 лет (средний возраст 32.1 г.). Их средние гематологические показатели: RBC (1012/л) – 4.68 ± 0.09; Гб – 134.6 ± 4.56 г/л. Исследование проведено с разрешения локального этического комитета при Мордовском государственном университете в соответствии с принципами Good Clinical Practice (протокол № 12 от 17 сентября 2014 г.). Информированное согласие доноров на участие в исследовании получено.
Кровь забирали утром натощак из локтевой вены в вакуумные пробирки, после чего из венозной крови получали эритроцитарную взвесь.
Также в качестве объекта исследования использовали эритроциты крови половозрелых голубей (Columba livia, 29 птиц) в возрасте 4–8 лет массой 300 г. При работе с птицами полностью соблюдали международные принципы Хельсинкской декларации о гуманном отношении к животным.
Получение суспензии эритроцитов
В качестве антикоагулянта применялся 3Na-цитрат, конечная концентрация составляла 13 мМ, pH = 7.35. Форменные элементы крови осаждали центрифугированием 10 мин при 1000 g. Плазму и лейкоцитарный слой отбрасывали, осадок ресуспендировали в десятикратном объеме среды промывания и инкубации эритроцитов, которая содержала (мМ): 10 KH2PO4, 3.5 KCl, 1.5 MgCl2, 145 NaCl, 6 глюкозы, pH = 7.4 [14]. Осаждали эритроциты центрифугированием при 1000 g 15 мин (температура 4°С). Процедуру промывания повторяли трехкратно. Полученный осадок эритроцитов разводили средой промывания в соотношении 1 : 5 (V : V). Суспензию эритроцитов хранили в холодильнике при температуре 4°С не более 6 ч. В течение этого времени эритроциты использовали для проведения дальнейших экспериментов.
Процедура получения эритроцитов голубя не отличалась от процедуры получения эритроцитов человека.
Инкубация эритроцитов
Эритроцитарную массу хорошо размешивали и отбирали 10 мл в инкубационную камеру. Время инкубации составляло 60 мин. В инкубационной камере поддерживалась стабильная температура 37°С (в случае с ядерными эритроцитами голубя – 40°С).
Для создания экспериментальной гипоксии мы использовали пропускание (барботаж) азота через инкубационную среду с эритроцитами [15]. За основу была взята модифицированная методика Wood с соавт. [l6] и Ramser с соавт. [16, 17]. Использована установка, разработанная инженерами нашей кафедры. Инкубация эритроцитов проводилась в пробирках, герметично закрытых силиконовыми пробками. Газовую смесь, содержащую N2 и 0.04% СО2 (ООО Торговая компания “ПРОМКОМПЛЕКТ-С”) осторожно пропускали через суспензию эритроцитов через входные отверстия, просверленные в силиконе (от которых в суспензию опускались тонкие капилляры). Из пробирок газ удалялся через выходные отверстия. Скорость подачи газовой смеси составляла 5 см3/мин. Процедура продувки газа проводилась при температуре 37°С (в случае эритроцитов голубя 40°С) с использованием водяной бани.
После инкубации эритроциты осаждались центрифугированием при 1000 g в течение 10 мин, после чего небольшую часть осадка ресуспендировали в среде промывания, приготавливали препараты для микроскопии, другая часть использовалась для получения мембран.
Выделение мембран из эритроцитов человека
Осадок эритроцитов подвергался лизису в охлажденном растворе 5 мМ NaH2PO4 (pH = 8.0; T = 4°С). Соотношение осадка эритроцитов к лизирующему раствору составляло 1 : 20 (V : V).
Смесь оставляли на 10 мин при 4°С. После этого центрифугировали при 20 000 g в течение 50 мин (температура 0°C). Надосадочную жидкость отбрасывали, осадок ресуспендировали в лизирующем растворе. Центрифугировали при 20 000 g в течение 50 мин (температура 0°C). Процедуру повторяли трехкратно [18].
Выделение мембран из эритроцитов голубя
Выделение мембран из эритроцитов голубя проводили по методу, описанному в статье [19]. Эритроциты голубя подвергались лизису в охлажденном растворе 5 мМ NaH2PO4 (pH = 8,0; T = 4°С). Спустя 15 мин центрифугировали при 3100 g в течение 10 мин, супернатант отбрасывали. В пробирки с осадком добавляли раствор Na2HPO4, ресуспендировали и снова центрифугировали при 3100 g в течение 30 мин. Цикл повторялся не менее 7 раз. Осадок промывали лизирующим буфером до получения мембран белого цвета.
Экстракция и хроматографическое разделение липидов мембран эритроцитов
Экстракцию липидов из эритроцитарных мембран проводили по методу Блайя–Дайера [20].
Хроматографическое разделение проводили в тонком слое силикагеля, нанесенного на стеклянную пластинку [21–23]. Использовали стандартные пластинки HPTLCSilicagel 60 F254 (Merck Германия). Образцы, предназначенные для разделения, наносили с помощью автоматического аппликатора AutomaticTCL-Sanipler 4 (Gamag, Швейцария) на расстоянии 0.7–1 см от краев пластины по 20 мкл в виде полосы (одномерное разделение).
Для обнаружения липидов нами был использован метод, основанный на окрашивании их парами йода, удобный благодаря своей универсальности и отсутствию разрушающего действия на липиды [24].
Обнаружение фосфолипидов проводили методом Васьковского [25]. Отдельные фракции фосфолипидов идентифицировали с использованием значений Rf специфических окрашивающих агентов и свидетелей.
Холинсодержашие фосфолипиды обнаруживали с помощью реагента Драгендорфа. Для обнаружения аминосодержаших фосфолипидов (ФЭА, ФС) использовали нингидриновый реактив [26].
Обнаружение свободных жирных кислот (CЖК) проводили с помошью бромкрезолового зеленого [24].
Количественное определение фосфолипидов осуществляли с помошью денситометрического автоматизированного комплекса CAMAG TLC Scanner 4 (Швейцария) [22, 23]. Детектирование осуществляли с помощью TCL Scanner 4 и программного обеспечения winCATS в режиме поглощения при 360 нм с дейтериевой лампой. Содержание фосфолипидов выражали отношением неорганического фосфора индивидуальных фосфолипидных фракций к суммарному неорганическому фосфору всех фосфолипидных фракций.
Определение жирнокислотного состава индивидуальных фосфолипидов
Метиловые эфиры жирных кислот (ЖК) индивидуальных липидов и СЖК анализировали методом газовой хроматографии (ГХ). Метилирование ЖК проводили по методу Моррисона и Смита [27]. Разделение метиловых эфиров ЖК проводили на газовом хроматографе SHIMADZU GC-2010Plus AF (Япония). Анализ и обработку результатов хроматографических исследований проводили методом внутреннего стандарта.
Лазерная интерференционная микроскопия
Структурные изменения в эритроцитах, перераспределение гемоглобина и филаментов, обеспечивающих взаимодействие гемоглобина с внутренней стороной плазматической мембраны, изучали методом лазерной интерференционной микроскопии (ЛИМ) на автоматизированном интерференционном микроскопе МИИ-4М (Россия) [28, 29].
В ходе исследования биологические объекты размещались на зеркальной подложке, от которой отражается проходящий через клетку свет. В результате фиксируется двойной сдвиг фазы луча когерентного источника света в каждой точке объекта, а с помощью дополнительной волны от того же источника формируется интерференционное изображение клетки. Для исследования получали изображения 10 участков с монослойным расположением клеток в интерференционном канале и отраженном свете в каждой пробе. Полученные изображения эритроцитов обрабатывали с помощью программы FIJI [30].
Состояние эритроцитов человека оценивали, регистрируя среднюю величину оптической разности хода (ОРХ) и площадь фазового изображения эритроцита. Для получения достоверного результата показатели рассчитывали, используя не менее 100 клеток от каждого образца.
Дополнительно рассчитывали фазовый объем и физическую высоту эритроцитов, а также плотность упаковки гемоглобина в одном эритроците по значениям оптической разности хода, плотности гемоглобина, показателям преломления гемоглобина, эритроцитов и среды выделения.
Метод спектроскопии комбинационного рассеяния
Исследование конформации и свойств гемоглобина проводили с использованием рамановской спектроскопии комбинационного рассеяния (КР) на приборе InViaRenishaw (Великобритания) с короткофокусным высокосветосильным монохроматором (фокусное расстояние не более 250 мм) [31–34]. Для возбуждения рамановских спектров использовался лазер (длина волны 532 нм, максимальная мощность излучения 100 мВт, объектив 100×). Регистратор данных – CCD-детектор (1024 × × 256 пикселей с пельтье-охлаждением до – 70°С) с решеткой 1800 штр/мм. Оцифрованные спектры обработаны в программе WIRE 3.3. Произведены коррекция базовой линии, сглаживание спектров.
При изучении конформации Гб суспензия эритроцитов помещалась в запаянные капилляры, диаметром 1 мм, которые устанавливались в держатель спектрометра. Выписывались полосы спектра гемоглобина при возбуждении лазером 532 нм и соотнесение полос с колебаниями связей порфирина. Для каждой пробы измерения проводили троекратно, полученные значения усредняли.
Для анализа конформации гематопорфирина гемоглобина использовали определенные характерные полосы спектра КР, которые позволяют исследовать конформацию гематопорфирина в дезоксигемоглобине (д-Гб) и способность д-Гб связывать лиганды, а также конформацию гематопорфирина в оксигемоглобине (о-Гб) и способность о-Гб сбрасывать кислород.
В работе для анализа конформации и О2-связывающих свойств Гб использованы следующие полосы спектров КР крови (указаны положения максимумов): 1355, 1375, 1550, 1580 см–1.
Использование отношений КР-пиков, а не их абсолютных значений обусловлено тем, что абсолютное значение интенсивности спектра зависит от количества гемоглобина и, следовательно, эритроцитов в пробе и в области фокусировки лазера. Внутренняя нормировка пиков (на интенсивности других полос) обеспечивает то, что анализируемые параметры в разных пробах не зависят от количества гемоглобина, а определяются только его конформацией и относительным содержанием его различных форм.
Характер спектров комбинационного рассеяния гемопорфирина гемоглобина [35] позволяет определять степень окисления входящего в него атома железа, его спиновое состояние и наличие лигандов, отражает изменения в структуре глобина, приводящие к деформации гемопорфирина и влияющие на кислородсвязывающие свойства гемоглобина [36].
Интенсивности полос спектра 1355 и 1375 см–1обусловлены симметричными колебаниями пиррольных колец в молекулах дезоксигемоглобина и гемоглобина, связанного с лигандами [37]. Поскольку количество O2 в крови на 3–4 порядка превосходит содержание других лигандов (например, NO или CO), то интенсивность полосы 1375 см–1 определяется в основном содержанием оксигемоглобина. Таким образом, отношение интенсивностей I1375/(I1355 + I1375) пропорционально относительному количеству оксигемоглобина в крови.
Интенсивности полос 1550 и 1580 см–1 характеризуют спиновое состояние железа в дезокси- и окси-форме соответственно и, таким образом, являются маркерами, оценивающими структурные характеристики железа в простетической группе. Это позволяет, используя отношения интенсивностей полос I1355/I1550 и I1375/I1580, оценивать способность молекул гемоглобина в эритроцитах связывать и отдавать молекулы кислорода с учетом внутреннего состояния молекул гемоглобина. Разделив одно отношение на другое (I1355/I1550)/(I1375/I1580), можно получить характеристику, отражающую сродство молекул гемоглобина к кислороду в нативных эритроцитах.
Также методом КР-спектроскопии осуществляли контроль за созданием гипоксических условий в среде инкубации эритроцитов [38].
Статистическая обработка результатов
При проведении статистической обработки результатов эксперимента первоначально оценивали нормальность распределения значений для каждого из образцов с помощью критерия Гири [39]. После этого оценивали однородность дисперсии, затем проводили ANOVA и ANOVA для повторных измерений. В случае статистически значимых различий между средними значениями мы использовали постфактум метод анализа сравнения средних Тьюки [40].
Результаты исследований представлены в виде среднего арифметического и стандартного отклонения (Mean ± SD).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изучение фосфолипидного и жирнокислотного состава индивидуальных фосфолипидов, содержания свободных жирных кислот и диацилглицерина в условиях нормы и гипоксии. Исследование степени окисленности липидов
В нашей работе мы исследовали фосфолипидный состав мембран эритроцитов, а также степень их окисленности в условиях нормы и гипоксии.
Из мембран эритроцитов были выделены 7 фракций фосфолипидов – фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭА), фосфатидилсерин (ФС), сфингомиелин, лизофосфатидилхолин (ЛФХ), лизофосфатидилэтаноламин (ЛФЭА), фосфатидилинозитол (ФИ). Кроме этого, были выделены такие метаболиты фосфолипидов, как диацилглицерол (ДАГ), являющийся вторичным посредником фосфоинозитидного цикла и образующийся из фосфатидилинозитол-4,5-дифосфата под действием фосфолипазы С, и СЖК [41].
В ходе эксперимента было установлено, что в эритроцитах (как безъядерных, так и ядерных) в условиях недостаточного содержания кислорода в среде инкубации происходят изменения в количественном составе фосфолипидов и их метаболитов (табл. 1).
Таблица 1.
Изменение липидного состава мембран эритроцитов человека и голубя в условиях нормы и недостатка кислорода Table 1. Changes in the lipid composition of human and pigeon erythrocyte membranes under normal and lack of oxygen conditions
| Условия
эксперимента Experimental conditions |
Безъядерные эритроциты (n = 39) Nuclear-free erythrocytes |
Ядерные эритроциты (n = 29) Nuclear erythrocytes |
||
|---|---|---|---|---|
| ФЛ и метаболиты, мкг/мг липидов PL and metabolites, μg/mg lipids |
контроль control |
гипоксия hypoxia |
контроль control |
гипоксия hypoxia |
| ФЭА PEA |
190.3 ± 8.1 | 68.3 ± 2.8** | 186.5 ± 8.8 | 166.8 ± 3.6* |
| ФХ PC |
230.8 ± 9.3 | 118.2 ± 3.6* | 233.1 ± 10.4 | 148.4 ± 5.4** |
| ФС PS |
36.6 ± 1.3 | 20.4 ± 1.6** | 57.84 ± 5.6 | 35.1 ± 1.6* |
| ФИ PI |
82.5 ± 3.8 | 77.6 ± 6.2** | 77.4 ± 2.1 | 32.4 ± 2.4* |
| СМ SM |
158.4 ± 6.3 | 146.2 ± 9.5* | 165.3 ± 7.6 | 155.6 ± 11.6* |
| ЛФХ LPC |
17.3 ± 0.4 | 23.7 ± 1.7** | 18.6 ± 0.6 | 36.4 ± 1.8** |
| ЛФЭА LPEA |
19.8 ± 0.7 | 37.8 ± 2.4** | 19.8 ± 0.8 | 29.2 ± 2.5** |
| ДАГ DAG |
17.5 ± 0.5 | 25.5 ± 1.1** | 15.5 ± 0.7 | 23.4 ± 0.8* |
| СЖК FFA |
38.4 ± 1.3 | 51.6 ± 2.2* | 37.7 ± 1.4 | 49.1 ± 1.3** |
Возможно, что в условиях гипоксии происходит активация фосфолипаз в эритроцитах, что, в свою очередь, приводит к расщеплению ФЭА, ФХ и ФС. Это также подтверждается накоплением в условиях гипоксии ДАГ и СЖК (их количество увеличивалось на 47.8 и 34.2% соответственно по сравнению с контролем).
При исследовании ядерных эритроцитов голубя были выделены те же фракции ФЛ, что и из мембран эритроцитов человека. В ходе эксперимента прослеживались те же закономерности, что и при исследовании эритроцитов человека (табл. 1).
В условиях недостатка кислорода наблюдалось снижение содержания ФЭА, ФХ, ФС и ФИ по сравнению с контролем на 45.1, 36.5, 38.5 и 58.4% соответственно. Минимальное снижение наблюдалось для СМ (табл. 1). Также в ядерных эритроцитах происходило накопление продуктов превращения фосфолипидов – ЛФЭА и ЛФХ, однако, в сравнении с эритроцитами человека в большей степени, практически в 2 раза по сравнению с контролем, увеличилось количество ЛФХ. Кроме этого, наблюдалось увеличение количества ДАГ и СЖК на 53.3 и 32.4% соответственно.
Очевидно, что выявленные изменения в составе липидов цитоплазматической мембраны эритроцитов – снижение содержания ФЭА, ФХ, ФС, ФИ, СМ и увеличение содержания лизофосфолипидов, а также метаболитов липидов могут влиять на структурные и функциональные свойства мембраны клетки [30].
Для лучшего понимания характера и степени участия отдельных фосфолипидов в функциях как общих для всех клеток, так и специфических для эритроцитов, необходимо более глубокое изучение молекулярного строения отдельных фосфолипидов и, прежде всего, их жирных кислот как самого переменного компонента фосфолипидов [42].
При изучении состава ЖК фосфолипидов мембран эритроцитов человека было выявлено, что они включали миристиновую (С14:0), миристолеиновую (С14:1), пальмитиновую (С16:0), пальмитолеиновую (С16:1), стеариновую (С18:0), олеиновую (С18:1), линолевую (С18:2), линоленовую (С18:3), арахиновую (С20:0), гондоиновую (С20:1), эйкозодиеновую (С20:2), бегеновую (С22:0), эруковую (С22:1), лигноглицериновую (С24:0) кислоты (табл. 2).
Таблица 2.
Жирнокислотный состав фракций фосфолипидов и СЖК безъядерных эритроцитов (% от общего количества)M ± SD (n = 39) Table 2. Fatty acid composition of fractions of phospholipids and FFA of nuclear-free erythrocytes (% of total) M ± SD (n = 39)
| Фракции ФЛ PL fractions |
ЖК FA |
С14:00 | С14:01 | С16:00 | С16:01 | С18:00 | С18:01 | С18:02 | С18:03 | С20:00 | С20:01 | С20:02 | С22:00 | С22:01 | С24:00 | Кнас Dsat |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Условия эксперимента Experimental conditions |
||||||||||||||||
| ФХ PC |
Контроль Control |
14.04 ± ± 0.16 | 0 | 26.56 ± ± 0.11 | 0.95 ± ± 0.05 | 20.01 ± ± 1.09 | 0.63 ± ± 0.03 | 2.83 ± ± 0.09 | 1.78 ± ± 0.05 | 3.83 ± ± 0.04 | 1.38 ± ± 0.09 | 16.50 ± ± 0.32 | 12.59 ± ± 0.48 | 0 | 6.31 ± ± 0.09 | 0.81 |
| Гипоксия Hypoxia |
15.79 ± ± 0.16* | 0 | 28.97 ± ± 0.38* | 0.75 ± ± 0.06* | 22.36 ± ± 0.17* | 0.56 ± ± 0.03 | 1.90 ± ± 0.06* | 1.77 ± ± 0.04 | 4.06 ± ± 0.02* | 1.41 ± ± 0.04 | 14.23 ± ± 0.07* | 13.58 ± ± 0.24* | 0 | 7.89 ± ± 0.08** | 0.86 | |
| ФС PS |
Контроль Control |
11.54 ± ± 0.39 | 0.02 ± ± 0.001 | 17.82 ± ± 0.27 | 2.88 ± ± 0.17 | 13.06 ± ± 1.96 | 13.6 ± ± 0.22 | 9.42 ± ± 0.08 | 0 | 13.65 ± ± 0.11 | 2.99 ± ± 0.08 | 1.51 ± ± 0.09 | 5.30 ± ± 0.16 | 7.56 ± ± 0.07 | 0 | 0.63 |
| Гипоксия Hypoxia |
18.44 ± ± 0.88* | 0.62 ± ± 0.03* | 19.68 ± ± 0.33* | 0.03 ± ± 0.001** | 8.44 ± ± 0.18* | 10.7 ± ± 0.16* | 6.82 ± ± 0.11* | 0 | 13.23 ± ± 0.08* | 2.88 ± ± 0.06* | 3.96 ± ± 0.07* | 6.6 ± ± 0.09* | 0 | 0 | 0.84 | |
| ФЭА PEA |
Контроль Control |
15.86 ± ± 0.27 | 1.18 ± ± 0.01 | 0 | 0.31 ± ± 0.02 | 17.37 ± ± 1.55 | 0.24 ± ± 0.02 | 2.01 ± ± 0.07 | 0.92 ± ± 0.02 | 0 | 1.09 ± ± 0.08 | 1.13 ± ± 0.22 | 19.82 ± ± 1.11 | 35.60 ± ± 2.67 | 0 | 0.61 |
| Гипоксия Hypoxia |
17.15 ± ± 0.68 | 2.97 ± ± 0.07** | 5.38 ± ± 0.19* | 0.32 ± ± 0.01 | 25.81 ± ± 0.92** | 1.81 ± ± 0.02** | 4.88 ± ± 0.29* | 1.56 ± ± 0.09* | 4.25 ± ± 0.03* | 1.76 ± ± 0.09* | 2.31 ± ± 0.06* | 26.15 ± ± 1.78* | 0 | 5.74 ± ± 0.05* | 0.87 | |
| ФИ PI |
Контроль Control |
6.74 ± ± 0.18 | 0.91 ± ± 0.06 | 8.19 ± ± 0.42 | 11.83 ± ± 0.34 | 19.30 ± ± 0.35 | 0.22 ± ± 0.01 | 2.60 ± ± 0.09 | 1.26 ± ± 0.07 | 12.37 ± ± 0.31 | 1.54 ± ± 0.06 | 3.39 ± ± 0.12 | 19.70 ± ± 0.25 | 4.53 ± ± 0.02 | 8.56 ± ± 0.11 | 0.77 |
| Гипоксия Hypoxia |
10.08 ± ± 0.18* | 1.60 ± ± 0.06* | 10.47 ± ± 0.33* | 5.16 ± ± 0.15* | 15.29 ± ± 1.14* | 0.30 ± ± 0.01* | 0.98 ± ± 0.08* | 1.27 ± ± 0.07 | 25.31 ± ± 0.48** | 1.16 ± ± 0.04* | 3.61 ± ± 0.19 | 11.76 ± ± 0.18* | 0 | 13.94 ± ± 0.69* | 0.89 | |
| СЖК FFA |
Контроль Control |
11.26 ± ± 0.12 | 0.22 ± ± 0.02 | 22.25 ± ± 0.61 | 4.73 ± ± 0.12 | 21.43 ± ± 0.54 | 0.36 ± ± 0.02 | 5.77 ± ± 0.12 | 1.45 ± ± 0.09 | 12.36 ± ± 0.36 | 0.32 ± ± 0.01 | 3.01 ± ± 0.16 | 18.72 ± ± 0.15 | 0.40 ± ± 0.01 | 2.33 ± ± 0.22 | 0.86 |
| Гипоксия Hypoxia |
8.44 ± ± 0.18* | 1.56 ± ± 0.08** | 29.06 ± ± 0.59** | 1.60 ± ± 0.09** | 18.61 ± ± 0.92* | 0.33 ± ± 0.01* | 3.03 ± ± 0.09* | 0 | 20.77 ± ± 0.29** | 0.44 ± ± 0.02* | 9.02 ± ± 0.28** | 14.63 ± ± 0.11* | 0.61 ± ± 0.03* | 0 | 0.88 |
Для каждой фракции фосфолипидов существует свой жирнокислотный профиль. Тем не менее, общим для всех фракций фосфолипидов является высокое содержание стеариновой и олеиновой кислот. К минорным относится линоленовая незаменимая жирная кислота с максимальным содержанием во фракции фосфатидилхолина.
Анализ жирнокислотного состава липидов эритроцитов показал, что в контрольном образце во фракции ФХ были обнаружены все перечисленные выше жирные кислоты, кроме миристолеиновой и эруковой. Основной вклад в их количество вносят С16:0, С18:0, С20:2. Коэффициент насыщенности ФХ составил 0.81.
Во фракции ФС отсутствовали линоленовая и лигноглицериновая кислоты. Коэффициент насыщенности ФС составил 0.63. Во фракции ФЭА среди всех ЖК наибольший процент составила С22:1 – эруковая кислота. Отсутствовали С12:0, С16:0, С20:0, С24:0. Коэффициент насыщенности составил 0.61.
Качественный состав ЖК фосфоинозитидов был таким же, как в названных выше фракциях. Из насыщенных кислот наибольшее количество составили С18:0 (стеариновая), С22:0 (бегеновая). Из ненасыщенных в наибольшем количестве была обнаружена С16:1 – пальмитолеиновая. Коэффициент насыщенности ФИ составил 0.77. Насыщенные СЖК были представлены в основном С16:0 и С18:0. Из ненасыщенных обнаружены С16:1, С18:2 и С20:2. Коэффициент насыщенности СЖК составил 0.86.
Во фракции ФХ при инкубации эритроцитов в условиях гипоксии качественных изменений в составе ЖК не произошло. Увеличилось количество практически всех насыщенных кислот. Как следствие, коэффициент насыщенности увеличился до 0.86. В составе жирнокислотной фракции ФС не были обнаружены линоленовая и эруковая кислоты, а также насыщенная лигноцериновая кислота. Появилась миристоoлеиновая кислота. Количество насыщенных кислот с длинными цепями уменьшилось, либо осталось почти на контрольном уровне. Значительно снизилось содержание стеариновой кислоты. Из ненасыщенных кислот почти до нуля уменьшилось содержание пальмитолеиновой, не обнаружено эруковой, но более чем в три раза увеличилось количество эйкозадиеновой кислоты. Коэффициент насыщенности ФС составил 0.84. Во фракции ФЭА при инкубации в условиях гипоксии изменился качественный состав насыщенных ЖК. Появились пальмитиновая, арахиновая, лигноцериновая кислоты, среди ненасыщенных не была обнаружена эруковая кислота. Увеличилось содержание насыщенных ЖК – С18:0 и С22:0. Коэффициент насыщенности ФЭА составил 0.87. В составе фосфоинозитидов при инкубации в условиях гипоксии по сравнению с контрольной фракцией в составе насыщенных ЖК качественных изменений не было обнаружено. Не обнаружена ненасыщенная эруковая кислота. В количественном составе отмечены следующие изменения: увеличилось количество арахиновой кислоты, значительно уменьшилось содержание стеариновой и бегеновой. Из ненасыщенных кислот значительно уменьшилось содержание пальмитолеиновой и нервоновой кислот. Коэффициент насыщенности увеличился до 0.89. В составе СЖК после инкубации в условиях гипоксии не было обнаружено линоленовой и лигноцериновой кислот. Отмечено значительное снижение количества стеариновой, миристиновой, бегеновой кислот. В отличие от контроля во фракции ненасыщенных кислот обнаруживалась миристолеиновая кислота. В три раза уменьшилось содержание пальмитолеиновой кислоты и повысилось количество эйкозадиеновой кислоты. Коэффициент насыщенности составил 0.88 (табл. 2).
Анализ жирнокислотного состава липидов эритроцитов голубя показал, что в контрольном образце во фракции ФХ были обнаружены все перечисленные выше ЖК за исключением миристолеиновой и эруковой. Основной вклад в количество ЖК вносят С16:0, С18:0, С20:0, С20:2 (табл. 3).
Таблица 3.
Жирнокислотный состав фракций фосфолипидов и СЖК ядерных эритроцитов (% от общего количества) M ± SD (n = 29) Table 3. Fatty acid composition of fractions of phospholipids and FFA of nuclear erythrocytes (% of total) M ± SD (n = 29)
| Фракции ФЛ PL fractions |
ЖК FA |
С12:00 | С14:00 | С14:01 | С16:00 | С16:01 | С18:00 | С18:01 | С18:02 | С18:03 | С20:00 | С20:01 | С20:02 | С21:00 | С22:00 | С22:01 | С24:00 | Кнас Dsat |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Условия эксперимента Experimental conditions |
||||||||||||||||||
| ФХ PC |
Контроль Control |
1.02 ± ± 0.11 | 7.21 ± ± 0.64 | 0 | 18.3 ± ± 0.69 | 0.95 ± ± 0.05 | 19.10 ± ± 0.49 | 0.53 ± ± 0.03 | 3.95 ± ± 0.11 | 1.91 ± ± 0.19 | 20.91 ± ± 0.99 | 1.08 ± ± 0.12 | 8.03 ± ± 0.54 | 0 | 6.93 ± ± 0.54 | 0 | 6.12 ± ± 0.44 | 0.82 |
| Гипоксия Hypoxia |
1.64 ± ± 0.11* | 8.43 ± ± 0.457* | 0 | 20.06 ± ± 0.84* | 0.88 ± ± 0.04 | 19.23 ± ± 0.54 | 0.58 ± ± 0.03 | 2.63 ± ± 0.14* | 1.85 ± ± 0.10 | 24.81 ± ± 1.02* | 1.85 ± ± 0.12* | 7.62 ± ± 0.38* | 0 | 7.02 ± ± 0.68 | 0 | 8.42 ± ± 0.58* | 0.85 | |
| ФС PS |
Контроль Control |
0 | 11.51 ± ± 0.85 | 0 | 15.32 ± ± 0.65 | 14.20 ± ± 0.44 | 13.74 ± ± 0.47 | 0.98 ± ± 0.05 | 3.81 ± ± 0.12 | 0 | 14.25 ± ± 0.54 | 2.51 ± ± 0.19 | 3.86 ± ± 0.19 | 0 | 8.34 ± ± 0.69 | 5.82 ± ± 0.35 | 0 | 0.61 |
| Гипоксия Hypoxia |
0.83 ± ± 0.08* | 18.61 ± ± 0.45* | 1.52 ± ± 0.05 | 19.72 ± ± 0.81* | 1.71 ± ± 0.09** | 18.44 ± ± 0.32* | 0.90 ± ± 0.05 | 3.63 ± ± 0.12 | 0 | 20.72 ± ± 0.56** | 2.85 ± ± 0.19* | 3.77 ± ± 0.14 | 0 | 10.68 ± ± 0.36* | 0 | 0 | 0.82 | |
| ФЭА PEA |
Контроль Control |
15.17 ± ± 0.56 | 9.33 ± ± 0.58 | 0.93 ± ± 0.04 | 16.04 ± ± 0.68 | 5.31 ± ± 0.42 | 9.62 ± ± 0.66 | 2.37 ± ± 0.21 | 3.01 ± ± 0.11 | 3.62 ± ± 0.11 | 7.32 ± ± 0.65 | 0.63 ± ± 0.06 | 9.62 ± ± 0.5 | 4.81 ± ± 0.32 | 15.60 ± ± 0.35 | 16.33 ± ± 0.54 | 11.45 ± ± 0.68 | 0.91 |
| Гипоксия Hypoxia |
14.05 ± ± 0.65* | 10.72 ± ± 0.23* | 0.97 ± ± 0.02 | 18.35 ± ± 0.86* | 3.98 ± ± 0.19* | 16.22 ± ± 0.31* | 1.65 ± ± 0.10* | 3.85 ± ± 0.13* | 3.74 ± ± 0.21 | 6.25 ± ± 0.41* | 0.68 ± ± 0.05 | 7.63 ± ± 0.54* | 5.03 ± ± 0.45 | 17.23 ± ± 0.47 | 0 | 10.10 ± ± 0.77 | 0.84 | |
| ФИ PI |
Контроль Control |
4.11 ± ± 0.21 | 3.36 ± ± 0.12 | 0 | 12.74 ± ± 0.56 | 12.80 ± ± 0.65 | 19.42 ± ± 0.54 | 0.86 ± ± 0.04 | 4.8 ± ± 0.16 | 2.41 ± ± 0.16 | 8.95 ± ± 0.48 | 2.85 ± ± 0.21 | 4.70 ± ± 0.25 | 2.61 ± ± 0.19 | 16.32 ± ± 0.47 | 4.25 ± ± 0.35 | 6.25 ± ± 0.34 | 0.73 |
| Гипоксия Hypoxia |
5.03 ± ± 0.35* | 3.85 ± ± 0.21* | 0 | 13.49 ± ± 0.59* | 6.35 ± ± 0.25* | 10.32 ± ± 0.21* | 0.70 ± ± 0.05* | 3.99 ± ± 0.12* | 1.47 ± ± 0.99* | 18.01 ± ± 0.54** | 1.95 ± ± 0.20* | 4.00 ± ± 0.37 | 3.05 ± ± 0.32 | 10.38 ± ± 0.11** | 0 | 6.87 ± ± 0.31 | 0.86 | |
| СЖК FFA |
Контроль Control |
4.77 ± ± 0.29 | 6.89 ± ± 0.46 | 0 | 15.32 ± ± 0.39 | 19.24 ± ± 0.94 | 19.65 ± ± 0.44 | 0.96 ± ± 0.02 | 3.21 ± ± 0.15 | 4.20 ± ± 0.18 | 8.74 ± ± 0.23 | 4.00 ± ± 0.37 | 6.35 ± ± 0.34 | 4.85 ± ± 0.45 | 5.68 ± ± 0.35 | 0 | 4.96 ± ± 0.24 | 0.85 |
| Гипоксия Hypoxia |
6.12 ± ± 0.54* | 3.74 ± ± 0.24* | 0.86 ± ± 0.04* | 18.63 ± ± 0.58** | 10.44 ± ± 0.54* | 14.45 ± ± 0.11** | 0.44 ± ± 0.03** | 3.77 ± ± 0.14* | 0 | 12.03 ± ± 0.23* | 4.11 ± ± 0.25 | 6.34 ± ± 0.38 | 6.90 ± ± 0.44* | 6.22 ± ± 0.47* | 0 | 0 | 0.86 |
Коэффициент насыщенности ФХ составил 0.82. Во фракции ФС общий жирнокислотный состав был аналогичен вышеописанному, однако среди ЖК не были обнаружены линоленовая и лигноглицериновая. Коэффициент насыщенности ФС составил 0.61. Во фракции ФЭА в общий жирнокислотный состав наибольший вклад вносит эруковая кислота. В значительном количестве были представлены С12:0, С16:0, С20:2, С21:0 кислоты. Коэффициент насыщенности 0.91. Качественный состав ЖК фосфоинозитидов не отличался от такового ранее описанных фракций. В количественном составе из насыщенных кислот лидерами являлись С16:0, С18:0 и С22:0, из ненасыщенных – С16:1. Коэффициент насыщенности ФИ составил 0.73. Насыщенные СЖК были представлены в основном С16:0 и С18:0. Из ненасыщенных в наибольшем количестве были обнаружены С16:1, С18:2 и С20:2. Коэффициент насыщенности СЖК составил 0.85.
После инкубации эритроцитов в условиях гипоксии во фракции ФХ качественных изменений в составе ЖК не произошло. Увеличилось количество практически всех насыщенных кислот кроме стеариновой и бегеновой. Коэффициент насыщенности вырос до 0.85. При исследовании фракции ФС в условиях гипоксии в составе ЖК не были обнаружены линоленовая, эруковая, а также лигноцериновая кислоты. Обнаружена миристолеиновая кислота. Количественные изменения характеризовались увеличением числа насыщенных кислот с более короткой углеродной цепью. Из длинноцепочечных кислот увеличилось содержание арахиновой кислоты. Из ненасыщенных кислот практически до нуля уменьшилось содержание пальмитолеиновой кислоты, не было обнаружено эруковой и линоленовой кислот. Коэффициент насыщенности ФС составил 0.82. Во фракции ФЭА при инкубации в условиях гипоксии в составе насыщенных ЖК появились лауриновая, пальмитиновая, арахиновая кислоты. Среди ненасыщенных отсутствовала эруковая кислота (С22:1), которая в условиях нормоксии является основной ЖК данной фракции фосфолипидов. Увеличилось содержание насыщенных ЖК – С18:0 и С22:0, вновь обнаруживалась лигноцериновая кислота. Среди ненасыщенных значительно уменьшилось содержание олеиновой, пальмитолеиновой и эйкозадиеновой кислот, увеличилось количество линолевой кислоты. Коэффициент насыщенности составил 0.84. Во фракции фосфоинозитидов при гипоксии в составе насыщенных ЖК не была обнаружена эруковая кислота. Наблюдались следующие количественные изменения состава ЖК: увеличилось содержание арахиновой кислоты, значительно уменьшился уровень стеариновой и бегеновой.
Среди ненасыщенных кислот уменьшилось содержание пальмитолеиновой кислоты. Коэффициент насыщенности увеличился до 0.86.
В составе фракции СЖК после инкубации в условиях гипоксии не были обнаружены С18:3 и С24:0. Отмечено значительное снижение количества стеариновой, миристиновой, и бегеновой кислот. В отличие от контроля во фракции ненасыщенных кислот обнаруживались миристолеиновая кислота. Уменьшилось содержание пальмитолеиновой кислоты. Коэффициент насыщенности в данных условиях составил 0.86.
Важным моментом нашей работы было изучение количества и состава диацилглицерола (ДАГ), играющего главную роль в регуляции активности фосфолипазы А2, протеинкиназы С и транспорта Са2+. ДАГ придают важное значение как активатору протеинкиназы С, участвующей в усилении сигнала от возбужденного рецептора клеточной поверхности к белкам-исполнителям и фосфолипазе А2, и как источнику арахидоновой кислоты. ДАГ инициирует синтез ДНК и пролиферацию клеток, действуя как митоген, а также служит предшественником для ФХ, ФЭА и триацилглицеринов.
В жирнокислотном составе ДАГ эритроцитов человека нами были обнаружены и идентифицированы 17 ЖК: декановая (С10:0), гендекановая (С11:0), лауриновая (С12:0), миристиновая (С14:0), миристолеиновая (С14:1), пентадекановая (С15:0), пальмитиновая (С16:0), пальмитолеиновая (С16:1), стеариновая (С18:0), олеиновая (С18:1), линолевая (С18:2), линоленовая (С18:3), арахиновая (С20:0), эйкозодиеновая (С20:2), арахидоновая (С20:4), эйкозопентаеновая (С20:5), бегеновая (С22:0). Состав ДАГ в норме определяется в основном стеариновой (17.2%), арахиновой (21.4%), бегеновой (8.1%) насыщенными ЖК. Среди ненасыщенных наибольший удельный вес принадлежит линоленовой (4.4%), эйкозодиеновой (7.1%) и арахидоновой (14.3%) кислотам. Коэффициент насыщенности равен 1.60 (табл. 4).
Таблица 4.
Жирнокислотный состав ДАГ безъядерных и ядерных эритроцитов (% от общего количества) M ± SD Table 4. Fatty acid composition of DAG of nuclear-free erythrocytes and nuclear erythrocytes (% of total) M ± SD
| Жирные кислоты Fatty acids |
Безъядерные эритроциты (n = 39) Nuclear-free erythrocytes |
Ядерные эритроциты (n = 29) Nuclear erythrocytes |
||
|---|---|---|---|---|
| контроль control |
гипоксия hypoxia |
контроль control |
гипоксия hypoxia |
|
| С10:00 | 3.95 ± 0.08 | 5.22 ± 0.17* | 4.83 ± 0.04 | 7.43 ± 0.64* |
| С11:00 | 2.63 ± 0.09 | 5.68 ± 0.08** | 3.83 ± 0.09 | 6.37 ± 0.74* |
| С12:00 | 2.95 ± 0.05 | 2.71 ± 0.08* | 4.89 ± 0.12 | 6.35 ± 0.33* |
| С14:00 | 3.83 ± 0.04 | 5.99 ± 0.11* | 5.20 ± 0.32 | 11.48 ± 0.89** |
| С14:01 | 6.72 ± 0.04 | 4.50 ± 0.08* | 0 | 0 |
| С15:00 | 6.56 ± 0.41 | 8.36 ± 0.56* | 4.12 ± 0.22 | 7.35 ± 0.77* |
| С16:00 | 5.56 ± 0.09 | 8.75 ± 0.68* | 35.83 ± 0.99 | 37.23 ± 1.04* |
| С16:01 | 2.95 ± 0.10 | 2.48 ± 0.09* | 3.85 ± 0.18 | 3.45 ± 0.36 |
| С18:00 | 17.23 ± 1.09 | 25.01 ± 0.44* | 14.44 ± 0.39 | 21.60 ± 0.93* |
| С18:01 | 2.83 ± 0.09 | 2.29 ± 0.12* | 9.83 ± 0.62 | 6.21 ± 0.87* |
| С18:02 | 1.78 ± 0.05 | 1.24 ± 0.04* | 7.81 ± 0.29 | 5.23 ± 0.58* |
| С18:03 | 4.38 ± 0.26 | 3.79 ± 0.16* | 6.19 ± 0.11 | 5.12 ± 0.46* |
| С20:00 | 21.41 ± 0.92 | 26.60 ± 2.43* | 4.93 ± 0.12 | 7.88 ± 0.69* |
| С20:02 | 7.12 ± 0.08 | 5.53 ± 0.06** | 6.39 ± 0.16 | 5.45 ± 0.35* |
| С20:04 | 14.32 ± 0.46 | 13.11 ± 0.51* | 8.74 ± 0.58 | 7.25 ± 0.68* |
| С20:05 | 2.65 ± 0.12 | 2.88 ± 0.08* | 0 | 0 |
| С22:00 | 8.11 ± 0.21 | 11.14 ± 1.29* | 4.18 ± 0.13 | 7.69 ± 0.45** |
| Кнас Dsat |
1.60 | 1.85 | 1.95 | 2.1 |
При инкубации в условиях гипоксии содержание ДАГ увеличивалось. Это свидетельствует о том, что в мембране эритроцита при увеличении концентрации кальция происходит активация систем, которые ответственны за гидролиз фосфатидилинозитолбифосфата, продуктом которого и выступает ДАГ. По полученным данным можно судить об активации фосфолипазы С.
В эритроцитах голубя в жирнокислотном составе ДАГ нами были выделены и идентифицированы 15 ЖК: декановая (С10:0), гендекановая (С11:0), лауриновая (С12:0), миристиновая (С14:0), пентадекановая (С15:0), пальмитиновая (С16:0), пальмитолеиновая (С16:1), стеариновая (С18:0), олеиновая (С18:1), линолевая (С8:2), линоленовая (С18:3), арахиновая (С20:0), эйкозодиеновая (С20:2), арахидоновая (С20:4), бегеновая (С22:0). Состав ДАГ эритроцитов голубя в норме определяется в основном пальмитиновой (35.8%), стеариновой (14.4%) миристиновой (5.2%) насыщенными кислотами. Среди ненасыщенных ЖК наибольший удельный вес принадлежит олеиновой (9.8%), арахидоновой (8.7%) и линолевой (7.8%) кислотам. Коэффициент насыщенности равен 1.95. При инкубации в условиях гипоксии наблюдался тот же эффект, что и для эритроцитов человека (табл. 4).
В эритроцитах голубя в жирнокислотном составе ДАГ нами были выделены и идентифицированы 15 ЖК: декановая (С10:0), гендекановая (С11:0), лауриновая (С12:0), миристиновая (С14:0), пентадекановая (С15:0), пальмитиновая (С16:0), пальмитолеиновая (С16:1), стеариновая (С18:0), олеиновая (С18:1), линолевая (С18:2), линоленовая (С18:3), арахиновая (С20:0), эйкозодиеновая (С20:2), арахидоновая (С20:4), бегеновая (С22:0). Состав ДАГ эритроцитов голубя в норме определяется в основном пальмитиновой (35.8%), стеариновой (14.4%) миристиновой (5.2%) насыщенными кислотами. Среди ненасыщенных ЖК наибольший удельный вес принадлежит олеиновой (9.8%), арахидоновой (8.7%) и линолевой (7.8%) кислотам. Коэффициент насыщенности равен 1.95. При инкубации в условиях гипоксии наблюдался тот же эффект, что и для эритроцитов человека (табл. 4).
Таким образом, в условиях гипоксии в мембранах как ядерных, так и безъядерных эритроцитов происходят изменения в фосфолипидном и жирнокислотном составе, ведущие к накоплению лизоформ ФЛ, ДАГ и СЖК, а также к повышению степени насыщенности ЖК в составе ФЛ. Данные изменения свидетельствуют о структурных перестройках в мембране безъядерных и ядерных эритроцитов и вследствие этого о функциональных изменениях как со стороны эритроцита в целом, так и основного кислородтранспортного белка эритроцитов – гемоглобина [43, 44].
Изучение морфометрических характеристик структуры эритроцитов в условиях нормы и гипоксии
Для оценки структурных изменений эритроцитов были изучены методом лазерной интерференционной микроскопии морфометрические характеристики красных клеток крови. Установлено, что в условиях нормы эритроцит человека характеризуется нормальной дискоидной формой, четко просматривающейся на фазовом изображении (рис. 1).
Рис. 1.
3D-модель эритроцита человека в условиях нормоксии. Fig. 1. 3D model of human erythrocyte under normoxia.

Такая форма связана с равномерным распределением гемоглобина и, следовательно, относительно одинаковым показателем преломления.
В условиях гипоксии площадь эритроцитов относительно контроля увеличилась на 16.5%. ОРХ и объем эритроцитов уменьшились на 6.6 и 12.8% относительно контроля. Высота клеток и плотность упаковки гемоглобина увеличились на 13.5 и 41.4% соответственно (табл. 5).
Таблица 5.
Морфометрические показатели эритроцитов человека в условиях нормо- и гипоксии (М ± SD) Table 5. Morphometric characteristics of human erythrocytes in conditions normo- and hypoxia (М ± SD)
| Показатели Indicators |
Площадь фазового изображения
эритроцита S, мкм2 Phase image area of erythrocyte, S, µm2 |
Оптическая разность
хода ОРХ, нм The mean value of optical path difference (OPD), Φmean, nm |
Фазовый объем
эритроцита V, мкм3 Erythrocyte phase volume, V, µm3 |
Физическая (геометрическая)
толщина эритроцита Zmean, мкм Geometric mean height of the erythrocyte, Zmean, µm |
Плотность упаковки гемоглобина
в эритроците, mHb, пг Erythrocyte hemoglobin packing density, pg |
|---|---|---|---|---|---|
| условия эксперимента experimental conditions |
|||||
| Контрольная проба, n= 39 Control, n = 39 |
52.20 ± 5.01 | 118.80 ± 3.00 | 85.55 ± 5.21 | 1.73 ± 0.55 | 29.59 ± 2.89 |
| Гипоксия, n =39 Hypoxia, n = 39 |
61.50 ± 3.79* | 110.68 ± 5.37* | 72.92 ± 3.52* | 1.96 ± 0.04* | 41.84 ± 5.04* |
После инкубации ядерных эритроцитов в условиях гипоксии площадь фазового изображения также увеличилась на 28.1% по сравнению с контрольным значением. ОРХ уменьшилась на 32.6%, также наблюдалось уменьшение фазового объема эритроцита на 13.2% относительно контроля (табл. 6).
Таблица 6.
Морфометрические показатели эритроцитов голубя в условиях нормо- и гипоксии (М ± SD) Table 6. Morphometric parameters pigeon erythrocytes in conditions normo and hypoxia (М ± SD)
| Показатели Indicators |
Площадь фазового
изображения эритроцита. S, мкм2 Phase image area of erythrocyte, S, µm2 |
Средняя оптическая разность
хода, ОРХ, нм The mean value of optical path difference (OPD), Φmean, nm |
Фазовый объем эритроцита, V, мкм3 Erythrocyte phase volume, V, µm3 |
Физическая (геометрическая)
толщина эритроцита, Zmean, мкм Geometric mean height of the erythrocyte, Zmean, µm |
Плотность упаковки
гемоглобина в эритроците, пг Erythrocyte hemoglobin packing density, pg |
|---|---|---|---|---|---|
| условия эксперимента experimental conditions |
|||||
| Контрольная проба, n = 29 Control, n = 29 |
121.90 ± 7.45 | 184.44 ± 9.24 | 296.80 ± 9.04 | 3.19 ± 0.04 | 106.38 ± 3.9 |
| Гипоксия, n = 29 Hypoxia, n = 29 |
155.16 ± 6.24* | 124.44 ± 5.23* | 257.08 ± 10.87* | 2.86 ± 0.05* | 92.17 ± 4.69* |
В отличие от безъядерных эритроцитов показано снижение показателей геометрической высоты и плотности упаковки эритроцитов на 10.3 и 13.3% соответственно.
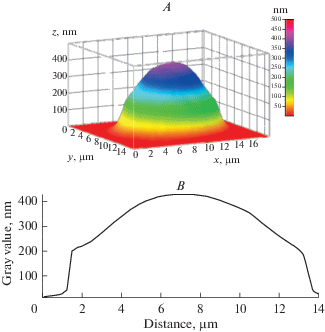
Изменение условий инкубации (гипоксия) приводило к появлению нарушений в морфологии эритроцитов. Фазовое изображение некоторых эритроцитов имело не гладкую тороидную форму, а “шероховатую”, с выростами и выпуклостями, что связано с изменениями в структуре цитоскелета и перераспределением гемоглобина в цитоплазме. Эти изменения могут быть вызваны патологическими процессами в эритроцитах, которые обусловлены состоянием гипоксии. Трансформация дискоцита в эхиноцит (обратимая деформация эритроцита) начинается с нарушения контура двояковогнутой структуры эритроцита с последующим появлением грубых выростов сначала по окружности диска, а затем по всей поверхности клетки, после чего эритроцит принимает в основном сферическую форму. Образование сфероцита представляет собой пример необратимой деформации эритроцита (рис. 2).
Рис. 2.
3D-модель (A) и профиль (B) эритроцита человека в условиях гипоксии (сфероцит). Fig. 2. 3D model (A) and profile (B) of human erythrocyte during incubation under hypoxia (spherocyte).
Также в ходе работы нами были получены фазовые 3D-изображения эритроцитов и поперечный срез эритроцита голубя. Эритроциты контрольного образца имели овальную форму, внутриклеточные структуры были равномерно распределены (рис. 3).
Рис. 3.
3D-модель (A) и профиль (B) эритроцита голубя в условиях нормоксии. Fig. 3. 3D model (A) and profile (B) of pigeon erythrocyte in normoxia.

Мембрана эритроцитов имела ровную, гладкую поверхность. В центре эритроцита находится ядро. Поперечное сечение эритроцита голубя имеет два плеча и один максимум.
У эритроцитов, инкубированных в условиях гипоксии, в поперечном сечении мы наблюдали только один максимум, эритроциты изменяли свою форму, становились более шаровидными (рис. 4).
Рис. 4.
3D-модель (A) и профиль (B) эритроцита голубя в условиях гипоксии. Fig. 4. 3D model (A) and profile (B) of pigeon erythrocyte in hypoxia.

Некоторые эритроциты после инкубации в условиях гипоксии имели неровные края и шероховатую поверхность.
Выявленные в результате нашей работы нарушения различных морфометрических показателей эритроцитов будут отражаться и на функциональной способности гемоглобина, о чем свидетельствует изменение плотности упаковки гемоглобина как в безъядерных, так и ядерных эритроцитах.
Исследование конформационных свойств гематопорфирина гемоглобина и определение лигандсвязывающей способности гемоглобина в условиях нормы и гипоксии
Показатели кислородсвязывающей способности гемоглобина мы оценивали методом спектроскопии комбинационного рассеяния по конформационным изменениям гемопорфирина.
Анализ спектров комбинационного рассеяния эритроцитов человека, инкубированных в условиях гипоксии, показал, что в эритроцитах уменьшается относительное количество о-Гб (I1375/(I1355 + I1375)) на 12.9% и способность гемоглобина сбрасывать лиганды (I1375/I1580) (рис. 5a).
Рис. 5.
Отношение амплитуд в спектре комбинационного рассеяния эритроцитов человека (A) и эритроцитов голубя (B) при инкубации в нормальных условиях и условиях гипоксии (*p ≤ 0.05 достоверно по отношению к контролю). Fig. 5. The ratio of amplitudes in the Raman spectrum of human (A) and pigeon (B) erythrocytes during incubation under normal and hypoxic conditions (*p ≤ 0.05 significantly with respect to the control).
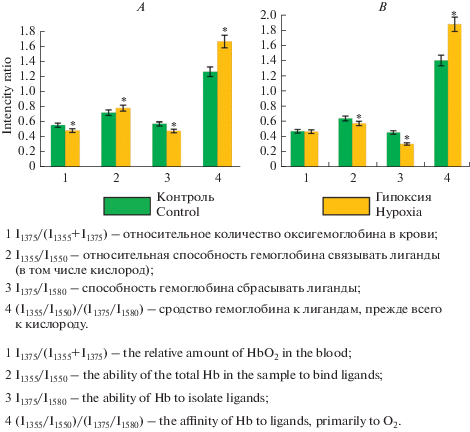
При этом незначительно (на 8.2%) увеличилась способность гемоглобина сбрасывать лиганды. Более значительно (на 31.6%) повысилось сродство гемоглобина к лигандам, прежде всего к кислороду.
Показатели кислородсвязывающей способности гемоглобина ядерных эритроцитов отличались от таковых в случае безъядерных. Кроме этого, для ядерных эритроцитов мы обнаружили несколько иные изменения конформационного состояния гемопорфирина гемоглобина и соответственно показателей кислородсвязывающей способности гемоглобина эритроцитов (рис. 5B). Так, в условиях экспериментальной гипоксии относительная доля о-Гб (I1375/(I1355 + I1375)) в эритроцитах голубя достоверно не изменилась. Способность гемоглобина связывать лиганды при гипоксии снизилась на 10.1%, а способность выделять лиганды – на 32.8% (рис. 5B). При этом увеличилось на 33.9% сродство гемоглобина к лигандам ((I1355/I1550)/(I1375/I1580)).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Пребывание ядерных и безъядерных эритроцитов в условиях гипоксии способствовало возникновению различных изменений как со стороны морфологии эритроцита, состояния его мембран (в частности, липидного компонента), так и конформации кислородпереносящего белка – гемоглобина.
Показанные нами изменения в содержании ФИ и одновременное накопление ДАГ однозначно свидетельствуют об активации ФИ-цикла, и, следовательно, об усилении процессов образования вторичных мессенджеров, приводящих к активации протеинкиназы С, осуществляющей фосфорилирование и активацию большого числа внутриклеточных белков.
Как известно, для активации и функционирования фосфоинозитидного цикла необходимы ионы Са2+. Их поступление в условиях гипоксии показано в ряде работ [45–47].
Увеличение концентрации Са2+ приводит к активации Са2+-зависимой фосфолипазы А2, результатом действия которой является накопление в мембранах лизофракций фосфолипидов и СЖК [48–50].
Cведения об увеличении активности фосфолипаз в условиях гипоксии встречаются и в других источниках литературы [51–53].
В пользу данного факта свидетельствуют и наши результаты, свидетельствующие о снижении содержания одного из количественно преобладающих фосфолипидов мембраны эритроцитов – фосфатидилхолина. На его долю по разным данным может приходиться от 37 до 46% и выше от общего количества ФЛ [54].
Известно также, что он в большем количестве находится во внешней части липидного бислоя мембраны [48, 55–57].
Поскольку в эритроцитарных мембранах чуть ли не половина фосфолипидов приходится на ФХ и при гипоксии происходит резкое изменение морфологических характеристик самой клеточной мембраны, можно однозначно утверждать, что доступность фосфатидилхолина для атаки фосфолипаз возрастает. Усиление биосинтетических процессов и, как следствие этого, накопление СЖК, в том числе и в условиях гипоксии, в эритроцитах невозможно.
Учитывая эти данные и изложенные соображения, мы полагаем, что одной из вероятных причин выявленных изменений в составе фосфолипидов, а также ДАГ и СЖК, является активация фосфолипаз С и А2.
Накопление лизоформ фосфолипидов (ЛФХ и ЛФЭА) и СЖК в условиях гипоксии может способствовать “разрыхлению” отдельных участков бислоя липидов мембраны эритроцитов [58].
Увеличение степени насыщенности фосфолипидов эритроцитов, сопровождаемое уменьшением содержания ненасыщенных ЖК, приводит к увеличению микровязкости мембран и возрастанию их кластерности.
Все это также может оказывать влияние на изменение кислородсвязывающх свойства гемоглобина эритроцитов через изменение конформации гематопорфирина [59–61].
Многочисленные процессы, происходящие в липидном бислое мембраны, приводят к изменениям морфометрических характеристик эритроцитов в условиях экспериментальной гипоксии (появление эхиноцитов и сфероцитов с перараспределением и конденсацией гемоглобина в объеме клетки). Изменения морфологии эритроцита и, как следствие, распределения в нем гемоглобина существенно влияют на эффективность переноса О2 в организме и являются признаком многих патологий, связанных с развитием гипоксии [36].
Выявленное нарушение конформации гематопорфирина гемоглобина в эритроцитах в условиях экспериментальной гипоксии приводит к установленному снижению кислородсвязывающей способности гемоглобина (например, снижению относительной способности гемоглобина связывать лиганды, способности гемоглобина сбрасывать лиганды, увеличению сродства гемоглобина к лигандам).
В дезокси-форме метиновые связи гемопорфирина растянуты и деформированы, а лиганды хуже связываются и удерживаются Гб, в оксигенированной форме данные связи, как и сама молекула гемопорфирина, менее деформированы и более компактны. Кроме того, изменяется геометрия пирролов гемопорфирина. В дезоксигемоглобине атом Fe выходит из плоскости порфиринового кольца из-за стерического отталкивания гистидина и атомов азота порфиринового цикла. С-концы глобина дважды соединены солевыми связями, тирозины зафиксированы в полостях между спиралями ван-дер-ваальсовыми и водородными связями, вся структура стабилизирована 2.3-БФГ с отрицательным зарядом.
Принимая во внимание тот факт, что возникновение гипоксии является достаточно распространенным (частым) явлением, возникающим и при физических нагрузках, и при разных формах патологий, можно полагать, что обнаруженные нами изменения в составе липидов и морфологической картине эритроцитарных клеток являются одним из компенсаторных механизмов, сохраняющих способность гемоглобина к транспорту кислорода.
Список литературы
Upadhyay R. K. Emerging Risk Biomarkers in Cardiovascular Diseases and Disorders. J. Lipids. 2015. https://doi.org/10.1155/2015/971453
Pierson D.J. Pathophysiology and Clinical Effects of Chronic Hypoxia. Respir. Care. 45(1): 39–53. 2000.
D'Alessandro A., Xia Y. Erythrocyte adaptive metabolic reprogramming under physiological and pathological hypoxia. Curr. Opin. Hematol. 5. 2020. https://doi.org/10.1097/MOH.0000000000000574
Järemo P., Jejcic A., Jelic V., Shahnaz T., Behbahani H., Oweling M., Winblad B. Alzheimer’s Disease: Erythrocyte 2,3-diphosphoglycerate Content and Circulating Erythropoietin. Curr. Alzheimer. Res. 16(9): 834–835. 2019. https://doi.org/10.2174/1567205016666190827120108
Cadiz L., Bundgaard A., Malte H., Fago A. Hypoxia enhances blood O2 affinity and depresses skeletal muscle O2 consumption in zebrafish (Danio rerio). Comp. Biochem. Physiol. B. Biochem. Mol. Biol. 234: 18–25. 2019. https://doi.org/10.1016/j.cbpb.2019.05.003
Liu J., Qiang Y., Alvarez O., Du E. Electrical Impedance Characterization of Erythrocyte Response to Cyclic Hypoxia in Sickle Cell Disease. ACS Sens. 4(7): 1783–1790. 2019. https://doi.org/10.1021/acssensors.9b00263
Li X., Li W., Feng S., Wang R. Research progress on mechanism in adaptation of hemoglobin to plateau hypoxia. Zhejiang Da Xue Xue Bao Yi Xue Ban. 48(6): 674–681. 2019.
Rifkind J.M., Mohanty J.G., Nagababu E., Salgado M.T., Cao Z. Potential Modulation of Vascular Function by Nitric Oxide and Reactive Oxygen Species Released From Erythrocytes. Front. Physiol. 9: 690. 2018. https://doi.org/10.3389/fphys.2018.00690
Moras M., Lefevre S.D., Ostuni M.A. From Erythroblasts to Mature Red Blood Cells: Organelle Clearance in Mammals. Front. Physiol. 8:1076. 2017.
González-Alonso J., Mortensen S.P., Dawson E.A., Secher N.H., Damsgaard R. Erythrocytes and the regulation of human skeletal muscle blood flow and oxygen delivery: role of erythrocyte count and oxygenation state of haemoglobin. J. Physiol. 572(Pt 1): 295–305. 2006.
Yachie-Kinoshita A., Nishino T., Shimo H., Suematsu M., Tomita M. A Metabolic Model of Human Erythrocytes: Practical Application of the E-Cell Simulation Environment. J. Biomed. Biotechnol. 2010:642420. 2010.
Kosmachevskaya O.V., Topunov A.F. Alternate and Additional Functions of Erythrocyte Hemoglobin. Biochemistry. (Mosc). 83(12): 1575–1593. 2018. https://doi.org/10.1134/S0006297918120155
Yamaguchi T., Fukuzaki S. ATP effects on response of human erythrocyte membrane to high pressure. Biophys. Physicobiol. 16: 158–166. 2019. https://doi.org/10.2142/biophysico.16.0_158
Соломадин И.Н., Маров Н.В., Бенедиктова Н.И., Косенко Е.А., Каминский Ю.Г. Токсическое действие Ар25-35 и фуллерена С60 на эритроциты. Известия РАИ. Серия биол. 4: 507–512. 2008. [Solomadin I.N., Marov N.V., Benediktova N.I., Kosenko Ye.A., Kaminskiy YU. G. Toxic effect of Ar 25–35 and fullerene C60 on red blood cells. Russ. Izvestiya RAI. Seriya biol. 4: 507–512. 2008. (In Russ)].
Perez-Guaita D., Veij M. de, Marzec K.M., Almohammedi A.R.D., McNaughton D., Hudson A.J., Wood B.R. Resonance Raman and UV-Visible Micros-copy Reveals that Conditioning Red Blood Cells with Repeated Doses of Sodium Di-thionite Increases Haemoglobin Oxygen Uptake. Chem. Select. 2(11): 3342–3346. 2017.
Wood B.R., Tait B., Mc Naughton D. Micro-Raman characterisation of the R to T state transition of haemoglobin within a single living erythrocyte. Biochim. Biophys. Acta. 1539 (1–2): 58–70. 2001.
Ramser K., Wenseleers W., Dewilde S., Van Doorslaer S., Moens L. The combination of resonance Raman spectroscopy, optical tweezers and microfluidic systems applied to the study of various heme-containing single cells. J. Spectrosc. 22(4): 287–295. 2008.
Dodge J.T., Mitchell C., Hanahan D.J. The preparation and chemical characteristics of hemoglobin-free ghosts of human erythrocytes. Arch. Biochem. Biophys. 100:119-30. 1963.
Watts C., Wheeler K.P. Partial separation of a sodium-dependent transport system for amino acids in avian erythrocyte membranes. FEBS Lett. 94(2): 241–244. 1978.
Bligh E.A., Dyer W. Rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37(8): 911–917. 1959.
Эванз У.Г., Морре Д.Д., О'Брайтман Э., Санделиус А.С., Бейлез Э.М., Ричардсон П.Дж., Лузио Дж.П., Хиггинс Д.А., Джонс О.Т., Эрнест Ю.П., Мак-Нэми М.Дж., Финдлей Дж.Б., Башфорд К.Л., Шуберт Д., Сивапрасадарао А. Биологические мембраны. Методы. Пер. с англ. Дж.Б. Финдлей, У.Г. Эванз (Ред.). М. Мир. 1990. [Evans W.G., Morre D.D., O’Brightman E., Sandelius A.S., Beylez E.M., Richardson P.J., Lusio J.P., Higgins D.A., Jones O. T., Ernest J.P., McNemy M.J., Findlay J.B., Bashford K.L., Schubert D., Sivaprasadarao A. Biologicheskiye membrany. Metody [Biological membranes. Methods. Findlay J.B. Evans W.G. (Eds.)]. Moscow. Mir. 1990. (In Russ)].
Handloser D., Widmer V., Reich E. Separation of phospholipids by HPTLC – an investigation of important parameters. J. Liq. Chromatogr. Relat. Technol. 31: 1857–1870. 2008.
Reich E., Schibli A. A standardized approach to modern high performance tlm-layer chromatography (HPTLC). J. Planar Chromatogr.–Mod. TLC. 6(17): 438–443. 2004.
Кирхнер Ю. Тонкослойная хроматография. М. Мир. 1981. [Kirkhner Yu. Tonkosloynaya khromatografiya [Thin -layer chromatography]. Moscow. Mir. 1981. (In Russ)].
Vaskovsky V.E., Kostetsky E.Y., Vasendin I.M. A universal reagent for phospholipids analysis. J. Chromatogr. 114(1): 129–141. 1975.
Marinetti G.V., James A.T., Morris L.J. New Biochemical Separations.Van Nostrand. Princeton. N. J. 1964.
Morrison W.R., Smith. M.L. Preparation of fatty acid methylesters and dimethylacetals from lipid with boron fluoride–methanol. J. Lipid. Res. 5: 600–608. 1964.
Yusipovich A.I., Bryzgalova N.Y., Parshina E.Y., Lomakin A.G., Rodnenkov O.V., Levin G.G., Maksimov G.V., Rubin A.B. Evaluation of erythrocyte shape and status by laser interference microscopy. Bull. Exp. Biol. Med. 145(3): 382–385. 2008.
Yusipovich A.I., Parshina1 E.Yu., Brysgalova1 N.Yu., Brazhe A.R., Brazhe N.A., Lomakin A G., Levin G.G., Maksimov G.V. Laser interference microscopy in erythrocyte study. J. Appl. Phys. 105(10): 102037. 2009.
Schindelin J., Arganda-Carreras I., Frise E., Kaynig V., Longair M., Pietzsch T., Preibisch S., Rueden C., Saalfeld S., Schmid B., Tinevez J.Y., White D.J., Hartenstein V., Eliceiri K., Tomancak P., Cardona A. Fiji: an open-source platform for biological-image analysis. Nat. Methods. 28.9(7): 676–682. 2012.
Brazhe N.A., Abdali S., Brazhe A.R., Luneva O.G., Bryzgalova N.Y., Parshina E.Y., Sosnovtseva O.V., Maksimov G.V. New insight into erythrocyte through in vivo surface-enhanced raman spectroscopy. Biophys. J. 97(12): 3206–3214. 2009.
Brazhe N.A. Brazhe N.A., Baĭzhumanov A.A., Parshina E.Iu., Iusipovich A.I., Akhalaia M.Ia., Iarlykova Iu.V., Labetskaia O.I., Ivanova S.M., Morukov B.V., Maksimov G.V. Studies of the blood antioxidant system and oxygen-transporting properties of human erythrocytes during 105-day isolation. Aviakosm. Ekolog. Med. 45(1): 40–45. 2014.
Revin V.V., Gromova N.V., Revina E.S., Martynova M.I., Seikina A.I., Revina N.V., Imarova O.G., Solomadin I.N., Tychkov A.Yu., Zhelev N. Role of Membrane Lipids in the Regulation of Erythrocytic Oxygen-Transport Function in Cardiovascular Diseases. Biomed Res. Int. 2016(1): 1–11. 2016.
Maksimov G.V., Maksimova N.V., Churin A.A., Orlov S.N., Rubin A.B. Study on conformational changes in hemoglobin protoporphyrin in essential hypertension. Biochemistry. (Mosc.). 66(3): 295–299. 2001.
Mityanina V.A., Parshina E.Yu, Yusipovich A.I., Maksimov G.V., Selischeva A.A. Oxygen-binding characteristics of erythrocyte in children with type I diabetes mellitus of different duration. Bull. Exp. Biol. Med. 153(4): 508–512. 2012.
Yusipovich A.I., Braze N.A., Luneva O.G., Parshina E.Y., Churin A.A., Rodnenkov O.V., Maksimov G.V. Changes in the state of hemoglobin in patients with coronary heart disease and patients with circulatory failure. Bull. Exp. Biol. Med. 155(2): 233–235. 2013.
Rodnenkov O.V., Luneva O.G., Ulyanova N.A., Maksimov G.V., Rubin A.B., Orlov S.N., Chazov E.I. Erythrocyte membrane fluidity and haemoglobin haemoporphyrin conformation: features revealed in patients with heart failure. Pathophysiology. 11(4): 209–213. 2005.
Sidorenko S.V., Luneva O.G., Novozhilova T.S., Alekseeva N.V., Rodnenkov O.V., Deev L.I., Maksimov G.V., Grygorczyk R., Orlov S.N. Hemolysis and ATP Release from Human and Rat Erythrocytes under Conditions of Hypoxia: A Comparative Study. Biochemistry (Moscow), Suppl. Series A: Membrane and Cell Biology. 12(2): 114–120. 2018.
Geary R.C. Testing for Normality. Biometrika. 34(3/4): 209–242. 1947.
Tukey J.W. Comparing individual means in the analysis of variance. Biometrics. 5(2): 99–114. 1949.
Watts C., Wheeler K. P. Protein and lipid components of the pigeon erythrocyte membrane. Biochem. J. 173(3): 899–907. 1978.
Корженевский Д.А. Селищева А. А. Определение фосфолипидного состава эритроцитов человека в норме методом ВЭЖХ с детектором светорассеяния. Бюлл. экс. биол. мед. 147(4): 473–476. 2009. [Korzhenevsky D.A. Selishcheva A.A. Determination of the phospholipid composition of human red blood cells in normal by HPLC with a light scattering detector. Bull. Exp. Biol. Med. 147(4): 473–476. 2009. (In Russ)].
Revin V.V., Filatova S.M., Syusin I.V., Yazykova M.Y., Revina E.S., Gromova N.V., Devyatkin A.A. Study of correlation between state and composition of lipid phase and change in erythrocytes structure under induction of oxidative processes. Int. J. Hematol. 101(5): 487–496. 2015.
Revin V.V., Gromova N.V., Revina E.S., Mel’nikova N.A., Balykova L.A., Solomadin I.N., Tychkov A.Yu., Revina N.V., Gromova O.Yu., Anashkina I.V., Yakushkin V.A. Study of the Structure, Oxygen-Transporting Functions, and Ionic Composition of Erythrocytes at Vascular. Biomed. Res. Int. 2015: 973973. 2015.
Tiffert T., Etzion Z., Bookchin R.M., Lew V.L. Effects of deoxygenation on active and passive Ca2+ transport and cytoplasmic Ca2+ buffering in normal human red cells. J. Physiol. 464: 529–544. 1993.
Wang J., Kimcorresponding D. Activation of voltage-dependent K+ channels strongly limits hypoxia-induced elevation of [Ca2+]i in rat carotid body glomus cells. J. Physiol. 596(15): 3119–3136. 2018.
Grygorczyk R., Orlov S. N. Effects of Hypoxia on Erythrocyte Membrane Properties—Implications for Intravascular Hemolysis and Purinergic Control of Blood Flow. Front. Physiol. 8: 1110. 2017.
Новицкий В.В., Рязанцева Н.В., Степовая Е.А., Федорова Т.С., Кравец Е.Б., Иванов В.В., Жаворонок Т.В., Часовских Н.Ю., Чудакова О.М., Бутусова В.Н., Яковлева Н.М. Молекулярные нарушения мембраны эритроцитов при патологии разного генеза являются типовой реакцией организма: контуры проблемы. Бюлл. Сибирск. медицины. 2: 62–68. 2006. [Novitsky V.V., Ryazantseva N.V., Stepovaya Ye.A., Fyodorova T.S., Kravets Ye.B., Ivanov V.V., Zhavoronok T.V., Chasovskikh N.Yu., Choudakova O.M., Butusova V.N., Yakovleva N.M. Moleculardisturbances of erythrocytes membrane during pathology of different genesis are the typical reaction of the organism: contours of the problem. Bull. Siberian Med. 2: 62–68. 2006. (In Russ)].
Michiels C., Renard P., Bouaziz N., Heck N., Eliaers F., Ninane N., Quarck R., Holvoet P., Raes M. Identification of the phospholipase A(2) isoforms that contribute to arachidonic acid release in hypoxic endothelial cells: limits of phospholipase A(2) inhibitors. Biochem. Pharmacol. 63(2): 321–332. 2002.
Wu H., Bogdanov M., Zhang Yu., Sun K., Zhao S., Song A., Luo R., Parchim N.F., Liu H., Huang A., Adebiyi M.G., Jin J., Alexander D.C., Milburn M.V., Idowu M., Juneja H.S., Kellems R.E., Dowhan W., Xiaa Ya. Hypoxia-mediated impaired erythrocyte Lands’ Cycle is pathogenic for sickle cell disease. Sci. Rep. 6: 29637. 2016.
Дещекина М.Ф., Танаева Г.В., Демин В.Ф. Состояние перекисного окисления липидов и липидного состава плазмы у новорожденных, перенесших острую и хроническую гипоксию. Педиатрия. 2: 22–25.1988. [Deshchekina M.F., Tanaeva G.V., Demin V.F. State of lipid peroxidation and plasma lipid composition in newborns undergoing acute and chronic hypoxia. Pediatriya. 2: 22–25. 1988. (In Russ)].
Лоскутова Е.В., Воронцова И.А., Вахитов Х.М., Валеева И.Х., Полякова О.И., Вахитова Л.Ф., Шибалова О.Н., Нуриахметова И.Т., Шарафутдинова Э.А., Сафиуллин Т.Р. Состояние системы липопероксидации у недоношенных новорожденных, перенесших перинатальную гипоксию. Рос. вестник перинатол. и педиатрии. 63(5): 135–138. 2018. [Loskutova E.V., Vorontsova I.A., Vahitov H.M., Valeeva I.H., Polyakova O.I., Vahitova L.F., Shibalova O.N., Nuriahmetova I.T., Sharafutdinova E.A., Safiullin T.R. The Condition of the Lipoperoxidation System in Premature Newborns After Perinatal hypoxia. Ross. Vestnik Perinatol. Pediatrii. 63(5): 135–138. 2018. (In Russ)].
Ишутина Н.А., Дорофиенко Н.Н., Болелова С.М. Фракционный состав фосфолипидов мембран эритроцитов у беременных с бронхиальной астмой. Бюлл. физиол. патол. дыхания. 31. 60–62. 2009. [Ishutina N.A., Dorofienko N.N., Bolelova S M. Fractional phospholipid composition of erithrocytes membranes in pregnant women with bronchial asthma. Fraktsionnyy sostav fosfolipidov membran eritrotsitov u beremennykh s bronkhial’noy astmoy. Bull. Physiol. Respirat. Pathol. 31: 60–62. 2009. (In Russ)].
Sunyakina O.A., Konoplya N.A., Sergeeva S.L., Barsuk A.A. Protein-lipid composition of erythrocyte membranes and metabolism in chronic endometritis. In the world of scient. Discover. Ser. A. 5(1–2): 14–27. 2017.
Virtanen J.A., Cheng K.H., Somerharju P. Phospholipid composition of the mammalian red cell membrane can be rationalized by a superlattice model. Proc. Natl. Acad. Sci. USA. 95: 4964–4969. 1998.
Новицкий В.В., Рязанцева Н.В., Степовая Е.А. Физиология и патофизиология эритроцита. Томск. Изд-во Томcк. Универ. 2004. [Novitsky V.V., Ryazantseva N.V., Stepovaya E.A. Fiziologiya i patofiziologiya eritrotsita. [Physiology and pathophysiology of an erythrocyte]. Tomsk. Publishing House Tomsk. Univer. 2004. (In Russ)].
Daleke D.L. Regulation of transbilayer plasma membrane phospholipid asymmetry. J. Lipid Res. 44: 233–242. 2003.
Mills J.K., Needham D. Lysolipid incorporation in dipalmitoylphosphatidylcholine bilayer membranes enhances the ion permeability and drug release rates at the membrane phase transition. Biochim. Biophys. Acta. 1716(2): 77–96. 2005.
Shaklai N., Yguerabide J., Ranney H.M. Interaction of hemoglobin with red blood cell membranes as shown by a fluorescent chromophore. Biochemistry. 16(25): 5585–5592. 1997.
Walder J.A., Chatterjee R., Steck T.L., Low P.S., Musso G.F., Kaiser E.T., Rogers P.H., Arnone A. The interaction of hemoglobin with the cytoplasmic domain of band 3 of the human erythrocyte membrane. J. Biol. Chem. 259(16): 10238–10246. 1984.
Chen Q., Balazs T.C., Nagel R.L., Hirsch R.E. Human and mouse hemoglobin association with the transgenic mouse erythrocyte membrane. FEBS Lett. 580(18): 4485–4490. 2006.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


