Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 5, стр. 563-583
Ганглиозиды мозга и их функции как природных адаптогенов
Н. Ф. Аврова *
Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: avrova@iephb.ru
Поступила в редакцию 20.12.2019
После доработки 13.03.2020
Принята к публикации 13.03.2020
Аннотация
В обзоре охарактеризованы на примере ганглиозидов некоторые аспекты исследований липидов мозга позвоночных, проводившихся под руководством академика Е.М. Крепса и продолженных его сотрудниками. Показано, что для ганглиозидов (как и фосфолипидов) мозга холодноводных стенотермных видов костистых рыб характерно более высокое содержание моно- и полиеновых жирных кислот, чем для аналогичных липидов мозга тепловодных стенотермных видов костистых рыб. Изменения состава жирных кислот липидов мозга рыб при адаптации к жизни в холодной воде (или на больших глубинах) направлены на поддержание оптимальной степени жидкостности и микрогетереогенности мембран клеток мозга. Результаты кластерного анализа данных о составе и строении углеводного компонента ганглиозидов мозга представителей различных классов эктотермных позвоночных были использованы для построения дендрограммы. Эта дендрограмма, как оказалось, является сходной с эволюционным древом, соответствующим классической таксономии позвоночных. Выдвинуто предположение, что изменения молекулярной организации ганглиозидов в процессе эволюции позвоночных вносят вклад в процессы дифференцировки мозга и усложнения его функций в ходе их филогенетического развития. Основные ганглиозиды мозга млекопитающих (GM1, GD1a, GD1b и GT1b) защищают нейроны и клетки РС12 от действия возбуждающих аминокислот, перекиси водорода, амилоидного бета-пептида, причем их защитный эффект зависит от активации тирозинкиназы Trk-рецепторов и протеинкиназ, активирующихся после этой протеинкиназы (Akt, ERK1/2, протеинкиназы С). Другой механизм защиты используется ганглиозидами GM1 и GD1a против токсического действия бактериального липополисахарида (ЛПС). Он, очевидно, связан с изменением состава липидных рафтов плазматических мембран нервных клеток благодаря включению экзогенных ганглиозидов, что приводит к предотвращению транслокации рецепторов ЛПС TLR4 в их состав. Используя водный тест Морриса, показана способность ганглиозидов, введенных крысам с диабетом 2-го типа, предотвращать нарушения пространственной памяти. Интраназальное введение ганглиозидов применено впервые, показана его высокая эффективность.
С начала 60-х годов прошлого века в лаборатории сравнительной нейрохимии (вошедшей в 2014 г. в состав лаборатории молекулярной эндокринологии и нейрохимии) большое внимание уделялось изучению липидов нервной ткани. В выборе этой темы исследования сказался дар научного предвидения, свойственный Евгению Михайловичу Крепсу, создавшему лабораторию и долгие годы возглавлявшему ее. В 60-е годы липиды клеточных мембран привлекали мало внимания исследователей, тогда как позднее стало ясно, что их изучение необходимо для понимания биохимических механизмов реализации действия гормонов, медиаторов и других физиологически активных веществ, процессов адаптации животных к изменяющимся условиям окружающей среды, патогенеза многих заболеваний. При этом клинические испытания многих липидов могут привести к разработке новых лекарственных препаратов.
В ходе проводимых исследований липидов мозга позвоночных и беспозвоночных в лаборатории сравнительной нейрохимии изучением были охвачены основные липиды нервной ткани – фосфолипиды (их диацильная и плазмалогенная формы), холестерин, его эфиры, цереброзиды, сульфатиды и ганглиозиды [1–4].
Ганглиозиды представляют собой наиболее сложные гликолипиды животных. В состав основных четырех ганглиозидов мозга (GM1, GD1a, GD1b и GT1b) входят сфингозиновые основания, жирные кислоты (образующие церамид) и углеводная цепь из четырех углеводных остатков (глюкоза–галактоза–N-ацетилгалактозамин–галактоза), представляющая собой по структуре ганглиотетраозильную цепь, к галактозным остаткам которой присоединены от 1 до 3 остатков сиаловых кислот. Ганглиозиды появились на относительно поздних этапах эволюции животных как компоненты мембран клеток у вторичноротых, представленных типами иглокожих и хордовых. В процессе эволюционного развития ветви позвоночных содержание ганглиозидов в мозге увеличивается по мере усложнения его организации и увеличения степени дифференцированности [4–6], при этом основным местом локализации ганглиозидов у позвоночных являются мембраны нервных клеток, особенно синаптические [7, 8].
Цель настоящего обзора заключается в том, чтобы охарактеризовать на примере изучения ганглиозидов некоторые аспекты исследования липидов мозга позвоночных, проводившихся под руководством академика Евгения Михайловича Крепса и продолженных его учениками и сотрудниками в последующие годы.
КОМПЕНСАТОРНЫЕ ИЗМЕНЕНИЯ СОСТАВА ЖИРНЫХ КИСЛОТ ГАНГЛИОЗИДОВ МОЗГА ПРИ ПРИРОДНЫХ АДАПТАЦИЯХ РЫБ К ТЕМПЕРАТУРЕ ВОДЫ И ДРУГИМ ИЗМЕНЯЮЩИМСЯ УСЛОВИЯМ ОКРУЖАЮЩЕЙ СРЕДЫ
Сравнительно-биохимическое изучение липидов биологических мембран является плодотворным подходом к пониманию их приспособительных функций, роли в биохимических механизмах адаптации эктотермных организмов к постоянно меняющимся условиям среды и функциональной активности [1–4, 9, 10]. Состав ганглиозидов и других липидов мозга был изучен под руководством Е.М. Крепса у представителей всех классов позвоночных животных, в том числе у десятков видов костистых рыб. Среди них нами были отобраны 7 холодноводных стенотермных видов костистых рыб, обитающих при температуре 0–10°С (Bathylagus antarcticus, Lampanictus australis, Antimora rostrata, Coelorhyncus sp., Comeporus baicalensis, Comeporus dybowski, Cottocomeporus inermis), и 7 тепловодных стенотермных видов костистых рыб, обитающих при температуре 23–25°С (Cheilopogon exsilience, Lepophidium profundorum, Calamus sp., Coryphaena hippurus, Lethrinus chrisostomus, Rhomboplites aurorubens, Sphyraena picudilla). При сравнении состава жирных кислот ганглиозидов мозга у этих двух групп рыб между ними были выявлены очень яркие различия, обладающие высокой степенью достоверности [9]. Так, тепловодные виды содержали в составе ганглиозидов мозга 83.4 ± 1.5% насыщенных жирных кислот от их общего содержания, а холодноводные виды – лишь 50.9 ± 4.9% этих кислот (рис. 1), различия достоверны (p < 0.01). У тепловодных видов доля моноеновых и полиеновых жирных кислот в составе ганглиозидов мозга составляла лишь 16.1 ± 1.6% и менее 1% от общего их содержания соответственно, а у холодноводных видов – 35.3 ± 3.6% и 13.8 ± 4.0% от общего содержания жирных кислот соответственно (различия достоверны, p < 0.01). Наиболее высокое содержание моноеновых и полиеновых жирных кислот в составе ганглиозидов мозга оказалось характерным для рыб, обитающих при низких температурах воды и на больших глубинах. Аналогичные различия в составе жирных кислот оказались характерными (рис. 1) и для отдельных фосфолипидов (фосфатидилхолина, фосфатидилэтаноламина и сфингомиелина). При адаптации к температуре окружающей среды наиболее выраженные изменения были обнаружены в содержании жирных кислот 18:0, 22:1, 24:1 and 22:6 ω3 в составе фосфолипидов и ганглиозидов мозга рыб, эти кислоты можно назвать “инструментами адаптации” [4, 9]. Интересно отметить, что изменения состава жирных кислот ганглиозидов при природных адаптациях костистых рыб к температуре обитания оказались более выраженными, чем аналогичные изменения в составе жирных кислот фосфолипидов мозга у тех же видов рыб (рис. 1). Возможно, это связано с тем, что основным местом локализации ганглиозидов в мозгу позвоночных являются наружные мембраны нервных клеток, в том числе синаптические, сохранение функциональной активности которых на оптимальном уровне особенно важно для организма [6–8].
Рис. 1.
Состав жирных кислот холодноводных и тепловодных стенотермных видов костистых рыб. Приведены средние данные по составу жирных кислот ганглиозидов и фосфолипидов 7 холодноводных стенотермных видов костистых рыб, обитающих при температуре 0–10°С (Bathylagus antarcticus, Lampanictus australis, Antimora rostrata, Coelorhyncus sp., Comeporus baicalensis, Comeporus dybowski, Cottocomeporus inermis), и 7 тепловодных стенотермных видов костистых рыб, обитающих при температуре 23–25°С (Cheilopogon exsilience, Lepophidium profundorum, Calamus sp., Coryphaena hippurus, Lethrinus chrisostomus, Rhomboplites aurorubens, Sphyraena picudilla). Fig. 1. Fatty acid composition of lipids from brain of warm-water and cold-water stenothermal species of teleost fishes. The data are presented showing the average fatty acid composition of gangliosides and phospholipids from brain of 7 cold-water stenothermal teleost species living at water temperature of 0–10°C (Bathylagus antarcticus, Lampanictus australis, Antimora rostrata, Coelorhyncus sp., Comeporus baicalensis, Comeporus dybowski, Cottocomeporus inermis) and of 7 warm-water stenothermal teleost species living at temperature of 23–25°C (Cheilopogon e-xsilience, Lepophidium profundorum, Calamus sp., Coryphaena hippurus, Lethrinus chrisostomus, Rhomboplites a-urorubens, Sphyraena picudilla).
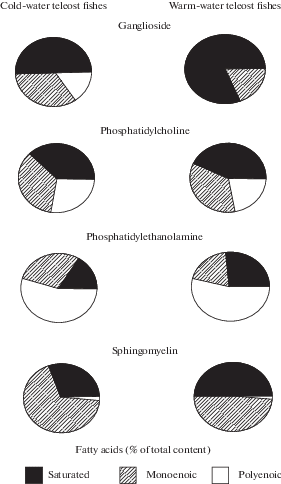
У хрящевых и ганоидных рыб также наблюдаются адаптивные изменения в составе ганглиозидов мозга, обуславливающие различия в составе жирных кислот этих липидов у тепловодных и холодноводных видов. Но у этих рыб они происходят, главным образом, за счет изменения доли насыщенных и моноеновых жирных кислот. Высокое содержание полиеновых жирных кислот в составе ганглиозидов мозга оказалось характерным прежде всего для холодноводных и глубоководных видов костистых рыб, у которых содержание отдельных полиеновых жирных кислот, например, докозагексаеновой кислоты (22:6, n-3), достигает 20–30% от суммы жирных кислот [4, 9]. Интересно, что при этом у млекопитающих состав жирных кислот ганглиозидов обладает очень высокой степенью насыщенности и однородности. Так, на долю стеариновой кислоты в ганглиозидах мозга разных видов этих животных приходится 80–90% от суммы жирных кислот [5].
При сравнении данных по составу жирных кислот ганглиозидов мозга у 37 видов рыб (костистых, ганоидных и хрящевых) также показана зависимость их состава от температуры обитания вида. Так, выявлена прямая корреляционная зависимость степени насыщенности жирных кислот ганглиозидов мозга этих рыб от температуры окружающей среды и отрицательная корреляция содержания моноеновых и длинноцепочечных жирных кислот ганглиозидов мозга рыб и температуры обитания вида [11].
Следует отметить, что введение даже одной и тем более нескольких двойных связей в молекулу жирной кислоты намного уменьшает температуру ее плавления, вплоть до нескольких десятков градусов. По-видимому, отмеченные различия в составе жирных кислот ганглиозидов мозга разных видов рыб определяются идиоадаптациями этих животных к температуре их обитания, направленными на сохранение жидкокристаллического состояния клеточных мембран, на поддержание на оптимальном уровне их микровязкости, микрогетерогенности и состава аннулярных липидов, окружающих молекулы мембранных ферментов [4, 9].
РАЗЛИЧИЯ В СОСТАВЕ И СТРОЕНИИ УГЛЕВОДНОГО КОМПОНЕНТА МОЛЕКУЛЫ ГАНГЛИОЗИДОВ У ПРЕДСТАВИТЕЛЕЙ РАЗНЫХ КЛАССОВ ПОЗВОНОЧНЫХ
В отличие от данных по жирным кислотам нами не выявлено зависимости состава и строения углеводного компонента молекулы ганглиозидов мозга рыб от температуры окружающей среды или глубины обитания видов [4, 6, 11, 12]. Для объективной интерпретации большого по объему экспериментального материала оценки относительного сходства и различия видов на основании признаков молекулярной организации веществ, которые можно оценить количественно, может быть применен один из политетических методов кластерного анализа. Такого рода исследований в отношении липидов в литературе мы не встретили. Нами проведено построение дендрограммы, отражающей признаки организации состава и строения углеводного компонента ганглиозидов мозга. Его проводили, используя “невзвешенный” парно-групповой метод [11]. “Невзвешенный” означает, что каждому из признаков придавалось равное значение или “вес”. В качестве 8 признаков молекулярной организации, которые можно оценить количественно, использовали содержание индивидуальных ганглиозидов (GP, GQ, GT1b, GD1b, GD1a, GD3, GM1) и суммарное содержание двух их минорных фракций (GM2 + GM3) в мозгу изученных нами по этим показателям 24 видов эктотермных позвоночных. Содержание отдельных ганглиозидов оценивалось в условных единицах. Так, содержание отдельных ганглиозидов обозначалось величиной 1, если оно составляло в мозгу данного вида 1–10%, величиной 2 – при его содержании 11–20%, 3 – при его содержании 21–40%, 4 – при его содержании, превышающем 40% от суммы ганглиозидов. Величина 0 присваивалась виду по данному показателю, если индивидуальный ганглиозид в мозгу данного вида находился в количествах менее 0.5% от суммы ганглиозидов. Таким образом, каждый из изученных видов эктотермных позвоночных был охарактеризован по 8 разным признакам, отражающим содержание разных ганглиозидов в мозгу данного вида. Дендрограммы затем генерировали с помощью программы PAUP версии 4.0b8 для компьютера Макинтош, используя невзвешенный парно-групповой метод средних оценок, оптимизированный согласно принципу максимальной экономии [11].
Кладограмма, построенная на основании кластерного анализа данных о составе углеводного компонента ганглиозидов мозга позвоночных (рис. 2), в значительной мере соответствует картине классической таксономии позвоночных. Хрящевые и ганоидные рыбы образуют отдельные кластеры и являются сестринскими ветвями друг для друга, виды этих рыб не образуют сестринские группы с какими-либо представителями костистых рыб, амфибий или пресмыкающихся. Все костистые рыбы находятся в пределах одной и той же отдельной ветви на кладограмме. Изученные рептилии образуют на дендрограмме отдельную ветвь. Но в отличие от классической систематики позвоночных два изученных вида земноводных (из отряда бесхвостых) не образуют отдельной ветви, а расположены среди представителей костистых рыб, что, по-видимому, связано с сохранением черт организации, присущих общим предкам.
Рис. 2.
Дендрограмма, показывающая относительное сходство различных видов эктотермных позвоночных в отношении молекулярной организации углеводного компонента ганглиозидов мозга. Fig. 2. The dendrogram of relative similarity of different vertebrate species according to the parameters of the molecular organization of the carbohydrate component of brain gangliosides.

На приведенной кладограмме высшие позвоночные представлены лишь рептилиями, но для птиц и млекопитающих так же, как и для рептилий, характерно низкое содержание полисиалоганглиозидов с 4 и 5 остатками сиаловых кислот в молекуле и увеличение доли моносиалоганглиозидов по сравнению с низшими позвоночными, у которых велико содержание полисиалоганглиозидов. Как известно, при выходе позвоночных на сушу происходили кардинальные изменения в организации животных и их отдельных органов, которые являются типичным примером ароморфоза [13]. Углеводный компонент молекулы гликолипидов и гликопротеинов играет существенную роль в процессах дифференцировки клеток и межклеточного взаимодействия, в том числе, клеточного узнавания и адгезии, особенно при развитии органов и тканей. При этом ганглиозиды с разным строением углеводной цепи могут различаться по своим функциям. Полученные данные позволяют предположить, что изменения состава и строения ганглиозидов мозга, связанные с появлением высших позвоночных, наряду со многими другими биохимическими изменениями внесли вклад в молекулярные основы ароморфоза при переходе позвоночных к сухопутному образу жизни и амниотическому развитию зародышей, сопровождавшемуся дифференцировкой и усложнением функций мозга.
В нашем исследовании ганоидные рыбы образуют единый кластер, при этом они входят в сестринскую группу с высокоорганизованными хрящевыми рыбами. Взгляды зоологов на систематическое положение ганоидных рыб противоречивы. Их рассматривают как один из надотрядов класса костных рыб. Но ряд зоологов, напротив, подчеркивает общность происхождения хрящевых ганоидов и хрящевых рыб [см., например, 14]. Наши результаты согласуются с данными этих ученых. Исследования гибридизации ДНК [15, 16] и изучение состава разных липидов (фосфолипидов, ганглиозидов, цереброзидов и сульфатидов) у разных видов рыб выявили существенное отличие ганоидных рыб как от костистых, так и от хрящевых рыб [4]. Совокупность данных, полученных при изучении молекулярной организации как ДНК, так и состава и структуры разных липидов мозга у отдельных видов рыб позволяет предполагать целесообразность выделения ганоидных рыб в таксон более высокого порядка, чем надотряд класса костных рыб, возможно, в отдельный подкласс или даже класс [4, 15, 16].
ЗАЩИТНЫЙ ЭФФЕКТ ОСНОВНЫХ ГАНГЛИОЗИДОВ МОЗГА МЛЕКОПИТАЮЩИХ (GM1, GD1A, GD1B И GT1B) НА ПЕРВИЧНЫЕ КУЛЬТУРЫ НЕРВНЫХ КЛЕТОК И КЛЕТКИ НЕЙРОНАЛЬНОЙ КЛЕТОЧНОЙ ЛИНИИ PC12, МОДУЛЯЦИЯ АКТИВНОСТИ СИГНАЛЬНЫХ ПУТЕЙ
Ганглиозиды мозга обладают функциями адаптогенов и у млекопитающих. Однако это не проявляется в сколько-нибудь существенных изменениях их жирнокислотного состава при содержании крыс при низкой температуре окружающей среды [17], а проявляется в повышении ганглиозидами жизнеспособности нейронов мозга и в улучшении функционального состояние организма при введении этих липидов животным с различными поражениями мозга. Основные ганглиозиды мозга обладают защитным действием на нервные клетки в культуре, чаще всего в опытах используется наиболее стабильный ганглиозид GM1. Найдено, что защитный эффект GM1 против токсического действия глутамата или бессывороточной среды на первичные культуры нервных клеток и клетки нейрональных линий зависит от активации этим ганглиозидом тирозинкиназы Trk-рецепторов [18–20]. Нами впервые показано, что ганглиозид GM1 повышает жизнеспособность нервных клеток и при других токсических воздействиях, таких как действие амилоидного бета-пептида [21], что было подтверждено затем другими авторами [22, 23], либо при действии перекиси водорода [24], причем в этих случаях защитное действие GM1 также основано на активации им тирозинкиназы Trk-рецепторов.
Изучение защитного эффекта ганглиозидов на нервные клетки в культуре, как правило, ведется, используя их в микромолярных концентрациях (10–50 мкМ). Но в спинномозговой жидкости (СМЖ) и межклеточном пространстве мозга людей и животных присутствуют наномолярные концентрации ганглиозидов. Так, по данным Blennow и соавт. [25] у людей суммарное содержание четырех основных ганглиозидов мозга в СМЖ составляет в среднем 92 нМ. По-видимому, физиологическими концентрациями ганглиозидов in vivo, в которых они действуют извне на нервные клетки мозга, являются именно наномолярные концентрации.
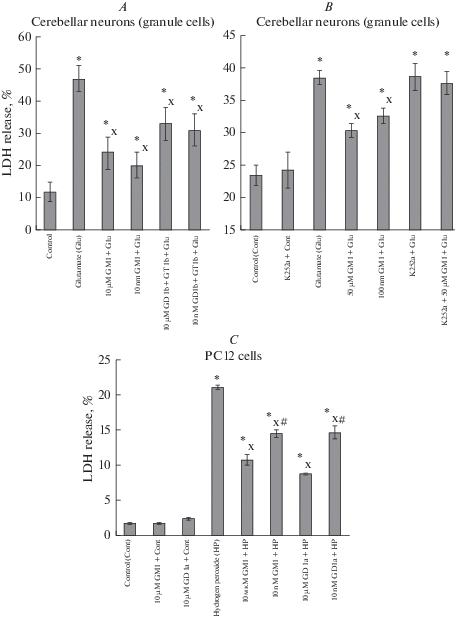
Нам удалось впервые показать, что защитный эффект ганглиозидов GM1, GD1a, GD1b и GT1b против токсического действия глутамата на нейроны мозжечка (клетки-зерна), имеющие экспрессированные глутаматные рецепторы, хорошо выражен не только в микро, но и в наномолярной концентрации [20, 26]. Так, 100 мкМ глутамата увеличивало число погибших нейронов с 12 ± 3% до 47 ± 4% (n = 8). Но при преинкубации клеток с 10 нМ или 10 мкМ GM1 (рис. 3A и B) до действия глутамата число погибших нейронов уменьшалось до 24 ± 4% и до 20 ± 5% соответственно [24], о чем судили, определяя гибель нейронов по проценту клеток с пикнотическими ядрами (p < 0.01 во всех случаях). Достоверное и сходное повышение жизнеспособности клеток-зерен отмечалось также под влияние микро- и наномолярных концентраций ганглиозидов GD1a, GT1b и GD1b (рис. 3A), а также суммарных ганглиозидов мозга. Затем эти данные были подтверждены нами [20], используя биохимический лактатдегидрогеназный метод определения жизнеспособности нейронов мозжечка. При этом было показано, что защитный эффект зависит от активации ганглиозидом GM1 тирозинкиназы Trk-рецепторов и исчезает в присутствии ингибитора этого фермента K-252a (рис. 3B). Ганглиозиды GM1 и GD1a повышали и жизнеспособность клеток нейрональной линии PC12, подвергнутых действию перекиси водорода (рис. 3C), в этом случае в присутствии K-252a защитный эффект GM1 также не проявлялся [24]. Но при защите клеток PC12 от токсического действия перекиси водорода (рис. 3C) защитный эффект наномолярного ганглиозида GM1 был достоверно ниже, чем эффект микромолярного GM1 [24]. Эти результаты свидетельствуют о том, что ганглиозиды в наномолярных концентрациях, характерных для спинномозговой жидкости, наиболее эффективно защищают нервные клетки от эксайтотоксичности.
Рис. 3.
Влияние ганглиозидов GM1и GD1a и тирозинкиназы Trk-рецепторов K252a на жизнеспособность клеток-зерен мозжечка и клеток нейрональной линии PC12, подвергнутых действию токсинов. Данные представлены как среднее ± SEM из трех параллельных определений в типичном опыте из 4–5 поставленных опытов. Нейроны мозжечка (клетки-зерна) и клетки PC12 инкубировали с ингибитором K-252a (или без него) 30 мин, затем с ганглиозидами GM1 или GD1a или GD1b и GT1b в течение 1 ч, после чего подвергали действию 100 мкМ глутамата в течение 0.5 ч (A и B), а клетки PC12 – действию 1 мМ перекиси водорода в течение 2 ч (C). Жизнеспособность клеток определяли по выходу ЛДГ, %. Различия достоверны по сравнению: * – с контролем, p < 0.01, х – по сравнению с действием одного токсина (глутамата или перекиси водорода), p < 0.01, # – по сравнению с аналогичными пробами, не содержащими ингибитор K-252a (B) или по сравнению с действием того же ганглиозида в микромолярной концентрации. Fig. 3. The effect of GM1 and GD1a gangliosides and of Trk receptor tyrosine kinase inhibitor K252a on the viability of cerebellar granule cells and PC12 cells exposed to toxins. The data represent the mean ± SEM of 3 parallel determinations in a typical experiment from 4–5 experiments made. Cerebellar neurons (granule cells) and PC12 cells were preincubated with the inhibitor K-252a (or without it) for 0.5 h, then with gangliosides GM1, GD1a, GD1b and GT1b for 1 h. Afterwards cerebella neurons were exposed to 100 µM glutamate for 0.5 h (A and B) and PC12 cells to 1mM hydrogen peroxide for 2 h (C). The differences are significant as compared to: * – controls, p < 0.01, х – to the effect of toxin only (glutamate or hydrogen peroxide), p < 0.01, # – to the similar samples not containing K-252a (B) or to the effect of the same ganglioside in micromolar concentration (C).
Активация ганглиозидом GM1 протеинкиназы, регулируемой внеклеточными сигналами (ERK1/2), и протеинкиназы B (Akt) происходит после активации тирозинкиназы Trk-рецепторов. Так, в клетках PC12 в присутствии ингибитора тирозинкиназы Trk-рецепторов K-252a активации этих протеинкиназ под влиянием перекиси водорода и преинкубации с ганглиозидом GM1 практически не происходило [24]. Активность ERK1/2 после их аппликации в присутствии этого ингибитора оставалась крайне низкой, а активность Akt продолжала находиться на уровне контрольных значений [24]. Ранее было показано, что в срезах коры мозга активация ERK1/2 и Akt происходит после активации тирозинкиназы Trk-рецепторов [27].
Необходимо было оценить, важна ли активация ERK1/2 и Akt ганглиозидами для осуществления ими защитного эффекта на нервные клетки. Нами показано [24], что в присутствии ингибитора ERK1/2, или Akt, или протеинкиназы С защитный эффект GM1 против токсического действия перекиси водорода на клетки PC12 достоверно снижается (табл. 1). Но лишь в присутствии ингибиторов всех трех этих протеинкиназ уменьшение защитного эффекта ганглиозида становится сопоставимым с эффектом ингибитора тирозинкиназы Trk-рецепторов (табл. 1). Полученные нами результаты согласуются с данными о том, что активация ERK1/2 ганглиозидом GM1 увеличивает жизнеспособность нейронов сетчатки после аксотомии оптического нерва [28].
Таблица 1.
Влияние ингибиторов различных протеинкиназ на долю клеток PC12, гибель которых при действии перекиси водорода была предотвращена преинкубацией с 10 мкМ ганглиозида GM1 (доля выживших клеток, %) Table 1. Effect of various protein kinase inhibitors on the percent of the PC12 cells, whose death was prevented by preincubation with 10 µM GM1 prior to cell exposure to hydrogen peroxide (rescue rates, %)
| Rescue rates, % | Проба Sample |
Rescue rates, % | Проба Sample |
|---|---|---|---|
| 70.5 ± 3.8 | Преинкубация только с GM1 Preincubation only with GM1 |
56.7 ± 4.6* | Преинкубация с LY294002 и GM1 Preincubation with LY294002 & GM1 |
| 76.2 ± 3.2 | Преинкубация только с GM1 Preincubation only with GM1 | 65.7 ± 2.8* | Преинкубация с SL327 и GM1 Preincubation with SL327 & GM1 |
| 63.1 ± 4.1 | Преинкубация только с GM1 Preincubation only with GM1 | 48.2 ± 3.4* | Преинкубация с GF108293X и GM1) Preincubation with SL327 & GM1 |
| 57.5 ± 5 | Преинкубация только с GM1 Preincubation only with GM1 |
20.8 ± 7.4** | Преинкубация с SL327, LY294002, GF108293X и GM1 Preincubation with SL327, LY294002 & GM1& |
| 61.2 ± 3.7 | Преинкубация только с GM1 Preincubation only with GM1 |
12.4 ± 7.6** | Преинкубация с K252a и GM1 Preincubation with K252a &GM1 |
Данные представляют собой среднее ± SEM из 6 опытов. Клетки PC12 выращивали в среде DMEM, содержащей 10% сыворотки плодов коровы и 5% сыворотки лошади, 50 мкг/мл пенициллина и 50 ед./мл стрептомицина. Опыты проводили в среде DMEM, клетки PC12 за 24 ч до проведения опытов помещали в 24-луночные планшеты по 2 × 105 клеток в лунку. Клетки преинкубировали 0.5 ч с 10 мкМ LY294002 или с 10 мкМ SL327 или с 1 мкМ GF108293X или с тремя этими ингибторами или с 1мкМ K-252a. Затем клетки подвергали действию 10 мкМ ганглиозида GM1 в течение 1 ч, после чего воздействовали 1 мМ перекиси водорода в течение 2 ч. * и ** – различия достоверны по сравнению с данными (rescue rates), полученными при отсутствии в пробах ингибиторов, * – p < 0.05, ** – p < 0.01. The data are presented as mean ± SEM from 6 experiments. PC12 cells (ATCC) were cultivated in DMEM containing 10% fetal calf serum, 5% horse serum, 50 µg/ml of penicillin and 50 U/ml of streptomycin Assessment of PC12 cell viability was performed measuring lactate dehydrogenase (LDH) release. The experiments were performed in DMEM, they started 24 h after the transfer of the cells to the 24-well plates (2 × 105 cells for a well). PC12 cells were preincubated with 10 µM SL327 or with 10 µM LY294002 or with 1 µM GF108293X or with these three inhibitors or with 1 µM K-252a (or without them) for 0.5h, then with 10 µM of GM1 ganglioside (or without it) for 1 h. Then PC12 cells were exposed to 1 mM hydrogen peroxide for 2 h. * and ** – the differences are significant as compared to the data (rescue rates) obtained in the absence of the inhibitors in the samples, * – p < 0.05, ** – p < 0.01.
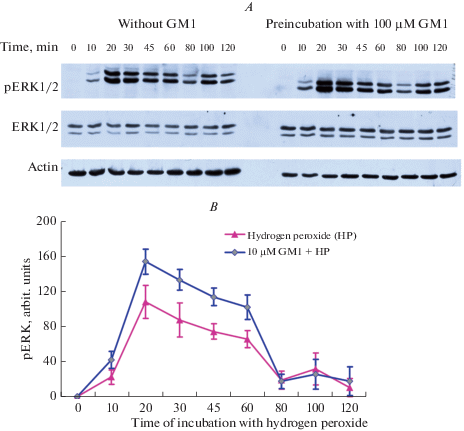
Методом иммуноблоттинга показано, что ганглиозид GM1 активирует не только тирозинкиназу Trk-рецепторов, но и протеинкиназу B (Akt) и ERK1/2 в клетках PC12 [24]. Наши данные согласуются с данными других авторов, свидетельствующими о том, что защитный эффект микромолярного ганглиозида GM1 на нервные клетки и клетки нейрональных линий в культуре реализуется благодаря активации тирозинкиназы Trk-рецепторов [18, 19, 27, 28]. При модуляции активности ERK1/2 более выраженным в наших опытах оказался эффект микромолярного GM1. Перекись водорода сама активировала ERK1/2 и Akt. При этом преинкубация с 10 мкМ (рис. 4A и 4B) и в меньшей мере со 100 нМ GM1 еще больше увеличивала активность ERK1/2 в клетках PC12.
Рис. 4.
Увеличение активности ERK1/2 (уровня pERK1/2) в клетках PC12 под влиянием перекиси водорода и преинкубации с ганглиозидом GM1. Клетки PC12 инкубировали с 10 мкМ ганглиозида GM1 в течение 1 ч, после чего подвергали действию 1 мМ перекиси водорода в течение 2 ч. A – представлен результат одного типичного опыта из 5–6 поставленных (иммуноблоты). B – данные представлены как среднее ± SEM из 5–6 опытов. На клетки PC12 действовали одной перекисью водорода (линия с треугольниками), либо перекисью водорода после преинкубации с 10 мкМ GM1 (линия с ромбами). Уровень pERK1/2 выражали в условных единицах, принимая за 1.0 уровень pERK в контрольных клетках в отсутствие в среде перекиси водорода и ганглиозидов. Его определяли через 0, 10, 20, 30, 45, 60, 80, 100 и 120 мин после аппликации перекиси водорода. Различия достоверны по сравнению c: * – контролем, p < 0.05, х – с эффектом одной перекиси водорода по t критерию Стьюдента методом попарных сравнений, p < 0.05. Fig. 4. The increase of ERK1/2 activity (pERK1/2 level) in PC12 cells by cell exposure to hydrogen peroxide and preincubation with GM1 ganglioside. PC12 cells were preincubated with 10 µM GM1 for 1 h. Then the cells were exposed to 1 mM hydrogen peroxide for 2 h. A The results of one typical experiment from 5–6 experiments carried out is presented (immunoblots). B The data are presented as the mean ± SEM from 5–6 experiments. PC12 cells were exposed to hydrogen peroxide only (line with triangulars) or to hydrogen peroxide after preincubation with 10 µM GM1 (line with rhombs). The results are expressed in arbitrary units, taking for 1.0 the pERK1/2 level in control cells in the absence of hydrogen peroxide or gangliosides in the incubation medium. The pERK1/2 levels were determined 10, 20, 30, 45, 60, 80, 100 and 120 min after the onset of the exposure of PC12 cells to hydrogen peroxide. The difference is significant by paired Student’s t test as compared: * – to control value, p < 0.01, x – to the effect of hydrogen peroxide alone, p < 0.01.
При действии на клетки PC12 ганглиозида GM1 происходит также активация Akt, о чем судили по увеличению фосфорилированной формы фермента – pAkt (Ser473) в контрольных клетках PC12 (рис. 5A и 5B). Увеличение уровня pAkt (Ser473) было достоверным через 30 и 45 мин после аппликации как 100 нМ, так и 10 мкМ GM1, достоверных различий между эффектом разных концентраций GM1 в этом случае не выявлено.
Рис. 5.
Ганглиозид GM1 увеличивает базальную активность Akt (уровень pAkt) в клетках PC12. A – представлен результат одного типичного опыта из 4 поставленных (иммуноблоты). Инкубация со 100 нМ и 10 мкМ GM1увеличивает уровень pAkt в клетках PC12 по сравнению с контролем (0 точка). Экспрессия Akt (общий уровень Akt) не меняется под влиянием инкубации клеток с ганглиозидом GM1. B – данные представлены как среднее ± SEM из 4 опытов. На клетки PC12 действовали 100 нМ GM1(линия с квадратами) и 10 мкМ GM1 (линия с ромбами) в течение 1 ч. Уровень pAkt нормализовали по его уровню в контрольных клетках (в отсутствие GM1), который принимали за 1.0. Уровень pAkt (в условных единицах) измеряли через 1, 5, 10, 15, 20, 30, 45 и 60 мин после аппликации GM1. * – различия достоверны по t критерию Стьюдента методом попарных сравнений по сравнению с базальным уровнем pAkt в отсутствие GM1 (0 точка), p < 005. Fig. 5. GM1 ganglioside increases the basal pAkt level in PC12 cells. Incubation with 100 nM and 10 µM GM1 increases the level of pAkt in PC12 cells as compared with control (0 min). Akt expression (total Akt level) was not changed as a result of incubation with ganglioside GM1. A The results of one typical experiment from four experiments carried out (immunoblots) is presented.). B The data represent the mean ± SEM from four experiments. PC12 cells were exposed to100 nM GM1 (line with squares) or to 10 µM GM1 (line with rhombs) for 1 h. The pAkt levels are normalized to the level in control cells in the absence of GM1 (set as 1.0). The pAkt levels (arbitrary units) in the PC12 cells were measured 1, 5, 10, 15, 20, 30, 45 and 60 min after the exposure to GM1. * – the difference is significant by paired Students t test as compared to the basal pAkt level in the absence of GM1 (0 min), p < 0.05.

ГАНГЛИОЗИД GM1 НОРМАЛИЗУЕТ СКОРОСТИ ДЫХАНИЯ КЛЕТОК PC12 И МИТОХОНДРИЙ, ИЗОЛИРОВАННЫХ ИЗ МОЗГА КРЫСЫ, СНИЖЕННЫЕ В РЕЗУЛЬТАТЕ ДЕЙСТВИЯ ПРООКСИДАНТА, ВОЗМОЖНЫЙ МЕХАНИЗМ ЗАЩИТНОГО ДЕЙСТВИЯ ГАНГЛИОЗИДОВ
Как известно из данных литературы, активация Akt в клетках, в том числе в нервных, может приводить к активации фактора транскрипции CREB, к усилению экспрессии антиапоптотических белков митохондрий Bcl-2 и Bcl-xL и к уменьшению отношения про- к антиапоптотическим белкам [29, 30].
Наряду с этим активация ERK1/2 и Akt может приводить к инактивации проапоптотического белка митохондрий Bad, который в активной форме способен реагировать с антиапоптотическими белками Bcl-2 и Bcl-xL [31] и вызывать их инактивацию. Анти- и проапоптотические белки митохондрий являются важными регуляторами процесса апоптоза. Если отношение митохондриальных про- к антиапоптотическим белкам является высоким, митохондрии инициируют запрограммированную клеточную смерть, высвобождая AIF, цитохром с и другие проапоптотические факторы. Эти данные свидетельствуют о том, что активация протеинкиназ ERK1/2 и Akt под влиянием GM1 [24] и других ганглиозидов мозга может приводить к стабилизации митохондрий. Нами показано уменьшение отношения Bax/Bcl-2 в контрольных клетках PC12 под влиянием ганглиозида GM1.
Совместно с сотрудниками других лабораторий ИЭФБ РАН найдено [32], что преинкубация клеток PC12 с ганглиозидом GM1 предотвращает (или в значительной мере уменьшает) снижение скорости базального и разобщенного дыхания, вызванные воздействием перекиси водорода на эти клетки. Был выявлен также нормализующий эффект ганглиозидов GM1 и GD1a на дыхание изолированных из мозга крыс митохондрий [33], сниженное при действии такого прооксиданта, как трет-бутилгидропероксид (тБГП). Интересно, что защитный эффект этих ганглиозидов на изолированные митохондрии не проявлялся, если в среде присутствовал ингибитор тирозинкиназы Trk-рецепторов K-252a. В изолированных из мозга митохондриях присутствуют разные протеинкиназы, в том числе тирозинкиназа Trk-рецепторов A и B [34, 35]. Полученные нами результаты согласуются с данными литературы, показывающими, что защитный эффект фактора роста нервов на изолированные из мозга митохондрии также не проявляется, если в среде присутствует ингибитор K-252a [35]. Эти данные позволяют предполагать, что защитный эффект ганглиозидов (как и фактора роста нервов) может быть в значительной мере обусловлен их действием на сигнальные системы митохондрий.
ГАНГЛИОЗИДЫ GM1 И GD1A ПРЕДОТВРАЩАЮТ ТОКСИЧЕСКОЕ ДЕЙСТВИЕ БАКТЕРИАЛЬНОГО ЛИПОПОЛИСАХАРИДА НА НЕРВНЫЕ КЛЕТКИ, НАРУШАЯ ПРОЦЕСС ТРАНСЛОКАЦИИ ЕГО РЕЦЕПТОРА TLR4 В ЛИПИДНЫЕ РАФТЫ ПЛАЗМАТИЧЕСКИХ МЕМБРАН НЕРВНЫХ КЛЕТОК
Интересные данные получены при изучении механизма защитного действия ганглиозидов [36, 37] против токсического действия бактериального липополисахарида (ЛПС), являющегося основным токсином, инициирующим менингоэнцефалиты у человека. Узнавание ЛПС клетками и внутриклеточная сигнализация, приводящая к реализации его токсического эффекта, инициируются связыванием ЛПC с рецепторами TLR4 клетки хозяина, что требует создание комплекса, состоящего из ЛПС, ЛПС-связывающего белка, СВ14 (ко-рецептора ЛПС), TLR4 и адапторного белка – MD-2. Активированный TLR4 вовлекает в реализацию эффектов ЛПС ряд адапторных белков, которые связывают его с серин/треониновыми киназами. Эти ферменты, в свою очередь, опосредуют активацию фактора транскрипции NFkB , что приводит к транскрипции генов, кодирующих молекулы, связанные с воспалением и цитокины [38–40].
Для инициации внутриклеточного сигналинга ЛПС требуется транслокация TLR4 в липидные рафты плазматической мембраны клеток, которая обычно происходит при действии ЛПС на клетки [41, 42]. Рафты представляют собой специальные микродомены, расположенные в плазматической мембране, для которых характерно высокое содержание холестерина и сфинголипидов. Ганглиозиды (представляющие собой сложные гликосфиголипиды), наряду с холестерином, играют ключевую роль в образовании и стабилизации липидных рафтов, вносят существенный вклад в регуляцию процессов адгезии и воспаления [43–45].
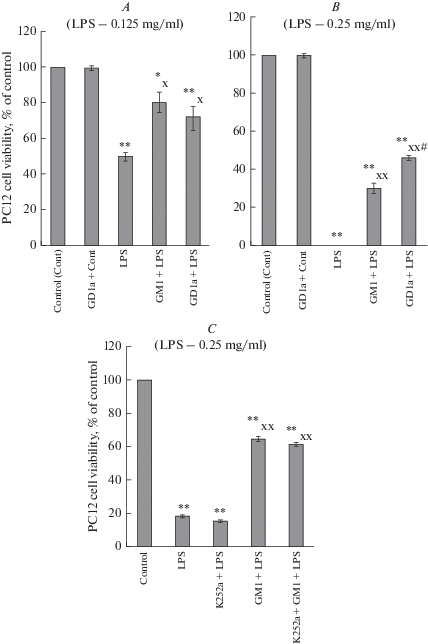
В опытах нами использовался ЛПС из E. coli серотипа 0111:B4. Найдено, что ЛПС очень сильно снижает жизнеспособность клеток нейрональной линии PC12. Так, при его содержании в среде 0.25 мг/мл снижение жизнеспособности клеток происходит до крайне низких величин или даже до 0 [36, 37]. В то же время преинкубация с ганглиозидами GM1 и GD1a вызывает значительное увеличение жизнеспособности этих клеток, подвергнутых действию 0.25 или 0.125 мг ЛПС на мл (рис. 6A и 6B). Найдено, что защитный эффект GM1 и GD1a против действия ЛПС на клетки PC12 не проявляется в наномолярной концентрации и не зависит от модуляции этими ганглиозидами активности тирозинкиназы Trk-рецепторов (рис. 6C). Как указывалось, образование рецепторного комплекса ЛПС с его рецепторами TLR4 происходит в липидных рафтах. При этом ганглиозиды, как и холестерин, в наибольшей мере определяют структуру и функции липидных рафтов [38–45]. Николаевой и Парновой [37] было показано, что преинкубация клеток PC12 с экзогенным ганглиозидом GM1 увеличивает его включение в состав плазматических мембран клеток и практически предотвращает транслокацию рецептора TLR4 в липидные рафты этих мембран под влиянием ЛПС. А такая транслокация рецепторов TLR4 необходима для осуществления ЛПС его токсического эффекта на клетки. По-видимому, при инкубации клеток в присутствии экзогенных ганглиозидов и их включении в состав наружных мембран клеток происходит изменение состава и свойств липидных рафтов, увеличение доли ганглиозидов в них, что предотвращает транслокацию рецептора TLR4 под влиянием ЛПС в состав рафтов и заметно снижает проявление токсического действия ЛПС на клетки. Такой механизм защитного действия ганглиозидов против токсического действия ЛПС является отличным от механизма их защитного действия против длительной инкубации клеток в бессывороточной среде, действия глутамата, амилоидного бета-пептида или перекиси водорода на нервные клетки или клетки нейрональных линий, в основе которого лежит активация тирозинкиназы Trk-рецепторов.
Рис. 6.
Защитный эффект ганглиозидов GD1a и GM1 против токсического действия ЛПС серотипа 0111:B4 на клетки PC12 (жизнеспособность, % от контроля). Клетки PC12 преинкубировали с 1 мкМ ингибитора K-252a (или без него) в течение 0.5 ч, затем их инкубировали в течение 1 ч с ганглиозидами GM1 или GD1a, после чего подвергали воздействию ЛПС (0.125 или 0.25 мг/мл). Данные представлены как среднее ± SEM из 4 определений в одном типичном опыте из 4–5 поставленных опытов. Жизнеспособность клеток определяли, используя МТТ-метод. Различия достоверны: * и ** – по сравнению с контролем, * – p < 0.05, ** – p < 0.01, х и хх– по сравнению с эффектом одного ЛПС, х – p < 0.05, хх – p < 0.01, # – по сравнению с эффектом GM1 и ЛПС. Fig. 6. Protective effect of GD1a and GM1 gangliosides against the toxic action of lipopolysaccharide of 0111:B4 serotype (LPS) on PC12 cells (viability, % from control). PC12 cells were preincubated with the inhibitor K-252a (or without it) for 0.5 h, then with GD1a or GM1 gangliosides for 1 h, afterwards the cells were exposed to LPS (0.125 and 0.25 mg/ml). The data are presented as the mean ± SEM of 4 determinations in a typical experiment from 4–5 expeiments made. The viability of PC12 cells was determined by MTT method and expressed as a per cent of control cell viability taken as 100%. The differences are significant as compared to: * and ** – control, * – p < 0.05, ** – p < 0.01, х and xx – the effect of LPS, x – p < 0.05, xx – p < 0.01, # – the effect of GM1 and LPS.
УЛУЧШЕНИЕ ПРОСТРАНСТВЕННОЙ ПАМЯТИ У КРЫС С НЕОНАТАЛЬНЫМ САХАРНЫМ ДИАБЕТОМ 2-ГО ТИПА ПРИ ИНТРАНАЗАЛЬНОМ ВВЕДЕНИИ ИМ ГАНГЛИОЗИДОВ МОЗГА
Нами изучена способность ганглиозидов мозга, вводимых интраназально, улучшать пространственную память у крыс с неонатальной моделью сахарного диабета 2-го типа (СД2), в опытах использовали расширенную версию водного теста Морриса [46]. Интересно отметить, что интраназальное введение ганглиозидов было применено нами впервые и показало свою высокую эффективность.
В отношении инсулина в последние годы получены данные, показывающие эффективность его интраназального введения для нормализации когнитивных функции мозга при патологии центральной нервной системы человека и животных, в том числе при диабете 1-го (СД1) и 2-го типа (СД2) [46–48]. Для СД2 характерна гиперинсулинемия в крови и введение инсулина в кровь не рекомендуется. Но при интраназальном введении инсулин попадает непосредственно в мозг [49], а в мозге (в том числе в гиппокампе и гипоталамусе, важнейших мишенях инсулина в ЦНС) содержание этого гормона и активность инсулиновой сигнальной системы при СД2 заметно снижены [50]. Поэтому, очевидно, интраназальное введение инсулина, непосредственно поступающего в мозг, компенсирует его дефицит в мозге при СД2. Забегая вперед, можно указать, что интраназальное введение ганглиозидов, впервые примененное нами в том исследовании, о котором пойдет речь в этом разделе [46] показало свою эффективность. Поступление соединений непосредственно в мозг, минуя гематоэнцефалический барьер [49], причем путем, который не является травматичным, имеет большие преимущества, если целью испытаний является предотвращение нарушений когнитивных функций.
Анализ данных литературы показывает, что введение ганглиозидов улучшает обменные процессы и функциональное состояние мозга у животных с нейродегенеративными, ишемическими и другими поражениями мозга [см., например, 51–54]. При этом чаще всего вводят моносиалоанглиозид GM1. Однако имеются сведения, что другие основные ганглиозиды GD1a, GD1b и GT1b и суммарные ганглиозиды мозга обладают не менее выраженным нейропротекторным эффектом [26, 51–54]. Есть примеры благоприятного эффекта ганглиозидов мозга на когнитивные функции человека в условиях клиники [55]. Пищевые добавки в виде комплексных липидов молока, включающих ганглиозиды и фосфолипиды, на ранних стадиях развития улучшают процессы обучения и памяти у животных и коэффициент интеллектуального развития у детей [56, 57]. Но способность ганглиозидов улучшать когнитивные функции при диабете пока не исследована. Представляло интерес изучить влияние ганглиозидов на пространственную память, нарушенную у крыс с неонатальным СД2.
Неонатальный СД2 вызывали однократным введением 5-дневным крысятам-самцам линии Вистар стрептозотоцина (Sigma, США) в дозе 80 мг на кг массы тела. Через 4 мес., когда у крыс развивались признаки СД2, начинали их лечение интраназально вводимыми ганглиозидами (6 мг/кг), которое проводили в течение недели до опытов и во время тестирования в водном тесте Морриса в течение двух недель. Крыса, плавая в бассейне, отыскивала скрытую платформу. Опыты состояли из обучения (5 дней) и переобучения (5 дней), ежедневно каждая крыса совершала по 4 попытки. Поведение животных в водном тесте Морриса регистрировали с помощью веб-камеры. Для каждой серии опытов рассчитывали среднее время нахождения животными из разных групп платформы и величину площади под кривой “время поиска–продолжительность обучения” (AUC – area under curve). Данные тестирований обрабатывались в программе ANYmaze.
Ганглиозиды выделяли из серого вещества мозга быка и подвергали многоступенчатой очистке, как это описано нами ранее [26], после диализа пробы упаривали путем лиофильной сушки. С помощью тонкослойной хроматографии высокого разрешения было показано отсутствие в препарате ганглиозидов мозга примесей фосфолипидов и других гликолипидов, а также белков.
Развитие СД2 у крыс оценивали в глюкозотолерантном тесте, для чего им вводили раствор глюкозы (внутрибрюшинно, 2 г глюкозы/кг) и в течение 120 мин измеряли концентрацию глюкозы в цельной крови, полученной из хвостовой вены, с помощью тест-полосок One Touch Ultra (США) и глюкометра фирмы Life Scan Johnson & Johnson (Дания). При проведении этого теста у крыс с СД2 уровень глюкозы в крови был достоверно выше, чем у контрольных животных, через 30, 60 и 120 мин после введения глюкозы (p < 0.02), что свидетельствует о нарушении толерантности к глюкозе и является характерным признаком СД2. Ганглиозиды существенно не влияли на толерантность диабетических крыс к глюкозе.
У диабетических крыс показано нарушение формирования пространственной памяти. Найдено, что на разных сроках обучения и переобучения время поиска скрытой платформы у крыс с СД2 (группа Д) было достоверно большим, чем у контрольных крыс (группа К). Различия между этими группами наблюдали и по значениям AUC.
Интраназальное введение диабетическим крысам ганглиозидов в дозе 6 мг/кг достоверно снижало время поиска платформы животными (группа ГД) на разных днях обучения (со второго по пятый) и переобучения (с седьмого по десятый) по сравнению с крысами с СД2, не получавшими этот препарат (рис. 7 ). Достоверно ниже были и значения AUС у группы ГД по сравнению с группой Д при анализе данных опытов как по обучению, так и по переобучению крыс (рис. 7 ).
Столь выраженный эффект ганглиозидов на пространственную память обусловлен, по-видимому, их способностью модулировать сигнальные пути мозга, повышая жизнеспособность нервных клеток, благодаря активации тирозинкиназы Trk-рецепторов, протеинкиназы Akt, ERK1/2 и протеинкиназы С [24].
Необходимо подчеркнуть, что способность ганглиозидов, вводимых интраназально, оказывать эффект в сравнительно низкой дозе (6 мг/кг) продемонстрирована нами впервые. При внутрибрюшинном или подкожном введении для выявления защитного эффекта обычно используют 25–100 мг ганглиозидов мозга (или ганглиозида GM1) в расчете на кг массы тела [51, 54]. Мы надеемся, что интраназальное введение ганглиозидов, которые улучшают общее состояние организма, воздействуя именно на мозг, найдет в дальнейшем свое практическое применение. Перспективным для лечения когнитивных нарушений при СД2, очевидно, может быть использование ганглиозидов при их интраназальном введении совместно с метформином и другими препаратами, снижающими резистентность к инсулину.
Список литературы
Kreps E., Smirnov A., Chirkovskaya E., Patrikeeva M., Krasilnikova V. Phospholipids in the nervous system of molluscs. J. Neurochem. 15(4): 285–291. 1968.
Kreps E.M., Avrova N.F., Chebotareva M.A., Chirkovskaya E.V., Levitina M.V., Pomazanskaya L.F., Pravdina N.I. Some aspects of comparative biochemistry of brain lipids in teleost and elasmobranch fish. Comp. Biochem. Physiol B. 52(2): 293–299. 1975.
Крепс Е.М., Аврова Н.Ф., Забелинский С.А., Круглова Э.Э., Левитина М.В. О биохимической эволюции мозга позвоночных. Журн. эвол. биохим. и физиол. 13(5): 556–569. 1977. [Kreps E.M., Avrova N.F., Zabelinskiĭ S.A., Kruglova E.E., Levitina M.V. Biochemical evolution of the vertebrate brain. Zh. Evol. Biokhim. Fiziol. 13(5): 556–569. 1977. (In Russ)].
Крепс Е.М. Липиды клеточных мембран. Л. Наука. 1981. [Kreps E.M. Lipidy` kletochny`x membrane [Lipids of cell membranes]. L. Nauka. 1981. (In Russ)].
Avrova N.F. Brain ganglioside patterns of vertebrates J. Neurochem. 18(4): 667–674. 1971.
Avrova N.F. Evolutionary approach to the analysis of structure and function of gangliosides. Neurochem. Res. 10(11): 1547–1554. 1985.
Аврова Н.Ф. О роли ганглиозидов в дифференцировке нервных клеток и синаптической передаче нервного импульса. Нейрохимия. 1: 290–302. 1982. [Avrova N.F. On the role of gangliosides in nerve cell differentiation and synaptic impulse transduction. Neirokhim. 1: 290–302 (In Russ)].
Palmano K., Rowan A., Guillermo R., Guan J., Mc Jarrow P. The role of gangliosides in neurodevelopment. Nutrients. 7(5): 3891–3913. 2015.
Avrova N.F. The effect of natural adaptation of fishes to the environmental temperature on brain ganglioside fatty acid and long chain base composition. Comp. Biochem. Phsyiol. B. 78: 903–909. 1984.
Крепс Е.М., Тюрин В.А., Горбунов Н.В., Максимович А.А. Активация перекисного окисления липидов при миграционном стрессе у горбуши: возможный механизм адаптации. Докл. АН СССР. 286(4): 1009–1012. 1986. [Kreps E.M., Tiurin V.A., Gorbunov N.V., Maksimovich A.A. Activation of lipid peroxidation during migration stress in the hump-backed salmon: possible mechanism of adaptation. Dokl. Akad. Nauk SSSR. 286(4): 1009–1012. 1986. (In Russ)].
Avrova N.F., Irwin L. New methods to analyze the variations of the brain gangliosides content, which are connected with idioadaptation and aromorphosis in vertebrates. J. Evol. Biochem. Physiol. 38(6): 689–699. 2002.
Avrova N.F. Systematic position of fish species and ganglioside composition and content. Comp. Biochem. Physiol. B. 83(3): 669–676. 1986.
Северцов А.С. Направленность эволюции. М. МГУ.1990. [Severtsov A.S. Napravlennost` e`volyucii. [The focus of evolution]. Moscow. MGU. 1990]. (In Russ)].
Patterson C. Interrelationships of holosteans. In: “Interrelationships of fishes”. Eds. Greenwood P.H., Miles R.S., Patterson C. London. Acad. Press. 1973.
Попов Л.С., Антонов А.С., Медников Б.М., Белозерский А.Н. О естественной системе рыб: итоги применения метода гибридизации ДНК. Докл. АН СССР. 211(3): 737–739. 1973. [Popov L.S., Antonov A.S., Mednikov B.M., Belozerskiĭ A.N. Natural system of fishes: results of application of the method of DNA hybridization. Dokl. Akad. Nauk SSSR. 211(3): 737–739. 1973. (In Russ)].
Попов Л.С., Антонов А.С. Нуклеотидный состав ДНК представителей некоторых отрядов рыб. Научн. докл. высш. школы. Биол. науки. 6: 33–39. 1974. [Popov L.S., Antonov A.S. Nucleotide makeup of the DNA in representatives of certain orders of fishes. Nauchnye Dokl. Vyss. Shkoly. Biol. Nauki. 6: 33–39. 1974. (In Russ)].
Zakharova I.O., Avrova N.F. The effect of cold stress on ganglioside fatty acid composition and ganglioside-bound sialic acid content of rat brain subcellular fractions. J. Thermal Biol. 26: 215–222. 2001.
Ferrari G., Anderson B.L., Stephens R.M., Kaplan D.R., Greene L.A. Prevention of apoptotic neuronal death by GM1 ganglioside. Involvement of Trk neurotrophin receptors. J. Biol. Chem. 270: 3074–3080. 1995.
Bachis A., Rabin S.J., Del Fiacco M., Mocchetti I. Gangliosides prevent excitotoxicity through activation of TrkB receptor. Neurotox. Res. 4(3): 225–234. 2002.
Sokolova T.V., Rychkova M.P., Avrova N.F. Protective effect of GM1 ganglioside against toxic effect of glutamate on cerebellar granule cells. J. Evol. Biochem. Physiol. 50(5): 456–459. 2014.
Sokolova T.V., Zakharova I.O., Furaev V.V., Rychkova M.P., Avrova N.F. Neuroprotective effect of ganglioside GM1 on the cytotoxic action of hydrogen peroxide and amyloid beta-peptide in PC12 cells. Neurochem. Res. 32(8): 1302–1313. 2007.
Kreutz F., Frozza R.L., Breier A.C., de Oliveira V.A., Horn A.P., Pettenuzzo L.F., Netto C.A., Salbego C.G., Trindade V.M. Amyloid-β induced toxicity involves ganglioside expression and is sensitive to GM1 neuroprotective action. Neurochem. Intern. 59(5): 648–655. 2011.
Kreutz F., Scherer E.B., Ferreira A.G., Pereira C.L., Santana F., de Souza W., Salbego C.G., Trindade V.M. Alterations on Na+, K+-ATPase and acetylcholinesterase activities induced by amyloid-β peptide in rat brain and GM1 ganglioside neuroprotective action. Neurochem. Res. 38(11): 342–2350. 2013.
Zakharova I.O., Sokolova T.V., Vlasova Yu.A., Furaev V.V., Rychkova M.P., Avrova N.F. GM1 ganglioside activates ERK1/2 and Akt downstream of Trk tyrosine kinase and protects PC12 cells against hydrogen peroxide toxicity. Neurochem. Res. 39(11): 2262–2275. 2014.
Blennow K., Davidsson P., Wallin A., Fredman P., Gattfries C.G., Mansson J.E., Svennerholm L. Differences in cerebrospinal fluid gangliosides between “probable” Alzheimer disease and normal aging. Aging. 4: 301–306. 1992.
Avrova N.F., Victorov I.V., Tyurin V.A., Zakharova I.O., Sokolova T.V., Andreeva N.A., Stelmaschuk EV., Tyurina Y.Y., Gonchar V.S. Inhibition of glutamate-induced intensification of free radical reactions by gangliosides: possible role in their protective effect in rat cerebellar granule cells and brain synaptosomes. Neurochem. Res. 23(7): 945–952. 1998.
Duchemin A.M., Ren Q., Neff N.H., Hadjiconstantinou M. GM1-induced activation of phosphatidylinositol 3-kinase: involvement of Trk receptors. J. Neurochem. 104: 1466–1477. 2008.
Choi J.S., Kim J.A., Joo C.K. Activation of MAPK and CREB by GM1 induces survival of RGCs in the retina with axotomized nerve. Invest. Ophthalmol. Vis. Sci. 44(4): 1747–1752. 2003.
Pugazhenti S., Nesterova A., Sable C., Heidenreich K.A., Boxer L.M., Heasley L.E., Reusch J.E. Akt/protein kinase B up-regulates Bcl-2 expression through cAMP-response element-binding protein. J. Biol. Chem. 275(15): 10761–10766. 2000.
Cheng Y., Loh Y.P., Birch N.P. Neuroserpin attenuates H2O2-induced oxidative stress in hippocampal neurons via AKT and BCL-2 signaling pathways. J. Mol. Neurosci. 61: 123–131, 2017.
Vauzour D., Vafeiadou K., Rice-Evans C., Williams R. J., Spencer J. P. Activation of pro-survival Akt and ERK 1/2 signalling pathways underlie the anti-apoptotic effects of flavanones in cortical neurons. J. Neurochem. 103(4): 1355–1367. 2007.
Brailovskaya I.V., Sokolova T.V., Kobylyanskii A.G., Avrova N.F. Effect of ganglioside GM1 on mitochondrial respiration and viability of PC12 cells under oxidative stress. J. Evol. Biochem. Physiol. 50(2): 174–176. 2014.
Korotkov S.M., Sokolova T.V., Avrova N.F. Gangliosides GM1 and GD1a normalize respiratory rates of rat brain mitochondria reduced by tert-butyl hydroperoxide. J. Evol. Biochem. Physiol. 53(3): 200–207. 2017.
Wiedemann F.R., Siemen D., Mawrin C., Horn T.F., Dietzmann K. The neurotrophin receptor TrkB is colocalized to mitochondrial membranes. Intern. J. Biochem. & Cell Biol. 38: 610–620. 2006.
Carito V., Pingitore A., Cione E., Perrotta I., Mancuso D., Russo A., Genchi G., Caroleo M.C. Localization of nerve growth factor (NGF) receptors in the mitochondrial compartment: characterization and putative role. Biochim. Biophys. Acta. 1820(2): 96–103. 2012.
Власова Ю.А., Баюнова Л.В., Микурова Е.И., Ляховненко Ю.Б., Николаева С.Д., Парнова Р.Г., Аврова Н.Ф. Защитный эффект ганглиозидов против токсического действия на клетки PC12 бактериального липополисахарида различных серотипов. Рос. физиол. журн. им. И.М. Сеченова. 99(7): 876–887. 2013. [Vlasova Iu.A., Baiunova L.V., Mikurova E.I., Liakhovnenko Iu.D., Nikolaeva S.D., Parnova R.G., Avrova N.F. Protective effect of gangliosides against the toxic action of bacterial lipopolysaccharide of various serotypes on PC12 cells. Russ. J. Physiol. 99(7): 876–887. 2013. (In Russ)].
Nikolaeva S., Bayunova L., Sokolova T., Vlasova Y., Bachteeva V., Avrova N., Parnova R. GM1 and GD1a gangliosides modulate toxic and inflammatory effects of E. coli lipopolysaccharide by preventing TLR4 translocation into lipid rafts. Biochim. Biophys. Acta. Mol. Cell Biol. Lipids. 1851(3): 239–47. 2015.
Palsson-McDermott E. M., O’Neill L. A. Signal transduction by the lipopolysaccharide receptor, Toll-like receptor-4. Immunology. 113(2): 153–162. 2004.
Triantafilou M., Triantafilou K. The dynamics of LPS recognition: complex orchestration of multiple receptors. J. Endotoxin. Res 11(1): 5–11. 2005.
Lu Y.C., Yeh W.C., Ohashi P.S. LPS/TLR4 signal transduction pathway. Cytokine. 42(2): 145–151. 2008.
Triantafilou M., Miyake K., Golenbock D.T., Triantafilou K. Mediators of innate immune recognition of bacteria concentrate in lipid rafts and facilitate lipopolysaccharide-induced cell activation. J. Cell Sci. 115 (Part 12): 2603–2611. 2002.
Anderson R.G., Jacobson K. A role for lipid shells in targeting proteins to caveolae, rafts, and other lipid domains. Science. 296(5574): 1821–1825. 2002.
Pike L.J. Lipid rafts: bringing order to chaos. J. Lipid Res. 44(4): 655–667. 2003.
Sonnino S., Mauri L., Chigorno V., Prinetti A. Gangliosides as components of lipid membrane domains. Glycobiology. 17(1): 1R–13R. 2007.
Ohmi Y., Ohkawa Y., Yamauchi Y., Tajima O., Furukawa K., Furukawa K. Essential roles of gangliosides in the formation and maintenance of membrane microdomains in brain tissues. Neurochem. Res. 37(6): 1185–1191. 2012.
Sukhov I.B., Lebedeva M.F., Zakharova I.O., Derkach K.V., Bayunova L.V., Zorina I.I., Avrova N.F., Shpakov A.O. Improvement of spatial memory of rats with neonatal type 2 diabetes mellitus by intranasal administration of insulin and ganglioside. Bull. Exp. Biol. Med. 168(9): 282–287. 2019.
Chistyakova O.V., Bondareva V.M., Shipilov V.N., Sukhov I.B., Shpakov A.O. Intranasal administration of insulin eliminates the deficit of long-term spatial memory in rats with neonatal Diabetes mellitus. Dokl. Biochem. Biophys. 440(2): 276–278. 2011.
Шпаков О., Деркач К.В. Гормональные системы мозга и сахарный диабет 2-го типа. Санкт-Петербург. Изд-во Политехн. Универ. 2015. [Shpakov A.O., Derkach K.V. Gormonal`ny`e sistemy` mozga i saxarny`j diabet 2-go tipa. Sankt-Peterburg. Izd-vo Politexn. Univer. [Brain hormornal systems and type 2 diabetes mellitus]. Saint-Petersburg. Publ. by Polytechnic University. 2015. (In Russ)].
Fan L.W., Carter K., Bhatt A., Pang Y. Rapid transport of insulin to the brain following intranasal administration in rats. Neural Regen. Res. 14(6): 1046–1051. 2019.
Derkach K., Zakharova I., Zorina I., Bakhtyukov A., Romanova I., Bayunova L., Shpakov A. The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLoS One. 14(3): e0213779. 2019.
Vancetto M.D., Curi L.C., Pereira C.A. Neutralization of the effect of Crotalus durissus terrificus venom by gangliosides. Braz. J. Med. Biol. Res. 28(5): 553–556. 1995.
Pope-Coleman A., Schneider J.S. Effects of chronic GM1 ganglioside treatment on cognitive and motor deficits in a slowly progressing model of Parkinsonism in non-human primates. Restor Neurol. Neurosci. 12(4): 255–266. 1998.
Yamamoto H.A., Mohanan P.V. Ganglioside GT1b and melatonin inhibit brain mitochondrial DNA damage and seizures induced by kainic acid in mice. Brain Res. 964(1): 100–106. 2003.
Li L., Tian J., Long M.K., Chen Y., Lu J., Zhou C., Wang T. Protection against experimental stroke by ganglioside GM1 is associated with the inhibition of autophagy. PLoS One. 11(1): e0144219. 2016.
Svennerholm L., Bråne G., Karlsson I., Lekman A., Ramström I., Wikkelsö C. Alzheimer disease – effect of continuous intracerebroventricular treatment with GM1 ganglioside and a systematic activation programme. Dement. Geriatr. Cogn. Disord. 14(3): 128–136. 2002.
Gurnida D.A., Rowan A.M., Idjradinata P., Muchtadi D., Sekarwana N. Association of complex lipids containing gangliosides with cognitive development of 6-month-old infants. Early Hum. Dev. 88(8): 595–601. 2012.
Liu H., Radlowski E.C., Conrad M.S., Li Y., Dilger R.N., Johnson R.W. Early supplementation of phospholipids and gangliosides affects brain and cognitive development in neonatal piglets. J. Nutr. 144(12): 1903–1909. 2014.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


