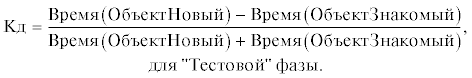Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 6, стр. 765-782
Когнитивная дисфункция у потомства крыс с экспериментальной преэклампсией на ранних и поздних этапах онтогенеза и ее коррекция производными ГАМК
Е. А. Музыко 1, *, Г. А. Ткачева 2, В. Н. Перфилова 1, К. В. Суворин 1, А. А. Нестерова 1, И. Н. Тюренков 1
1 Волгоградский государственный медицинский университет Минздрава России
Волгоград, Россия
2 Волгоградский государственный социально-педагогический университет
Волгоград, Россия
* E-mail: muzyko.elena@mail.ru
Поступила в редакцию 02.03.2020
После доработки 10.03.2020
Принята к публикации 03.04.2020
Аннотация
В статье изучены когнитивные нарушения в различные периоды онтогенеза у потомства крыс с экспериментальной преэклампсией, смоделированной путем замены питьевой воды на 1.8%-ный раствор хлорида натрия с 1-го по 21-й день гестации. У потомства самок с осложненной беременностью как на ранних (40 дней и 3 мес.), так и на более поздних (6 и 12 мес.) этапах индивидуального развития наблюдается снижение рабочей памяти в тесте Распознавание нового объекта, ухудшение формирования и сохранения памятного следа в тесте Условный рефлекс пассивного избегания, а также более выраженный амнезирующий эффект скополамина в дозе 1.75 мг/кг при тестировании сохранности памятного следа. Пероральное введение в пубертатном возрасте (с 40-го по 70-й день жизни) потомству самок с экспериментальной преэклампсией производных ГАМК: сукцикарда, салифена, фенибута и препарата сравнения пантогама способствует уменьшению когнитивного дефицита у животных в разные периоды постнатального развития.
Преэклампсия – специфичное для беременности заболевание, сопряженное с высокой частотой возникновения осложнений как у матери, так и у ребенка на разных этапах жизни.
Ухудшение маточно-плацентарного кровотока при преэклампсии из-за абнормальной плацентации и эндотелиальной дисфункции ведет к гипоксии, хроническое влияние которой провоцирует образование активных форм кислорода, повреждающих нейроны коры и других структур головного мозга. Следствием этого являются нарушения формирования памяти, познавательных процессов и двигательных навыков у потомства [1–3].
У детей, рожденных матерями с преэклампсией, повышен риск возникновения гипертонии, инсульта и когнитивных нарушений [4]. В раннем возрасте у них наблюдается дефицит развития речи [5], а также более низкий уровень коэффициента интеллекта [6] и индекса умственного развития по сравнению с детьми, рожденными здоровыми матерями [7].
По достижении подросткового периода и во взрослой жизни сохраняется дефицит словесно-логического мышления и устного счета [8]. У таких детей в зрелом возрасте и в старости повышается риск развития депрессивных состояний и вероятность ранних дементных нарушений [9].
Гипоксические поражения головного мозга могут вызвать снижение активности холинергической системы. Изменение экспрессии и метаболизма ее ключевого фермента ацетилхолинэстеразы приводит к когнитивной дисфункции в раннем возрасте и развитию нейродегенеративных изменений в более поздние периоды онтогенеза [10].
На настоящий момент нет лекарственных средств с доказанной эффективностью для лечения постгипоксических нарушений у детей в ранние и поздние сроки онтогенеза, недостаточно внимания уделяется проблемам и перспективам поиска новых эффективных и безопасных лекарственных препаратов для коррекции отклонений у потомства, рожденного матерями с преэклампсией. В этом аспекте интерес представляют производные гамма-аминомасляной кислоты (ГАМК), обладающие ноотропными, нейро- и эндотелиопротекторными, антигипоксическими и антиоксидантными эффектами [11–13], способностью регулировать пролиферацию и созревание нейрональных клеток [14]. Перечисленные эффекты веществ этой группы дают основание предполагать возможность влияния их на различные патогенетические звенья постгипоксических осложнений у детей. В ранее проведенных исследованиях было показано, что салифен (аддукт γ-амино-β-фенилмасляной и салициловой кислот) устранял нарушения поведения в пре- и пубертатном периодах у крысят, подвергнутых на второй день после рождения гипоксическому воздействию [13]. В этой связи целью нашего исследования явилось изучение влияния курсового введения производных ГАМК: сукцикарда, салифена, фенибута и препарата сравнения пантогама в пубертатном периоде (с 40-го по 70-й день жизни) на когнитивные функции потомства крыс с экспериментальной преэклампсией в ближайшие и отдаленные периоды онтогенеза.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Эксперименты выполнены на потомстве (n = 442) в возрасте 40 дней, 3, 6 и 12 мес., рожденном белыми беспородными крысами-самками массой 230–250 г с физиологической беременностью (n = 13) и экспериментальной преэклампсией (n = 65), которую моделировали заменой питьевой воды на 1.8%-ный раствор хлорида натрия с 1-го по 21-й день гестации [11]. Животные были получены из ФГУП “Питомник лабораторных животных Рапполово” (Ленинградская область) и содержались в условиях вивария ВолгГМУ. Содержание и уход за ними осуществляли согласно рекомендациям национального стандарта Российской Федерации ГОСТ Р-33044-2014 “Принципы надлежащей лабораторной практики”, Международных рекомендаций “Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях” (The European Convevtion, 1986). Исследование было выполнено в соответствии с требованиями приказа МЗ РФ № 199н от 01.04.2016 г. “Об утверждении правил лабораторной практики” и директивы 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22.09.2010 г. по охране животных, используемых в научных целях. Протокол экспериментального исследования был одобрен Региональным Исследовательским Этическим Комитетом Волгоградской области: № 2044-2017 от 25 декабря 2017 г.
О развитии экспериментальной преэклампсии у самок судили по увеличению артериального давления (АД) и белка в моче на 20-й день беременности по сравнению с 1-ым днем. Измерение АД проводили у самок в 1-й и 20-й дни гестации с помощью прибора неинвазивного измерения давления CODA’TM Non-Invasive Blood Pressure System (“Kent Scientific Corporation”, США). Для сбора суточной мочи крыс-самок помещали в метаболическую клетку (Nalgene, Италия). При определения общего белка в моче использовали набор реагентов КлиниТест-БМ ПГК (Эко-сервис, Россия).
На 39-й день после рождения потомство отсаживали от самок и распределяли таким образом, чтобы крысята от одной самки с экспериментальной преэклампсией оказались в разных группах.
Эксперимент носил двухэтапный характер. На первом этапе животных разделили на две группы: 1 – позитивный контроль – потомство (самцы и самки) от крыс без экспериментальной преэклампсии (n = 41); 2 – негативный контроль – потомство (самцы и самки) от крыс с экспериментальной преэклампсией (n = 40). Затем на 40-ой день для оценки рабочей памяти проводили тест Распознавание нового объекта.
Выявленные нарушения рабочей памяти у потомства от самок с экспериментальной преэклампсией послужили основой для проведения второго этапа исследования, где были сформированы следующие группы животных: 1-я позитивный контроль – потомство (самцы и самки) от крыс без экспериментальной преэклампсии (n = 59), получавшее дистиллированную воду; 2 – негативный контроль – потомство (самцы и самки) от крыс с экспериментальной преэклампсией (n = 60), получавшее дистиллированную воду; 3-я, 4-я, 5-я, 6-я опытные – потомство (самцы и самки) от крыс с экспериментальной преэклампсией, получавшее производные ГАМК – сукцикард в дозе 22 мг/кг (n = 59), салифен – 7.5 мг/кг (n = 62), фенибут – 25 мг/кг (n = 61), а также препарат сравнения пантогам 50 мг (n = 60) соответственно. Исследуемые производные ГАМК и дистиллированную воду вводили перорально один раз в сутки с 40-го по 70-й день постнатального периода в одно и то же время. Дозы веществ соответствовали ½ от используемых у взрослых крыс, проявляющих максимально выраженную фармакологическую активность в ранее проведенных экспериментах [15, 16]. Пантогам был выбран в качестве препарата сравнения, потому что показаниями к применению его у детей являются детский церебральный паралич, перинатальная энцефалопатия, умственная отсталость различной степени тяжести, нарушения психологического статуса в виде общей задержки психического развития, специфические расстройства речи и двигательных функций или их сочетания, затруднение формирования навыков чтения, письма, счета.
После проведенного “лечения” у потомства в возрасте 3, 6 и 12 мес. оценивали рабочую память в тесте Распознавание нового объекта в следующем варианте: тест проводили в установке Открытое поле, для этого животных предварительно помещали в установку на 3 мин, что способствовало привыканию к ней и снижению стрессорного воздействия на поведение крыс. В качестве объектов использовали два металлических цилиндра белого цвета и один цилиндр синего цвета. Они имели одинаковый размер (d = 6 см, h = 11 см) и массу (385 г). В первую фазу “Ознакомления” крысы изучали два одинаковых незнакомых объекта (белые цилиндры) в течение 4 мин, при этом регистрировалось время исследования каждого из них. Затем на 3 мин крысу помещали в индивидуальную клетку. Во вторую фазу “Тестовую” объект 2 меняли на другой, одинаковый по форме, но различающийся по цвету (синий). После этого 4 мин регистрировали время исследования знакомого и нового объектов. Перед началом теста для каждой последующей крысы установку и цилиндры протирали спиртом для уничтожения меток и запаха, оставленных предыдущим животным. Для оценки рабочей памяти и исследовательской активности крыс использовали коэффициент дискриминации (Кд), отражающий разницу между временем исследования двух объектов по отношению к суммарному времени их исследования. Увеличение Кд расценивали как повышение уровня когнитивных процессов. Кд рассчитывали для каждой фазы отдельно по формулам:
Если крыса в “Тестовую” фазу не проявляла интереса ни к одному объекту, то ее относили к животным с отсутствием исследовательской активности.
Затем группы животных разделяли на 2 подгруппы, одной из которых оценивали долговременную память (формирование и сохранение памятного следа) в тесте УРПИ в возрасте 3, 6 и 12 мес., а другой – состояние холинергической системы в аналогичные возрастные периоды.
В УРПИ тестировались животные группы позитивного контроля (n = 38), негативного контроля (n = 41), опытные: 3-я группа (n = 36), 4-я (n = 37), 5-я (n = 38) и 6-я (n = 40).
Установка для обучения УРПИ состояла из двух отсеков, сообщающихся между собой: темного с электрифицированным полом и светлого. Животных по одному помещали в светлую камеру хвостом к входному отверстию в темную камеру. Крысы, в силу норкового рефлекса, имея возможность покинуть менее комфортную светлую камеру, заходили в темный отсек, после чего животное закрывали и в течение 10 с наносили электроболевое раздражение (10 ударов током, сила тока 0.45 мА). Оценку сформировавшегося памятного следа производили через 24 ч после сеанса обучения, а сохранность его на 3-и, 7-е, 14-е и 21-е сут после обучения. Крысу помещали в установку и в течение 180 с регистрировали латентный период первого захода в темную камеру, который является показателем выработки памятного следа, и количество животных от общего числа каждой исследуемой группы, зашедших в нее, в процентах. В день воспроизведения навыка при заходе животного в темную камеру болевое раздражение не наносили [17].
Холинергическая система играет важную роль в регуляции внимания, временной и эксплицитной памяти, обучении и других когнитивных процессов [18]. Для оценки состояния холинергической системы использовали модель скополаминовой амнезии. После обучения УРПИ животным внутрибрюшинно вводили антагонист М-холинорецепторов – скополамин (Across, США) в дозе 1.75 мг/кг за 16 ч перед 1-ым, 3-им, 7-ым, 14-ым и 21-ми днями воспроизведения навыка и на 1-е, 3-и, 7-е, 14-е и 21-е сут проверяли сохранность рефлекса пассивного избегания. Доза скополамина была выбрана в соответствии с ранее проведенными исследованиями [19]. В эксперименте участвовало потомство группы позитивного (n = 20), и негативного контроля (n = 20), животные опытных групп: 3-ей (n = 22), 4-ой (n = 22), 5‑ой (n = 21) и 6-ой (n = 20).
Для регистрации поведения животных применялись видеокамеры, подключенные к персональному компьютеру с программным обеспечением для работы с видеопотоком.
Статистическую обработку результатов исследования осуществляли в пакете программ STATISTICA v.6.0 (StatSoftInc., США) по U-критерию Манна–Уитни, F-критерию Фишера для парных сравнений и критерию Крускала–Уоллиса с пост-тестом Даннета для множественных, с предварительной проверкой выборок на нормальность распределения по критерию Шапиро–Уилка. Различия считали статистически значимыми при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У крыс, которым моделировали экспериментальную преэклампсию, АД на 20‑й день гестации было выше в 1.2 раза (p < 0.05) по сравнению с 1-ым днем, а уровень суточного белка – в 2.1 раза (p < 0.05), в то время как у здоровых самок АД и уровень белка в моче к 20-му дню беременности существенно не изменялись. Это дало основание считать, что у самок, получавших солевой раствор, развилась экспериментальная преэклампсия.
В тесте Распознавание нового объекта у сорокадневного потомства крыс с экспериментальной преэклампсией показатели рабочей памяти были ниже, чем у животных, рожденных здоровыми самками (табл. 1). В “Тестовой” фазе у крысят от самок с экспериментальной преэклампсией Кд носил отрицательный характер, что говорит о пониженном интересе к новому объекту в знакомой обстановке и когнитивных расстройствах в адолесцентном периоде. В этой связи на втором этапе исследования были сформированы группы потомства крыс с экспериментальной преэклампсией, которым с 40-го по 70-й день жизни вводили производные ГАМК и препарат сравнения пантогам.
Таблица 1.
Влияние производных ГАМК на рабочую память потомства от крыс с экспериментальной преэклампсией в разные периоды онтогенеза в тесте Распознавание нового объекта (M ± m) Table 1. The effect of GABA derivatives on the working memory of the offspring from rats with experimental preeclampsia in different periods of ontogenesis in the Novel object recognition test (M ± m)
| Возраст Age |
Группы животных Groups of animals |
n | Фаза
“Ознакомления” “Familiarization” phase |
“Тестовая” фаза “Test” phase |
|
|---|---|---|---|---|---|
| Коэффициент дискриминации Discrimination ratio (М ± m) |
Коэффициент дискриминации Discrimination ratio (М ± m) | Доля особей с отсутствием
исследовательской активности The part of rats with lack of research activity (%) |
|||
| 40 дней 40 days |
Потомство от самок с физиологической беременностью – позитивный контроль The offspring from rats with physiological pregnancy – positive control |
41 | –0.04 ± 0.06 | 0.36 ± 0.07 | 0 |
| Потомство от самок с экспериментальной преэклампсией – негативный контроль The offspring from rats with experimental preeclampsia – negative control |
40 | –0.03 ± 0.07 | –0.01 ± 0.08* | 0 | |
| 3 месяца 3 months |
Потомство от самок с физиологической беременностью, получавшее дистиллированную воду
– позитивный контроль The offspring from rats with physiological pregnancy receiving distilled water – positive control |
59 | 0.01 ± 0.06 | 0.47 ± 0.05 | 3.39 |
| Потомство от самок с экспериментальной преэклампсией, получавшее дистиллированную
воду – негативный контроль The offspring from rats with experimental preeclampsia receiving distilled water – negative control |
60 | –0.07 ± 0.06 | –0.04 ± 0.06* | 5 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее сукцикард 22 мг/кг The offspring from rats with experimental preeclampsia receiving succicard 22 mg/kg |
59 | –0.18 ± 0.05 | 0.32 ± 0.05# | 1.69 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее салифен 7.5 мг/кг The offspring from rats with experimental preeclampsia receiving salifen 7.5 mg/kg |
62 | 0.03 ± 0.05 | 0.52 ± 0.04# | 1.61 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее фенибут 25 мг/кг The offspring from rats with experimental preeclampsia receiving phenibut 25 mg/kg |
61 | –0.07 ± 0.05 | 0.33 ± 0.06# | 1.64 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее пантогам 50 мг The offspring from rats with experimental preeclampsia receiving pantogam 50 mg |
60 | –0.04 ± 0.05 | 0.32 ± 0.05# | 5 | |
| 6 месяцев 6 months |
Потомство от самок с физиологической беременностью, получавшее дистиллированную воду
– позитивный контроль The offspring from rats with physiological pregnancy receiving distilled water – positive control |
57 | 0.09 ± 0.06 | 0.54 ± 0.04 | 0 |
| Потомство от самок с экспериментальной преэклампсией, получавшее дистиллированную
воду – негативный контроль The offspring from rats with experimental preeclampsia receiving distilled water – negative control |
59 | 0.006 ± 0.05 | –0.06 ± 0.05* | 3.34 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее сукцикард 22 мг/кг The offspring from rats with experimental preeclampsia receiving succicard 22 mg/kg |
56 | 0.15 ± 0.05 | 0.41 ± 0.05# | 1.79 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее салифен 7.5 мг/кг The offspring from rats with experimental preeclampsia receiving salifen 7,5 mg/kg |
55 | 0.09 ± 0.07 | 0.43 ± 0.05# | 0 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее фенибут 25 мг/кг The offspring from rats with experimental preeclampsia receiving phenibut 25 mg/kg |
58 | 0.07 ± 0.05 | 0.47 ± 0.05# | 0 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее пантогам 50 мг The offspring from rats with experimental preeclampsia receiving pantogam 50 mg |
59 | 0.08 ± 0.05 | 0.50 ± 0.04# | 0 | |
| 12 месяцев 12 months |
Потомство от самок с физиологической беременностью, получавшее дистиллированную воду
– позитивный контроль The offspring from rats with physiological pregnancy receiving distilled water – positive control |
54 | 0.14 ± 0.07 | 0.36 ± 0.07 | 0 |
| Потомство от самок с экспериментальной преэклампсией, получавшее дистиллированную
воду – негативный контроль The offspring from rats with experimental preeclampsia receiving distilled water – negative control |
58 | 0.12 ± 0.03 | 0.17 ± 0.06* | 6.89 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее сукцикард 22 мг/кг The offspring from rats with experimental preeclampsia receiving succicard 22 mg/kg |
54 | 0.02 ± 0.07 | 0.42 ± 0.06# | 1.85 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее салифен 7.5 мг/кг The offspring from rats with experimental preeclampsia receiving salifen 7,5 mg/kg |
49 | 0.10 ± 0.07 | 0.53 ± 0.07# | 2.04 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее фенибут 25 мг/кг The offspring from rats with experimental preeclampsia receiving phenibut 25 mg/kg |
54 | 0.11 ± 0.08 | 0.41 ± 0.07# | 1.85 | |
| Потомство от самок с экспериментальной преэклампсией, получавшее пантогам 50 мг The offspring from rats with experimental preeclampsia receiving pantogam 50 mg |
54 | 0.12 ± 0.07 | 0.52 ± 0.05# | 1.85 | |
* p < 0.05 по критерию Манна–Уитни по сравнению c группой позитивного контроля; # p < 0.05 по критерию Крускала–Уоллиса. с пост-тестом Даннета по сравнению с группой негативного контроля. * р < 0.05 as compared with the positive control group, Mann−Whitney U-test; # р < 0.05 as compared with the negative control, Kruskal–Wallis test with Dunn’s multiple comparison (post hoc) test.
В возрасте 3 мес. животные всех групп в фазе “Ознакомления” не отдавали предпочтение какому-либо одному объекту, а в 6 и 12 мес. чуть более часто интересовалось Объектом 2, однако достоверных отличий между группами выявлено не было.
В “Тестовой” фазе у крыс, рожденных самками с осложненной беременностью как на ранних (3 мес.), так и на более поздних (6 и 12 мес.) этапах онтогенеза Кд был достоверно ниже, чем у группы позитивного контроля, что свидетельствует об ухудшении у потомства крыс с экспериментальной преэклампсией кратковременной рабочей памяти. Кроме того, в возрасте 3, 6 и 12 мес. процент животных, не проявлявших исследовательской активности и не подходивших ни к одному объекту, в группе негативного контроля был выше по сравнению с потомством, рожденным здоровыми самками. У животных всех возрастов, получавших производные ГАМК и препарат сравнения пантогам, Кд был достоверно выше относительно потомства группы негативного контроля (табл. 1). Это свидетельствует о том, что рабочая память у животных, которым вводили сукцикард, салифен, фенибут и препарат сравнения пантогам, была лучше, чем у крыс группы негативного контроля как на ранних, так и на поздних этапах индивидуального развития.
При проведении теста УРПИ трехмесячные крысята группы негативного контроля быстрее заходили в темную камеру по сравнению с животными, рожденными от самок без экспериментальной преэклампсии на 7-е, 14-е и 21-е сут после обучения, а процент животных, зашедших в нее на 21-е сут был значительно больше, чем у потомства группы позитивного контроля (рис. 1).
Рис. 1.
Влияние производных ГАМК на формирование и сохранность памятного следа у потомства самок с экспериментальной преэклампсией в тесте Условный рефлекс пассивного избегания в возрасте 3 месяцев (M ± m): * p < 0.05 по критерию Манна–Уитни по сравнению c группой позитивного контроля; # p < 0.05 по критерию Манна–Уитни по сравнению с группой негативного контроля; ^ φ > 2.31 по критерию Фишера по сравнению c группой позитивного контроля; & φ > 2.31 по критерию Фишера по сравнению c группой негативного контроля; n – количество обучившихся животных. Fig. 1. The effect of GABA derivatives on the formation and preservation of a memorial trace in the offspring from rats with experimental preeclampsia in the test One-way step-down inhibitory (“passive”) avoidance at the age of 3 months (M ± m): * р < 0.05 as compared with the positive control group, Mann−Whitney U-test; # р < 0.05 as compared with the negative control, Mann−Whitney U-test; ^ φ > 2.31 as compared with the positive control, Fisher F-test; & φ > 2.31 as compared with the negative control, Fisher F-test; n – the number of trained animals.

Шестимесячные животные группы негативного контроля в большем количестве заходили в темную камеру и имели меньший по сравнению с группой позитивного контроля латентный период захода в нее на 3-и, 7-е, 14-е и 21-е сут воспроизведения навыка (рис. 2). Следует отметить, что в возрасте 6 мес. среди потомства здоровых крыс обучилось всего 4 животных из 36, и обучившиеся не заходили в темную камеру во все дни воспроизведения навыка, в то время как 11 обучившихся (из 38) крыс из группы негативного контроля посетили ее на 3-и сут тестирования сохранности рефлекса. Подобное снижение обучаемости можно объяснить тем, что большее количество крыс группы позитивного контроля помнило о болевом раздражении, нанесенном им в темной камере в возрасте 3 мес., по сравнению с потомством самок с экспериментальной преэклампсией.
Рис. 2.
Влияние производных ГАМК на формирование и сохранность памятного следа у потомства самок с экспериментальной преэклампсией в тесте Условный рефлекс пассивного избегания в возрасте 6 месяцев (M ± m): * p < 0.05 по критерию Манна–Уитни по сравнению c группой позитивного контроля; # p < 0.05 по критерию Манна–Уитни по сравнению с группой негативного контроля; ^ φ > 2.31 по критерию Фишера по сравнению c группой позитивного контроля; & φ > 2.31 по критерию Фишера по сравнению c группой негативного контроля; n – количество обучившихся животных. Fig. 2. The effect of GABA derivatives on the formation and preservation of a memorial trace in the offspring from rats with experimental preeclampsia in the test One-way step-down inhibitory (“passive”) avoidance at the age of 6 months (M ± m): * р < 0.05 as compared with the positive control group, Mann−Whitney U-test; # р < 0.05 as compared with the negative control, Mann−Whitney U-test; ^ φ > 2.31 as compared with the positive control, Fisher F-test; & φ > 2.31 as compared with the negative control, Fisher F-test; n – the number of trained animals.

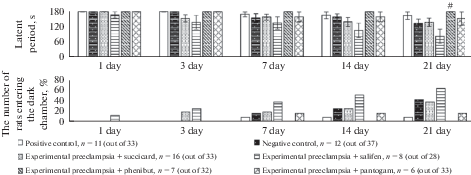
В возрасте 12 мес. количество обучившихся животных в группах позитивного и негативного контролей статистически значимо не различалось, и крысы обеих групп начали заходить в темную камеру на 7-е сут воспроизведения навыка. Несмотря на то, что достоверных отличий между группами не было, латентный период захода в темную камеру у потомства самок с экспериментальной преэклампсией был меньше по сравнению с группой позитивного контроля, а процент зашедших – больше (рис. 3).
Рис. 3.
Влияние производных ГАМК на формирование и сохранность памятного следа у потомства самок с экспериментальной преэклампсией в тесте Условный рефлекс пассивного избегания в возрасте 12 мес. (M ± m): * p < 0.05 по критерию Манна–Уитни по сравнению c группой позитивного контроля; # p < 0.05 по критерию Манна–Уитни по сравнению с группой негативного контроля; ^ φ > 2.31 по критерию Фишера по сравнению c группой позитивного контроля; & φ > 2.31 по критерию Фишера по сравнению c группой негативного. Fig. 3. The effect of GABA derivatives on the formation and preservation of a memorial trace in the offspring from rats with experimental preeclampsia in the test One-way step-down inhibitory (“passive”) avoidance at the age of 12 months (M ± m): * р < 0.05 as compared with the positive control group, Mann−Whitney U-test; # р < 0.05 as compared with the negative control, Mann−Whitney U-test; ^ φ > 2.31 as compared with the positive control, Fisher F-test; & φ > 2.31 as compared with the negative control, Fisher F-test; n – the number of trained animals.
Полученные результаты говорят о нарушении долговременной памяти у потомства крыс с экспериментальной преэклампсией в пубертатном возрасте и в отдаленные периоды развития.
У животных в возрасте 3 мес., которым в адолесцентном периоде (с 40-го по 70-й дни жизни) вводили сукцикард, салифен, фенибут и препарат сравнения пантогам, лучше формировался и сохранялся памятный след. Так, процент животных, зашедших в темную камеру среди потомства, получавшего производные ГАМК и пантогам, было ниже, чем в группе негативного контроля, а латентный период захода в нее – больше (рис. 1).
У шестимесячных крыс латентный период захода в темную камеру и процент зашедших в нее среди животных, которым вводили сукцикард, салифен и фенибут, статистически значимо не отличались от показателей крыс группы негативного контроля, в то время как животные, получавшие пантогам, имели достоверно больший латентный период захода в темную камеру на 7-е и 14-е сут воспроизведения УРПИ по сравнению с потомством самок с экспериментальной преэклампсией, которому вводили дистиллированную воду (рис. 2).
В возрасте 12 мес. показатели потомства, получавшего сукцикард, салифен и пантогам, не имели достоверных отличий от группы крыс, рожденных самками с экспериментальной преэклампсией и получавших дистиллированную воду. Животные, которым вводили фенибут, не заходили в темную камеру во все дни воспроизведения навыка (рис. 3).
Холинергическая система играет значительную роль в формировании когнитивной функции. Ее состояние определяли путем введения М-холиноблокатора скополамина в дозе 1.75 мг/кг за 16 ч перед 1-ым, 3-им, 7-ым, 14-ым и 21-ым днями воспроизведения УРПИ потомству здоровых крыс и самок с экспериментальной преэклампсией, что вызывало у последних больший амнестический эффект в различные периоды постнатального онтогенеза.
В возрасте 3 мес. животные группы негативного контроля заходили в темную камеру через 24 ч после обучения, имели достоверно более низкий по сравнению с группой позитивного контроля латентный период, начиная с 7-го дня тестирования сохранности рефлекса. Кроме того, процент животных от крыс с экспериментальной преэклампсией, посетивших темную камеру, был значительно больше, чем среди потомства самок без экспериментальной преэклампсии (рис. 4).
Рис. 4.
Влияние производных ГАМК на выраженность амнезии, вызванной введением скополамина, у потомства самок с экспериментальной преэклампсией в тесте Условный рефлекс пассивного избегания в возрасте 3 месяцев (M ± m): * p < 0.05 по критерию Манна–Уитни по сравнению c группой позитивного контроля; # p < 0.05 по критерию Манна–Уитни по сравнению с группой негативного контроля; ^ φ > 2.31 по критерию Фишера по сравнению c группой позитивного контроля; & φ > 2.31 по критерию Фишера по сравнению c группой негативного контроля; n – количество обучившихся животных. Fig. 4. The effect of GABA derivatives on the severity of amnesia caused by the administration of scopolamine to the offspring from females with experimental preeclampsia in the test One-way step-down inhibitory (“passive”) avoidance at the age of 3 months (M ± m): * р < 0.05 as compared with the positive control group, Mann−Whitney U-test; # р < 0.05 as compared with the negative control, Mann−Whitney U-test; ^ φ > 2.31 as compared with the positive control, Fisher F-test; & φ > 2.31 as compared with the negative control, Fisher F-test; n – the number of trained animals.

В возрасте 6 и 12 мес. тенденция сохранялась. Шестимесячные крысы из группы негативного контроля посетили темную камеру на 3-и сутки тестирования сохранности УРПИ, тогда как потомство группы позитивного контроля только на 14-е сут. У потомства самок с экспериментальной преэклампсией наблюдались более низкие значения латентного периода, чем в группе позитивного контроля на 3-и, и 7-е сут воспроизведения навыка (рис. 5).
Рис. 5.
Влияние производных ГАМК на выраженность амнезии, вызванной введением скополамина, у потомства самок с экспериментальной преэклампсией в тесте Условный рефлекс пассивного избегания в возрасте 6 месяцев (M ± m): * p < 0.05 по критерию Манна–Уитни по сравнению c группой позитивного контроля; # p < 0.05 по критерию Манна–Уитни по сравнению с группой негативного контроля; ^ φ > 2.31 по критерию Фишера по сравнению c группой позитивного контроля; & – φ > 2.31 по критерию Фишера по сравнению c группой негативного контроля; n – количество обучившихся животных. Fig. 5. The effect of GABA derivatives on the severity of amnesia caused by the administration of scopolamine to the offspring from females with experimental preeclampsia in the test One-way step-down inhibitory (“passive”) avoidance at the age of 6 months (M ± m): * р < 0.05 as compared with the positive control group, Mann−Whitney U-test; # р < 0.05 as compared with the negative control, Mann–Whitney U-test; ^ φ > 2.31 as compared with the positive control, Fisher F-test; & φ > 2.31 as compared with the negative control, Fisher F-test; n – the number of trained animals.

В возрасте 12 мес. потомство здоровых самок не посещало темную камеру на всем протяжении этапа тестирования сохранности рефлекса, а крысы из группы негативного контроля заходили в нее, начиная с 1-го дня (рис. 6).
Рис. 6.
Влияние производных ГАМК на выраженность амнезии, вызванной введением скополамина, у потомства самок с экспериментальной преэклампсией в тесте Условный рефлекс пассивного избегания в возрасте 12 месяцев (M ± m): * p < 0.05 по критерию Манна–Уитни по сравнению c группой позитивного контроля; # p < 0.05 по критерию Манна–Уитни по сравнению с группой негативного контроля; ^ φ > 2.31 по критерию Фишера по сравнению c группой позитивного контроля; & φ > 2.31 по критерию Фишера по сравнению c группой негативного контроля; n – количество обучившихся животных. Fig. 6. The effect of GABA derivatives on the severity of amnesia caused by the administration of scopolamine to the offspring from females with experimental preeclampsia in the test One-way step-down inhibitory (“passive”) avoidance at the age of 12 months (M ± m): * р < 0.05 as compared with the positive control group, Mann−Whitney U-test; # р < 0.05 as compared with the negative control, Mann−Whitney U-test; ^ φ > 2.31 as compared with the positive control, Fisher F-test; & φ > 2.31 as compared with the negative control, Fisher F-test; n – the number of trained animals.

Большая выраженность амнезии у потомства самок с экспериментальной преэклампсией как на ранних этапах, так и в отдаленные периоды развития по сравнению с крысами, рожденными здоровыми самками, в тесте УРПИ с использованием скополамина может быть связана с недостаточностью холинергической системы, вызванной гипоксией в пренатальном периоде.
В возрасте 3, 6 и 12 мес. потомство, получавшее производные ГАМК, имело больший латентный период захода в темную камеру по сравнению с группой негативного контроля (рис. 4, 5, 6). В возрасте 3 мес. статистически значимые отличия были выявлены на 3-и сут воспроизведения навыка у потомства, которому вводили фенибут, на 14-е сут – у животных, получавших сукцикард и фенибут, на 21-е сут – у крыс, которым вводили сукцикард, салифен и фенибут. В возрасте 6 и 12 мес. производные ГАМК и препарат сравнения пантогам сохраняли антиамнестический эффект.
Следует отметить, что при формировании скополаминовой амнезии потомство некоторых групп, получавших производные ГАМК, в возрасте 6 и 12 мес. не посещало темную камеру при воспроизведении УРПИ, в то время как животные, которые тестировались в УРПИ без моделирования амнезии, заходили в нее. Подобные результаты могут быть связаны с высокой эффективностью исследуемых веществ в условиях амнезии. Однако это также может объясняться и малой выборкой обучившихся животных, поскольку моделирование амнезии проходило после этапа обучения, а введение скополамина в дозе 1.75 мг/кг вызывало лишь кратковременный амнестический эффект, они могли помнить о болевом раздражении, нанесенном им в темной камере в возрасте 3 мес. Для уточнения данного факта необходимо провести дополнительные исследования.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По данным литературы, гипоксические поражения ЦНС имеют от 20 до 50% детей, матери которых перенесли преэклампсию и эклампсию различной степени тяжести, что проявляется в виде таких патологий, как детский церебральный паралич, гидроцефалия и микроцефалия, задержка развития интеллектуальных и двигательных навыков [20]. Многие экспериментальные исследования свидетельствуют о негативном влиянии экспериментальной преэклампсии на когнитивные функции потомства. При использовании таких моделей, как замена питьевой воды на 1.8%-ный раствор хлорида натрия с 1-го по 21-й день гестации или введение беременным крысам внутрибрюшинно неселективного блокатора NO-синтаз L-NAME в дозе 25 мг/кг с 14–20-й день гестации, двухмесячное потомство имело нарушение пространственной памяти в приподнятом 8-радиальном лучевом лабиринте [21]. При проведении тестов водный лабиринт Морриса и Y-образный лабиринт у потомства в возрасте 2 мес. от самок с экспериментальной преэклампсией, вызванной L-NAME, также наблюдалось нарушение памяти [22, 23].
Результаты проведенных нами экспериментов свидетельствуют, что потомство самок с экспериментальной преэклампсией, которую моделировали заменой питьевой воды на 1.8%-ный раствор хлорида натрия в течение всего периода беременности, на ранних (40 дней и 3 мес.) и поздних (6 и 12 мес.) этапах постнатального развития имеет когнитивные нарушения, проявляющиеся в снижении кратковременной и долговременной памяти. На это указывают значительно более низкий по сравнению с животными группы позитивного контроля Кд в “Тестовой” фазе Распознавания нового объекта, более короткий латентный период захода в темную камеру и больший процент животных, посетивших ее, в тесте УРПИ. Кроме того, у животных группы негативного контроля в разные периоды онтогенеза наблюдался более выраженный амнезирующий эффект после введения скополамина за 16 ч перед 1-ым, 3-им, 7-ым, 14-ым и 21-ым днями тестирования сохранности УРПИ, что может свидетельствовать о снижении активности холинергической системы, отвечающей за регуляцию когнитивных функций.
Подобные последствия экспериментальной преэклампсии, очевидно, связаны с гипоксически-ишемическим поражением ЦНС потомства. В ранее проведенных исследованиях было показано, что у самок с экспериментальной преэклампсией, смоделированной путем замены питьевой воды на 1.8%-ный раствор хлорида натрия с 1-го по 21-й день гестации, развивается эндотелиальная дисфункция, сопровождающаяся вазоконстрикцией, увеличением агрегации тромбоцитов и гиперкоагуляцией, нарушением маточно-плацентарного кровообращения и гипоксией, а также активацией процесса перекисного окисления липидов с одновременным снижением активности ферментов антиоксидантной системы [12, 15]. Все это может привести к нарушению нейрогенеза и дифференциации структур головного мозга плода, а также гибели нейронов различных нейромедиаторных систем, в том числе холинергической, с последующим отставанием в развитии психических и физических функций у потомства в постнатальном периоде [24]. Было показано, что в сенсомоторной коре головного мозга крыс из-за внутриутробной гипоксии к концу первого месяца жизни и до полутора лет повышена активность растворимой и мембраносвязанной форм ацетилхолинэстеразы, что способствует быстрой деградации ацетилхолина, снижению активности холинергической системы головного мозга и развитию когнитивной дисфункции как на ранних, так и на поздних этапах онтогенеза [10, 25]. Кроме того, при значительном снижении активности холинергической системы происходит задержка клеточной дифференцировки коры, что в постнатальном периоде может служить причиной поведенческого и когнитивного дефицита [26]. Поэтому проблема коррекции связанных с отягощенной беременностью постгипоксических состояний у потомства в различные периоды онтогенеза, является актуальной для современной медицины.
У потомства крыс с экспериментальной преэклампсией, получавшего производные ГАМК с 40-го по 70-й день жизни, в возрасте 3, 6 и 12 мес. отмечались более высокие показатели когнитивных функций по сравнению с группой негативного контроля.
В тесте Распознавание нового объекта животные этих групп во все возрастные периоды проявляли выраженный интерес к новому объекту и имели высокий Кд в “Тестовую” фазу.
При оценке долговременной памяти в тесте УРПИ трехмесячные крысы, получавшие сукцикард, салифен и препарат сравнения пантогам, дольше помнили о болевом раздражении, чем животные контрольной группы, рожденные самками с экспериментальной преэклампсией. В возрасте 6 мес. раннее введение сукцикарда, салифена и фенибута не улучшало формирование и сохранение памятного следа, в отличие от препарата сравнения пантогама. В возрасте 12 мес. животные, получавшие фенибут, дольше помнили о болевом воздействии в темной камере, латентный период захода и количество зашедших в нее среди крыс, которым вводили сукцикард, салифен и препарат сравнения пантогам, достоверно не отличались от показателей группы негативного контроля.
При ведении М-холиноблокатора скополамина сукцикард, салифен, фенибут и пантогам ограничивают развитие амнезии в возрасте 3, 6 и 12 мес. Об этом свидетельствуют меньшее по сравнению с группой негативного контроля количество животных, посетивших темную камеру, больший латентный период захода в нее при воспроизведении УРПИ.
Производные ГАМК обладают ноотропным, нейро- и эндотелиопротекторным, антигипоксическим и антиоксидантным эффектами, что было показано в ранее проведенных исследованиях [11, 12, 15]. Производные ГАМК соединение РГПУ-147 и фенибут предотвращают нарушения микрогемоциркуляции у стрессированных животных [16]. Известно также, что фенибут повышает функциональную устойчивость мозгового кровотока при значительных изменениях системного артериального давления [27], а дилитиевая соль N'N-бис [2,6-пиридинкарбонил]-ГАМК и литиевая соль N-ацетил-ГАМК предотвращают развитие гиперемии и восстанавливают мозговой кровоток после ишемии [28]. В экспериментальном исследовании, проведенном Ордян и соавт. [13], введение салифена в дозе 15 мг/кг в течение 14 дней после гипоксического воздействия двухдневным крысятам корректировало поведенческие нарушения у последних. Еще одним из важнейших механизмов действия препаратов данной группы, в частности, циклического производного ГАМК пирацетама, является активация синтеза ацетилхолина, дефицит которого приводит к недостаточности холинергической системы и может проявляться в виде нарушений памяти на разных этапах онтогенеза [25, 29]. Применение пантогама, который представляет собой видоизмененную молекулу пантотеновой кислоты, включающую остаток ГАМК, способствует синтезу макроэргических фосфатов и активации тканевого дыхания, снижая энергодефицит нейронов при гипоксии, улучшает утилизацию глюкозы, стимулирует процессы синтеза белка в клетках мозга и стабилизирует функции нейрональных мембран при хронической церебральной ишемии [30, 31]. Вероятно, высокие показатели когнитивной функции в разные периоды постнатального онтогенеза у потомства самок с экспериментальной преэклампсией, получавшего исследуемые соединения, можно объяснить политропным действием производных ГАМК.
ЗАКЛЮЧЕНИЕ
Таким образом, у потомства, рожденного самками с экспериментальной преэклампсией, наблюдаются когнитивные нарушения как на ранних, так и на более поздних этапах онтогенеза. Поэтому данная проблема является актуальной не только для акушерской и педиатрической практики, но и для специалистов, работающих с болезнями более зрелого возраста. Исследуемые в этой работе производные ГАМК, очевидно, способны нивелировать нарушения когнитивных функций у потомства, рожденного самками с экспериментальной преэклампсией.
Список литературы
Curtis D., Sood A., Phillips T., Leinster V., Nishiguchi A., Coyle C., Lacharme-Lora L., Beaumont O., Kemp H., Goodall R., Cornes L., Giugliano M., Barone R., Matsusaki M., Akashi M., Tanaka H., Kano M., McGarvey J., Halemani N., Simon K., Keehan R., Ind W., Masters T., Grant S., Athwal S., Collett G., Tannetta D., Sargent I., Scull-Brown E., Liu X., Aquilina K., Cohen N., Lane J., Thoresen M., Hanley J., Randall A., Case C. Secretions from placenta, after hypoxia/reoxygenation, can damage developing neurones of brain under experimental conditions. Exp. Neurol. 261: 386–395. 2014.
Miller S., Huppi P., Mallard C. The consequences of fetal growth restriction on brain structure and neurodevelopmental outcome. J. Physiol. 594(4): 807–823. 2016.
Phillips T., Scott H., Menassa D., Bignell A., Sood A., Morton J., Akagi T., Azuma K., Rogers M., Gilmore C., Inman G., Grant S., Chung Y., Aljunaidy M., Cooke C., Steinkraus B., Pocklington A. Logan A., Collett G., Kemp H., Holmans P., Murphy M., Fulga T., Coney A., Akashi M., Davidge S., Case C. Treating the placenta to prevent adverse effects of gestational hypoxia on fetal brain development. Scient. Rep. 7: 1–16. 2017.
Dang F. Croy B.A., Stroman P.W. Figueiró-Filho E.A. Impacts of preeclampsia on the brain of the offspring. Rev. Bras. Ginecol. Obstet. 38(8): 416–22. 2016.
Whitehouse A.J., Robinson M., Newnham J.P., Pennell C.E. Do hypertensive diseases of pregnancy disrupt neurocognitive development in offspring? Paediatr. Perinat. Epidemiol. 26(2): 101–108. 2012.
Many A., Fattal A., Leitner Y., Kupferminc M.J., Harel S., Jaffa A. Neurodevelopmental and cognitive assessment of children born growth restricted to mothers with and without preeclampsia. Hypertens. Pregnancy. 22(1): 25–29. 2003.
Morsing E., Maršál K. Preeclampsia- an additional risk factor for cognitive impairment at school age after intrauterine growth restriction and very preterm birth. Early Hum. Dev. 90(2): 99–101. 2014.
Tuovinen S., Eriksson J.G., Kajantie E., Räikkönen K. Maternal hypertensive pregnancy disorders and cognitive functioning of the offspring: a systematic review. J. Am. Soc. Hypertens. 8(11): 832–847. 2014.
Tuovinen S., Räikkönen K., Kajantie E., Pesonen A.K., Heinonen K., Osmond C., Barker D.J., Eriksson J.G. Depressive symptoms in adulthood and intrauterine exposure to preeclampsia: the Helsinki Birth Cohort Study. Br. J. Obstet. Gynaecol. 117(10): 1236–1242. 2010.
Nalivaeva N.N., Turnerand A.J., Zhuravin I.A. Role of prenatal hypoxia in brain development, cognitive functions, and neurodegeneration. Front. Neurosci. 12: 825. 2018.
Тюренков И.Н., Перфилова В.Н., Михайлова Л.И., Жакупова Г.А., Лебедева С.А. Сравнительное изучение влияния нейроактивных аминокислот на постнатальное развитие потомства крыс с экспериментальным гестозом. Вестн. Рос. акад. мед. наук. 69(9–10): 123–130. 2014. [Tyurenkov I.N., Perfilova V.N., Mikhailova L.I., Zhakupova G.A., Lebedeva S.A. Comparative study of the effects of new neuroactive amino acid derivatives on the postnatal development of the rat’s offspring with experimental preeclampsia. Vestn. Ross. Akad. Med. Nauk. 69(9–10): 123–130. 2014. (In Russ)].
Тюренков И.Н., Перфилова В.Н., Карамышева В.И., Попова Т.А., Лебедева С.А., Михайлова Л.И., Жакупова Г.А. Гравидопротекторное действие фенибута при экспериментальной преэклампсии. Эксп. клин. фармакол. 77(11): 6–10. 2014. [Tyurenkov I.N., Perfilova V.N., Karamysheva V.I., Popova T.A., Lebedeva S.A., Mikhailova L.I., Zhakupova G.A. Gravidaprotective action of phenibut in experimental pre-eclampsia. Eksp. Klin. Farmakol. 77(11): 6–10. 2014. (In Russ)].
Ордян Н.Э., Акулова В.К., Пивина С.Г., Отеллин В.А., Тюренков И.Н. Нарушения вследствие перинатальной гипоксии поведенческой и гормональной стресс-реакций крыс адолесцентного возраста и их коррекция новым производным ГАМК. Журн. эвол. биохим. физиол. 55(1): 59–64. 2019. [Ordyan N.E., Akulova V.K., Pivina S.G., Otellin V.A., Tyurenkov I.N. Perinatal hypoxia-induced impairments of behavioral and hormonal stress responses in rats and their correction by a novel GABA derivative. Zhurn. Evol. Biokhim. Fiziol. 55(1): 59–64. 2019. (In Russ)].
Represa A., Ben-Ari Y. Trophic actions of GABA on neuronal development. Trends Neurosci. 28(6): 278–283. 2005.
Тюренков И.Н., Перфилова В.Н., Резникова Л.Б., Смирнова Л.А., Рябуха А.Ф., Сучков Е.А., Кузнецов К.А. Производные ГАМК цитрокард и салифен уменьшают тяжесть течения экспериментального гестоза. Бюлл. эксп. биол. мед. 157(1): 49–52. 2014. [Tyurenkov I.N., Perfilova V.N., Reznikova L.B., Smirnova L.A., Ryabukha A.F., Suchkov E.A., Kuznetsov K.A. GABA derivatives citrocard and salifen reduce the intensity of experimental gestosis. Byull. Eks-p. Biol. Med. 2014. 157(1): 49–52. 2014. (In Russ)].
Тюренков И.Н., Лебедева С.А., Перфилова В.Н., Берестовицкая В.М., Васильева О.С. Изменения функционирования системы микроциркуляции под влиянием нового производного ГАМК — соединения РГПУ‑147 при хроническом стрессорном воздействии. Регионарн. кровообращ. и микроциркул. 4: 64–67. 2007. [Tyurenkov I.N., Lebedeva S.A., Perfilova V.N., Berestovitskaya V.M., Vasilyeva O.S. Changes in the functioning of the microcirculation system under the influence of a new derivative of GABA - the compound RGPU-147 under chronic stress effects. Region. Blood Circulat. Microcirculat. 4: 64–67. 2007. (In Russ)].
Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. М. Гриф и К. 2012 [Mironov A.N. Rukovodstvo po provedeniyu doklinicheskih issledovanij lekarstvennyh sredstv [Preclinical drug research guide] Moscow. Grif i K. 2012. (In Russ)].
Лобзин С.В. Соколова М.Г, Налькин С.А. Влияние дисфункции холинергической системы головного мозга на состояние когнитивных функций (обзор литературы). Вестник Сев.-Зап. гос. мед. универ. им. И.И. Мечникова. 9(4): 53–58. 2017. [Lobzin S.V., Sokolova M.G., Nalkin S.A. Influence of brain basal cholinergic system dysfunctionon the condition of cognitive functions (literature review). Vestnik Sev.-Zap. Gos. Med. Univ. im. I.I. Mechnikova. 9(4): 53–58. 2017. (In Russ)].
Тюренков И.Н., Перфилова В.Н., Лащенова Л.И., Жакупова Г.А., Лебедева С.А. Изучение психических функций потомства от крыс с экспериментальной преэклампсией в постнатальном онтогенезе. Журн. высш. нерв. деят. им. И.П. Павлова. 66(4): 499–510. 2016. [Tyurenkov I.N., Perfilova V.N., Lashhenova L.I., Zhakupova G.A., Lebedeva S.A. Study of mental functions offspring of rats with experimental preeclampsia in postnatal ontogenesis. Zh. Vyssh. Nervn. Deyat. im. I.P. Pavlova. 66(4): 499–510. 2016. (In Russ)].
Блинов Д.В., Терентьев А.А. Белковые маркеры гипоксически-ишемического поражения ЦНС в перинатальном периоде. Нейрохимия. 10(2): 22–28. 2013. [Blinov D.V., Terent’ev A.A. Protein markers of hypoxic-ischemic lesions of the CNS in the perinatal period. Neirokhimiya. 10(2): 22–28. 2013. (In Russ)].
Перфилова В.Н., Жакупова Г.А., Лащенова Л.И., Лебедева С.А., Тюренков И.Н. Изучение пространственной памяти у потомства крыс с различными моделями экспериментальной преэклампсии. Бюлл. эксп. биол. мед. 161(5): 581–584. 2016. [Perfilova V.N., Zhakupova G.A., Lashchenova L.I., Tyurenkov I.N., Lebedeva S.A. Spatial memory in the progeny of rats subjected to different types of experimental preeclampsia. Byull. Eksp. Biol. Med. 161(5): 581–584. 2016. (In Russ)].
Liu X., Zhao W., Liu H., Kang Y., Ye C., Gu W., Hu R., Li X. Developmental and Functional Brain Impairment in Offspring from Preeclampsia-Like Rats. Mol. Neurobiol. 53(2):1009–1019. 2016.
Cauli O., Herraiz S., Pellicer B., Pellicer A., Felipo V. Treatment with sildenafil prevents impairment of learning in rats born to pre-eclamptic mothers. Neuroscience. 171(2): 506–12. 2010.
Kay V.R., Ratsep M.T., Figueiro-Filho E.A., Croy B.A. Preeclampsia may influence off-spring neuroanatomy and cognitive function: a role for placental growth factor. Biol. Reprod. 0(0): 1–13. 2019.
Кочкина Е.Г., Плеснева С.А., Журавин И.А., Тернер А.Я., Наливаева Н.Н. Влияние гипоксии на активность холинэстераз в сенсомоторной коре у крыс. Журн. эвол. биохим. физиол. 51(2): 107–116. 2015. [Kochkina E.G., Plesneva S.A., Zhuravin I.A., Nalivaeva N.N., Turner A.J. Effect of hypoxia on cholinesterase activity in rat sensorimotor cortex. Zhurn. Evol. Biokh. Fiziol. 51(2): 107–116. 2015. (In Russ)].
Beer A., Slotkin T.A., Seidler F.J., Aldridge J.E., Yanai J. Nicotine therapy in adulthood reverses the synaptic and behavioral deficits elicited by prenatal exposure to phenobarbital. Neuropsychopharmacology. 30(1): 156–65. 2005.
Attwell D., Iadecola C. The neural basis of functional brain imaging signals. Trends in neurosciences. Trends Neurosci. 25 (12): 621–625. 2002.
Перфилова В.Н., Бородкина Л.Е. Участие гамма-аминомаслянокислотно-ергической системы в регуляции мозгового кровообращения. Вестн. Рос. военно-мед. акад. 1(45): 203–211. 2014. [Perfilova V.N., Borodkina L.E. Participation of gamma-amino-butyric-ergic system in the regulation of cerebral blood flow. Vestnik Ross. Voen. Med. Acad. 1(45): 203–211. 2014. (In Russ)].
Востриков В.В. Место пирацетама в современной практической медицине. Обзоры по клин. фармакол. и лекарств. терапии. 15(1): 14–25. 2017. [Vostrikov V.V. Place of piracetam in the modern practice of medicine. Obzori Klin. Farmak. Lekarstv. Terap. 15(1): 14–25. 2017. (In Russ)].
Бурчинский С.Г. ГАМК-ергические средства в фармакотерапии хронической церебральной ишемии. Междунар. невролог. журн. 1(71): 101–105. 2015. [Burchynskyi S.H. GABA-ergic agents in the pharmacotherapy of chronic cerebral ischemia. Internat. Neurolog. J. 1(71): 101–105. 2015. (In Russ)].
Воронина Г.А. Пантогам и пантогам актив. Клиническое применение и фундаментальные исследования. М. Триада-Фарм. 2009. [Voronina G.A. Pantogam i pantogam aktiv. Klinicheskoe primenenie i fundamental’nye issledovaniya [Pantogam and pantogam active. Clinical application and fundamental research]. Moscow. Triada-Farm. 2009. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова