Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 6, стр. 756-764
Особенности ответов защитных систем мозга взрослых крыс на стрессоры и липополисахарид
Н. П. Комышева 1, Г. Т. Шишкина 1, *, Т. С. Калинина 1, Н. Н. Дыгало 1
1 Институт цитологии и генетики СО РАН
Новосибирск, Россия
* E-mail: gtshi@bionet.nsc.ru
Поступила в редакцию 29.01.2020
После доработки 10.03.2020
Принята к публикации 03.04.2020
Аннотация
Восприимчивость или устойчивость к развитию депрессии определяется действием провоцирующих ее стимулов, включающих стрессоры и воспалительные процессы, а также активностью защитных систем организма, например, нейротрофинов и антиапоптозных белков. Для выяснения влияния стрессорных и провоспалительного воздействий, индуцирующих депрессивно-подобное состояние, на эти защитные механизмы, исследовали уровни мРНК мозгового нейротрофического фактора (BDNF) и антиапоптозного белка Bcl-xL в отделах мозга взрослых самцов крыс после 14-дневных стрессовых (принудительное плавание или ограничение подвижности) или провоспалительного (введение липополисахарида, LPS) воздействий. Оба стрессора достоверно снижали экспрессию BDNF в среднем мозге; снижение экспрессии нейротрофина в коре было достоверным после плавания, а после ограничения подвижности – на уровне тенденции. После LPS уровень мРНК BDNF достоверно снижался в гиппокампе, но не в среднем мозге – области эффекта стрессоров. Оба стрессора повышали уровень мРНК Bcl-xL в стволовой части мозга, но снижали его в среднем мозге и не изменяли в других отделах. LPS не влиял на экспрессию Bcl-xL в большинстве отделов, но снижал ее в стволе мозга, в котором уровень этого транскрипта негативно коррелировал с индексом надпочечников. В целом стрессорные и провоспалительное воздействия индуцировали уникальные для каждого из них и даже противоположные по направлению (в стволе мозга) изменения экспрессии Bcl-xL. Про-депрессивное действие и LPS, и стрессоров ассоциировалось со снижением экспрессии BDNF, которое локализовалось в специфичных для каждого из этих типов воздействий отделах мозга: для LPS в гиппокампе, а стрессоров – в среднем мозге и префронтальной коре. Выявленные особенности ответов BDNF и Bcl-xL указывают на существенные различия путей индукции психоэмоциональной патологии стрессом и активацией воспаления.
Развитие депрессии связано с вовлечением в этиологию заболевания многофакторных процессов, что создает сложности в выявлении конкретных мишеней для ее эффективной терапии. Среди индукторов депрессии наиболее часто рассматривают стрессовые события [1], а в последнее время в этой связи также интенсивно исследуется роль провоспалительных факторов [2–6]. Несмотря на очевидные различия природы этих воздействий, они имеют некоторые общие пути влияния на организм. Стрессоры способны провоцировать нейровоспаление [7], а провоспалительные факторы, в свою очередь, могут активировать центральную для ответа на стрессоры гипоталамо-гипофизарно-адренокортикальную систему [8–10]. Восприимчивость или устойчивость к развитию депрессии определяется не только действием патогенных стимулов, но и активностью защитных систем организма, что, очевидно, обусловливает значительную индивидуальную вариабельность поведенческих и воспалительных последствий стрессовых воздействий, а также наличие чувствительных и устойчивых в этом плане субпопуляций [11].
Возникновение психиатрических расстройств, таких как депрессия, связывают, в том числе, и с уменьшением количества нейрональных клеток в результате ослабления нейрогенеза, прежде всего, в гиппокампе, либо прямой их гибели в разных отделах мозга [12, 13]. Важную роль в обеспечении жизнеспособности клеток играют нейротрофические факторы [14–16] и антиапоптозные белки [17], которые, как было показано, также могут вовлекаться в формирование устойчивости к провоцирующему симптомы психопатологии действию непродолжительного стресса [18]. Сравнение ответов этих защитных систем на разные типы воздействий, индуцирующих депрессию, может быть полезным как для выявления общих и специфических механизмов патофизиологии заболевания, так и понимания путей адаптивной реакции. Целью работы явилось исследование экспрессии мозгового нейротрофического фактора (BDNF) и антиапоптозного белка Bcl-xL в отделах мозга взрослых самцов крыс после хронических стрессовых и провоспалительного воздействий, способных провоцировать у животных депрессивно-подобное состояние. Среди антиапоптозных белков мы выбрали Bcl-xL, который помимо канонической антиапоптозной функции вовлекается в ряд важных противодействующих нейродегенеративным стимулам процессов, включающих регуляцию биоэнергетической функции митохондрий, формирование синапсов, рециркуляцию синаптических пузырьков и рост нейритов [19].
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили на взрослых самцах крыс линии Вистар, содержавшихся в стандартных условиях вивария ИЦиГ СО РАН при температуре 22–24°C, естественном освещении и свободном доступе к воде и корму в соответствии с принципами Базельской декларации, Международными стандартами по работе с лабораторными животными и рекомендациями комиссии по биоэтике ФГБНУ “Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук”. Было проведено 2 отдельных эксперимента в сходных световых и температурных условиях. Все исследования проводили с 10:00 до 14:00.
В первом эксперименте, в котором были использованы 3 группы по 10 крыс в каждой, животных подвергали двум видам стрессового воздействия. В одной группе это было помещение животных в условия принудительного плавания (в стеклянные цилиндры высотой 46 см и диаметром 20 см, наполненных водой 20°C до 30 см) 1 раз в день на 15 мин в течение 14 последовательных дней. Животных другой стрессовой группы в течение такого же двухнедельного периода ежедневно подвергали одночасовому ограничению подвижности в тесных сетчатых цилиндрах. Контролем служили животные, которых не подвергали стрессовым воздействиям, но так же, как и стрессируемых животных, ежедневно брали в руки.
Для моделирования нейровоспаления в экспериментах на грызунах широко используют липополисахарид (LPS) – компонент клеточной мембраны грамотрицательных бактерий. В течение нескольких часов после однократного введения эндотоксина у взрослых крыс наблюдается достоверное увеличение уровней мРНК провоспалительных цитокинов в гиппокампе и развитие симптомов депрессивно-подобного состояния [20]. Поскольку психиатрические заболевания, как полагают, являются следствием хронических провоспалительных процессов, в работе для длительной индукции нейровоспаления LPS из Escherichia coli, серотип 055:B5 (Sigma-Aldrich Corp., St Louis, США), согласно опубликованному в литературе протоколу [21], вводили крысам в дозе 0.5 мг/кг 1 раз в 2 дня (7 введений) в течение двух недель. Контрольные животные в этом эксперименте получали соответствующие инъекции физиологического раствора. В каждой из групп было по 8 животных.
У животных после воздействий было оценено потребление сахарозы – тест на ангедонию. Для этого животным был предоставлен выбор между обычной питьевой водой и 1%-ным раствором сахарозы. Потребление сахарозы оценивалось в процентах относительно общего потребления жидкости за сутки.
После окончания стрессовых и провоспалительного воздействий, у животных были определены относительные массы надпочечников (мг/100 г веса тела), а также выделены ствол, средний мозг, гиппокамп и префронтальная кора. Средний мозг включал блок ткани от ростральной границы верхнего колликулюса до ростральной границы моста, ствол мозга – мост и ростральную часть продолговатого мозга до примерно –10.5 мм относительно брегмы. Префронтальная кора выделялась в границах координат от +3.20 до +2.70 мм. В выделенных образцах 5–6 животных каждой группы, выбранных случайным образом, определяли уровни мРНК (ПЦР в реальном времени в технологии TagMan с использованием наборов праймеров/зондов Applied Biosystems, США) мозгового нейротрофического фактора (BDNF; Rn02531967_s1) и антиапоптозного белка Bcl-xL (Rn00437783_m1) на амплификаторе ABI VIIA™ 7 (“Applied Biosystems”, США). Референсным геном служил бета-актин (Rn00667869_m1). Суммарную РНК выделяли одноступенчатым гуанидин-изотиоционатным методом. Уровни транскриптов рассчитывали по методу ΔΔСt [22].
Полученные данные обрабатывали статистически с помощью однофакторного (фактор–стресс) дисперсионного анализа или t-критерия Стьюдента (после введения LPS), а также, для оценки возможной взаимосвязи между защитными и адренокортикальными ответами, коэффициента корреляции Пирсона.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Примененные нами воздействия являются для животных стрессовыми, на что указывает повышение относительной массы надпочечников (после LPS – на уровне тенденции), а также индуцирующими у животных депрессивно-подобное состояние, подтверждаемое развитием у животных ангедонии (уменьшением по сравнению с соответствующим контролем, принятым за 100%, процента потребления сахарозы) (табл. 1). Фактическое потребление сахарозы контрольными животными: в стрессовом эксперименте – 69.2 ± 11.0%; с введением эндотоксина – 57.1 ± 11.7%.
Таблица 1.
Изменение массы надпочечников и потребления сахарозы после принудительного плавания, ограничения подвижности или введения липополисахарида (стрелками показано направление изменений, выраженное в процентах по отношению к значениям у соответствующего контроля) Table 1. Change in adrenal gland weight and sucrose intake after forced swim, restraint, or lipopolysaccharide (LPS) (the arrows indicate the direction of change, expressed as a percentage in relation to the values of the corresponding control)
| Параметры Parameters |
Принудительное плавание Forced swim | Ограничение подвижности Restraint | Липополисахарид LPS |
|---|---|---|---|
| Масса надпочечников, мг/100 г массы тела Adrenals, mg/100 g BW |
$ \uparrow $ 33%, p < 0.01 | $ \uparrow $ 25%, p < 0.05 | $ \uparrow $ 11%, p = 0.07 |
| Потребление сахарозы Sucrose intake |
↓ 36%, p < 0.05 | ↓ 43%, p < 0.05 | ↓ 45%, p < 0.05 |
При очевидном сходстве этих изменений после разных по природе воздействий (стрессоры, эндотоксин) ответы исследованных защитных систем в отделах мозга демонстрировали как похожие черты, так и специфические особенности (рис. 1A, B). Несмотря на более чем 25%-ное снижение уровня мРНК BDNF (рис. 1A) в стволе после обоих стрессовых воздействий, а также введения LPS, изменения в этом отделе не достигали статистической значимости. После стрессовых воздействий экспрессия мРНК BDNF достоверно (p < 0.05) снижалась в среднем мозге и не отличалась от контроля в гиппокампе. После LPS, напротив, экспрессия нейротрофина не была изменена в среднем мозге, но значительно (p < 0.05) снижена в гиппокампе. В префронтальной коре после всех воздействий наблюдалось снижение экспрессии мРНК BDNF, достоверное (p < 0.05) после стресса принудительного плавания и на уровне тенденции после стресса ограничения подвижности (p = 0.07) и введения LPS (p = 0.08).
Рис. 1.
Уровни мРНК BDNF (А) и Bcl-xL (В) в стволе (STEM), среднем мозге (MID), гиппокампе (HIPP) и коре (CORT) после принудительного плавания (Forced swim), ограничения подвижности (Restraint) или введения липополисахарида (LPS). Данные представлены в процентах к соответствующему контрольному значению, принятому за 100% и показанному на рисунке линией. Звездочками отмечены достоверные различия с соответствующим контролем. Fig. 1. BDNF (A) and Bcl-xL (B) mRNA levels in the brainstem (STEM), midbrain (MID), hippocampus (HIPP) and cortex (CORT) after forced swimming (Forced swim), mobility restriction (Restraint) or lipopolysaccharide (LPS). The data are presented as a percentage of the corresponding control value, taken as 100% and shown in the figure by a line. Asterisks indicate significant differences with appropriate controls.
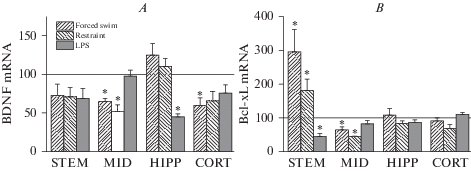
Уровень мРНК антиапоптозного белка Bcl-xL (рис. 1В) после обоих видов хронических стрессовых воздействий был достоверно (p < 0.05) увеличен в стволе мозга, снижен в среднем мозге и не изменен в гиппокампе и фронтальной коре. После воздействия LPS в течение двух недель уровень мРНК Bcl-xL был достоверно (p < 0.05) уменьшен в стволе мозга и не изменен в среднем мозге, гиппокампе и префронтальной коре.
С целью оценки возможного вклада активации адренокортикальной функции в изменение экспрессии BDNF и Bcl-xL в отделах мозга были проанализированы корреляции между значениями экспрессии этих параметров и относительной массой надпочечников после примененных воздействий. Единственная достоверная (отрицательная) корреляция была обнаружена между индексом надпочечников и экспрессией Bcl-xL в стволе мозга в эксперименте с двухнедельным введением LPS: r = –0.66, p < 0.05.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Хронические стрессовые воздействия, такие как принудительное плавание [23, 24] и ограничение подвижности животных [25, 26], а также периферическое введение LPS [21], широко используются для индукции депрессивно-подобного поведения в исследованиях на грызунах. В нашей работе после двухнедельных стрессовых воздействий в соответствии с опубликованными результатами процитированных выше исследований, в которых применяли подобные воздействия в течение 1–3 нед., обнаружено достоверное увеличение массы надпочечников, а также уменьшение потребления сахарозы, являющееся общепринятым показателем развития у животных сопоставимого с клиническим симптомом депрессии ангедонии. Введение LPS в течение двух недель также уменьшало потребление сахарозы и увеличивало массу надпочечников, отмечаемое и другими исследователями [8, 9], что подтверждает активацию эндотоксином адренокортикальной функции, включающей увеличение продукции глюкокортикоидов [27].
Сравнение ответов исследованных защитных систем на стрессовые и провоспалительное воздействия показало после обоих типов воздействий снижение экспрессии BDNF в ряде отделов мозга, эффект, который согласно нейротрофической гипотезе депрессии [12, 28], рассматривается в качестве одной из причин наблюдаемого у животных депрессивно-подобного состояния. Вместе с тем, ответ экспрессии BDNF в отдельных областях зависел от примененного воздействия. Если в коре наблюдалось единообразие ответа, то в среднем мозге уровень BDNF был снижен после стрессовых воздействий и не изменен после LPS, а в гиппокампе, напротив, обнаружено отсутствие отличий от контроля после стрессовых воздействий, но выраженное снижение после LPS. Снижение экспрессии BDNF в коре, достоверное после стресса принудительного плавания и на уровне тенденции после более мягкого стресса ограничения подвижности животных, а также введения LPS, сходное с наблюдениями и других авторов, может указывать на особое значение этого эффекта как фактора риска депрессии и в условиях стресса и воспаления. Хотя подобное заключение, безусловно, требует дополнительных специальных исследований, определенным подтверждением такой возможности может служить достоверная отрицательная корреляция, выявленная между уровнем BDNF во фронтальной коре и таким общепринятым оценочным показателем депрессивно-подобного поведения в тесте принудительного плавания, как продолжительность замирания [29]. Однако достоверное, в отличие от коры, снижение экспрессии BDNF в гиппокампе после LPS может указывать на больший вклад этого изменения в индукцию депрессивно-подобного поведения в условиях воспаления. Например, увеличение продолжительности пассивного поведения в тесте принудительного плавания после центрального введения LPS крысам ассоциировалось со снижением экспрессии BDNF именно в гиппокампе [30].
В рамках нейротрофической гипотезы основные усилия по выяснению роли вызываемых стрессом изменений длительное время были нацелены на BDNF гиппокампа. Однако поскольку направленное снижение экспрессии нейротрофина в гиппокампе не всегда индуцировало симптомы депрессии [31], был сделан вывод, что само по себе снижение экспрессии BDNF в этой структуре не является определяющей причиной психопатологии. Непродолжительный стресс, в том числе и стресс принудительного плавания [18], вызывает, как правило, быстрое снижение экспрессии BDNF в гиппокампе, эффект, который, однако, не наблюдался после двухнедельного воздействия. Отсутствие изменений в экспрессии BDNF в гиппокампе, отмечаемое в работах и других авторов [32], а также наблюдаемое в некоторых случаях даже увеличение экспрессии нейротрофина в этой структуре [33–35] после хронических стрессовых воздействий, индуцирующих депрессивно-подобное состояние, очевидно, являются элементами защитного ответа против негативных центральных эффектов стресса. Еще одним проявлением механизма защитного ответа на стресс может быть обнаруженное в нашей работе выраженное увеличение экспрессии антиапоптозного белка Bcl-xL в стволе мозга. Хронический стресс, индуцирующий депрессию, может повышать предрасположенность некоторых нейронов к гибели путем апоптоза [36]. Поэтому активация антиапоптозной функции была одновременно предложена двумя независимыми группами исследователей в качестве потенциальной терапевтической стратегии уменьшения апоптотической активности и ослабления симптомов депрессии [37, 38].
Важный вклад в психоэмоциональные эффекты стресса и LPS, помимо сходного после обоих типов воздействий снижения экспрессии BDNF в коре, может вносить уменьшение экспрессии антиапоптозного белка Bcl-xL в областях мозга, где локализованы клеточные тела моноаминергических нейронов. Так, в среднем мозге вместе с Bcl-xL, осуществляющим ряд внутриклеточных аспектов действия BDNF, обнаружено также снижение экспрессии и самого нейротрофина. После введения LPS экспрессия Bcl-xL была значительно снижена в стволе мозга. Одним из последствий этих изменений может быть ослабление локализованной в среднем мозге и стволе активности серотонинергической системы – наиболее тесно связываемой с про- и антидепрессивными эффектами [13]. Например, на ослабление серотонинергической активности после введения LPS в той же дозе и том же режиме, что и в данной работе, указывает уменьшение содержания серотонина в префронтальной коре и гиппокампе, иннервируемых нейронами среднего мозга и ствола [20].
В основе сходных и специфических ответов BDNF и Bcl-xL на стресс и LPS в отделах мозга могут лежать сложные взаимодействия между провоспалительными и адренокортикальными ответами. Оба типа воздействий повышают экспрессию провоспалительных цитокинов в отделах мозга [7, 21], и, как уже обсуждалось, способны активировать гипоталамо-гипофизарно-адренокортикальную систему, на что в нашей работе указывают повышенные массы надпочечников. Вместе с тем, какой механизм или оба ответственны за выявленные изменения экспрессии нейротрофина и антиапоптозного белка в той или иной структуре, остается неясным. Достоверная отрицательная корреляция между массой надпочечников и экспрессией Bcl-xL в стволе мозга в эксперименте с двухнедельным введением LPS указывает на возможный вклад в механизм снижения экспрессии антиапоптозного белка в этой структуре активации адренокортикального комплекса в условиях стимуляции иммунной системы.
В целом экспрессии мРНК BDNF и Bcl-xL в отделах мозга в ответ на стрессоры и LPS демонстрировали как однотипные, так и специфические изменения. Эти ответы могут отражать особенности путей индукции психоэмоциональной патологии стрессом и активацией воспаления, включающих изменения нейрональной пластичности.
Список литературы
Stepanichev M., Dygalo N.N., Grigoryan G., Shishkina G.T., Gulyaeva N. Rodent models of depression: neurotrophic and neuroinflammatory biomarkers. Biomed. Res. Int. 2014: 932757. 2014.
Dantzer R. Cytokine, sickness behavior, and depression. Immunol. Allergy Clin. North Am. 29: 247–264. 2009.
Adzic M., Brkic Z., Mitic M., Francija E., Jovicic M.J., Radulovic J., Maric N.P. Therapeutic Strategies for Treatment of Inflammation-related Depression. Curr. Neuropharmacol. 16: 176–209. 2018.
Leonard B.E. Inflammation and depression: a causal or coincidental link to the pathophysiology? Acta Neuropsychiatr. 30: 1–16. 2018.
Liu C.H., Zhang G.Z., Li B., Li M., Woelfer M., Walter M., Wang L. Role of inflammation in depression relapse. J. Neuroinflam. 16: 90. 2019.
Lasselin J. Is inflammation-associated depression atypical depression? Brain Behav. Immun. 2020. [Epub ahead of print].
Slavich G.M., Way B.M., Eisenberger N.I., Taylor S.E. Neural sensitivity to social rejection is associated with inflammatory responses to social stress. Proc. Natl. Acad. Sci. USA. 107: 14817–14822. 2010.
Takemura T., Makino S., Takao T., Asaba K., Suemaru S., Hashimoto K. Hypothalamic-pituitary-adrenocortical responses to single vs. repeated endotoxin lipopolysaccharide administration in the rat. Brain Res. 767: 181–191. 1997.
Grinevich V., Ma X.M., Herman J.P., Jezova D., Akmayev I., Aguilera G. Effect of repeated lipopolysaccharide administration on tissue cytokine expression and hypothalamic-pituitary-adrenal axis activity in rats. J. Neuroendocrinol. 13: 711–723. 2001.
Elgarf A.S., Aboul-Fotouh S., Abd-Alkhalek H.A., El Tabbal M., Hassan A.N., Kassim S.K., Hammouda G.A., Farrag K.A., Abdel-tawab A.M. Lipopolysaccharide repeated challenge followed by chronic mild stress protocol introduces a combined model of depression in rats: reversibility by imipramine and pentoxifylline. Pharmacol. Biochem. Behav. 126: 152–162. 2014.
Finnell J.E., Wood S.K. Putative Inflammatory Sensitive Mechanisms Underlying Risk or Resilience to Social Stress. Front. Behav. Neurosci. 12: 240. 2018.
Duman R.S., Monteggia L.M. A neurotrophic model for stress-related mood disorders. Biol. Psychiatry. 59: 1116–1127. 2006.
Krishnan V., Nestler E.J. The molecular neurobiology of depression. Nature. 455: 894–902. 2008.
Sairanen M., Lucas G., Ernfors P., Castrén M., Castrén E. Brain-derived neurotrophic factor and antidepressant drugs have different but coordinated effects on neuronal turnover, proliferation, and survival in the adult dentate gyrus. J. Neurosci. 25: 1089–1094. 2005.
Gulyaeva N.V. Molecular Mechanisms of Neuroplasticity: An Expanding Universe. Biochemistry (Mosc). 82: 237–242. 2017.
Wurzelmann M., Romeika J., Sun D. Therapeutic potential of brain-derived neurotrophic factor (BDNF) and a small molecular mimics of BDNF for traumatic brain injury. Neural. Regen. Res. 12: 7–12. 2017.
Youle R.J., Strasser A. The BCL-2 protein family: opposing activities that mediate cell death. Nat. Rev. Mol. Cell Biol. 9: 47–59. 2008.
Shishkina G.T., Kalinina T.S., Berezova I.V., Bulygina V.V., Dygalo N.N. Resistance to the development of stress-induced behavioral despair in the forced swim test associated with elevated hippocampal Bcl-xl expression. Behav. Brain Res. 213: 218–224. 2010.
Jonas E.A., Porter G.A., Alavian K.N. Bcl-xL in neuroprotection and plasticity. Front. Physiol. 5: 355. 2014.
Fulenwider H.D., Smith B.M., Nichenko A.S., Carpenter J.M., Nennig S.E., Cheng K., Rice K.C., Schank J.R. Cellular and behavioral effects of lipopolysaccharide treatment are dependent upon neurokinin-1 receptor activation. J. Neuroinflam. 15: 60. 2018.
Dang R., Zhou X., Tang M., Xu P., Gong X., Liu Y., Jiao H., Jiang P. Fish oil supplementation attenuates neuroinflammation and alleviates depressive-like behavior in rats submitted to repeated lipopolysaccharide. Eur. J. Nutr. 57: 893–906. 2018.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)). Method. Methods. 25(4): 402–408. 2001.
Dal-Zotto S., Martí O., Armario A. Influence of single or repeated experience of rats with forced swimming on behavioural and physiological responses to the stressor. Behav. Brain Res. 114: 175–181. 2000.
Guan X.T., Lin W.J., Tang M.M. Comparison of stress-induced and LPS-induced depressive-like behaviors and the alterations of central proinflammatory cytokines mRNA in rats. Psych. J. 4: 113–122. 2015.
Chiba S., Numakawa T., Ninomiya M., Richards M.C., Wakabayashi C., Kunugi H. Chronic restraint stress causes anxiety- and depression-like behaviors, downregulates glucocorticoid receptor expression, and attenuates glutamate release induced by brain-derived neurotrophic factor in the prefrontal cortex. Prog. Neuropsychopharmacol. Psychiatry. 39: 112–119. 2012.
Ampuero E., Luarte A., Santibañez M., Varas-Godoy M., Toledo J., Diaz-Veliz G., Cavada G., Rubio F.J., Wyneken U. Two Chronic Stress Models Based on Movement Restriction in Rats Respond Selectively to Antidepressant Drugs: Aldolase C As a Potential Biomarker. Int. J. Neuropsychopharmacol. 18: pyv038. 2015.
Martinez C.C., Astort F., Di Gruccio J.M., Repetto E.M., Mercau M., Giordanino E., Sanchez R., Pignataro O., Arias P., Cymeryng C.B. Lipopolysaccharide stimulates adrenal steroidogenesis in rodent cells by a NFκB-dependent mechanism involving COX-2 activation. Mol. Cell Endocrinol. 337: 1–6. 2011.
Duman R.S., Deyama S., Fogaça M.V. Role of BDNF in the pathophysiology and treatment of depression: Activity-dependent effects distinguish rapid-acting antidepressants. Eur. J. Neurosci. 2019. [Epub ahead of print].
Borsoi M., Antonio C.B., Viana A.F., Nardin P., Gonçalves C.A., Rates S.M. Immobility behavior during the forced swim test correlates with BNDF levels in the frontal cortex, but not with cognitive impairments. Physiol. Behav. 140: 79–88. 2015.
Hritcu L., Gorgan L.D. Intranigral lipopolysaccharide induced anxiety and depression by altered BDNF mRNA expression in rat hippocampus. Prog. Neuropsychopharmacol. Biol. Psychiatry. 51: 126–132. 2014.
Adachi M., Barrot M., Autry A.E., Theobald D., Monteggia L.M. Selective loss of brain-derived neurotrophic factor in the dentate gyrus attenuates antidepressant efficacy. Biol. Psychiatry. 63: 642–649. 2008.
Allaman I., Papp M., Kraftsik R., Fiumelli H., Magistretti P.J., Martin J.L. Expression of brain-derived neurotrophic factor is not modulated by chronic mild stress in the rat hippocampus and amygdala. Pharmacol. Rep. 60: 1001–1007. 2008.
Naert G., Ixart G., Maurice T., Tapia-Arancibia L., Givalois L. Brain-derived neurotrophic factor and hypothalamic-pituitary-adrenal axis adaptation processes in a depressive-like state induced by chronic restraint stress. Mol. Cell. Neurosci. 46: 55–66. 2011.
Charoenphandhu N., Nuntapornsak A., Wongdee K., Krishnamra N., Charoenphandhu J. Upregulated mRNA levels of SERT, NET, MAOB, and BDNF in various brain regions of ovariectomized rats exposed to chronic aversive stimuli. Mol. Cell. Biochem. 375: 49–58. 2013.
Scotton E., Colombo R., Reis J.C., Possebon G.M.P., Hizo G.H., Valiati F.E., Géa L.P., Bristot G., Salvador M., Silva T.M., Guerra A.E., Lopes T.F., Rosa A.R., Kunz M. BDNF prevents central oxidative damage in a chronic unpredictable mild stress model: The possible role of PRDX-1 in anhedonic behavior. Behav. Brain Res. 378: 112245. 2020.
McKernan D.P., Dinan T.G., Cryan J.F. “Killing the Blues”: a role for cellular suicide (apoptosis) in depression and the antidepressant response? Prog. Neurobiol. 88: 246–263. 2009.
Dygalo N.N., Kalinina T.S., Bulygina V.V., Shishkina G.T. Increased expression of the anti-apoptotic protein Bcl-xL in the brain is associated with resilience to stress-induced depression-like behavior. Cell. Mol. Neurobiol. 32: 767–776. 2012.
Malkesman O., Austin D.R., Tragon T., Henter I.D., Reed J.C., Pellecchia M., Chen G., Manji H.K. Targeting the BH3-interacting domain death agonist to develop mechanistically unique antidepressants. Mol. Psychiatry. 17: 770–780. 2012.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


