Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 7, стр. 898-915
Изучение состава полиненасыщенных жирных кислот и их индивидуальных соотношений у лиц зрелого возраста климатогеографически разных районов севера
Ф. А. Бичкаева 1, *, Н. И. Волкова 1, Д. С. Галстян 1, А. А. Бичкаев 1, А. А. Лобанов 2
1 Федеральный исследовательский центр комплексного изучения Арктики
им. акад. Н.П. Лавёрова РАН
Архангельск, Россия
2 Национальный медицинский исследовательский центр реабилитации и курортологии
Москва, Россия
* E-mail: fatima@fciarctic.ru
Поступила в редакцию 13.03.2020
После доработки 18.03.2020
Принята к публикации 19.03.2020
Аннотация
Цель исследования – изучение методом газожидкостной хроматографии состава полиненасыщенных жирных кислот (ПНЖК) в сыворотке крови и оценка информативности их индивидуальных соотношений на примере клинически здоровых лиц зрелого возраста (22–35, 36–45 и 46–60 лет) приарктической (661 человек) и арктической (895 человек) территории Севера России. Результаты исследования показали, что несмотря на повышение в обоих регионах с 22–35 до 46–60 лет уровня ω-6 – линолевой (С18:2ω6с), арахидоновой (С20:4ω6), эйкозатриеновой (С20:3ω6) и ω-3 линоленовой (С18:3ω3), эйкозапентаеновой (С20:5ω3), докозагексаеновой (С22:6ω3) кислот в крови, установлен дефицит докозапентаеновой (С22:5ω3) и докозагексаеновой (С22:6ω3), особенно в приарктическом и избыток арахидоновой кислоты в арктическом регионе. Вместе с тем, во всех возрастных группах приарктического региона отмечен рост величины соотношения С20:4ω6/С20:5ω3 и снижение С20:5ω3/С22:5ω3, (С20:3ω6 + С20:5ω3)/С22:6ω3, относительно аналогичных возрастов арктического региона, указывающих на интенсификацию синтеза субстрата для образования эйкозаноидов провоспалительного действия. При этом в арктическом регионе статистически значимое повышение как ω-3, так и ω-6 может являться компенсаторно-приспособительной реакцией в сохранении липидного компонента клеточных мембран, направленной на снижение риска их деструкции, но повышение величины соотношения арахидоновая/эйкозатриеновая является одним из скрытых критериев риска синтеза провоспалительных эйкозаноидов. Полученные результаты демонстрируют возрастную специфику состава ПНЖК у жителей северных территорий, определяют их физиологическое состояние и отражают риски развития метаболически обусловленных заболеваний.
Метаболически обусловленные заболевания (МОЗ) являются одной из ведущих причин нарушения здоровья и смертности в современном обществе, основой которых является изменение в липидном обмене [1, 2]. У северян это связано, в первую очередь, с активацией энергетических затрат за счет липидных энергоносителей, что выгодно при проживании в условиях холодного климата [3]. При этом сложившаяся в последние годы модификация образа жизни, связанная с ограничением физической активности, увеличением калорийности пищевых продуктов и неуклонным ростом эмоционально-стрессовых нагрузок, провоцирует адаптивные перестройки в липидном обмене, как в содержании сывороточных липидов, так и в перераспределении состава жирных кислот (ЖК) в липидах клеточных мембран. Все это потенцирует основные факторы риска возникновения сердечно-сосудистых заболеваний, которые являются “отрицательным достоянием прогресса”, а именно повышение артериального давления, дислипидемии, сахарный диабет и ожирение [4–6].
Истощение в клеточном мембранном пуле физиологически важных полиненасыщенных жирных кислот (ПНЖК) является негативным фактором дисфункции в синтезе биологически активных метаболитов – оксилипинов (эйкозаноидов: простагландинов, лейкотриенов, тромбоксанов) [7–9]. Доказано, что нарушение синтеза оксилипинов и его дисбаланс в организме является причиной хронических воспалений, артериальной гипертензии, ишемической болезни сердца, атеросклероза, сахарного диабета [10–12]. Цепочка последовательных нарушений, начиная с патологии транспортных белков ЖК, приводит к клеточному дефициту незаменимых жирных кислот и нарушению синтеза эйкозаноидов, формируя метаболический синдром. Изменение профиля ЖК в липидах мембран не только изменяет синтез оксилипинов, но и является причиной нарушения их физико-химических свойств с понижением жидкостности, рецепторной чувствительности и мембранной проницаемости [13, 14]. При этом состав эссенциальных ЖК сыворотки крови, отражающий структурные и функциональные изменения клеток и всего организма в целом, значительно зависит от характера питания [15–20].
Одной из важнейших ω-6 ЖК является арахидоновая кислота (С20: 4ω6), а из ω-3 – эйкозапентаеновая (С20: 5ω3) и докозагесаеновая кислоты (С22: 6ω3) [14, 21]. Отмечено, что высвобождение арахидоновой кислоты из фосфолипидов и последующий ее метаболизм происходят в ответ на самые различные факторы (стресс, гипоксия, катехоламины, реакцию антиген–антитело и др.). Данная кислота является основным субстратом для циклооксигеназ и липоксигеназ, быстро метаболизируется с образованием эйкозаноидов 2-й и 4-й серии, которые, изменяя содержание цАМФ и цГМФ в клетке, модулируют ее метаболизм и активность [21, 22]. Вместе с тем установлено, что избыток арахидоновой кислоты повышает синтез эйкозаноидов, что приводит к различным метаболически обусловленным заболеваниям и усилению воспалительных процессов [12, 23]. Однако достаточное количество эйкозапентаеновой и докозагексаеновой кислот, конкурируя с арахидоновой кислотой за одни и те же ферменты, обеспечивает синтез противовоспалительных “эндогормонов” (простагландинов-3, тромбоксанов-3 и лейкотринов-5). То есть, для комфортного существования необходим определенный баланс “эндогормонов”, производных эйкозапентаеновой, докозагексаеновой ω-3 и арахидоновой ω-6 кислот [12, 21, 23].
Вместе с тем у практически здоровых жителей Севера, проживающих в районах с разной степенью экстремальности, содержание ПНЖК и их соотношений остаются малоизученными, особенно у лиц зрелого возраста, хотя рядом авторов показано, что одним из критериев в адаптационно-компенсаторном механизме северян является активация липидного обмена (24, 25). В ранних исследованиях коллектива сотрудников лаборатории биологической и неорганической химии ИФПА ФИЦКИА РАН был отмечен дефицит эйкозатриеновой, арахидоновой, эйкозапентаеновой и докозагексаеновой ПНЖК у девочек 8–18 лет [26]. В другом исследовании при сравнении коренного и пришлого населения северных территорий 16–21 лет более высокие значения ПНЖК были отмечены у коренных жителей [27]. Также есть сведения, что у лиц, проживающих в Арктическом регионе, уровни ПНЖК значимо выше, чем у жителей более южных регионов России [28, 29].
Кроме того, отмечен большой интерес у исследователей к уровню ПНЖК при различных заболеваниях. Так, у лиц с атеросклеротическими повреждениями и ишемической болезнью сердца установлено снижение в крови преимущественно уровня ω-3 кислот ПНЖК – α-линоленовой, эйкозапентаеновой и докозагексаеновой [30–32]. В других исследованиях показано, что важным звеном в патогенезе хронических заболеваний бронхолегочной системы является нарушение метаболизма ПНЖК вследствие конкурентного ингибирования биосинтеза ω-3 ПНЖК (эйкозапентаеновой и докозапентаеновой) с преобладанием образования ω-6 полиеновых кислот (арахидоновой и докозатетраеновой) и эйкозаноидов с выраженными провоспалительными свойствами [33]. Новгородцева и соавт., изучая уровни ПНЖК у лиц с метаболическим синдромом, отметили дефицит полиеновых кислот в клетках, связанный с интенсивностью транспорта в крови и поглощением клетками насыщенных и ненасыщенных жирных кислот [1, 34]. Плотникова и соавт. обращают внимание на то, что чувствительность тканей к инсулину повышается с увеличением ω-3 ПНЖК, это повышает текучесть клеточных мембран и выработку простагландинов, способствующих увеличению числа инсулиновых рецепторов [35]. Таким образом, уровни ПНЖК в крови являются важными биомаркерами функционального состояния организма и в виду ограниченности сведений как по содержанию ПНЖК, так и по их соотношениям у жителей зрелого возраста экологически разных районов Севера изучение их является актуальным.
В связи с этим целью работы стало изучение состава полиненасыщенных жирных кислот и оценка информативности их индивидуальных соотношений, отражающих дисбаланс в эйкозаноидном цикле на примере клинически здоровых лиц зрелого возраста, проживающих в приарктическом и арктическом регионе Севера России.
МЕТОДЫ ИССЛЕДОВАНИЯ
Для выполнения данной цели был использован материал 19-ти экспедиций, проведенных с 2009 по 2019 гг. в приарктическом и арктическом регионе Севера России. Обследовано 1556 практически здоровых (I и II группа здоровья) жителей северных территорий зрелого возраста 22–35, 36–45 и 46–60 лет, согласно возрастной периодизации [36]. Из них 661 человек (206 человек – 22–35 лет, 144 человека – 36–45 лет и 311 человек 46–60 лет) в приарктическом и 895 человек (259 человек – 22–35 лет, 244 человека – 36–45 лет и 392 человека – 46–60 лет) в арктическом регионах.
Арктический регион включал поселки Ненецкого автономного округа – п. Нельмин-Нос (67°59′ с.ш.), п. Несь (66°36′ с.ш.) Заполярного района; Архангельской области – д. Совполье (65°18′ с.ш), д. Сояна (65°46′ с.ш), с. Долгощелье (66°02′ с.ш.) Мезенского района; Ямало-Ненецкого автономного округа – с. Сёяха (70°10′ с.ш.) Ямальского района, г. Надым (65°32′ с.ш.), с. Ныда (66°37′ с.ш.), с. Нори (66°09′ с.ш.) Надымского района; с. Гыда (70°54′ с.ш.), с. Газ-Сале (67°22′ с.ш.), п. Тазовский (67°21′ с.ш.), с. Антипаюта (69°06′ с.ш.) Тазовского района; с. Толька (64°00′ с.ш.), с. Красноселькуп (65°42′ с.ш.) Красноселькупского района, а приарктический регион – г. Архангельск (64°54′ с.ш.), п. Пинега (64°41′ с.ш.), п. Коноша (60°58′ с.ш.), с. Рикасиха (64°32′ с.ш.) Архангельской области. Чтобы исключить влияние сезонных факторов и фотопериода исследование проводилось в весенний период (март–апрель), то есть в период увеличения светового дня, когда в организме северян происходят наиболее существенные перестройки метаболических процессов [37, 38].
В ходе исследования осуществляли забор крови в вакутайнеры из локтевой вены утром натощак с 8:00 до 10:00 ч, кровь центрифугировали, отбирали сыворотку, фасовали в эппендорфы, замораживали в жидком азоте и сохраняли ее до начала анализов. Одновременно проводилось анкетирование и физикальный осмотр врачами. При анкетировании все испытуемые заполняли стандартную анкету, которая содержала вопросы о возрасте, национальности пациента и их родителей, перенесенных заболеваниях, вредных привычках, питании, антропометрических параметрах и др.
В процессе физикального осмотра врач проводил беседу, измерял артериальное давление и на его основании, а также анамнестических и анкетных данных делал заключение о состоянии здоровья участников исследования.
В арктическом регионе в исследование были включены коренные жители, перешедшие с “кочевого” образа жизни на “оседлый”, живущие в поселке вместе с европеоидным (местное русское) населением, в том числе в межэтнических браках и изменившие не только социально-бытовую среду, но и характер питания, который стал ближе к местному русскому населению с бóльшим потреблением быстрых углеводов и транс-жиров [18–20]. Это явилось причиной незначимых различий в уровне, изучаемых нами показателей, и позволило объединить их в одну группу сравнения с местными русскими [39].
Критерии исключения – сердечно сосудистые заболевания и их осложнения, сахарный диабет, заболевания щитовидной железы, острые патологические состояния и обострение хронических болезней, а также коренные жители, ведущие “кочевой” образ жизни. Исследование одобрено этическим комитетом и выполнено в соответствии с этическими нормами Хельсинкской декларации Всемирной медицинской ассоциации 1964 г. с изменениями и дополнениями 2013 г. Все обследованные подписали форму добровольного информированного согласия на участие в исследовании, одобренное Комиссией по биомедицинской этике при Институте физиологии природных адаптаций ФИЦКИА РАН.
Количественное определение состава полиненасыщенных жирных кислот в сыворотке крови проводили в лаборатории биологической и неорганической химии ИФПА ФИЦКИА РАН г. Архангельска. Методом газожидкостной хроматографии на хроматографе Agilent 7890A с пламенно-ионизационным детектором на капиллярных колонках ВРХ-90 SGE (60 м–0.25 мм–0.25 мкм) после предварительной экстракции липидов и последующим получением метиловых эфиров ЖК определяли содержание ω-3 α-линоленовой (С18:3ω3), эйкозапентаеновой (С20:5ω3), докозагексаеновой (С22:6ω3), эйкозатриеновой (С20:3ω6), докозапентаеновой (С22:5ω3), ω-6 линолевой (С18:2ω6с), арахидоновой (С20:4n6), докозатетраеновой (С22:4ω6) кислот. Экстрагирование липидов и метилирование ЖК в сыворотке крови проводили методом Бичкаевой и др. [40]. Идентификацию ЖК осуществляли с использованием стандарта Nu-Chek Prep Ins 569 B (США), а количественный расчет ЖК проводили методом внутреннего стандарта С19:0 (нонадекановая кислота) в программе AgilentChemStationB.03.01 (США).
Рассчитывали величины соотношений индивидуальных ЖК: С20:4ω6/C22:6ω3, С20:4ω6/C20:5ω3, С20:4ω6/C20:3ω6, С20:4ω6/C22:4ω6, С20:5ω3/C22:5ω3, С22:6ω3/C22:5ω3, С18:2ω6с/C20:4ω6, (C20:3ω6 + C20:5ω3)/С22:6ω3.
Статистическую обработку данных, определение границ нормального распределения показателей проводили с использованием программы SPSS 15.0. Критический уровень значимости p ≤ 0.05. Для подавляющего большинства показателей в группах была выявлена ассиметрия рядов распределения, поэтому использованы методы непараметрической статистики. Выполнен дискриптивный анализ, определены медиана, значения 25-го и 75-го перцентилей Me (25, 75%), для сравнения медиан в группах использовали U-критерий Манна–Уитни [41].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Содержание в сыворотке крови рассматриваемых нами ПНЖК у лиц зрелого возраста приарктического и арктического регионов представлено в табл. 1.
Таблица 1.
Средние Мe (25; 75) значения омега-3 и омега-6 полиненасыщенных жирных кислот в крови у клинических здоровых жителей зрелого возраста Приарктического (ПР) и Арктического (АР) регионов Севера России Table 1. Mean Me (25; 75) values of omega-3 and omega-6 polyunsaturated fatty acids in the blood in clinically healthy residents of the mature age of the Subarctic (SR) and Arctic (AR) regions of the North of Russia
| Кислота, мкг/мл норма Acid, μkg /ml norm |
Возрастные группы Age groups |
Уровни значимости Significance levels |
||||
|---|---|---|---|---|---|---|
| регион region |
22–35 (1) |
36–45 (2) |
46–60 (3) |
Р между возрастами between ages |
Р между аналогичными
возрастными группами ПР и АР between similar age groups of SR and AR |
|
| Мe (25; 75) | Мe (25; 75) | Мe (25; 75) | ||||
| n (человек) n (people) |
ПР SR |
206 | 144 | 311 | ||
| АР AR |
259 | 244 | 392 | |||
| Линолевая
кислота Linoleic acid (C18:2ω6c) 371.97–1041.0 |
ПР SR |
642.57 (453.50; 806.69) |
672.44 (444.74; 936.78) |
766.21 (555.11; 960.72) |
1–2 = 0.428 1–3 < 0.001 2–3 = 0.013 |
1–1 = 0.777 2–2 = 0.577 3–3 = 0.002 |
| АР | 643.42 (470.27; 824.40) |
692.98 (521.90; 887.67) |
686.68 (524.69; 858.42) |
1–2 = 0.031 1–3 = 0.010 2–3 = 0.976 |
||
| Арахидоновая
кислота Arachidonic acid (C20:4ω6) 26.33–139.53 |
ПР SR |
59.07 (27.71; 104.01) |
62.93 (35.44; 110.90) |
78.46 (32.83; 123.58) |
1–2 = 0.241 1–3 = 0.005 2–3 = 0.182 |
1–1 = 0.002 2–2 < 0.001 3–3 < 0.001 |
| АР AR |
81.56 (41.48; 118.24) |
96.22 (56.56; 139.47) |
91.26 (58.95; 141.26) |
1–2 = 0.001 1–3 < 0.001 2–3 = 0.880 |
||
| Цис-7,1013,16-
Докозатетраеновая кислота Cis-7,1013,16- Docosatetraenoic acid (C22:4ω6) 1.09–6.15 |
ПР SR |
1.94 (1.35; 2.95) |
1.32 (1.02; 2.11) |
1.56 (1.06; 2.27) |
1–2 = 0.066 1–3 = 0.203 2–3 = 0.461 |
1–1 = 0.012 2–2 < 0.001 3–3 < 0.001 |
| АР AR |
3.15 (1.77; 5.41) |
3.52 (1.95; 5.01) |
3.19 (2.08; 5.01) |
1–2 = 0.866 1–3 = 0.947 2–3 = 0.651 |
||
| Линоленовая
кислота Linolenic acid (C18:3ω3) 1.51–9.57 |
ПР SR |
3.54 (1.86; 5.72) |
4.26 (2.50; 6.36) |
4.68 (3.08; 6.92) |
1–2 = 0.011 1–3 < 0.001 2–3 = 0.084 |
1–1 < 0.001 2–2 = 0.001 3–3 < 0.001 |
| АР AR |
4.64 (2.98; 6.62) |
5.38 (3.53; 7.17) |
5.80 (4.06; 8.72) |
1–2 = 0.009 1–3 < 0.001 2–3 = 0.014 |
||
| Эйкозапентаеновая кислота Eicosapentaenoic acid (C20:5ω3) 3.36–71.38 |
ПР SR |
7.11 (3.26; 12.31) |
8.91 (3.97; 16.11) |
9.98 (4.67; 19.39) |
1–2 = 0.019 1–3 < 0.001 2–3 = 0.224 |
1–1 < 0.001 2–2 < 0.001 3–3 < 0.001 |
| АР AR |
13.80 (6.48; 27.12) |
20.24 (10.69; 38.42) |
23.07 (10.4; 45.99) |
1–2 < 0.001 1–3 < 0.001 2–3 = 0.350 |
||
| Докозагексаеновая кислота Docosahexaenoic acid (C22:6ω3) 8.84–138.9 |
ПР SR |
20.56 (9.39; 50.81) |
27.38 (12.33; 59.93) |
37.01 (12.49; 71.57) |
1–2 = 0.095 1–3 < 0.001 2–3 = 0.122 |
1–1 = 0.048 2–2 < 0.001 3–3 < 0.001 |
| АР AR |
29.30 (13.89; 53.05) |
44.23 (22.10; 74.75) |
45.64 (21.11; 85.08) |
1–2< 0.001 1–3< 0.001 2–3 = 0.247 |
||
| Цис-8,11,14-
Эйкозатриеновая кислота Cis-8,11,14- Eicosatrienic acid (C20:3ω6) 3.72–44.32 |
ПР SR |
15.04 (6.01; 24.23) |
15.74 (7.92; 27.72) |
19.45 (7.62; 32.11) |
1–2 = 0.126 1–3 = 0.001 2–3 = 0.166 |
1–1 = 0.245 2–2 = 0.075 3–3 = 0.258 |
| АР AR |
15.13 (7.89; 25.79) |
19.31 (10.61; 30.21) |
20.52 (11.03; 31.08) |
1–2 = 0.009 1–3 < 0.001 2–3 = 0.409 |
||
| Докозапентаеновая кислота Docosapentaenoic acid (C22:5ω3) 3.23–19.93 |
ПР SR |
4.03 (2.11; 6.56) |
3.15 (2.42; 5.78) |
3.34 (2.31; 4.85) |
1–2 = 0.505 1–3 = 0.407 2–3 = 0.809 |
1–1 < 0.001 2–2 < 0.001 3–3 < 0.001 |
| АР AR |
8.26 (5.16; 13.46) |
8.64 (5.05; 14.61) |
9.43 (6.02; 13.37) |
1–2 = 0.522 1–3 = 0.120 2–3 = 0.563 |
||
Сравнение медианных значений (Ме) линолевой кислоты, являющейся субстратом для образования остальных ω-6 ЖК, показало, что в обоих регионах ее концентрация с возрастом увеличилась, но в приарктическом регионе у 46–60-летних, относительно 22–35 и 36–45-летних (р < 0.001, р = 0.013), в арктическом у 36–45- и 46–60-летних относительно 22–35-летних (р = 0.031, р = 0.010), а также у 46–60-летних приарктического региона была выше аналогичного возраста в арктическом (р = 0.002). Причем, повышение уровня в крови с возрастом сопровождалось снижением процента лиц с ее дефицитом от 11.2 до 6.1%, р = 0.038 в приарктическом и от 12.0 до 4.8%, р = 0.001 в арктическом регионах и повышением с избытком от 10.2 до 22.2%, р < 0.001 в приарктическом и от 9.7 до 10.5%, р = 0.74 в арктическом регионе ( табл. 1, рис. 1).
Рис. 1.
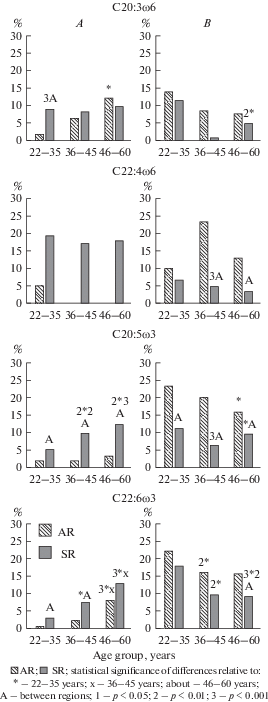
Распределение частоты отклонений уровня полиненасыщенных жирных кислот от нормативных значений у практически здоровых жителей зрелого возраста приарктического и арктического регионов Севера России: A – выше нормативных значений, B – ниже нормативных значений. Fig. 1. Distribution of the frequency of deviations of the level of polyunsaturated fatty acids from the normative values in practically healthy residents of the mature age of the Subarctic regions (SR) and the Arctic (AR) regions of the North of Russia: A – above the normative values, B – below the normative values.
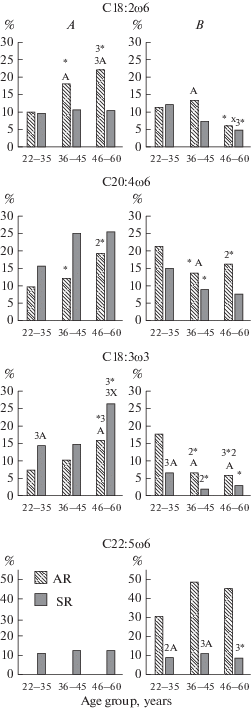
Рис. 1.
Окончание
Содержание арахидоновой кислоты – главного субстрата синтеза провоспалительных эйкозаноидов с возрастом повышалась и в арктическом у 36–45- и 46–60‑летних (р = 0.001, р < 0,001), а в приарктическом регионе у 46–60-летних (р = 0.005) ее уровень был выше 22–35-летних. Более того, у 22–35- (р = 0.002), 36–45- (р < 0.001) и 46-60-летних (р < 0.001) арктического региона ее уровень в 1.4, 1.5 и 1.2 раза был выше. Процент лиц с отклонениями С20:4ω6 от нормы у 22–35-, 36–45-летних жителей приарктического региона был больше смещен в сторону ниже, чем выше нормативных значений (с 21.4 и 9.7%, р = 0.011; 13.9 и 12.5%, р = 0.72), у 22–35-летних жителей арктического региона в равной степени в сторону ниже и выше нормы (15.5 и 15.9%, р = 0.86), а у 46–60-летних обитателей приарктического региона (16.2 и 19.5%, р = 0.28) и 36–45- (9.1 и 25.1%; р < 0.001), 46-60-летних арктической зоны (7.9 и 25.8%, р = 0.001) больше в сторону выше нормативных значений (табл. 1, рис. 1)
Уровень эйкозатриеновой кислоты изменялся аналогично арахидоновой – повышение С20:3ω6 относительно 22–35-летних, но в приарктическом регионе у 46–60-летних (р = 0.001), а в арктическом у 36–45- и 46–60-летних (р = 0.009, р < 0.001), и в отличие от С20:4ω6 без региональных различий (р = 0.245, р = 0.075, р = 0.258).
Вместе с тем во всех возрастных группах жителей арктического региона, относительно приарктического, содержание докозатетраеновой кислоты было выше (р = 0.012, р < 0.001, р < 0.001), что совместно с высокими уровнями арахидоновой кислоты, является неблагоприятным фактором усиления синтеза провоспалительных эйкозаноидов (табл. 1).
В обоих регионах у жителей 36–45 и 46–60 лет установлено повышение относительно 22–35-летних, основного антагониста арахидоновой и докозатетраеновой кислот, эйкозапентаеновой кислоты (в приарктическом регионе – р = 0.019, р < 0.001; в арктическом – р < 0.001, р < 0.001), но у жителей приарктического региона ее содержание во всех возрастных группах было ниже аналогичных возрастов арктического региона (р < 0.001, р < 0.001). Кроме того, с возрастом у лиц приарктического региона установлено снижение процента лиц с ее недостатком от 23.2 до 15.6%, р = 0.031 (против от 11.2 до 9.5%, р = 0.48 в арктическом), а в арктическом, наоборот, повышение с избытком от 5.0 до 12.3% р = 0.002 (против от 1.5 до 2.9%, р = 0.30 в приарктическом) (табл. 1, рис. 1).
Снижение уровня эйкозапентаеновой кислоты в крови явилось причиной недостатка ее метаболита докозапентаеновой кислоты, особенно у жителей приарктического региона, где относительное ее содержание было в 2.0, 2.7 и 2.8 раза ниже, чем в аналогичных возрастных группах арктического (p < 0.001, р < 0.001, р < 0.001).
В отношении докозагексаеновой кислоты установлена подобная эйкозапентаеновой кислоте динамика, то есть у 46–60-летних (р < 0.001, р < 0.001) лиц обоих регионов, а в арктическом также у 36–45-летних (р < 0.001) ее содержание было выше 22–35-летних. При этом уровень докозагексаеновой кислоты, подобно эйкозапентаеновой, был выше в аналогичных возрастных группах арктического региона (р = = 0.048, p < 0.001, p < 0.001) (табл. 1). С возрастом в обоих регионах установлено снижение процента лиц с ее недостатком от 22.3 до 15.8%, р = 0.062 в приарктическом, от 18.1 до 9.2%, р = 0.001 в арктическом и увеличение с избытком от 0.5 до 8.1%, р < 0.001 в приарктическом, от 3.1 до 13.0%, р < 0.001 в арктическом. То есть, в приарктическом регионе процент лиц с ее дефицитом был больше, а с избытком, наоборот, меньше. Вместе с тем, дефицит докозагексаеновой кислоты у жителей обоих регионов повышает вероятность синтеза провоспалительных эйкозаноидов, но особенно в приарктическом регионе.
Содержание незаменимой α-линоленовой кислоты, являющейся предшественником эйкозатриеновой, эйкозапентаеновой и докозагексаеновой ω-3 кислот, повышалось у 36–45- и 46–60-летних людей обоих регионов относительно 22–35-летних (в приарктическом – р = 0.011, р < 0.001; в арктическом – р = 0.009, р < 0.001). При этом 22–35-летних пределы ее колебаний были разнонаправленными, в приарктическом смещены преимущественно в сторону ниже нормативных значений (17.5% против 6.6%, p < 0.001), в арктическом, наоборот, выше нормативных (7.3% против 14.3%, p = 0.017). У 36–45- и 46-60-летних жителей обоих регионов ее содержание было смещено лишь в сторону выше нормативных значений, но процент лиц с ее избытком в приарктическом был меньше, чем в арктическом (10.4 и 15.8% против 14.8 и 26.4%, p = 0.123, p = 0.001) ( табл. 1, рис. 1).
Учитывая, что одной из главных причин изменения состава ЖК является изменение активности ферментов их метаболизма, нами были проанализированы некоторые показатели превращений ЖК: величина соотношения С20:4ω6/С20:3ω6 косвенно отражала активность ∆5-десатураз; С22:6ω3/С22:5ω3 – показатель активности ферментов последнего этапа биосинтеза ЖК; С20:4ω6/С22:4ω6 и С20:5ω3/С22:5ω3 – показатель активности элонгаз. Величина С20:4ω6/С22:6ω3 и (С20:3ω6 + С20:5ω3)/С22:6ω3 отражали состояние метаболизма в эйкозаноидном цикле, а значение С20:4ω6/С20:5ω3 позволяло оценить участие в эйкозаноидном цикле предшественников различных семейств. Информативная значимость представленных критериев была доказана для больных сердечно сосудистой патологией [1, 4, 6], но при этом нет данных по клинически здоровым лицам.
Анализ полученных нами значений не выявил значимых изменений величины 20:4ω6/20:3ω6 у лиц обоих регионов с повышением возраста, но при сравнении аналогичных возрастных групп величина данного соотношения у лиц арктического региона была выше (р = 0.014, р = 0.001, р = 0.009). Это косвенно указывает на повышение активности ∆5-десатураз, катализирующих реакции синтеза субстрата для эйкозаноидов 2-й и 4-й серии (табл. 2).
Таблица 2.
Средние Мe (25; 75) значения соотношений полиненасыщенных жирных кислот в крови клинически здоровых лиц зрелого возраста приарктического (ПР) и арктического (АР) регионов Севера России Table 2. Mean Me (25; 75) values of ratios of polyunsaturated fatty acids in the blood of clinically healthy people of mature age in the Subarctic (SR) and Arctic (AR) regions of the North of Russia
| Соотношение кислот, усл. ед. The ratio of acids conv. units |
Возрастные группы Age groups |
Уровни значимости Significance levels |
||||
|---|---|---|---|---|---|---|
| регионы regions |
22–35 (1) |
36–45 (2) |
46–60 (3) |
Р между возрастами between ages |
Р между аналогичными
возрастными группами ПР и АР between similar age groups of SR and AR |
|
| Мe (25; 75) | Мe (25; 75) | Мe (25; 75) | ||||
| n (человек) n (people) |
ПР SR |
206 | 144 | 311 | ||
| АР AR |
259 | 244 | 392 | |||
| С20:4ω6/C22:6ω3 | ПР SR |
2.55 (1.78; 3.86) |
2.27 (1.58; 3.54) |
2.19 (1.52; 3.24) |
1–2 = 0.068 1–3 = 0.001 2–3 = 0.286 |
1–1 = 0.623 2–2 = 0.519 3–3 = 0.050 |
| АР | 2.63 (1.90; 3.79) |
2.30 (1.67; 3.00) |
2.06 (1.38; 2.96) |
1–2<0,001 1–3<0.001 2–3 = 0.014 |
||
| С20:4ω6/C20:5ω3 | ПР SR |
8.97 (4.79; 15.40) |
6.43 (3.8; 13.27) |
6.80 (3.9; 13.06) |
1–2 = 0.896 1–3 = 0.006 2–3 = 0.985 |
1–1 < 0.001 2–2 < 0.001 3–3 < 0.001 |
| АР | 5.45 (2.81; 9.33) |
4.05 (2.36; 7.59) |
3.85 (2.25; 7.85) |
1–2 = 0.013 1–3 = 0.001 2–3 = 0.484 |
||
| С20:4ω6/C20:3ω6 | ПР SR |
4.34 (3.35; 5.93) |
4.28 (3.4; 5.89) |
4.22 (3.24; 5.66) |
1–2 = 0.280 1–3 = 0.198 2–3 = 0.981 |
1–1 = 0.014 2–2 = 0.001 3–3 = 0.009 |
| АР | 4.81 (3.52; 7.71) |
5.10 (3.69; 6.98) |
4.52 (3.36; 6.69) |
1–2 = 0.925 1–3 = 0.100 2–3 = 0.073 |
||
| С22:6ω3/C22:5ω3 | ПР SR |
4.82 (3.86; 7.08) |
4.15 (3.00; 4.99) |
4.61 (3.82; 5.23) |
1–2 = 0.050 1–3 = 0.235 2–3 = 0.270 |
1–1 = 0.404 2–2 = 0.042 3–3 = 0.178 |
| АР | 4.60 (3.58; 6.01) |
4.78 (3.53; 6.33) |
4.88 (3.66; 6.54) |
1–2 = 0.468 1–3 = 0.223 2–3 = 0.697 |
||
| С20:4ω6/C22:4ω6 | ПР SR |
24.19 (20.68; 33.53) |
27.83 (23.14; 33.72) |
23.33 (18.62; 30.38) |
1–2 = 0.352 1–3 = 0.354 2–3 = 0.044 |
1–1 = 0.408 2–2 = 0.259 3–3 < 0.001 |
| АР | 26.19 (20.30; 41.31) |
28.88 (23.07; 43.00) |
29.63 (22.64; 46.28) |
1–2 = 0.085 1–3 = 0.020 2–3 = 0.511 |
||
| С20:5ω3/C22:5ω3 | ПР SR |
1.99 (1.56; 2.45) |
1.97 (1.24; 2.68) |
1.89 (1.19; 2.41) |
1–2 = 0.747 1–3 = 0.500 2–3 = 0.726 |
1–1 = 0.05 2–2 = 0.011 3–3 < 0.001 |
| АР | 2.38 (1.39; 3.93) |
2.70 (1.60; 4.68) |
2.84 (1.65; 4.22) |
1–2 = 0.104 1–3 = 0.031 2–3 = 0.761 |
||
| (C20:3ω6 + + C20:5ω3)/С22:6ω3 | ПР SR |
0.92 (0.68; 1.43) |
0.94 (0.65; 1.51) |
0.83 (0.65; 1.27) |
1–2 = 0.760 1–3 = 0.328 2–3 = 0.250 |
1–1 < 0.001 2–2 = 0.134 3–3 = 0.005 |
| АР | 1.12 (0.87; 1.61) |
1.03 (0.78; 1.43) |
0.96 (0.73; 1.33) |
1–2 = 0.021 1–3<0.001 2–3 = 0.150 |
||
Вместе с тем в обоих регионах установлено снижение с возрастом относительно 22–35-летних величины 20:4ω6/20:5ω3, более значимое во всех возрастных группах арктического региона (р < 0.001, р < 0.001, р < 0.001). При этом у лиц 36–45 лет приарктического региона значение С20:4ω6/С22:4ω6 было выше 46–60-летних (р = = 0.044), а значимых возрастных изменений С20:5ω3/С22:5ω3 у них не установлено (р = 0.747, р = 0.500, р = 0.726); в арктическом регионе значения обоих соотношений С20:4ω6/С22:4ω6 и С20:5ω3/С22:5ω3 с возрастом повышались и у 46–60-летних были выше 22–35-летних (р = 0.020, р = 0.031). Сравнение аналогичных возрастных групп жителей приарктического и арктического регионов показало, что у жителей приарктического региона, с одной стороны, значимо выше величина соотношения С20:4ω6/С20:5ω3 (p < 0.001, p < 0.001, p < 0.001), с другой, значимо ниже величина С20:5ω3/С22:5ω3 (p = 0.05, p = 0.011, p < 0.001) и (С20:3ω6 + С20:5ω3)/С22:6ω3 (p < 0.001, p = 0.134, p = 0.005) (табл. 2).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученное в нашем исследовании увеличение во всех возрастных группах уровня арахидоновой и докозатетраеновой кислот у жителей арктического региона относительно аналогичных возрастов приарктического происходило на фоне повышения основных ингибиторов и конкурентов за циклооксигеназные и липоксигеназные метаболические пути эйкозапентаеновой и докозагексаеновой кислот. Но, несмотря на то, что условия проживания в арктическом регионе более дискомфортные по сравнению с приарктическим, с почти повсеместным распространением вечной мерзлоты, более суровыми и продолжительными зимами, более низкими температурами, напряженным ветровым режимом и резкими перепадами атмосферного давления, перечисленные выше изменения в уровне ПНЖК могут указывать на увеличение синтеза противовоспалительных эйкозаноидов, улучшение текучести фосфолипидной жидкокристаллической структуры мембран клеток и косвенно свидетельствовать о незначительном снижении риска развития метаболически обусловленных заболеваний у лиц арктического региона.
Обращает на себя внимание то, что выявленные изменения в уровне арахидоновой кислоты именно у жителей арктического региона, более северного района с большей жесткостью погодных условий, чем в приарктическом сочетались с большей частотой встречаемости избыточных состояний линолевой кислоты. Известно, что именно линолевая кислота метаболизируется в арахидоновую, но интенсивность процессов определяется активностью ферментов элонгации и десатурации. Хотя анализ полученных нами значений 20:4n6/20:3n6 не выявил значимых изменений у лиц обоих регионов с повышением возраста, но величина данного соотношения у лиц всех возрастных групп арктического региона была выше, что косвенно указывает на повышение активности D5-десатураз, катализирующих реакции синтеза арахидоновой кислоты – субстрата для эйкозаноидов 2-й и 4-й серии. Это, по нашему мнению, связано с тем, что совокупность климатических факторов Севера, стимулирует выброс стрессовых гормонов, усиливает липолиз, а простагландины-2 эндогенно модулируют метаболизм липидов через снижение образования цАМФ, необходимого для активации липолиза [12, 21, 22].
Вместе с тем, повышение уровня С20:4ω6 (С20:4ω6/С20:5ω3 выше во всех возрастных группах приарктического, а С20:4ω6/С20:3ω6 во всех возрастных группах арктического регионов) увеличивает риск дисбаланса эйкозаноидов в сторону провоспалительного характера, что может являться причиной развития хронического воспаления, эндотелиальной дисфункции и артериальной гипертонии [12, 23] – клинико-биохимических процессов метаболического синдрома. При этом, смещение уровня С20:5ω3 у лиц обоих регионов в сторону нижней границы нормы и высокий процент лиц с ее содержанием ниже нормы, особенно у 22–35- и 36–45-летних лиц приарктического региона, способствует развитию инсулинорезистентности и, как следствие, ожирения, согласно гипотезе инсулинорезистентности в развитии метаболического синдрома [1, 34, 35]. Следовательно, установленные значения С20:4ω6/С20:5ω3 и С20:4ω6/С20:3ω6 у жителей северных регионов, являются значимым фактором повышенного риска развития метаболического синдрома во всех возрастных группах зрелого возраста.
Одной из причин выявленных нами изменений ЖК в крови северян с возрастом, может быть, как нарушение их активного транспорта, так и несбалансированное питание, в частности, потребление легко усваиваемых углеводов и транс-жиров, ранее нехарактерное для жителей арктического региона [15, 17–20]. Кроме того, поскольку основным субстратом перекисного окисления липидов являются ПНЖК, дефицит ω-3 и избыток ω-6, установленный у лиц обоих регионов, указывает на усиление окислительных процессов с образованием атерогенных фракций липидов [2, 3, 6].
Положительным моментом работы был анализ не только индивидуальных ПНЖК, но и оценка их соотношений с учетом возраста и региона проживания. Традиционно обеспеченность полиненасыщенными жирными кислотами сводится к их качественному и количественному определению, анализу соотношений ω-3 и ω-6 кислот между собой и их суммарного содержания (∑ω-6/∑ω-3). Однако, результаты исследований в последние годы свидетельствуют о том, что данные коэффициенты не всегда корректно отражают функциональные свойства ω-3 и ω-6 ПНЖК. При этом соотношения ПНЖК косвенно являются показателями их метаболизма – одной из реальных причин изменения состава ЖК. Так, в обоих регионах было установлено снижение с возрастом величины 20:4n6/20:5n3 и повышение 20:4n6/22:4n6, характеризующих взаимосвязь между предшественником синтеза эйкозаноидов и ингибитором их образования. При сравнении аналогичных возрастных групп обоих регионов показано, что у жителей приарктического региона, с одной стороны, значимо выше величина соотношения 20:4n6/20:5n3, с другой, значимо ниже величина 20:5n3/22:5n3 и (20:3n6 + 20:5n3)/22:6n3, что свидетельствует об изменении метаболизма ЖК.
Таким образом, у северян, особенно приарктического региона, установлены изменения в метаболизме ЖК и биосинтезе эйкозаноидов при отсутствии клинических симптомов, обусловленные угнетением активности ферментов начального и последнего этапа метаболизма эссенциальных ЖК с реципрокным подавлением синтеза циклооксигеназных и липоксигеназных метаболитов ω-3 ЖК. Следовательно, значимым фактором повышенного риска развития метаболического синдрома во всех возрастных группах зрелого возраста приарктического региона было повышение величины соотношения 20:4n6/20:5n3, а в арктическом – 20:4n6/20:3n6.
Полученные результаты свидетельствуют об изменении состава жирных кислот в сыворотке крови у клинически здоровых лиц зрелого возраста, основанной на нарушении их метаболизма, конкурентном ингибировании биосинтеза ω-3 ЖК, преобладании образования ω-6 ЖК и эйкозаноидов с выраженными провоспалительными свойствами. Можно заключить, что у жителей Арктики, особенно приарктического региона, начиная с 22–35 лет, развивается нарушение липидного обмена на клеточном уровне (в легкой степени тяжести), которое сохраняется до 46–60 лет. То есть, важным звеном метаболического синдрома является дезорганизация липидного компонента клеточных мембран.
ЗАКЛЮЧЕНИЕ
Результаты исследования показали, что в обоих регионах с возрастом повышение уровня предшественника ω-6 ЖК линолевой кислоты сочеталось с увеличением содержания арахидоновой, докозатетраеновой и эйкозатриеновой кислот, а предшественника ω-3 ЖК α-линоленовой кислоты с повышением эйкозапентаеновой, докозапентаеновой и докозагексаеновой кислот, содержание которых было выше у лиц арктического региона.
При избытке ω-6 арахидоновой кислоты в арктическом и линолевой кислоты в приарктическом в обоих регионах, несмотря на повышение уровня ω-3 эйкозапентаеновой и докозагексаеновой кислот от 22–35 до 46–60 лет, процент лиц с их дефицитом оставался высоким, особенно в приарктическом регионе. Это свидетельствует не только о снижении у северян синтеза субстрата противовоспалительных эйкозаноидов, но и определяет содержание ЖК в липидах мембран, изменяя их свойства в сторону понижения жидкостности, рецепторной чувствительности и мембранной проницаемости, за счет избытка у жителей приарктического региона линолевой, а арктического – арахидоновой кислоты и дефиците в обоих регионах докозапентаеновой и докозагексаеновой кислот.
Во всех возрастных группах жителей приарктического региона отмечено увеличение величины С20:4ω6/С20:5ω3 и снижение С20:5ω3/С22:5ω3, (С20:3ω6 + + С20:5ω3)/С22:6ω3 относительно аналогичных возрастов арктического, что указывает на интенсификацию метаболизма ПНЖК и усиление синтеза субстрата для образования эйкозаноидов провоспалительного действия. При этом в арктическом регионе статистически значимое повышение как ω-3, так и ω-6 может являться компенсаторно-приспособительной реакцией сохранения липидного компонента клеточных мембран, направленной на снижение риска их деструкции, а повышение величины соотношения арахидоновая/эйкозазатриеновая – одним из скрытых критериев риска синтеза провоспалительных эйкозаноидов.
Полученные нами данные о содержании и соотношениях ПНЖК показывают их значимую роль в сохранении липидного компонента клеточных мембран и синтезе эйкозаноноидов у клинически здоровых лиц в условиях высоких широт. Результаты исследования следует учитывать при разработке и выборе профилактических и терапевтических мероприятий по снижению риска метаболически обусловленных заболеваний с учетом региона проживания и возраста.
Список литературы
Новгородцева Т.П., Денисенко Ю.К., Антонюк М.В., Юбицкая Н.С., Лобанова Е.Г., Жукова Н.В. Жирные кислоты крови в формировании и коррекции метаболического синдрома. Терапевт. архив. 8: 30–34. 2016. [Novgorodtseva T.P., Denisenko Yu.K., Antonyuk M.V., Yubitskaya N.S., Lobanova E.G., Zhukova N.V. Blood fatty acids in the development and correction of metabolic syndrome. Therap. Arch. 8: 30–34. 2016. (In Russ)].
Василькова Т.Н., Матаев С.И. Метаболический синдром в популяции коренных народов Крайнего Севера. Вестн. Южно-Уральского ГУ. Серия: Образование, здравоохранение, физическая культура. 27: 71–73. 2009. [Vasilkova T.N., Mataev S.I. Metabolic a syndrome in population of the radical people of the extreme North Herald. South Ural State University. Series: Education, healthcare, physical education. 27: 71–73. 2009. (In Russ)].
Панин Л.Е. Гомеостаз и проблемы приполярной медицины методологические аспекты адаптации. Бюлл. СО РАМН. 3: 6–11. 2010. [Panin L.E. Homeostasis and problems of circumpolar health (Methodological aspects of adaptation). Bull. SB RAMS. 3: 6–11. 2010. (In Russ)].
Psota T.L., Gebauer S.K., Kris-Etherton P. Dietary omega-3 fatty acid intake and cardiovascular risk. Am. J. Cardiol. 98: 3–18. 2006.
Zhou Y.E., Kubow S., Dewailly E., Julien P., Egeland G.M. Decreased activity of desaturase 5 in association with obesity and insulin resistance aggravates declining long-chain n-3 fatty acid status in Cree undergoing dietary transition. Br. J. Nutr. 102(6): 888–894. 2009.
Драпкина О.М., Шепель Р.Н. Омега-3 полиненасыщенные жирные кислоты и возраст – ассоциированные заболевания: реалии и перспективы. Рациональная фармакология в кардиологии. 3(11): 309–316. 2015. [Drapkina O.M., Shepel R.N. Omega-3 fatty acids and age-related diseases: realities and prospects Racional’naya farmakologiya v kardiologii. 3(11): 309–316. 2015. (In Russ)].
Stillwell W., Wassall S.R. Docosahexaenoic acid: membrane properties of a unique fatty acid. Chem. Phys. Lipids. 126(1): 1–27. 2003.
Новгородцева Т.П., Караман Ю.К., Жукова Н.В., Лобанова Е.Г., Антонюк М.В., Кантур Т.А. Состав свободных и эстерифицированных жирных кислот крови при формировании метаболического синдрома. Бюлл. СО РАМН. 32(2): 61–66. 2012. [Novgorodtseva T.P., Karaman Y.K., Zhukova N.V., Lobanova E.G., Antonyuk M.V. Kantur T.A. Composition of blood free and esterified fatty acids under the forming of metabolic syndrome. Bull. SO RAMN. 32(2): 61–66. 2012. (In Russ)].
Назаров П.Е., Мягкова Г.И., Гроза Н.В. Полиненасыщенные жирные кислоты как универсальные эндогенные биорегуляторы. Вестник МИТХТ им. М.В. Ломоносова. 4(5): 3–19. 2009. [Nazarov P.E., Miagkova G.I., Groza N.V. Polyunsaturated fatty acids as universal endogenious bioregulators. Vestnik MITHT im. M.V. Lomonosova. 4(5): 3–19. 2009. (In Russ)].
Calder P.C. n-3 polyunsaturated fatty acids, inflammation, and inflammatory diseases Am. J. Clin. Nutr. 83(6): 1505–1519. 2006.
Lorente-Cebrián S., Costa A.G.V., Navas-Carretero S., Zabala M., Laiglesia L.M., Martínez J.A., Moreno-Aliaga M.J. An update on the role of omega-3 fatty acids on inflammatory and degenerative diseases. J. Physiol. Biochem. 71(2): 341–349. 2015.
Новгородцева Т.П., Денисенко Ю.К., Антонюк М.В., Жукова Н.В. Модификация состава жирных кислот мембраны эритроцитов при хронической обструктивной болезни легких. Бюл. СО РАМН. 33(5): 64–69. 2013. [Novgorodtseva T.P., Denisenko Y.K., Antonyuk M.V., Zhukova N.V. Modification of fatty acid content of cell membranes of erythrocytes at chronic obstructive pulmonary disease. Bull. SO RAMN. 33(5): 64–69. 2013. (In Russ)].
Таратухин Е.О. Атеросклероз и жирные кислоты: важная взаимосвязь и новое направление терапии. Рос. кардиол. журнал. 5: 77–80. 2011. [Taratukhin E.O. Atherosclerosis and fatty acids: important association and new therapeutic approach. Ross. Kardiol. Zhurn. 5: 77–80. 2011. (In Russ)].
Williams J.A., Batten S.E., Harris M., Rockett B.D., Shaikh S.R., William S., Wassall S.R. Docosahexaenoic and eicosapentaenoic acids segregate differently between raft and nonraft domains. Biophys. J. 103(2): 228–237. 2012.
Чанчаева Е.А. К вопросу об адекватности питания аборигенного населения Сибири. Экология человека. 3: 31–34. 2010. [Tchantchaeva E.A. Тo the issue of the adequacy of nutrition of siberian aboriginal population Literature rewiev. Ekologiya cheloveka. 3: 31–34. 2010. (In Russ)].
Innis S.M. Omega-3 fatty acid biochemistry: perspectives from human nutrition. Mil. Med. 179(11): 82–87. 2014.
Лобанов А.А., Богданова Е.Н., Андронов С.В., Попов А.И., Кочкин Р.А., Кострицин В.В., Лобанова Л.П., Протасова И.В., Лобанова Е.В., Кобелькова И.В. Исследование традиционного питания жителей Арктической зоны западной Сибири. Вопросы питания. 87(5): 31–32. 2018. [Lobanov A.A., Bogdanova E.N., Andronov S.V., Popov A.I., Kochkin R.A., Kostricin V.V., Lobanova L.P., Protasova I.V., Lobanova E.V., Kobelkova I.V. A study of the traditional diet of the inhabitants of the Arctic zone of Western Siberia. Voprosy pitaniya. 87(5): 31–32. 2018. (In Russ)].
Никифорова Н.А., Карапетян Т.А., Доршакова Н.В. Особенности питания жителей Севера. Экология человека. 11: 20–22. 2018. [Nikiforova N.A., Karapetyan T.A., Dorshakova N. Feeding habits of the northerners. Ekologiya cheloveka. 11: 20–22. 2018. (In Russ)].
Иванова Г.В., Сафронова Т.Н. Особенности питания коренного населения арктической зоны российской федерации. Рос. Арктика. 3: 60–69. 2018. [Ivanova G.V., Safronova T.N. Nutritional pecularities of the arctic indigenous population. Ross. Arktika. 3: 60–69. 2018. (In Russ)].
Белова Н.И., Лавринов П.А., Воробьева Н.А., Зуева Т.Н., Айвазова Е.А. Алиментарный статус коренного населения ненецкого автономного округа. Экология человека. 7: 10–14. 2013. [Belova N., Lavrinov P., Vorobyova N., Zueva T., Ayvazova E. Alimentary status of native population of the nenets autonomous area. Ekologiya cheloveka.7: 10–14. 2013. (In Russ)].
Денисенко Ю.К., Виткина Т.И., Кондратьева Е.В., Жукова Н.В. Назаренко А.В. Модификация состава жирных кислот мембран митохондрий тромбоцитов у больных хроническим необструктивным бронхитом. Здоровье. Медицинская экология. Наука.2(56): 59–61. 2014. [Denisenko Yu.K., Vitkina T.I., Kondratyeva E.V., Zhukova N.V., Nazarenko A.V. Modification of the composition of fatty acids in membranes of mitochondria of platelets in patients with chronic non-obstructive bronchitis. Zdorov’e. Medicinskaya ekologiya. Nauka. 2(56): 59–61. 2014. (In Russ)].
D'Alessandro M.E., Chicco A., Lombardo Y.B. Fish oil reverses the altered glucose transporter, phosphorylation, insulin receptor substrate-1 protein level and lipid contents in the skeletal muscle of sucrose-rich diet fed rats. Prostaglandins Leukot. Essent. Fatty Acids. 88(2): 171–177. 2013.
Schwartz J. Role of polyunsaturated fatty acids in lung disease. Am. J. Clin. Nutr. 71(1): 393S-396S. 2000.
Панин Л.Е. Особенности энергетического обмена. Механизмы адаптации человека в условиях высоких широт. Л. Медицина. 1980. [Panin L.E. Features of energy metabolism. Mechanisms of human adaptation in high latitudes. L. Medicine. 1980. (In Russ)].
Бойко Е.Р. Физиолого-биохимические основы жизнедеятельности человека на Севере. Екатеринбург. 2005. [Boyko E.R. Fiziologo-biohimicheskie osnovy zhiznedeyatel’nosti cheloveka na Severe. [Physiological and biochemical foundations of human life in the North]. Ekaterinburg. 2005. (In Russ)].
Третьякова Т.В., Власова О.С., Волкова Н.И., Баранова Н.Ф. Особенности фракций сывороточного холестерина и ω-3, ω-6 полиненасыщенных жирных кислот у девочек северо-восточного региона в зависимости от стадии полового развития. Вестник Уральской мед. акад. науки. 2: 159–162. 2014. [Tretyakova T.V., Vlasova O.S., Volkova N.I., Baranova N.F. Features of fractions of serum cholesterol and ω-3, ω-6 polyunsaturated fatty acids in girls of the north-eastern region depending on the stage of sexual development. Vestnik Ural’skoj med. akad. nauki. 2: 159–162. 2014. (In Russ)].
Третьякова Т.В., Власова О.С., Баранова Н.Ф. Сравнительный анализ параметров липидного и углеводного обмена у коренного и некоренного юношеского населения арктического региона. Вестник Уральской мед. акад. науки. 15(2): 229–238. 2018. [Tretyakova T.V., Vlasova O.S., Baranova N.F. Comparative Analysis of Parameters of Lipid and Carbohydrate Matabolism in Aboriginal and Non-Aboriginal Young People in the Arctic Region. Vestnik Ural’skoj med. аkad. nauki. 15(2): 229–238. 2018. (In Russ.)]
Бичкаева Ф.А., Кокоев Т.И., Джиоева Ц.Г., Волкова Н.И., Третьякова Т.В., Власова О.С. Сравнительная характеристика углеводного и жирового обменов у жителей двух различных климатогеографических территорий. Вестник акад. знаний. 1: 174–181. 2013. [Comparative characteristics of carbohydrate and fat metabolism in residents of two different climatogeographic territories. Vestnik akad. znanij. 1: 174–181. 2013. (In Russ)].
Galstyan D.S., Bichkaeva F.A., Vlasova O.S., Volkova N.I., Tretyakova T.V., Nesterova E.V., Shengoff B.A., Baranova N.F., Bichkaenv A.A. Features content of essential omega 3 polyunsaturated fatty acids and glucose level in the inhabitants of the Arctic region of mature age. IOP Conference. Series:Earth and Environmental Science. Arctic Biomonitoring: International Conference. Arkhangelsk. Russian Federation. 263(1): 169–173. 2018.
Lausada N.R., Boullon S., Boullon F. Tacconi de Gomez Dumm I. N. Erythrocyte membrane, plasma and atherosclerotic plaque lipid patten in coronary disease. Medicina. (B Aires). 67(5): 451–457. 2007.
Салахова Л.К., Никитина Е.В., Гусаров А.В. Экспрессное определение жирных кислот в капиллярной крови методом газаовой хроматографии. Вестник казанск. техн. универ. 3(4): 27–32. 2007. [Salakhova L.K., Nikitina E.V., Gusarov A.V. Rapid determination of fatty acids in capillary blood by gas chromatography. Vestnik kazanskogo tekhn. univer. 3(4): 27–32. 2007. (In Russ)].
Ткачева Н.И., Морозов С.В., Стахнева Е.М., Шрамко В.С., Рагино Ю.И. Хроматографическое определение содержания жирных кислот в различных биологических средах при атеросклеротических повреждениях. Атеросклероз и дислипидемии. 1: 17–28. 2017. [T-kacheva N.I., Morozov S.V., Stakhneva E.M., Shramko V.S., Ragino Yu.I. Chromatographic determination of the content of fatty acids in different biological environments at atherosclerotic damages. Ateroskleroz i dislipidemii. 1: 17–28. 2017. (In Russ)].
Денисенко Ю.К., Новгородцева Т.П., Жукова Н.В., Жукова Н.В., Лобанова Н.Г., Антонюк М.В. Метаболические превращения полиненасыщенных жирных кислот при хронических воспалительных заболеваниях органов дыхания. Междунар. Журн. прикладных и фундаментальных исследований. 11(2): 201–206. 2015. [Denisenko Y.K., Novgorodtseva T.P., Zhukova N.V., Lobanova E.G., Antonuk M.V. Metabolic conversion of polyunsaturated fatty acids in chronic inflammatory respiratory diseases. Mezhdunar. Zhurn. prikladnyh i fundamental’nyh issledovanij. 11(2): 201–206. 2015. (In Russ)].
Александров О.В., Алехина Р.М., Григорьев С.П., Ежова И.С., Золкина И.В. Метаболический синдром. Рос. мед. журн. 6: 50–55. 2006. [Aleksandrov O.V., Alekhina R.M., Grigor’ev S.P., Ye-zhova I.S., Zolkina I.V. Metabolic syndrome. Ros. med. zhurn. 6: 50–55. 2006. (In Russ)].
Плотникова Е.Ю. Синькова М.Н., Исаков Л.К. Роль омега-3 ненасыщенных кислот в профилактике и лечении различных заболеваний. Лечащий врач. 8: 56. 2018. [Plotnikova E.Yu., Sinkova M.N., Isakov L.K. Role of omega-3 unsaturated acids in prevention and treatment of different diseases (part 2). Lechashchij vrach. 8: 56. 2018. (In Russ.)]
Безруких М.М., Сонькин В.Д., Фарбер Д.А. Возрастная физиология. М. Академия. 2002. [Bezrukikh M.M., Sonkin V.D., Farber D.A. Age physiology. (Bezrukikh M.M., Sonkin V.D., Farber D.A. Izdatel’skij centr. Moscow. Akademiya. 2002. (In Russ)].
Красильникова В.А., Хаснулин В.И. Сезонные изменения метаболизма коренных жителей Тывы. Экология человека. 3: 20–24. 2015. [Krasilnikova V.A., Hasnulin V.I. Seasonal changes in metabolism of tyva indigenous people. Ekologiya cheloveka. 3: 20–24. 2015. (In Russ)].
Бичкаева Ф.А. Резервные возможности эндокринной регуляции метаболических процессов у человека на Севере. Автореф. дис. … д-ра биол. наук. Архангельск. 2006. [Bichkaeva F.A. Reserve capabilities of endocrine regulation of metabolic processes in humans in the North: abstract of thesis. Dr. biol. sciences. 2006. (Bichkaeva F.A. Reserve capabilities of endocrine regulation of metabolic processes in humans in the North: abstract of thesis. Dr. biol. sciences. Arkhangelsk. 2006. (In Russ)].
Бичкаева Ф.А., Типисова Е.В., Бичкаев А.А Особенности жирно-кислотного состава и гормонов поджелудочной железы у аборигенного и местного русского населения Заполярья. Вестник Уральской мед. акад. науки. 2(48): 116–119. 2014. [Bichkaeva F.A., Tipisova E.V., Bichkaev A.A. Aspects of fatty acid profile and pancreatic hormones in aboriginal and local russian population from polar region. Vestnik Ural’skoj med. аkadem. nauki. 2(48): 116–119. 2014. (In Russ)].
Бичкаева Ф.А., Баранова Н.Ф., Власова О.С., Третьякова Т.В., Нестерова Е.В., Шенгоф Б.А., Бичкаев А.А., Волкова Н.И. Методика измерений массовой концентрации метиловых эфиров жирных кислот (МЭЖК) в сыворотке крови методом газожидкостной хроматографии. Реестр методик измерений УрО РАН. Номер 88-16365-001-2019. Номер ФР.1.31.2019.33742. [Bichkaeva F.A., Baranova N.F., Vlasova O.S., Tretyakova T.V., Nesterova E.V., Shengof B.A., Bichkaev A.A., Volkova N.I. Method for measuring the mass concentration of fatty acid methyl esters (FAMEs) in blood serum by gas-liquid chromatography. The register of measurement methods of the Ural Branch of the Russian Academy of Sciences. Number 88-16365-001-2019. Number FR.1.31.2019.33742. 2019. (In Russ)].
Наследов А.Д. SPSS 15.0 Профессиональный статистический анализ данных. СПб. 2008. [Nasledov A.D. SPSS 15.0 Professional’nyj statisticheskij analiz dannyh [Professional’nyj statisticheskij analiz dannyh. SPSS 15.0]. St. Petersburg. 2008. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


