Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 7, стр. 916-924
Анализ показателей микроциркуляции симметричных органов человека в условиях изменения артериального давления
Л. В. Мезенцева *
НИИ нормальной физиологии им. П.К. Анохина
Москва, Россия
* E-mail: l.v.mezentseva@mail.ru
Поступила в редакцию 25.11.2019
После доработки 25.02.2020
Принята к публикации 04.05.2020
Аннотация
Известно, что ключевым звеном в патогенезе многих заболеваний, в том числе артериальной гипертензии, являются нарушения микроциркуляции (МЦР). Несмотря на большое количество публикаций, посвященных изучению показателей МЦР у больных артериальной гипертензией, вопросы функциональной асимметрии этих характеристик и их взаимосвязи с артериальным давлением до сих пор мало изучены. Поэтому целью настоящего исследования явилось изучение особенностей проявления лево-правосторонней асимметрии в регуляции сосудистого тонуса симметричных областей парных органов в условиях изменения артериального давления (АД). Измерения показателей МЦР проводили у 5 здоровых добровольцев от 50 до 70 лет методом лазерной допплеровской флоуметрии (ЛДФ) с помощью прибора ЛАКК-02 НПП ЛАЗМА-двухканальный. Датчики ЛДФ-сигнала устанавливали на симметричных сторонах нижних частей правого и левого плеча в точках, расположенных на 3 см выше локтевого сгиба. Оценивали значения показателей МЦР (перфузии) и составляющих частотного спектра: нейрогенной, миогенной дыхательной и сердечной, а также корреляционные взаимосвязи между показателями левой и правой сторон измерения. Результаты корреляционного анализа выявили наличие лево-правосторонней асимметрии в регуляции показателей МЦР, не связанную c величиной артериального давления. Невысокие значения коэффициентов корреляции между показателями МЦР и АД, полученные в ходе настоящего исследования, указывают на отсутствие линейных регрессионных зависимостей между этими величинами, но не исключают наличие нелинейных взаимосвязей между ними.
Несмотря на значительный прогресс в изучении различных сердечно-сосудистых заболеваний, физиологические механизмы регуляции артериального давления (АД) и возникновения артериальной гипертензии (АГ) до сих пор окончательно не выяснены. В то же время известно [1–3], что формирование и протекание различных форм АГ не может осуществляться без участия изменений в системе МЦР. Показано [3], что ключевым звеном в регуляции показателей МЦР является периферическое сосудистое сопротивление, изменения которого приводят к возрастанию или снижению АД. Кровоток в микроциркуляторном русле подвержен спонтанным флуктуациям, поэтому для анализа временных рядов, описывающих динамику процессов МЦР, применяются методы корреляционно-спектрального анализа, позволяющие дифференцировать вклад в общую спектральную мощность составляющих регуляции сосудистого тонуса различной природы: эндотелиальной, нейрогенной, миогенной и других [4, 5]. С помощью этих методов были выявлены корреляционные взаимосвязи между различными составляющими регуляции сосудистого тонуса симметричных областей парных органов млекопитающих и установлено наличие феномена функциональной асимметрии в регуляции МЦР [6–10]. Несмотря на большое количество публикаций, касающихся изучения показателей МЦР у больных АГ [11–14], особенности проявления функциональной асимметрии в регуляции микрокровотока парных органов и их взаимосвязи с АД до сих пор мало изучены. Поэтому целью настоящей работы явилось изучение корреляционных взаимосвязей между показателями МЦР сосудов симметричных органов в условиях изменения АД.
МЕТОДЫ ИССЛЕДОВАНИЯ
Методом лазерной допплеровской флоуметрии (ЛДФ) измеряли показатели МЦР у 5 здоровых добровольцев от 50 до 70 лет. Измерения проводили с помощью прибора ЛАКК-02 НПП ЛАЗМА-двухканальный. Датчики ЛДФ фиксировались на наружной поверхности симметричных областей нижних частей правого и левого плеча в точках, расположенных на 3 см выше локтевого сгиба. Синхронные измерения показателей МЦР слева и справа проводили в дневное время 5 раз в сутки через каждые 3 ч в течение 5 дней (общий объем выборки n = 125 измерений). Записи ЛДФ-сигнала проводилась с частотой 20 Гц в течение 2 мин с интервалом отсчетов 0.05 с. Математическая обработка результатов измерений включала в себя как оценку статистических параметров МЦР каждого фрагмента (среднего значения перфузии PM, стандартного отклонения (σ) и коэффициента вариации KV = = (σ/ПМ)100%), так и оценку показателей амплитудно-частотного спектра колебаний, отражающих выраженность различных составляющих спектра [4]: нейрогенного N (0.02–0.06 Гц), миогенного M (0.06–0.15 Гц), дыхательного R (0.15–0.4 Гц) и сердечного C (0.4–1.6 Гц). Расчеты всех показателей МЦР проводились в условных (перфузионных) единицах с помощью программного обеспечения, прилагаемого к ЛДФ-анализатору. Далее проводили множественный корреляционный анализ сопряженности между показателями МЦР симметричных областей. Степень сопряженности между признаками оценивали по величине коэффициента корреляции (r). Принималась, что при |r| < 0.3 степень связи практически отсутствует; при 0.3 < |r| < 0.5 имеет место слабая степень связи; при 0.5 < |r| < 0.7 – умеренная степень связи; при 0.7 < |r| < 1 – сильная степень связи. Синхронные измерения систолического и диастолического АД проводили с помощью прибора DIGITAL BLOOD PRESSURE MONITIR UA-777 A&D Company Limited (Токио, Япония). Статистический и корреляционный анализ результатов измерений проводили с использованием стандартных статистических методов, входящих в пакеты прикладных программ Excel for Windows, v. 6.0. Проверка выборок на нормальность проводилась по критерию асимметрии и эксцесса. Оценка значимости различий между данными, полученными в исследуемых временных рядах, проводилась с использованием t-критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены временные ряды, отражающие динамику синхронных изменений АД, ЧСС, перфузии (PM) и коэффициентов вариации (KV) симметричных областей у одного из испытуемых.
Рис. 1.
Динамика изменения показателей гемодинамики и МЦР симметричных сторон измерения. A – динамика изменения диастолического AD, мм рт. ст. (синяя линия) и ЧСС (HR), уд/мин (красная линия). B – динамика изменения показателя микроциркуляции PM, усл. ед. C – динамика изменения коэффициента вариации (KV). Оси абсцисс – порядковый номер измерений. Fig. 1. Dynamics of changes in hemodynamic parameters and parameters of microcirculation of symmetric sides of measurement. A – dynamics of changes of arterial diastolic blood pressure AD, mm Hg (blue line) and heart rate, (HR, beats/min) (red line). B – dynamics of changes of the perfusion PM, conv. un. C – dynamics of changes of the coefficient of variation KV. The abscissa axis is the sequence number of measurements.
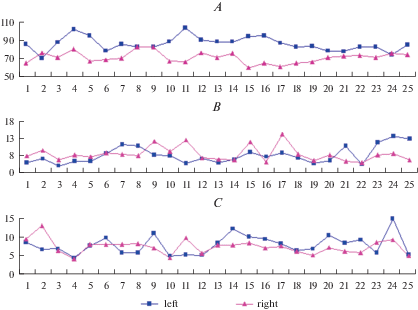
Можно видеть, что динамика изменений показателей МЦР слева и справа – это разные, взаимно не накладывающиеся стохастические процессы. Статистический анализ этих процессов, выполненный для всех 5 испытуемых, показал, что среднее значение величины PM справа (7.57 ± 0.94) достоверно не отличалось от этого показателя слева (7.28 ± 0.89). Аналогичное имело место и для коэффициента вариации: величина KV cправа составляла 7.56 ± 0.36, а слева 7.31 ± 0.51, разница не достоверна. Дальнейшие расчеты амплитудно-частотного спектра колебаний PM позволили оценить выраженность различных составляющих спектра симметричных областей. Оценивали максимальные амплитуды нейрогенного, миогенного, дыхательного и сердечного ритмов. На рис. 2 показаны временные ряды, отражающие динамику синхронных изменений амплитуд различных частотных составляющих спектра PM симметричных областей у одного из испытуемых. Можно видеть, что в целом динамика изменения всех показателей носит стохастический характер, поэтому для выявления особенностей лево-правосторонней асимметрии и взаимоотношений между различными составляющими спектра необходим более детальный математический анализ. В табл. 1 представлены результаты статистического анализа этих временных рядов у всех 5 испытуемых (объем выборки n = 125 измерений). Из этой таблицы можно видеть, что средние значения амплитуд нейрогенного, миогенного, дыхательного и сердечного ритмов справа были немного выше, чем слева, но эта разница не достоверна.
Рис. 2.
Временные ряды, отражающие динамику изменения различных составляющих спектра МЦР симметричных сторон измерения. A – динамика изменения амплитуды нейрогенной (N) компоненты спектра МЦР. B – динамика изменения амплитуды миогенной (M) компоненты спектра МЦР. C – динамика изменения амплитуды дыхательной (R) компоненты спектра МЦР. D – динамика изменения амплитуды сердечной (C) компоненты спектра МЦР. Оси ординат – значения показателей (усл. ед); оси абсцисс – порядковый номер измерений. Fig. 2. Time series, reflecting the dynamics of changes in the various components of the spectrum of microcirculation of symmetric sides of measurement. A – dynamics of changes in the amplitude of the neurogenic (N) component of the MCR spectrum. B – dynamics of changes in the amplitude of the myogenic (M) component of the MCR spectrum. C – dynamics of changes in the amplitude of the respiratory (R) component of the MCR spectrum. D – dynamics of changes in the amplitude of the cardiac (C) component of the MCR spectrum. Axes ordinate-values of indicators (conv. un.); The abscissa axis is the sequence number of measurement.
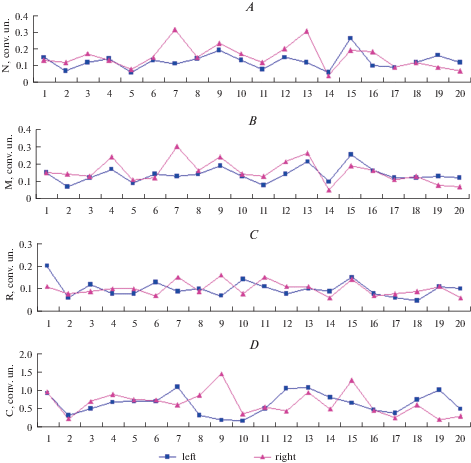
Таблица 1.
Средние значения показателей МЦР (M ± m) симметричных областей Table 1. The average values of the MCR (M ± m) symmetric areas
| Показатель (усл.ед.) Parameter (conv.un.) |
Слева Left (M ± m) |
Справа Right (M ± m) |
|---|---|---|
| Перфузия Perfusion (PM) |
7.28 ± 0.89 | 7.57 ± 0.94 |
| Коэффициент вариации The coefficient of variation (KV) |
7.31 ± 0.51 | 7.56 ± 0.36 |
| Нейрогенная компонента спектра Neurogenic component of the spectrum (N) |
0.12 ± 0.01 | 0.15 ± 0.01 |
| Миогенная компонента спектра Myogenic component of the spectrum (M) |
0.16 ± 0.03 | 0.17 ± 0.02 |
| Респираторная компонента спектра Respiratory component of the spectrum (R) |
0.09 ± 0.02 | 0.10 ± 0.01 |
| Сердечная компонента спектра Cardiac component of the spectrum (C) |
0.49 ± 0.17 | 0.61 ± 0.01 |
Дальнейший анализ был направлен на выявление корреляционных взаимоотношений между амплитудами нейрогенного, миогенного, дыхательного и сердечного ритмов симметричных областей. Результаты расчетов представлены в табл. 2.
Таблица 2.
Коэффициенты корреляции между показателями гемодинамики (артериальное давление, AD, мм рт. ст. и ЧСС, уд/мин) и показателями МЦР симметричных областей (перфузии (PM), коэффициента вариации (KV), нейрогенной (N), миогенной (M), респираторной (R) и сердечной (C) компонент спектра), n = 125 Table 2. Correlation coefficients between hemodynamic parameters (blood pressure (AD, mmHg) and heart rate (HR, b/min)) and MCR parameters of symmetric regions (perfusion (PM), coefficient of variation (KV), neurogenic (N), myogenic (M), respiratory (R) and cardiac (C) components of the spectrum), n = 125
| Показатель Index | AD | HR | PM Лев Left |
KV Лев Left |
N Лев Left |
M Лев Left |
R Лев Left |
C Лев Left |
PM Пр Right |
KV Пр Right |
N Пр Right |
M Пр Right |
R Пр Right |
C Пр Right |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AD | 1.00 | –0.16 | –0.09 | –0.23 | –0.31 | 0.18 | 0.18 | –0.05 | 0.09 | –0.05 | 0.18 | 0.25 | –0.19 | 0.07 |
| HR | –0.16 | 1.00 | 0.28 | 0.17 | –0.41 | –0.33 | 0.17 | –0.12 | –0.17 | 0.17 | 0.51* | 0.13 | 0.11 | 0.25 |
| PM Лев Left |
–0.09 | 0.28 | 1.00 | 0.21 | 0.09 | 0.05 | 0.38 | 0.51* | 0.12 | –0.05 | 0.05 | 0.03 | 0.18 | 0.01 |
| KV Лев Left |
–0.23 | 0.17 | 0.21 | 1.00 | 0.49 | 0.45 | 0.11 | 0.76** | 0.04 | 0.26 | 0.51* | 0.33 | 0.34 | 0.08 |
| N Лев Left |
0.04 | –0.41 | 0.09 | 0.49 | 1.00 | 0.71** | 0.26 | 0.36 | 0.36 | 0.25 | 0.39 | 0.32 | 0.45 | 0.36 |
| M Лев Left |
–0.1 | –0.33 | 0.05 | 0.45 | 0.71** | 1.00 | 0.2 | 0.55* | 0.52* | 0.31 | 0.57* | 0.55* | 0.46 | 0.53* |
| R Left Лев |
0.18 | 0.17 | 0.38 | 0.11 | 0.26 | 0.20 | 1.00 | 0.37 | 0.29 | –0.17 | 0.2 | 0.01 | 0.36 | 0.25 |
| C Лев Left |
–0.05 | –0.12 | 0.51* | 0.76** | 0.36 | 0.55* | 0.37 | 1.00 | 0.28 | 0.38 | 0.34 | 0.42 | 0.46 | 0.21 |
| PM Пр Right |
–0.05 | –0.17 | 0.12 | 0.04 | 0.36 | 0.52* | 0.29 | 0.28 | 1.00 | 0.34 | 0.74** | 0.73** | 0.73** | 0.61* |
| KV Пр Right |
–0.05 | 0.17 | –0.05 | 0.26 | 0.25 | 0.31 | –0.17 | 0.38 | 0.34 | 1.00 | 0.35 | 0.55* | 0.39 | 0.68* |
| N Пр Right |
0.18 | 0.51* | 0.05 | 0.51* | 0.39 | 0.57* | 0.20 | 0.34 | 0.74** | 0.35 | 1.00 | 0.72** | 0.58* | 0.38 |
| M Пр Right |
0.13 | 0.13 | 0.03 | 0.33 | 0.32 | 0.55* | 0.01 | 0.42 | 0.73** | 0.55* | 0.72** | 1.00 | 0.65* | 0.72** |
| R Пр Right |
–0.19 | 0.11 | 0.18 | 0.34 | 0.45 | 0.46 | 0.36 | 0.46 | 0.73** | 0.39 | 0.58* | 0.65* | 1.00 | 0.57* |
| C Пр Right |
0.07 | 0.25 | 0.01 | 0.08 | 0.36 | 0.53* | 0.25 | 0.21 | 0.61* | 0.68* | 0.38 | 0.72** | 0.57* | 1.00 |
| 0 < |r| < 0.5 | * | 0.5 < |r| < 0.7 | ** | 0.7 < |r| < 1 | ||||||||||
Из этой таблицы можно видеть, что величины PM справа и слева по-разному коррелируют с другими показателями. Так, для среднего значения перфузии PM справа, достоверно значимая (|r| > 0.5) степень связи была выявлена с нейрогенной, миогенной, дыхательной и сердечной компонентами той же стороны измерения. В то же время для среднего значения PM слева достоверно значимая степень связи была выявлена только с сердечной компонентой спектра той же стороны измерения. Миогенная компонента спектра слева положительно коррелирует с сердечной компонентой той же стороны, а также с миогенной и нейрогенной компонентами противоположной стороны измерения. Если между миогенной компонентой спектра слева и средним значением PM той же стороны измерения достоверной корреляционной взаимосвязи не обнаружено, то для правой стороны наблюдалось противоположное: между величинами Mпр и PMправ выявлена высокая степень корреляции (r = 0.73). Нейрогенная компонента спектра также характеризовалась лево-правосторонней асимметрией: если Nлев положительно коррелировала с миогенной компонентой той же стороны (r = 0.71), то Nправ коррелировала с миогенной компонентой противоположной стороны (r = 0.57). Относительно корреляционных связей нейрогенной компоненты с величиной среднего значения PM также была выявлена асимметрия: справа между Nпр и PMпр наблюдалась сильная корреляционная связь (r = 0.74), а слева аналогичная взаимосвязь практически отсутствовала (r = 0.09). Асимметрия была выявлена и по отношению к дыхательной компоненте спектра: если величина дыхательной компоненты спектра справа коррелировала положительно со средним значением PM, нейрогенной, миогенной и сердечной компонентой той же стороны, то аналогичные корреляции слева были не достоверны. Асимметрия отмечалась и по отношению к взаимосвязи между сердечной и дыхательной компонентами спектра: выявлена корреляционная взаимосвязь между этими показателями справа (r > 0.5) и не обнаружено аналогичных достоверных взаимосвязей слева. Между показателями МЦР симметричных областей и величиной АД достоверных корреляционных связей не выявлено. В то же время между ЧСС и нейрогенной компонентой спектра корреляционная связь характеризовалась асимметрией: справа имела место положительная корреляция, а слева – слабая отрицательная корреляция. Представленные в табл. 2 корреляционные взаимосвязи характеризуют регуляторные процессы, отраженные в динамике изменения индивидуальных характеристик МЦР, измеренных в разные временные периоды, т.е. временных рядах, изображенных на рис.2. Результаты корреляционного анализа этих временных рядов выявили наличие лево-правосторонней асимметрии в регуляции показателей МЦР и не выявили достоверных корреляционных взаимосвязей между этими показателями и величиной АД.
Имеющиеся в литературе данные относительно корреляционных взаимосвязей между АД и показателями МЦР противоречивы. В работе [3] показано, что у больных с АГ отмечается увеличение PM и увеличение амплитуд высокочастотных гармоник в спектре, что рассматривается как компенсаторное усиление парасимпатических влияний в регуляции кровотока. Однако авторы работы [2] показали, что у здоровых пациентов и больных АГ показатели МЦР не имели статистически значимых отличий. В работе [12] авторы изучали показатели МЦР подъязычной области у здоровых испытуемых и больных АГ различного возраста. Результаты исследований показали, что у больных АГ снижены показатели PVD (perfused vessel density) и TVD (total vessel density), но достоверных различий между остальными показателями МЦР здоровых пациентов и пациентов с АГ не обнаружено. Что касается корреляционных взаимосвязей между величиной АД и показателями МЦР симметричных органов, то до настоящего времени в клинической практике эти вопросы мало изучены. Вместе с тем, в экспериментах на животных было показано наличие феномена лево-правосторонней асимметрии в регуляции показателей МЦР [6–9], в том числе и в условиях снижения системного АД. Так, в работе [7] на основании данных ЛДФ было установлено, что при снижении АД кровоток в микроциркуляторном русле парных защечных мешков хомячка уменьшается, причем относительно исходного уровня снижение ПМ было более выражено слева. Авторы этой работы высказывают предположение, что одной из причин резкого снижения кровотока в МЦР слева является уменьшение числа функционирующих капилляров, которые чувствительны к изменению АД, и снижение скорости кровотока в венулах, вероятность расширения которых более выражена для МЦР слева, как показано при биомикроскопии русла в условиях снижения системного давления [15]. Результаты проведенных нами исследований показали, что числовые значения коэффициентов корреляции между величиной АД и параметрами МЦР находились в диапазоне 0 < r < 0.5, сильных корреляционных взаимосвязей нами не обнаружено. Однако невысокие значения коэффициентов корреляции между показателями МЦР и АД указывают только на отсутствие линейных регрессионных зависимостей между этими величинами, но не исключают наличие нелинейных взаимосвязей между ними. Экспериментальные исследования, выполненные на животных, указывают на наличие именно нелинейных взаимосвязей между АД и показателями скорости кровотока в сосудах левого и правого кровеносного русла. Так, в работе Ногиной и соавт. [16] проведены синхронные регистрации величин объемной скорости кровотока в симметричных областях правой и левой общих сонных артериях головного мозга кошки в условиях изменения величины АД. Исследования показали, что при низких значениях АД объемная скорость кровотока в правой артерии выше, чем в левой, при высоких значениях АД обе эти величины сравниваются, а в диапазоне средних значений АД существует точка, где объемные скоростьи кровотока справа и слева равны. Причем, левое и правое кровеносное русло имеют различные типы регуляторных процессов: слева они описываются параболической зависимостью, а справа синусоидальной. Подобные нелинейные процессы не могут иметь значимые корреляционные взаимосвязи, т.к. при вычислении коэффициента корреляции суммирование происходит по всей выборке значений АД от самых низких до самых высоких. Учитывая, что локальные значения величин коэффициентов корреляции, измеренные в различных диапазонах изменения АД, различны не только по величине, но и по знаку, суммирование по всей выборке всегда будет иметь итогом невысокие значения коэффициентов корреляции, что говорит об отсутствии линейных регрессионных зависимостей исследуемых параметров кровотока от АД. Поэтому результаты проведенных нами исследований свидетельствуют о том, что взаимосвязь между параметрами МЦР симметричных областей АД нелинейная. Экспериментальное изучение этих взаимосвязей может быть выполнено только путем формирования репрезентативных групп испытуемых отдельно на каждом локальном диапазоне изменений величины АД, начиная от крайней левой границы этого диапазона (низкие значения АД, гипотоники), и кончая крайней правой границы (высокие значения АД, гипертоники). Результаты проведенных нами исследований согласуются с предположением, высказанном авторами работы [16], о том, что определяющую роль в регуляции сосудистых функций играют не местные регуляторные влияния на сосуды, а системные ауторегуляторные процессы, обеспечивающие устойчивость функционирования целостной гемодинамической системы. Дальнейшие исследования механизмов системной регуляции сосудистых функций и роли функциональной асимметрии в поддержании устойчивости гемодинамических показателей важны не только для фундаментальной физиологии, но и для практической медицины.
Список литературы
Абрамович С.Г., Машанская А.В. Лазерная допплеровская флоуметрия в оценке микроциркуляции у здоровых людей и больных артериальной гипертонией. Сибирский мед. журн. (Иркутск). 92(1): 57–59. 2010. [Abramovich S.G., Mashanskaya A.V. Laser Doppler flowmetry in the assessment of microcirculation in healthy people and patients with arterial hypertension. Siberian Med. J. 92(1): 57–59. 2010. (In Russ)].
Васильев А.П., Стрельцова Н.Н., Секисова М.А. Варианты функциональной организации микроциркуляции кожи у больных артериальной гипертонией по результатам лазерной допплеровской флоуметрии. Рос. кардиол. журн. 4(120): 7–12. 2015. [Vasiliev A.P., Streltsova N.N., Sekisova M.A. Variants of functional organization of skin microcirculation in patients with arterial hypertension based on the results of laser Doppler flowmetry. Russ. J. Gardiol. 4 (120): 7–12. 2015 (In Russ)].
Козлов В.И., Азизов Г.А. Механизм модуляции тканевого кровотока и его изменение при гипертонической болезни. Регионарное кровообращение и микроциркуляция. 4(8): 53–59. 2003. [Kozlov V.I., Azizov G.A. The mechanism of modulation of tissue blood flow and its change in hypertension. Regionarnoe krovoobrachenie i micricirculacia. 4(8): 53–59. 2003. (In Russ)].
Крупаткин А.И., Сидоров В.В. Лазерная допплеровская флоуметрия микроциркуляции крови: руководство для врачей. М. Медицина. 2005. [Krupatkin A.I., Sidorov V.V. Laser Doppler flowmetry of blood microcirculation: a guide for doctors. Moscow. Medicine. 2005. (In Russ)].
Kvandal P., Landsverk S.A., Bernjak A., Stefanovska A., Kvernmo H.D., Kirkebøen K.A. Low-frequency oscillations of the laser Doppler perfusion signal in human skin. Microvasc. Res. 72 (3): 120–127. 2006. https://doi.org/10.1016/j.mvr.2006.05.006
Михайличенко Л.А. Эндотелиальный компонент в механизмах регуляции тонуса сосудов парных образований по данным лазерной допплеровской флоуметрии. Регионарное кровообращение и микроциркуляция. 28(4): 71–79. 2008. [Mikhailichenko L.A. Endothelial component in mechanisms of regulation of a tone of vessels of pair formations according to laser Doppler flowmetry. Regionarnoe krovoobrachenie i micricirculacia. 28(4): 71–79. 2008. (In Russ)].
Mikhailichenko L.A. Parameters of microcirculation in hamster buccal pouches under conditions of reduced systemic blood pressure. Bull. Exp. Biol. Med. 145(1): 23–28. 2008.
Михайличенко Л.А, Мезенцева Л.В. Корреляционно-спектральный анализ регуляторных механизмов тонуса сосудов парных образований в постнатальном онтогенезе крыс. Бюл. экспер. биол. и мед. 158(9): 287–293. 2014. [Mikhailichenko L.A., Mezentseva L.V. Correlation and spectral analysis of the regulation mechanisms of vessel tone of pair formations in postnatal ontogenesis in rats. Bull. Exp. Biol. Med. 145(1): 23–28. 2008. (In Russ)].
Mezentseva L.V., Pertsov S.S., Hugaeva V.K. A Comparative Analysis of the Persistence of Capillary Blood Flow Oscillations in the Left and Right Rat Kidneys. Biophysics. 61(4): 656–660. 2016.
Guzik P., Piskorski J., Krauze T., Narkiewicz K., Wykretowicz A., Wysocki H. Asymmetric features of short-term blood pressure variability. Hypertens. Res. 33(11): 1199–205. 2010. https://doi.org/10.1038/hr.2010.138
Tsioufis C., Dimitriadis K., Katsiki N., Tousoulis D. Microcirculation in Hypertension: An Update on Clinical Significance and Therapy. Curr. Vasc. Pharmacol. 13 (3): 413–417. 2015.
Kanoore Edul V.S., Ince C., Estenssoro E., Ferrara G., Arzani Y., Salvatori C., Dubin A. The Effects of Arterial Hypertension and Age on the Sublingual Microcirculation of Healthy Volunteers and Outpatients with Cardiovascular Risk Factors. Microcirculation. 22(6): 485–92. 2015. https://doi.org/10.1111/micc.12219
Bruno R.M., Masi S., Taddei M., Taddei S., Virdis A. Essential Hypertension and Functional Microvascular Ageing. High Blood Press. Cardiovasc. Prev. 25(1): 35–40. 2018. https://doi.org/10.1007/s40292-017-0245-9
De Moraes R., Tibirica E. Early Functional and Structural Microvascular Changes in Hypertension Related to Aging. Curr. Hypertens. Rev. 13(1): 24–32. 2017. https://doi.org/10.2174/1573402113666170413095508
Михайличенко Л.А., Тимкина М.И. Микрососуды защечных мешков хомячка в условиях снижения системного давления. Бюл. экспер. биол. и мед. 138(12): 617–621. 2004. [Mikhailichenko L.A., Timkina M.I. Microvessels in cheek pouches of a hamster under declining systemic pressure. Bull. Exp. Biol. Med. 138 (12): 617–621. 2004. (In Russ)].
Ногина С.П., Саноцкая Н.В., Мациевский Д.Д. Особенности гемодинамического режима в правой и левой общих сонных артериях кошки. Бюл. экспер. биол. мед. 105 (4): 414–417. 1988. [Nogina S.P., Sanotskaya N.V., Matsievsky D.D. Haemodynamic Regtimes in the common right and left carotid arteries in cats. Bull. Exp. Biol. Med. 105(4): 414–417. 1988. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


