Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 7, стр. 795-810
Ангиотензин-превращающий фермент 2-го типа, как молекулярный посредник для инфицирования клетки вирусами SARS-CoV и SARS-CoV-2
А. О. Шпаков *
Институт эволюционной физиологии и биохимии им. И.М. Сеченова Российской академии наук
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 10.04.2020
После доработки 21.04.2020
Принята к публикации 21.04.2020
Аннотация
Для проникновения коронавируса SARS-CoV-2 (Severe Acute Respiratory Syndrome-CoronaVirus-2), возбудителя пандемии COVID-19, в клетку необходимо взаимодействие поверхностного шиповидного S-белка этого вируса с внеклеточным доменом мембранно-связанной формы ангиотензин-превращающего фермента 2-го типа (ACE2). Этот фермент, ключевое звено ренин-ангиотензиновой системы, отвечает за синтез ангиотензина-(1–7), наделенного вазодилаторными и противовоспалительными свойствами, из ангиотензина-II, мощного вазоконстриктора, синтез которого катализируется ангиотензин-превращающим ферментом (ACE), функциональным антагонистом ACE2. После сайт-специфичного гидролиза, осуществляемого локализованной в инфицируемой клетке трансмембранной сериновой протеазой TMPRSS2, вирусный S-белок специфично связывается с ACE2, что является триггером интернализации вируса в клетку путем эндоцитоза. Подавление этого процесса с помощью препаратов, ингибирующих протеазу TMPRSS2 и нарушающих взаимодействие S-белка с ACE2, позволяет предотвратить инфицирование и, тем самым, является перспективным подходом для лечения и профилактики COVID-19. Сходный механизм проникновения в клетку использует и вирус SARS-CoV, возбудитель атипичной пневмонии, родственный SARS-CoV-2. При лечении пациентов с артериальной гипертензией и сахарным диабетом с помощью ACE-ингибиторов, блокаторов ангиотензиновых рецепторов, статинов и некоторых антидиабетических препаратов экспрессия и активность ACE2, как правило, повышаются, что увеличивает риск заражения SARS-CoV-2 и ухудшает исход заболевания. В процессе инфицирования вирус, образуя комплекс с ACE2, снижает количество ACE2 на поверхности клеток, нарушает зависимые от ACE2 физиологические процессы, и это является одной из причин острого респираторного дистресс-синдрома и сердечной недостаточности у больных COVID-19. В настоящем обзоре анализируется функциональная роль ACE2 в инфицировании клеток вирусами SARS-CoV-2 и SARS-CoV, а также обсуждаются молекулярные механизмы этого процесса и его патофизиологические последствия.
ВВЕДЕНИЕ
В декабре 2019 года в городе Ухань (КНР) была зарегистрирована новая коронавирусная инфекция, которая в дальнейшем стала стремительно распространяться по миру. 11 февраля 2020 года возбудитель этой инфекции был классифицирован Всемирной Организацией Здравоохранения как SARS-CoV-2 (Severe Acute Respiratory Syndrome-CoronaVirus-2), а само заболевание как COVID-19 [1]. Коронавирус SARS-CoV-2 размером 30 kb, представляет собой одноцепочечный РНК-содержащий вирус, который относится к семейству Coronaviridae. В его геноме закодированы четыре структурных белка – мембранный белок M, белок оболочки E, нуклеокапсидный белок N, а также относящийся к гликопротеинам шиповидный белок S (spike), который выступает над поверхностью вирусного капсида, образуя структуры наподобие “шипиков”, предназначенные для контакта с поверхностью клетки-хозяина [2]. Острая респираторная инфекция, вызываемая вирусом SARS-CoV-2, характеризуется сравнительно высокой смертностью среди пожилого населения (старше 60 лет), а также среди пациентов, страдающих заболеваниями сердечно-сосудистой системы, болезнями почек, сахарным диабетом, онкологическими и аутоиммунными заболеваниями [3–6]. Основываясь на имеющихся в настоящее время эпидемиологических данных, имеются основания считать, что по тяжести симптомов и уровню смертности инфекция, вызываемая SARS-CoV-2, по краней мере, не превосходит таковые, вызываемые родственным вирусом SARS-CoV, который стал причиной эпидемии в 2003 году. Однако широкое распространение вируса SARS-CoV-2, которое в настоящее время приобрело характер пандемии, и более быстрая, в сравнении с SARS-CoV, передача возбудителя от человека к человеку со сравнительно высоким репродуктивным числом создают высокие риски для здоровья людей во всех странах мира. Это ставит перед специалистами в области медицины, биологии и смежных наук задачу в самые сжатые сроки расшифровать молекулярные механизмы инфицирования клеток вирусом SARS-CoV-2, а также разработать эффективные подходы для лечения COVID-19.
Наибольший интерес представляют данные о том, что для эффективного проникновения в инфицированную клетку вирусу SARS-CoV-2 необходимо “содействие” одного из ключевых ферментов ренин-ангиотензиновой системы – ангиотензин-превращающего фермента 2-го типа (ACE2). Это хорошо согласуется с тем, что в наибольшей степени от COVID-19 страдают пожилые люди и пациенты с хроническими заболеваниями сердца и почек и сахарным диабетом, которые длительное время получают лечение антигипертензивными и антидиабетическими препаратами. У этих пациентов отмечаются наиболее выраженные изменения экспрессии и активности ACE2, которые, как правило, повышаются в результате проводимой фармакотерапии [7, 8]. В связи с этим развернута широкая дискуссия о том, как учесть фактор изменчивости экспрессии ACE2 у пациентов с диабетом и сердечно-сосудистой патологией при оценке рисков их заражения вирусом SARS-CoV-2 и при прогнозировании течения и исхода COVID-19, а также о том, как терапия этих пациентов с помощью ингибиторов ангиотензин-превращающего фермента (ACE), блокаторов рецептора 1-го типа ангиотензина-II (AT1R), статинов, антидиабетических препаратов может повлиять на ACE2-опосредуемое их инфицирование вирусом SARS-CoV-2. Необходимо отметить, что вирус SARS-CoV, имеющий черты сходства с SARS-CoV-2, для проникновения в клетку хозяина также использует ACE2 [9–11]. Это указывает на то, что наработки по взаимодействию вируса SARS-CoV с ферментом ACE2, которые были сделаны ранее, еще задолго до пандемии COVID-19, могут быть успешно использованы для расшифровки молекулярных механизмов проникновения в клетку нового коронавируса SARS-CoV-2, что собственно уже взято на вооружение вирусологами и молекулярными биологами, пытающимися сдержать пандемию COVID-19 [12, 13]. Обсуждению этих вопросов и посвящен настоящий обзор. Однако сначала кратко остановимся на структурно-функциональной организации ренин-ангиотензиновой системы, а также на структуре и регуляторных свойствах ангиотензиновых рецепторов и нижележащих сигнальных каскадах и мишенях.
РЕНИН-АНГИОТЕНЗИНОВАЯ СИСТЕМА И АНГИОТЕНЗИНОВЫЕ РЕЦЕПТОРЫ
Ренин-ангиотензиновая система включает ферменты с протеолитической активностью, вовлеченные во взаимопревращения пептидов ангиотензинового семейства, сами ангиотензиновые пептиды, их рецепторы и сопряженные с ними внутриклеточные сигнальные каскады и эффекторы (рис. 1).
Рис. 1.
Роль протеазы TMPRSS2, ACE2 и компонентов ангиотензинового пути в проникновении вируса SARS-CoV-2 в клетку. Условные обозначения: TMPRSS2 – трансмембранная сериновая протеаза (transmembrane protease, serine 2); ACE – ангиотензин-превращающий фермент; ACE2 – ангиотензин-превращающий фермент 2-го типа; AT1R – рецептор 1-го типа ангиотензина-II; AGT – ангиотензиноген; ANG-I – ангиотензин-I; ANG-II – ангиотензин-II; ANG-(1–7) – ангиотензин-(1–7); Gq/11 – гетеротримерный Gq/11-белок; PKC – протеинкиназа С; S1, S2 – субдомены S1 и S2 в поверхностном шиповидном вирусном S-белке. Fig. 1. The role of the protease TMPRSS2, ACE2 and angiotensin pathway components in the penetration of the SARS-CoV-2 virus into the cell. Abbreviations: TMPRSS2 – transmembrane serine protease (transmembrane protease, serine 2); ACE – angiotensin-converting enzyme; ACE2 – type 2 angiotensin-converting enzyme; AT1R – angiotensin-II receptor of the type 1; AGT – angiotensinogen; ANG-I – angiotensin-I; ANG-II - angiotensin-II; ANG-(1–7) – angiotensin-(1–7); Gq/11 – heterotrimeric Gq/11 protein; PKC – protein kinase C; S1, S2 – the subdomains S1 and S2 in the surface spike viral protein S.
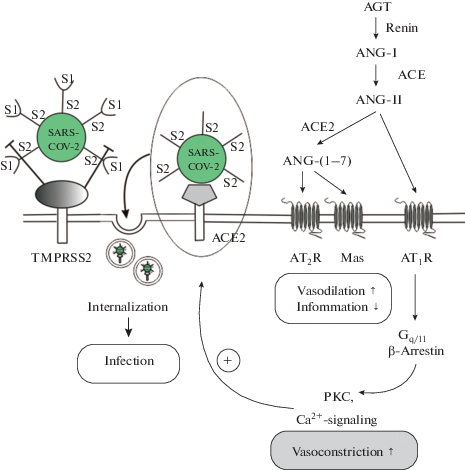
Первую стадию превращений пептидов ангиотензинового семейства осуществляет ренин, фермент с протеолитической активностью, который отщепляет от молекулы ангиотензиногена (AGT), имеющего длину 153 аминокислотных остатка, N-концевой декапептид, соответствующий ангиотензину-I (ANG-I) [14]. AGT относят к семейству ингибиторов сериновых протеаз (серпинов), причем активность AGT во многом зависит от степени его гликозилирования [15]. Превращение ANG-I в ANG-II осуществляет фермент ACE, представляющий собой связанную с мембраной цинк- и хлорид-зависимую дипептидилкарбоксипептидазу (EC.3.4.15.1), каталитический сайт которой расположен во внеклеточном пространстве. Этот фермент является мишенью для большого числа ACE-ингибиторов, фармакологические эффекты которых направлены на ослабление артериальной гипертензии [16].
Экзопептидаза АCE2 (EC.3.4.17.23), осуществляющая превращение ANG-II до ANG-(1–7) и ANG-I до ANG-(1–9), несмотря на заметный уровень гомологии с ферментом ACE (около 40% идентичных и 60% сходных по физико-химическим характеристикам аминокислотных остатков), имеет противоположную по отношению к нему функциональную активность, поскольку предотвращает вазоконстрикторные эффекты ANG-II и, напротив, усиливает противодействующие им вазодилаторные эффекты пептидов ANG-(1–7) и ANG-(1–9) [17–20]. В отличие от ACE, фермент АCE2 является монокарбоксипептидазой и характеризуется сравнительно низкой специфичностью, гидролизуя не только ангиотензиновые пептиды, но также апелин, опиоидные пептиды и кинины. Ингибиторы ACE не влияют на каталитическую активность AСE2, поскольку в области каталитических и аллостерических сайтов, мишеней этих ингибиторов, молекулы ACE и ACE2 существенно различаются. Имеются две формы ACE2 – функционально активная мембранно-связанная форма, которая, наряду с N-концевым каталитическим эктодоменом, включает трансмембранный домен и небольшой по размеру цитоплазматический домен, и растворимая форма, соответствующая N-концевому эктодомену, которая генерируется путем отщепления внеклеточной части молекулы ACE2 от ее трансмембранного домена [17]. Этот процесс осуществляется значительной по размеру мембранно-связанной протеазой ADAM17 [21–23]. Протеаза ADAM17 представляет собой трансмембранный белок I-го типа и содержит несколько функциональных доменов – (1) N-концевой домен, который выполняет функцию “внутреннего” блокатора протеазной активности, (2) металлопротеазный (каталитический) домен, (3) дезинтегриновый домен, (4) обогащенный остатками цистеина проксимальный к мембране домен, (5) трансмембранный домен и (6) небольшой цитоплазматический участок [24]. По топологии в плазматической мембране оба фермента, ACE2 и ADAM17, сходны между собой. Сравнительно высокий уровень экспрессии ACE2 и ADAM17 обнаружен в сердце, легких, почках, мозге и семенниках, в то время как в других тканях он ниже или незначителен. Эти данные указывают на неравномерное распределение экспрессии и активности этих ферментов в различных органах и тканях и на тесную взаимосвязь между ними [17, 24]. Следует, однако, отметить, что протеаза ADAM17, помимо ACE2, контролирует активность еще множества других белков, компонентов сигнальных и эффекторных систем [24].
Основными мишенями ANG-II являются два подтипа G-белок-сопряженных рецепторов – AT1R и AT2R, которые сильно различаются как по спектру регулируемых через них сигнальных каскадов, так и по физиологическим ответам [25–27]. При этом AT2R может модулировать функциональную активность AT1R, образуя с ним гетеродимерный рецепторный комплекс [28, 29], а также подавлять активность пострецепторных звеньев AT1R-активируемых сигнальных каскадов [30].
Связывание рецептора AT1R с агонистами приводит к стимуляции гетеротримерного Gq/11-белка, который активирует фосфоинозитид-специфичную фосфолипазу Cβ. Результатом этого является образование инозитол-1, 4, 5-трифосфата, который, активируя специфичные к нему внутриклеточные рецепторы, стимулирует высвобождение Ca2+ из внутриклеточных депо, а также синтез диацилглицерола, который активирует форбол-чувствительные изоформы протеинкиназы C (PKC) [26, 31]. Наряду с этим, AT1R-агонисты активируют регуляторные белки β-аррестины, стимулируя каскад митогенактивируемых протеинкиназ (MAPK) и ряд других β-аррестин-зависимых путей [26, 32]. Важно отметить, что ANG-II-индуцированная активация ERK1/2, ключевых компонентов каскада MAPK, может осуществляться как с участием Gq/11-белков [33], так и независимо от G-белков, путем активации β-аррестинов [32, 34]. В отличие от AT1R, рецептор AT2R реализует свои эффекты по путям, независимым от G-белков и β-аррестинов, что не типично для “классических” G-белок-сопряженных рецепторов. Его эффекты, как отмечалось выше, могут реализовываться путем образования гетеродимерных комплексов с AT1R, Mas-рецептором и другими G-белок-сопряженными рецепторами. Наряду с этим, будучи активирован ANG-II, рецептор AT2R через неканонические каскады способен повышать активность различных изоформ NO-синтаз и активировать, тем самым, NO-зависимые пути, а также стимулировать MAPK- и 3-фосфоинозитидный пути [27, 29, 35, 36].
Ангиотензиновые пептиды ANG-(1–7) и его укороченный аналог ANG-(1–5) специфично взаимодействуют с G-белок-сопряженным Mas-рецептором, продуктом протоонкогена MAS1, через посредство которого они оказывают противовоспалительный, вазодилаторный и антифибротический эффекты на клетки-мишени [29, 37]. Если Mas-рецептор является функциональным антагонистом AT1R, то его основной лиганд пептид ANG-(1–7) – функциональным антагонистом ANG-II. Пептид ANG-(1–7) может быть получен гидролитическим расщеплением ANG-I или ANG-(1–9) с помощью неприлизина, но основной его пул получается в ходе катализируемого ACE2 гидролиза ANG-II [16].
ACE2-ОПОСРЕДУЕМЫЙ МЕХАНИЗМ ПРОНИКНОВЕНИЯ ВИРУСА SARS-COV В КЛЕТКУ
Как уже отмечалось, еще до появления SARS-CoV-2, при изучении родственного ему вируса SARS-CoV, возбудителя острого респираторного синдрома, была показана способность последнего использовать мембранно-связанную форму ACE2 для проникновения в клетку хозяина [9–11]. После установления взаимосвязи между проникновением SARS-CoV в клетки легких человека и присутствием в них ACE2 был выявлен протеолитический фермент, который необходим для такого проникновения. Им оказалась трансмембранная сериновая протеаза TMPRSS2 (transmembrane protease, serine 2), которая с высокой интенсивностью экспрессируется в эпителиальных клетках легких человека и способствует их инфицированию вирусом гриппа А и метапневмовирусом [38–41]. При изучении вируса гриппа А было показано, что протеаза TMPRSS2 расщепляет гликопротеид гемагглютенин его оболочки, в результате чего вирус гриппа А приобретает способность сливаться с мембраной клетки-хозяина и в дальнейшем путем эндоцитоза проникать внутрь клетки [38, 40]. В случае SARS-CoV, протеаза TMPRSS2 осуществляет частичный гидролиз поверхностного вирусного шиповидного белка S, тем самым, вызывая его праймирование, что индуцирует эффективное слияние вируса с плазматической мембраной и его интернализацию внутрь клетки хозяина [10]. Следует отметить, что репликация вирусов в клетках с повышенной экспрессией протеазы TMPRSS2 не сопровождается увеличением способности вируса к инфицированию и изменениями структуры вирусного белка S, что указывает на участие протеазы TMPRSS2 именно в процессе проникновения вируса через клеточную мембрану, а не в контроле его дальнейшей репликации [10].
В дальнейшем было показано, что протеаза TMPRSS2 способна не только расщеплять и активировать вирусный белок S, но и расщеплять мембранную форму ACE2, что также вносит определенный вклад в проникновение вируса SARS-CoV в клетку. Расщепление осуществляется по остаткам лизина и аргинина, расположенным в сегменте 697–716 ACE2. Сайты, мишени протеазы TMPRSS2, отличаются от таковых, по которым фермент расщепляется трансмембранной эктопротеазой ADAM17, вследствие чего и последствия такого расщепления различны. Так TMPRSS2-индуцированное расщепление ACE2 способствует инфицированию клетки вирусом, в то время как расщепление фермента с помощью ADAM17, напротив, этот процесс угнетает [11].
В 2005 году английскими учеными было установлено, что расщепление ACE2 с помощью протеазы ADAM17 приводит к появлению растворимой формы ACE2, которая специфически связывается с поверхностным белком S вируса SARS-CoV и, тем самым, препятствует его взаимодействию с мембранной формой ACE2, вовлеченной в инфицирование клетки-мишени [21]. Малые интерферирующие РНК, ингибирующие синтез ADAM17, подавляют процесс расщепления ACE2, в то время как повышенная экспрессия ADAM17, напротив, стимулирует его. Показано, что форболовый эфир – форбол-12-миристат-13-ацетат в клетках HEK-293 и Huh-7 с экспрессированной в них мембранно-связанной ACE2 стимулирует процесс ADAM17-индуцированного расщепления молекулы ACE2, причем селективные ингибиторы металлопротеиназы TAPI-1 и GM6001 предотвращают этот процесс. Эти данные свидетельствуют о том, что в процесс активации ADAM17 вовлечены сигнальные пути, реализуемые через форбол-чувствительные изоформы ПКС [21]. В дальнейшем было показано, что в нейронах и глиальных клетках мозга пациентов с гипертензией, у которых была повышена экспрессия и активность ACE2, повышалась и активность протеазы ADAM17. При этом активность ADAM17, а, следовательно, и накопление растворимых форм ACE2 повышались при ANG-II-индуцированной стимуляции рецептора AT1R [22]. Все это указывает на то, что ANG-II и другие AT1R-агонисты стимулирует сигнальный каскад, включающий AT1R, Gq/11-белок и фосфолипазу Cβ, результатом чего является повышение продукции диацилглицерола, активация форбол-чувствительных изоформ PKC и интенсификация ADAM17-индуцированного расщепления ACE2 [23]. Имеются основания считать, что и другие активаторы этих изоформ PKC способны стимулировать A-DAM17 и индуцировать гидролиз мембранно-связанной ACE2.
С целью расшифровки механизмов взаимодействия белка S вируса SARS-CoV с мембранно-связанной формой ACE2 были идентифицированы ключевые аминокислотные остатки, вовлеченные в этот процесс. В результате было установлено, что для взаимодействия с ACE2 человека наиболее важны остатки Tyr442, Leu472, Asn479, Asp480, Thr487 и Tyr491 вирусного белка S SARS-CoV (NP_828851.1). Эти аминокислотные остатки входят в состав так называемого “рецептор”-связывающего домена, соответствующего последовательности 424–494 белка S [42, 43]. В свою очередь, в структуре ACE2 выявлены высококонсервативные аминокислотные остатки Lys31, Glu35, Asp38, Met82 и Lys353, четыре из которых расположены в N-концевой части эктодомена фермента, ответственные за взаимодействие с вирусным белком [43].
Комплекс проведенных исследований позволил высказать вполне обоснованное предположение о том, что подавление TMPRSS2/ACE2-опосредованного проникновения вируса SARS-CoV в клетку может быть одним из эффективных путей предотвращения острой респираторной инфекции, вызываемой этим коронавирусом [10, 11]. Определенные надежды связывали и с регуляцией функциональной активности трансмембранной протеазы ADAM17, которая, в отличие от протеазы TMPRSS2, предотвращает инфицирование клеток вирусом SARS-CoV. Однако прекращение эпидемии и переоценка перспектив разработки вакцин против SARS-CoV не позволили этим работам получить достойное продолжение. В то же время, имеющиеся наработки стали практическим и теоретическим заделом для изучения ACE2-опосредуемых механизмов инфицирования клеток новым вирусом SARS-CoV-2.
ACE2-ОПОСРЕДУЕМЫЙ МЕХАНИЗМ ПРОНИКНОВЕНИЯ ВИРУСА SARS-COV В КЛЕТКУ
С учетом структурного и функционального сходства вирусов SARS-CoV и SARS-CoV-2 уже в самом начале исследований, стартовавших в начале 2020 года, основное внимание было сконцентрировано на роли ACE2 и протеаз TMPRSS2 и ADAM17 в молекулярных механизмах проникновения вируса SARS-CoV-2 в клетку. Изучали молекулярные основы взаимодействия ACE2 с поверхностным белком S вируса SARS-CoV-2 и роль в этом трансмембранных протеаз TMPRSS2 и ADAM17, способных изменять структуру белка S (TMPRSS2) и вызывать гидролитическое расщепление мембранно-связанной формы ACE2 (ADAM17, TMPRSS2) [7, 12, 13, 44–49].
Поверхностные белки S вирусов SARS-CoV и SARS-CoV-2 имеют значительное сходство первичной структуры (76% идентичных аминокислотных остатков), в том числе в области “рецептор”-связывающего домена этих белков. При этом пять из шести аминокислотных остатков, играющих ключевую роль во взаимодействии белка S SARS-CoV с мембранно-связанной формой ACE2, в структуре белка S SARS-CoV-2 (YP_009724390.1) были изменены (Leu455, Phe486, Gln493, Ser494, Asn501), за исключением остатка Tyr505 белка S SARS-CoV-2, соответствующего остатку Tyr491 белка S SARS-CoV. Несмотря на этот факт, топология и конформационные характеристики ACE2-связывающего сайта белков S обоих вирусов являются сходными [45]. Согласно данным молекулярного моделирования, наибольшую аффинность к белку S SARS-CoV-2 имеют ACE2 человека, панголина, собаки, кошки, золотистого хомячка, в то время как, например, ACE2 мышей и крыс с этим белком взаимодействует слабо. В сконструированной модели дистанция между остатком Phe486 в белке S SARS-CoV-2 и остатком Met82 в ACE2 человека в комплексе между этими белками составляет 3.753Å. В модели комплекса белка S SARS-CoV-2 с ACE2 панголина, собаки, кошки и золотистого хомячка, эта дистанция равна 1.621, 2.695, 3.753 и 2.024 Å соответственно, что может указывать на возможность эффективного проникновения вируса в клетки этих животных. Способность ACE2 эффективно взаимодействовать с белком S SARS-CoV-2 во многом обусловлена природой аминокислотного остатка в положении 82. Теоретический анализ показывает, что мутантный ACE2 человека с заменой остатка метионина в этом положении на аспарагин будет еще больше способствовать проникновению вируса SARS-CoV-2 в клетку в сравнении с ACE2 дикого типа [45]. Другие авторы, основываясь на результатах проведенного ими структурного анализа ACE2 и взаимодействия этого фермента с белком S SARS-CoV-2, показали, что, наряду с человеком, такое взаимодействие возможно у целого ряда млекопитающих (панголин, свинья, овца, кошка, собака и др.), имеются формы ACE2, которые способны с высокой эффективностью взаимодействовать с вирусным белком S SARS-CoV-2. Полученные ими результаты свидетельствуют в пользу высокой вероятности инфицирования этих животных вирусом SARS-CoV-2. Исключение составляют мыши и крысы, что создает ограничения для их использования в экспериментах по изучению SARS-CoV-2 [47].
Показано, что, как и в случае SARS-CoV, протеаза TMPRSS2 играет исключительно важную роль в ACE2-опосредованном проникновении вируса SARS-CoV-2 в клетку-мишень [6, 13, 46]. Мишенью TMPRSS2 также является белок S, который расщепляется протеазой по двум сайтам. Один из них обогащен остатками аргинина и расположен на границе двух субдоменов S1 и S2, вследствие чего его обозначают S1/S2, в то время как другой локализован в N-концевой части S2-домена и потому назван S2-сайтом. Следует отметить, что субдомен S1 содержит “рецептор”-связывающий участок и отвечает за прикрепление к мембранносвязанной ACE2, а субдомен S2 отвечает за формирование комплекса с эктодоменом ACE2 и дальнейшее проникновение вирусной частицы в клетку. Протеолиз по S1/S2-сайту осуществляется гораздо интенсивнее, чем по сайту S2, и играет исключительно важную роль в проникновении вируса в клетку. В пользу этого свидетельствуют данные о большом количестве расщепленного по S1/S2-сайту вирусного S-белка внутри клетки, инфицированной SARS-CoV-2. Расщепление вирусного белка S позволяет S2-субдомену высвободиться из комплекса с S1-субдоменом, после чего он приобретает способность эффективно взаимодействовать с эктодоменом ACE2 и образовывать комплекс ACE2–S2(SARS-CoV-2), обеспечивающий интернализацию вируса в клетку путем эндоцитоза [13, 50]. Важно отметить, что сайт для расщепления S1/S2 отсутствует в S-белках других вирусов, в том числе в S-белке вируса RaTG13, филогенетически наиболее близкого SARS-CoV-2. Это указывает на то, что TMPRSS2 способен опосредовать проникновение SARS-CoV-2 в клетку хозяина, но, как полагают, может оказаться неэффективным в отношении вируса атипичной аневмонии SARS-CoV и некоторых других родственных SARS-CoV-2 коронавирусов [13]. Клеточная культура VeroE6, в которой был экспрессирован TMPRSS2, обладала высокой способностью инфицироваться SARS-CoV-2, в то время как в отсутствие протеазы вирус в клетки не проникал и заражения не происходило [46].
Наряду с TMPRSS2, катепсины B и L, эндосомные цистеиновые протеазы, также способны расщеплять вирусные S-белки коронавирусов [51]. Однако в случае SARS-CoV и ряда других родственных ему вирусов это не приводит к “правильному” праймированию S-белка и проникновению вирусной частицы в клетку [50, 52, 53], а в случае SARS-CoV-2, как предполагают, может вносить лишь незначительный вклад в этот процесс [13]. На это указывают данные о том, что инфицирование вирусом SARS-CoV-2 клеток Calu-3, обработанных мезилатом камостата, селективным ингибитором TMPRSS2, было ослаблено, но не блокировано полностью. Это может быть обусловлено праймированием S-белка катепсинами B и L, хотя нельзя исключать и неполного ингибирования TMPRSS2 [13]. В этой связи необходимо отметить, что определенный вклад в проникновение в клетку вируса ближневосточного респираторного синдрома (Middle East respiratory syndrome-CoV, MERS-CoV), вносит сериновая протеаза фурин, но при этом для эффективного инфицирования необходима и протеаза TMPRSS2 [54, 55]. Все вышесказанное свидетельствует о том, что мезилат камостата и другие ингибиторы протеазы TMPRSS2 представляют значительный интерес для разработки препаратов, предназначенных для предотвращения и лечения коронавирусной инфекции, тем более что сам мезилат камостата уже прошел клинические испытания и одобрен для применения, как фармакологический препарат [52, 53].
В отношении роли протеазы ADAM17 в инфицировании вирусом SARS-CoV-2 прямых данных пока не получено, хотя и предполагается, что активация ANG-II сигнального пути, включающего AT1R и форбол-чувствительные формы PKC, должна усиливать протеолиз мембранно-связанной формы ACE2 и, тем самым, влиять на ее участие в проникновении вируса в клетку. Однако однозначные выводы о взаимосвязи между активностью ADAM17 и ACE2-опосредованным эндоцитозом вируса SARS-CoV-2 внутрь клетки могут быть сделаны только после проведения соответствующих экспериментов [7].
КЛИНИЧЕСКИЕ ПОСЛЕДСТВИЯ УЧАСТИЯ ACE2 В ИНФИЦИРОВАНИИ КЛЕТОК-МИШЕНЕЙ ВИРУСОМ SARS-COV-2
Основной контингент пациентов, которые наиболее тяжело переносят инфекцию, вызываемую SARS-CoV-2, составляют пожилые люди, страдающие атеросклерозом, гипертонической болезнью, ишемической болезнью сердца, сахарным диабетом, заболеваниями почек и легких. Многие из этих заболеваний обусловлены нарушением функционирования ренин-ангиотензиновой системы и сопровождаются компенсаторными или вызванными фармакологическими препаратами изменениями экспрессии ACE2 [3–6, 56, 57]. Поскольку мембранносвязанная форма ACE2 усиливает проникновение SARS-CoV-2 в клетку-мишень, то повышение экспрессии и количества этой формы фермента в мембране должно способствовать заражению вирусом SARS-CoV-2 и утяжелять течение COVID-19. В этой связи необходимо отметить, что ACE2 экспрессируется в основном в тех тканях, которые являются основными мишенями для SARS-CoV-2 и первыми подвергаются инфицированию – это легкие, почки, кишечник, стенки кровеносных сосудов, мозг, семенники [17, 18, 58-62].
Времени с начала пандемии прошло немного, вследствие чего вопрос о том, насколько уровни экспрессии и активности ACE2 у пациентов коррелируют с тяжестью заболевания, и как на это влияет системная терапия пациентов с хроническими заболеваниями сердечно-сосудистой системы и сахарным диабетом еще остается открытым. Но ряд важных соображений по этому поводу уместно высказать именно сейчас.
При сахарном диабете активность ACE2 снижается, что во многом обусловлено избыточным гликированием молекулы фермента в условиях характерной для диабетической патологии длительной гипергликемии, и это снижение является одной из первопричин предрасположенности пациентов с диабетом к тяжелым заболеваниям легких [63]. Снижение при диабете активности ACE2 и уровня ANG-(1–7), для которого характерно выраженное противовоспалительное и антиоксидантное действие, ослабляет защиту ткани легкого от вирусных инфекций, как это показано на примере характеризующегося высокой летальностью птичьего гриппа-A (H5N1) [64]. Имеются веские основания считать, что лечение сахарного диабета с помощью некоторых антидиабетических препаратов, в том числе пиоглитазона и лираглутида, повышает экспрессию ACE2, что было продемонстрировано в экспериментах с животными [3, 65]. Так лираглутид, аналог глюкагоподобного пептида-1, при его введении как здоровым крысам, так и животным с экспериментальным диабетом в значительной степени повышал экспрессию ACE2 в легких и увеличивал уровень циркулирующего в крови ANG-(1–7) [65]. Сахарный диабет обычно сопровождается дисфункциями сердечно-сосудистой системы – атеросклерозом и гипертензией, что требует специфической терапии с помощью ингибиторов ACE, блокаторов AT1R и статинов. Их применение также приводит к значительному повышению экспрессии ACE2, причем этот эффект отмечается у пациентов с сердечно-сосудистыми заболеваниями и без диабетической патологии [3, 8, 57]. Он подтвержден в экспериментах на животных [8, 66-68]. Показано, что при введении нормотензивным крысам лизиноприла, ингибитора ACE, и лозартана, антагониста AT1R, экспрессия ACE2 в сердце повышалась в 4.7 и 2.8 раза, соответственно [67]. Повышение экспрессии ACE2 в сердечной мышце отмечали и при введении этих препаратов гипертензивным трансгенным крысам линии Ren-2 [68]. При введении как нормотензивным, так и гипертензивным крысам лизиноприла и лозартана также повышалась экспрессия и активность ACE2 в почках, хотя и в меньшей степени, чем в сердце [68, 69]. При изучении влияния различных блокаторов AT1R на мышей было обнаружено повышение примерно в два раза количества белка ACE2 в сердечной мышце [70]].
Таким образом, возникает замкнутый круг. С одной стороны, в отсутствие лечения уровень ACE2, как правило, снижен, что сопровождается опасными для жизни функциональными расстройствами и ослаблением иммунитета, и это критично в условиях COVID-19. С другой стороны, лечение некоторыми антидиабетическими и антигипертензивными препаратами приводит к повышению экспрессии ACE2, что способствует проникновению вируса SARS-CoV-2 в клетку. Важно отметить, что в условиях инфицирования клеток вирусом SARS-CoV-2 в результате вирус-опосредуемого эндоцитоза фермента ACE2 и его дальнейшей внутриклеточной деградации количество функционально активного ACE2 на поверхности клетки-мишени резко снижается. Это в еще большей степени усугубляет функциональные нарушения в легких, сердечно-сосудистой системе и почках и способствует развитию острого респираторного дистресс-синдрома и острой сердечной недостаточности при COVID-19 [8, 71]. В этой связи ряд исследователей предлагают на время заболевания COVID-19 пациентам, которые системно принимают ингибиторы ACE, блокаторы AT1R и статины, отказаться от этих препаратов и заменить их, например, блокаторами кальциевых каналов или использовать комбинированную терапию [3, 57]. Несмотря на то, что в доступной литературе данные о влиянии блокаторов кальциевых каналов на экспрессию и активность ACE2 отсутствуют, нельзя исключить, что вызываемое ими снижение концентрации ионов кальция в клетке также способно привести к усилению экспрессии ACE2. Это обусловлено тем, что блокирование кальциевого сигналинга приводит к ингибированию того же AT1R-зависимого сигнального каскада, который подавляется при ингибировании AT1R или снижении продукции ANG-II.
Значительный уровень экспрессии ACE2 показан в некоторых отделах мозга. С одной стороны, это еще один путь распространения инфекции, вызываемой SARS-CoV-2, и, с другой, причина резкого снижения уровня ACE2 в ЦНС, как результат его совместной интернализации с вирусными частицами в нейроны [3]. Высокое содержание вирусных частиц и ассоциированный с этим перенос деградирующих форм ACE2 были выявлены в стволе мозга и отходящих от него черепных нервах [72, 73]. В результате отмечали активацию апоптотических процессов в этих клетках и их гибель, что приводило к нарушению функционирования центров мозга, ответственных за регуляцию артериального давления и дыхания. Необходимо отметить, что снижение уровня ACE2 в стволе мозга может также вызывать нарушение тонуса симпатической нервной системы и обострять артериальную гипертензию [74–76], что, согласно имеющимся сообщениям, характерно для COVID-19.
ЗАКЛЮЧЕНИЕ
Установление ключевой роли ренин-ангиотензиновой системы и ACE2 в инфицировании клеток хозяина возбудителем атипичной пневмонии SARS-CoV, а также новым вирусом SARS-CoV-2, возбудителем новой пандемии COVID-19, не только позволяет выделить группы риска, наиболее восприимчивые к этим заболеваниям, но и разработать новые подходы для создания противовирусных препаратов, предотвращающих коронавирусную инфекцию. Результаты клинических наблюдений пациентов с COVID-19 показывают, что баланс вазоконстрикторных и вазодилаторных влияний, реализуемых пептидами ангиотензинового семейства через различные типы ангиотензиновых рецепторов, соотношение между активностью ACE и его функционального антагониста ACE2, паттерн мембранно-связанных протеаз (TMPRSS2, ADAM17), определяющих судьбу ACE2 и способность вируса интернализоваться в клетку, не только влияют на процессы заражения человека вирусом SARS-CoV-2, но и во многом предопределяют патогенез и исход COVID-19. В настоящее время предложено несколько подходов для создания препаратов, в основе действия которых лежит нарушение способности вируса проникать в клетку – в первую очередь это ингибиторы протеазы TMPRSS2, а также соединения, способные препятствовать эффективному взаимодействию ACE2 с вирусным белком S. Определенные надежды связывают и с генерацией растворимых форм ACE2, которые способны нейтрализовать вирусные частицы. Однако в этом случае возникают риски гиперпродукции ANG-(1–7) с развитием у пациента гипотонии. Не менее эффективными являются меры, направленные на нормализацию ренин-ангиотензиновой системы и на оптимизацию стратегии применения фармакологических препаратов, мишенями которых являются ACE и AT1R, поскольку дисбаланс в системе ACE–ANG-II/ACE2–ANG-(1–7) может иметь самые пагубные последствия для пациента в условиях SARS-CoV-2 инфицирования. Все эти подходы востребованы, и в сочетании с разработкой вакцин против вируса SARS-CoV-2, которые также находятся только в начале пути [77–79], могут остановить пандемию COVID-19, унесшую по данным на апрель 2020 года уже более 180 тысяч человеческих жизней.
Список литературы
World Health Organization. WHO Director-General’s remarks at the media briefing on 2019-nCoV on 11 February 2020. 2020. https://www.who.int/dg/speeches/detail/who-director-general-s-remarks-at-the-media-briefing-on-2019-ncov-on-11-february-2020.
Wu A., Peng Y., Huang B., Ding X., Wang X., Niu P., Meng J., Zhu Z., Zhang Z., Wang J., Sheng J., Quan L., Xia Z., Tan W., Cheng G., Jiang T. Genome composition and divergence of the novel coronavirus (2019-nCoV) originating in China. Cell Host Microbe. 27(3): 325e328. 2020. https://doi.org/10.1016/j.chom.2020.02.001
Fang L., Karakiulakis G., Roth M. Are patients with hypertension and diabetes mellitus at increased risk for Covid-19 infection? Lancet Respir. Med. 8(4): e21. 2020. https://doi.org/10.1016/S2213-2600(20)30116-8
Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y., Zhang L., Fan G., Xu J., Gu X., Cheng Z., Yu T., Xia J., Wei Y., Wu W., Xie X., Yin W., Li H., Liu M., Xiao Y., Gao H., Guo L., Xie J., Wang G., Jiang R., Gao Z., Jin Q., Wang J., Cao B. Clinical features of patients infected with 2019 novel coronavirus in Wuhan. China. Lancet. 395: 497–506. 2020. https://doi.org/10.1016/S0140-6736(20)30183-5
Zheng Y.Y., Ma Y.T., Zhang J.Y., Xie X. COVID-19 and the cardiovascular system. Nat. Rev. Cardiol. 2020. https://doi.org/10.1038/s41569-020-0360-5
Zhou P., Yang X.L., Wang X.G., Hu B., Zhang L., Zhang W., Si H.R., Zhu Y., Li B., Huang C.L., Chen H.D., Chen J., Luo Y., Guo H., Jiang R.D., Liu M.Q, . Chen Y., Shen X.R., Wang X., Zheng X.S., Zhao K., Chen Q.J., Deng F., Liu L.L., Yan B., Zhan F.X., Wang Y.Y., Xiao G.F., Shi Z.L. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 579(7798): 270–273. 2020. https://doi.org/10.1038/s41586-020-2012-7
Danser A.H.J., Epstein M., Batlle D. Renin-angiotensin system blockers and the COVID-19 Pandemic: At present there is no evidence to abandon renin-angiotensin system blockers. Hypertension. HYPERTENSIONAHA12015082. 2020. https://doi.org/10.1161/HYPERTENSIONAHA.120.15082
South A.M., Diz D., Chappell M.C. COVID-19, ACE2 and the Cardiovascular Consequences. Am. J. Physiol. Heart. Circ. Physiol. 2020. https://doi.org/10.1152/ajpheart.00217.2020
Li W., Moore M.J., Vasilieva N., Sui J., Wong S.K., Berne M.A., Somasundaran M., Sullivan J.L., Luzuriaga K., Greenough T.C., Choe H., Farzan M. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 426: 450–454. 2003. https://doi.org/10.1038/nature02145
Matsuyama S., Nagata N., Shirato K., Kawase M., Takeda M., Taguchi F. Efficient activation of the severe acute respiratory syndrome coronavirus spike protein by the transmembrane protease TMPRSS2. J. Virol. 84: 12658–12664. 2010. https://doi.org/10.1128/JVI.01542-10
Heurich A., Hofmann-Winkler H., Gierer S., Liepold T., Jahn O., Pöhlmann S. TMPRSS2 and ADAM17 cleave ACE2 differentially and only proteolysis by TMPRSS2 augments entry driven by the severe acute respiratory syndrome coronavirus spike protein. J. Virol. 88(2): 1293–307. 2014. https://doi.org/10.1128/JVI.02202-13
Batlle D., Wysocki J., Satchell K. Soluble angiotensin-converting enzyme 2: a potential approach for coronavirus infection therapy? Clin. Sci. (Lond). 134: 543–545. 2020. https://doi.org/10.1042/CS20200163
Hoffmann M., Kleine-Weber H., Schroeder S., Kruger N., Herrler T., Erichsen S., Schiergens T.S., Herrler G., Wu N.H., Nitsche A., Müller M.A., Drosten C., Pöhlmann S. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell. pii: S0092-8674(20)30229-4. 2020. https://doi.org/10.1016/j.cell.2020.02.052
Lu H., Cassis L.A., Kooi C.W., Daugherty A. Structure and functions of angiotensinogen. Hypertens. Res. 39(7): 492–500. 2016. https://doi.org/10.1038/hr.2016.17
Wu C., Lu H., Cassis L.A., Daugherty A. Molecular and pathophysiological features of angiotensinogen: a mini review. N. Am. J. Med. Sci. (Boston). 4: 183–190. 2011. https://doi.org/10.7156/v4i4p183
Arendse L.B., Danser A.H.J., Poglitsch M., Touyz R.M., Burnett J.C. Jr., Llorens-Cortes C., Ehlers M.R., Sturrock E.D. Novel Therapeutic approaches targeting the renin-angiotensin system and associated peptides in hypertension and heart failure. Pharmacol. Rev. 71(4): 539–570. 2019. https://doi.org/10.1124/pr.118.017129
Donoghue M., Hsieh F., Baronas E., Godbout K., Gosselin M., Stagliano N., Donovan M., Woolf B., Robison K., Jeyaseelan R., Breitbart R.E., Acton S. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1–9. Circ Res. 87: E1–9. 2000. https://doi.org/10.1161/01.res.87.5.e1
Tipnis S.R., Hooper N.M., Hyde R., Karran E., Christie G., Turner A.J. A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase. J. Biol. Chem. 275(43): 33238–33243. 2000. https://doi.org/10.1074/jbc.M002615200
Varagic J., Ahmad S., Nagata S., Ferrario C.M. ACE2: angiotensin II/angiotensin-(1–7) balance in cardiac and renal injury. Curr. Hypertens. Rep. 16(3): 420. 2014. https://doi.org/10.1007/s11906-014-0420-5
Patel V.B., Zhong J.C., Grant M.B., Oudit G.Y. Role of the ACE2/Angiotensin 1–7 Axis of the Renin-Angiotensin System in Heart Failure. Circ. Res. 118(8): 1313–1326. 2016. https://doi.org/10.1161/CIRCRESAHA.116.307708
Lambert D.W., Yarski M., Warner F.J., Thornhill P., Parkin E.T., Smith A.I., Hooper N.M., Turner A.J. Tumor necrosis factor-alpha convertase (ADAM17) mediates regulated ectodomain shedding of the severe-acute respiratory syndrome-coronavirus (SARS-CoV) receptor, angiotensin-converting enzyme-2 (ACE2). J. Biol. Chem. 280(34): 30113–30119. 2005. https://doi.org/10.1074/jbc.M505111200
Xu J., Sriramula S., Xia H., Moreno-Walton L., Culicchia F., Domenig O., Poglitsch M., Lazartigues E. Clinical relevance and role of neuronal AT1 receptors in ADAM17-mediated ACE2 shedding in neurogenic hypertension. Circ. Res. 121: 43–55. 2017. https://doi.org/10.1161/CIRCRESAHA.116.310509
Mukerjee S., Gao H., Xu J., Sato R., Zsombok A., Lazartigues E. ACE2 and ADAM17 Interaction Regulates the Activity of Presympathetic Neurons. Hypertension. 74(5): 1181–1191. 2019. https://doi.org/10.1161/HYPERTENSIONAHA.119.13133
Zunke F., Rose-John S. The shedding protease ADAM17: Physiology and pathophysiology. Biochim. Biophys. Acta. Mol. Cell Res. 1864(11 Pt B): 2059–2070. 2017. https://doi.org/10.1016/j.bbamcr.2017.07.001
Kaschina E., Namsolleck P., Unger T. AT2 receptors in cardiovascular and renal diseases. Pharmacol. Res. 125(Pt A): 39–47. 2017. https://doi.org/10.1016/j.phrs.2017.07.008
Balakumar P., Jagadeesh G. Structural determinants for binding, activation, and functional selectivity of the angiotensin AT1 receptor. J. Mol. Endocrinol. 53(2): R71–92. 2014. https://doi.org/10.1530/JME-14-0125
Zhang H., Han G.W., Batyuk A., Ishchenko A., White K.L., Patel N., Sadybekov A., Zamlynny B., Rudd M.T., Hollenstein K., Tolstikova A., White T.A., Hunter M.S., Weierstall U., Liu W., Babaoglu K., Moore E.L., Katz R.D., Shipman J.M., Garcia-Calvo M., Sharma S., Sheth P., Soisson S.M., Stevens R.C., Katritch V., Cherezov V. Structural basis for selectivity and diversity in angiotensin II receptors. Nature. 544(7650): 327–332. 2017. https://doi.org/10.1038/nature22035
AbdAlla S., Lother H., Abdel-tawab A.M., Quitterer U. The angiotensin II AT2 receptor is an AT1 receptor antagonist. J. Biol. Chem. 276(43): 39721–39726. 2001. https://doi.org/10.1074/jbc.M105253200
Patel S., Hussain T. Dimerization of AT2 and Mas Receptors in Control of Blood Pressure. Curr. Hypertens. Rep. 20(5): 41. 2018. https://doi.org/10.1007/s11906-018-0845-3
Akazawa H., Yano M., Yabumoto C., Kudo-Sakamoto Y., Komuro I. Angiotensin II type 1 and type 2 receptor-induced cell signaling. Curr. Pharm. Des. 19(17): 2988–2995. 2013. https://doi.org/10.2174/1381612811319170003
Zhang H., Unal H., Desnoyer R., Han G.W., Patel N., Katritch V., Karnik S.S., Cherezov V., Stevens R.C. Structural Basis for Ligand Recognition and Functional Selectivity at Angiotensin Receptor. J. Biol. Chem. 290(49): 29127–29139. 2015. https://doi.org/10.1074/jbc.M115.689000
Turu G., Balla A., Hunyady L. The Role of β-arrestin proteins in organization of signaling and regulation of the AT1 angiotensin receptor. Front. Endocrinol. (Lausanne). 10: 519. 2019. https://doi.org/10.3389/fendo.2019.00519
Chiu T., Santiskulvong C., Rozengurt E. ANG II stimulates PKC-dependent ERK activation, DNA synthesis, and cell division in intestinal epithelial cells. Am. J. Physiol. Gastrointest Liver Physiol. 285(1): G1–11. 2003. https://doi.org/10.1152/ajpgi.00419.2002
Hines J., Fluharty S.J., Yee D.K. Structural determinants for the activation mechanism of the angiotensin II type 1 receptor differ for phosphoinositide hydrolysis and mitogen-activated protein kinase pathways. Biochem. Pharmacol. 66(2): 251–262. 2003. https://doi.org/10.1016/s0006-2952(03)00257-0
Namsolleck P., Recarti C., Foulquier S., Steckelings U.M., Unger T. AT2 Receptor and tissue injury: Therapeutic Implications. Curr. Hypertens. Rep. 16(2): 416. 2014. https://doi.org/10.1007/s11906-013-0416-6
Saavedra J.M., Armando I. Angiotensin II AT2 receptors contribute to regulate the sympathoadrenal and hormonal reaction to stress stimuli. Cell Mol. Neurobiol. 38(1): 85–108. 2018. https://doi.org/10.1007/s10571-017-0533-x
Bennion D.M., Haltigan E., Regenhardt R.W., Steckelings U.M., Sumners C. Neuroprotective mechanisms of the ACE2-angiotensin-(1-7)-Mas axis in stroke. Curr. Hypertens Rep. 17(2): 3. 2015. https://doi.org/10.1007/s11906-014-0512-2
Böttcher E., Matrosovich T., Beyerle M., Klenk H., Garten W., Matrosovich M. Proteolytic activation of influenza viruses by serine proteases TMPRSS2 and HAT from human airway epithelium. J. Virol. 80(19): 9896–9898. 2006. https://doi.org/10.1128/JVI.01118-06
Shirogane Y., Takeda M., Iwasaki M., Ishiguro N., Takeuchi H., Nakatsu Y., Tahara M., Kikuta H., Yanagi Y. Efficient multiplication of human metapneumovirus in Vero cells expressing the transmembrane serine protease TMPRSS2. J. Virol. 82(17): 8942–8946. 2008. https://doi.org/10.1128/JVI.00676-08
Chaipan C., Kobasa D., Bertram S., Glowacka I., Steffen I., Tsegaye T.S., Takeda M., Bugge T.H., Kim S., Park Y., Marzi A., Pölmann S. Proteolytic activation of the 1918 influenza virus hemagglutinin. J. Virol. 83(7): 3200–3211. 2009. https://doi.org/10.1128/JVI.02205-08
Yun B., Zhang Y., Liu Y., Guan X., Wang Y., Qi X., Cui H., Liu C., Zhang Y., Gao H., Gao L., Li K., Gao Y., Wang X. TMPRSS12 Is an Activating Protease for Subtype B Avian Metapneumovirus. J. Virol. 90(24): 11231–11246. 2016. https://doi.org/10.1128/JVI.01567-16
Li F., Li W., Farzan M., Harrison S.C. Structure of SARS coronavirus spike receptor-binding domain complexed with receptor. Science. 309(5742): 1864–1868. 2005. https://doi.org/10.1126/science.1116480
Wan Y., Shang J., Graham R., Baric R.S., Li F. Receptor recognition by novel coronavirus from Wuhan: an analysis based on decade-long structural studies of SARS. J. Virol. 94(7): pii: JVI.00127-20. 2020. https://doi.org/10.1128/JVI.00127-20
Lan J., Ge J., Yu J., Shan S., Zhou H., Fan S., Zhang Q., Shi X., Wang Q., Zhang L., Wang X. Structure of the SARS-CoV-2 spike receptor-binding domain bound to the ACE2 receptor. Nature. 2020. https://doi.org/10.1038/s41586-020-2180-5
Luan J., Lu Y., Jin X., Zhang L. Spike protein recognition of mammalian ACE2 predicts the host range and an optimized ACE2 for SARS-CoV-2 infection. Biochem. Biophys. Res. Commun. pii: S0006-291X(20)30526-X. 2020. https://doi.org/10.1016/j.bbrc.2020.03.047
Matsuyama S., Nao N., Shirato K., Kawase M., Saito S., Takayama I., Nagata N., Sekizuka T., Katoh H., Kato F., Sakata M., Tahara M., Kutsuna S., Ohmagari N., Kuroda M., Suzuki T., Kageyama T., Takeda M. Enhanced isolation of SARS-CoV-2 by TMPRSS2-expressing cells. Proc. Natl. Acad. Sci. USA. 117(13): 7001–7003. 2020. https://doi.org/10.1073/pnas.2002589117
Qiu Y., Zhao Y.B., Wang Q., Li J.Y., Zhou Z.J., Liao C.H., Ge X.Y. Predicting the angiotensin converting enzyme 2 (ACE2) utilizing capability as the receptor of SARS-CoV-2. Microbes Infect. pii: S1286-4579(20)30049-6. 2020. https://doi.org/10.1016/j.micinf.2020.03.003
Shang J., Ye G., Shi K., Wan Y., Luo C., Aihara H., Geng Q., Auerbach A., Li F. Structural basis of receptor recognition by SARS-CoV-2. Nature. 2020. https://doi.org/10.1038/s41586-020-2179-y
Yan R., Zhang Y., Li Y., Xia L., Guo Y., Zhou Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science. 367(6485): 1444–1448. 2020. https://doi.org/10.1126/science.abb2762
Iwata-Yoshikawa N., Okamura T., Shimizu Y., Hasegawa H., Takeda M., Nagata N. TMPRSS2 Contributes to virus spread and immunopathology in the airways of murine models after coronavirus infection. J. Virol. 93(6): pii: e01815-18. 2019. https://doi.org/10.1128/JVI.01815-18
Simmons G., Gosalia D.N., Rennekamp A.J., Reeves J.D., Diamond S.L., Bates P. Inhibitors of cathepsin L prevent severe acute respiratory syndrome coronavirus entry. Proc. Natl. Acad. Sci. USA. 102(33): 11876–11881. 2005. https://doi.org/10.1073/pnas.0505577102
Kawase M., Shirato K., van der Hoek L., Taguchi F., Matsuyama S. Simultaneous treatment of human bronchial epithelial cells with serine and cysteine protease inhibitors prevents severe acute respiratory syndrome coronavirus entry. J. Virol. 86(12): 6537–6545. 2012. https://doi.org/10.1128/JVI.00094-12
Zhou Y., Vedantham P., Lu K., Agudelo J., Carrion R. Jr., Nunneley J.W., Barnard D., Pöhlmann S., McKerrow J.H., Renslo A.R., Simmons G. Protease inhibitors targeting coronavirus and filovirus entry. Antiviral Res. 116: 76-84. 2015. https://doi.org/10.1016/j.antiviral.2015.01.011
Park J.E., Li K., Barlan A., Fehr A.R., Perlman S., McCray P.B., Jr., Gallagher T. Proteolytic processing of middle east respiratory syndrome coronavirus spikes expands virus tropism. Proc. Natl. Acad. Sci. USA. 113(43): 12262–12267. 2016. https://doi.org/10.1073/pnas.1608147113
Kleine-Weber H., Elzayat M.T., Hoffmann M., Pöhlmann S. Functional analysis of potential cleavage sites in the MERS-coronavirus spike protein. Sci. Rep. 8(1): 16597. 2018. https://doi.org/10.1038/s41598-018-34859-w
Diaz J.H. Hypothesis: angiotensin-converting enzyme inhibitors and angiotensin receptor blockers may increase the risk of severe COVID-19. J. Travel. Med. pii: taaa041. 2020. https://doi.org/10.1093/jtm/taaa041
Pal R., Bhansali A. COVID-19, Diabetes Mellitus and ACE2: The conundrum. Diabetes Res. Clin. Pract. 29: 108132. 2020. https://doi.org/10.1016/j.diabres.2020.108132
Ferrario C.M., Varagic J. The ANG-(1-7)/ACE2/mas axis in the regulation of nephron function. Am. J. Physiol. 298: F1297–F1305. 2010. https://doi.org/10.1152/ajprenal.00110.2010
Ohtsuki M., Morimoto S.-I., Izawa H., Ismail T.F., Ishibashi-Ueda H., Kato Y., Horii T., Isomura T., Suma H., Nomura M., Hishida H., Kurahashi H., Ozaki Y. Angiotensin converting enzyme 2 gene expression increased compensatory for left ventricular remodeling in patients with end-stage heart failure. Int. J. Cardiol. 145(2): 333–334. 2010. https://doi.org/10.1016/j.ijcard.2009.11.057
Wong S.H., Lui R.N., Sung J.J. Covid-19 and the Digestive System. J. Gastroenterol. Hepatol. 2020. https://doi.org/10.1111/jgh.15047
Kreutz R., Algharably E.A.E., Azizi M., Dobrowolski P., Guzik T., Januszewicz A., Persu A., Prejbisz A., Riemer T.G., Wang J.G., Burnier M. Hypertension, the renin-angiotensin system, and` the risk of lower respiratory tract infections and lung injury: implications for COVID-19. Cardiovasc. Res. pii: cvaa097. 2020. https://doi.org/10.1093/cvr/cvaa097
Nicin L., Abplanalp W.T., Mellentin H., Kattih B., Tombor L., John D., Schmitto J.D., Heineke J., Emrich F., Arsalan M., Holubec T., Walther T., Zeiher A.M., Dimmeler S. Cell type-specific expression of the putative SARS-CoV-2 receptor ACE2 in human hearts. Eur. Heart. J. 2020 Apr. 15. pii: ehaa311. https://doi.org/10.1093/eurheartj/ehaa311
Tikellis C., Thomas M.C. Angiotensin-Converting Enzyme 2 (ACE2) Is a Key Modulator of the Renin Angiotensin System in Health and Disease. Int. J. Pept. 2012: 1–8. 2012. https://doi.org/10.1155/2012/256294
Zou Z., Yan Y., Shu Y., Gao R., Sun Y., Li X., Ju X., Liang Z., Liu Q., Zhao Y., Guo F., Bai T., Han Z., Zhu J., Zhou H., Huang F., Li C., Lu H., Li N., Li D., Jin N., Penninger J.M., Jiang C. Angiotensin-converting enzyme 2 protects from lethal avian influenza A H5N1 infections. Nat. Commun. 5: 3594. 2014. https://doi.org/10.1038/ncomms4594
Romaní-Pérez M., Outeiriño-Iglesias V., Moya C.M., Santisteban P., González-Matías L.C., Vigo E. Activation of the GLP-1 Receptor by Liraglutide Increases ACE2 Expression, Reversing Right Ventricle Hypertrophy, and Improving the Production of SP-A and SP-B in the Lungs of Type 1 Diabetes Rats. Endocrinology. 156(10):3559–3569. 2015. https://doi.org/10.1210/en.2014-1685
Stanziola L., Greene L.J., Santos R.A.S. Effect of chronic angiotensin converting enzyme inhibition on angiotensin I and bradykinin metabolism in rats. Am. J. Hypertens. 12: 1021–1029. 1999. https://doi.org/10.1016/S0895-7061(99)00090-4
Ferrario C.M., Jessup J., Chappell M.C., Averill D.B., Brosnihan K.B., Tallant E.A., Diz D.I., Gallagher P.E. Effect of Angiotensin-Converting Enzyme Inhibition and Angiotensin II Receptor Blockers on Cardiac Angiotensin-Converting Enzyme 2. Circulation. 111: 2605–2610. 2005. https://doi.org/10.1161/CIRCULATIONAHA.104.510461
Jessup J., Gallagher P.E., Averill D.B., Brosnihan K.B., Ann T.E., Chappell M.C., Ferrario C.M. Effect of Angiotensin II blockade on a new congenic model of hypertension derived from the transgenic Ren-2 rat. Am. J. Physiol. Heart Circ. 291(5): H2166–7H2172. 2006. https://doi.org/10.1152/ajpheart.00061.2006
Ferrario C.M., Jessup J., Gallagher P.E., Averill D.B., Brosnihan K.B., Smith R., Chappell M.C. Effect of renin-angiotensin system blockade on renal Angiotensin-(1-7)-forming enzymes, ACE-2 and receptors. Kidney Int. 68(5): 2189–2196. 2005. https://doi.org/10.1111/j.1523-1755.2005.00675.x
Wang X., Ye Y., Gong H., Wu J., Yuan J., Wang S., Yin P., Ding Z., Kang L., Jiang Q., Zhang W., Li Y., Ge J., Zou Y. The effects of different Angiotensin II Type 1 Receptor blockers on the regulation of the ACE-AngII-AT1 and ACE2-Ang-(1-7)-Mas axes in pressure overload-induced cardiac remodeling in male mice. Mol. Cell Cardiol. 97: 180–190. 2016. https://doi.org/10.1016/j.yjmcc.2016.05.012
Wu C., Chen X., Cai Y., Xia J., Zhou X., Xu S. Risk Factors Associated With Acute Respiratory Distress Syndrome and Death in Patients With Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern. Med. 2020. https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2763184.
Li Y.C., Bai W.Z., Hashikawa T. The neuroinvasive potential of SARS-CoV2 may play a role in the respiratory failure of COVCID-19 patients. J. Med. Virol. 1: 1–4. 2020. https://doi.org/10.1002/jmv.25728
Mao L., Wang M., Chen S., He Q., Chang J., Hong C., Zhou Y., Wang D., Li Y., Jin H., Bo H. Neurological Manifestations of Hospitalized Patients with COVID-19 in Wuhan, China: a retrospective case series study. MedRExiv. 2020. https://doi.org/10.1101/2020.02.22.20026500
Diz D.I., Garcia-Espinosa M.A., Gegick S., Tommasi E.N., Ferrario C.M., Ann Tallant E., Chappell M.C., Gallagher P.E. Injections of angiotensin-converting enzyme 2 inhibitor MLN4760 into nucleus tractus solitarii reduce baroreceptor reflex sensitivity for heart rate control in rats. Exp. Physiol. 93(5): 694–700. 2008. https://doi.org/10.1113/expphysiol.2007.040261
Xu P., Sriramula S., Lazartigues E. ACE2/ANG-(1-7)/Mas pathway in the brain: the axis of good. Am. J. Physiol. Regul. Integr. Comp. Physiol. 300(4): R804–R817. 2011. https://doi.org/10.1152/ajpregu.00222.2010
Alenina N., Bader M. ACE2 in brain physiology and pathophysiology: Evidence from transgenic animal models. Neurochem. Res. 44(6): 1323–1329. 2019. https://doi.org/10.1007/s11064-018-2679-4
Chen W.H., Strych U., Hotez P.J., Bottazzi M.E. The SARS-CoV-2 Vaccine Pipeline: an Overview. Curr. Trop. Med. Rep. 3: 1–4. 2020. https://doi.org/10.1007/s40475-020-00201-6
Amanat F., Krammer F. SARS-CoV-2 Vaccines: Status Report. Immunity. pii: S1074-7613(20)30120-5. 2020. https://doi.org/10.1016/j.immuni.2020.03.007
Hotez P.J., Bottazzi M.E., Corry D.B. The Potential Role of Th17 Immune Responses in Coronavirus Immunopathology and Vaccine-induced Immune Enhancement. Microbes Infect. pii: S1286-4579(20)30072-1. 2020. https://doi.org/10.1016/j.micinf.2020.04.005
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


