Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 7, стр. 811-822
Молекулярные основы влияния метформина на репродуктивную систему
А. О. Шпаков *
Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 03.02.2020
После доработки 20.02.2020
Принята к публикации 17.03.2020
Аннотация
В основе действия метформина (МФ), который широко применяется для лечения сахарного диабета 2 типа и метаболического синдрома, лежит нормализация инсулиновой чувствительности, липидного и углеводного обмена. В последние годы появились данные экспериментальных и клинических исследований о том, что МФ нормализует нарушенные в условиях метаболических расстройств функции основных звеньев гипоталамо-гипофизарно-гонадной оси, усиливая продукцию гонадолиберина, гипоталамического регулятора этой оси, а также восстанавливая стероидогенную активность гонад и нормализуя процессы сперматогенеза, фолликулогенеза и оогенеза. Применение МФ при синдроме поликистозных яичников и при других репродуктивных дисфункциях, ассоциированных с метаболическими нарушениями, предотвращает снижение фертильности и повышает результативность вспомогательных репродуктивных технологий. Современным достижениям в области изучения механизмов действия МФ и его использования для восстановления функций женской и мужской репродуктивных систем при метаболических заболеваниях и других патологиях посвящен настоящий обзор.
Метформин (МФ), впервые синтезированный еще в 1958 г., в настоящее время является основным препаратом для лечения сахарного диабета 2 типа (СД2) и метаболического синдрома (МС), а также широко применяется для коррекции массы тела и метаболических показателей при ожирении. В основе его терапевтического эффекта лежит способность повышать чувствительность тканей к инсулину, сниженную при СД2 и МС, улучшая, тем самым, инсулин-индуцированную утилизацию глюкозы, а также подавлять синтез глюкозы в печени de novo и снижать абсорбцию глюкозы в желудочно-кишечном тракте [1, 2]. Результатом этого является ослабление гипергликемии, гиперинсулинемии, восстановление липидного обмена. Будучи стабильным соединением, гидрофильным по природе, МФ при введении в организм легко преодолевает гистогематические барьеры, в том числе гематоэнцефалический барьер, и достигает множества тканей, включая мышцы, печень, поджелудочную железу, жировую ткань, гипоталамус, гипофиз, гонады. Его проникновение внутрь клетки может происходить как посредством ограниченной пассивной диффузии, так и с помощью транспортеров органических катионов, таких как OCT1 (Organic Cation Transporter-1), OCT2 и MATE1 (Multidrug And Toxin Extrusion-1), причем активный транспорт МФ превалирует над пассивным [3]. Полиморфизмы в генах, кодирующих транспортеры органических катионов, вызывают значительные изменения в распределении МФ в тканях и меняют его фармакологический профиль [4, 5]. В клинике для лечения пациентов с СД2 используют МФ в дозах 30–50 мг/кг/сутки, что позволяет достичь уровня этого препарата в сыворотке крови 10–40 мкмоль/л [6]. Мыши примерно в 10 раз менее чувствительны к МФ в сравнении с человеком [6, 7]. Видоспецифичность эффектов МФ необходимо принимать во внимание как для сопоставления его эффективных доз при лечении человека и экспериментальных животных, так и для правильной интерпретации полученных результатов.
В последние годы появились свидетельства того, что МФ не только положительно влияет на метаболические показатели, пищевое поведение и энергетический обмен при СД2 и МС, но и способен восстанавливать нарушенные при этих патологических состояниях функции репродуктивной системы. В дальнейшем появились свидетельства того, что МФ, непосредственно воздействуя на различные звенья гипоталамо-гипофизарно-гонадной оси, способен нормализовать репродуктивный потенциал и может быть использован во вспомогательных репродуктивных технологиях. Достижениям и перспективам использования МФ для восстановления функционирования женской и мужской репродуктивной систем при метаболических и других заболеваниях посвящен настоящий обзор.
МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ДЕЙСТВИЯ МЕТФОРМИНА
Сигнальные пути и мишени МФ, несмотря на большое число посвященных решению этого вопроса исследований, до сих пор мало изучены, что во многом обусловлено различиями механизмов действия МФ в различных типах клеток и у различных представителей позвоночных животных, разными дозами и стратегиями применения МФ, а также различиями метаболического и энергетического статуса организма, в том числе в условиях СД2, МС и других метаболических расстройств [2, 8, 9].
Основным механизмом ингибирующего действия МФ на глюконеогенез считают активацию АМФ-активируемой протеинкиназы (AMPK), основного энергетического сенсора клетки [9, 10]. Этот процесс может реализовываться как при воздействии сравнительно низких концентраций МФ на стабильность αβγ-гетеротримерного комплекса AMPK, так и при ингибировании более высокими концентрациями МФ комплекса 1 дыхательной транспортной цепи митохондрий и фермента АМФ-дезаминазы (рис. 1). Показателем активации AMPK является фосфорилирование α-субъединицы фермента по остатку Thr172, осуществляемое протеинкиназой LKB1. Стимулирующий эффект низких концентраций МФ на активность AMPK обусловлен стабилизацией комплекса между каталитической α-субъединицей и неактивными β- и γ-субъединицами, что позволяет протеинкиназе LKB1 более эффективно фосфорилировать AMPK и переводить ее в активное состояние [11]. Стабилизация αβγ-комплекса AMPK также препятствует дефосфорилированию α-субъединицы AMPK фосфатазой PP2C, что позволяет AMPK более длительное время оставаться в активной фосфорилированной форме. Вызываемая МФ активация AMPK приводит к фосфорилированию активатора транскрипции CBP по остатку Ser436 с помощью атипичной протеинкиназы ι/λ, в результате чего нарушается ассоциация CBP с цАМФ-регулируемым транскрипционным фактором CREB. Это приводит к подавлению экспрессии генов, ответственных за глюконеогенез, в том числе кодирующих ферменты, катализирующие скорость-лимитирующие стадии глюконеогенеза, и к снижению продукции глюкозы гепатоцитами [12]. Эффект МФ на активность AMPK, обусловленный стабилизацией αβγ-комплекса, реализуется при его концентрациях ниже 80 мкМ, которые достигаются при пероральном приеме даже относительно низких терапевтических доз МФ [13].
В более высоких концентрациях МФ, ингибируя митохондриальный комплекс 1 и АМФ-дезаминазу, снижает продукцию АТФ и вызывает накопление АМФ внутри клетки, что приводит к увеличению соотношения [АМФ]/[АТФ] и активации AMPK [14, 15] (рис. 1). Однако концентрации МФ, достоверно повышающие соотношения [АМФ]/[АТФ] и [АДФ]/[АТФ], существенно превышают 250 мкМ [7, 14], и являются труднодостижимыми при клиническом его применении [13]. Независимо от механизмов МФ-индуцированной активации AMPK следствием этого являются стимуляция обеспечивающих выработку энергии катаболических путей, опосредующих усиление поглощения глюкозы клетками, повышение экспрессии и активности мембранных переносчиков глюкозы, усиление метаболических процессов, таких как гликолиз и окислительное фосфорилирование, нормализация митохондриального биогенеза (рис. 1). В дополнение к этому стимуляция активности AMPK приводит к активации β-окисления жирных кислот и к ингибированию процесса липогенеза, результатом чего является ослабление характерной для СД2 и МС дислипидемии и нормализация липидного обмена.
Рис. 1.
Молекулярные механизмы действия метформина, осуществляемые путем активации AMPK и ингибирования митохондриального комплекса I дыхательной цепи переноса электронов. Условные обозначения: ОСТ1, ОСТ2, MATE1 – транспортеры органических катионов; LKB1 – киназа печени B1; AMPKαβγ – гетеротримерная АМФ-активируемая протеинкиназа, состоящая из субъединиц α1/2 (мишень для активирующего фосфорилирования по остатку Thr172), β1/2 и γ1/2/3; PP2C – протеинфосфатаза 2С; CREB – цАМФ-активируемый транскрипционный фактор (cAMP response element-binding protein); CBP, p-CBP – CREB-связывающий белок с ацетилтрансферазной активностью, коактиватор фактора CREB, и его фосфорилированная форма; AMPD1 – АМФ-дезаминаза; АЦ – аденилатциклаза; ПКА – протеинкиназа А; mG3PDH – митохондриальная глицерол-3-фосфатдегидрогеназа; NFκB – ядерный фактор κB; комплекс I – митохондриальный NADH-дегидрогеназный комплекс, первый комплекс дыхательной цепи переноса электронов. Fig.1. The molecular mechanisms of metformin action which are carried out by activation of AMPK and inhibition of mitochondrial complex I of the respiratory electron transport chain. Abbreviations: OST1, OST2, and MATE1 – the transporters of organic cations; LKB1 – liver kinase B1; AMPKαβγ – the heterotrimeric AMP-activated protein kinase consisting of the α1/2 (the target for activation phosphorylation at the Thr172 residue), β1/2 and γ1/2/3 subunits; PP2C – protein phosphatase 2C; CREB – cAMP-activated transcription factor (cAMP response element-binding protein); CBP, p-CBP – CREB-binding protein with acetyltransferase activity, a co-activator of the factor CREB, and its phosphorylated form; AMPD1 – AMP deaminase; AC – adenylyl cyclase; PKA – protein kinase A; mG3PDH – mitochondrial glycerol-3-phosphate dehydrogenase; NFκB – nuclear factor κB; complex I – mitochondrial NADH-dehydrogenase complex, the first complex of the respiratory electron transport chain.
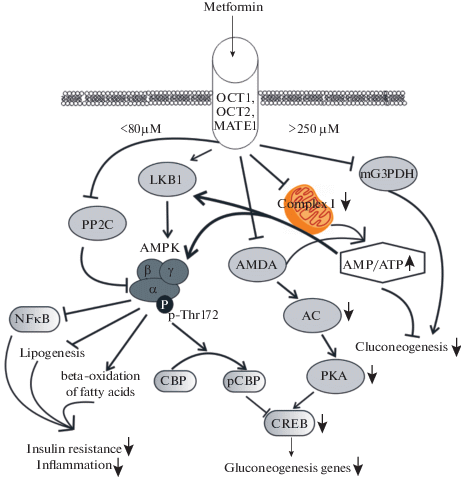
Наряду с AMPK-зависимыми имеются и не зависимые от AMPK пути влияния МФ на эффекторные системы клетки. Подавляя активность АМФ-дезаминазы, МФ может вызвать АМФ-опосредуемое ингибирование фермента аденилатциклазы, что ведет к снижению уровня внутриклеточного цАМФ и ослаблению активности протеинкиназы А [16] (рис. 1). Снижение активности цАМФ-зависимых путей в печени, как и активация AMPK, ингибирует синтез глюкозы гепатоцитами. МФ ингибирует митохондриальную челночную глицерол-3-фосфатдегидрогеназу (mG3PDH), переносящую NADH из цитоплазмы в митохондрии [17]. Ингибирование активности mG3PDH повышает уровень NADH и снижает уровень NAD+, что вызывает дефицит NAD+, который вовлечен в реакцию превращения лактата в пируват. Поскольку снижение активности mG3PDH ингибирует процесс превращения лактата в глюкозу, то результатом является снижение интенсивности глюконеогенеза в гепатоцитах и накопление лактата, что может вызывать лактоацидоз при длительном лечении высокими дозами МФ [17, 18]. Недавно была идентифицирована еще одна мишень МФ – фермент H3K27me3-деметилаза KDM6A/UTX, ответственная за транскрипционную активность некоторых генов [19]. Ряд антидиабетических эффектов МФ может быть обусловлен изменениями в микробиоте кишечника, вследствие стимуляции роста бактерий, которые продуцируют короткоцепочечные жирные кислоты [20, 21]. Модулируя состав микробиоты у грызунов с СД2 и МС, МФ снижает уровни бактериальных липополисахаридов в крови [22], а также активирует AMPK-зависимые пути в мукозном слое кишечника, снижая абсорбцию глюкозы [23].
Среди механизмов действия МФ, направленных на усиление инсулиновых сигнальных путей, определяющую роль играет ингибирование активности ядерного фактора κB (NF-κB), вызывающего развитие инсулиновой резистентности, а также снижение экспрессии фосфатазы PTEN, которая дефосфорилирует фосфатидилинозитол-3,4,5-трифосфат и, тем самым, предотвращает стимуляцию инсулином Akt-киназы, ключевого эффекторного звена 3-фосфоинозитидного пути. Ингибирующее влияние МФ на активность NF-κB-зависимых сигнальных путей осуществляется в основном через стимуляцию AMPK [2, 24]. Поскольку NF-κB играет ключевую роль в воспалительных реакциях, то вызываемое МФ ингибирование активности этого фактора способствует ослаблению процессов воспаления и повышает выживаемость клеток.
МЕТФОРМИН И ЖЕНСКАЯ РЕПРОДУКТИВНАЯ СИСТЕМА
Наибольшее число клинических данных по применению МФ для коррекции заболеваний женской репродуктивной системы и повышения эффективности вспомогательных репродуктивных технологий относятся к пациенткам с синдромом поликистозных яичников (СПКЯ), который встречается в среднем у 5–10% женщин репродуктивного возраста и гораздо чаще у женщин с СД2, МС и гестационным диабетом. СПКЯ диагностируется по трем основным критериям: (1) наличие олиго- или ановуляции, (2) гиперандрогения, (3) наличие 12 или большего числа фолликулов размером от 2 до 9 мм в каждом яичнике или увеличение объема яичников свыше 10 мл [25]. Для СПКЯ характерны резистентность к инсулину и лептину, повышение активности факторов воспаления, нарушения липидного и углеводного обмена. В настоящее время получено немало доказательств в пользу эффективности МФ для восстановления функций яичников у женщин с СПКЯ, причем в ряде стран МФ целенаправленно назначают во время беременности женщинам с СПКЯ и гестационным диабетом [26, 27].
Результаты обследования 2150 женщин с СПКЯ, полученные при проведении 27 клинических исследований, показали, что МФ повышает частоту овуляции, улучшает клинические показатели беременности, усиливает терапевтический эффект кломифен-цитрата – препарата, широко применяемого для лечения СКПЯ [28]. МФ усиливает терапевтический эффект нестероидного ингибитора ароматазы летрозола у женщин с СПКЯ, повышая частоту наступления беременности и коэффициент рождаемости [29]. Большинство авторов указывает на то, что МФ улучшает результативность контролируемой индукции овуляции и клинические показатели беременности у женщин с СПКЯ и СД2 [28, 30, 31]. Одни из них считают, что положительные эффекты МФ на фолликулогенез, овуляцию и развитие эмбриона у женщин с СПКЯ обусловлены его прямым действием на ткани яичников, в то время как другие связывают эти эффекты с нормализацией чувствительности тканей к инсулину, восстановлением метаболических показателей, снижением активности факторов воспаления [32].
Показано, что при длительном лечении пациенток с СКПЯ с помощью МФ отмечается снижение уровня андрогенов и нормализация уровня лютеинизирующего гормона, основного активатора синтеза андрогенов в фолликулярных клетках яичников, что приводит к возобновлению менструаций, сопровождающихся овуляцией, и восстановлению фертильности, в том числе при контролируемой индукции овуляции [33]. МФ предотвращает гиперандрогению посредством ослабления гиперинсулинемии, которая не только является одним из ведущих факторов, провоцирующих СПКЯ [34], но также усиливает синтез андрогенов яичниками [35] и снижает продукцию связывающего стероидные гормоны глобулина, повышая, тем самым, уровень свободных андрогенов в крови [36]. Наряду с ослаблением гиперандрогении, МФ предотвращает ее негативные последствия, как это показано на модели СПКЯ у мышей, индуцированной дегидроэпиандростероном. При лечении мышей МФ (500 мг/кг, 20 дней) отмечали нормализацию числа ооцитов, находящихся в метафазе II мейотического деления, восстановление потенциала внутренней мембраны митохондрий и содержания АТФ в ооцитах, ослабление окислительного стресса, что выражалось в снижении активных форм кислорода и нормализации уровня восстановленного глутатиона. В результате повышалось качество ооцитов и нормализовались начальные стадии эмбриогенеза [37].
Эффекты МФ на синтез андрогенов реализуются в основном через AMPK-зависимые механизмы [31]. При действии на культуру клеток теки яичников человека как в базальном состоянии, так и при воздействии активатора аденилатциклазы форсколина, МФ стимулировал AMPK и при этом снижал синтез андростендиона, предшественника тестостерона. В клетках теки, стимулированных форсколином, он подавлял экспрессию генов белка StAR, транспортирующего холестерин в митохондрии (скорость-лимитирующая стадия синтеза тестостерона), и фермента 17α-гидроксилазы, катализирующего синтез андростендиона [38]. В пользу функциональной важности AMPK для женской фертильности свидетельствуют данные о том, что делеция каталитической α1-субъединицы AMPK в ооцитах мышей приводит к значительному снижению у мутантных животных как размера помета, так и количества эмбрионов после экстракорпорального оплодотворения, причинами чего являются нарушение клеточного деления и дисфункции митохондрий, зависимые от активности AMPK [39].
Наряду с ослаблением гиперандрогении МФ ингибирует экспрессию гена ароматазы в фолликулярных клетках, снижая продукцию эстрогенов, в том числе индуцированную ФСГ и другими гормонами [40, 41]. У значительной части женщин с СПКЯ отмечается повышение чувствительности клеток гранулезы яичников к ФСГ, инсулину и инсулиноподобному фактору роста-1 (ИФР-1). Наряду с этим в клетках гранулезы повышена экспрессия рецептора ФСГ и гиперактивированы внутриклеточные мишени этого гонадотропина [42]. Все это приводит к ускоренному росту и пролиферации фолликулярных клеток в ответ на воздействие ФСГ, инсулина и ИФР-1 [43]. Ослабляя стимулирующие эффекты ФСГ, инсулина и ИФР-1 на стероидогенез и ростовую активность клеток гранулезы, МФ нормализует процессы фолликулогенеза и овуляции. Таким образом, МФ обеспечивает отсрочку запуска системы, стимулирующей рост фолликулов, поскольку для нормальной дифференцировки и развития антральных фолликулов, способных войти в менструальный цикл, требуется около трех месяцев [40]. В пользу этого свидетельствуют данные о том, что трехмесячное введение о МФ пациенткам с СПКЯ улучшает показатели беременности и число новорожденных [28, 44].
Одной из причин ослабления чувствительности яичников к ФСГ, инсулину и ИФР-1 и подавления в них экспрессии ароматазы является МФ-индуцированное снижение экспрессии рецепторов ФСГ, инсулина и ИФР-1 в клетках гранулезы яичников [40, 41]. Наряду с этим МФ ингибирует фосфорилирование фактора CREB, предотвращая цАМФ-зависимую активацию экспрессии CREB-зависимых генов, и подавляет транслокацию в ядро фактора CRTC2, необходимого для сборки активационного комплекса, включающего CREB. Все эти процессы независимы от AMPK, что указывает на участие в контроле функций яичников как зависимых, так и независимых от AMPK механизмов действия МФ [40].
МЕТФОРМИН И МУЖСКАЯ РЕПРОДУКТИВНАЯ СИСТЕМА
У мужчин СД2 и МС также приводят к снижению фертильности, что обусловлено нарушениями сперматогенеза и стероидогенеза, снижением количества и качества сперматозоидов [45]. Лечение мужчин с МС, имеющих нарушения сперматогенеза – олигоспермию, тератозооспермию и астенозооспермию, с помощью МФ в течение 6 месяцев повышало число сперматозоидов, их подвижность, улучшало морфологию и, по крайней мере, частично восстанавливало фертильность. Основными причинами этого были повышение чувствительности тканей к инсулину, ослабление гипергликемии и гиперинсулинемии, а также нормализация андрогенного статуса, что было обусловлено снижением продукции связывающего стероидные гормоны глобулина и повышением уровня свободного тестостерона в крови [46]. Лечение МФ также восстанавливало пульсирующий выброс лютеинизирующего гормона, что указывает на нормализацию различных звеньев гипоталамо-гипофизарно-гонадной оси, в том числе гипоталамических нейронов, секретирующих гонадолиберин, рилизинг-фактор лютеинизирующего гормона [46]. Необходимо отметить, что на уровне гипоталамуса МФ подобно лептину нормализует активность AMPK и улучшает функциональное состояние нейронов, продуцирующих про-опиомеланокортин, предшественник α-меланоцитстимулирующего гормона и других пептидов меланокортинового семейства [47]. Поскольку меланокортиновые пептиды являются положительными регуляторами секреторной активности гонадолиберин-экспрессирующих нейронов [48, 49], то повышение их уровня в гипоталамических структурах приводит к усилению продукции гонадолиберина и активации гонадной оси, что и наблюдается при лечении МФ мужчин с МС. В той связи следует подчеркнуть, что многие эффекты МФ на фертильность у женщин с СПКЯ также могут быть обусловлены гипоталамическими механизмами действия МФ [50].
Лечение МФ восстанавливало массу и морфологию яичек, показатели сперматогенеза и уровень тестостерона в крови грызунов с метаболическими расстройствами, ассоциированными с репродуктивными дисфункциями [51–56]. Лечение диабетических крыс МФ восстанавливало систему антиоксидантной защиты и окислительно-восстановительный баланс в семенниках, предотвращало нарушение стабильности генома и изменения пролиферативной активности тестикулярных соматических и генеративных клеток, оказывая тем самым антигенотоксический эффект [51]. Четырехнедельное лечение самцов крыс с СД2 МФ и пиоглитазоном снижало долю дефектных сперматозоидов и повышало количество каудальных сперматозоидов [52]. Лечение МФ (100 мг/кг/сутки, 8 недель) самцов крыс линии Sprague–Dawley с МС, вызванным высокожировой диетой, восстанавливало уровни инсулина, лептина, эстрогенов и тестостерона в крови, существенно снижало число мелких, атрофированных, неправильной формы семенных канальцев, нормализовало количество сперматогоний, клеток Сертоли и Лейдига, уменьшало интенсивность апоптотических и провоспалительных процессов в тестикулярных клетках, повышало количество подвижных сперматозоидов и улучшало их морфологию [53]. Одним из ключевых механизмов положительного влияния МФ на функции сперматозоидов, как полагают, является его способность стимулировать AMPK в тестикулярной ткани. Фармакологическое подавление активности AMPK резко снижало долю сперматозоидов с прямолинейным направленным движением и скорость их движения [57].
Четырехнедельное лечение самцов крыс линии Sprague–Dawley с СД2 МФ в сравнительно высокой дозе (300 мг/кг/сутки) повышало уровень тестостерона в крови и семенниках, нормализовало количество клеток Лейдига, улучшало морфологические показатели сперматозоидов, препятствовало ДНК-фрагментации в ядрах сперматозоидов, восстанавливало экспрессию и активность транспортного белка StAR и стероидогенных ферментов – цитохрома CYP11A1 и дегидрогеназ 3β-HSD и 17β-HSD, а также повышало активность ферментов антиоксидантной защиты, ослабляя провоспалительные и апоптотические процессы в семенниках [55, 56]. Восстанавливающий эффект на функции тестикулярных клеток и сперматогенез МФ оказывал при лечении крыс с тестикулярной ишемией/реперфузией, вызванной перекрутом и деформацией яичек [54]. В этом случае прием МФ снижал уровень малонового альдегида, маркера окислительного стресса, и ингибировал активность каспазы-3, ключевого фермента апоптоза, в семенниках крыс. При этом МФ нормализовал активность системы антиоксидантной защиты в тестикулярных клетках уже через 4 ч после ишемии/реперфузии яичек [54].
В то время как МФ оказывает положительное влияние на репродуктивные функции при лечении мужчин и экспериментальных животных с метаболическими расстройствами, при внутриутробном воздействии МФ демонстрирует ряд негативных эффектов на развитие семенников у плода. Так, введение МФ беременным самкам мышей уменьшало размеры яичек у новорожденных самцов, а во внутриутробный период снижало количество клеток Сертоли и Лейдига, прогениторных клеток и уровень андрогенов в семенниках плода [58]. В условиях in vitro при воздействии МФ на культивируемые клетки Лейдига снижалась продукция ими тестостерона и экспрессия генов стероидогенеза. Одним из факторов негативного влияния МФ на стероидогенез в культуре клеток Лейдига является накопление лактата, ведущее к лактоацидозу [58]. В свою очередь индуцированное МФ ингибирование ростовой активности тестикулярных клеток обусловлено его влиянием на клеточный цикл, о чем свидетельствуют уменьшение ФСГ-стимулированной пролиферации, повышение экспрессии и активности ингибиторов циклин-зависимой киназы (p19INK4d, p21Cip1, p27Kip1), снижение активности циклина D [59].
ЗАКЛЮЧЕНИЕ
МФ нормализует репродуктивные функции у женщин с СПКЯ и гестационным диабетом и у мужчин с СД2 и МС, восстанавливая процессы фолликулогенеза, оогенеза и сперматогенеза. Это обусловлено его стимулирующим влиянием на сниженную при этих заболеваниях активность AMPK в гонадах, а также активацией AMPK-независимых механизмов, в первую очередь аденилатциклазного сигнального пути, через который регулируется экспрессия большого числа генов и который вовлечен в контроль стероидогенеза, гаметогенеза, роста и дифференцировки тестикулярных и фолликулярных клеток. МФ может влиять на гонадолиберин-экспрессирующие гипоталамические нейроны, нормализуя функции гонад через центральные механизмы. Воздействие МФ на различные звенья гипоталамо-гипофизарно-гонадной оси может осуществляться опосредованно, через ослабление гипергликемии и гиперинсулинемии и ассоциированных с ними окислительных и воспалительных процессов, что улучшает метаболический и гормональный статус репродуктивной системы и способствует восстановлению ее функций при СД2, МС и СПКЯ, а также вследствие нормализации интегративных связей между гипоталамическими системами, вовлеченными в центральную регуляцию репродуктивных функций [8, 47]. Доказанная роль МФ в контроле женской и мужской репродуктивной системы требует дальнейших усилий по расшифровке молекулярных механизмов его действия, которые характеризуются видовой, тканевой и клеточной специфичностью, в значительной степени зависят от метаболического статуса организма. Важно отметить, что МФ присущи и эпигенетические эффекты, поскольку имеются данные об отставленных эффектах пренатального применения МФ на транскрипционную активность генов в постнатальном периоде и взрослом состоянии [31, 60].
Список литературы
Sliwinska A., Drzewoski J. Molecular action of metformin in hepatocytes: an updated insight. Curr. Diabetes Rev. 11(3): 175–181. 2015. https://doi.org/10.2174/1573399811666150325233108
An H., He L. Current understanding of metformin effect on the control of hyperglycemia in diabetes. J. Endocrinol. 228(3): R97–R106. 2016. https://doi.org/10.1530/JOE-15-0447
Gong L., Goswami S., Giacomini K.M., Altman R.B., Klein T.E. Metformin pathways: pharmacokinetics and pharmacodynamics. Chemosphere. 104: 8897–8901. 2012. https://doi.org/10.1097/FPC.0b013e3283559b22
Shu Y., Brown C., Castro R.A., Shi R.J., Lin E.T., Owen R.P., Sheardown S.A., Yue L., Burchard E.G., Brett C.M., Giacomini K.M. Effect of genetic variation in the organic cation transporter 1, OCT1, on metformin pharmacokinetics. Clin. Pharmacol. Ther. 83(2): 273–280. 2008. https://doi.org/10.1038/sj.clpt.6100275
Chang H.H., Hsueh Y.S., Cheng Y.W., Ou H.T., Wu M.H. Association between Polymorphisms of OCT1 and Metabolic Response to Metformin in Women with Polycystic Ovary Syndrome. Int. J. Mol. Sci. 20(7): pii: E1720. 2019. https://doi.org/10.3390/ijms20071720
Graham G.G., Punt J., Arora M., Day R.O., Doogue M.P., Duong J.K., Furlong T.J., Greenfield J.R., Greenup L.C., Kirkpatrick C.M., Ray J.E., Timmins P., Williams K.M. Clinical pharmacokinetics of metformin. Clin. Pharmacokinet. 50(2): 81–98. 2011. https://doi.org/10.2165/11534750-000000000-00000
Foretz M., Hébrard S., Leclerc J., Zarrinpashneh E., Soty M., Mithieux G., Sakamoto K., Andreelli F., Viollet B. Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state. J. Clin. Invest. 120(7): 2355–2369. 2010. https://doi.org/10.1172/JCI40671DS1
Shpakov A.O., Derkach K.V. Molecular Mechanisms of the Effects of Metformin on the Functional Activity of Brain Neurons. Neurosci. Behav. Physiol. 48(8): 969–977. 2018. https://doi.org/10.1007/s11055-018-0657-6
Rena G., Hardie D.G., Pearson E.R. The mechanisms of action of metformin. Diabetologia. 60(9): 1577–1585. 2017. https://doi.org/10.1007/s00125-017-4342-z
Hardie D.G., Ross F.A., Hawley S.A. AMPK: a nutrient and energy sensor that maintains energy homeostasis. Nat. Rev. Mol. Cell. Biol. 13(4): 251–262. 2012. https://doi.org/10.1038/nrm3311
Meng S., Cao J., He Q., Xiong L., Chang E., Radovick S., Wondisford F.E., He L. Metformin activates AMP-activated protein kinase by promoting formation of the alphabetagamma heterotrimeric complex. J. Biol. Chem. 290(6): 3793–3802. 2015. https://doi.org/10.1074/jbc.M114.604421
He L., Sabet A., Djedjos S., Miller R., Sun X.J., Hussain M.A., Radovick S., Wondisford F.E. Metformin and Insulin Suppress Hepatic Gluconeogenesis through Phosphorylation of CREB Binding Protein. Cell. 137(4): 635–646. 2009. https://doi.org/10.1016/j.cell.2009.03.016
He L., Wondisford F.E. Metformin Action: Concentrations Matter. Cell Metab. 21(2): 159–162. 2015. https://doi.org/10.1016/j.cmet.2015.01.003
Cao J., Meng S.M., Chang E., Beckwith-Fickas K., Xiong L.S., Cole R.N., Radovick S., Wondisford F.E., He L. Low Concentrations of Metformin Suppress Glucose Production in Hepatocytes through AMP-activated Protein Kinase (AMPK). J. Biol. Chem. 289(30): 20435–20446. 2014. https://doi.org/10.1074/jbc.M114.567271
Cameron A.R., Logie L., Patel K., Erhardt S., Bacon S., Middleton P., Harthill J., Forteath C., Coats J.T., Kerr C., Curry H., Stewart D., Sakamoto K., Repiščák P., Paterson M.J., Hassinen I., McDougall G., Rena G. Metformin selectively targets redox control of complex I energy transduction. Redox Biol. 14: 187–197. 2018. https://doi.org/10.1016/j.redox.2017.08.018
Miller R.A., Chu Q.W., Xie J.X., Foretz M., Viollet B., Birnbaum M.J. Biguanides suppress hepatic glucagon signalling by decreasing production of cyclic AMP. Nature. 494(7436): 256–260. 2013. https://doi.org/10.1038/nature11808
Madiraju A.K., Erion D.M., Rahimi Y., Zhang X.-M., Braddock D.T., Albright R.A., Prigaro B.J., Wood J.L., Bhanot S., MacDonald M.J., Jurczak M.J., Camporez J.P., Lee H.Y., Cline G.W., Samuel V.T., Kibbey R.G., Shulman G.I. Metformin suppresses gluconeogenesis by inhibiting mitochondrial glycerophosphate dehydrogenase. Nature. 510(7506): 542–546. 2014. https://doi.org/10.1038/nature13270
Madiraju A.K., Qiu Y., Perry R.J., Rahimi Y., Zhang X.-M., Zhang D., Camporez J.G., Cline G.W., Butrico G.M., Kemp B.E., Casals G., Steinberg G.R., Vatner D.F., Petersen K.F., Shulman G.I. Metformin inhibits gluconeogenesis via a redox-dependent mechanism in vivo. Nat. Med. 24(9): 1384–1394. 2018. https://doi.org/10.1038/s41591-018-0125-4
Cuyàs E., Verdura S., Llorach-Pares L., Fernández-Arroyo S., Luciano-Mateo F., Cabré N., Stursa J., Werner L., Martin-Castillo B., Viollet B., Neuzil J., Joven J., Nonell-Canals A., Sanchez-Martinez M., Menendez J.A. Metformin directly targets the H3K27me3 demethylase KDM6A/UTX. Aging Cell. 17(4): e12772. 2018. https://doi.org/10.1111/acel.12772
Bauer P.V., Duca F.A., Waise T.M.Z., Rasmussen B.A., Abraham M.A., Dranse H.J., Puri A., O’Brien C.A., Lam T.K.T. Metformin alters upper small intestinal microbiota that impact a glucose-SGLT1-sensing glucoregulatory pathway. Cell Metab. 27(1): 101–117. 2017. https://doi.org/10.1016/j.cmet.2017.09.019
Wu H., Esteve E., Tremaroli V., Khan M.T., Caesar R., Mannerås-Holm L., Ståhlman M., Olsson L.M., Serino M., Planas-Fèlix M., Xifra G., Mercader J.M., Torrents D., Burcelin R., Ricart W., Perkins R., Fernàndez-Real J.M., Bäckhed F. Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the therapeutic effects of the drug. Nat. Med. 23(7): 850–858. 2017. https://doi.org/10.1038/nm.4345
Shin N.R., Lee J.C., Lee H.Y., Kim M.S., Whon T.W., Lee M.S., Bae J.W. An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice. Gut. 63(5): 727–735. 2014. https://doi.org/10.1136/gutjnl-2012-303839
Duca F.A., Cote C.D., Rasmussen B.A., Zadeh-Tahmasebi M., Rutter G.A., Filippi B.M., Lam T.K. Metformin activates a duodenal Ampk-dependent pathway to lower hepatic glucose production in rats. Nat. Med. 21(5): 506–511. 2015. https://doi.org/10.1038/nm.3787
Huang N.L., Chiang S.H., Hsueh C.H., Liang Y.J., Chen Y.J., Lai L.P. Metformin inhibits TNF-alpha-induced I kappa B kinase phosphorylation, I kappa B-alpha degradation and IL-6 production in endothelial cells through PI3K-dependent AMPK phosphorylation. Int. J. Cardiol. 134(2): 169–175. 2009. https://doi.org/10.1016/j.ijcard.2008.04.010
Cimino I., Casoni F., Liu X., Messina A., Parkash J., Jamin S.P., Catteau-Jonard S., Collier F., Baroncini M., Dewailly D., Pigny P., Prescott M., Campbell R., Herbison A.E., Prevot V., Giacobini P. Novel role for anti-mullerian hormone in the regulation of GnRH neuron excitability and hormone secretion. Nat. Commun. 7: 1–12. 2016. https://doi.org/10.1038/ncomms10055
Sivalingam V.N., Myers J., Nicholas S., Balen A.H., Crosbie E.J. Metformin in reproductive health, pregnancy and gynaecological cancer: established and emerging indications. Hum. Reprod. Update. 20(6): 853–868. 2014. https://doi.org/10.1093/humupd/dmu037
Martis R., Crowther C.A., Shepherd E., Alsweiler J., Downie M.R., Brown J. Treatments for women with gestational diabetes mellitus: an overview of Cochrane systematic reviews. Cochrane Database Syst. Rev. 8: CD012327. 2018. https://doi.org/10.1002/14651858.CD012327.pub2
Tang T., Lord J., Norman R., Yasmin E., Balen A. Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) forwomenwith polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database Syst. Rev. 5–7: CD003053. 2012. https://doi.org/10.1002/14651858.CD003053.pub5
Yu Y., Fang L., Zhang R., He J., Xiong Y., Guo X., Du Q., Huang Y., Sun Y. Comparative effectiveness of 9 ovulation-induction therapies in patients with clomiphene citrate-resistant polycystic ovary syndrome: a network meta-analysis. Sci. Rep. 7(1): 1–12. 2017. https://doi.org/10.1038/s41598-017-03803-9
Palomba S., Falbo A., La Sala G.B. Metformin and gonadotropins for ovulation induction in patients with polycystic ovary syndrome: a systematic review with meta-analysis of randomized controlled trials. Reprod. Biol. Endocrinol. 12: 3. 2014. https://doi.org/10.1186/1477-7827-12-3
Faure M., Bertoldo M.J., Khoueiry R., Bongrani A., Brion F., Giulivi C., Dupont J., Froment P. Metformin in Reproductive Biology. Front Endocrinol. (Lausanne). 9: 675. 2018. https://doi.org/10.3389/fendo.2018.00675
Kalem M.N., Kalem Z., Gurgan T. Effect of metformin and oral contraceptives on polycystic ovary syndrome and IVF cycles. J. Endocrinol. Invest. 40(7): 745–752. 2017. https://doi.org/10.1007/s40618-017-0634-x
Barbieri R.L., Makris A., Randall R.W., Daniels G., Kistner R.W., Ryan K.J. Insulin stimulates androgen accumulation in incubations of ovarian stroma obtained from women with hyperandrogenism. J. Clin. Endocrinol. Metab. 62(5): 904–910. 1986. https://doi.org/10.1210/jcem-62-5-904
Stepto N.K., Cassar S., Joham A.E., Hutchison S.K., Harrison C.L., Goldstein R.F., Teede H.J. Women with polycystic ovary syndrome have intrinsic insulin resistance on euglycaemic-hyperinsulaemic clamp. Hum. Reprod. 28(3): 777–784. 2013. https://doi.org/10.1093/humrep/des463
Adashi E.Y., Resnick C.E., D’Ercole A.J., Svoboda M.E., Van Wyk J.J. Insulin-like growth factors as intraovarian regulators of granulosa cell growth and function. Endocr. Rev. 6: 400–420. 1985. https://doi.org/10.1210/edrv-6-3-400
Nestler J.E., Powers L.P., Matt D.W. A direct effect of hyperinsulinemia on serum sex hormone-binding globulin levels in obese women with the polycystic ovary syndrome. J. Clin. Endocrinol. Metab. 72(1): 83–89. 1991. https://doi.org/10.1210/jcem-72-1-83
Huang Y., Yu Y., Gao J., Li R., Zhang C. Impaired oocyte quality induced by dehydroepiandrosterone is partially rescued by metformin treatment. PLoS One. 10:e 0122370. 2015. https://doi.org/10.1371/journal.pone.0122370
Attia G.R., Rainey W.E., Carr B.R. Metformin directly inhibits androgen production in human thecal cells. Fertil. Steril. 76(3): 517–524. 2001. https://doi.org/10.1016/S0015-0282(01)01975-6
Bertoldo M.J., Guibert E., Faure M., Ramé C., Foretz M., Viollet B., Dupont J., Froment P. Specific deletion of AMP-activated protein kinase (α1AMPK) in murine oocytes alters junctional protein expression and mitochondrial physiology. PLoS ONE. 10(3):e0119680. 2015. https://doi.org/10.1371/journal.pone.0119680
Rice S., Elia A., Jawad Z., Pellatt L., Mason H.D. Metformin inhibits follicle-stimulating hormone (FSH) action in human granulosa cells: relevance to polycystic ovary syndrome. J. Clin. Endocrinol. Metab. 98(9): E1491–E500. 2013. https://doi.org/10.1210/jc.2013-1865
Fuhrmeister I., Branchini G., Pimentel A., Ferreira G., Capp E., Brum I., von Eye Corleta H. Human granulosa cells: insulin and insulin-like growth factor-1 receptors and aromatase expression modulation by metformin. Gynecol. Obs. Invest. 77: 156–162. 2014. https://doi.org/10.1159/000358829
Catteau-Jonard S., Jamin S.P., Leclerc A., Gonzalès J., Dewailly D., di Clemente N. Anti-Mullerian hormone, its receptor, FSH receptor, and androgen receptor genes are overexpressed by granulosa cells from stimulated follicles in women with polycystic ovary syndrome. J. Clin. Endocrinol. Metab. 93(11): 4456–4461. 2008. https://doi.org/10.1210/jc.2008-1231
Willis D.S., Watson H., Mason H.D., Galea R., Brincat M., Franks S. Premature response to luteinizing hormone of granulosa cells from anovulatory women with polycystic ovary syndrome: relevance to mechanism of anovulation. J. Clin. Endocrinol. Metab. 83(11): 3984–3991. 1998. https://doi.org/10.1210/jcem.83.11.5232
Morin-Papunen L., Rantala A.S., Unkila-Kallio L., Tiitinen A., Hippeläinen M., Perheentupa A., Tinkanen H., Bloigu R., Puukka K., Ruokonen A., Tapanainen J.S. Metformin improves pregnancy and live-birth rates in women with polycystic ovary syndrome (PCOS): a multicenter, double-blind, placebo-controlled randomized trial. J. Clin. Endocrinol. Metab. 97(5): 1492–1500. 2012. https://doi.org/10.1210/jc.2011-3061
Dupont C., Faure C., Sermondade N., Boubaya M., Eustache F., Clément P., Briot P., Berthaut I., Levy V., Cedrin-Durnerin I., Benzacken B., Chavatte-Palmer P., Levy R. Obesity leads to higher risk of sperm DNA damage in infertile patients. Asian J. Androl. 15(5): 622–625. 2013. https://doi.org/10.1038/aja.2013.65
Morgante G., Tosti C., Orvieto R., Musacchio M.C., Piomboni P., De Leo V. Metformin improves semen characteristics of oligo-terato-asthenozoospermic men with metabolic syndrome. Fertil Steril. 95: 2150–2152. 2011. https://doi.org/10.1016/j.fertnstert.2010.12.009
Derkach K., Zakharova I., Zorina I., Bakhtyukov A., Romanova I., Bayunova L., Shpakov A. The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PLoS ONE. 14(3): e0213779. 2019. https://doi.org/10.1371/journal.pone.0213779
Mathew H., Castracane V.D., Mantzoros C. Adipose tissue and reproductive health. Metabolism. 86: 18–32. 2018. https://doi.org/10.1016/j.metabol.2017.11.006
Shpakov A.O., Ryzhov J.R., Bakhtyukov A.A., Derkach K.V. The regulation of the male hypothalamic-pituitary-gonadal axis and testosterone production by adipokines. In: Advances in Testosterone Action (Ed by M. Estrada). Intech Open Access Publisher, Rijeka, Croatia. 25–57. 2018. https://doi.org/10.5772/intechopen.76321
Бахтюков А.А., Шпаков А.О. Молекулярные механизмы действия лептина на гипоталамо-гипофизарно-гонадную ось. Цитология. 60(10): 755–767. 2018. [Bakhtyukov A.A., Shpakov A.O. Molecular mechanisms of leptin action on the hypothalamic-pituitary-gonadal axis. Tsitologiia. 60(10): 755–767. 2018.(In Russ)]. https://doi.org/10.7868/S0041377118100016
Attia S.M., Helal G.K., Alhaider A.A. Assessment of genomic instability in normal and diabetic rats treated with metformin. Chem. Biol. Interact. 180: 296-304. 2009. https://doi.org/10.1016/j.cbi.2009.03.001
Rabbani S.I., Devi K., Khanam S. Role of pioglitazone with metformin or glimepiride on oxidative stress-induced nuclear damage and reproductive toxicity in diabetic rats. Malays J. Med. Sci. 17: 3–11. 2010.
Yan W.J., Mu Y., Yu N., Yi T.L., Zhang Y., Pang X.L., Cheng D., Yang J. Protective effects of metformin on reproductive function in obese male rats induced by high-fat diet. J. Assist. Reprod. Genet. 32(7): 1097–1104. 2015. https://doi.org/10.1007/s10815-015-0506-2
Ghasemnejad-Berenji M., Ghazi-Khansari M., Yazdani I., Nobakht M., Abdollahi A., Ghasemnejad-Berenji H., Mohajer Ansari J., Pashapour S., Dehpour A.R. Effect of metformin on germ cell-specific apoptosis, oxidative stress and epididymal sperm quality after testicular torsion/detorsion in rats. Andrologia. 50(2). 2018. https://doi.org/10.1111/and.12846
Nna V.U., Bakar A.B.A., Ahmad A., Mohamed M. Diabetes-induced testicular oxidative stress, inflammation, and caspase-dependent apoptosis: the protective role of metformin. Arch. Physiol. Biochem. 4: 1–12. 2018. https://doi.org/10.1080/13813455.2018.1543329
Nna V.U., Bakar A.B.A., Ahmad A., Mohamed M. Down-regulation of steroidogenesis-related genes and its accompanying fertility decline in streptozotocin-induced diabetic male rats: ameliorative effect of metformin. Andrology. 7(1): 110–123. 2019. https://doi.org/10.1111/andr.12567
Hurtado de Llera A., Martin-Hidalgo D., Gil M.C., Garcia-Marin L.J., Bragado M.J. AMP-activated kinase AMPK is expressed in boar spermatozoa and regulates motility. PLoS ONE. 7: e38840. 2012. https://doi.org/10.1371/journal.pone.0038840
Tartarin P., Moison D., Guibert E., Dupont J., Habert R., Rouiller-Fabre V., Frydman N., Pozzi S., Frydman R., Lecureuil C., Froment P. Metformin exposure affects human and mouse fetal testicular cells. Hum. Reprod. 27: 3304–3314. 2012. https://doi.org/10.1093/humrep/des264
Riera M.F., Regueira M., Galardo M.N., Pellizzari E.H., Meroni S.B., Cigorraga S.B. Signal transduction pathways in FSH regulation of rat Sertoli cell proliferation. Am. J. Physiol. Endocrinol. Metab. 302(8): E914-E923. 2012. https://doi.org/10.1152/ajpendo.00477.2011
Bridgeman S.C., Ellison G.C., Melton P.E., Newsholme P., Mamotte C.D.S. Epigenetic effects of metformin: from molecular mechanisms to clinical implications. Diabetes Obes Metab. 20(7): 1553–1562. 2018. https://doi.org/10.1111/dom.13262
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


