Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 7, стр. 853-865
Исследование иннервации двенадцатиперстной кишки крысы с использованием нейральных иммуногистохимических маркеров
Е. И. Чумасов 1, 2, *, Е. С. Петрова 1, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
2 Санкт-Петербургская государственная академии ветеринарной медицины
Санкт-Петербург, Россия
* E-mail: iemmorphol@yandex.ru
Поступила в редакцию 07.02.2020
После доработки 21.03.2020
Принята к публикации 04.05.2020
Аннотация
Цель работы – исследовать топографию, морфологические особенности и медиаторный статус нервных аппаратов двенадцатиперстной кишки половозрелых крыс с помощью иммуногистохимических методов. Использование селективных для периферической нервной системы маркеров (PGP 9.5, синаптофизина (Syn), тирозингидроксилазы (TH) и серотонина (5HT)) позволило выявить в тканях стенки кишки, кроме двух основных (миентерального и подслизистого ганглиозных нервных сплетений), третье – слизистое эпителиально-ворсинчатое. С помощью сравнительного иммуногистохимического анализа установлено, что подавляющее число нервных структур (нейронов, нервных волокон, межнейронных и нейромышечных синапсов в ганглизных сплетениях) имеют PGP 9.5 иммуноположительную реакцию и холинергическую природу. Катехоламинергические и серотонинергические (5HT+) нейроны в исследованных ганглиозных сплетениях отсутствуют. Предполагается, что постганглионарные симпатические волокна приходят в двенадцатиперстную кишку извне. Они участвуют в иннервации мышечных слоев кишечной стенки и артериальных сосудов, образуют перицеллюлярные синапсы на телах и дендритах парасимпатических нейронов. Внутри соединительной ткани ворсинок с помощью PGP 9.5 обнаружено большое количество терминальных холинергических варикозных аксонов, а в эпителии встречаются одиночные биполярные нейроноподобные клетки. Симпатические элементы в ворсинках не выявлены. С помощью реакции на серотонин обнаружено большое количество серотонин-синтезирующих клеток, морфологически сходных с энтерохромаффиноцитами.
Энтеральная нервная система играет основную роль в создании координированных движений кишечника, обеспечении тканей и органов питательными веществами с целью поддержания жизнедеятельности организма. Энтеральная нервная система является частью метасимпатической нервной системы. Понятие о метасимпатической нервной системе как третьем отделе автономной нервной системы определил, а также экспериментально охарактеризовал ее главные элементы академик А.Д. Ноздрачев. Структурные элементы энтеральной нервной системы расположены по всей длине стенки кишечника и представлены диффузными ганглиозными нервными сплетениями. По плотности иннервации в энтеральной нервной системе выделяют два взаимосвязанных нервных сплетения: межмышечное (Ауэрбаха) и подслизистое (Мейснера). Миентеральное сплетение Ауэрбаха локализуется между продольным и кольцевым мышечными слоями кишечника, а Мейснера – в подслизистой оболочке. Известно, что нейроны миентерального сплетения регулируют моторику желудка и кишечника, а нейроны подслизистого сплетения, по предположению ряда авторов, участвуют в поддержании водно-солевого баланса и циркуляции плазмы крови и лимфы в кровеносных и лимфатических сосудах слизистой оболочки [1–3]. Cледует подчеркнуть, что в отличие от наиболее изученного в морфологическом отношении миентерального сплетения, многие вопросы о структуре и функции нейронов подслизистого сплетения, а также об их участии в иннервации тканей слизистой оболочки остаются недостаточно выясненными.
Использование в 60–70-е года прошлого столетия импрегнационных и гистохимических методов и электронной микроскопии внесли существенный вклад в изучение проблемы иннервации желудочно-кишечного тракта. Было уточнено распределение ганглиев вдоль различных отделов кишечной трубки, изучена морфология многих нейронов и нервных волокон на светооптическом и ультраструктурном уровне, описаны различные типы синапсов (аксосоматических, аксодендритических, аксошипиковых) [4–9]. На основании электрофизиологических, фармакологических, гистохимических, биохимических и ультраструктурных признаков выделено более десяти различных типов энтеральных нейронов. Установлено, что большинство нейронов и нервных волокон собственно ганглиозных сплетений, а также нервов, входящих извне, являются холинергическими. Они являются наиболее изученными и считаются основными внутренними структурами энтеральной нервной системы, обеспечивающими моторику стенки кишки.
С помощью иммуногистохимических исследований последних десятилетий в нейронах и нервных волокнах периферической нервной системы обнаружен ряд специфических регуляторных пептидов и разработан большой набор маркеров для их выявления [10]. Некоторые из них: холинацетилтрансфераза (ХАТ), тирозингидроксилаза (TH), серотонин, вещество Р, нейропептид Y и другие были выявлены в тканях желудочно-кишечного тракта. В стенке двенадцатиперстной кишки как в нервных клетках, так и в межганглионарных нервах с помощью иммуногистохимических методов было обнаружено более пяти нейропептидов: вазоактивный интестинальный пептид, вещество Р, соматостатин, мет-энкефалин, бомбензин [11]. Использование иммуногистохимических методов для дальнейшего изучения морфологии и иннервации кишечной стенки весьма актуально. Они необходимы для выяснения нерешённых до конца вопросов о функциональных межнейронных взаимоотношениях и о нейромедиаторном статусе нервных элементов различных отделов желудочно-кишечного тракта позвоночных животных и человека.
Целью настоящей работы явилось исследование нервных аппаратов двенадцатиперстной кишки половозрелых крыс с помощью селективных нейроиммуногистохимических методов.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа проведена на половозрелых (3–4 мес., n = 8) крысах линии Вистар массой 200–250 г. При содержании и умерщвлении животных соблюдали международные правила Хельсинской декларации о гуманном обращении с животными и “Правила проведения работ с использованием экспериментальных животных” (приложение к приказу МЗ СССР № 755 от 12.08.1977 г.). Исследование было одобрено Локальным этическим комитетом Института экспериментальной медицины, Санкт-Петербург, Россия (протокол № 3 от 30 ноября 2017 г.). Крыс умерщвляли передозировкой паров этилового эфира, выделяли фрагменты двенадцатиперстной кишки (ДПК) размером приблизительно 1.5 см из области, располагающейся вблизи поджелудочной железы, и фиксировали в растворе цинк-этанол-формальдегида [10]. После обезвоживания в спиртах возрастающей концентрации материал заливали в парафин и изготавливали срезы толщиной 5 мкм. Часть срезов окрашивали толуидиновым синим по Нисслю, эозином и астровым синим. Иммуногистохимические реакции на три нейральных маркера: белок PGP 9.5, синаптофизин (Syn) и тирозингидроксилазу (TH) проводили на парафиновых срезах. Паннейрональный маркер периферической нервной системы – белок PGP 9.5 применяли для выявления всех нервных структур кишки: нервных стволов и пучков, нервных сплетений и клеток без учета их медиаторной специфики [12]. Для его выявления использовали поликлональные кроличьи антитела в разведении 1 : 200 (Spring Bioscience, США). Для выявления синаптофизин-положительных терминалей [13] применяли поликлональные кроличьи антитела к синаптофизину (MONOSAN, Нидерланды). Для идентификации катехоламинергических структур симпатической нервной системы применяли поликлональные кроличьи антитела к TГ в разведении 1 : 1000 (Abcam, Великобритания). Для выявления серотонина использовали кроличьи поликлональные антитела к 5-гидроокситриптамину (5-НТ) (Leica-Novocastra, Великобритания). В качестве вторичных реагентов использовали реактивы из набора Super Sensitive Polymer-HRP Detection System (Bio Genex, США). Для иммуногистохимических реакций проводили отрицательный контроль с нанесением на срезы вместо первичных антител их разбавителя (Dako, Дания). Анализ гистологических препаратов осуществляли с помощью микроскопа Leica DM 750 (Leica, Германия) и цифровой камеры Leica ICC 50 (Leica, Германия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
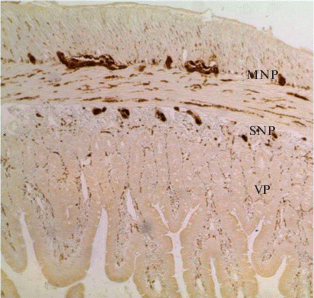
С помощью иммуногистохимической реакции на PGP 9.5 (рис. 1) на поперечных срезах через кишку крысы хорошо выявляются следующие сплетения: два ганглиозных – межмышечное и подслизистое и третье – слизистое ворсинчатое сплетение. Наиболее выраженным и богатым нервными элементами является межмышечное нервное сплетение. Оно располагается между продольным и циркулярным гладкомышечными слоями стенки, в объеме имеет решетчатый многослойный вид, клеточные и волокнистые элементы четко окрашиваются при реакции на PGP 9.5 в черно-коричневый цвет. В сплетении выявляются крупные, средние и мелкие ганглии, располагающиеся по ходу нервных стволиков. Количество составляющих нейронов различно: от нескольких десятков до сотни. Обращает на себя внимание высокая плотность расположения тканевых структур внутри ганглиев и сплетений. Многочисленные PGP 9.5+ пучки нервных волокон, выходящие из ганглиев, участвуют не только в формировании межганглионарных связей, но и в иннервации мышечной стенки кишки. На поперечных срезах в глубине мышечных слоев хорошо прослеживаются фрагменты различной толщины стволиков и пучков нервных волокон, формирующих широкопетлистое миоэнтеральное сплетение (рис. 1).
Рис. 1.
Поперечный срез двенадцатиперстной кишки крысы. MNP – межмышечное нервные сплетения; SNP – подслизистое нервное сплетение; VP – слизистое ворсинчатое сплетение. Иммуногистохимическая реакция на PGP 9.5. Ув.: ×100. Fig. 1. A transverse section of the rat duodenum. MNP – intramuscular nerve plexus; SNP – submucosal nerve plexus; VP – mucous villous plexus. Immunohistochemical reaction to PGP 9.5. ×100.
Подслизистое нервное сплетение, в отличие от миентерального сплетения, представлено узкопетлистой сетью нервных пучков и микроганглиев, состоящих из мелких групп нервных клеток (рис. 2B), имеющих размеры от 25 до 35 мкм, округлую или грушевидную форму. Между микроганглиями изредка видны связи.
Рис. 2.
Ганглии межмышечного (A) и подслизистого (B) нервного сплетения. Иммуногистохимическая реакция PGP 9.5, окраска толуидиновым синим. Ув.: ×200. Fig. 2. Ganglia of intramuscular nerve plexus (A) and submucosal nerve plexus (B). Immunohistochemical reaction to PGP 9.5, toluidine blue staining. ×200.
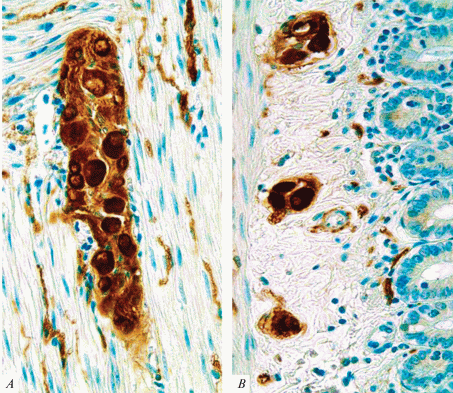
Небольшая часть тонких нервных пучков из микроганглиев подслизистого нервного сплетения вступает в вышележащие миоэтеральные слои. На рис. 2 видно, что ганглии межмышечного нервного сплетения находятся в тесном окружении гладкомышечных клеток, в то время как микроганглии и отдельные нейроны подслизистого нервного сплетения располагаются в рыхлой соединительной ткани и находятся в плотном окружении пучков коллагеновых волокон.
Нередко можно проследить, как большинство тонких пучков безмиелиновых аксонов, отходящих от нервных клеток микроганглиев подслизистого нервного сплетения, разветвляясь на границе подслизистой и слизистой оболочек, в составе артериол и рыхлой соединительной ткани входят внутрь ворсинок и формируют в них внутреннее терминальное сплетение. Оно состоит из варикозных аксонов, которые прослеживаются внутри ворсинок на всем их протяжении вплоть до апикального конца. Они избирательно выявляются при реакции на PGP 9.5 и окрашиваются в черный цвет. Между ворсинками в слизистой оболочке они формируют густую ячеистую сеть. Внутри ворсинок многие из таких аксонов находятся в тесной связи с эндотелием обменных капилляров, включая синусоидные и лимфотические сосуды, а часть из них на большом протяжении прилежит непосредственно к базальной мембране эпителия ворсинок (рис. 3). На основании этих признаков можно заключить, что терминальные варикозные аксоны представляют собой дистантные нервные окончания типа en passant.
Рис. 3.
Фрагменты терминальных варикозных аксонов в рыхлой соединительной ткани ворсинок, находящиеся в тесной связи с базальной мембраной (b), капиллярами (c), синусоидными и лимфатическими сосудами (v). Стрелки – нейроноподобные клетки внутри эпителия ворсинок кишки. Иммуногистохимическая реакция на PGP 9.5. Окраска толуидиновым синим. Ув.: × 100 (A); ×400 (B). Fig. 3. Fragments of terminal varicose axons in the connective tissue of the villi associated with the basement membrane (b), capillaries (c), sinusoidal and lymphatic vessels (v). Arrows are neuron-like cells inside the intestinal villi epithelium. Immunohistochemical reaction to PGP 9.5. Toluidine blue staining. ×100 (A); ×400 (B).
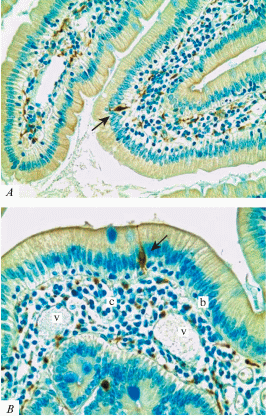
В настоящем исследовании в эпителии ворсинок слизистой оболочки ДПК обнаружены нейроноподобные клетки, содержащие белок PGP 9.5 (рис. 3). Это клетки небольших размеров (20–25 мкм) со светлыми круглыми ядрами и иммунореактивной цитоплазмой. Они имеют, как правило, клиновидную или веретеновидную форму. Тела этих клеток находятся в эпителиальном слое в тесном контакте с энтероцитами. От одного полюса клетки отходит относительно длинный отросток, который прослеживается вплоть до выхода в просвет кишки. На другом полюсе клетки наблюдается несколько коротких булавовидных выростов, окрашенных в черный цвет, которые тесно прилежат к стенке капилляра, заполненного эритроцитами. На основании морфологических особенностей можно предположить, что эти нейроноподобные клетки в эпителии ворсинок могут представлять собой хемосенсорные элементы внутренней рефлекторной дуги, вынесенные в стенку кишки.
С помощью иммуногистохимической реакции на синаптофизин (Syn) показано, что в межмышечном и подслизистом сплетениях выявляется плотная сеть перицеллюлярных синаптических аппаратов, вплотную окружающих перикарионы нейронов и их дендриты. Пресинаптические бутоны могут иметь вид пуговок, колечек, булавовидных структур. Густые тонкие терминальные сеточки их варикозных Syn+ аксонов наблюдаются также вокруг пучков миоцитов и прилежащих к ним капилляров в мышечной стенки кишки, а также вокруг мелких артерий и артериол, находящихся в соединительной ткани подслизистой оболочки (рис. 4). На рис. 4 видно, что плотность перицеллюлярной сети синапсов вокруг нейронов ганглиев настолько высока, что на рисунке только в некоторых местах определяются окрашенные эозином перикарионы иммунонегативных нервных клеток. Типичные синаптические терминальные сети варикозных аксонов часто встречаются и вокруг атериальных кровеносных сосудов. Они представляют собой дистантные синапсы типа en passant и отвечают за иннервацию и регуляцию кровотока.
Рис. 4.
Густая сеть синаптофизин-иммунореактивных перицеллюлярных аппаратов вокруг нейронов ганглиев ММНС и ПСНС. Иммуногистохимическая реакция на Syn. Окраска эозином. Ув.: ×400. Fig. 4. A network of synaptophysin-immunoreactive pericellular apparatus around the neurons of the intramuscular nerve plexus and submucosal nerve plexus ganglia. Immunohistochemical reaction to synaptophysin. Eosin staining. ×400.
PGP 9.5 – иммунопозитивные тонкие пучки нервных волокон, формирующих подслизистое нервное сплетение, тесно связаны с кровеносными сосудами и встречаются в области дуоденальных желез, располагающихся в подслизистой основе двенадцатиперстной кишки. Как правило, в области ацинусов дуоденальных желез варикозные терминали отсутствовали (рис. 5A), более иннервируемыми оказались выводные протоки этих желез.
Рис. 5.
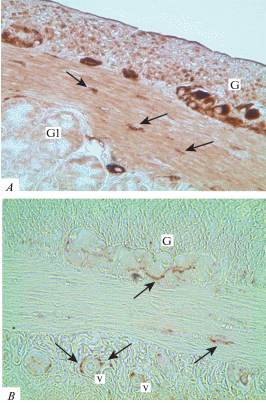
Сравнительная оценка выявления холинергических (A) и катехоламинергических (B) нервных структур в стенке двенадцатиперстной кишки крысы. Иммуногистохимическая реакция на PGP 9.5 (A) и TH (B). G –ганглий; Gl – железы в подслизистой основе ДПК; v – сосуды, стрелки – синаптические терминали. Ув: ×400 (A); ×1000 (B). Fig. 5. Comparison of cholinergic (A) and catecholaminergic (B) nerve structures detection in the wall of the rat duodenum. G – ganglion; Gl – submucosal glands of the duodenum; v – vessels, arrows – synaptic terminals. Immunohistochemical reaction to PGP 9.5 (A) and TH (B). ×400 (A); ×1000 (B).
Для определения медиаторного статуса нервных структур двенадцатиперстной кишки мы использовали сравнительное исследование – иммуногистохимическое выявление нескольких маркеров: PGP 9.5, TH и Syn. На представленных выше иллюстрациях видно, что большинство структур энтеральной нервной системы двенадцатиперстной кишки: многочисленные ганглии, нервные стволики, перицеллюлярные аппараты, терминальные сети вокруг сосудов, многочисленные терминали варикозных аксонов, иннервирующие мышечные слои стенки кишки, являются, главным образом, PGP 9.5-иммунопозитивными, но не ТН-иммунопозитивными, что предположительно может свидетельствовать об их холинергической природе.
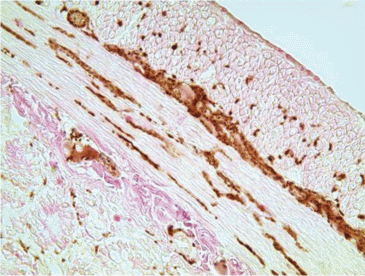
Чтобы отличить холинергические нервные аппараты от катехоламинергических был использован маркер TH, селективно выявляющий только симпатические структуры. Оказалось, что в мышечных слоях двенадцатиперстной кишки катехоламинергические аппараты встречаются значительно реже PGP 9.5-содержащих (рис. 5). В мышечной стенке кишечника встречаются лишь редкие пучки TH+ нервных волокон ремаковского типа. Они представляют собой тончайшие симпатические варикозные аксоны, которые следуют вдоль пучков миоцитов и прилежащих к ним капилляров (рис. 5B).
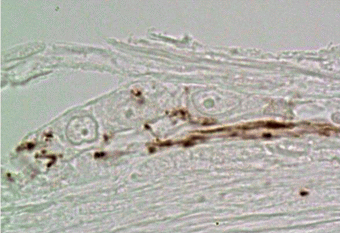
Значительно чаще ТН+ симпатические нервные волокна и их терминальные структуры встречаются внутри ганглиозных сплетений. Удалось проследить, как из межганглионарных нервных стволиков и пучков отходят тонкие претерминальные ТН+ волоконца, проникают в ганглии и разветвляются на тончайшие варикозные терминали. Последние следуют между телами иммунонегативных холинергических нейронов и образуют вокруг их перикарионов нежную сеть из концевых и касательных (et passant) синаптических бутонов (рис. 6). Подобные TH+ синаптические аппараты найдены вокруг мелких артерий и артериол в межмышечном и подслизистом нервных сплетениях. Следует отметить, что в ворсинках слизистой оболочки TH+ симпатические структуры не обнаруживаются.
Рис. 6.
Симпатические перицеллюлярные нервные окончания вокруг иммунонегативных холинергических нейронов межмышечного и подслизистого ганглиозных сплетений. Иммуногистохимическая реакция на TH. Ув: ×1000. Fig. 6. Sympathetic pericellular nerve endings around immunonegative cholinergic neurons of the intramuscular and submucosal ganglion plexuses. Immunohistochemical reaction to TH. ×1000.
Все описанные выше катехоламинергические синаптические аппараты наряду с холинергическими выполняют множество функций. Они участвуют в сложных механизмах регуляции межнейронных и межтканевых взаимоотношений, в поддержании тканевого метаболизма, моторных и сосудисто-двигательных рефлексах стенки кишки.
С помощью иммуногистохимической реакции на 5-НТ в стенке двенадцатиперстной кишки были выявлены иммуноположительные к данному ферменту мелкие (от 9 до 15 мкм в диаметре) серотонин-содержащие клетки. Большинсто этих клеток локализуется в области крипт ворсинок слизистой оболочки (рис. 7), внутри их рыхлой соединительной ткани, вблизи базальной мембраны, а некоторые располагаются в самом эпителии.
Рис. 7.
Серотонин-содержщие клетки в стенке двенадцатиперстной кишки крысы (A) и в эпителии ворсинок (стрелка) (B). Иммуногистохимическая реакция на серотонин. Окраска толуидиновым синим (A), астровым синим (B). Ув.: ×100 (A); 400 (B). Fig. 7. Serotonin-containing cells in the wall of the rat duodenum (a) and in the epithelium of the villi (arrow) (B). Immunohistochemical reaction to serotonin. Toluidine blue staining (A), astra blue staining (B). ×100 (A); 400 (B).
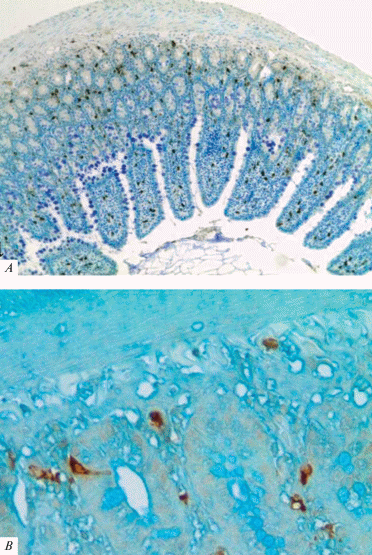
Серотонин-содержащие клетки имеют различную форму: треугольную, округлую, веретеновидную, снабжены короткими и длинными отростками. Следует отметить, что серотонинергические нейроны ни в одном из сплетений не были выявлены.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Несмотря на то, что проблемы физиологии и морфологии энтеральной нервной системы интенсивно изучаются уже более сотни лет, и результаты этих исследований были обобщены в известных трудах нейрогистологов и физиологов российской школы [1–5, 14–16], многие вопросы остаются спорными и нерешенными. Например, в кишечной стенке млекопитающих принято выделять два ганглиозных нервных сплетения – Ауэрбахово и Мейснерово. Некоторые авторы отмечают еще и третье – подсерозное сплетение, которое наиболее выражено в области дна большой кривизны желудка [1], однако в изучаемом отделе желудочно-кишечного тракта у крысы оно отсутствует. Данные настоящей статьи, полученные с помощью иммуногистохимических методов исследования, подтверждают и дополняют литературные сведения. Они позволяют внести корректировку в известную классификацию. С помощью специальных нейроиммунгистохимических методов в двенадцатиперстной кишке крысы нами идентифицировано кроме ганглиозных (межмышечного и подслизистого) сплетений третье, локализующееся в собственно слизистой оболочке – “эпителиально-ворсинчатое”. Оно представлено узкопетлистой, концевой сетью варикозных аксонов.
Ранее в желудочно-кишечного тракте у животных и человека с помощью гистохимических, флуоресцентно микроскопических исследований и электронной микроскопии были обнаружены парасимпатические, симпатические, серотонинергические нервные клетки и волокна [17–19]. По мнению большинства авторов, в ганглиях желудочно-кишечного тракта преобладают холинергические нейроны [1, 3, 6, 16, 20]. На ультраструктурном уровне показано, что на одном и том же нейроне ганглиозного сплетения обнаруживаются различного типа синапсы: холинергические, катехоламинергические, серотонинергические, а также неопределенной природы контакты [6, 17]. В обзоре [8], посвященном изучению вегетативных ганглиев энтеральной нервной системы, по морфологическим, физиологическим, проекционным, медиаторным и иммуногистохимическим признакам идентифицировано более 10 типов нейронов. Эти данные свидетельствуют о высокой вовлеченности различных медиаторов, нейротрансмиттеров и регуляторных пептидов в иннервации тканей кишечной стенки, обеспечении ее моторики и регуляции многих других важных функций.
Полученные нами данные согласуются с литературными, существенно дополняют и уточняют их. С помощью сравнительного иммуногистохимического анализа установлено, что в двенадцатиперстной кишке крысы подавляющее число нервных структур (нейронов, стволиков, пучков, нервных волокон, межнейронных и нейромышечных синапсов) содержат белок PGP 9.5. Из PGP 9.5+ нейроцитов и их отростков построены ганглиозные сплетения, сети претерминальных и терминальных варикозных аксонов. Они обнаруживаются вокруг тел и дендритов нейронов в виде перицеллюлярных аппаратов, вокруг артериальных и венозных сосудов, между мышечными слоями, в соединительной ткани подслизистой и слизистой оболочек.
Что касается симпатической иннервации, в тканях данного отдела кишки она значительно менее выражена. Источники постганглионарных симпатических нервных волокон находятся вне двенадцатиперстной кишки. Заметная часть симпатических TH-иммунопозитивных нервные волокон и особенно их варикозных терминалей образует многочисленные перицеллюлярные синаптические аппараты на телах и дендритах парасимпатических нейронов. Часть симпатических аксонов принимает участие в иннервации гладкой мускулатуры стенки кишки, а также мелких артерий и артериол подслизистой оболочки. При этом симпатическая иннервация по своей интенсивности заметно уступает холинергической.
Анализ литературы, посвященной вопросам иннервации стенки кишки показывает, что наименее изученными являются нервные аппараты подслизистой и слизистой оболочек. Многие известные нейрогистологи прошлого века в своих трудах [4, 5] нередко упоминали о существующих трудностях выявления нервных структур в тканях этих двух отделов с помощью импрегнационных методов. Только использование специальных нейроиммуногистохимических методик позволило нам впервые выявить в слизистой оболочке крысы густую сеть из тончайших терминальных аксонов, изучить их строение, определить медиаторный статус и проследить их направление. По нашим данным ткани подслизистой и слизистой оболочек, включая ворсинки, получают иннервацию от нейронов Мейснерова сплетения. Тончайшие пучки аксонов, образованных его холинергическими нейронами, в составе артериол проходят через мышечную пластинку подслизистой основы, формируют густое ячеистое сплетение вокруг ацинусов интерстинальных желез и проникают внутрь каждой ворсинки слизистой оболочки. Внутри ворсинок терминальные варикозные аксоны находятся в тесных взаимоотношениях с клеточными элементами рыхлой соединительной ткани, со стенками обменных и лимфоидных капилляров, а также с эпителием слизистой. С помощью сравнительного иммуногистохимического анализа установлено, что симпатические нервные волокна в ворсинках отсутствуют.
По данным литературы [20] в стенке кишечного тракта животных кроме катехоламинергических структур (НА, ДОФА) обнаружены две разновидности серотонинергических клеток, различающихся по ферментному составу – триптофан гидроксилазы (ТРН 1 и ТРН2). Одни из них – многочисленные, мелких размеров клетки, локализующиеся, главным образом, в эпителии крипт ворсинок слизистой оболочки, по мнению авторов, являются энтерохромаффинными. Другие – серотонинергические нервные клетки, изредка встречающиеся в энтеральном ганглиозном сплетении. Наши наблюдения отчасти согласуются с данными литературы. В подслизистой и слизистой оболочках двенадцатиперстной кишки мы также выявили большое количество мелких серотонинсодержащих клеток. Судя по морфологии и топографии, их можно отнести к разновидности энтерохромаффинных элементов, содержащих индольные амины. Однако серотонинергические нервные клетки в ДПК кишке нами обнаружены не были.
Таким образом, в настоящей работе, выполненной с использованием современных нейроиммуногистохимических методов исследования, в двенадцатиперстной кишке крыс кроме двух основных ганглиозных сплетений (миентерального и подслизистого) было выявлено еще одно, ранее не привлекавшее внимание исследователей, эпителиально-ворсинчатое нервное сплетение. С помощью сравнительного анализа иммуногистохимического выявления селективных нейральных маркеров (PGP 9.5, Syn, TH, 5-НТ) предполагается, что подавляющее большинство нервных структур, присутствующих во всех трех сплетениях, имеют холинергическую природу. Симпатические нервные аппараты в энтеральной нервной системе представлены в меньшей степени. Они выявляются в виде перицеллюлярных аппаратов холинергических нейронов, а также варикозных терминалей в мышечных слоях стенки кишки и вокруг мелких артерий и артериол. Показано, что в рыхлой соединительной ткани и в эпителии ворсинок двенадцатиперстной кишки постоянно выявляются многочисленные мелкие серотонинсодержащие клетки. В эпителии ворсинок обнаружены неописанные ранее нейроноподобные клетки, содержащие белок PGP 9.5 и синаптофизин. Результаты настоящего исследования подтверждают перспективность использования нейроиммуногистохимических методов для изучения морфологии и функции структур энтеральной нервной системы, выявленные особенности нервных аппаратов двенадцатиперстной кишки следует учитывать при изучении молекулярно-клеточных механизмов регуляции ее функций.
Список литературы
Ноздрачев А.Д. Физиология вегетативной нервной системы. Л. Медицина. 1983. [Nozdrachev A.D. Fiziologiya vegetativnoj nervnoj sistemy`[ Physiology of the autonomic nervous system]. Leningrad. Medicine. 1983. (In Russ)].
Wang X.Y., Wong W.C., Ling E.A. Ultrastructural localisation of substance P, vasoactive intestinal peptide and somatostatin immunoreactivities in the submucous plexus of guinea pig ileum. J. Anat. 186(1): 187–196. 1995.
Foong J.P., Tough I.R., Cox H.M., Bornstein J.C. Properties of cholinergic and non-cholinergic submucosal neurons along the mouse colon. J. Physiol. 592(4): 777–793. 2014.
Лаврентьев Б.И. Теория строения вегетативной нервной системы. М. Медицина. 1983. [Lavrentiev B.I. Teoriya stroeniya vegetativnoj nervnoj sistemy [The theory of the structure of the autonomic nervous system]. Moscow. Medicine. 1983. (In Russ)].
Колосов Н.Г., Хабарова А.Я. Структурная организация вегетативных ганглиев. Л. Наука. 1978. [Kolosov N.G., Khabarova A.Ya. Strukturnaya organizaciya vegetativny`x gangliev [Structural organization of vegetative ganglia]. Leningrad. Nauka. 1978. (In Russ)].
Gabella G. Structure of the autonomic nervous system. London. Chapman and Hall. 1979.
Fehér E., Burnstock G. Ultrastructural localization of substance P, vasoactive intestinal polypeptide, somatostatin and neuropeptide Y immunoreactivity in perivascular nerve plexuses of the gut. Blood Vessels. 23(3): 125–126. 1986.
Furness J.B. Types of neurons in the enteric nervous system. J. Auton. Nerv. Syst. 81(1–3): 87–96. 2000.
Wang X.Y., Wong W.C., Ling E.A. Localization of NADPH-diaphorase activity in the submucous plexus of the guinea-pig intestine: light and electron microscopic studies. J. Neurocytol. 24(4): 271–81. 1995.
Коржевский Д.Э., Кирик О.В., Петрова Е.С. Теоретические основы и практическое применение методов иммуногистохимии (руководство). СПб. СпецЛит. 2014. [Korzhevskii D.E., Kirik O.V., Petrova E.S. Teoreticheskie osnovy` i prakticheskoe primenenie metodov immunogistoximii (rukovodstvo) [Theoretical foundations and practical application of immunohistochemistry methods]. St. Petersburg. SpetsLit. 2014. (In Russ)].
Cai W., Gu J., Huang W., McGregor G.P., Ghatei M.A., Bloom S.R., Polak J.M. Peptide immunoreactive nerves and cells of the guinea pig gall bladder and biliary pathways. Gut. 24(12): 1186–1193. 1983.
Коржевский Д.Э., Колос Е.А. Белок PGP 9.5 и его использование в качестве функционального маркера в нейроморфологии. Мед. акад. журн. 13(4): 29–35. 2013. [Korzhevskii D.E., Kolos E.A. Protein PGP 9.5 and its use as a functional marker in neuromorphology. Med. Acad. J. 13 (4): 29–35. 2013. (In Russ)].
Колос Е.А., Григорьев И.П., Коржевский Д.Э. Mаркер синаптических контактов – синаптофизин. Морфология. 147(1): 78–82. 2015. [Kolos E.A., Grigoriev I.P., Korzhevskii D.E. Synaptic contacts marker – synaptophysin. Morphologiia. 147(1): 78–82. 2015. (In Russ)].
Dogiel A.S. Ueber den Bau der Ganglien in den Geflechten des Darmes und der Gallenblase des Menschen und der Säugethiere. Arch. Anat. Physiol. Anat. Abth.: 130–158. 1899.
Кнорре А.Г., Суворова Л.В. Развитие вегетативной нервной системы в эмбриогенезе. М. Медицина. 1984. [Knorre A.G., Suvorova L.V. Razvitie vegetativnoj nervnoj sistemy` v e`mbriogeneze [The development of the autonomic nervous system in embryogenesis]. Moscow. Medicine. 1984].
Ноздрачев А.Д., Чумасов Е.И. Периферическая нервная система. СПб. Наука. 1999. [Nozdrachev A.D., Chumasov E.I. Perifericheskaya nervnaya sistema [Peripheral nervous system]. St. Petersburg. Nauka. 1999].
Cook R.D., Burnstock G. The ultrastructure of Auerbach’s plexus in the guinea-pig. II. Non-neuronal elements. J. Neurocytol. 5(2): 195–206. 1976.
Ferri G.L. Human gut neuroanatomy: methodology for a quantitative analysis of nerve elements and neurotransmitter diversity in the human “enteric nervous system”. Basic Appl. Histochem. 32(1): 117–144. 1988.
Baker D.M., Santer R.M. A quantitative study of the effects of age on the noradrenergic innervation of Auerbach’s plexus in the rat. Mech. Ageing Dev. 42(2): 147–158. 1988.
Li Z., Chalazonitis A., Huang Y.Y., Mann J.J., Margolis K.G., Yang Q.M., Kim D.O., Côté F., Mallet J., Gershon M.D. Essential roles of enteric neuronal serotonin in gastrointestinal motility and the development/survival of enteric dopaminergic neurons. J. Neurosci. 31(24): 8998–9009. 2011.
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


