Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 7, стр. 843-852
Влияние гравитационной разгрузки и пищевой белковой недостаточности на накопление коллагена и минералов в костном матриксе после перелома голени
М. В. Стогов 1, *, Е. А. Киреева 1
1 Национальный медицинский исследовательский центр травматологии и ортопедии
им. акад. Г.А. Илизарова Минздрава России
Курган, Россия
* E-mail: stogo_off@list.ru
Поступила в редакцию 25.02.2020
После доработки 06.03.2020
Принята к публикации 04.05.2020
Аннотация
Цель исследования – оценить влияние гравитационной разгрузки поврежденной конечности и пищевой белковой недостаточности на накопление коллагена и минералов в костном матриксе после перелома голени у мышей. Исследование выполнено на 132 самцах мышей линии СВА, разделенных на две серии экспериментов. В первой серии (n = 66) в течение эксперимента мыши находились на сбалансированном по белку и углеводам рационе. Во второй серии (n = 66) мыши с месячного возраста находились на углеводном, обедненном белком изокалорийном рационе, в котором источником белка служил пшеничный глиадин. Внутри каждой серии животные были рандомизированы на 4 группы: интактные животные; животные, которым моделировали перелом костей голени; животные с гравитационной разгрузкой (ГР) задних конечностей; животные, которым после моделирования перелома выполняли ГР. В костях определяли уровень кальция, фосфата и коллагена, в сыворотке крови – активность щелочной фосфатазы. Обнаружено, что у мышей всех групп серии 2 в костях достоверно снижался уровень минералов и особенно коллагена. Наибольшее снижение уровня коллагена отмечено у животных, которым моделировали перелом костей голени на фоне ГР и неполноценного белкового питания. Репарация кости после перелома на фоне ГР при сбалансированном рационе питания не сопровождалась статистически достоверными изменениями уровня минералов и коллагена в костях изученного сегмента. Заключается, что у мышей заживление перелома костей голени на фоне ГР неполноценное белковое питание является системным фактором, способствующим существенному снижению интенсивности накопления органической компоненты костного матрикса.
В настоящее время ряд исследований показывает, что после переломов в костях поврежденного сегмента происходит общее суммарное снижение уровня минеральных (прежде всего кальция и фосфата) и органических компонентов костного матрикса [1–3]. При этом восстановление содержания этих компонентов в костях сегмента несколько отстает от скорости накопления этих веществ в зоне перелома [4–6]. В клинической практике такое отставание может лежать в основе патогенеза повторных переломов, формирования посттравматических дефектов костей, замедления сращения [7–9].
Дополнительными факторами, которые могут замедлять посттравматическое восстановление уровня минеральных и органических компонентов в костях поврежденного сегмента, по нашему мнению, являются снижение нагрузки на травмированную конечность и неполноценность пищевого рациона. Однако влияние данных факторов на обмен кости после травм изучены в неполной мере. Так, наиболее изучены последствия снижения нагрузки на конечность в посттравматическом периоде в основном по отношению к скелетным мышцам [10–12]. Неполноценность же пищевого рациона обычно оценивается в основном по недостатку кальция и фосфора в пище [13–16]. Однако по нашим наблюдениям посттравматическая гипопротеинемия – наиболее частый встречаемый признак, нежели посттравматическая гипокальциемия [17], соответственно, восстановление белкового обмена после травм – актуальная задача.
В целом же имеющиеся работы на вопрос, является ли снижение нагрузки на травмированную конечность и неполноценность пищевого рациона по белку, в совокупности или отдельно взятые, препятствием для полноценного восстановления минерального и органического компонента костного матрикса после перелома, не дают ответа [18].
Цель работы – оценить влияние гравитационной разгрузки поврежденной конечности и пищевой белковой недостаточности на накопление коллагена и минералов в костном матриксе после перелома голени у мышей.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование выполнено на 132 самцах мышей линии CBA в возрасте двух месяцев и массой 25–30 г. Было поставлено две серии экспериментов.
Животные первой серии (n = 66) в течение всего эксперимента находились на сбалансированном по белку (3.3 г/сутки перевариваемого протеина) и углеводам рационе вивария. Животные второй серии (n = 66) с месячного возраста находились на углеводном, обедненным белком (0.88 г/сутки перевариваемого протеина) изокалорийном рационе, в котором источником белка служил пшеничный глиадин. Таким образом, в серии 2 животные были включены в эксперимент после месяца пищевой белковой недостаточности. Животные обеих серий получали воду в свободном доступе.
Внутри каждой серии животные были рандомизированы на 4 группы в зависимости от экспериментальной модели. Всего было получено 8 групп:
Группа 1 (И, n = 12) – интактные животные, которые находились на сбалансированном рационе. Часть животных данной группы (n = 6) эвтаназировали в возрасте 2 мес., часть (n = 6) – в возрасте 3 месяца.
Группа 2 (ИО, n =12) – интактные животные, которые находились с месячного возраста на углеводном, обедненным белком изокалорийном рационе. Часть животных данной группы (n = 6) эвтаназировали в возрасте 2 мес., часть (n = 6) – в возрасте 3 месяца.
Группа 3 (ПГ, n = 18) – моделировали перелом костей левой голени (ПГ) (согласно патента РФ № 2456927). Животные находились на сбалансированном рационе.
Группа 4 (ПГ + О, n = 18) – моделировали перелом костей левой голени. Животные с месячного возраста и до момента эвтаназии находились на углеводном, обедненным белком изокалорийном рационе.
Группа 5 (ГР, n = 18) – моделировали гипокинезию сегментов задней конечности лишением их опоры в модели гравитационной разгрузки (ГР) [19]. Животные находились на сбалансированном рационе.
Группа 6 (ГР + О, n = 18) – моделировали гипокинезию сегментов задней конечности лишением их опоры в модели гравитационной разгрузки. Животные с месячного возраста и до момента эвтаназии находились на углеводном, обедненным белком изокалорийном рационе.
Группа 7 (ПГ + ГР, n = 18) – после моделирования перелома костей левой голени животных лишали опоры в модели гравитационной разгрузки. Животные находились на сбалансированном рационе.
Группа 8 (ПГ + ГР + О, n = 18) – после моделирования перелома костей левой голени животных лишали опоры в модели гравитационной разгрузки. Животные с месячного возраста и до момента эвтаназии находились на углеводном, обедненным белком изокалорийном рационе.
Все вмешательства проводили под ингаляционным эфирным наркозом. Из эксперимента животных выводили декапитацией после предварительного наркотизирования диэтиловым эфиром. Эвтаназию в группах 3–8 проводили на 3-и, 7-е и 28-е сутки после моделирования острого эксперимента (по 6 животных на срок). Эвтаназия двухмесячных животных групп 1 и 2 соответствовала третьим и седьмым суткам эксперимента в группах 3–8. Эвтаназия трехмесячных животных групп 1 и 2 соответствовала 28-м суткам эксперимента в группах 3–8.
После эвтаназии кости левой голени очищали от остатков соединительной и мышечной ткани, лиофильно высушивали в течение суток. Высушенную костную ткань измельчали в фарфоровой ступке и делили на две навески. В первой – определяли содержание кальция и фосфата. Для этого навеску озоляли в муфельной печи при температуре 800°С в течение 4 ч, затем золу растворяли в 1 мл концентрированной НСl, количественно переносили в мерные пробирки, нейтрализовали раствором щелочи и доводили объем до 10 мл. В полученном растворе определяли концентрацию фосфата по реакции с молибдатом аммония и кальция с о-крезолфталеином, для чего использовали наборы реагентов фирмы Vital Diagnostics (Россия). В другой навеске определяли оксипролин, по концентрации которого, используя формулу Зайдеса, рассчитывали количество коллагена. Оксипролин в навеске определяли после гидролиза с 8н НСl по реакции с реактивом Эрлиха. В сыворотке крови определяли активность маркера остеогенеза – щелочной фосфатазы (ЩФ) с помощью наборов реагентов (Vital Diagnostics, СПб) на фотометре лабораторном StatFax 1904+ (Awareness Technology, Inc., США).
Исследование проведено при соблюдении принципов гуманного обращения с лабораторными животными в соответствии с принципами Базельской декларации, рекомендациями и после одобрения Комитета по этике при ФГБУ “РНЦ “ВТО” им. акад. Г.А. Илизарова” Минздрава России.
На рисунках результаты представлены в виде средней арифметической и стандартного отклонения. Достоверность межгрупповых различий изученных показателей определяли с помощью непараметрического критерия Крускала–Уоллиса, с последующим множественным сравнением с использованием критерия Данна. Различия считали достоверными при минимальном уровне значимости р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Изменения изученных показателей у животных экспериментальных групп серии 1 представлены на рис. 1 и 2. Обнаружено, что суммарное содержание кальция и фосфата в костях голени у животных групп 3, 5, 7 на третьи и седьмые сутки эксперимента статистически значимо относительно значений интактных животных не отличалось (рис. 1A). У животных группы 3 на 28-е сутки эксперимента суммарный уровень кальция и фосфата в костях голени травмированного сегмента был по критерию множественного сравнения достоверно выше относительно значений животных групп 1, 5, 7 (p < 0.05).
Рис. 1.
Суммарное содержание кальция и фосфата (A), а также соотношение Са/Р (B) в костях голени экспериментальных животных серии 1 (группы 1, 3, 5, 7). По оси абсцисс: 3, 7, 28 – сутки эксперимента. * – достоверные отличия значений в группе 3 относительно значений в других группах при р < 0.05. # – достоверные отличия значений в группе 5 относительно значений в других группах при р < 0.05. Fig. 1. The total level of calcium and phosphate (A), and the Ca/P ratio (B) in the tibia bone of experimental animal series 1 (groups 1, 3, 5, 7). On the x-axis: 3, 7, 28 – day of the experiment. * – significant differences in the values in group 3 relative to the values in other groups at p < 0.05. # significant differences in the values in group 5 relative to the values in other groups at p < 0.05.
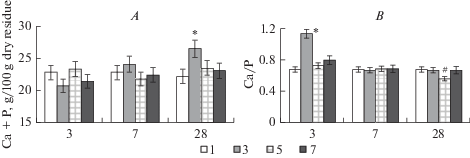
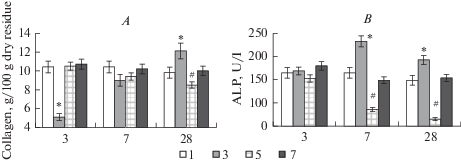
Рис. 2.
Содержание коллагена в костях голени (A) и активность щелочной фосфатазы в сыворотке крови (B) экспериментальных животных серии 1 (группы 1, 3, 5, 7). По оси абсцисс: 3, 7, 28 – сутки эксперимента. * – достоверные отличия значений в группе 3 относительно значений в других группах при р < 0,05. # – достоверные отличия значений в группе 5 относительно значений в других группах при р < 0.05. Fig. 2. The level of collagen (A) and the activity of alkaline phosphatase in the blood serum (B) in the tibia bone of experimental animals of series 1 (groups 1, 3, 5, 7). On the x-axis: 3, 7, 28 – day of the experiment. * – significant differences in the values in group 3 relative to the values in other groups at p < 0.05. # – significant differences in the values in group 5 relative to the values in other groups at p < 0.05.
Соотношение Са/Р у животных группы 3 на третьи сутки после травмы было значимо (p < 0.05) выше относительно значений других групп (рис. 1B). На 28-е сутки эксперимента соотношение Са/Р было достоверно ниже у животных группы 5 относительно показателей трех других групп (р < 0.05).
Содержание коллагена в костях поврежденного сегмента у животных группы 3 на третьи сутки после травмы было значимо (p < 0.05) ниже относительно значений других групп (рис. 2A). На 28-е сутки эксперимента уровень коллагена в костях голени у животных группы 3 по критерию множественного сравнения был выше, а у животных группы 5 ниже, относительно показателей трех других групп (р < 0.05).
Активность ЩФ в сыворотке крови у животных группы 3 на 7-е и 28-е сутки эксперимента была значимо выше относительно значений других групп (р < 0.05), а у животных группы 5 в эти же сроки, наоборот, была значимо ниже относительно значений других групп (р <0.05) (рис. 2B).
Изменения изученных показателей у животных экспериментальных групп серии 2 представлены на рис. 3 и 4. Обнаружено, что на третьи сутки эксперимента суммарное содержание кальция и фосфата в костях голени у животных группы 4 было значимо ниже значений животных других групп (p < 0.05) (рис. 3A). На 7-е и 28-е сутки эксперимента уровень минералов в костях голени мышей групп 2, 4, 6, 8 был статистически значимо (p < 0.05) ниже относительно значений интактных животных (группа 1).
Рис. 3.
Суммарное содержание кальция и фосфата (A), а также соотношение Са/Р (B) в костях голени экспериментальных животных серии 2 (группы 1, 2, 4, 6, 8). По оси абсцисс: 3, 7, 28 – сутки эксперимента. * – достоверные отличия значений в группах 2, 4, 6, 8 относительно значений в группе 1 при р < 0,05. # – достоверные отличия значений в группе 4 (а) и группах 2, 4 (B) относительно значений в других группах при р < 0.05. Fig. 3. The total level of calcium and phosphate (A), and the Ca/P ratio (B) in the tibia bone of experimental animal series 2 (groups 1, 2, 4, 6, 8). On the x-axis: 3, 7, 28 – day of the experiment. * – significant differences in the values in groups 2, 4, 6, 8 relative to the values in group 1 at p < 0.05. # – significant differences between the values in group 4 (a) and groups 2, 4 (b) relative to the values in other groups at p < 0.05.
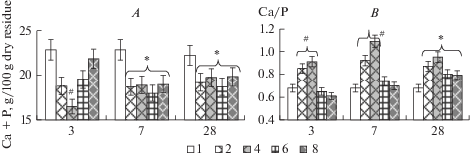
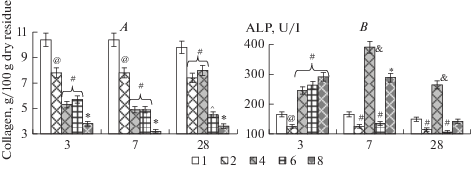
Рис. 4.
Содержание коллагена в костях голени (А) и активность щелочной фосфатазы в сыворотке крови (B) экспериментальных животных серии 2 (группы 1, 2, 4, 6, 8). По оси абсцисс: 3, 7, 28 – сутки эксперимента. @ – достоверные отличия значений в группе 2 относительно значений в других группах при р < 0.05. & – достоверные отличия значений в группе 4 относительно значений в других группах при р < 0.05. ^ – достоверные отличия значений в группе 6 относительно значений в других группах при р < 0.05. * – достоверные отличия значений в группе 8 относительно значений в других группах при р < 0.05. # – достоверные отличия значений в отмеченных группах относительно значений в других группах при р < 0.05. Fig. 4. The level of collagen (A) and the activity of alkaline phosphatase in the blood serum (B) in the tibia bone of experimental animals of series 1 (groups 1, 2, 4, 6, 8). On the x-axis: 3, 7, 28 – day of the experiment. @ – significant differences in the values in group 2 relative to the values in other groups at p < 0.05. & – significant differences in the values in group 4 relative to the values in other groups at p < 0.05. ^ – significant differences in the values in group 6 relative to the values in other groups at p < 0.05. * – significant differences in the values in group 8 relative to the values in other groups at p < 0.05. # – significant differences in the values of the marked groups relative to the values in other groups at p < 0.05.
Соотношение Са/Р у животных групп 2 и 4 на третьи и седьмые сутки эксперимента было значимо (p < 0.05) выше относительно значений других групп (рис. 3B). На 28-е сутки эксперимента соотношение Са/Р было достоверно выше у мышей групп 2, 4, 6, 8 относительно значений интактных животных (группа 1) (р < 0.05).
Содержание коллагена в костях голени у животных групп 2, 4, 6, 8 на всех сроках эксперимента было значимо (p < 0.05) ниже относительно значений группы 1 (рис. 4A). При этом уровень коллагена достоверно (p < 0.05) отличался и между экспериментальными группами. Так, его уровень на третьи и седьмые сутки эксперимента снижался в ряду: группа 2 > группа 4, 6 > группа 8; на 28-е сутки в ряду: группа 2, 4 > > группа 6 > группа 8.
Активность ЩФ в сыворотке крови животных групп 4, 6, 8 на третьи сутки эксперимента была достоверно выше, а в группе 2 – ниже относительно значений других групп (р < 0.05) (рис. 4B). На седьмые сутки эксперимента активность ЩФ у животных групп 4, 8 была значимо выше, а в группах 2, 6 – ниже относительно активности фермента в других группах (р < 0.05). На 28-е сутки эксперимента активность ЩФ в группе 4 была выше, а у животных группы 2, 6 ниже относительно значений других групп (р < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные данные показали, что при сбалансированном рационе питания восстановление количественного состава компонентов матрикса костей поврежденного после перелома сегмента конечности проходило через последовательное снижение уровня минералов и коллагена в остром периоде (3-е сутки), с последующим их увеличением к 28-м суткам. Отмеченная нами динамика вполне согласуется с этапами репаративного остеогенеза [20].
При гравитационной разгрузке конечности в течение 28 суток мы также наблюдали, в целом ожидаемое, снижение содержания коллагена в кости [21]. Однако, нами обнаружено, что уровень минеральной компоненты при ГР значимо в этот период не снижался, однако достоверно изменялось соотношение минералов в пользу преобладания фосфата (снижение Са/Р соотношения).
Восстановление целостности кости после ее повреждения в условиях ГР при сбалансированном рационе питания не сопровождалось статистически достоверными изменениями уровня минералов и коллагена в костях изученного сегмента. Это свидетельствует о том, что ГР слабо влияла на интенсивность формирования костного матрикса в костях голени после перелома при сбалансированном рационе. Такая картина, видимо, связана с тем, что системные и местные реакции, возникающие в организме животных в ответ на травматический стресс, практически полностью нивелировали физиологические эффекты, вызываемые ГР.
Изменения количественного содержания минералов и коллагена в кости после ее перелома в условиях неполноценного по белку рациона на фоне ГР имели большее число статистически значимых отличий, чем у животных, находившихся на сбалансированном рационе.
Прежде всего нужно отметить, что недостаточность белка в рационе сама по себе вызывала достоверное снижение уровня минералов в кости, при повышении Са/Р соотношения. При этом данные изменения минерального состава кости не усугублялись ни после перелома, ни при ГР, ни при сочетанном действии этих факторов.
В свою очередь у мышей, находившихся на неполноценном по белку рационе, уровень коллагена в костях снижался в зависимости от экспериментальной модели. Так, минимальное снижение накопления коллагена отмечено у интактных животных (группа 2). У животных с переломом костей голени (группа 4) уровень коллагена после заметного снижения в раннем посттравматическом периоде (3–7-е сутки) восстанавливался до значений интактных животных (группа 2) к 28-м суткам. При переломе костей голени на фоне ГР и неполноценного белкового питания содержание коллагена в кости было достоверно ниже значений всех других экспериментальных групп.
Эти наблюдения показывают, что: 1) неполноценное белковое питание способствует потере органического компонента кости, что вполне согласуется с данными других исследователей [22, 23]; 2) у животных после перелома голени на фоне ГР неполноценное белковое питание является фактором, способствующим существенному снижению интенсивности накопления органической компоненты костного матрикса.
Далее, если проанализировать изменения активности ЩФ сыворотки крови в динамике эксперимента, то можно выделить группы животных с моделью ГР (группа 5, 6), для которых отмечалось наибольшее падение активности данного фермента, что может являться следствием значительного снижения остеосинтетических процессов у животных указанных групп [24]. Это наблюдение свидетельствует о том, что снижение уровня коллагена у мышей при ГР (вне зависимости от полноценности пищевого рациона) происходило за счет снижения синтеза данного белка, а не за счет роста процессов его распада. Такое снижение уровня коллагена объясняет наблюдаемое нами изменение у всех животных с белковым ограничением баланса Са/Р в кости. Это происходит вследствие недостатка синтеза коллагена, что ведет к нарушению формирования полноценного костного минерала [25].
Механизмы нарушений формирования органического матрикса кости после ее перелома на фоне ГР и пищевой белковой недостаточности, по полученным нами данным, могут быть следующими. В условиях ГР при полноценном пищевом рационе, в связи со снижением функциональной активности кости, по механизмам мехонотрансдукции происходит снижение синтеза коллагена [26]. Учитывая, что костный матрикс постоянно самообновляющаяся система [27], это приводит к тому, что с увеличением длительности ГР уровень органического компонента костного матрикса начинает снижаться. В свою очередь перелом является достаточно мощным фактором, который на системном и местном уровне стимулирует процессы костеобразования [28–30]. Восстановление же целостности кости в условиях ГР конечности при полноценном белковом рационе, как показало наше исследование, происходило на фоне суммации двух противоположных эффектов (травматический стресс и ГР), что в целом не приводило к достоверному снижению синтеза коллагена в этих условиях.
Нами показано, что накопление коллагена в кости при ее репарации после перелома на фоне ГР и пищевой белковой недостаточности было достоверно снижено при всех экспериментальных моделях. Важно отметить, что такое снижение оказалось критическим для репарации кости, так как даже системные и локальные механизмы, обеспечивающие остеогенез после перелома, оказались недостаточными для обеспечения синтеза коллагена в условиях неполноценного белкового рациона, особенно в условиях восстановления целостности кости на фоне ГР.
Таким образом, неполноценность пищевого рациона по содержанию белка является более важным, чем ГР фактором, замедляющим формирование органического компонента костного матрикса. При этом взаимодействие этих двух факторов в посттравматический период усугубляет этот процесс. В клиническом приложении наше исследование может быть применено для обоснования необходимости поддержания полноценного белкового рациона в восстановительном периоде после переломов костей конечностей как важного фактора, обеспечивающего формирование органического и минерального матрикса костного регенерата. Разработка таких пищевых рационов, обеспечивающих оптимальный рост и репарацию кости – достаточно перспективное направление [31, 32].
Список литературы
Christiansen B.A., Emami A.J., Fyhrie D.P., Satkunananthan P.B., Hardisty M.R. Trabecular bone loss at a distant skeletal site following noninvasive knee injury in mice. J. Biomech. Eng. 137(1): 0110051–0110056. 2015. https://doi.org/10.1115/1.4028824
Fischer V., Haffner-Luntzer M., Amling M., Ignatius A. Calcium and vitamin D in bone fracture healing and post-traumatic bone turnover. Eur. Cell. Mater. 35: 365–385. 2018. https://doi.org/10.22203/eCM.v035a25
Osipov B., Emami A.J., Christiansen B.A. Systemic bone loss after fracture. Clin. Rev. Bone Miner. Metab. 16(4): 116–130. 2018. https://doi.org/10.1007/s12018-018-9253-0
Грубер Н.М., Валеев Е.К., Шульман А.А., Яфарова Г.Г. Патогенетические механизмы репаративного остеогенеза при сочетанной травме. Практическая медицина. (4–1): 79–81. 2016. [Gruber N.M., Valeev E.K., Shulman A.A., Yafarova G.G. Pathogenetic mechanisms of reparative osteogenesis after combined trauma. Pract. med. (4–1): 79–81. 2016. (In Russ)].
Резник Л.Б., Рожков К.Ю., Дзюба Г.Г., Заводиленко К.В. Особенности формирования костной мозоли на фоне контактного низкочастотного ультразвукового воздействия в клинике и эксперименте. Политравма. (2): 87–92. 2018. [Reznik L.B., Rozhkov K.Yu., Dzyu-ba G.G., Zavodilenko K.V. Features of formation of bone callus at the background of contact low-frequency ultrasound in the clinic and in the experiment. Polytrauma. (2): 87–92. 2018. (In Russ)].
Stogov M.V., Luniova S.N., Tkachuk E.A. Accumulation of calcium, phosphate, and collagen in bones and accumulation of creatine in muscles of mice with acute hepatic intoxication during shin fracture healing. Bull. Exp. Biol. Med. 149(5): 575–577. 2010.
Косимов А.А., Ходжанов И.Ю., Горбач Е.Н., Силантьева Т.А., Дюрягина О.В., Борзунов Д.Ю. Морфологические особенности регенерации костной ткани при экспериментальном моделировании рефрактуры длинных трубчатых костей в периоде их роста. Гений ортопедии. 25(4): 555–560. 2019. [Kosimov A.A., Khodzhanov I.Iu., Gorbach E.N., Silanteva T.A., Diuriagina O.V., Borzunov D.Yu. Morphological features of bone regeneration in simulated refracture of growing long bones. Genij Ortopedii. 25(4): 555–560. 2019. (In Russ)].
Кутиков С.А., Борзунов Д.Ю., Осипова Е.В. Особенности минерализации костной ткани в зоне дефекта у пациентов c врожденным ложным суставом костей голени. Забайкальск. мед. вестник. (3): 111–116. 2014. [Kutikov S.A., Borzunov D.Yu., Osipova E.V. Features bone mineral density in the deffect zone of patients with congenital pseudoarthrosis of the tibia. Transbaikalian Med. Bull. (3): 111–116. 2014. (In Russ)].
van Geel T.A., Huntjens K.M., van den Bergh J.P., Dinant G.J., Geusens P.P. Timing of subsequent fractures after an initial fracture. Curr. Osteopor. Rep. 8(3): 118–122. 2010. https://doi.org/10.1007/s11914-010-0023-2
Киреева Е.А., Стогов М.В. Динамика изменения энергетических субстратов в мышцах и печени мышей после скелетной травмы на фоне гравитационной разгрузки конечности. Рос. физиол. журн. им. И.М. Сеченова. 102(9): 1074–1081. 2016. [Kireeva E.A., Stogov M.V. The dynamics of energy substrate changes in mice muscles and liver after skeletal injury through limb gravitation unloading. Russ. J. Physiol. 102(9): 1074–1081. 2016. (In Russ)].
Goodman C.A., Hornberger T.A., Robling A.G. Bone and skeletal muscle: Key players in mechanotransduction and potential overlapping mechanisms. Bone. 80: 24–36. 2015. https://doi.org/10.1016/j.bone.2015.04.014
Hendy A.M., Spittle M., Kidgell D.J. Cross education and immobilisation: mechanisms and implications for injury rehabilitation. J. Sci. Med. Sport. 15(2): 94–101. 2012. https://doi.org/10.1016/j.jsams.2011.07.007
Кокорева И., Кореньков А., Соловьев И. Влияние препарата остеомед форте на сроки консолидации переломов костей у детей и подростков. Врач. 31(1): 82–85. 2020. [Kokoreva I., Korenkov A., Solovyev I. Effect of osteomed forte on the terms of bone fracture consolidation in children and adolescents. The Doctor. 31(1): 82–85. 2020. (In Russ)].
Корж Н.А., Дедух Н.В. Использование оссеин-гидроксиапатитного комплекса в лечении остеопороза и переломов (обзор литературы). Ортопедия, травматол. и протезиров. (2): 120–129. 2016. [Korzh M.O., Dedukh N.V. Application of ossein-hydroxyapatite complex for osteoporosis and fracture treatment (literature review). Orthopaedics, Traumatol. and Prosthetics. (2): 120–129. 2016. (In Russ)].
Fischer V., Haffner-Luntzer M., Prystaz K., Vom Scheidt A., Busse B., Schinke T., Amling M., Ign-atius A. Calcium and vitamin-D deficiency marginally impairs fracture healing but aggravates posttraumatic bone loss in osteoporotic mice. Sci. Rep. 7(1): 7223. 2017. https://doi.org/10.1038/s41598-017-07511-2
Karpouzos A., Diamantis E., Farmaki P., Savvanis S., Troupis T. Nutritional aspects of bone health and fracture healing. J. Osteoporos. 2017: 4218472. 2017. https://doi.org/10.1155/2017/4218472
Киреева Е.А., Стогов М.В., Карасев А.Г. Лабораторные биохимические маркеры тяжести травмы в остром периоде после множественных переломов костей конечностей. Клин. лабор. диагн. 61(6): 348–351. 2016. [Kireyeva E.A., Stogov M.V., Karasev A.G. The laboratory biochemical markers of severity of trauma in acute period after multiple fractures of bones of extremities. Klin. Lab. Diagn. 61(6): 348–351. 2016. (In Russ)].
Аметов А.С., Смоленский А.В., Капустина Н.В., Доскина Е.В. Особенности нутрицевтивной коррекции у пациентов с переломами костей. Вопр. питания. 87(S5): 69–70. 2018. [Ametov A.S., Smolenskii A.V., Kapustina N.V., Doskina E.V. Features of nutraceutical correction in patients with bone fractures. Probl. Nutrit. 87(S5): 69–70. 2018. (In Russ)].
Немировская Т.Л., Шенкман Б.С., Мухина А.М., Володкович Я.Ю., Саяпина М.М., Братцева Е.В., Ларина О.М. Влияние деафферентации на размеры и миозиновый фенотип мышечных волокон при растяжении m.soleus крысы на фоне гравитационной разгрузки. Рос. физиол. журн. им. И.М. Сеченова. 89(3): 259–270. 2003. [Nemirovskaia T.L., Shenkman B.S., Mukhina A.M., Volodkovich I.I., Saiapina M.M., Brattseva E.V., Larina O.M. Effect of deafferentation on the size and myosin phenotype of muscle fibers during stretching of rat m. soleus and gravitational unloading. Russ. J. Physiol. 89(3): 259–270. 2003. (In Russ)].
Bahney C.S., Zondervan R.L., Allison P., Theologis A., Ashley J.W., Ahn J., Miclau T., Marcucio R.S., Hankenson K.D. Cellular biology of fracture healing. J. Orthop. Res. 37(1): 35–50. 2019. https://doi.org/10.1002/jor.24170
Liu J., Wang J., Guo Y. Effect of collagen peptide, alone and in combination with calcium citrate, on bone loss in tail-suspended rats. Molecules. 25(4): 782. 2020. https://doi.org/10.3390/molecules25040782
Veronese N., Reginster J.Y. The effects of calorie restriction, intermittent fasting and vegetarian diets on bone health. Aging Clin. Exp. Res. 31(6): 753–758. 2019. https://doi.org/10.1007/s40520-019-01174-x
Darling A.L., Manders R.J.F., Sahni S., Zhu K., Hewitt C.E., Prince R.L., Millward D.J., Lanham-New S.A. Dietary protein and bone health across the life-course: an updated systematic review and meta-analysis over 40 years. Osteoporos. Int. 30(4): 741–761. 2019. https://doi.org/10.1007/s00198-019-04933-8
Halling L.C., Englund U.H., Narisawa S., Millán J.L., Magnusson P. Isozyme profile and tissue-origin of alkaline phosphatases in mouse serum. Bone. 53(2): 399–408. 2013. https://doi.org/10.1016/j.bone.2012.12.048
Murshed M. Mechanism of bone mineralization. Cold Spring Harb. Perspect. Med. 8(12): a031229. 2018. https://doi.org/10.1101/cshperspect.a031229
Rosa N., Simoes R., Magalhães F.D., Marques A.T. From mechanical stimulus to bone formation: A review. Med. Eng. Phys. 37(8): 719–728. 2015. https://doi.org/10.1016/j.medengphy.2015.05.015
Crockett J.C., Rogers M.J., Coxon F.P., Hocking L.J., Helfrich M.H. Bone remodelling at a glance. J. Cell. Sci. 124(Pt 7): 991–998. 2011. https://doi.org/10.1242/jcs.063032
Очеретина Р.Ю., Мкртчан О.З., Стогов М.В. Морфометрические параметры сосудов дольки печени у мышей в восстановительном периоде после травмы голени. Морфология. 141(2): 32–34. 2012. [Ocheretina R.Iu., Mkrtchan O.Z., Stogov M.V. Morphometric parameters of hepatic lobule vessels in mice during the restorative period after leg injury. Morphology. 141(2): 32–34. 2012. (In Russ)].
Majidinia M., Sadeghpour A., Yousefi B. The roles of signaling pathways in bone repair and regeneration. J. Cell. Physiol. 233(4): 2937–2948. 2018. https://doi.org/10.1002/jcp.26042
Marsell R., Einhorn T.A. The biology of fracture healing. Injury. 42(6): 551–555. 2011. https://doi.org/10.1016/j.injury.2011.03.031
Dolan E., Sale C. Protein and bone health across the lifespan. Proc. Nutr. Soc. 78(1): 45–55. 2019. https://doi.org/10.1017/S0029665118001180
Roberts J.L., Drissi H. Advances and promises of nutritional influences on natural bone repair. J. Orthop. Res. 38(4): 695–707. 2020. https://doi.org/10.1002/jor.24527
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


