Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 9, стр. 1109-1121
Влияние Roux-en-Y гастрошунтирования и продольной резекции желудка на метаболические и гормональные показатели и гипоталамический сигналинг у крыс с диабетом 2 типа
О. В. Корнюшин 1, К. В. Деркач 2, И. Б. Сухов 1, 2, А. С. Полозов 1, 3, Е. В. Савочкина 1, 3, В. В. Маслей 1, А. Э. Егорова 4, А. А. Бахтюков 2, А. О. Шпаков 2, *
1 НМИЦ им. В.А. Алмазова Минздрава России
Санкт-Петербург, Россия
2 Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
Санкт-Петербург, Россия
3 Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
4 Первый Санкт-Петербургский государственный медицинский университет
им. акад. И.П. Павлова
Санкт-Петербург, Россия
* E-mail: alex_shpakov@list.ru
Поступила в редакцию 06.03.2020
После доработки 16.04.2020
Принята к публикации 05.05.2020
Аннотация
Бариатрические операции широко используются для коррекции метаболических нарушений при сахарном диабете 2 типа (СД2), но механизмы их действия до конца не выяснены. Целью работы было изучить влияние Roux-en-Y гастрошунтирования (ГШ) и продольной резекции желудка (ПРЖ) на метаболические и гормональные показатели, а также на экспрессию гипоталамических генов, кодирующих факторы, регулирующие аппетит, и компоненты сигнальных систем, контролирующих энергетический обмен, у самцов крыс с СД2 без явного ожирения. СД2 вызывали 20-недельной высокожировой диетой и обработкой крыс 20 мг/кг стрептозотоцина (СТЗ) на 12-й неделе эксперимента. Операции проводили через 3 нед. после обработки СТЗ, на 19-й нед. оценивали чувствительность к глюкозе и гормональные показатели, на 20-й нед. забирали ткани гипоталамуса для оценки экспрессии генов. У крыс с СД2 обе операции уменьшали потребление пищи, снижали постпрандиальный уровень глюкозы, нормализовали уровень лептина, снижали значительно повышенный при СД2 уровень грелина в крови. Операция ПРЖ, которая в сравнении с ГШ в меньшей степени влияла на глюкозный гомеостаз и уровень грелина, более эффективно снижала потребление пищи и, в отличие от ГШ, восстанавливала сниженный при СД2 уровень глюкагоноподобного пептида-1 (ГПП-1). ГШ снижала повышенную при СД2 экспрессию орексигенных генов, кодирующих агути-подобный пептид и рецептор грелина, повышала экспрессию анорексигенных генов, кодирующих MC3- и MC4-меланокортиновые, 5-HT2C-серотониновый и лептиновый рецепторы и про-опиомеланокортин. Наибольший вклад в эффекты ПРЖ вносит значительное повышение экспрессии гена рецептора ГПП-1 в гипоталамусе, ассоциированное с повышением уровня ГПП-1 в крови. Таким образом, ГШ и ПРЖ могут быть эффективны для коррекции метаболических и функциональных нарушений при СД2 без ожирения, причем значительный вклад в эти эффекты вносит восстановление баланса между орексигенными и анорексигенными путями в гипоталамусе.
Бариатрические операции (БО) в настоящее время широко применяются для нормализации пищевого поведения и коррекции метаболических и гормональных нарушений у пациентов с сахарным диабетом 2 типа (СД2), метаболическим синдромом и тяжелыми формами ожирения [1, 2]. Среди БО наиболее часто используют продольную резекцию желудка (ПРЖ) и Roux-en-Y гастрошунтирование (ГШ). Операция ПРЖ обеспечивает сохранение общей протяженности желудочно-кишечного тракта и предотвращает развитие осложнений, обусловленных снижением всасывания питательных веществ. Операция ГШ, сочетающая рестриктивный и шунтирующий компоненты, обеспечивает выключение большей части желудка и начальных отделов тонкой кишки, результатом чего является снижение времени и площади соприкосновения содержимого желудочно-кишечного тракта со слизистой тонкой кишки. Обе БО показаны для пациентов с СД2, имеющих отчетливо выраженное ожирение и нарушенный липидный и углеводный обмен [1, 3, 4], в то время как их терапевтический эффект при лечении пациентов с СД2 без явного ожирения и дислипидемии остается мало изученным [5, 6]. Еще в 2010–2012 годы появилась серия клинических работ, авторы которых использовали ГШ по Roux-en-Y и лапароскопическую операцию мини-гастрошунтирования для лечения пациентов с СД2 без явного ожирения (индекс массы тела ниже 35 кг/м2) и добивались стабильного и устойчивого во времени улучшения чувствительности к инсулину и восстановления ряда метаболических и гормональных показателей [7–10]. Так, проведение ГШ по Roux-en-Y пациентам с СД2 и массой тела близкой к норме нормализовало у них уровни глюкозы и гликированного гемоглобина, восстанавливало липидный обмен, уменьшало до контрольных значений показатели артериального давления, снижало риски развития сердечно-сосудистых заболеваний, и все эти эффекты сохранялись на протяжении многих лет после оперативного вмешательства [7]. Китайские медики в 2017 г. сообщили, что эффективность ГШ по Roux-en-Y в группах пациентов с СД2 с ожирением и без такового является сходной как в отношении восстановления глюкозного и липидного обмена, так и в отношении предотвращения артериальной гипертензии [11]. Все это указывает на определяющую роль в терапевтическом эффекте БО не вызываемого этими операциями снижения массы тела, а изменения баланса секретируемых желудочно-кишечным трактом инкретинов и их регуляторного влияния на функции поджелудочной железы и гипоталамическую регуляцию пищевого поведения [6, 7, 9, 11].
Имеются убедительные свидетельства того, что БО подавляют аппетит и тем самым уменьшают поступление избыточного количества калорий в условиях, характерных для СД2, сниженного энергетического обмена и нарушенной чувствительности к глюкозе и инсулину [3, 12]. В то же время механизмы, лежащие в основе анорексигенных влияний БО, исследованы недостаточно [13]. Получены данные о положительном влиянии БО на гипоталамические пути, ответственные за контроль пищевого поведения и регуляцию энергетического обмена на периферии, у грызунов с сильно выраженным ожирением [12, 14]. Ранее нами при изучении крыс с тяжелой декомпенсированной формой СД2, имеющих небольшой дефицит массы тела, сильно выраженную гипергликемию и ослабленную инсулин-продуцирующую функцию поджелудочной железы, было показано, что в гипоталамусе БО снижают повышенную экспрессию гена Agrp, кодирующего орексигенный агути-подобный пептид (АПП), и нормализуют экспрессию генов рецептора глюкагоноподобного пептида-1 (ГПП-1) и негативных регуляторов лептинового и инсулинового сигналинга – фосфотирозин-специфичной фосфатазы 1B и супрессора-3 цитокинового сигналинга (SOCS3) [15]. Однако данные о влиянии БО на контролирующие энергетический обмен гипоталамические пути при умеренно выраженном СД2 с нормальной или в небольшой степени повышенной массой тела отсутствуют. В этой связи необходимо отметить, что такие формы СД2 соответствуют ранним стадиям этого заболевания, когда БО являются наиболее эффективными и могут быть использованы для лечения и профилактики тяжелых форм диабетической патологии.
Целью работы было изучить, как ГШ и ПРЖ влияют на пищевое поведение, метаболические и гормональные показатели и экспрессию гипоталамических генов, кодирующих сигнальные и эффекторные белки, регулирующие аппетит и периферический энергетический обмен, у самцов крыс с умеренно выраженным СД2 без явных признаков ожирения.
МЕТОДЫ ИССЛЕДОВАНИЯ
Для индукции СД2 использовали двухмесячных самцов крыс линии Вистар SPF-статуса, для чего животные в течение 20 недель получали обогащенную жирами диету, включающую 22% жира, 18% белка и 38% углеводов. Через 12 недель им однократно внутрибрюшинно в дозе 20 мг/кг вводили стрептозотоцин (СТЗ) в 0.1 М цитратном буфере (pH 4.5). Через 2 недели отбирали крыс с концентрацией постпрандиальной глюкозы в крови не ниже 8 мМ и рандомизировали их на три группы – ложнооперированные диабетические (группа ЛО-Д, n = 6) и диабетические с ГШ (ГШ-Д, n = 6) и ПРЖ (ПРЖ-Д, n = 6). Контрольных крыс (К, n = 6) содержали на стандартном рационе и вместо СТЗ однократно вводили цитратный буфер.
БО проводили, как описано ранее [16, 17] с нашими модификациями [18]. В ходе проведения операции ГШ осуществляли “выключение” большей части желудка и начальных отделов тонкой кишки, уменьшая площадь и время контакта содержимого со слизистой тонкой кишки, в то время как операцию ПРЖ проводили путем удаления большой кривизны желудка с формированием из оставшейся части узкой трубки.
Содержание глюкозы в крови оценивали с помощью тест-полосок One Touch Ultra (США), уровни инсулина, лептина, ГПП-1 и грелина – с помощью ИФА-наборов Rat Insulin ELISA (Mercodia, Швеция), ELISA kit for Leptin, ELISA kit for Glucagon like Peptide-1 (GLP-1), ELISA kit for Ghrelin (Ghrl) (Cloud-Clone Corp., США). В крови животных исследовали уровни глюкозы натощак, а также постпрандиальной глюкозы – через 120 мин после приема пищи или через 120 мин после глюкозной нагрузки в глюкозотолерантном тесте (ГТТ), в ходе которого крысам внутрибрюшинно вводили глюкозу в дозе 2 г/кг. В конце эксперимента, спустя 5 нед. после БО, крыс наркотизировали изофлюраном, декапитировали и забирали ткани гипоталамуса для оценки экспрессии целевых генов. Все процедуры проводили в соответствии с утвержденным Комиссией по контролю содержания и использования лабораторных животных протоколом-заявкой НМИЦ им. В.А. Алмазова и ИЭФБ РАН и требованиями, предусмотренными European Communities Council Directive 1986 и изложенными в Guide for the Care and Use of Laboratory Animals, 2010.
Для исследования экспрессии генов использовали количественную RT-ПЦР, для чего, как описано ранее [19, 20], выделяли тотальную РНК из гипоталамуса крыс с помощью TRIzol Reagent (Thermo Fisher Scientific Inc., США). Амплификацию осуществляли в инкубационной смеси, содержащей 100 нг ПЦР-продукта, 0.4 мкМ каждого праймера, среду qPCRmix-HS SYBR+LowROX (Евроген, Россия), детектируя амплификационный сигнал с помощью прибора 7500 Real-Time PCR System (Thermo Fisher Scientific Inc., США). В работе использовали праймеры для АПП (ген Agrp), про-опиомеланокортина (ПОМК) (ген Pomc), нейропептида Y (НПY) (ген Npy), рецептора инсулина (ген InsR), рецептора лептина (ген LepR), рецептора НПY (ген NpyR), рецептора ГПП-1 (ген Glp1R), рецептора грелина (ген GhsR), MC3-меланокортинового рецептора (МК3Р) (ген Mc3R), МК4Р (ген Mc4R), 5-HT2C-серотонинового рецептора (ген Ht2cR), D2-дофаминового рецептора (ген D2R), тирозиновой фосфатазы 1B (ген Ptp1b), ингибитора цитокинового сигналинга SOCS3 (ген Socs3). Последовательности прямых и обратных праймеров приведены в табл. 1. В качестве референсных использовали гены β-актина (Actb) и 18S rRNA. Анализ результатов проводили с использованием порогового метода ΔΔСt. Значения RQ рассчитывали по отношению к контрольной группе крыс.
Таблица 1.
Последовательности прямых и обратных праймеров, используемых для амплификации транскриптов целевых генов Table 1. The sequences of the forward (For) and reverse (Rev) primers used for amplification of transcripts of target genes
| No | Ген Gene | Локализация Localization | Праймер Primer |
|---|---|---|---|
| 1. | Agrp | For 5'–3' | TGAAGAAGACAGCAGCAGACC |
| Rev 5'–3' | TGAAGAAGCGGCAGTAGCAC | ||
| 2. | Pomc | For 5'–3' | AGGACCTCACCACGGAAAG |
| Rev 5'–3' | GTCAAGGGCTGTTCATCTCC | ||
| 3. | Npy | For 5'–3' | ACCAGGCAGAGATATGGCAAGA |
| Rev 5'–3' | GGACATTTTCTGTGCTTTCTCTCATTA | ||
| 4. | InsR | For 5'–3' | CTGGAGAACTGCTCGGTCATT |
| Rev 5'–3' | GGCCATAGACACGGAAAAGAAG | ||
| 5. | LepR | For 5'–3' | GCATGCAGAATCAGTGATATTTGG |
| Rev 5'–3' | CAAGCTGTATCGACACTGATTTCTTC | ||
| 6. | NpyR | For 5'–3' | GCTGTGGAACGTCATCAGCTA |
| Rev 5'–3' | TTGATAGATCACGAAGGGCAG | ||
| 7. | Glp1R | For 5'–3' | CATCGTGATAGCCAAGCTGA |
| Rev 5'–3' | GCTCGTCCATCACAAAGG | ||
| 8. | GhsR | For 5'–3' | GAGATCGCTCAGATCAGCCAGTAC |
| Rev 5'–3' | TAATCCCCAAACTGAGGTTCTGC | ||
| 9. | Mc3R | For 5'–3' | GTCACCATCACCATCCTGCTGGG |
| Rev 5'–3' | CAGGTAGGTGTTGAAGTGCGCCG | ||
| 10. | Mc4R | For 5'–3' | ACCCTCTCATTTATGCCCTGCGG |
| Rev 5'–3' | CACTCTGTCCCCACTTAATACCTGCC | ||
| 11. | Ht2cR | For 5'–3' | CGAGTCCGTTTCTCGTCTAGCT |
| Rev 5'–3' | TTGGCCTATGCTTGCAGGTA | ||
| 12. | D2R | For 5'–3' | GCAGCAGTCGAGCTTTCAGA |
| Rev 5'–3' | CGCCTGTTCACTGGGAAACT | ||
| 13. | Ptp1b | For 5'–3' | CAACCGAGGAGGAACAAAAGG |
| Rev 5'–3' | CAGTCTGTCAGTGAAAACATACCCG | ||
| 14. | Socs3 | For 5'–3' | GGGACCAAGAACCTACGC |
| Rev 5'–3' | GCTGCTCCTGAACCTCAAA |
Статистический анализ данных осуществляли с использованием программы Microso-ft Office Excel 2007. Нормальность распределения проверяли с помощью критерия Шапиро–Уилка. Для сравнения двух выборок с нормальным распределением использовали t-критерий Стьюдента. Данные представляли как M ± SEM, статистически значимыми считали отличия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Крысы с СД2, индуцированным 20-недельной высокожировой диетой и однократной обработкой низкой дозой СТЗ, имели повышенную массу тела, избыточное потребление пищи (из расчета в калориях), повышенные уровни глюкозы через 120 мин после приема пищи (постпрандиальная) или глюкозной нагрузки при проведении ГТТ (120-ГТТ). В крови крыс группы ЛО-Д в сравнении с контролем были повышены уровни грелина и, в меньшей степени, лептина, а также снижен уровень ГПП-1 (табл. 2). Эти данные свидетельствуют в пользу развития у животных умеренно выраженного СД2 без явного ожирения, с нарушенной толерантностью к глюкозе, а также с характерными для СД2 изменениями продукции лептина, грелина и ГПП-1. Обе БО снижали массу тела, подавляли аппетит, улучшали показатели глюкозного гомеостаза и гормональные показатели. В отношении влияния на массу тела, показатели глюкозного гомеостаза и уровни лептина и грелина, ГШ была более эффективной в сравнении с ПРЖ. В то же время ПРЖ в большей степени снижала потребление пищи. Наряду с этим, в группе ПРЖ-Д уровень ГПП-1 в крови, сниженный при СД2, повышался до контрольных значений, в то время как в группе ГШ-Д он не отличался от такового в группе ЛО-Д (табл. 2).
Таблица 2.
Масса тела, потребление пищи, уровни глюкозы и гормонов у крыс с СД2 и влияние на них Roux-en-Y гастрошунтирования и продольной резекции желудка Table 2. The body weight, food intake, the glucose and hormones levels in rats with DM2 and the effect of Roux-en-Y gastric bypass and sleeve gastrectomy on them
| Показатель Parameters | К C | ЛО-Д Sham-D | ГШ-Д RYGB-D | ПРЖ-Д SG-D |
| Масса тела, г Body weight, g |
405 ± 9 | 440 ± 11 a | 383 ± 17 b | 393 ± 10 b |
| Потребление пищи, ккал/крысу/день* Food intake, kcal/rat/day* |
65.0 ± 2.1 | 83.3 ± 2.1 a | 74.7 ±1.3 a, b | 68.8 ± 2.2 b, c |
| Глюкоза (тощ.), ммоль/л Glucose (fasting), mmol/L |
4.4 ± 0.2 | 6.1 ± 0.4 a | 4.9 ± 0.2 b | 5.4 ± 0.2 a |
| Глюкоза (постпранд.), ммоль/л Glucose (postprandial), mmol/L |
5.3 ± 0.3 | 8.9 ± 0.5 a | 6.7 ± 0.3 a, b | 7.9 ± 0.6 a |
| Глюкоза (120 мин, ГТТ), ммоль/л Glucose (120 min), mmol/L |
5.2 ± 0.2 | 10.4 ± 0.6 a | 7.1 ± 0.6 a, b | 7.6 ± 0.6 a, b |
| Инсулин, нг/мл Insulin, ng/mL |
0.74 ± 0.09 | 0.69 ± 0.08 | 0.71 ± 0.05 | 0.72 ± 0.08 |
| Лептин, нг/мл Leptin, ng/mL |
0.83 ± 0.10 | 1.17 ± 0.10 a | 0.85 ± 0.08 b | 0.92 ± 0.09 |
| ГПП-1, пг/мл GLP-1, pg/mL |
1.62 ± 0.15 | 1.05 ± 0.08 a | 0.99 ± 0.07 a | 1.54 ± 0.17 b, c |
| Грелин, пг/мл Ghrelin, pg/mL |
276 ± 38 | 879 ± 72 a | 337 ± 36 b | 519 ± 41 a, b, c |
a – различия между группами К и ЛО-Д статистически значимы при p < 0.05; b – различия между группой ЛО-Д и группами ГШ-Д и ПРЖ-Д статистически значимы при p < 0.05. M ± SEM. * – усредненное потребление пищи в течение шести дней в пересчете на килокалории. a – the differences between the groups C and Sham-D are statistically significant at p < 0.05; b – the differences between the group Sham-D and the groups RYGB-D and SG-D are statistically significant at p < 0.05. M ± SEM. * – the average food intake for six days, expressed in the kilocalories.
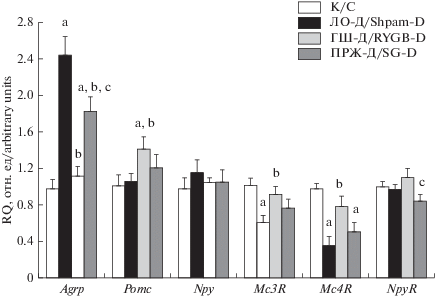
В гипоталамусе исследовали экспрессию генов, кодирующих факторы пищевого поведения и их рецепторы, рецепторы моноаминов, грелина и ГПП-1 и компоненты лептинового и инсулинового сигнальных путей. В группе ЛО-Д экспрессия гена орексигенного фактора АПП в значительной степени повышалась, а экспрессия генов Pomc и Npy менялась незначительно (рис. 1). В этой группе также отмечали снижение экспрессии генов МК3Р и МК4Р, являющихся мишенями АПП (антагониста) и генерируемых из ПОМК анорексигенных меланокортиновых пептидов (агонистов), при сохранении экспрессии гена рецептора НПY. Операция ГШ приводила к значительному снижению экспрессии гена Agrp и повышению, хотя и слабо выраженному, экспрессии гена Pomc, не влияя при этом на экспрессию гена орексигенного фактора НПY. Наряду с этим, в группе ГШ-Д восстанавливалась экспрессия гена Mc4R и, в меньшей степени, гена Mc3R. Операция ПРЖ статистически значимо снижала экспрессию Agrp, но в значительно меньшей степени, чем ГШ, и слабо влияла на экспрессию генов Pomc, Npy, Mc3R, Mc4R и NpyR (рис. 1).
Рис. 1.
Влияние Roux-en-Y гастрошунтирования и продольной резекции желудка на экспрессию генов анорексигенных и орексигенных факторов и их рецепторов в гипоталамусе крыс с СД2. Уровень экспрессии целевых генов нормирован по уровню экспрессии генов Actb и 18S rRNA. a – различия между группами К и ЛО-Д статистически значимы при p < 0.05; b – различия между группой ЛО-Д и группами ГШ-Д и ПРЖ-Д статистически значимы при p < 0.05; c – различия между группами ГШ-Д и ПРЖ-Д статистически значимы при p < 0.05. Данные представлены в виде M ± SEM. n = 6. Fig. 1. The effect of Roux-en-Y gastric bypass and sleeve gastrectomy on the expression of the genes of the anorexigenic and orexigenic factors and their receptors in the hypothalamus of rats with DM2. The level of expression of target genes is normalized by the level of gene expression of Actb and 18S rRNA. a – the differences between the groups C and Sham-D are statistically significant at p < 0.05; b – the differences between the group Sham-D and the groups RYGB-D and SG-D are statistically significant at p < 0.05; c – the differences between the groups RYGB-D and SG-D are statistically significant at p < 0.05. The data are presented as M ± SEM. n = 6.
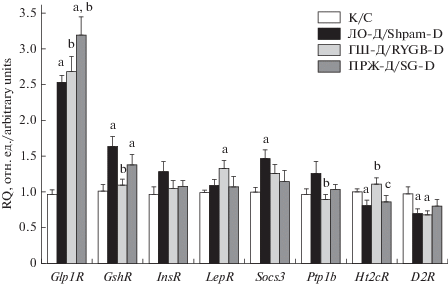
В гипоталамусе крыс группы ЛО-Д экспрессия генов рецепторов ГПП-1 и грелина в значительной степени повышалась, в то время как экспрессия генов рецепторов лептина и инсулина не отличалась от таковых в контроле. В группе ЛО-Д повышалась экспрессия генов негативных регуляторов лептинового и инсулинового сигналинга – SOCS3 и фосфатазы 1B, но достоверные различия отмечали только для гена Socs3 (рис. 2). В группе ГШ-Д при сохранении высокого уровня экспрессии гена Glp1R отмечали снижение экспрессии генов рецепторов грелина и фосфатазы 1B, а также повышение, по сравнению с контрольной группой, экспрессии гена лептинового рецептора. В группе ПРЖ-Д отмечали еще более выраженное повышение экспрессии гена Glp1R, а также тенденцию к снижению экспрессии генов Socs3 и Ptp1b, но различия с группой ЛО-Д не были статистически значимыми (рис. 2). Экспрессия генов 5-HT2C-серотонинового и D2-дофаминового рецепторов в группе ЛО-Д снижалась. При проведении операции ГШ отмечали восстановление экспрессии гена Ht2cR, в то время как ПРЖ существенного влияния на экспрессию генов Ht2cR и D2R не оказывала (рис. 2).
Рис. 2.
Влияние Roux-en-Y гастрошунтирования и продольной резекции желудка на экспрессию генов рецепторов инсулина, лептина, инкретинов и моноаминов и негативных регуляторов лептинового и инсулинового сигналинга в гипоталамусе крыс с СД2. Уровень экспрессии целевых генов нормирован по уровню экспрессии генов Actb и 18S rRNA. a – различия между группами К и ЛО-Д статистически значимы при p < 0.05; b – различия между группой ЛО-Д и группами ГШ-Д и ПРЖ-Д статистически значимы при p < 0.05; c – различия между группами ГШ-Д и ПРЖ-Д статистически значимы при p < 0.05. Данные представлены в виде M ± SEM. n = 6. Fig. 2. The effect of Roux-en-Y gastric bypass and sleeve gastrectomy on the expression of the genes of the insulin, leptin, incretins and monoamines receptors and the negative regulators of insulin signaling in the hypothalamus of rats with DM2. The level of expression of target genes is normalized by the level of gene expression of Actb and 18S rRNA. a – the differences between the groups C and Sham-D are statistically significant at p < 0.05; b – the differences between the group Sham-D and the groups RYGB-D and SG-D are statistically significant at p < 0.05; c – the differences between the groups RYGB-D and SG-D are statistically significant at p < 0.05. The data are presented as M ± SEM. n = 6.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Имеются многочисленные свидетельства того, что БО приводят к снижению массы тела и жировой ткани, нормализации углеводного и липидного обмена, восстановлению чувствительности к глюкозе и инсулину как у экспериментальных животных, так и у пациентов с СД2 [1–4]. Положительное влияние БО на метаболические и гормональные показатели может выявляться не только при СД2 с сильно выраженным ожирением и дислипидемией, но и при СД2 без явных признаков ожирения. В пользу этого свидетельствуют полученные нами ранее результаты о влиянии операций ПРЖ, ГШ и илеотранспозиции на метаболический статус крыс с тяжелой формой СД2 и небольшим дефицитом массы тела [15], а также данные ряда авторов о положительном влиянии БО на метаболические и функциональные показатели у пациентов с СД2 без явного ожирения [5–11]. На основании этого мы предположили, что вызываемая БО нормализация метаболических и гормональных показателей при СД2 без ожирения обусловлена не только снижением всасывания питательных веществ в желудочно-кишечном тракте, но и изменениями инкретинового статуса и активности гипоталамических сигнальных систем, контролирующих аппетит, пищевое поведение и энергетический обмен. В пользу этого свидетельствует то, что операция ПРЖ, после которой всасывание питательных веществ в желудочно-кишечном тракте меняется слабо, по эффективности при СД2 сопоставима, а по некоторым параметрам и превосходит другие БО [1, 4, 21]. Результаты проведенного нами исследования, в ходе которого изучали влияние ГШ и ПРЖ не только на метаболические и гормональные показатели, но и на экспрессию “пищевых” и “метаболических” генов в гипоталамусе крыс с СД2 без явного ожирения подтвердили это предположение.
Операция ГШ снижала повышенную при СД2 экспрессию гена орексигенного АПП, восстанавливала сниженную при СД2 экспрессию гена МК4Р и в небольшой степени повышала экспрессию гена анорексигенного ПОМК. Необходимо отметить, что ПОМК является прекурсором α-меланоцитстимулирующего гормона и других меланокортиновых пептидов, эндогенных агонистов МК4Р и МК3Р, функционирующих как факторы снижения аппетита [22, 23], в то время как АПП наделен активностью функционального антагониста МК4Р [24]. Операция ГШ также нормализовала уровень грелина в крови – полипептидного гормона, синтезируемого клетками желудочно-кишечного тракта. Одна из главных функций грелина состоит в стимуляции аппетита и реализуется как вследствие повышения моторики желудка и усиления секреции желудочного сока, так и путем активации орексигенных гипоталамических путей при его связывании с грелиновыми рецепторами, расположенными на поверхности гипоталамических нейронов [25, 26]. Нами показано, что повышенная при СД2 экспрессия гена GshR в гипоталамусе крыс группы ГШ-Д снижалась до контрольного уровня, что в сочетании со снижением уровня грелина в крови ведет к ослаблению орексигенного влияния грелина на пищевое поведение как на уровне желудочно-кишечного тракта, так и через гипоталамические механизмы. Вызываемое БО снижение повышенного при СД2 уровня грелина в крови показано и другими авторами [27, 28]. Восстановление нарушенного при СД2 баланса между орексигенными и анорексигенными путями в гипоталамусе при проведении ГШ хорошо согласуется со снижением массы тела и потребления пищи и нормализацией глюкозного гомеостаза у крыс группы ГШ-Д.
В сравнении с ГШ, ПРЖ была менее эффективной в отношении восстановления таких показателей у крыс с СД2, как масса тела, уровни постпрандиальной глюкозы, лептина и грелина в крови. В меньшей степени она влияла и на экспрессию гипоталамических генов АПП, ПОМК, меланокортиновых рецепторов и рецептора грелина. В то же время в группе ПРЖ-Д отмечали более выраженное снижение потребления пищи в сравнении с группой ГШ-Д. Как можно полагать, это обусловлено повышением уровня ГПП-1 в крови и, как следствие, усилением сигнальных путей ГПП-1 в гипоталамусе. ГПП-1, вырабатываемый преимущественно L-клетками кишечника и α-клетками поджелудочной железы, повышает секрецию инсулина панкреатическими β-клетками в условиях повышения уровня глюкозы в крови, а также снижает аппетит, являясь функциональным антагонистом грелина [29–31]. Анорексигенный эффект ГПП-1 и его аналогов обусловлен не только его влиянием на желудочно-кишечный тракт, в основе чего лежит замедление опорожнения желудка и снижение моторики кишечника, но и непосредственным воздействием на гипоталамические нейроны, ответственные за достижение чувства сытости, на поверхности которых локализованы рецепторы ГПП-1 [29]. Нами показано, что в группе ПРЖ-Д уровень ГПП-1 в крови достигал такового в контроле и превышал уровни ГПП-1 в группах ЛО-Д и ГШ-Д на 47 и 56% соответственно. В дополнение к этому в гипоталамусе крыс группы ПРЖ-Д экспрессия гена рецептора ГПП-1 была в три раза выше, чем в контроле и достоверно превышала таковую в группе ЛО-Д. Повышая уровень ГПП-1 в крови и нормализуя гипоталамические ГПП-1-зависимые пути при СД2, БО не только усиливают анорексигенные ГПП-1-зависимые влияния, но также препятствуют развитию нейродегенеративных изменений в гипоталамусе и других отделах мозга, улучшая тем самым центральную регуляцию пищевого поведения и энергетического баланса [32].
Выявленные различия во влиянии ГШ и ПРЖ на пищевое поведение и экспрессию контролирующих его гипоталамических генов могут быть обусловлены особенностями этих БО. Так, при ГШ значительная часть желудка и тонкой кишки выключаются из процесса всасывания пищи, в то время как при ПРЖ этого не происходит. В случае ПРЖ общая протяженность желудочно-кишечного тракта не претерпевает существенных изменений, что модифицирует всасывающую способность, но не приводит к ее снижению. Вероятно в связи с этим, при проведении ПРЖ на первый план выходит восстановление у крыс с СД2 уровня ГПП-1 и активности его сигнальных путей, в то время как нормализация других механизмов, направленных на снижение потребления пищи и достижение чувства сытости, в этом случае не столь критична, как при ГШ.
В этой связи необходимо отметить, что ПРЖ также не влияла на ослабленную при СД2 экспрессию генов 5-HT2C-серотонинового и D2-дофаминового рецепторов, в то время как ГШ достоверно повышала экспрессию гена 5-HT2C-серотонинового рецептора. Имеются данные, что в условиях метаболических расстройств экспрессия этих рецепторов и регулируемые ими каскады в различных отделах мозга претерпевают значительные изменения, что влияет на мотивацию к потреблению пищи и на достижение чувства сытости [33, 34]. Наряду с этим серотонинергические и дофаминергические системы в гипоталамусе влияют на функциональную активность меланокортиновых, лептиновых, грелиновых и НПY-зависимых путей [19, 35].
Нами показано, что экспрессия генов орексигенного фактора НПY и его рецептора, играющих важную роль в контроле пищевого поведения [36], как в группе ЛО-Д, так и в группах ГШ-Д и ПРЖ-Д менялась незначительно. В связи с этим можно предположить, что НПY и его сигнальная система непосредственно не вовлечены в нормализацию пищевого поведения, вызываемую ГШ и ПРЖ при СД2 без ожирения. Однако в гипоталамусе НПY-сигнальная система является важным связующим звеном между грелиновой и меланокортиновой системами [37] и тем самым может опосредованно участвовать в реализации эффектов ГШ и ПРЖ на аппетит и метаболические показатели при СД2. Так, показано, что у крыс линии Sprague–Dawley с сильно выраженным ожирением ПРЖ не только нормализовала экспрессию НПY в гипоталамусе, но и одновременно с этим нормализовала уровень грелина в крови и усиливала экспрессию гена ПОМК в гипоталамусе [38].
Известно, что в регуляцию аппетита и энергетического обмена вовлечены гипоталамические лептиновая и инсулиновая системы, причем, нами и другими авторами показано, что при СД2 и МС они претерпевают существенные изменения [19, 20, 35, 39]. БО, в первую очередь ГШ, ослабляют гиперлептинемию и гиперинсулинемию у экспериментальных животных и пациентов с СД2 и сильно выраженным ожирением [3, 40, 41]. Однако нами установлено, что у крыс с СД2 без ожирения изменения уровней инсулина и лептина в крови, а также изменения экспрессии генов, кодирующих рецепторы лептина и инсулина и негативные регуляторы их сигнальных путей в гипоталамусе, либо отсутствуют, либо слабо выражены. Операции ГШ и ПРЖ вызывали нормализацию уровня лептина, в небольшой степени повышенного в группе ЛО-Д, а в гипоталамусе крыс группы ГШ-Д отмечали достоверное, хотя и слабо выраженное усиление экспрессии гена лептинового рецептора и ослабление экспрессии гена фосфатазы 1B, негативного регулятора лептинового и инсулинового сигналинга. Это может указывать на вызываемое ГШ усиление гипоталамической лептиновой сигнализации у крыс с СД2.
Таким образом, нами впервые показано, что ГШ и ПРЖ приводят к снижению потребления пищи и нормализации ряда метаболических и гормональных показателей у крыс с СД2 без явного ожирения, в том числе, к улучшению нарушенного при диабетической патологии гликемического гомеостаза, нормализации уровня лептина и снижению значительно повышенного при СД2 уровня грелина. Операция ПРЖ, которая в сравнении с ГШ в меньшей степени влияла на глюкозный гомеостаз и уровень грелина, была более эффективной в отношении снижения потребления пищи и, в отличие от ГШ, восстанавливала сниженный при СД2 уровень ГПП-1. При проведении ГШ отчетливо снижалась повышенная при СД2 экспрессия орексигенных генов (АПП, рецептор грелина) и повышалась экспрессия анорексигенных генов до ее уровня в контроле (МК3Р, МК4Р, 5-HT2C-серотониновый рецептор) или выше (ПОМК, рецептор лептина). Значительный вклад в вызываемые ПРЖ снижение аппетита и улучшение метаболических показателей вносят нормализация уровня ГПП-1 в крови и повышение экспрессии гена рецептора ГПП-1 в гипоталамусе. Полученные данные указывают на перспективы применения ГШ и ПРЖ для коррекции метаболических и функциональных нарушений при СД2 без ожирения, а также на вклад в восстанавливающие эффекты этих БО гипоталамических механизмов.
Список литературы
Nguyen N.T., Varela J.E. Bariatric surgery for obesity and metabolic disorders: state of the art. Nat. Rev. Gastroenterol. Hepatol. 14(3): 160–169. 2017. https://doi.org/10.1038/nrgastro.2016.170
Stewart J., Allen S., Weidman-Evans E. Bariatric surgery and type 2 diabetes. JAAPA. 33(1):28–32. 2020. https://doi.org/10.1097/01.JAA.0000615484.77430.1b
Gonzalez-Campoy J.M., Richardson B., Richardson C., Gonzalez-Cameron D., Ebrahim A., Strobel P., Martinez T., Blaha B., Ransom M., Quinonez-Weislow J., Pierson A., Gonzalez Ahumada M. Bariatric endocrinology: principles of medical practice. Int. J. Endocrinol. 2014:917813. 2014. https://doi.org/10.1155/2014/917813
Aminian A. Bariatric procedure selection in patients with type 2 diabetes: choice between Roux-en-Y gastric bypass or sleeve gastrectomy. Surg. Obes. Relat. Dis. pii: S1550-7289(19)31114-1. 2019. https://doi.org/10.1016/j.soard.2019.11.013
Osman Abouzeid T.A., Ain Shoka A.A., Abd Elsamee Atia K.S. From diabetes remedy to diabetes remission; could single-anastomosis gastric bypass be a safe bridge to reach target in non-obese patients? Asian J. Surg. 42(1): 307–313. 2019. https://doi.org/10.1016/j.asjsur.2018.04.002
Rubio-Almanza M., Hervás-Marín D., Cámara-Gómez R., Caudet-Esteban J., Merino-Torres J.F. Does Metabolic Surgery Lead to Diabetes Remission in Patients with BMI <30 kg/m2? A Meta-analysis. Obes. Surg. 29(4): 1105–1116. 2019. https://doi.org/10.1007/s11695-018-03654-x
Shah S.S., Todkar J.S., Shah P.S., Cummings D.E. Diabetes remission and reduced cardiovascular risk after gastric bypass in Asian Indians with body mass index <35 kg/m(2). Surg. Obes. Relat. Dis. 6(4): 332–338. 2010. https://doi.org/10.1016/j.soard.2009.08.009
Rubino F., Schauer P.R., Kaplan L.M., Cummings D.E. Metabolic surgery to treat type 2 diabetes: clinical outcomes and mechanisms of action. Annu. Rev. Med. 61: 393–411. 2010. https://doi.org/10.1146/annurev.med.051308.105148
Cohen R.V., Pinheiro J.C., Schiavon C.A., Salles J.E., Wajchenberg B.L., Cummings D.E. Effects of gastric bypass surgery in patients with type 2 diabetes and only mild obesity. Diabetes Care. 35(7): 1420–1428. 2012. https://doi.org/10.2337/dc11-2289
Reis C.E., Alvarez-Leite J.I., Bressan J., Alfenas R.C. Role of bariatric-metabolic surgery in the treatment of obese type 2 diabetes with body mass index <35 kg/m2: a literature review. Diabetes Technol. Ther. 14(4): 365–372. 2012. https://doi.org/10.1089/dia.2011.0127
Zhang H., Han X., Yu H., Di J., Zhang P., Jia W. Effect of Roux-en-Y Gastric Bypass on Remission of T2D: Medium-Term Follow-up in Chinese Patients with Different BMI Obesity Class. Obes. Surg. 27(1): 134–142. 2017. https://doi.org/10.1007/s11695-016-2262-5
Nilaweera K.N., Speakman J.R. Regulation of intestinal growth in response to variations in energy supply and demand. Obes. Rev. 19(Suppl 1): 61–72. 2018. https://doi.org/10.1111/obr.12780
Russel S.M., Valle V., Spagni G., Hamilton S., Patel T., Abdukadyrov N., Dong Y., Gangemi A. Physiologic Mechanisms of Type II Diabetes Mellitus Remission Following Bariatric Surgery: a Meta-analysis and Clinical Implications. J. Gastrointest. Surg. 24(3): 728–741. 2020. https://doi.org/10.1007/s11605-019-04508-2
Sirohi S., Skripnikova E., Davis J.F. Vertical Sleeve Gastrectomy Attenuates Hedonic Feeding Without Impacting Alcohol Drinking in Rats. Obesity (Silver Spring). 27(4): 603–611. 2019. https://doi.org/10.1002/oby.22415
Kornyushin O.V., Bakhtyukov A.A., Zorina I.I., Toropova Ya.G., Derkach K.V., Berko O.M., Todosenko M.N., Litvinova L.S., Shpakov A.O., Galagudza M.M. The effect of different types of bariatric surgery on metabolic and hormonal parameters in rats with a decompensated form of type II diabetes mellitus. Adv. Gerontol. 9(3): 336–342. 2019. https://doi.org/10.1134/S2079057019030081
Liu J.Y., Mu S., Zhang S.P., Guo W., Li Q.F., Xiao X.Q., Zhang J., Wang Z.H. Roux-en-Y gastric bypass surgery suppresses hypothalamic PTP1B protein level and alleviates leptin resistance in obese rats. Exp. Ther. Med. 14(3): 2536–2542. 2017. https://doi.org/10.3892/etm.2017.4801
Wang Q., Tang W., Rao W.S., Song X., Shan C.X., Zhang W. Changes of Ghrelin/GOAT axis and mTOR pathway in the hypothalamus after sleeve gastrectomy in obese type-2 diabetes rats. World J. Gastroenterol. 23(34): 6231–6241. 2017. https://doi.org/10.3748/wjg.v23.i34.6231
Корнюшин О.В., Торопова Я.Г., Неймарк А.Е., Берко О.М., Глистенкова Д.Д., Карелли Л.Г., Полозов А.С., Галагудза М.М. Хирургическая коррекция метаболического синдрома в эксперименте на крысах: методические аспекты. Бюл. Сибирск. медицины. 17(1): 59–74. 2018. [Kornyushin O.V., Toropova Ya.G., Neimark A.E., Berko O.M., Glistenkova D.D., Carelli L.G., Polozov A.S., Galagudza M.M. Surgical correction of metabolic syndromes in rats: methodological aspects. Bull. Siberian Medicine. 17(1): 59–74. 2018. (In Russ)]. https://doi.org/10.20538/1682-0363-2018-1-59-74
Romanova I.V., Derkach K.V., Mikhrina A.L., Sukhov I.B., Mikhailova E.V., Shpakov A.O. The leptin, dopamine and serotonin receptors in hypothalamic POMC-neurons in normal and obese rodents. Neurochem. Res. 43(4): 821–837. 2018. https://doi.org/10.1007/s11064-018-2485-z
Derkach K., Zakharova I., Zorina I., Bakhtyukov A., Romanova I., Bayunova L., Shpakov A. The evidence of metabolic-improving effect of metformin in Ay/a mice with genetically-induced melanocortin obesity and the contribution of hypothalamic mechanisms to this effect. PloS One. 14(3): e0213779. 2019. https://doi.org/10.1371/journal.pone.0213779
Abdel-Rahim M.M., Magdy M.M., Mohamad A.A. Comparative study between effect of sleeve gastrectomy and mini-gastric bypass on type 2 diabetes mellitus. Diabetes Metab. Syndr. 12(6):949–954. 2018. https://doi.org/10.1016/j.dsx.2018.06.001
Baldini G., Phelan K.D. The melanocortin pathway and control of appetite-progress and therapeutic implications. J. Endocrinol. 241(1): R1–R33. 2019. https://doi.org/10.1530/JOE-18-0596
Heyder N., Kleinau G., Szczepek M., Kwiatkowski D., Speck D., Soletto L., Cerdá-Reverter J.M., Krude H., Kühnen P., Biebermann H., Scheerer P. Signal Transduction and Pathogenic Modifications at the Melanocortin-4 Receptor: A Structural Perspective. Front. Endocrinol. (Lausanne). 10: 515. 2019. https://doi.org/10.3389/fendo.2019.00515
Han Y., Xia G., Wu Q. Functional Interrogation of the AgRP Neural Circuits in Control of Appetite, Body Weight, and Behaviors. Adv. Exp. Med. Biol. 1090: 1–16. 2018. https://doi.org/10.1007/978-981-13-1286-1_1
Al Massadi O., López M., Tschöp M., Diéguez C., Nogueiras R. Current Understanding of the Hypothalamic Ghrelin Pathways Inducing Appetite and Adiposity. Trends Neurosci. 40(3):167–180. 2017. https://doi.org/10.1016/j.tins.2016.12.003
Sanger G.J., Broad J., Callaghan B., Furness J.B. Ghrelin and Motilin Control Systems in GI Physiology and Therapeutics. Handb. Exp. Pharmacol. 239: 379–416. 2017. https://doi.org/10.1007/164_2016_104
Yardimci E., Bozkurt S., Cengiz M.B., Malya F.U. Comparison of Weight Loss, Ghrelin, and Leptin Hormones After Ligation of Left Gastric Artery and Sleeve Gastrectomy in a Rat Model. Med. Sci. Monit. 23: 1442–1447. 2017. https://doi.org/10.12659/msm.901003
Yavuz Y., Kumral Z.N., Memi G., Çevik Ö.D., Yeğen C., Yeğen B.Ç. Serum Leptin, Obestatin, and Ghrelin Levels and Gastric Emptying Rates of Liquid and Solid Meals in Non-obese Rats with Roux-en-Y Bypass Surgery or Prosthesis Placement: Implications for the Role of Vagal Afferents. Obes. Surg. 27(4): 1037–1046. 2017. https://doi.org/10.1007/s11695-016-2420-9
Shah M., Vella A. Effects of GLP-1 on appetite and weight. Rev. Endocr. Metab. Disord. 15(3): 181–187. 2014. https://doi.org/10.1007/s11154-014-9289-5
Lu K., Chen X., Yan J., Li X., Huang C., Wan Q., Deng X., Zou Q. The Effect of Feeding Behavior on Hypothalamus in Obese Type 2 Diabetic Rats with Glucagon-like Peptide-1 Receptor Agonist Intervention. Obes. Facts. 11(3): 181–194. 2018. https://doi.org/10.1159/000486316
Nonogaki K., Kaji T. Liraglutide, a GLP-1 Receptor Agonist, Which Decreases Hypothalamic 5-HT2A Receptor Expression, Reduces Appetite and Body Weight Independently of Serotonin Synthesis in Mice. J. Diabetes Res. 2018: 6482958. 2018. https://doi.org/10.1155/2018/6482958
Keshava H.B., Mowla A., Heinberg L.J., Schauer P.R., Brethauer S.A., Aminian A. Bariatric surgery may reduce the risk of Alzheimer’s diseases through GLP-1 mediated neuroprotective effects. Med. Hypotheses. 104: 4–9. 2017. https://doi.org/10.1016/j.mehy.2017.05.002
Salahpour A., Caron M.G. Food for thought: the physiological relevance of ghrelin and dopamine D2 receptor heterodimerization in the regulation of appetite. Neuron. 73(2): 210–211. 2012. https://doi.org/10.1016/j.neuron.2012.01.004
D'Agostino G., Lyons D., Cristiano C., Lettieri M., Olarte-Sanchez C., Burke L.K., Greenwald-Yarnell M., Cansell C., Doslikova B., Georgescu T., Martinez de Morentin P.B., Myers M.G. Jr, Rochford J.J., Heisler L.K. Nucleus of the Solitary Tract Serotonin 5-HT2C Receptors Modulate Food Intake. Cell. Metab. 28(4): 619–630.e5. 2018. https://doi.org/10.1016/j.cmet.2018.07.017
Shpakov A.O., Derkach K.V., Berstein L.M. Brain signaling systems in the type 2 diabetes and metabolic syndrome: promising target to treat and prevent these diseases. Future Science OA (FSO). 1(3): FSO25. 2015. https://doi.org/10.4155/fso.15.23
Shende P., Desai D. Physiological and Therapeutic Roles of Neuropeptide Y on Biological Functions. Adv. Exp. Med. Biol. 1237: 37–47. 2020. https://doi.org/10.1007/5584_2019_427
Yu C.H., Chu S.C., Chen P.N., Hsieh Y.S., Kuo D.Y. Participation of ghrelin signalling in the reciprocal regulation of hypothalamic NPY/POMC-mediated appetite control in amphetamine-treated rats. Appetite. 113: 30–40. 2017. https://doi.org/10.1016/j.appet.2017.02.010
Kawasaki T., Ohta M., Kawano Y., Masuda T., Gotoh K., Inomata M., Kitano S. Effects of sleeve gastrectomy and gastric banding on the hypothalamic feeding center in an obese rat model. Surg. Today. 45(12):1560–1566. 2015. https://doi.org/10.1007/s00595-015-1135-1
Izquierdo A.G., Crujeiras A.B., Casanueva F.F., Carreira M.C. Leptin, Obesity, and Leptin Resistance: Where Are We 25 Years Later? Nutrients. 11(11). pii: E2704. 2019. https://doi.org/10.3390/nu11112704
Ramos A.P., de Abreu M.R., Vendramini R.C., Brunetti I.L., Pepato M.T. Decrease in circulating glucose, insulin and leptin levels and improvement in insulin resistance at 1 and 3 months after gastric bypass. Obes. Surg. 16(10): 1359–1364. 2006. https://doi.org/10.1381/096089206778663706
Netto B.D., Bettini S.C., Clemente A.P., Ferreira J.P., Boritza K., Souza Sde F., Von der Heyde M.E., Earthman C.P., Dâmaso A.R. Roux-en-Y gastric bypass decreases pro-inflammatory and thrombotic biomarkers in individuals with extreme obesity. Obes. Surg. 25(6): 1010–1018. 2015. https://doi.org/10.1007/s11695-014-1484-7
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


