Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 9, стр. 1122-1131
Роль тканевого эритропоэтина и механизмов обратной связи в локальной регуляции эритропоэза
Н. В. Тишевская 1, *, С. А. Шевяков 1
1 Южно-Уральский государственный медицинский университет
Челябинск, Россия
* E-mail: natalya-tishevskaya@yandex.ru
Поступила в редакцию 12.02.2020
После доработки 17.05.2020
Принята к публикации 05.07.2020
Аннотация
Эритробластические островки (ЭО) костного мозга крысы культивировали 24, 48 или 72 ч вместе с эритроцитами разной степени зрелости, моделируя в системе in vitro состояние гипер- или гипорегенерации эритрона. В контрольных и опытных культурах ЭО определяли концентрацию эритропоэтина методом двухсайтового твердофазного иммуноферментного анализа. При добавлении ретикулоцитов/молодых эритроцитов (модель гиперрегенерации эритрона) в дозе 30 или 60 клеток/1 ЭО через 24 ч культивирования концентрация эритропоэтина в культуральной среде увеличилась на 37% по сравнению с контрольными культурами. В культурах с 120/1 ЭО ретикулоцитами/молодыми эритроцитами концентрация эритропоэтина к 48 ч снижалась на 25%. Добавление зрелых/старых эритроцитов (модель гипорегенерации эритрона) вызывало торможение синтеза эритропоэтина в культуре ЭО. К 48 ч содержание этого гормона в культивационной среде достоверно уменьшилось во всех сериях эксперимента: в культурах с 30 клеток/1 ЭО – на 18%, а в культурах с большой эритроцитарной нагрузкой – на 28%. В 72-часовых культурах, содержащих 30, 60 или 120 эритроцитов/1 ЭО, концентрация эритропоэтина снизилась на 26, 40 и 53% соответственно по сравнению с контролем. Нами установлено, что локальная регуляция эритропоэза напрямую связана с синтезом эритропоэтина в ЭО и зависит от количества и степени зрелости клеток, продуцируемых красным костным мозгом. Полученные данные позволяют утверждать, что именно тканевой эритропоэтин является важнейшим звеном в реализации механизмов обратной связи, обеспечивающих адекватный ответ центрального звена эритрона на кислородный запрос в физиологических условиях и поддерживающих эритропоэз при патологических состояниях, сопровождающихся недостаточной продукцией эритропоэтина в почках.
Эритропоэз в костном мозге млекопитающих происходит в специализированных гемопоэтических нишах – эритробластических островках (ЭО), представляющих собой ассоциации макрофагальных (центральные макрофаги ЭО) и эритроидных клеток [1–4]. Эти многоклеточные ассоциации формируются и развиваются только в присутствие эритропоэтина (ЭПО) [5, 6]. Ранее в нашей лаборатории было установлено, что в регуляции функций центрального звена эритрона большую роль играют механизмы положительной и отрицательной обратной связи [7]. Добавление к культивируемым ЭО небольшого количества молодых эритроцитов (ретикулоцитов) приводило к усилению эффекта экзогенного ЭПО и стимулировало процесс формирования ЭО de novo (положительная обратная связь). В то же время присутствие в культуре ЭО избыточного количества молодых или зрелых эритроцитов (эритроциты крыс с посттрансфузионной полицитемией) угнетало развитие эритроидных клеток в ЭО и подавляло процесс новообразования островков (отрицательная обратная связь). Также были получены данные о том, что культивационная среда культур ЭО, однократно стимулированных одинаковой дозой рекомбинантного ЭПО, не является однозначно активной по своим эритропоэтическим свойствам. Добавленная в виде супернатанта к другим культурам островков она может как стимулировать, так и угнетать эритропоэз, причем направленность эффекта зависит не только от возраста культуры ЭО, из которой был получен супернатант, но и от количества продуцируемых этой культурой ретикулоцитов [8].
Физиологический ход эритропоэза в ЭО характеризует постоянство количественного и качественного состава островков в единице объема кроветворной ткани. Однако дифференцировка и созревание эритроидных клеток в “короне” ЭО связаны не только с интенсивностью продукции почечного ЭПО (в системе in vivo) или количеством добавленного в культуру гормона (в системе in vitro), но и от функционального состояния самих клеток ЭО, в частности, от их способности синтезировать гемопоэтические цитокины.
В настоящей работе мы исследовали, как именно интенсивность синтеза ЭПО клетками ЭО зависит от числа и степени зрелости эритроцитов, окружающих развивающиеся островки, оценили непосредственный вклад тканевого ЭПО в реализацию механизмов положительной и отрицательной обратной связи, регулирующих эритропоэз. Для достижения поставленной цели нормально развивающиеся ЭО культивировали, искусственно увеличивая в их окружении количество эритроцитов разной степени зрелости, т.е. фактически в каждом отдельном культуральном сосуде создавали экспериментальные модели гипер- или гипорегенерации эритрона, оценивая при этом динамику концентрации ЭПО в культивационной среде.
МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнена на 30 белых беспородных крысах обоего пола массой 120–180 г, костный мозг которых использовался для культивирования, и 30 белых беспородных крысах массой 200–350 г, из крови которых получали эритроциты. Исследование проведено в соответствии с принципами Базельской декларации и рекомендациями о соблюдении биоэтических норм этического комитета ФГБОУ ВО “Южно-Уральский государственный медицинский университет” Минздрава России. Животные содержались в экспериментально-биологической клинике Южно-Уральского государственного медицинского университета в соответствии с правилами СП 2.2.1.3218 и Директивой 2010/63/EU по охране животных, используемых в научных целях. Все манипуляции с животными производили под эфирным наркозом, эвтаназию грызунов осуществляли путем цервикальной дислокации, также проводимой под эфирным наркозом.
ЭО выделяли из костного мозга бедренных костей здоровых интактных крыс и далее культивировали по методике, разработанной и используемой в нашей лаборатории [9, 10]. Костный мозг получали в результате промывания канала бедренной кости 1.5 мл препаративной среды, аналогичной по составу среде для культивирования, но без 2-меркаптоэтанола и эритропоэтина. В суспензии костного мозга, разведенной в 2 раза препаративной средой, с помощью камеры Горяева подсчитывали количество ЭО. Суспензию разливали в отдельные стерильные пластиковые чашки Петри диаметром 35 мм (Corning-Costar, США) из расчета 3500 ЭО/чашку. Для отделения взвеси костномозговых клеток чашки Петри на 30 мин помещали в мультигазовый инкубатор (МСО-18М, SANYO, Япония) при температуре 37°С, относительной влажности 95% и содержании СО2 4.5%. По окончании инкубации с помощью шприца монослой островков отмывали от неадгезировавшихся клеток, используя для этого среду RPMI-1640. Каждую чашку Петри с адгезировавшимися ЭО заполняли 3 мл культуральной среды. 100 мл готовой культуральной среды содержали: среду RPMI-1640 – 62 мл, эмбриональную телячью сыворотку – 30 мл, гепарина – 1.3 мл (6500 ЕД), бензилпенициллина калиевую соль – 1 мл (5000 ЕД), стрептомицина – 1 мл (5 мг), 2-меркаптоэтанола – 1 мл маточного раствора, L-глютамина – 1 мл (14.6 мг), бикарбоната натрия – 2.7 мл 7.5% раствора. Перед добавлением в чашки культуральную среду пропускали через стерильные шприцевые насадки с диаметром пор 0.22 мкм.
Перед началом культивирования в каждую чашку Петри вносили рекомбинантный ЭПО (Рекормон, Рош Диагностикс ГмбХ, Германия) в дозе 500 мЕ/мл, поскольку ранее было установлено, что именно эта доза ЭПО поддерживает эритропоэз в культуре ЭО на физиологическом уровне [11]. Культивирование ЭО производилось в мультигазовом инкубаторе при температуре 37°С, относительной влажности 95% и содержании СО2 4.5%.
Для моделирования в системе in vitro двух разных состояний периферического и центрального звеньев эритрона перед началом культивирования в опытные чашки Петри добавляли эритроциты разной степени зрелости.
Модель 1 – гиперрегенерация эритрона. Эритроцитарная взвесь, состоящая преимущественно из ретикулоцитов и молодых эритроцитов, была получена у крыс, которым внутрибрюшинно вводили солянокислый фенилгидразин в дозе 60 мг/кг. Кровь у этих анемизированных животных забирали на 5-е сутки после введения гемолитика, когда количество ретикулоцитов в их крови составляло не менее 65 × 109/л.
Модель 2 – гипорегенерация эритрона. Эритроцитарная взвесь, состоящая преимущественно из зрелых и старых эритроцитов, была получена у крыс с экспериментальной посттрансфузионной полицитемией, для создания которой животным-реципиентам внутрибрюшинно в объеме 7% от массы тела была произведена однократная трансфузия 80%-ной взвеси отмытых эритроцитов крыс-доноров. Кровь у этих полицитемичных крыс-реципиентов забирали на 5-сутки после трансфузии, когда количество ретикулоцитов в их крови не превышало 1 × 109/л.
Кровь забирали из задней полой вены и стабилизировали гепарином, после чего эритроциты трижды отмывали стерильным 9%-ным раствором NaCl. Все манипуляции производились в стерильных условиях. Отмытые эритроциты с помощью микродозатора вносили в культуральные сосуды с адгезированными ЭО из расчета 30, 60 или 120 клеток на 1 ЭО. Указанные дозы были выбраны неслучайно. В физиологических условиях в здоровом организме 1 ЭО за один свой цикл продуцирует примерно 30 эритроцитов, при компенсационном эритропоэзе (после кровопотери) – в 2 раза больше (60 эритроцитов). Доза 120 клеток/1 ЭО моделировала избыточное количество эритроцитов, находящееся в кровотоке при миелопролиферации эритроидного ростка кроветворения, например, при истинной полицитемии.
ЭО культивировали в течение 24, 48 или 72 ч. Контролем служили 24-, 48- и 72-часовые культуры ЭО без добавления эритроцитов. По окончании культивирования клетки фиксировали и окрашивали по Паппенгейму (фиксатор-краситель Май–Грюнвальда и краситель Романовского). Всего в работе было проанализировано 126 культур. Количество ЭО на поверхности чашек Петри подсчитывали по методу Автандилова с помощью морфометрической сетки. Содержание ЭПО в культуральной среде определяли методом двухсайтового твердофазного иммуноферментного анализа с помощью набора реактивов Biomerica EPO ELISA (Германия), включающего биотинилированные и конъюгированные с пероксидазой хрена мышиные моноклональные антитела к определенным участкам человеческого ЭПО. Поскольку в ходе эксперимента по мере созревания ЭО их число в культурах уменьшалось, нами было рассчитано удельное содержание ЭПО, т.е. количество мЕ ЭПО в пересчете на 1 ЭО (удельное содержание = количество ЭПО в 3 мл культуральной среды/число ЭО в культуре).
Статистическая обработка результатов исследований проводилась с использованием программы STATISTICA 6.0. Рассчитывали среднее значение (М), стандартную ошибку (m). Для проверки гипотезы о наличии или отсутствии различий между опытными и контрольными группами использовали непараметрический критерий интегральных различий Колмогорова–Смирнова. Различия считались достоверными при 95%-м уровне значимости (p < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При изучении динамики концентрации ЭПО в контрольных культурах были получены данные, аналогичные представленным ранее результатам [12]. Если перед началом культивирования содержание ЭПО в культуральной среде составляло 500 мЕ/мл, то через 24 ч данный показатель достоверно снизился более чем в 3 раза (табл. 1) за счет интенсивного связывания молекул гормона рецепторами эритроидных клеток островков. Через 48 ч концентрация гормона в культуральной среде возросла на 82% и сохранилась на этом уровне до 72 ч. Поскольку рекомбинантный ЭПО был добавлен в культуральную среду только в начале эксперимента, выявленный рост содержания гормона в ходе развития ЭО, несомненно, был обусловлен продукцией эндогенного ЭПО клетками островков.
Таблица 1.
Динамика концентрации эритропоэтина (ЭПО) в модели гиперрегенерации эритрона in vitro Table 1. Erythropoietin (EPO) concentration dynamics in an in vitro erythron hyperregeneration model
| Доза эритроцитов Red blood cell dose |
Количество ЭО в культуре The number of EI in culture |
Концентрация ЭПО (мЕ/мл) EPO concentration, (mU/ml) |
|---|---|---|
| 24 ч культивирования (24 h cultivation) | ||
| Контроль (The control) | 3173 ± 106 | 157 ± 11 |
| 30/1 ЭО (30/1 EI) | 3214 ± 76 | 213 ± 11* |
| 60/1 ЭО (60/1 EI) | 3255 ± 81 | 215 ± 32* |
| 120/1 ЭО (120/1 EI) | 2935 ± 93 | 185 ± 22 |
| 48 ч культивирования (48 h cultivation) | ||
| Контроль (The control) | 2293 ± 99 | 285 ± 15 |
| 30/1 ЭО (30/1 EI) | 2302 ± 87 | 288 ± 21 |
| 60/1 ЭО (60/1 EI) | 2101 ± 95 | 244 ± 22 |
| 120/1 ЭО (120/1 EI) | 2198 ± 92 | 215 ± 20* |
| 72 ч культивирования (72 h cultivation) | ||
| Контроль (The control) | 1619 ± 88 | 257 ± 30 |
| 30/1 ЭО (30/1 EI) | 1455 ± 70 | 220 ± 25 |
| 60/1 ЭО (60/1 EI) | 1523 ± 71 | 184 ± 15* |
| 120/1 ЭО (120/1 EI) | 1546 ± 86 | 196 ± 11* |
При добавлении в культуру ЭО ретикулоцитов/молодых эритроцитов (модель гиперрегенерации эритрона) в дозе 30 или 60 клеток/1 ЭО концентрация эритропоэтина в культуральной среде через 24 ч увеличилась на 37% по сравнению с контрольными культурами (табл. 1). Однако, когда количество внесенных в чашку Петри молодых эритроидных клеток в 4 раза (120 клеток/1 ЭО) превышало число эритроцитов, формируемых одним островком в физиологических условиях, концентрация ЭПО в культуральной среде через 24 ч не изменилась, а через 48 ч снизилась на 25%. К 72 ч достоверно меньше ЭПО регистрировалось не только в культурах, содержащих 120 клеток/1 ЭО, но и в культурах, к которым добавляли 60 клеток/1 ЭО. Таким образом, относительно небольшая ретикулоцитарная нагрузка на культуру (30 или 60 клеток/1 ЭО) к концу первых суток вызывала увеличение продукции ЭПО в островках. В то же время присутствие в культуре избыточного количества молодых эритроцитов/ретикулоцитов, так же как и увеличение длительности сокультивирования, приводили к снижению синтеза ЭПО клетками ЭО.
Присутствие в микроокружении ЭО зрелых эритроцитов (модель гипорегенерации эритрона) сопровождалось явным торможением эритропоэтиновой продуктивности клеток островков (табл. 2). Если через 24 ч синтез ЭПО оставался на исходном уровне, то к 48 ч содержание гормона в культуральной среде достоверно уменьшилось во всех сериях эксперимента: в культурах с малым количеством внесенных зрелых эритроцитов (30 клеток/1 ЭО) – на 18%, а в культурах с большой эритроцитарной нагрузкой – на 28%. В 72-часовых культурах, содержащих 30, 60 или 120 эритроцитов/1 ЭО, количество ЭПО оказалось меньше контрольных значений на 26, 40 и 53% соответственно. Таким образом, в присутствии зрелых эритроидных клеток, выделенных из крови полицитемичных животных, культивируемые ЭО снижали продукцию эндогенного ЭПО тем заметнее, чем больше эритроцитов их окружало.
Таблица 2.
Динамика концентрации эритропоэтина (ЭПО) в модели гипорегенерации эритрона in vitro Table 2. Erythropoietin (EPO) concentration dynamics in an in vitro erythron hyporegeneration model
| Доза эритроцитов (Red blood cell dose) |
Количество ЭО в культуре The number of EI in culture |
Концентрация ЭПО (мЕ/мл) EPO concentration, (mU/ml) |
|---|---|---|
| 24 ч культивирования (24 h cultivation) | ||
| Контроль (The control) | 3173 ± 106 | 157 ± 11 |
| 30/1 ЭО (30/1 EI) | 3157 ± 100 | 167 ± 19 |
| 60/1 ЭО (60/1 EI) | 3167 ± 101 | 166 ± 28 |
| 120/1 ЭО (120/1 EI) | 3111 ± 88 | 140 ± 20 |
| 48 ч культивирования (48 h cultivation) | ||
| Контроль (The control) | 2293 ± 99 | 285 ± 15 |
| 30/1 ЭО (30/1 EI) | 2228 ± 82 | 234 ± 23* |
| 60/1 ЭО (60/1 EI) | 2176 ± 86 | 206 ± 23* |
| 120/1 ЭО (120/1 EI) | 2236 ± 80 | 207 ± 20* |
| 72 ч культивирования (72 h cultivation) | ||
| Контроль (The control) | 1619 ± 88 | 257 ± 30 |
| 30/1 ЭО (30/1 EI) | 1556 ± 75 | 188 ± 21* |
| 60/1 ЭО (60/1 EI) | 1518 ± 73 | 154 ± 13* |
| 120/1 ЭО (120/1 EI) | 1424 ± 84 | 200 ± 14* |
Поскольку формирование ЭО происходит на основе контактов макрофагов с уже коммитированными клетками, островки фактически представляют собой конечную стадию в развитии центрального звена эритрона. Эритроидные клетки, теряя ядро, дифференцируются до состояния ретикулоцитов и деадгезируются. Если центральный макрофаг в этот момент не присоединяет к себе новую КОЕ-Э или проэритробласты, то этот ЭО прекращает свое существование. В условиях in vitro островки также созревают, и ассоциации клеток распадаются, поэтому число ЭО в культуре неуклонно уменьшается. По этой причине мы сочли целесообразным оценить удельное содержание ЭПО, то есть рассчитать, сколько мЕ ЭПО приходится на 1 ЭО.
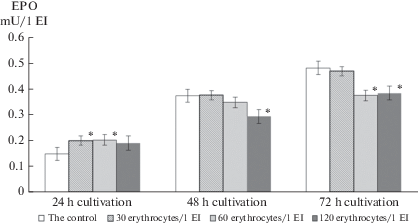
При анализе динамики удельного содержания ЭПО стало очевидным, что через 24 ч после внесения в культуру ретикулоцитов/молодых эритроцитов (модель гиперрегенерации эритрона) каждый ЭО начал продуцировать больше ЭПО, чем 1 островок контрольных культур (рис. 1). Через 48 ч продукция ЭПО в культурах, получивших 30 или 60 молодых эритроцитов/1 ЭО, была на уровне контрольных значений, но в культурах с избыточной эритроцитарной нагрузкой синтез ЭПО достоверно снизился. К 72 ч торможение синтеза ЭПО наблюдалось не только в указанной серии чашек Петри, но и в культурах, получивших по 60 эритроцитов/1 ЭО.
Рис. 1.
Удельное содержание эритропоэтина (мЕ/1 ЭО) в модели гиперрегенерации эритрона in vitro (*отмечено наличие достоверных различий между контрольными и опытными показателями, p < 0.05). Fig. 1. The specific content of erythropoietin (mU/1 EI) in an in vitro erythron hyporegeneration model (*the presence of significant differences between the control and experimental results, p < 0.05).
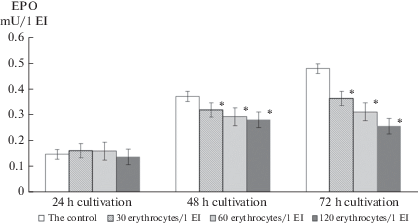
Островки, нагруженные эритроцитами полицитемичных животных (модель гипорегенерации эритрона), независимо от количества добавленных клеток достоверно снизили продукцию ЭПО через 48 ч культивирования (рис. 2). К 72 ч эксперимента наблюдалась отчетливая зависимость между удельным содержанием гормона и количеством добавленных в культуру клеток: чем больше зрелых эритроцитов находилось в культуре, тем меньше ЭПО синтезировал каждый островок.
Рис. 2.
Удельное содержание эритропоэтина (мЕ/1 ЭО) в модели гипорегенерации эритрона in vitro (*отмечено наличие достоверных различий между контрольными и опытными показателями, p < 0.05). Fig. 2. The specific content of erythropoietin (mU/1 EI) in an in vitro erythron hyporegeneration model (* the presence of significant differences between the control and experimental results, p < 0.05).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Несмотря на то, что ЭПО могут синтезировать и сами эритроидные клетки [13], несомненно, что в костном мозге основным источником этого гормона являются макрофаги, ЭПО-продуктивность которых была доказана многими авторами [14–16]. Rich с соавт. [14] обнаружил, что в супернатантах первичных культур эмбриональных печеночных макрофагов мыши в первые 7 сут. заметно нарастает продукция ЭПО: общая эритропоэтическая активность клеток каждые сутки увеличивалась на 25 мЕ/мл культуральной среды. Присутствие в макрофагальном микроокружении других клеток, например, апоптотических нейтрофилов, в условиях in vitro стимулировало продукцию ЭПО в 2–11 раз [17].
Способность клеток ЭО секретировать ЭПО имеет большое значение для поддержания костномозгового эритропоэза после кровопотери и при некоторых гематологических заболеваниях. Увеличение функциональной активности центральных макрофагов ЭО (повышение их эритропоэтических и фагоцитарных свойств, усиление способности формировать гемопоэтическое микроокружение) [18] обеспечивает высокий темп пролиферации и дифференцировки эритроидных клеток как в условиях in vivo (в поздние сроки после кровопотери), так и в услових in vitro (при длительном культивировании ЭО). По всей видимости, эти же механизмы поддерживают эритропоэз при эритропоэтиндефицитной анемии и при анемии, сопровождающей многие онкологические процессы, поскольку в указанных случаях наблюдается чрезвычайно низкая продукция почечного ЭПО, неадекватная тяжести анемического синдрома [19].
Наши исследования показали, что продукция ЭПО культурой ЭО зависит от количества и степени зрелости эритроцитов, находящихся в окружении островков, а также от длительности их совместного культивирования. Небольшие дозы (30 или 60 клеток/1 ЭО) молодых эритроцитов/ретикулоцитов стимулируют синтез эндогенного ЭПО, что доказывается увеличением концентрации гормона в культуральной среде, особенно через 24 ч эксперимента. Дальнейшее увеличение числа внесенных в культуру клеток, а также увеличение длительности контакта молодых эритроцитов/ретикулоцитов с ЭО приводит к достоверному снижению продукции ЭПО клетками ЭО. Эритроциты полицитемичных крыс тормозят продукцию ЭПО клетками островков, и этот эффект усиливается пропорционально количеству зрелых эритроцитов в культуре.
Ранее нами была высказана гипотеза о существовании механизмов положительной и отрицательной обратной связи в регуляции эритропоэза. Эта гипотеза основана на выявленной способности молодых эритроцитов/ретикулоцитов ускорять формирование новых ЭО, а зрелых и старых – подавлять процесс присоединения колониеобразующих единиц эритроцитарных (КОЕ-Э) к центральным макрофагам ЭО [7]. До недавнего времени было неясно, с чем связаны такие функциональные различия между клетками, по сути являющимися одними и теми же представителями заключительной стадии развития эритроидного ряда. Однако после открытия механизма экзосомного транспорта стало очевидно, что они по-разному могут участвовать в информационном межклеточном обмене [20]. Экзосомы ретикулоцитов содержат регуляторные не кодирующие белок молекулы – микроРНК, среди которых находится микроРНК-451. Вероятно, именно с этой микроРНК связан стимулирующий эритропоэз эффект, возникающий при добавлении ретикулоцитов в культуру ЭО. Показано, что в процессе дифференцировки CD34+ клеток уровень экспрессии данной микроРНК в развивающихся эритроидных клетках к 7-м суткам культивирования увеличивался в 3 раза, а к 21-м суткам – в 35 раз по сравнению с исходными значениями [21]. Кроме того, доказана связь экспрессии микроРНК-451 с продукцией макрофагальными клетками интерлейкина-6 [22], который стимулирует пролиферацию эритроидных клеток-предшественниц и усиливает адгезивные свойства центральных макрофагов в ЭО.
В экзосомах зрелых эритроцитов были обнаружены микроРНК, имеющие отношение к процессу торможения эритропоэза: микроРНК-221 и микроРНК-222 [23]. В физиологических условиях эти микромолекулы подавляют пролиферацию и дифференцировку эритроидных клеток-предшественниц, одновременно ускоряя созревание эритробластов [24]. Кроме того, экзосомы зрелых эритроцитов индуцируют секрецию фактора некроза опухоли-альфа (ФНО-α) в клетках моноцитарного ряда [25], что, несомненно, может иметь место и в костномозговых макрофагах, формирующих вокруг себя эритроидную “корону”. Роль ФНО-α в регуляции эритропоэза доказана достаточно давно: связывание этого цитокина со специфическим рецептором на молодых эритроидных клетках приводит к торможению их выхода из фазы G0 в S-фазу клеточного цикла [26], а увеличение концентрации ФНО-α тормозит эритропоэз в культуре ЭО [27].
Не исключено также, что микроРНК ретикулоцитов и зрелых эритроцитов модулируют функциональные (в том числе и эритропоэтические) свойства макрофагальных и эритроидных клеток ЭО не напрямую, а опосредованно через лимфоциты, входящие в состав островков [20, 28]. В частности, было показано, что РНК лимфоидных клеток здоровых доноров и больных истинной полицитемией стимулирует эритропоэз в культурах ЭО костного мозга интактных крыс и крыс с угнетенным красным ростком кроветворения [29].
Таким образом, в настоящей работе мы установили, что локальная регуляция эритропоэза напрямую связана с синтезом тканевого ЭПО в ЭО и зависит от количества и степени зрелости эритроцитов, продуцируемых красным костным мозгом. Полученные результаты позволяют утверждать, что именно тканевой, локально синтезирующийся в эритроидной ткани ЭПО, является важнейшим звеном в реализации механизмов обратной связи, обеспечивающих адекватный ответ центрального звена эритрона на кислородный запрос в физиологических условиях и поддерживающих эритропоэз при патологических состояниях, сопровождающихся недостаточной продукцией эритропоэтина в почках.
Список литературы
Chasis J.A., Mohandas N. Erythroblastic islands: niches for erythropoiesis. Blood. 112(3): 470–478. 2008.
Hom J., Dulmovits B.M., Mohandas N., Blanc L. The erythroblastic island as an emerging paradigm in the anemia of inflammation. Immunol. Res. 63(1–3): 75–89. 2015.
Yeo J.H., Cosgriff M.P., Fraser S.T. Analyzing the formation, morphology, and integrity of erythroblastic islands. Methods Mol. Biol. 1698: 133–152. 2018.
Elvarsdottir E.M., Mortera-Blanco T., Dimitriou M., Bouderlique T., Jansson M., Hofman I.J.F., Conte S., Karimi M., Sander B., Douagi I., Woll P.S., Hellstrцm-Lindberg E. A three-dimensional in vitro model of erythropoiesis recapitulates erythroid failure in myelodysplastic syndromes. Leukemia. 34(1): 271–282. 2020.
Тишевская Н.В., Шевяков С.А., Захаров Ю.М. Влияние эритропоэтина и макрофагального колониестимулирующего фактора на пролиферативную активность эритроидных клеток в культурах эритробластических островков. Мед. акад. журн. 3(3): 67–72. 2003. [Tishevskaya N.V., Shevyakov S.A., Zakharov Yu.M. The effect of erythropoietin and macrophage colony stimulating factor on the proliferative activity of erythroid cells in cultures of erythroblastic islets. Med. akad. zhurn. 3(3): 67–72. 2003. (In Russ)].
Eggold J.T., Rankin E.B. Erythropoiesis, EPO, macrophages, and bone. Bone. 119: 36–41. 2019.
Захаров Ю.М., Шевяков С.А. Влияние эритроцитов разной степени зрелости на пролиферативную активность эритроидных клеток “короны” эритробластических островков. Рос. физиол. журн. им. Сеченова. 90(7): 874–881. 2004. [Zakharov Yu.M., Shevyakov S.A. The influences of various stage maturity of erythrocytes on proliferation rate of erythroid cells in “crown” of erythroblastic islands. Russ. J. Physiol. 90(7): 874–881. 2004. (In Russ)].
Шевяков С.А., Захаров Ю.М. Влияние супернатанта культур эритробластических островков костного мозга на эритропоэз in vitro. Рос. физиол. журн. им. И.М. Сеченова. 98(9): 1140–1148. 2012. [Shevyakov S.A., Zakharov Yu.M. Effect of supernatant of erythroblastic island bone marrow cultures on erythropoiesis in vitro. Russ. J. Physiol. 98(9): 1140–1148. 2012. (In Russ)].
Tishevskaya N.V., Zakharov Yu.M., Golubotovskii E.V., Kolesnikov O.L., Trofimova N.V., Arkhipenko Yu.V., Sazontova T.G. Effects of fullerenol C60(OH)24 on erythropoiesis in vitro. Bull. Exp. Biol. Med. 157(1): 49–51. 2014.
Волчегорский И.А., Тишевская Н.В., Кузнецов Д.А. Влияние “средних молекул”, выделенных из плазмы крови интактных и обожженных животных, на клеточный состав культур эритробластических островков костного мозга. Вестник Рос. академии мед. наук. 2: 30–36. 2002. [Volchegorsky I.A., Tishevskaya N.V., Kuznetsov D.A. Influence of “middle molecules”, separated from the blood plasma of intact and burned animals, on the cell composition of cultures of erythroblastic islands of bone marrow. Ann. Russ. Acad. Med. Sci. 2: 30–36. 2002. (In Russ)].
Тишевская Н.В., Болотов А.А., Захаров Ю.М. Математическое моделирование межклеточных взаимодействий в культуре эритробластических островков. Мед. акад. журн. 5(4): 50–59. 2005. [Tishevskaya N.V., Bolotov A.A., Zakharov Yu.M. Mathematical modeling of intercellular interactions in the culture of erythroblastic islets. Med. Akad. zhurn. 5(4): 50–59. 2005. (In Russ)].
Шевяков С.А., Захаров Ю.М. Исследование динамики концентрации эритропоэтина в культурах эритробластических островков. Рос. физиол. журн. им. И.М. Сеченова. 95(11): 1207–1215. 2009. [Shevyakov S.A., Zakharov Yu.M. The investigation of dynamic changes of erythropoietin content of the erythroblast island cultures. Russ. J. Physiol. 95(11): 1207–1215. 2009. (In Russ.)]
Sato T., Maekawa T., Watanabe S., Tsuji K., Nakahata T. Erythroid progenitors differentiate and mature in response to endogenous erythropoietin. J. Clin. Invest. 106(2): 263–270. 2000.
Rich I.N., Heit W., Kubanek B. Extrarenal erythropoietin production by macrophages. Blood. 60(4): 1007–1018. 1982.
Ohls R.K., Li Y., Trautman M.S., Christensen R.D. Erythropoietin production by macrophages from preterm infants: implications regarding the cause of the anemia of prematurity. Ped. Res. 35(2): 169–170. 1994.
Chernykh E.R., Shevela E.Y., Sakhno L.V., Tikhonova M.A., Petrovsky Y.L., Ostanin A.A. The generation and properties of human M2-like macrophages: potential candidates for CNS repair? Cell. Therapy Transplant. 2(6): 1–7. 2010.
Sakhno L.V., Shevela E.Y., Ostanin A.A., Chernykh E.R., Lykov A.P., Poveshchenko O.V. Effect of apoptotic neutrophils on the production of erythropoietin, MMP-9, and TIMP-1 in cultures of human macrophages. Bull. Exp. Biol. Med. 167(6): 755–758. 2019.
Тишевская Н.В., Шевяков С.А., Захаров Ю.М. Влияние гуморальных факторов на фагоцитарную активность центральных макрофагов в культуре эритробластических островков. Рос. физиол. журн. им. И.М. Сеченова. 88(9): 1191–1198. 2002. [Tishevskaya N.V., Shevyakov S.A., Zakharov Yu.M. The effect of humoral factors on phagocytic activity of central macrophages in the erythroblast islet culture. Russ. J. Physiol. 88(9): 1191–1198. 2002. 2009. (In Russ)].
Means R.T. Recent development in the anemia of chronic disease. Curr. Haematol. Rep. 2(2): 116–121. 2003.
Тишевская Н.В., Геворкян Н.М., Козлова Н.И. Современный взгляд на роль Т-лимфоцитов в регуляции эритропоэза. Успехи соврем. биологии. 136(1): 83–96. 2016. [Tishevskaya N.V., Gevorkyan N.M., Kozlova N.I. A modern view of the role of T-lymphocytes in regulation of erythropoiesis. Uspekhi Sovrem. Biologii. 136 (1): 83–96. 2016. (In Russ)].
Merkerova M., Belickova M., Bruchova H. Differential expression of microRNAs in hematopoietic cell lineages. Eur. J. Haematol. 81(4): 30–43. 2008.
Okamoto M., Fukushima Y., Kouwaki T., Daito T., Kohara M., Kida H., Oshiumi H. MicroRNA-451a in extracellular, blood-resident vesicles attenuates macrophage and dendritic cell responses to influenza whole-virus vaccine. J. Biol. Chem. 293(48): 18585–18600. 2018.
Sangokoya C., LaMonte G., Chi J.T. Isolation and characterization of microRNAs of human mature erythrocytes. Methods Mol. Biol. 667: 193–203. 2010.
Felli N., Fontana L., Pelosi E., Botta R., Bonci D., Facchiano F., Liuzzi F., Lulli V., Morsilli O., Santoro S., Valtieri M., Calin G., Liu C., Sorrentino A., Croce C., Peschle C. MicroRNAs 221 and 222 inhibit normal erythropoiesis and erythroleukemic cell growth via kit receptor down-modulation. Proc. Natl. Acad. Sci. USA. 102(50): 18081–18086. 2005.
Danesh A., Inglis H.C., Jackman R.P., Wu S., Deng X., Muench M.O., Heitman J., Norris P. Exosomes from red blood cell units bind to monocytes and induce proinflammatory cytokines, boosting T-cell responses in vitro. Blood. 123(5): 687–696. 2014.
Zhang X. Harada A., Bluethmann H. Tumor necrosis factor is a physiologic regulator of hematopoietic progenitor cells. Blood. 86(8): 2930–2938. 1995.
Шевяков С.А., Захаров Ю.М. Исследование роли фактора некроза опухоли-альфа в регуляции эритропоэза в культуре эритробластических островков. Рос. физиол. журн. им. Сеченова. 99(8): 993–1001. 2013. [Shevyakov S.A., Zakharov Yu.M. Studying of the role of tumor necrosis factor-alpha in regulation of erythropoiesis in erythroblastic islands cultures. Russ. J. Physiol. 99(8): 993–1001. 2013. (In Russ)].
Тишевская Н.В., Геворкян Н.М., Козлова Н.И. Роль Т-лимфоцитов в гормональной регуляции морфогенетических процессов. Успехи соврем. биологии. 135(2): 189–202. 2015. [Tishevskaya N.V., Gevorkyan N.M., Kozlova N.I. The role of T-lymphocytes in hormonal regulation of morphogenetic processes. Uspekhi Sovrem. Biologii. 135(2): 189–202. 2015. (In Russ)].
Бабаева А.Г., Геворкян Н.М., Тишевская Н.В., Головкина Л.Л., Муратова И.А., Рагимов А.А. О стимулирующих эритропоэз свойствах суммарной РНК лимфоцитов периферической крови при эритремии. Клин. и эксперим. морфология. 1(13): 33–37. 2015. [Babaeva A.G., Gevorkyan N.M., Tishevskaya N.V., Golovkina L.L., Muratova I.A., Ragimov A.A. Erythropoiesis-stimulating properties of total RNA from peripheral blood lymphocytes during erythremia. Klin. and Eksperim. morfologiya. 1(13): 33–37. 2015. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


