Российский физиологический журнал им. И.М. Сеченова, 2020, T. 106, № 9, стр. 1059-1068
Регенерация нервных волокон седалищного нерва крысы после повреждения и введения мезенхимных стволовых клеток
Е. С. Петрова 1, *, Е. А. Колос 1
1 Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: iempes@yandex.ru
Поступила в редакцию 11.03.2020
После доработки 18.04.2020
Принята к публикации 20.04.2020
Аннотация
В экспериментальных исследованиях, посвященных поиску способов стимуляции регенерации поврежденных нервных проводников, часто используются мезенхимные стволовые клетки (МСК). Целью настоящей работы явилось изучение влияния субпериневрального введения МСК на регенерирующие волокна поврежденного седалищного нерва крысы с использованием иммуногистохимического выявления периферина. Была проведена трансплантация суспензии МСК костного мозга крыс Вистар–Киото (5 × 104 клеток в 5 мкл среды) в поврежденный путем наложения лигатуры (40 с) седалищный нерв взрослых животных. Контрольной группе животных после наложения лигатуры субпериневрально вводили 5 мкл среды. Через 2 мес. после операции на поперечных срезах, проходящих через дистальный сегмент нерва реципиента, проводили подсчет и измерение периферин-иммунопозитивных регенерирующих нервных волокон. Морфометрический анализ регенерирующих волокон, выполненный с помощью программы ImageJ (NIH, США), показал, что средняя толщина нервных волокон у животных подопытной группы достоверно увеличивалась по сравнению с контролем. Изучение распределения нервных волокон дистального сегмента поврежденного нерва по толщине показало, что у животных, получивших однократную трансплантацию МСК, процентное содержание волокон бóльшего диаметра выше, чем у животных контрольной группы.
Актуальность проблемы восстановления периферических нервных проводников связана с высокой частотой их травмирования в результате переломов и ушибов и недостатком фундаментальных знаний о молекулярной регуляции процессов дегенерации и регенерации нервов. Применение современных хирургических подходов к восстановлению поврежденного нерва таких, как нейропластика и совершенствование шовной техники, не всегда приводит к восстановлению функций нервного проводника. В настоящее время разрабатываются новые способы восстановления нервных проводников с помощью создания специальных конструкций – кондуитов, соединяющих проксимальный и дистальный сегменты поврежденного периферического нерва [1–4]. Ведется разработка синтетических и натуральных материалов для создания таких кондуитов и их наполнителей, имитирующих структуру эндоневрия. Следует отметить, что в хирургической практике, по-прежнему, оптимальным методом для соединения дистального и проксимального концов поврежденного проводника является использование аутотрансплантации сегмента нерва. Это связано с тем, что микроокружение нервных волокон должно содержать необходимые для осуществления регенерации аксонов сигнальные молекулы, факторы роста и белки экстрацеллюлярного матрикса. С целью создания такого микроокружения для регенерирующих аксонов периферических нервных проводников в экспериментальных исследованиях наряду с нейропластикой и использованием специальных кондуитов активно применяется клеточная и генная терапия [3, 5–10]. В качестве клеточной терапии наиболее часто используют мезенхимные стволовые клетки (МСК). МСК – мультипотентные клетки, вырабатывающие большое число ростовых и трофических факторов, обладающие способностью модулировать иммунные процессы и влиять на репаративные процессы в различных тканях и органах [11, 12].
В течение последних двадцати лет было выполнено множество экспериментальных исследований с применением МСК для стимуляции регенерации периферических нервных проводников, в большинстве случаев отмечено благоприятное воздействие клеточной терапии c применением МСК на восстановление нерва в эксперименте, результаты этих исследований обобщены в ряде обзоров [7, 10, 13]. Однако механизмы влияния экзогенных МСК на восстановление поврежденных нервов до сих пор неясны. Эффект клеточной терапии зависит от многих факторов: от источника получения МСК (из жировой ткани, костного мозга, пупочного канатика, амниотической жидкости и др.), от способа введения клеток в организм реципиента (в кровоток, в кондуит, соединяющий проксимальный и дистальный сегменты поврежденного нервного проводника, непосредственно в нервный ствол), от количества пересаженных клеток. Для изучения влияния экзогенных МСК на репаративные процессы в нерве реципиента применяют различные модели повреждения (перерезка с последующим сшиванием или соединением с помощью биологического или искусственного кондуита, передавливание зажимом и др.). В настоящем исследовании использована модель повреждения нервного проводника путем наложения лигатуры в течение времени, достаточного для того, чтобы вследствие такой травмы в дистальном сегменте начались процессы валлеровской дегенерации с последующей регенерацией волокон. Это удобная модель, позволяющая изучать регенерацию нервных волокон как после травмы, так и после применения клеточной терапии [14]. Она позволяет решать такие фундаментальные вопросы, как изучение судьбы пересаженных в поврежденный нервный ствол клеток, взаимоотношения МСК с клетками реципиента, их влияние на изменение васкуляризации нерва реципиента и другие [15, 16].
Наше предыдущее исследование было посвящено изучению судьбы пересаженных в поврежденный нерв крыс Вистар–Киото МСК костного мозга крыс той же линии [15]. Было показано, что меченные бромдезоксиуридином МСК идентифицируются в нервном стволе, а также оболочках нерва реципиента, в течение 7 сут после пересадки [15]. Целью настоящей работы явилось изучение влияния субпериневрального введения МСК на регенерирующие волокна передавленного седалищного нерва крысы с использованием иммуногистохимического выявления периферина.
МЕТОДЫ ИССЛЕДОВАНИЯ
В исследовании использовали крыс линии Вистар–Киото массой 200–250 г (n = 36; по 12 животных на группу). При работе с животными руководствовались международными правилами Европейского сообщества по гуманному обращению с экспериментальными животными и “Правилами проведения исследований с использованием экспериментальных животных” (Приказ № 755 от 12.08.1977, Министерство Здравоохранение РФ). Исследование было одобрено этическим комитетом Федерального государственного бюджетного научного учреждения “Институт экспериментальной медицины” (протокол № 3/17 от 30.11.2017).
Повреждение седалищных нервов крыс и трансплантацию МСК осуществляли, используя микроскоп МБС-2 (ЛОМО, Россия) по методу, описанному в предыдущих исследованиях [14, 15]. Под эфирным наркозом проводили операцию: на уровне верхней трети бедра крысы после эпиляции делали разрез кожи размером 1–1.5 см, рассекали подлежащие мышцы и фиксировали седалищный нерв на стеклянной палочке, затем накладывали лигатуру в течение 40 с. Подопытной группе животных под периневрий одного из нервных стволов седалищного нерва вводили суспензию МСК (5 × 104 в 5 мкл культуральной среды). Животным контрольной группы вводили культуральную среду в том же объеме. МСК костного мозга крыс Вистар–Киото были получены в ООО Транс-Технологии (ген. директор к. б. н. Д.Г. Полынцев). Характеристика используемых для трансплантации МСК подробно представлена в работе Зиньковой и соавт. [17]. МСК выделяли из костного мозга бедренной кости крыс Вистар–Киото и культивировали в стандартных условиях. Проведенное фенотипирование показало, что 97% клеточной суспензии экспрессируют на поверхности CD90+. Продемонстрировано, что клетки сохраняют способность к дифференцировке в нескольких направлениях в определенных условиях in vitro [17]. Используемые для трансплантации клетки в культуре обладают свойством адгезивности, имеют характерную для МСК фибробластоподобную форму и экспрессируют виментин [15].
Животных содержали в стандартных условиях вивария без ограничения доступа к воде и пище. Через 2 мес. после операции животных умерщвляли передозировкой паров этилового эфира; дистальнее места наложения лигатуры выделяли сегменты нерва размером 3–4 мм и фиксировали в растворе цинк-этанол-формальдегида [18]. Фиксация осуществлялась в течение 24 ч, затем материал обезвоживали в спиртах возрастающей концентрации и ксилоле и заливали в парафин. Поперечные срезы седалищных нервов толщиной 5 мкм изготавливались на ротационном микротоме фирмы Pfm Rotary 3003 (PFM, Германия). Для идентификации нервных волокон проводили иммуногистохимическую реакцию на периферин. Периферин – белок промежуточных филаментов, маркер периферических нервных аксонов [19]. Первичные антитела наносили на депарафинированные срезы. В качестве первичных антител использовали кроличьи поликлональные антитела к периферину (Abcam, Великобритания). В качестве вторичных антител применяли реагенты из набора Reveal Polyvalent HRP/DAB Detection System kit (SpringBioscience, США). Визуализацию продукта иммуногистохимической реакции проводили при помощи диаминобензидинового хромогена (DAB+) (Agilent, США; ранее Dako, Дания). После проведения реакций часть срезов подкрашивали астровым синим для обзорного гистологического анализа препаратов. Для проведения морфометрического анализа с применением программы ImageJ использовали только неподкрашенные срезы.
Гистологические препараты анализировали с использованием светового микроскопа Leica DM750 (Германия) и цифровой фотокамеры ICC50 (Leica, Германия). Для обработки изображений использовалось программное обеспечение LAS EZ (Leica, Германия). Измерение количества и площади регенерирующих аксонов осуществляли на поперечных срезах через нерв, используя программу ImageJ (NIH, США). Подсчет нервных волокон проводили на 2–3 изображениях площадью 82365.2 мкм2, выполненных при увеличении микроскопа ×400, с последующим пересчетом на 1 мм2. Сравнительные исследования проводили между двумя группами животных: 1. интактные крысы и крысы с лигатурой; 2. крысы с лигатурой и крысы с лигатурой и введением МСК. Данные гистограмм приведены как среднее значение в группе со стандартным отклонением. Различия определяли по t-критерию при p < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование поперечных срезов через интактный седалищный нерв крысы подтвердило, что периферин является селективным маркером периферических нервных волокон и четко визуализируется в их осевых цилиндрах (рис. 1). Периферин – белок промежуточных филаментов с молекулярной массой 57 кД, который наряду с тубулином и актином участвует в процессе элонгации нервных волокон в поврежденных нервных стволах и применяется для исследования структур периферической нервной системы [19, 20]. Шванновские клетки (нейролеммоциты) и другие структурные элементы нерва (клетки эндоневрия, кровеносных сосудов, периневральной и эпиневральной оболочек) при этом не окрашиваются. Это дает возможность проводить подсчет нервных волокон на единицу площади нервного ствола, используя программ ImageJ (NIH, США). Применение иммуногистохимической реакции на периферин позволяет на поперечных срезах через нерв идентифицировать нервные волокна с диаметром менее 1 мкм. Оказалось, что в наиболее крупном стволе интактного седалищного нерва крысы количество периферин-содержащих нервных волокон составляет приблизительно 8000 волокон на 1 мм2. Большинство этих волокон имеет диаметр от 2 до 8 мкм.
Рис. 1.
Фрагменты поперечных срезов через седалищный нерв крыс. A – интактный нерв; B – дистальный сегмент регенерирующего нерва через 2 мес. после наложения лигатуры; C – дистальный конец через 2 мес. после наложения лигатуры и введения МСК. Иммуногистохимическая реакция на периферин, подкраска астровым синим (A), без подкраски (B, C). Масштабный отрезок равен 50 мкм. Fig. 1. Fragments of transverse sections through the sciatic nerve of rats. A – intact nerve; B – the distal segment of the nerve 2 months after the ligature; C – the distal segment of the nerve 2 months after ligature and MSC transplantation. Immunohistochemical reaction to peripherin, astro-blue staining (A), without astro-blue staining (B, C). Scale, 50 µm.
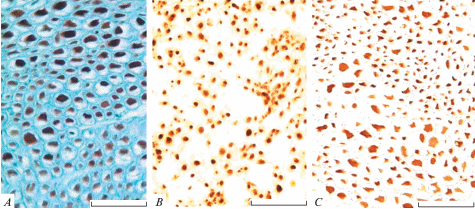
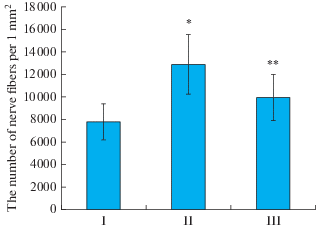
Анализ распределения регенерирующих аксонов показал, что в изученный срок (2 мес.) число волокон на единицу площади у животных с наложением лигатуры увеличивается по сравнению с интактным нервом (рис. 2) и достигает почти 13 000 волокон на 1 мм2. Увеличение нервных волокон в дистальном сегменте нерва после повреждения является характерной особенностью регенерирующего нерва: в месте повреждения нервные волокна подвергаются разветвлению [21, 22]. Затем мы провели анализ числа регенерирующих нервных волокон у животных контрольной (лигатура) и подопытной (лигатура и введение МСК) группы, оказалось, что у них этот показатель достоверно не отличается (рис. 2).
Рис. 2.
Изменение числа нервных волокон на единицу площади в седалищном нерве крысы. По оси ординат – число нервных волокон на 1 мм2. I – интактный нерв; II – лигатура; III – лигатура и введение МСК. *p I и II < 0.05; **p II и III > 0.05. Fig. 2. The change in the density of the rat sciatic nerve fibers. The ordinate – the number of nerve fibers per 1 mm2. I – intact nerve; II – ligature; III – ligature and the introduction of MSCs. *p I, II < 0.05; **p II, III > 0.05.
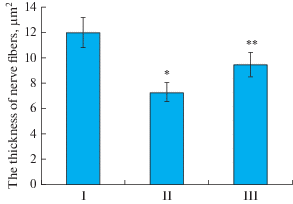
При этом была выявлена значимая разница средней толщины регенерирующих волокон у животных контрольной и подопытной групп (рис. 3).
Рис. 3.
Изменение средней толщины нервных волокон в седалищном нерве крысы. По оси ординат – средняя площадь сечения нервных волокон (мкм2). I – интактный нерв; II – лигатура; III – лигатура и введение МСК. *p I и II < 0.05 ; **p II и III < 0.05. Fig. 3. Change in the average thickness of rat sciatic nerve fibers. The ordinate – the average cross-sectional area of nerve fibers (μm2). I – intact nerve; II – ligature; III – ligature and the transplantation of MSCs. * p I, II < 0.05; ** p II, III < 0.05.
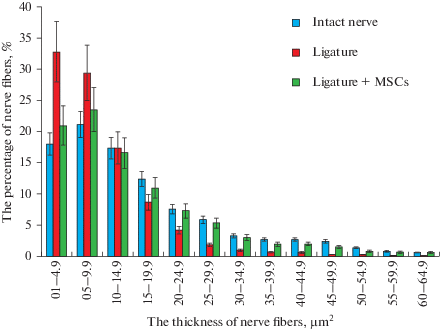
В связи с этим было проведено исследование распределения волокон с разной площадью сечения, то есть с разной толщиной. Гистограмма распределения (рис. 4) нервных волокон по размерам демонстрирует, что процент аксонов с площадью более 20 мкм2 (т.е. с диаметром более 5 мкм) заметно увеличивается в подопытной группе. Таким образом, показано, что применение клеточной терапии МСК приводит к увеличению количества более толстых аксонов в нерве реципиента.
Рис. 4.
Распределение нервных волокон по толщине в интактном седалищном нерве крысы (синие столбики), в нерве после наложения лигатуры (красные столбики) и после лигатуры и введения МСК (зеленые столбики). По оси ординат – доля нервных волокон в %, по оси абсцисс – интервал толщины (площадь сечения) нервных волокон (мкм2). Fig. 4. The distribution of nerve fibers thickness for the intact sciatic nerve of the rat (blue bars), for the nerve after ligature (red bars) and after ligature and MSC (green bars). The ordinate – the percentage of nerve fibers, %, the abscissa – the thickness interval (cross-sectional area) of nerve fibers (μm2).
Несмотря на то, что исследования по разработке терапии поврежденных нервных проводников с помощью применения МСК ведутся с 2001 г. [23], относительно механизмов влияния МСК на регенерацию нерва, по-прежнему, нет ясности. Авторы пионерских исследований в этом направлении предполагали, что экзогенные МСК способны дифференцироваться в нейролеммоциты (шванновские клетки) и участвовать в миелинизации регенерирующих аксонов. Позднее было показано, что МСК обретают способность дифференцироваться в шванновские клетки только после их предифференцировки в условиях in vitro с использованием специальных индукторов [7]. Были разработаны специальные протоколы с использованием ряда индукторов и регуляторов дифференцировки клеток в направлении ШК [23]. В последние годы более вероятным механизмом влияния МСК на репаративные процессы считается выработка и секреция ими ростовых и ангиогенных факторов, цитокинов, белков экстрацеллюлярного матрикса, необходимых для регенерации нервных проводников [3, 5, 7, 10].
В некоторых экспериментальных работах [24] показано, что число выживших после введения в организм реципиента МСК невелико. После трансплантации МСК костного мозга в поврежденный нерв крысы также отмечается, что лишь часть пересаженных клеток сохраняет жизнеспособность и идентифицируется в тканях реципиента в течение недели [15]. Есть данные, полученные на модели введения МСК крысам с острым респираторным дистресс-синдромом, о том, что экзогенные МСК подвергаются гибели по механизмам аутофагии и апоптоза [24]. В связи с этим в последние годы в исследованиях в области регенеративной медицины основное внимание уделяется влиянию пересаженных стволовых клеток на эндогенные клетки реципиента и их репаративные потенции. Одним из механизмов такого влияния считается способность МСК обмениваться с клетками реципиента внеклеточными микровезикулами [25] или непосредственно органеллами, например, митохондриями [26]. Есть мнение, что применение самих везикул или их содержимого может быть использовано в качестве терапии [27, 28], причем с меньшими рисками, чем введение самих МСК. На экспериментальных моделях повреждения легких [29] и ишемии задних конечностей [30] показано, что введенные в организм крысы-реципиента МСК оказывают влияние на макрофаги реципиента, на их фенотипические характристики и функции. Описанные наблюдения свидетельствуют о том, что для стимуляции репаративных процессов в тканях и органах реципиента может быть достаточно даже непродолжительного периода времени выживания МСК после операции. Способность МСК влиять на функции макрофагов реципиента [29] позволяет предположить, что клеточная терапия может изменять процессы валлеровской дегенерации в нерве в ранние сроки после операции.
В настоящем исследовании была использована стандартизированная модель регенерации нерва после нанесения травмы путем наложения лигатуры в течение 40 с [14]. Применение иммуногистохимического выявления периферина в осевых цилиндрах нервных волокон позволило провести морфологическую оценку степени восстановления волокон, выяснить особенности влияния на этот процесс клеточной терапии с применением МСК. Полученные данные имеют не только практическую значимость, но и важное теоретическое значение для нейрофизиологии. Травма нервных проводников приводит к изменению структуры самого нерва, гибели части нейронов спинного мозга и спинномозгового ганглия, нарушению иннервации органов-мишеней, приводящей к их атрофии [3, 21, 22]. Для предотвращения этих нарушений необходима разработка методов, влияющих на скорость регенерации аксонов. В настоящей работе установлено, что однократное введение МСК в поврежденный нерв способствует увеличению доли толстых волокон в дистальном конце травмированного нерва.
Относительно объяснения полученного факта можно высказать два предположения. Первое касается особенностей восстановления и роста регенерирующих нервных волокон после травмы периферических нервных проводников. Известно, что после травмы нервного ствола в его дистальном сегменте происходит валлеровская дегенерация, почти одновременно начинают расти на периферию тонкие регенерирующие аксоны. По мере роста их толщина увеличивается, часть из них подвергается миелинизации. Мы полагаем, что пересаженные в поврежденный нерв мезенхимные стволовые клетки, вырабатывая нейротрофические и ростовые факторы, создают благоприятное микроокружение для регенерации нервных волокон и могут ускорять репаративные процессы в нерве – такие, как рост регенерирующих аксонов, увеличение их калибра, их миелинизацию. Без дополнительных исследований структурных изменений, происходящих в ранние сроки после наложения лигатуры и введения МСК, мы не можем исключить второе предположение. Благодаря паракринному влиянию на эндогенные клетки нерва реципиента (нейролеммоциты, фибробласты, клетки периневрия, клетки стенок кровеносных сосудов, макрофаги) трансплантация МСК может способствовать сохранности единичных волокон после передавливания. Для решения этого вопроса необходимы дальнейшие исследования не только динамики роста нервных волокон в ранние сроки после травмы, но и влияния экзогенных МСК на происходящие в первые недели после травмы процессы валлеровской дегенерации.
ЗАКЛЮЧЕНИЕ
Применение иммуногистохимической реакции на периферин позволило провести оценку регенерирующих нервных волокон седалищного нерва крысы после наложения лигатуры и применения клеточной терапии с использованием МСК. Через 2 мес. после операции была выявлена значимая разница средней толщины регенерирующих волокон у животных контрольной группы, которым была нанесена травма седалищного нерва путем наложения лигатуры, и животных подопытной группы, которым была проведена однократная субпериневральная трансплантация МСК сразу после травмы. Анализ распределения нервных волокон дистального сегмента нерва по толщине показал, что введение МСК костного мозга крысы в поврежденный нерв приводит к увеличению доли регенерирующих волокон большого диаметра по сравнению с контролем (повреждение без введения МСК). Предположительно это является следствием стимулирующего влияния МСК на рост нервных волокон реципиента в более ранние сроки. Полученные данные следует учитывать в нейрофизиологических исследованиях, касающихся восстановления периферических нервных проводников, и в разработках, посвященных поиску новых способов стимуляции регенерации нервов.
Список литературы
Kemp S.W., Walsh S.K., Midha R. Growth factor and stem cell enhanced conduits in peripheral nerve regeneration and repair. Neurol. Res. 30(10): 1030–1038. 2008.
Челышев Ю.А., Богов А.А. Экспериментальное обоснование применения кондуитов нерва. Невролог. вестник. 40(4): 101–109. 2008. [Chelyshev J.A., Bogov A.A. Experimental ground for nerve conduit usage. Nevrolog. vestnik. 40(4): 101–109. 2008. (In Russ)].
Щаницын И.Н., Иванов А.Н., Бажанов С.П., Нинель В.Г., Пучиньян Д.М., Норкин И.А. Cтимуляция регенерации периферического нерва: современное состояние, проблемы и перспективы. Успехи физиол. наук. 48(3): 92–112. 2017. [ Shchanitsyn I.N., Ivanov A.N., Bazhanov S.P., Ninel` V.G., Puchin`yan D.M., Norkin I.A. Stimulation of peripheral nerve regeneration: current status, problems and perspectives. Advances in physiol. sciences. 48(3): 92–112. 2017. (In Russ)].
Sarker M., Saman N., McInnes A.D., Schreyer D.J., Xiongbiao C. Regeneration of peripheral nerves by nerve guidance conduits: Influence of design, biopolymers, cells, growth factors, and physical stimuli. Progress in Neurobiology. 2018. https://doi.org/10.1016/j.pneurobio.2018.07.002
Карагяур М.Н., Макаревич П.И., Шевченко Е.К., Стамбольский Д.В., Калинина Н.И., Парфёнова Е.В. Современные подходы к регенерации периферических нервов после травмы: перспективы генной и клеточной терапии. Гены и Клетки. 12(1): 6–14. 2017. [Karagyaur M.N., Makarevich P.I., Shevchenko E.K., Stambolsky D.V., Kalinina N.I., Parfyonova E.V. Modern approaches to peripheral nerve regeneration after injury: the prospects of gene and cell therapy. Genes and cells. 12(1): 6–14. 2017. (In Russ)].
Karagyaur M., Rostovtseva A., Semina E., Klimovich P., Balabanyan V., Makarevich P., Popov V., Stambolsky D., Tkachuk V. A bicistronic plasmid encoding brain-derived neurotrophic factor and urokinase plasminogen activator stimulates peripheral nerve regeneration after injury. J. Pharmacol. Exp. Ther. 372(3): 248–255. 2020.
Petrova E.S. Differentiation potential of mesenchymal stem cells and stimulation of nerve regeneration. Russ. J. Develop. Biol. 49(4): 193–205. 2018.
Boldyreva M.A., Stafeev I.S., Makarevich P.I., Beloglazova I.B., Zubkova E.S., Shevchenko E.K., Molokotina Y.D., Parfyonova Y.V., Bondar I.V., Ratner E.I., Karagyaur M.N. Plasmid-based gene therapy with hepatocyte growth factor stimulates peripheral nerve regeneration after traumatic injury. Biomedicine & Pharmacotherapy. 101. 682–690. 2018.
Masgutov R., Masgutova G., Mullakhmetova A., Zhuravleva M., Shulman A., Rogozhin A., Syromiatnikova V., Andreeva D., Zeinalova A., Idrisova K., Allegrucci C., Kiyasov A., Rizvanov A. Allogenic adipose derived stem cells transplantation improved sciatic nerve regeneration in rats: autologous nerve graft model. Front. Med. (Lausanne). 6: 68. 2019. https://doi.org/10.3389/fmed.2019.00068
Mathot F., Shin A.Y., Van Wijnen A.J. Targeted stimulation of MSCs in peripheral nerve repair. Gene. 20(710): 17–23. 2019.
Kalinina N.I., Sysoeva V.Yu., Rubina K.A., Parfenova E.V., Tkachuk V.A. Mesenchymal stem cells in tissue growth and repair. Acta Naturae. 3(4(11)): 30–37. 2011.
Mukhamedshina Y., Rizvanov A., Chelyshev Y., Gracheva O., Mukhutdinova D. Mesenchymal stem cells and the neuronal microenvironment in the area of spinal cord injury. Neural Regenerat. Res. 14(2): 227–237. 2019.
Petrova E.S. Injured nerve regeneration using cell-based therapies: current challenges. Acta Naturae. 7(3): 38–47. 2015.
Petrova E.S., Isaeva E.N. Study of effect of embryonic anlage allografts of the rat spinal cord on growth of regenerating fibers of the recipient nerve. Biol. Bull. 41(6): 479–485. 2014.
Petrova E., Isaeva E., Kolos E., Korzhevskii D. Allogeneic bone marrow mesenchymal stem cells in the epineurium and perineurium of the recipient rat. Biol. Communications. 63(2): 123–132. 2018.
Petrova E., Isaeva E., Kolos E., Korzhevskii D. Vascularization of the damaged nerve under the effect of experimental cell therapy. Bull. Exp. Biol. 165(1): 161–165. 2018.
Zinkova N.N., Sokolova I.B., Shvedova E.V., Bilibina A.A., Kruglyakov P.V., Polyntsev D.G., Gilerovitch E.G. Dynamics of morphological changes after transplantation of mesenchymal stem cells in rat brain provoked by stroke. Cell and Tissue Biology. 1(6): 482–490. 2007.
Grigorev I.P., Korzhevskii D.E. Current technologies for fixation of biological material for immunohistochemical analysis (Review). Modern Technologies in Medicine. 10(2): 156–165. 2018.
Петрова Е.С., Павлова Н.В., Коржевский Д.Э. Современные морфологические подходы к изучению регенерации периферических нервных проводников. Мед. акад. журн. 12(3): 15–29. 2012. [Petrova E.S., Pavlova N.V., Korzhevskii D.E. Advanced morphological approaches to the study of peripheral nerve regeneration. Med. Acad. J. 12(3): 15–29. 2012. (In Russ)].
Chadan S., Le Gall J.Y., Di Giamberardino L., Filliatreau G. Axonal transport of type III intermediate filament protein peripherin in intact and regenerating motor axons of the rat sciatic nerve. J. Neurosci. 39(2): 127–139. 1994.
Ноздрачев А.Д., Чумасов Е.И. Периферическая нервная система. СПб. Наука. 1999. [Nozdrachev A.D., Chumasov E.I. Perifericheskaya nervnaya sistema. (Peripheral nervous system) Spb. Nauka. 1999. (In Russ)].
Zochodne D.W. Neurobiology of peripheral nerve regeneration. Cambridge, New York, Melbourne, Madrid, Cape Town, Singapore, Sao Paulo. Cambridge Univer. Press. 2008.
Dezawa M., Takahashi I., Esaki M. Takano M., Sawada H. Sciatic nerve regeneration in rats induced by transplantation of in vitro differentiated bone-marrow stromal cells. Eur. J. Neurosci. 14: 1771–1776. 2001.
Weiss D.J., English K., Krasnodembskaya A., Isaza-Correa J.M., Hawthorne I.J., Mahon B.P. The Necrobiology of mesenchymal stromal cells affects therapeutic efficacy. Front. Immunol. 10: 1228. 2019. https://doi.org/. eCollection 2019https://doi.org/10.3389/fimmu.2019.01228
Lee Y., El Andaloussi S., Wood M.J. Exosomes and microvesicles: extracellular vesicles for genetic information transfer and gene therapy. Human Mol. Genetics. 21 (R1): R125–134. 2012. https://doi.org/10.1093/hmg/dds317
Jackson M.V., Morrison T.J., Doherty D.F., McAuley D.F., Matthay M.A., Kissenpfennig A., O’Kane C.M., Krasnodembskaya A.D. Mitochondrial transfer via tunneling nanotubes is an important mechanism by which mesenchymal stem cells enhance macrophage phagocytosis in the in vitro and in vivo models of ARDS. Stem Cells. 2016. 34(8): 2210–2223.
Сагарадзе Г.Д., Григорьева О.А., Ефименко А.Ю., Чапленко А.А., Суслина С.Н., Сысоева В.Ю., Калинина Н.И., Акопян Ж.А., Ткачук В.А. Терапевтический потенциал секреторных компонентов мезенхимных стромальных клеток человека: проблема стандартизации. Биомед. химия. 61(6): 750–759. 2015. [Sagaradze G.D., Grigorieva O.A., Efimenko A.Yu., Chaplenko A.A., Suslina S.N., Sysoeva V.Yu., Kalinina N.I., Akopyan Zh.A., Tkachuk V.A. Therapeutic potential of human mesenchymal stromal cells secreted components: a problem with. Biomed. Chemistry. 61(6): 750–759. 2015. (In Russ)].
Dong R., Liu Y., Yang Y., Wang H., Xu Y., Zhang Z. MSC-derived exosomes-based therapy for peripheral nerve injury: a novel therapeutic strategy. Biomed. Res. Int. 18;2019: 6458237. 2019. doi: eCollection 2019https://doi.org/10.1155/2019/6458237
Murray L.M.A., Krasnodembskaya A.D. Concise review: intercellular communication via organelle transfer in the biology and therapeutic applications of stem cells. Stem Cells. 37(1): 14–25. 2019.
Арутюнян И.В., Фатхудинов Т.Х., Ельчанинов А.В., Макаров А.В., Васюкова О.А., Усман Н.Ю., Марей М.В., Володина М.А., Кананыхина Е.Ю., Лохонина А.В., Большакова Г.Б., Гольдштейн Д.В., Сухих Г.Т. Исследование механизмов терапевтической активности аллогенных мультипотентных мезенхимальных стромальных клеток пупочного канатика в модели ишемии задних конечностей. Гены и клетки.13(1): 82–89. 2018. [Arutyunyan I.V., Fatkhudinov T.X., Elchaninov A.V., Makarov A.V., Vasyukova O.A., Usman N.Yu., Marey M.V., Volodina M.A., Kananykhina E.Yu., Lokhonina A.V., Bolshakova G.B., Goldshtein D.V., Sukhikh G.T. Understanding mechanisms of the umbilical cord-derived multipotent mesenchymal stromal cell-mediated recovery enhancement in rat model of limb ischemia. Genes and cells. 13(1): 82–89. 2018. (In Russ)].
Дополнительные материалы отсутствуют.
Инструменты
Российский физиологический журнал им. И.М. Сеченова


